Voorkeur antihypertensivum bij ouderen bij CVRM
Uitgangsvraag
Welk type antihypertensivum heeft de voorkeur bij (kwetsbare) ouderen (>70 jaar) met hypertensie?
Aanbeveling
Vitale en kwetsbare ouderen
Kies voor een passend antihypertensivum in relatie tot de comorbiditeit bij een (kwetsbare) oudere.
Vermijd zo mogelijk het gebruik van alpha- of beta-blokkers voor de enkelvoudige indicatie hypertensie bij (kwetsbare) ouderen wegens frequent optreden van ongewenste bijwerkingen (zoals orthostatische hypotensie).
Overwegingen
Uit bovenstaande studies komt niet naar voren dat er een voorkeursmiddel is voor ouderen boven de 70 jaar. Er zijn echter weinig studies beschikbaar en er zijn geen gerichte studies gedaan bij kwetsbare ouderen. Gezien de afwezigheid van bewijs en de weinige studies bij ouderen boven de 70 jaar, hebben we nu geen reden om af te wijken van de huidige CVRM-richtlijn. Bloeddrukverlaging is het belangrijkste doel en het type middel zal afhangen van de comorbiditeit van de desbetreffende persoon met hypertensie.
Wel adviseert de werkgroep zoveel mogelijk eenmaal daags te doseren en het aantal middelen te beperken tot bij voorkeur 2 en maximaal 3 typen ter bevordering van kwaliteit van leven en therapietrouw. Gezien de veranderde fysiologie van (kwetsbare) ouderen is het ook raadzaam om het Start-low-go-slow principe te hanteren met monitoring van bloeddruk en bijwerkingen.
Wat betreft bijwerkingen adviseren wij alpha- of beta-blokkers zoveel mogelijk te vermijden, mits de comorbiditeit dit toe laat, gezien het hoge risico op orthostatische hypotensie en het daaraan verbonden valrisico (Canney, 2016). Bij het starten van een thiazide diureticum is het raadzaam om de elektrolyten te controleren.
Onderbouwing
Achtergrond
In de huidige multidisciplinaire richtlijn CVRM wordt voor alle 70-plussers een gelijk beleid voor hypertensie geadviseerd zonder onderscheid te maken in vitaal en kwetsbaar. Daarnaast wordt er opgemerkt dat er mogelijk overwegingen zijn om een gerichte keuze te maken voor ouderen op basis van bijwerkingenpatroon en effectiviteit.
Conclusies / Summary of Findings
Ouderen met of zonder hart- en vaatziekten
Hart- en vaatziekten
|
Laag GRADE |
Vergelijking tussen calciumantagonist en diureticum Het risico op hart- en vaatziekten was niet verlaagd bij gebruik van een calciumantagonist vergeleken met een diureticum bij oudere patiënten met hypertensie.
Bronnen (Saruta, 2015; Ogihara, 2014) |
|
Laag GRADE |
Vergelijking tussen ACE-remmer en diureticum Het risico op hart- en vaatziekten was minimaal verlaagd bij gebruik van een ACE-remmer vergeleken met een diureticum bij oudere patiënten met hypertensie.
Bronnen (Wing, 2003) |
Kwaliteit van leven
|
Laag GRADE |
Vergelijking tussen beta-blokker met diureticum en calciumantagonist Het effect op kwaliteit van leven is niet verschillend bij gebruik van een beta-blokker en diureticum combinatie vergeleken met een calciumantagonist bij oudere patiënten met hypertensie.
Bronnen (Benetos, 2000) |
Functioneren
|
- GRADE |
Vanwege het ontbreken van bewijs is het niet mogelijk een conclusie te formuleren over het effect van verschillende antihypertensiva op functioneren bij oudere patiënten met hypertensie. |
Bijwerkingen
|
Zeer laag GRADE |
Vergelijking tussen calciumantagonist en diureticum Het risico op een ernstige aan de medicatie gerelateerde bijwerking is mogelijk verlaagd bij gebruik van een calciumantagonist vergeleken met een diureticum bij oudere patiënten met hypertensie.
Bronnen (Saruta, 2015; Ogihara, 2014) |
|
Zeer laag GRADE |
Vergelijking tussen beta-blokker met diureticum en calciumantagonist Het risico op een bijwerking is verhoogd bij gebruik van een beta-blokker tezamen met diureticum vergeleken met een calciumantagonist bij oudere patiënten met hypertensie.
Bronnen (Benetos, 2000) |
Mortaliteit
|
Matig GRADE |
Vergelijking tussen calciumantagonist en diureticum Het risico op overlijden gedurende de studie was niet noemenswaardig verlaagd bij gebruik van een calciumantagonist vergeleken met een diureticum bij oudere patiënten met hypertensie.
Bronnen (Saruta, 2015; Ogihara, 2014) |
|
Matig GRADE |
Vergelijking tussen ACE-remmer en diureticum Het risico op overlijden gedurende de studie was niet verlaagd bij gebruik van een ACE-remmer vergeleken met een diureticum bij oudere patiënten met hypertensie.
Bronnen (Wing, 2003) |
Bloeddruk
|
Matig GRADE |
Vergelijking tussen calciumantagonist en diureticum Het effect op bloeddruk is niet verschillend tussen een calciumantagonist en diureticum bij oudere patiënten met hypertensie.
Bronnen (Saruta, 2015 en Ogihara, 2014) |
|
Matig GRADE |
Vergelijking tussen ACE-remmer en diureticum Het effect op bloeddruk is niet verschillend tussen een ACE-remmer en diureticum bij oudere patiënten met hypertensie.
Bronnen (Wing, 2003) |
|
Laag GRADE |
Vergelijking tussen beta-blokker met diureticum en calciumantagonist Gebruik van een beta-blokker met een diureticum lijkt de bloeddruk meer te verlagen dan een calciumantagonist bij oudere patiënten met hypertensie.
Bronnen (Benetos, 2000) |
Ouderen met hart- en vaatziekten
|
Laag GRADE |
Er is geen verschil in het effect op kwaliteit van leven bij gebruik van een angiotensine receptor-blokker (losartan) of een ACE-remmer bij oudere patiënten met hartfalen en hypertensie.
Bronnen (Crowley, 2000) |
|
- GRADE |
Vanwege het ontbreken van bewijs is het niet mogelijk een conclusie te formuleren over het effect van verschillende types antihypertensiva op de uitkomsten hart- en vaatziekten, functioneren, bijwerkingen, mortaliteit en bloeddruk. |
Samenvatting literatuur
Beschrijving studies
Ouderen met of zonder hart- en vaatziekten
Vergelijking tussen calciumantagonist en diureticum
Saruta (2015) en Ogihara (2014) vergeleken de cardiovasculaire effecten van olmesartan gecombineerd met een calciumantagonist of een diureticum in een prospectief, gerandomiseerd, open-label, geblindeerde eindpunt trial. Patiënten in de leeftijd van 65 tot 85 jaar met een geschiedenis van hart- en vaatziekten of met risicofactoren voor hart- en vaatziekten kwamen in aanmerking wanneer de bloeddruk meer dan 140 over 90 mmHg was onder behandeling voor hypertensie of een bloeddruk van 160 over 100 mmHg bij geen behandeling. In totaal deden 5141 patiënten mee aan de trial, waarvan 2568 olmesartan met een calciumantagonist kregen en 2573 olmesartan met een diureticum kregen. In de eerste groep waren 46 (2%) patiënten lost to follow-up en in de tweede groep 72 (3%). De redenen voor lost to follow-up waren niet bekend. De gemiddelde follow-up was 3,3 jaar.
Vergelijking tussen ACE-remmer en diureticum
Wing (2003) ondernam een prospectief, gerandomiseerde, open-label, geblindeerde eindpunt trial ter vergelijking van de uitkomsten bij ouderen met hypertensie behandeld met ACE-remmers of met diuretica. Patiënten met hypertensie in de leeftijd van 65 tot 84 jaar onder behandeling bij een huisartsenpraktijk kwamen in aanmerking wanneer systolische bloeddruk hoger dan 160 mmHg was of ten minste een diastolische bloeddruk van 90 mmHg en geen hart- en vaatziekten in de laatste zes maanden hadden gehad. In totaal kregen 3044 patiënten een ACE-remmer en 3039 een diureticum. Minder dan 5% in beide groepen waren lost to follow-up. Redenen voor lost to follow-up zijn echter niet bekend. De mediane follow-up was 4,1 jaar.
Vergelijking tussen beta-blokker met diureticum en calciumantagonist
Benetos (2000) vergeleek de effectiviteit en veiligheid van bisoprolol/hydrochlorothiazide combinatie met die van een calciumantagonist amlodipine in de initiële behandeling van oudere patiënten met geïsoleerde systolische hypertensie. De auteurs ondernamen daar toe een dubbel geblindeerd, gerandomiseerd, multicenter trial. Patiënten met hartfalen, beroerte of myocardinfarct in de afgelopen drie maanden kwamen niet in aanmerking naast een reeks van andere exclusiecriteria. In totaal werden 164 patiënten geïncludeerd, waarvan 84 patiënten eenmaal daags in de ochtend 2,5 mg bisoprolol/ 6,25 mg hydrochlorothiazide kregen en 80 patiënten eenmaal daags 5 mg amlodipine in de ochtend. De behandeling werd voor totaal twaalf weken gegeven.
Resultaten
Hart- en vaatziekten
Vergelijking tussen calciumantagonist en diureticum
In de trial van Saruta (2015) en Ogihara (2014) werd hart- en vaatziekten met een samengesteld eindpunt gemeten van zowel fatale als niet-fatale events. In totaal kregen 116 (5%) patiënten hart- en vaatziekten bij gebruik van olmesartan met een calciumantagonist vergeleken met 135 (5%) patiënten bij gebruik van olmesartan met een diureticum. De frequentie om een event te krijgen gedurende de trial was potentieel 17% verlaagd bij gebruik van olmesartan met een calciumantagonist (HR 0,83 95%BI: 0,65 tot 1,07).
Vergelijking tussen ACE-remmer en diureticum
Ook in de trial van Wing (2003) werd hart- en vaatziekten met een composiet eindpunt van fatale en niet-fatale events gemeten. 394 (13%) patiënten uit de ACE-remmer groep kreeg hart- en vaatziekten vergeleken met 429 (14%) patiënten die een diureticum kregen. Het risico om gedurende de trial een event te krijgen was daarmee 11% lager bij gebruik van een ACE-remmer vergeleken met een diureticum (HR 0,89 95%BI: 0,79 tot 1,00).
Vergelijking tussen beta-blokker met diureticum en calciumantagonist
Benetos (2000) rapporteerde geen gegevens over het risico op hart- en vaatziekten.
Kwaliteit van leven
Saruta (2015), Ogihara (2014) en Wing (2003) rapporteerden geen gegevens over kwaliteit van leven.
Vergelijking tussen beta-blokker met diureticum en calciumantagonist
Benetos (2000) heeft kwaliteit van leven beoordeeld aan de hand van een vragenlijst met 22 vragen. De mogelijke score liep uiteen van 22 tot maximaal 88 waarbij een hogere score een indicatie is voor een beter kwaliteit van leven. Resultaten werden alleen in een figuur weergegeven. Beide behandelarmen gaven een verbetering in kwaliteit van leven aan. Deze toename was echter niet verschillend tussen de gebruikte medicamenten.
Figuur 1 Kwaliteit van leven scores na 12 weken van behandeling met bisoprolol/hydrochlorothiazide (licht grijs) en amlodipine (donkergrijs)
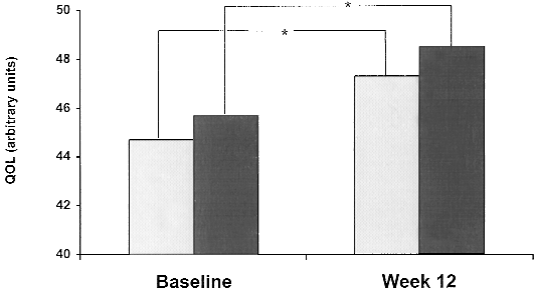
Functioneren
Saruta (2015), Ogihara (2014), Wing (2003) en Benetos (2000) rapporteerden geen gegevens over kwaliteit van leven.
Bijwerkingen
Vergelijking tussen calciumantagonist en diureticum
Saruta (2015) en Ogihara (2014) rapporteerden ernstige bijwerkingen gerelateerd aan de medicatie. Hierbij ging het om gastro-intestinale stoornissen, aritmie, nierfunctiestoornis en overige bijwerkingen. Echter alleen bij overige bijwerkingen waren de aantallen groter dan vijf. Bij gebruik van olmesartan met calciumantagonist kregen 5 (0,2%) patiënten een bijwerking gerelateerd aan de gebruikte medicatie vergeleken met 16 (0,6%) bij gebruik van olmesartan en diureticum (p=0,02).
Vergelijking tussen ACE-remmer en diureticum
Wing, 2003 rapporteerden geen gegevens over mogelijke bijwerkingen.
Vergelijking tussen beta-blokker met diureticum en calciumantagonist
Benetos (2000) observeerde dat 48 (58%) patiënten een bijwerking kregen uit de bisoprolol/hydrochlorothiazide groep en 65 (84%) uit de amlodipine groep. Hiermee was het risico op een bijwerking 31% lager bij gebruik van bisoprolol/hydrochlorothiazide (RR 0,69 95%BI: 0,56 tot 0,84).
Mortaliteit
Vergelijking tussen calciumantagonist en diureticum
In de trial van Saruta (2015) en Ogihara (2014) kwamen in totaal 140 patiënten te overlijden. Tijdens het gebruik van olmesartan met calciumanatagonist overlijden 64 (3%) patiënten en tijdens gebruik van olmesartan met diurecticum 76 (3%) patiënten. De frequentie om te overlijden gedurende de trial was daarmee potentieel 17% lager bij gebruik van olmesartan met calciumantagonist dan bij olmesartan met een diurecticum (HR 0,83 95%BI: 0,59 tot 1,15).
Vergelijking tussen ACE-remmer en diureticum
Wing (2003) observeerden gedurende de studie dat 195 (6%) patiënten die een ACE-remmer gebruikten kwamen te overlijden en 210 (7%) patiënten uit de diurecticum groep. Het risico om te overlijden gedurende de trial bij gebruik van een ACE-remmer was potentieel 10% verlaagd vergeleken met een diurecticum (HR 0,90 95%BI: 0,75 tot 1,09).
Vergelijking tussen beta-blokker met diureticum en calciumantagonist
Benetos, 2000 rapporteerden geen gegevens over mortaliteit.
Bloeddruk
Vergelijking tussen calciumantagonist en diureticum
Saruta (2015) en Ogihara (2014) observeerden dat de gemiddelde afname in systolisch en diastolische bloeddruk ten opzichte van baseline niet verschillend waren. Het ging hierbij om een systolisch bloeddruk afname van 24,4 (SD 16,4) versus 24,9 (SD 17,3) en diastolische bloeddruk afname van 13,8 (SD 12,0) versus 13,7 (SD 12,4).
Vergelijking tussen ACE-remmer en diureticum
Wing (2003) rapporteerden na een jaar, na drie jaren en na vijf jaren de gemiddeld afname in systolische en diastolische bloeddruk ten opzichte van baseline. Op alle drie de tijdspunten was de afname in bloeddruk niet verschillende tussen ACE-remmer en diurecticum. Na vijf jaar was in beide groepen de afname in bloeddruk 26 mmHg systolisch en 12 mmHg diastolisch.
Vergelijking tussen beta-blokker met diureticum en calciumantagonist
Benetos (2000) heeft het effect op klinische en 24 uurs bloeddruk gemeten ten opzichte van baseline. De resultaten zijn in een tabel 1 weergegeven. Potentieel verlaagt bisoprolol/hydrochlorothiazide de bloeddruk meer dan amlodipine.
Tabel 1 Resultaten uit Benetos, 2000
|
Medicament |
Klinische bloeddruk, mmHg |
24 uurs bloeddruk, mmHg |
||
|
|
Systolisch* |
Diastolisch* |
Systolisch* |
Diastolisch* |
|
Bisoprolol/hydrochlorothiazide |
-20,0 (13,7) |
-4,5 (7,4) |
-12,2 (12,3) |
-8,4 (6,5) |
|
Amlodipine |
-19,6 (14,2) |
-2,4 (8,4) |
-8,1 (13,0) |
-3,6 (7,4) |
*Gemiddelden met standaarddeviaties
Bewijskracht van de literatuur
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; onduidelijkheid over blindering) en het geringe aantal events (imprecisie).
Kwaliteit van leven: De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; onduidelijkheid over blindering) en het geringe aantal patiënten (imprecisie).
Functioneren: Vanwege het ontbreken van bewijs is het niet mogelijk om de bewijskracht voor de uitkomstmaat functioneren te graderen.
Bijwerkingen: De bewijskracht voor de uitkomstmaat bijwerkingen is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias, onduidelijkheid over blindering) en het geringe aantal patiënten (imprecisie).
Mortaliteit: De bewijskracht voor de uitkomstmaat mortaliteit is met een niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias, onduidelijkheid over blindering).
Bloeddruk: De bewijskracht voor de uitkomstmaat bloeddruk is met een of twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias, onduidelijkheid over blindering) en het geval van Benetos (2000) het geringe aantal patiënten.
Ouderen met hart- en vaatziekten
Cowley (2000) onderzocht in een prospectief, gerandomiseerde, dubbel geblindeerde trial kwaliteit van leven bij ouderen met symptomatisch hartfalen die of een angiotensine receptor-blokker (losartan) kregen of een ACE-remmer (captopril). In totaal deden 300 patiënten uit de Verenigde Staten mee. Patiënten kregen eenmaal daags 12,5 mg losartan, getritreerd naar 50 milligram eenmaal daags of driemaal daags captopril, getriteerd tot 50 milligram driemaal daags. In totaal kregen 147 losartan en 153 captopril. De trial was gesponsord door de industrie en auteurs waren in dienst bij de sponsor of werden betaald voor consultaties door de sponsor. De behandeling werd voor 48 weken gegeven.
Resultaten
Hart- en vaatziekten
Cowley (2000) rapporteerden geen gegevens over het risico op hart- en vaatziekten.
Kwaliteit van leven
Kwaliteit van leven werd met twee vragenlijsten onderzocht, de hartfalen ziekte specifieke kwaliteit van leven vragenlijst (LihFE) en een meer algemene vragenlijsten (SIP). Gegevens werden alleen in figuren gerapporteerd (Figuur 2 en 3). Uit beide resultaten bleek er geen verschil in kwaliteit van leven te zijn bij gebruik van losartan of captopril.
Figuur 2 Resultaten (gemiddelde met standaard error) van de verandering in kwaliteit van leven na 48 weken ten opzichte van baseline, gemeten met LihFR.
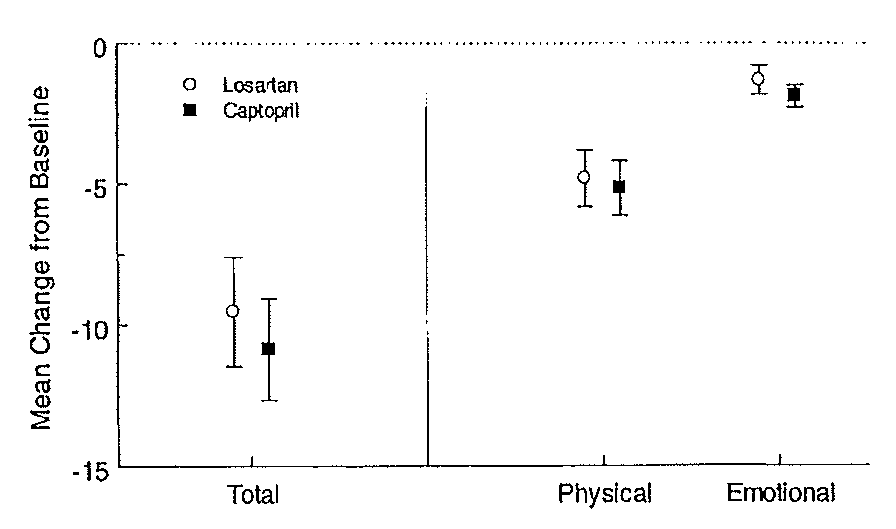
Figuur 3 Resultaten (gemiddelde met standaard error) van de verandering in kwaliteit van leven na 48 weken ten opzichte van baseline, gemeten met SIP.
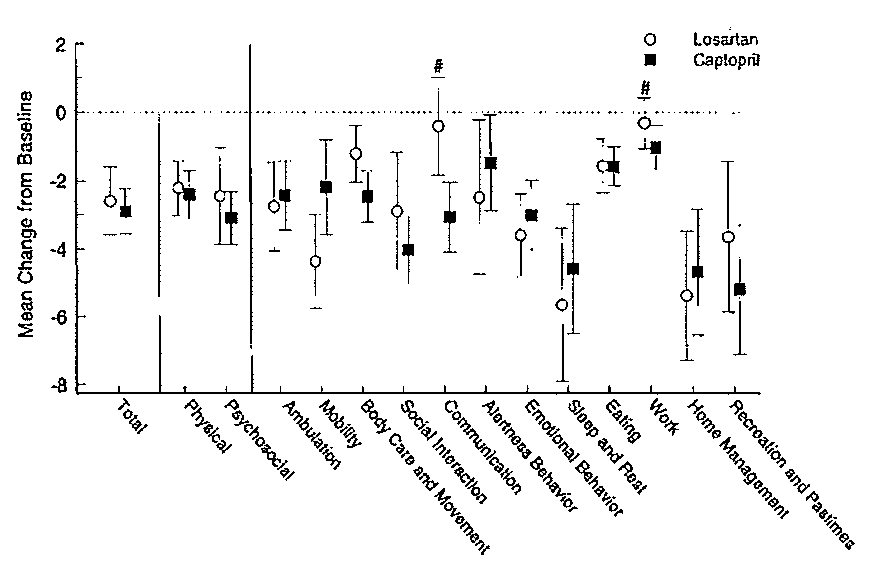
Functioneren
Cowley (2000) rapporteerden geen gegevens over functioneren.
Bijwerkingen
Cowley (2000) rapporteerden geen gegevens over bijwerkingen.
Mortaliteit
Cowley (2000) rapporteerden geen gegevens over mortaliteit.
Bloeddruk
Cowley (2000) rapporteerden geen gegevens over bloeddruk.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias, onduidelijkheid over blindering en verschil in lost to follow-up).
Vanwege het ontbreken van bewijs is het niet mogelijk de bewijskracht te graderen voor de uitkomsten hart- en vaatziekten, functioneren, bijwerkingen, mortaliteit en bloeddruk.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van een bepaald type antihypertensiva versus een ander bij ouderen van 70 plus met of zonder hart- en vaatziekten en met hypertensie?
P: ouderen (ouder dan 70 jaar) met of zonder hart- en vaatziekten en met hypertensie;
I: type ochranetionve;
C: type ochranetionve;
O: hart- en vaatziekten, kwaliteit van leven, functioneren, bijwerkingen, mortaliteit, bloeddruk.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten, kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en bijwerkingen, mortaliteit, bloeddruk voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd, gecontroleerde trials. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 369 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- systematische review met een gedetailleerde zoekstrategie, gezocht in ten minste twee databases en risico op bias beoordeling;
- gerandomiseerde trials van patiënten met hypertensie ouder dan 70 jaar, of patiënten met hypertensie en een gemiddelde leeftijd van 70 jaar of ouder of een subgroepanalyse van patiënten met hypertensie van 70 jaar of ouder waarbij verschillende types antihypertensiva werden vergeleken.
Op basis van titel en abstract werden in eerste instantie 24 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 20 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vier studies definitief geselecteerd.
Vier onderzoeken zijn opgenomen in de literatuuranalyse. In deze trials worden verschillende types antihypertensiva met elkaar vergeleken, waardoor het niet mogelijk was om de data te poolen. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (Risk of Bias) is opgenomen in de Risk of Bias tabellen.
Referenties
- Benetos A, Consoli S, Safavian A, et al. Efficacy, safety, and effects on quality of life of bisoprolol/hydrochlorothiazide versus amlodipine in elderly patients with systolic hypertension. Am Heart J. 2000;140(4):E11.
- Canney M, OConnell MD, Murphy CM, et al. Single Agent Antihypertensive Therapy and Orthostatic Blood Pressure Behaviour in Older Adults Using Beat-to-Beat Measurements: The Irish Longitudinal Study on Ageing. PloS One. 2016;11(1):e0146156. Doi: 10.1371/journal.pone.0146156.
- Cowley AJ, Wiens BL, Segal R, et al. Randomised comparison of losartan vs. captopril on quality of life in elderly patients with symptomatic heart failure: the losartan heart failure ELITE quality of life substudy. Qual Life Res. 2000;9(4):377-84.
- Ogihara T, Saruta T, Rakugi H, et al. Combinations of olmesartan and a calcium channel blocker or a diuretic in elderly hypertensive patients: a randomized, controlled trial. J Hypertens. 2014;32(10):2054-63; discussiom 2063. Doi: 10.1097/HJH.0000000000000281. PubMed PMID: 24999799; PubMed Central PMCID: PMC4166009.
- Saruta T, Ogihara T, Saito I, et al. Comparison of olmesartan combined with a calcium channel blocker or a diuretic in elderly hypertensive patients (COLM Study): safety and tolerability. Hypertens Res. 2015;38(2):132-6.
- Wing LMH, Reid CM, Ryan P, et al. A comparison of outcomes with angiotensin-converting-enzyme inhibitors and diuretics for hypertension in the elderly. N Engl J Med. 2003;348(7):583-92.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison/ control SEKS 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Saruta, 2015
Additional data from Ogihara, 2014 |
Type of study: RCT (parallel)
Setting: Patients with or without a history of cardiovascular disease
Country: Japan
Source of funding: Non-commercial |
Inclusion criteria:
N total at baseline: Intervention: 2568 Control: 2573
Important prognostic factors2: Age ± SD: I: 73 (5) C: 73 (5)
Sex: I: 52% M C: 52% M
History of CVD: I: 26% C: 26%
Groups comparable at baseline? Yes
|
Olmesartan plus a CCB (amlodipine or azelnidipine) for at least 3 years
Target BP was <140/90 mmHg |
Olmesartan plus a low-dose diuretic (trichlormethiazide, indapamide or some other thiazide) for at least 3 years
Target BP was <140/90 mmHg
|
Length of follow-up: Mean 3.3 years
Loss-to-follow-up: Intervention: N = 46 (2%) Reasons: not clear
Control: N = 72 (3%) Reasons: not clear
Incomplete outcome data: Intervention: N = 46 (2%) Reasons: not clear
Control: N = 72 (3%) Reasons: not clear
|
Measured as a composite of fatal and non-fatal cardiovascular events, n (%)
I: 116 (5) C: 135 (5) HR 0.83 (0.65 tot 1.07)
No data reported
No data reported
Indicated as drug-related serious adverse events, n (%)
Gastrointestinal disorder I: 1 (0.04) C: 1 (0.04)
Arrhythmia I: 2 (0.1) C: 2 (0.1)
Renal dysfunction I: 2 (0.1) C: 6 (0.2)
Miscellaneous I: 5 (0.2) C: 16 (0.6) p=0.02
Measured as all-cause mortality, n (%)
I: 64 (3) C: 76 (3) HR 0.83 (95%CI: 0.59-1.15)
Measured as the mean change from baseline, mean (SD) systolic/diastolic
I: 24.4 (16.4)/ 13.8 (12.0) C: 24.9 (17.3)/ 13.7 (12.4) p>0.05 |
Authors’ conclusions: “Total discontinuation rate, incidences of Aes, SAEs, drug-related SAEs and discontinuation due to SAEs were lower in the olmesartan plus CCB group than in the olmesartan plus diuretic group. |
|
Wing, 2003 |
Type of study: RCT (parallel)
Setting: Family medical practices
Country: Australia
Source of funding: Industry |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 3044 Control: 3039
Important prognostic factors2: For example age ± SD: I: 72 C: 71
Sex: I: 50% M C: 48% M
Coronary heart disease: I: 8% C: 8%
Groups comparable at baseline? Yes |
ACE-inhibitors
|
Diuretic
|
Length of follow-up: Median 4.1 years
Loss-to-follow-up: Intervention: N = 66 (2%) Reasons: unclear
Control: N = 102 (3%) Reasons: unclear
Incomplete outcome data: Intervention: N = 66 (2%) Reasons: unclear
Control: N = 102 (3%) Reasons: unclear
|
Measured as a composite of fatal and non-fatal cardiovascular events, n (%)
I: 394 (13) C: 429 (14) HR 0.89 (95%CI: 0.79-1.00)
No data reported
No data reported
No data reported
Measured as all-cause mortality, n (%)
I: 195 (6) C: 210 (7) HR 0.90 (95%CI: 0.75-1.09)
Measured as the mean change from baseline, mean (SD) systolic/diastolic
Year 1 I: 20/9 mmHg C: 22/9 mmHg
Year 2 I: 23/10 mmHg C: 24/10 mmHg
Year 5 I: 26/12 mmHg C: 26/12 mmHg |
|
|
Cowley, 2000 |
Type of study: RCT (parallel)
Setting: Heart failure patients
Country: United States, Europe and South America*
Source of funding: Industry** |
Inclusion criteria:
N total at baseline: Intervention: 147 Control: 153
Important prognostic factors2: Age ± SD: I: 73 (6) C: 73 (7)
Sex: I: 73% M C: 80% M
Groups comparable at baseline? Yes
|
Losartan (12.5 mg once daily, titrated to 50 mg once daily)
|
Captopril (6.25 mg three times daily, titrated to 50 mg thre times daily)
|
Length of follow-up: 48 weken
Loss-to-follow-up: Intervention: N = 30 (20%) Reasons: 10 clinical adverse events, 5 deaths, 1 laboratory adverse event, 14 lost to follow-up/withdrew/protocol deviation
Control: N = 45 (29%) Reasons: 21 clinical adverse events, 7 deaths, 1 laboratory adverse event, 1, therapy ineffective, 15 lost to follow-up/withdrew/protocol deviation
Incomplete outcome data: Intervention: N = 30 (20%) Reasons: 10 clinical adverse events, 5 deaths, 1 laboratory adverse event, 14 lost to follow-up/withdrew/protocol deviation
Control: N = 45 (29%) Reasons: 21 clinical adverse events, 7 deaths, 1 laboratory adverse event, 1, therapy ineffective, 15 lost to follow-up/withdrew/protocol deviation |
Data not reported
Measured with heart failure disease-specific HRQoL (LihFE) and more general HRQoL parameters (SIP)
Numbers were displayed in figures. There was no difference in scores for both measure between groups.
No data reported
No data reported
Data not reported
Data not reported |
* Only data from US sites was decribed ** Part of the authors were employees and other authors were paid consultants. |
|
Benetos, 2000 |
Type of study: RCT (parallel)
Setting: General practitioners
Country: France
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 83 Control: 77
Important prognostic factors2: Age ± SD: I: 72 (7) C: 73 (7)
Sex: I: 29% M C: 47% M
Groups comparable at baseline? Yes |
Bisoprolol 2.5 mg/hydrochlorothiazide 6.25 mg combination, once daily, for 12 weeks
|
Amlodipine 5 mg, once daily, for 12 weeks
|
Length of follow-up: 12 weeks
Loss-to-follow-up: Intervention: N = 11 (13%) Reasons: adverse events
Control: N = 7 (9%) Reasons: adverse events
Incomplete outcome data: Intervention: N = 11 (13%) Reasons: adverse events
Control: N = 7 (9%) Reasons: adverse events
|
No data reported
Assessed with a self-administered tool with 22 questions (score ranging from 22 5to 88) with a higher score indicating a greater sense of well-being.
Numbers were displayed in figures. There was no difference in scores for both measure between groups.
No data reported
Measured as any adverse event
I: 48 (58%) C: 65 (84%) RR 0.69 (95%CI: 0.56-0.84)
No data reported
Measured as the mean change from baseline, mean (SD) systolic/diastolic
I: -20.0 (13.7)/ -4.5 (7.4) C: -19.6 (14.2)/ -2.4 (8.4) p=0.85/ p=0.09
24-h I: -12.2 (12.3)/ -8.4 (6.5) C: -8.1 (13.0)/ -3.6 (7.4) p=0.16/ p=0.004 |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors ((potential) confounders)
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Saruta, 2015 and Ogihara, 2014 |
“Patients were randomized 1:1 using a dynamic allocation method with stratification for sex, age, history of cardiovascular disease, BP, prior use of antihypertensive agents, and centre. Randomization was conducted using a computerized system by the COLM study data centre, and the random allocation sequence was concealed until the end of the enrolment period. “ |
Unclear. Not clearly stated. |
Unclear. Unknown whether prescribed medications were identical in appearance. |
Likely. Investigator made to choose which CCB and diuretic was prescribed. |
Unclear. Not stated |
Unlikely. Rational, design was published before study. |
Unlikely. Less than 5% in each arm was lost to follow-up |
Unlikely. “All analyses were conducted according to the intention-to-treat principle.” |
|
Wing, 2003 |
“Subjects were randomly assigned centrally by telephone to either ACE-inhibitor-based or diuretic-based treatment.” |
Unlikely. |
Unclear. Unknown whether prescribed medications were identical in appearance. |
Unclear. Not stated |
Unlikely. “An end-point committee whose members were unaware of the treatment-group assignments adjudicated all potential end points.” |
Unclear. Study was not registered. However, all outcomes in the methods section were reported in the results. |
Unlikely. Less than 5% was lost to follow in each group. |
Unlikely. “All results are based on intention-to-treat analyses.” |
|
Cowley, 2000 |
“(…) were ochranet in blinded fashion to (…). |
Unclear. Not stated |
Unlikely. “Double-blinding was maintained as all patients received placebo-matching controls (…).” |
Unclear. Not stated. |
Unclear. Not stated. |
Unclear. Trial was not registered. However, all outcomes in the methods section were reported in the results. |
Likely. More than 20% in each group was lost to follow-up with more clinical adverse events in one group. |
Unclear. Not stated |
|
Benetos, 2000 |
“Those who qualified were randomly assigned to receive (…).” |
Unclear. Not stated. |
Unclear. Unknown whether prescribed medications were identical in appearance. |
Unclear. Not stated. |
Unclear. Not stated. |
Unclear. Trial was not registered. However, all outcomes in the methods section were reported in the results. |
Unlikely. Percentage of lost-follow-up was similar in each group. |
Unlikely. “Statistical analyses were performed for the intent-to-treat population (…)” |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the ochranetion process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central ochranetion (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate ochranetion procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the ochran of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the Risk of Bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the Risk of Bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-06-2021
Voor het beoordelen van de actualiteit van dit addendum is de werkgroep wel in stand gehouden. Het bestuur van de Nederlandse Internisten Vereniging bepaalt uiterlijk na de autorisatie van de multidisciplinaire richtlijn Cardiovasculair risicomanagement (CVRM) of de modules van dit addendum nog actueel zijn. Aangezien het addendum bij de huidige CVRM-richtlijn uit 2011 behoort, zal bij een herziene CVRM-richtlijn gecontroleerd moeten of het addendum nog steeds aansluit bij deze nieuwe richtlijn. De geldigheid van dit addendum komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging is regiehouder van dit addendum en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van dit addendum. De andere aan dit addendum deelnemende wetenschappelijke verenigingen of gebruikers van dit addendum delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De ontwikkeling van het addendum werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Dit addendum zal geautoriseerd of geaccordeerd worden door NIV, NVKG, NVVC, NVN, NHG, Verenso en De Hart&Vaatgroep.
Doel en doelgroep
Doel
Het doel van dit addendum is om een advies te geven over cardiovasculair risicomanagement voor de oudere (>70 jaar) al dan niet kwetsbare persoon.
Doelgroep
Dit addendum is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor (kwetsbare) oudere patiënten met (een verhoogd risico op) hart- en vaatziekten.
Samenstelling werkgroep
In 2016 is een multidisciplinaire werkgroep ingesteld, bestaand uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de preventie van hart- en vaatziekten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. A.W. (Arno) Hoes, klinisch epidemioloog, werkzaam in het Julius Centrum van het UMC Utrecht te Utrecht (voorzitter)
- Dr.ir. I. (Ineke) van Dis, epidemioloog en voedingswetenschapper, werkzaam bij de Hartstichting te Den Haag, Hartstichting
- Y.A. (Yvette) Henstra, verpleegkundig specialist vasculaire geneeskunde, werkzaam in het OVLG te Amsterdam, NVHVV
- Dr. H.M. (Heleen) den Hertog, neuroloog, werkzaam in het Isala Ziekenhuis te Zwolle, NVN
- Dr. K. (Karen) Konings, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk K. Konings te Maastricht, NHG
- H. (Hans) van Laarhoven, manager team collectieve belangenbehartiging, werkzaam bij Hartenraad te Den Haag, Harteraad
- Dr. A.H. (AnHo) Liem, cardioloog, werkzaam in het Franciscus Gasthuis & Vlietland te Rotterdam, NVVC
- Dr. F.M.A.C. (Fabrice) Martens, cardioloog, werkzaam in het Deventer Ziekenhuis te Deventer, NVVC
- Prof. dr. Y.M. (Yvo) Smulders, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
- Drs. A. (Anne-Margreet) Strijbis, relatiemanager zorg, werkzaam bij Harteraad te Den Haag, Harteraad
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Prof. dr. F.L.J. (Frank) Visseren, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
Met ondersteuning van:
- G.M. (Maike) van Leeuwen, beleid- en projectondersteuner, NIV
- Dr. Tj. (Tjerk) Wiersma, senior-wetenschappelijk medewerker, NHG
- Dr. W. (Wouter) de Ruijter, wetenschappelijk medewerker, NHG tot augustus 2017
- Drs. M. (Martijn) Sijbom, wetenschappelijk medewerker, NHG vanaf augustus 2017
- Dr. I.M. (Iris) Wichers, wetenschappelijk medewerker, NHG
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van FMS
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van FMS tot april 2018
- Dr. A. (Aleid) Wirix, adviseur, Kennisinstituut van FMS vanaf april 2018
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van FMS tot januari 2018
- J. (Jill) Heij, junior projectsecretaresse, Kennisinstituut van FMS vanaf februari 2018
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventueel belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Muller |
internist-ouderengeneeskunde |
- |
Geen |
Geen actie |
|
Visseren |
internist-vasculaire geneeskunde |
voorzitter sectie Vasculaire Geneeskunde, Nederlandse Internisten Vereniging (onbetaald) |
Deelname aan verschillende fase II en III multicenter klinische trials met PCSK9-remmers (Amgen, Sanofi, Pfizer), antisense apoB (GenZyme), antisense Lp(a) (ISIS), antisense apoCIII (ISIS), executive committee ORION trial naar siRNA PCSK9-i (Medicines Company) |
Geen actie (betreft onderzoek naar medicatie niet besproken in het addendum) |
|
De Vries |
internist-ouderengeneeskunde |
- |
Geen |
Geen actie |
|
Mattace Raso |
klinisch geriater |
- |
Geen |
Geen actie |
|
Verbunt |
cardioloog |
- |
Geen |
Geen actie |
|
Jansen |
neuroloog |
- |
Geen |
Geen actie |
|
Lanphen |
kaderhuisarts |
Medisch directeur zorggroep |
Geen |
Geen actie |
|
Van Leen |
specialist ouderengeneeskunde |
Scholing geven aan basisartsen en verpleegkundigen |
Onderzoek preventieve maatregelen decubitus |
Geen actie (valt buiten de afbakening van het addendum) |
|
Kors-Walraven |
beleidsadviseur belangenbehartiging Hart&Vaatgroep |
- |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Bij de ontwikkeling van dit addendum wordt nauw samengewerkt met De Hart&Vaatgroep, de patiëntenvereniging voor mensen met een hart- of vaatziekte of een verhoogd risico daarop en hun naasten. Tijdens de invitational conference voor het inventariseren van mogelijke knelpunten zijn de volgende voor de patiënt relevante uitkomstmaten benoemd: kwaliteit van leven, functioneren waaronder cognitie, bijwerkingen, mortaliteit en cardiovasculaire events en ziektevrij leven. In het verlengde van de vastgestelde uitkomstmaten kan opgemerkt worden dat voor deze doelgroep een verschuiving van ziektegerichtheid naar functiegerichtheid veelal aan de orde is. Het conceptaddendum is tevens voor commentaar voorgelegd aan De Hart&Vaatgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van dit addendum en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van dit addendum in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij de autorisatie van het addenum worden opgeleverd.
Werkwijze
AGREE
Dit addendum is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door De Hart&Vaatgroep, IGZ, KNMP, Lareb, NHG, NIV, NVHVV, NVKG, NVVC, V&VN, Vereniging Innovatieve Geneesmiddelen, Verenso en ZN via invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van het addendum is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
De werkgroep heeft besloten geen nieuwe indicatoren bij dit addendum te ontwikkelen, maar gebruik te maken van de reeds bestaande indicatoren op het gebied van CVRM.
Kennislacunes
Tijdens de ontwikkeling van dit addendum is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
Het conceptaddendum werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd het conceptaddendum aangepast en definitief vastgesteld door de werkgroep. Het definitieve addendum werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
