Bloeddrukmeting bij CVRM
Uitgangsvraag
Op welke manier kan de bloeddruk het beste gemeten worden?
Deze uitgangsvraag bevat de volgende deelvraag:
- Hoe verhouden gemeten bloeddrukken zich tot elkaar wanneer gemeten met verschillende bloeddrukmeetmethoden (spreekkamermetingen, 24-uurs bloeddrukmetingen, geprotocolleerde thuismetingen of 30-minuten bloeddrukmetingen)?
Aanbeveling
Evalueer de bloeddruk door middel van meerdere spreekkamermetingen. Gebruik bij een behandelindicatie ook een ambulante meting (zie stroomschema).
Doe een 24-uurs meting (voorkeur) of een geprotocolleerde thuismeting om een witte-jas-hypertensie uit te sluiten. Indien die niet haalbaar zijn, kan het gebruik van een BP30-meting worden overwogen.
Voel de pols bij het meten van de bloeddruk om personen met atriumfibrilleren op te sporen.
Overwegingen
Zorgvuldig bloeddruk meten is van groot belang voor een weloverwogen behandeladvies (zie ook protocol Bloeddruk meten). Uit de zoekvraag blijkt dat er te weinig gegevens zijn om de dertigminuten bloeddrukmeting te vergelijken met de 24-uurs bloeddrukmeting. Wel lijkt het aannemelijk dat de dertigminuten bloeddrukmeting significant lagere waardes geeft dan de spreekkamermeting.
Patiëntenperspectief
Het is van belang voor de patiënt om zorgvuldig de bloeddruk te evalueren voor het bepalen van een correcte behandelindicatie en voor het behalen van streefwaardes. Er zijn verschillende voor- en nadelen verbonden aan de verschillende bloeddrukmeetmethodes. Een spreekkamermeting is weinig belastend maar valt vaak hoger uit en is minder consistent dan een ambulante of dertigminuten meting. Een 24-uurs bloeddrukmeting is betrouwbaar maar wordt door sommigen als belastend ervaren. Een geprotocolleerde thuismeting is minder belastend, maar vraagt wel van de patiënt dat hij een week lang volgens protocol 2x per dag de bloeddruk meet en geeft geen informatie over de nachtelijke bloeddruk. De BP30-meting heeft als voordeel, dat het in 30 minuten klaar is, maar voor een patiënt zou het een nadeel kunnen zijn dat hij 30 minuten alleen in een kamer zit. Ook de dertig minuten meting geeft geen informatie over de nachtelijke bloeddruk. De bloeddruk gemeten over de nacht blijkt een sterker voorspeller te zijn dan bloeddruk overdag. Daarom heeft een 24-uurs bloeddrukmeting de voorkeur.
Beschikbaarheid van zorg
Voor de praktijk is een 24-uurs meting en geprotocolleerde thuismeting relatief makkelijk uitvoerbaar. Beide vergen wel een goede instructie aan de patiënt. Bij de BP30-meting hoeft de patiënt, buiten rustig blijven zitten, niets te doen. De meting neemt echter wel veel tijd en ruimte in beslag. Dit kan in de organisatie een probleem zijn. Voor zowel de 30 minuten meting als de thuismeting is (in elk geval in de eerste lijn) nog geen tarief vastgesteld, terwijl naast tijd en ruimte er ook goede apparatuur moet worden aangeschaft.
Praktische aspecten van de verschillende bloeddrukmeetmethodes
Spreekkamermeting
Auscultatoire of oscillometrische semiautomatische sfygmomanometers moeten worden gevalideerd en periodiek worden gecontroleerd (O’Brien, 2001). Let op: geautomatiseerde apparaten zijn niet goedgekeurd voor bloeddrukmeting bij patiënten met boezemfibrilleren. Het advies is om ook altijd de pols te voelen bij het meten van de bloeddruk om personen met boezemfibrilleren op te sporen.
In de praktijk blijkt dat spreekkamermetingen niet altijd optimaal worden uitgevoerd. De patiënt dient namelijk eerst 5 minuten te zitten in een rustige omgeving. De juiste manchet moet worden gebruikt aan de arm waarvan bekend is dat die de hoogste waarde geeft en er dienen ten minste 2 metingen gedaan te worden met een tussenpoos van 1 tot 2 minuten. Er zijn aanwijzingen dat de meting zo uitvoeren met een automatische bloeddrukmeter in afwezigheid van een zorgverlener betrouwbare resultaten geeft met minder witte-jasseneffect (Myers, 2012).
Ambulante metingen
De onderstaande algemene principes en opmerkingen moeten worden opgevolgd:
- de procedure moet afdoende worden uitgelegd aan de patiënt, met mondelinge en schriftelijke instructies;
- apparaten moeten goedgekeurd zijn en regelmatig gekalibreerd worden, ten minste elke 12 maanden.
Bloeddrukwaardes bij verschillende bloeddrukmeetmethoden
Het is bekend welke waardes van de 24-uurs bloeddrukmeting en de geprotocolleerde thuismeting overeenkomen met de 140 mmHg spreekkamermeting. Voor de hogere bloeddrukken is daar minder onderbouwing voor en is geprobeerd een schatting te maken mede aan de hand van de Amerikaanse bloeddrukrichtlijn (Whelton, 2017) en op basis van consensus van experts. Deze schattingen van de corresponderende metingen zijn weergegeven in tabel 1, waarbij ervoor gekozen is om de spreekkamermeting van 140 (streefwaarde) met 180 (absolute behandelindicatie) te vergelijken. Ten aanzien van de BP30-meting is de inhoud van deze tabel niet significant strijdig met de resultaten van de zoekstrategie. Derhalve neemt de werkgroep onderstaande tabel over.
Tabel 1 (Schatting van) corresponderende bloeddrukwaardes bij verschillende andere meetmethodes bij spreekkamermetingen van 140 en 180 mmHg.
|
Spreekkamermeting |
140 mmHg |
180 mmHg |
|
24-uurs bloeddrukmeting |
130 mmHg |
165 mmHg |
|
Geprotocolleerde thuismeting |
135 mmHg |
170 mmHg |
|
BP30-meting* |
135 mmHg |
170 mmHg |
*De BP30-meting is minder goed onderzocht; de verschilschattingen zijn daarom indicatief weergegeven.
Gebruik van ambulante metingen en de 30 minuten meting bij het opstellen van cardiovasculair risicoprofiel
Ambulante metingen wordt aanbevolen ter evaluatie van de bloeddruk, maar kunnen echter niet direct gebruikt worden als waarde bij de risicoschatting met behulp van de risicotabel (zie de module ‘Hoe het risico te schatten’). Uitgangspunt voor de SCORE-tabel zijn namelijk (gestandaardiseerde) spreekkamerbloeddrukmetingen. Wel kan aan de hand van een ambulante meting een schatting van de spreekkamerbloeddrukmeting gemaakt worden (zie tabel 1) om te gebruiken in de SCORE-tabel. Bij het bepalen van het al dan niet behaald zijn van streefwaardes met een ambulante meting geldt hetzelfde. Indien ambulante bloeddrukmetingen niet haalbaar zijn, kan een BP30-meting worden overwogen. Ook daarvoor geldt dat de corresponderende spreekkamermeting geschat moet worden.
De werkgroep adviseert de bloeddruk te bepalen aan de hand van meerdere metingen volgens onderstaand stroomschema. Indien de bloeddruk slechts licht verhoogd is, kan deze rustig geëvalueerd worden over een periode van weken tot maanden. Indien de bloeddruk duidelijk verhoogd is of vergezeld gaat met orgaanschade, andere risicofactoren voor hart- en vaatziekten of vastgestelde hart- en vaatziekten of chronische nierschade, zijn herhaalde bloeddrukmetingen binnen een kortere periode vereist om beslissingen te nemen over behandeling.
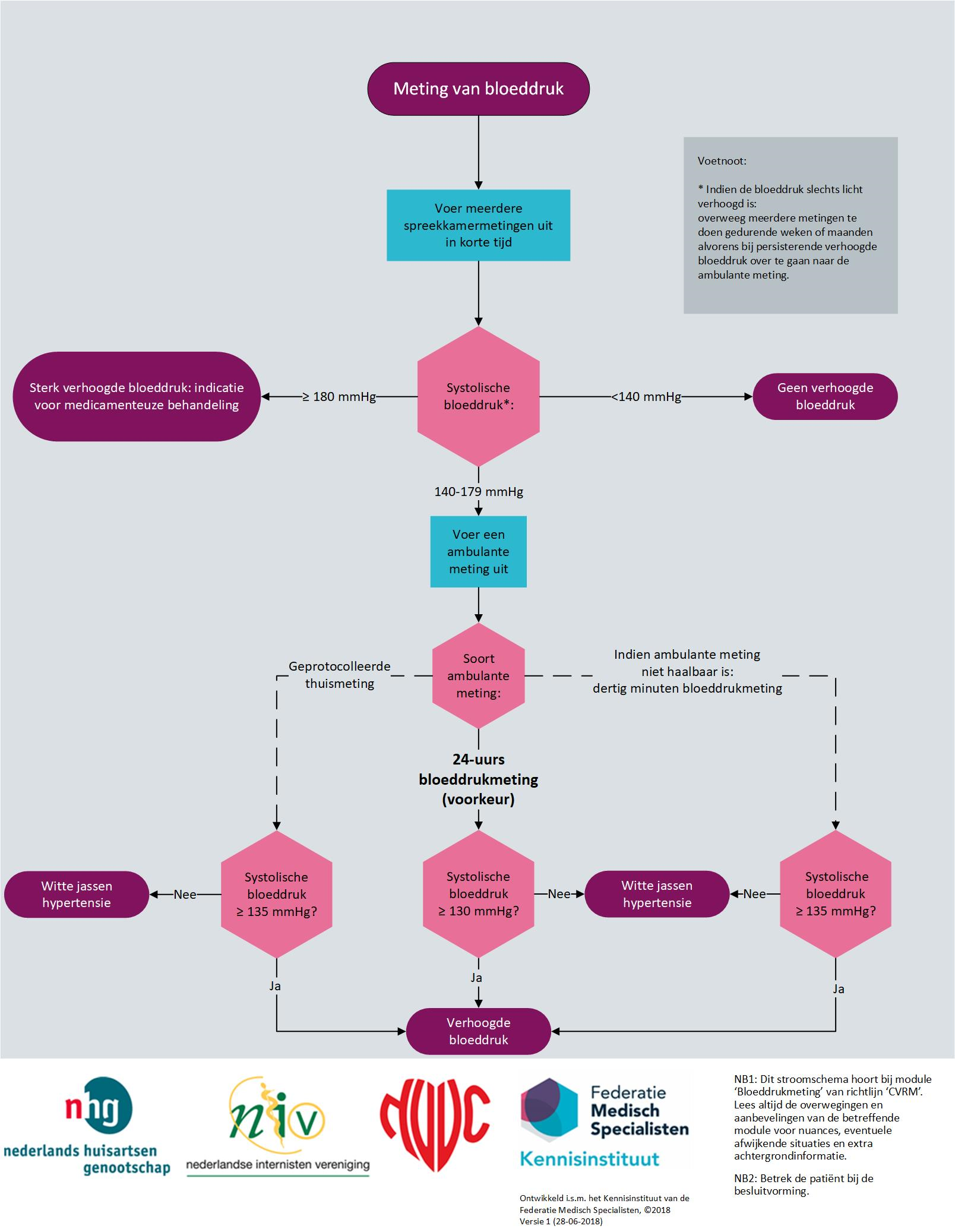
Figuur 1 Stroomschema bloeddruk meten
In dit schema is als uitgangspunt de spreekkamermeting 140 mmHg gekozen als streefwaarde. Indien in verband met bijvoorbeeld een comorbiditeit een andere streefwaarde is vastgesteld, dan kunnen de corresponderende waardes in plaats van de 140 mmHg worden aangehouden.
Onderbouwing
Achtergrond
De belangrijkste indicaties voor het meten van de bloeddruk zijn het schatten van het risico op hart- en vaatziekten en het bepalen of streefwaarden al dan niet behaald zijn. De spreekkamerbloeddrukmeting is lange tijd de meeste gebruikte meetmethode geweest. In de praktijk wordt de bloeddruk in de spreekkamer echter vaak niet goed gemeten (onvoldoende rust, geen herhaalde metingen, et cetera). Dit kan mede een oorzaak zijn van witte-jas-hypertensie met mogelijk overdiagnostiek en onnodige behandeling als gevolg.
In de praktijk kunnen verschillende soorten bloeddrukmeetmethode toegepast worden. Zo zijn er onder andere de 24-uurs ambulant bloeddrukmeting (ABPM) en de geprotocolleerde thuismeting (HBPM) (zie tabel 1). Ook is er recent veel aandacht voor de dertigminuten-bloeddrukmeting in de huisartsenpraktijk of het ziekenhuis.
Tabel 1 Overzicht van verschillende bloeddrukmeetmethoden
|
Praktijkmetingen |
|
|
OBPM |
Spreekkamerbloeddrukmeting |
|
AOBP |
Elektronische bloeddrukmeting (niet gesuperviseerd) |
|
Non AOBP |
Handmatige bloeddrukmeting |
|
BP30 |
Automatische bloeddrukmeting gedurende 30 minuten |
|
Ambulante metingen |
|
|
ABPM |
24-uurs bloeddrukmeting |
|
HBPM |
Geprotocolleerde thuismeting |
Praktijkmetingen
Een spreekkamerbloeddrukmeting (OBPM) is een bloeddrukmeting door een gezondheidszorgmedewerker. Dit kan zowel handmatig of elektronisch zijn. Een elektronische bloeddrukmeting (AOBP) is een bloeddrukmeting, waarbij de eerste meting wordt gedaan door een gezondheidszorgmedewerker. Daarna wordt de patiënt alleen gelaten en volgen er meerdere metingen met een interval van 1 tot 2 minuten (ofwel ‘unattended’ meting).
De automatische bloeddrukmeting gedurende 30 minuten is een specifiek soort AOBP, waarbij de patiënt in een rustige ruimte zit en er met een interval van 5 minuten 30 minuten lang de bloeddruk wordt gemeten (in totaal 6 metingen).
Ambulante metingen
Bij de 24-uurs bloeddrukmeting (ABPM) krijgt de patiënt een automatische bloeddrukmeter mee. Er wordt 24 uur gemeten, overdag met intervallen van 20 tot 30 minuten en ’s nachts met intervallen van 30 tot 60 minuten.
Bij de geprotocolleerde thuismeting (HBPM) meet de patiënt een week lang, meestal ’s morgens voor het ontbijt en ’s avonds 2 uur na het eten, de bloeddruk met een automatische bloeddrukmeter (telkens tweemaal). Er bestaan ook andere meetprotocollen voor HBPM, maar bovengenoemde variant is het meest bestudeerd.
Conclusies / Summary of Findings
BP30 versus OBPM
|
Redelijk GRADE |
De systolische bloeddruk gemeten met een BP30-meting is ten minste 6 mmHg lager dan gemeten in de spreekkamer bij patiënten met een indicatie om de bloeddruk te meten.
Bronnen (Bos, 2017; Scherpbier, 2011) |
BP30 versus ABPM
|
- GRADE |
Vanwege tegensprekende resultaten is het niet mogelijk een conclusie te trekken over de vergelijkbaarheid van een BP30-meting met een 24-uurs ABPM (daggemiddelde).
Bronnen (Van der Wel, 2011; Culleton, 2006) |
Samenvatting literatuur
Beschrijving studies
Bos (2017) vergeleek een BP30-meting met een spreekkamermeting onder patiënten uit een huisartsenpraktijk. Opeenvolgende patiënten die een BP30-meting kregen, werden gedurende een periode van zes maanden geïncludeerd. Het ging hierbij om patiënten die volgens de nationale richtlijnen in aanmerking kwamen voor een zorgvuldige bloeddrukbeoordeling. De BP30-meting is een meting van de bloeddruk om de vijf minuten voor een totaal van 30 minuten terwijl de patiënt zit en niet gestoord wordt. De uiteindelijk geregistreerde waarde is het gemiddelde van de laatste zes metingen. Als referentie werd de laatst gemeten spreekkamerbloeddruk genomen voordat een BP30-meting plaatsvond. In totaal werden 200 patiënten geïncludeerd.
Scherpbier (2011) onderzocht de overeenstemming tussen een BP30-meting en een gestandaardiseerde spreekkamermeting. In twee huisartsenpraktijken werden opeenvolgende patiënten, waarbij een bloeddrukmeting tijdens afspraak geagendeerd was, gevraagd om aan het onderzoek deel te nemen. Patiënten met boezemfibrilleren, een gedocumenteerde hartklepaandoening, volledige axillaire lymfeklieruitsnijding aan de rechterzijde of bovenarmomtrek groter dan 35 centimeter werden geëxcludeerd. De gestandaardiseerde bloeddrukmeting werd na een vijf minuten rustperiode in afwezigheid van de observator gemeten. Er werden drie metingen genomen. Direct aansluitend werd een BP30-meting uitgevoerd. Deze bestond uit 11 metingen, waarvan 10 in afwezig van de onderzoeker. Zowel de eerste meting van de gestandaardiseerde spreekkamermeting als die van de BP30-meting werden buiten beschouwing gelaten. 105 patiënten deden mee aan deze studie. In totaal kon de gegevens van 83 patiënten worden gebruik voor de analyse.
Van der Wel (2011) nodigde elke patiënt van 18 jaar of ouder doorverwezen voor een 24-uurs ABPM-meting uit. Patiënten bekend met boezemfibrilleren, onregelmatige pols, zwangerschap of nachtdienst-werk werden geëxcludeerd. De BP30-meting vond voorafgaand aan de 24-uurs ABPM-meting plaats. Alle BP30-metingen vonden plaats tussen 11 uur en 15 uur in een rustige kamer in een diagnostisch centrum. De bloeddruk werd gemeten aan de niet-dominante arm met vijf-minutenintervallen. De gemiddelde bloeddruk werd door de laatste zes metingen bepaald. De gemiddelde dag ABPM werd berekend uit de lezingen van 9 uur tot 21 uur. In totaal werden 96 patiënten geïncludeerd.
Culleton (2006) vergeleek de BP30-meting met het daggemiddelde van de 24-uurs ABPM-meting. Volwassen patiënten met hypertensie bij wie een ABPM aangevraagd zou worden, kwamen in aanmerking voor de studie. De BP30-meting vond om de vijf minuten plaats gedurende 25 minuten. Het gemiddelde van de bloeddruk werd gebaseerd op de laatste vijf metingen. Het is onbekend hoe de 24-uurs ABPM-meting werd verkregen. De auteurs vermeldden wel dat het daggemiddelde werd gebaseerd op de uren dat de patiënt wakker was. In totaal werden 107 patiënten geïncludeerd.
Resultaten
1. Bloeddruk
De resultaten van de studies van Bos (2017) en Scherpbier (2011) zijn in tabel 2 weergegeven. In beide studies was de bloeddruk gemeten volgens de BP30-meting significant lager dan de bloeddruk gemeten op de spreekkamer. Aangezien de betrouwbaarheidsintervallen niet overlappen, zijn de resultaten te heterogeen om te poolen. Echter, de resultaten wijzen dezelfde kant op. De systolische bloeddruk gemeten met een BP30-meting is ten minste 6 mmHg lager vergeleken met een spreekkamermeting.
Ook de resultaten uit de studies van der Wel (2011) en Culleton (2006) zijn weergegeven in tabel 2. In de studie van Van der Wel (2011) was de BP30-meting vergelijkbaar met de ABPM-meting gedurende de dag, terwijl in de studie van Culleton (2006) de bloeddruk gemeten met een BP30-meting significant lager was dan het dag gemiddelde ABPM-meting. Vanwege tegensprekende resultaten is er geen meta-analyse uitgevoerd.
Tabel 2 Resultaten van Bos (2017), Scherpbier (2011), Van der Wel (2011) en Culleton (2006)
|
Auteur, jaar |
Systolische bloeddruk, mmHg (95%CI) |
|
BP30 versus OBPM |
|
|
Bos, 2017 |
-22,8 (-26,1 tot -19,8) |
|
Scherpbier, 2011 |
-7,6 (-9,1 tot -6,1) |
|
BP30 versus ABPM overdag |
|
|
Van der Wel, 2011 |
0 (-2 tot 2) |
|
Culleton, 2006 |
-9,7 (-12,1 tot -7,2) |
Bewijskracht van de literatuur
Bloeddruk (BP30 versus OBPM): De bewijskracht voor de uitkomstmaat bloeddruk is met een niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; Bos (2017) heeft geen informatie over OBPM verstrekt).
Bloeddruk (BP30 versus ABPM): Vanwege tegensprekende resultaten is het niet mogelijk de bewijskracht te graderen.
Zoeken en selecteren
Om de deelvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Welke afkapwaarde van een BP30-meting komt overeen met de huidige afkapwaarde van 24 uurs ABPM-meting en met de afkapwaarde 140/90 mmHg bij een spreekkamermeting?
P: algemene populatie;
I: dertig minuten bloeddrukmeting (BP30);
C: 24-uurs bloeddrukmeting (ABPM) of spreekkamermeting (OBPM);
O: bloeddruk.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 24 juli 2017 met relevante zoektermen gezocht naar systematische reviews en observationele studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 110 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews met een gedetailleerde zoekstrategie, evidence-tabellen en Risk of Biasbeoordeling;
- observationele studies met een vergelijking tussen een BP30-meting en een 24-uurs ABPM-meting of spreekkamermeting.
Op basis van titel en abstract werden in eerste instantie 22 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 21 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 1 studie definitief geselecteerd. In referentielijsten werden nog drie relevante studies gevonden.
Vier onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (Risk of Bias) is opgenomen in de Risk of Bias tabellen.
Referenties
- Bos MJ, Buis S. Thirty-Minute Office Blood Pressure Monitoring in Primary Care. Ann Fam Med. 2017;15(2):120-123. doi: 10.1370/afm.2041. PubMed PMID: 28289110; PubMed Central PMCID: PMC5348228.
- Culleton BF, McKay DW, Campbell NR. Performance of the automated BpTRU measurement device in the assessment of white-coat hypertension and white-coat effect. Blood Press Monit. 2006;11(1):37-42. PubMed PMID: 16410740.
- Myers MG, Godwin M, Dawes M, Kiss A, Tobe SW, Kaczorowski J. Conventional versus automated measurement of blood pressure in the office (CAMBO) trial. Fam Pract. 2012 Aug;29(4):376-82. doi: 10.1093/fampra/cmr113. Epub 2011 Nov 24. PubMed PMID: 22117083.
- Scherpbier-de Haan N, van der Wel M, Schoenmakers G, et al. Thirty-minute compared to standardised office blood pressure measurement in general practice. Br J Gen Pract. 2011;61(590):e590-7. doi: 10.3399/bjgp11X593875. PubMed PMID: 22152748; PubMed Central PMCID: PMC3162182.
- van der Wel MC, Buunk IE, van Weel C, et al. A novel approach to office blood pressure measurement: 30-minute office blood pressure versus daytime ambulatory blood pressure. Ann Fam Med. 2011;9(2):128-35. doi: 10.1370/afm.1211. PubMed PMID: 21403139; PubMed Central PMCID: PMC3056860.
- Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2017;pii:S0735-1097(17)41519-1. doi: 10.1016/j.jacc.2017.11.006. (Epub ahead of print) PubMed PMID: 29146535.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Bos, 2017 |
Type of study: Cross-sectional study
Setting: All consecutive patients who underwent OBP30 for medical reasons over a 6-month period in a single primary health care center
Country: The Netherlands
Source of funding: None received |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 207 patients
Important prognostic factors2: Mean age: 68 (SD 13) Sex: 43% Male CVD: 20% Diabetes: 20%
|
BP30
BP30 is performed with the patient sitting alone and undisturbed for 30 minutes while the blood pressure is measured automatically every 5 minutes, producing 7 readings. The resulting OBP30 is the mean of the last 6 blood pressure readings.
|
OBPM
|
Length of follow-up: Not applicable because of the cross-sectional design
Loss-to-follow-up: N = 6 (3%) Reasons (n=2 missing OBP; n=2 technical problems OBP30; n=2 Start of medication between OBP and OBP30)
Incomplete outcome data: N = 6 (3%) Reasons (n=2 missing OBP; n=2 technical problems OBP30; n=2 Start of medication between OBP and OBP30)
|
Outcome Blood pressure
Systolic blood pressure (mmHg, 95%CI) BP30: 140.9 (138.4 to 143.5) OBPM: 163.8 (161.5 to 166.2) MD: -22.8 (-26.1 to -19.8)
Diastolic blood pressure (mmHg, 95%CI) BP30: 77.3 (75.7 to 78.9) OBPM: 88.9 (87.4 to 90.4) MD: -11.6 (-13.1 to -10.2) |
Authors’ conclusions: BP30 yields considerably lower blood pressure readings than OBPM in all studied patient groups. BP30 is a promising technique to reduce overtreatment of white-coat hypertension in primary health care. |
|
Scherpbier, 2011 |
Type of study: Cross-sectional study
Setting: General practices
Country: The Netherlands
Funding: This study was not funded |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 105 patients (83 patients were described)
Important prognostic factors2: Mean age: 62 (SD 11) Sex: 39% Male
|
BP30
30-minute OBPM of 11 measurements, of which 10 were made in the absence of the researcher. The position of the patient and cuff were not altered. The first measurement was discarded. |
Standardised OBPM
After a 5-minute rest period in the absence of the observer, three readings were taken. The first measurement was discarded. |
Length of follow-up: Not applicable because of the cross-sectional design
Loss-to-follow-up: N = 22 of 105 patients (21%) Reasons (n=10 because of fewer than nine measurements of BP30 were valid; 6 because of medication between the two visits, two because the felt unwell during the measurements, two because they altered the position of their arm during measurements, and two because they were unable to come for the second visit).
Incomplete outcome data: N = 22 of 105 patients (21%) Reasons (n=10 because of fewer than nine measurements of BP30 were valid; 6 because of medication between the two visits, two because the felt unwell during the measurements, two because they altered the position of their arm during measurements, and two because they were unable to come for the second visit). |
Outcome Blood pressure
Systolic blood pressure (mmHg, SD)) BP30: 126.8 (14.1) OBPM: 134.4 (16.4) MD: -7.6 (-9.1 to -6.1)
Diastolic blood pressure (mmHg, 95%CI) BP30: 81.6 (10.1) OBPM: 84.1 (10.8) MD: -2.5 (-3.4 to -1.5)
|
Authors’ conclusions: Thirty-minute OBPM resulted in lower readings than standardised OBPM and had a better repeatability. These results suggest that 30-minute OBPM better reflects the patient’s true blood pressure than standardised OBPM does. |
|
Van der Wel, 2011 |
Type of study: Cross-sectional study
Setting: All patients referred by their family physician
Country: The Netherlands
Funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 96 patients
Important prognostic factors2: Mean age: 57 (SD 20) Sex: 39% Male
|
BP30
Defined as 30-minute OBPM to be the mean blood pressure calculated from the 6 measurements taken at 5-minute intervals from t = 5 to t = 30 minutes. |
24-hour ABPM
The 24-hour ABPM was set at 20-minute intervals from 7 AM to 11 PM and at 1-hour intervals from 11 PM to 7 AM. Blood pressure was monitored on the same arm as during the 30-minute OBPM. Patients were instructed to perform their usual daily activities but to stop moving and be silent during measurements. The mean daytime ABPM was calculated from the readings of 9 AM to 9 PM. |
Length of follow-up: Not applicable because of the cross-sectional design
Loss-to-follow-up: N = 12 (13%) Reasons (n=6 measurements exceeded the predefined number of erroneous readings; in 5 patients a problem occurred with cuff fitting during the 24-hour ABPM, and 1 patient was disturbed during the 30-minute OBPM).
Incomplete outcome data: N = 12 (13%) Reasons (n=6 measurements exceeded the predefined number of erroneous readings; in 5 patients a problem occurred with cuff fitting during the 24-hour ABPM, and 1 patient was disturbed during the 30-minute OBPM).
|
Outcome Blood pressure
Systolic blood pressure (mmHg, SD) BP30: 141 (17) Daytime ABPM: 141 (14) MD: 0 (-2 to 2)
Diastolic blood pressure (mmHg, SD) BP30: 84 (11) Daytime ABPM: 82 (11) MD: 2 (0 to 3)
|
Authors’ conclusions: The 30-minute OBPM appears to agree well with daytime ABPM and has the potential to detect white-coat and masked hypertension. This finding makes 30-minute OBPM a promising new method to determine blood pressure during diagnosis and follow-up of patients with elevated blood pressure. |
|
Culleton, 2006 |
Type of study: Cross-sectional study
Setting: Adult hypertensive patients refer for ABPM.
Country: Canada
Funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 107 patients
Important prognostic factors2: Mean age: 57 (SD 12) Sex: 47% Male
|
BP30
A 5-min rest in a quiet comfortable room was used prior to measurement. All blood pressure measurements were obtained with the patient in a sitting position with the arm supported. The BpTRU device was set to measure blood pressure immediately and every 5 min for 25 min. The mean of the last five BpTRU measurements were used for all analyses. |
24-hour ABPM
The mean daytime ABPM systolic and diastolic pressures were used as the reference standard. Daytime was defined according to each patient’s waking hours as noted in the patient’s diary.
|
Length of follow-up: Not applicable because of the cross-sectional design
Loss-to-follow-up: Not stated
Incomplete outcome data: Not stated
|
Outcome Blood pressure
PB30 versus 24-ABPM Systolic blood pressure (mmHg, SD) OBP30: 132.1 (16.8) Daytime ABPM: 141.8 (13) MD: -9.7 (-12.1 to -7.2)
Diastolic blood pressure (mmHg, SD) BP30: 81.5 (9.5) Daytime ABPM: 85.3 (9.1) MD: -3.9 (-5.3 to -2.4) |
Authors’ conclusions: Although BpTRU reduces white-coat effect and white-coat hypertension, blood pressure is underestimated by the device, leading to misclassification of hypertension. BpTRU, when set at 5-min blood pressure measurement intervals, should not be used in clinical practice. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Bos, 2017 |
Unlikely. A consecutive sample of patients was used. |
Not applicable |
Likely. Not clearly described how OBP was obtained. |
Unlikely. No need for adjustment for prognostic factors. |
|
Scherpbier, 2011 |
Unlikely. A consecutive sample of patients was used. |
Not applicable |
Unlikely. Both blood pressure measures were described in detail. |
Unlikely. No need for adjustment for prognostic factors. |
|
Van der Wel, 2011 |
Unlikely. A consecutive sample of patients was used. |
Not applicable |
Unlikely. Both blood pressure measures were described in detail. |
Unlikely. No need for adjustment for prognostic factors. |
|
Culleton, 2006 |
Unclear. Patients referred to centre for ABPM, unclear whether this were consecutive patients. |
Not applicable |
Unlikely. Both blood pressure measures were described in detail. |
Unlikely. No need for adjustment for prognostic factors. |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The Risk of Bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-06-2021
Uiterlijk in 2020 bepalen het bestuur van het Nederlands Huisartsen Genootschap, de Nederlandse Internisten Vereniging en de Nederlandse Vereniging voor Cardiologie of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt van de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Het Nederlands Huisartsen Genootschap, de Nederlandse Internisten Vereniging en de Nederlandse Vereniging voor Cardiologie zijn regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Nederlands Huisartsen Genootschape en het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd door het Nederlands Huisartsen Genootschap en de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze multidisciplinaire richtlijn is het optimaliseren van de preventie van hart- en vaatziekten met specifieke focus op individuen met een verhoogd risico op hart- en vaatziekten.
Doelgroep
Deze multidisciplinaire richtlijn is geschreven voor alle zorgverleners die betrokken zijn bij cardiovasculair risicomanagement
Samenstelling werkgroep
In 2016 is een multidisciplinaire werkgroep ingesteld, bestaand uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de preventie van hart- en vaatziekten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. A.W. (Arno) Hoes, klinisch epidemioloog, werkzaam in het Julius Centrum van het UMC Utrecht te Utrecht (voorzitter)
- Dr.ir. I. (Ineke) van Dis, epidemioloog en voedingswetenschapper, werkzaam bij de Hartstichting te Den Haag, Hartstichting
- Y.A. (Yvette) Henstra, verpleegkundig specialist vasculaire geneeskunde, werkzaam in het OVLG te Amsterdam, NVHVV
- Dr. H.M. (Heleen) den Hertog, neuroloog, werkzaam in het Isala Ziekenhuis te Zwolle, NVN
- Dr. K. (Karen) Konings, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk K. Konings te Maastricht, NHG
- H. (Hans) van Laarhoven, manager team collectieve belangenbehartiging, werkzaam bij Hartenraad te Den Haag, Harteraad
- Dr. A.H. (AnHo) Liem, cardioloog, werkzaam in het Franciscus Gasthuis & Vlietland te Rotterdam, NVVC
- Dr. F.M.A.C. (Fabrice) Martens, cardioloog, werkzaam in het Deventer Ziekenhuis te Deventer, NVVC
- Prof. dr. Y.M. (Yvo) Smulders, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
- Drs. A. (Anne-Margreet) Strijbis, relatiemanager zorg, werkzaam bij Harteraad te Den Haag, Harteraad
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Prof. dr. F.L.J. (Frank) Visseren, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
Met ondersteuning van:
- G.M. (Maike) van Leeuwen, beleid- en projectondersteuner, NIV
- Dr. Tj. (Tjerk) Wiersma, senior-wetenschappelijk medewerker, NHG
- Dr. W. (Wouter) de Ruijter, wetenschappelijk medewerker, NHG tot augustus 2017
- Drs. M. (Martijn) Sijbom, wetenschappelijk medewerker, NHG vanaf augustus 2017
- Dr. I.M. (Iris) Wichers, wetenschappelijk medewerker, NHG
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van FMS
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van FMS tot april 2018
- Dr. A. (Aleid) Wirix, adviseur, Kennisinstituut van FMS vanaf april 2018
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van FMS tot januari 2018
- J. (Jill) Heij, junior projectsecretaresse, Kennisinstituut van FMS vanaf februari 2018
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Hoes (voorzitter) |
|
|
- |
Geen |
|
Konings |
Kaderhuisarts hart- en vaatziekten |
- |
- |
Geen |
|
Tjin-A-Ton |
Kaderhuisarts hart- en vaatziekten |
|
- |
Geen |
|
Visseren |
|
|
Deelname aan fase II en II multicenter trials oer PSCK9-antilichamen. Betrokken bij patiënteninclusie, geen data-analyse |
Geen |
|
Smulders |
|
|
- |
Geen |
|
Liem |
|
|
Advies aan universiteiten en industrie over dyslipidemie en lipidenverlaende middelen |
Geen actie; advies over alle middelen |
|
Martens |
Cardioloog |
Bestuurslid Werkgroep Cardiologische centra Nederland (WCN) |
Advies aan universiteiten en industrie over dyslipidemie en lipidenverlaende middelen |
Geen actie; advies over alle middelen |
|
Den Hertog |
Neuroloog |
|
- |
Geen |
|
Henstra |
Verpleegkundig Specialist Vasculaire geneeskunde |
- |
Advies aan industrie lancering nieuwe medicatie bij FH |
Geen; valt buiten het bestek van de richtlijn |
|
Strijbis |
Relatiemanager Hartenraad |
Werkgroeplid Hypertensie in de tweede en derde lijn |
- |
Geen |
|
Van Laarhoven |
|
Werkgroeplid (erfelijke) dyslipidemie in de tweede en derde lijn |
- |
Geen |
|
Van Dis |
|
Lid van de werkgroep Voeding van de European Heart Network |
Hartstichting heeft een samenwerkingscontract met Unilever |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardiging van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Hartenraad en Hartstichting.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. CVRM-indicatoren zijn separaat aan de herziening van deze richtlijn ontwikkeld en te vinden op https://www.nhg.org/themas/publicaties/download-indicatoren-archief.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stapsgewijze beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Voor het herzien van de Nederlandse multidisciplinaire richtlijn CVRM heeft de werkgroep besloten uit te gaan van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016. Deze richtlijn was op het moment van starten de meest recente richtlijn met de meest recente evidence. De werkgroep beoordeelde de aanbevelingen uit de eerder genoemde richtlijn op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens een Invitational conference door Diabetesvereniging Nederland, IGZ, FMCC, Hartenraad (voorheen De Hart&Vaatgroep), KNGF, KNMP, NHG, NVAB, NVALT, NVR, NVVC, Verenso en InEen. De werkgroep stelde vervolgens een lijst met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, en (3) de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse hebben de voorzitter en de ondersteuners concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming over aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep in ieder geval voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke onderzoeken in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar onderzoeken aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar onderzoeken met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. Deze geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met de desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënte perspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele onderzoeken
Individuele onderzoeken werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende onderzoeksresultaten (Risk of Bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de ‘Risk of Bias’ (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottawa – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal onderzoeken en overeenkomstigheid (homogeniteit) tussen de onderzoeken werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt)relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor Risk of Bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De uiteindelijke bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overkoepelende conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling worden naast (de kwaliteit van) het wetenschappelijke bewijs ook andere belangrijke aspecten meegewogen, zoals de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat de werkgroep toekent aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken deel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en heeft de werkgroep de richtlijn definitief vastgesteld. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline
Div.: 2005-juli 2017;
Engels |
1 blood pressure determination/ or blood pressure monitoring, ambulatory/ or exp Sphygmomanometers/ or ABPM.ti,ab,kf. or AOBP.ti,ab,kf. or (("blood pressure" or bp) adj3 (measur* or monitor* or automat*)).ti,ab,kf. (60571) 2 *"Home Care Services"/ or exp General Practice/ or Physicians' Offices/ or "Office Visits"/ or (home or office or "24" or ambula* or practice or ABPM or AOPM).ti,ab,kf. (1869131) 3 1 and 2 (19098) 4 Prognosis/ or reference values/ or prognos*.ti. or ("reference value*" or "normative value*" or threshold*).ti,ab,kf. or (cut-off or cutoff).ti,ab,kf. or ("30" adj min*).ti,ab,kf. (1056424) 5 3 and 4 (2567) 6 limit 5 to (english language and yr="2012 -Current") (600) 7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (335728) 8 6 and 7 (19) 9 (AOBP or (Automated adj office)).ti,ab,kf. (95) 10 1 and 9 (88) 11 limit 10 to (english language and yr="2005 -Current") (76) – 71 uniek 12 8 and 11 (1) = SR over AOBP (in beide files)
|
34 SR en 76 AOBP |
|
Embase (Elsevier) |
"(((('blood pressure measurement'/mj OR 'blood pressure monitoring'/exp/mj OR 'blood pressure meter'/exp/mj) OR (abpm:ti,ab OR aobp:ti,ab OR ((('blood pressure' OR bp) NEAR/3 (measur* OR monitor* OR automat*)):ti,ab)))
AND (('home care'/exp/mj OR 'general practice'/exp OR 'health care facility'/exp OR 'ambulatory monitoring'/exp) OR (('blood pressure' OR bp) NEAR/3 (measur* OR monitor* OR automat*)):ti,ab)
AND ('prognosis'/exp/mj OR 'reference value'/exp/mj OR prognos*:ti OR 'reference value*':ti,ab OR 'normative value*':ti,ab OR threshold*:ti,ab OR 'cut off':ti,ab OR cutoff:ti,ab OR (('30' NEAR/1 min*):ti,ab))
NOT 'conference abstract':it
AND (english)/lim AND (embase)/lim AND (2012-2017)/py)
AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))) (25) – 15 uniek
OR ((('blood pressure measurement'/mj OR 'blood pressure monitoring'/exp/mj OR 'blood pressure meter'/exp/mj) OR (abpm:ti,ab OR aobp:ti,ab OR ((('blood pressure' OR bp) NEAR/3 (measur* OR monitor* OR automat*)):ti,ab)))
AND (aobp:ti,ab OR ((automated NEAR/1 office):ti,ab))
NOT 'conference abstract':it AND (english)/lim AND (embase)/lim AND (2005-2017)/py) (63) – 4 uniek |
|
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Reviews |
|
|
Albasri, 2017 |
Bloeddruk gemeten bij de apotheek versus door de huisarts |
|
Blom, 2015 |
Betreft een studieprotocol |
|
Reino-Gonzalez, 2017 |
Vergelijking tussen ABPM en spreekkamermetingen |
|
Diverse designs |
|
|
Andreadis, 2017 |
Interval tussen bloeddrukmeting: 1 minuut |
|
Jegatheswaran, 2017 |
Interval tussen bloeddrukmeting: 1 à 2 minuten (1 referentie gevonden (Culleton,2006)) |
|
Rinfret, 2017 |
Interval tussen bloeddrukmeting: 1 minuut |
|
Filipovsky, 2016 |
Patiënten met hypertensie (97,5% gebruikte antihypertensiva) |
|
Wohlfahrt, 2016 |
Interval tussen bloeddrukmeting: 1 minuut |
|
Padwal, 2015 |
Patiënten met hypertensie; vergelijking apotheek versus ABPM |
|
Myers, 2014 |
Case report en narratieve review |
|
Edwards, 2013 |
Interval tussen bloeddrukmeting: 1 minuut |
|
van der Wel, 2013 |
Letter to the editor (commentaar) (1 referentie gevonden (van der Wel (2011)) |
|
Andreadis, 2012 |
Interval tussen bloeddrukmeting: 1 minuut |
|
Myers, 2012 |
Interval tussen bloeddrukmeting: 1 à 2 minuten |
|
Myers, 2012 |
Zelfde trial als vorige |
|
Andreadis, 2011 |
Interval tussen bloeddrukmeting: 1 minuut |
|
Godwin, 2011 |
Interval tussen bloeddrukmeting: 1 minuut |
|
Lamarre-Cliche, 2011 |
Interval tussen bloeddrukmeting: 1 minuut |
|
Myers, 2011 |
Interval tussen bloeddrukmeting: 1 à 2 minuten |
|
Myers, 2009 |
Interval tussen bloeddrukmeting: 1 à 2 minuten |
|
Myers, 2008 |
Interval tussen bloeddrukmeting: 1 à 2 minuten |
