Indicatie zuurstoftoediening
Uitgangsvraag
Bij welke zuurstofsaturatie is toediening van zuurstof geïndiceerd bij kinderen (0-3 jaar) met bronchiolitis die gezien worden in de eerste uren in het ziekenhuis/ op de spoedeisende hulp (SEH)?
Aanbeveling
Geef zuurstoftherapie aan kinderen met een bronchiolitis bij een zuurstofsaturatie gelijk of onder de 90%.
Overweeg zuurstoftherapie bij kinderen met een zuurstofsaturatie >90% als er op basis van klinische beoordeling (mate van ademarbeid) en/of verminderde intake en/of comorbiditeit een ernstiger beloop verwacht kan worden.
Overwegingen
Voor- en nadelen van het toedienen van zuurstof vanaf een lagere saturatiegrens en de kwaliteit van het bewijs
Op basis van één enkele, hoewel goed uitgevoerde RCT, is het moeilijk om een stellige, eenduidige conclusie te trekken ten aanzien van een veilige (lagere) target voor zuurstofsuppletie bij kinderen met bronchiolitis. Wat cruciale en belangrijke uitkomstmaten betreft, lijkt het erop dat het hanteren van een lagere target mogelijk neutraal tot positief uitpakt, maar het is niet uit te sluiten dat er ook negatieve effecten zijn. De RCT laat zien dat het aanhouden van een zuurstofsaturatiegrens van 90% voor zuurstofsuppletie in vergelijking met zuurstofsuppletie vanaf < 94% mogelijk de opnameduur verkort en het risico om daarna opnieuw opgenomen te worden in het ziekenhuis mogelijk verkleint. De gevolgen van het verlagen van de zuurstofsaturatiegrens naar 90% ten aanzien van overlijdenskans zijn zeer onzeker en het effect van het hanteren van deze lagere zuurstofsaturatiegrens voor zuurstofsuppletie op PICU opnames, neurologische uitkomstmaten en SEH heropnames is onbekend. In Cunningham (2015) kwam wel naar voren dat het hanteren van een zuurstofsaturatiegrens van 90% t.o.v. 94% mogelijk zou kunnen leiden tot een groter relatief risico om opgenomen te worden op een afdeling voor meer intensieve zorg (vergelijkbaar met een High Care afdeling in Nederland; geen beademing mogelijk op dit soort afdeling) alsmede een groter relatief risico op ernstige respiratoire events. De werkelijke effecten op alle genoemde uitkomstmaten zijn echter dermate onzeker dat het ook zou kunnen dat in werkelijkheid beide targets voor zuurstofsuppletie tot vergelijkbare uitkomsten leiden, of dat de uitkomsten andersom zijn dan hierboven gerapporteerd. De overall bewijskracht is daarmee zeer laag.
De AAP hanteert al geruime tijd een saturatiegrens van 90% bij bronchiolitis. Cunningham zelf schrijft over lage saturatiegrenzen en neurologie dat vanuit andere aandoeningen met milde hypoxie, zoals kinderen met milde of matige OSAS, geen negatieve effecten op neurologische uitkomst beschreven zijn. Wanneer bij kinderen met bronchiolitis de saturatie met zuurstof suppletie boven de 90% gehouden wordt, hebben zij minder hypoxie dan kinderen met OSAS, waarbij de saturatie regelmatig onder de 90% is. De auteurs stellen dat hieruit kan afgeleid worden dat de kans op neurocognitieve schade zeer laag of afwezig is.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De belangrijkste doelen van een opname voor bronchiolitis voor ouders zijn het voorkomen van complicaties, waarbij aangenomen kan worden dat overlijden, een IC opname en neurologische schade de meest relevante complicaties zijn. Nadeel van de interventie zuurstoftherapie is opnameduur, wat voor ouders van jonge patiënten heel ingrijpend is. Echter, als genoemde uitkomsten hiermee voorkomen worden, zullen ouders zeker bereid zijn hun kind de interventie te laten ondergaan. Er zijn geen subgroepen waarbij deze afweging anders gemaakt zal worden.
Kosten (middelenbeslag)
Indien opnames en zuurstoftherapie bij hogere saturatiegrenzen daadwerkelijk mortaliteit, IC opnames en neurologische schade voorkomen, zijn dit de kosten voor de gezondheidszorg zeker waard. Indien echter veiliggesteld kan worden dat het verlagen van de saturatiegrens niet leidt tot een toename van de genoemde effecten, kan een aanzienlijke kostenbesparing geëffectueerd worden doordat er wellicht minder opnames plaats zullen vinden en opnames van kortere duur zullen zijn.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is geen onderzoek gedaan naar de bereidbaarheid van ouders om hun kind op te laten nemen voor zuurstoftherapie bij bronchiolitis. Echter, uit de klinische praktijk is bekend dat ouders hier vrijwel altijd bereid toe zijn. Het is niet te verwachten dat ouders bezwaren hebben tegen het verlagen van de saturatiegrens, omdat bij hen de kennis ontbreekt wat de gevolgen zijn van het hanteren van een bepaalde saturatiegrens. Het is de verwachting dat collega’s 1 RCT waarin niet alle cruciale uitkomstmaten zijn meegenomen, te weinig vinden om een beleidsverandering op door te voeren. Mogelijk is bij hoogdrempeliger opnemen frequenter herbeoordeling op de spoedeisende hulp nodig. Mogelijk hebben ouders met lage gezondheidsvaardigheden of een laag inkomen minder mogelijkheden om meerdere opeenvolgende dagen naar het ziekenhuis te komen en wordt klinische verslechtering niet op tijd herkend.
Rationale van de aanbeveling: weging van de argumenten voor en tegen de interventie
Bij gezonde kinderen wordt een saturatie van ≥ 95% als normaal beschouwd. Bij kinderen met een bronchiolitis komt een saturatie onder deze normaalwaarde geregeld voor. Echter bij een saturatie tussen de 90% en 95% valt geen lichamelijke of neurologische schade te verwachten.
De zuurstofdissociatiecurve heeft een bovenste buigpunt bij een arteriële druk van 60 mmHg, wat overeenkomt met een saturatie van 90% (Figuur 1). Boven en rechts van dit punt is de curve vlak en grote veranderingen in saturatie komen overeen met kleine veranderingen in arteriële zuurstofdruk. Een wat lagere saturatie kan derhalve geaccepteerd worden tijdens de ziekte-episode van een bronchiolitis.
Wij adviseren daarom om extra zuurstof toe te dienen bij saturaties onder de 90%. Daarnaast kan toediening van extra zuurstof worden overwogen bij kinderen met een bronchiolitis en saturaties van 90 tot en met 93%, als er op basis van klinische beoordeling en/of comorbiditeit een ernstiger beloop verwacht kan worden.
Het bewijs hiervoor is echter laag. Er zijn helaas weinig studies verricht naar verschillende saturatiegrenzen bij kinderen met bronchiolitis. De beschikbare studies laten geen verschil in uitkomsten zien tussen een saturatiegrens van 94% of 90%. Wel zullen er bij een saturatiegrens van 90% wellicht minder kinderen opgenomen hoeven te worden en zal de opnameduur mogelijk korter zijn.
Stollar onderzochten of en wanneer kinderen met bronchiolitis die zich presenteerden op de SEH, desaturaties (sat. < 90%) ontwikkelden. 70% van de kinderen had één of meerdere desaturaties en de mediane tijd tot de eerste desaturatie was 3.6 uur. Van belang is echter dat er géén verschil was in desaturaties tussen de kinderen die werden opgenomen en degenen die naar huis werden ontslagen vanaf de SEH. Ook was er geen verschil in heropnames. Hieruit blijkt dat andere factoren blijkbaar zwaarder wegen dan de saturatie op zich, in de besluitvorming om een patiënt wel of niet op te nemen.
In een studie van Van Hasselt et al werden 320 kinderen met bronchiolitis deels opgenomen in ziekenhuizen die een grens van 90% hanteerden, deels in ziekenhuizen die een grens van 92% als opnamecriterium hanteerden. Er werd geen verschil gevonden in het aantal opnames. In deze studie bleek ook dat kinderen meestal niet vanwege een lage saturatie worden opgenomen, maar om andere redenen zoals onvoldoende drinken, verhoogde ademarbeid of algeheel ziek-zijn. De opnameduur was wel korter indien er een saturatiegrens van 90% werd gehanteerd bij ontslag.
Onderbouwing
Achtergrond
Het is onduidelijk vanaf welke zuurstofsaturatiegrens zuurstof toegediend moet worden om te zorgen dat een kind met bronchiolitis sneller herstelt danwel geen schade oploopt t.g.v. hypoxemie. De AAP (American Academy of Pediatrics) houdt als grens voor zuurstofsuppletie een persisterende zuurstofsaturatie onder de 90% aan, met als aanvullende criteria een verhoogde ademarbeid van boven de 70-80 ademhalingen per minuut, dyspneu, cyanose en intercostale intrekkingen. In de vorige versie van deze richtlijn werd een grens van 92% aangehouden om zuurstofsuppletie te geven, maar mogelijk kan deze grens dus worden verlaagd.
Duidelijk is wel dat ten gevolge van het meten van zuurstofsaturatie het aantal opnames sinds de jaren ’80 met bijna 250% is gestegen en dat het ontslag is vertraagd (i.e. kinderen die klinisch stabiel zijn, maar nog een lage zuurstofsaturatie hebben verblijven langer in het ziekenhuis).
Conclusies / Summary of Findings
|
Low GRADE |
Mortality rate (crucial outcome) The effect of managing children to a specific oxygen saturation target below 94% on mortality is unclear. Source: Cunningham, 2015 |
|
No GRADE |
PICU admission (crucial outcome) No data available. |
|
Low GRADE |
Hospital readmission (crucial outcome) Managing children to an oxygen saturation target of 90% may result in no difference in hospital readmissions within 7 or 28 days of discharge as compared to managing children to an oxygen saturation target of 94%. Source: Cunningham, 2015 |
|
No GRADE |
Neurological outcome (crucial outcome) No data available. |
|
No GRADE |
ED readmission (important outcome) No data available. |
|
Low GRADE |
Length of stay / hours to discharge (important outcome) Managing children to an oxygen saturation target of 90% may reduce length of stay as compared to managing children to an oxygen saturation target of 94%. Source: Cunningham, 2015 |
Samenvatting literatuur
Description of studies
Cunningham (2015) performed a multicenter, parallel-group, double-blind RCT, comparing clinical outcomes of two oxygen saturation targets for oxygen suppletion, SpO₂ < 90% and SpO₂ < 94%. Six-hundred-fifteen infants (age 6 weeks to 12 months, corrected for prematurity), who were newly admitted to hospital after being clinically diagnosed with bronchiolitis at the ED or acute assessment area of eight pediatric hospitals in the United Kingdom, were included. Patients received supplemental oxygen if their oximeter indicated that pulse oxygen saturation was < 94%. The 308 infants in the control group were connected to a standard oximeter. The 307 infants who had been assigned to the intervention group were connected to a modified oximeter which displayed a measured value of 90% as 94%. Therefore, in the intervention group, oxygen was not given until SpO₂ < 90%. Among other outcomes, the following relevant outcomes were assessed: mortality rate, hours to actual discharge, number of infants readmitted to hospital within 7 days and within 28 days. PICU admissions were not assessed in this trial. The researchers only assessed admissions to a High Dependency Unit (HDU), a type of unit in the United Kingdom that provides more intensive care without the possibility of mechanical ventilation, a crucial difference with a PICU. Furthermore, neurological outcomes were not assessed in this trial, as the oxygen saturation of trial subjects was not considered to be sufficiently decreased to form a neurodevelopmental concern. Besides hospital readmissions, ED readmissions were not assessed in this trial.
Results
Mortality rate (crucial outcome)
Cunningham (2015) reported two deaths, both in the SpO₂ 94% target group, noting without further specification with regard to causes, that both deaths were unrelated to the study intervention. Related to the intervention or not, the absolute difference between groups in mortality rate was very small with 0.65% and the true risk ratio remains very uncertain with a 95% confidence interval ranging from a 99% lower to a 316% higher risk to die in the SpO₂ 90% target group, as compared to the SpO₂ 94% target group. See Table 1 for results per group and per outcome with risk ratios, hazard ratios and 95% confidence intervals.
PICU admission (crucial outcome)
There are no data available on PICU admission.
Hospital readmission (crucial outcome)
No clinically important between-group difference in relative risk was found in hospital readmission within 7 days (see Table 1), but with regard to hospital readmission within 28 days, infants in the SpO₂ 90% target group did seem to have a clinically important 48% lower risk of being readmitted, as compared to the SpO₂ 94% target group. However, the width of the confidence interval indicated that for the SpO₂ 90% target group, the true risk to be readmitted could also be up to 73% lower or 3% higher than the risk of the SpO₂ 94% target group (see Table 1).
Neurological outcome (crucial outcome)
There are no data available on neurological outcome.
ED readmission (important outcome)
There are no data available on ED readmissions.
Length of stay / hours to discharge (important outcome)
A clinically important difference was found in length of stay, benefitting infants in the SpO₂ 90% target group. At any given time after initial hospital admission, infants in the SpO₂ 90% target group were 28% more likely to be discharged than infants in the SpO₂ 94% target group. However, the confidence interval was wide with the likelihood of infants in the SpO₂ 90% target group being discharged as compared to infants in the SpO₂ 94% target group ranging from clinically unimportant 9% to a clinically important 50%
(see Table 1).
Table 1. Cunningham 2015, results comparing the SpO₂ 90% and SpO₂ 94% target groups on crucial and important outcomes
|
------------------- - Outcome
Group |
Mortality rate (infants) |
Hospital readmission within 7 days (infants) |
Hospital readmission within 28 days (infants) |
Length of stay (median hours to discharge (IQR)) |
|
(I) SpO₂ 90% target (n = 307) |
0 (0%) |
5 (2%) |
12 (4%) |
40.9 (21.8 to 67.3) |
|
(C) SpO₂ 94% target (n = 308) |
2 (0.65%) |
6 (2%) |
23 (7%) |
50.9 (23.1 to 93.4) |
|
Statistical test |
RR 0.20 (95% CI 0.01;4.16), p=.2992 |
RR 0.84 (95% CI 0.26;2.71), p=.7654 |
RR 0.52 (95% CI 0.27;1.03), p=.0620 |
HR 1.28 (95% CI 1.09 to 1.50), p=.003 |
SpO₂ = Pulse Oxygen Saturation, IQR = Interquartile Range, RR = Risk Ratio, HR = Hazard Ratio, CI = Confidence Interval. Intervention group (I) received supplemental oxygen at SpO₂ < 90%; Control group (C) received supplemental oxygen at SpO₂ < 94%
Level of evidence of the literature
For all reported outcomes, there were no concerns with regard to study limitations (risk of bias) or publication bias. The evidence could not be graded on / downgraded for inconsistency because there were no conflicting results per outcome: only one study was included in our analysis of the literature (i.e. there was only one result per outcome). The level of evidence started as high, because the included study was an RCT.
Mortality rate (crucial outcome)
The level of evidence regarding mortality rate was downgraded by two levels for imprecision because the optimal information size was not met due to the low event rate, and the 95% confidence interval including both the possibility of a lower and higher relative risk to die for the SpO₂ 90% target group as compared to the SpO₂ 94% target group, resulting in serious imprecision. The level of evidence was assessed as “low”.
PICU admission (crucial outcome)
No evidence was found for an effect of managing children to oxygen saturation targets below 94% on PICU admission. The level of evidence was not assessed due to lack of data.
Hospital readmission (crucial outcome)
The level of evidence regarding hospital readmission was downgraded by two levels for imprecision, because the optimal information size was not met due to the low event rate, and 95% confidence intervals including both the possibility of a lower and higher relative risk to get readmitted to hospital for the SpO₂ 90% target group as compared to the SpO₂ 94% target group, resulting in serious imprecision. The level of evidence was assessed as “low”.
Neurological outcome (crucial outcome)
No evidence was found for an effect of managing children to oxygen saturation targets below 94% on neurological outcome. The level of evidence was not assessed due to lack of data.
ED readmission (important outcome)
No evidence was found for an effect of managing children to oxygen saturation targets below 94% on ED readmission. The level of evidence was not assessed due to lack of data.
Length of stay / hours to discharge (important outcome)
The level of evidence regarding length of stay (LOS) was downgraded by two levels for imprecision because of a sample size too small to meet the optimal information size and a wide 95% confidence interval including both the possibility of a lower and practically equal LOS for the SpO₂ 90% target group as compared to the SpO₂ 94% target group. The level of evidence was assessed as “low”.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
For children with bronchiolitis in the first hours after presentation at the hospital, what is the impact on clinical outcome of using a specific oxygen saturation (SpO₂) target below 94%, i.e. to provide oxygen supplementation until the SpO₂ is at target level?
P: Children with bronchiolitis (0-3 years) in the first hours after presentation at the hospital / at the ED
I: Start supplemental oxygen at a specific saturation level below 94% (< 90%, < 92%, < 94%)
C: Start supplemental oxygen at another saturation level (≥ 94% or another specified level below 94%, higher than in the intervention group)
O: Worse clinical outcome: mortality rate, Pediatric Intensive Care Unit (PICU) admission (including need for mechanical ventilation), hospital readmission, Emergency Department (ED) readmission, worse neurological outcome, length of stay (LOS)
For the clinical outcome “mortality rate”, a minimal absolute difference of 1% between groups was considered as clinically important. For the other variables, the following cut-offs for clinically important difference were used: A Risk Ratio (RR) or a Hazard Ratio (HR) above 1.25 or below 0.8 were considered to indicate a clinically important difference between groups.
Relevant outcome measures
The guideline development group considered mortality rate, PICU admission (including need for mechanical ventilation), hospital readmission, and worse neurological outcome as the crucial outcome measures for decision making; ED readmission and LOS were considered important outcome measures for decision making.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until December 1st, 2020. The detailed search strategy is depicted under the tab Methods.
The systematic literature search resulted in 351 unique hits. Studies were selected based on the following criteria:
- Systematic review, randomized controlled trial (RCT), or comparative observational study (i.e. prospective or retrospective cohort study);
- published since the year 2000 – December 1st, 2020;
- be in line with our PICO.
Initially, six studies were selected based on title and abstract screening. After reading the full text, five studies were excluded (see the table with reasons for exclusion under the tab Methods) and one study was included.
Results
One study was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Cunningham, S., Rodriguez, A., Adams, T., Boyd, K.A., Butcher, I., Enderby, B., MacLean, M., McCormick, J., Paton, J.Y., Wee, F., Thomas, H., Riding, K., Turner, S.W., Williams, C., McIntosh, E., & Lewis, S.C. (2015). Oxygen saturation targets in infants with bronchiolitis (BIDS): a double-blind, randomized, equivalence trial. Lancet, 386(9998), 10411048.
- van Hasselt TJ, Singham B, Bassett E, Wacogne ID; Paediatric Research Across the Midlands (PRAM) Network. Oxygen saturation thresholds in bronchiolitis: examining admissions. Arch Dis Child. 2020 Dec;105(12):1197-1199.
- Stollar F, Glangetas A, Luterbacher F, Gervaix A, Barazzone-Argiroffo C, Galetto-Lacour A. Frequency, Timing, Risk Factors, and Outcomes of Desaturation in Infants With Acute Bronchiolitis and Initially Normal Oxygen Saturation. JAMA Netw Open. 2020 Dec 1;3(12):e2030905.
Evidence tabellen
Figuur 1 – De zuurstofdissociatiecurve, die het verband weergeeft tussen de zuurstofspanning in het bloed en de zuurstofsaturatie van het hemoglobine.
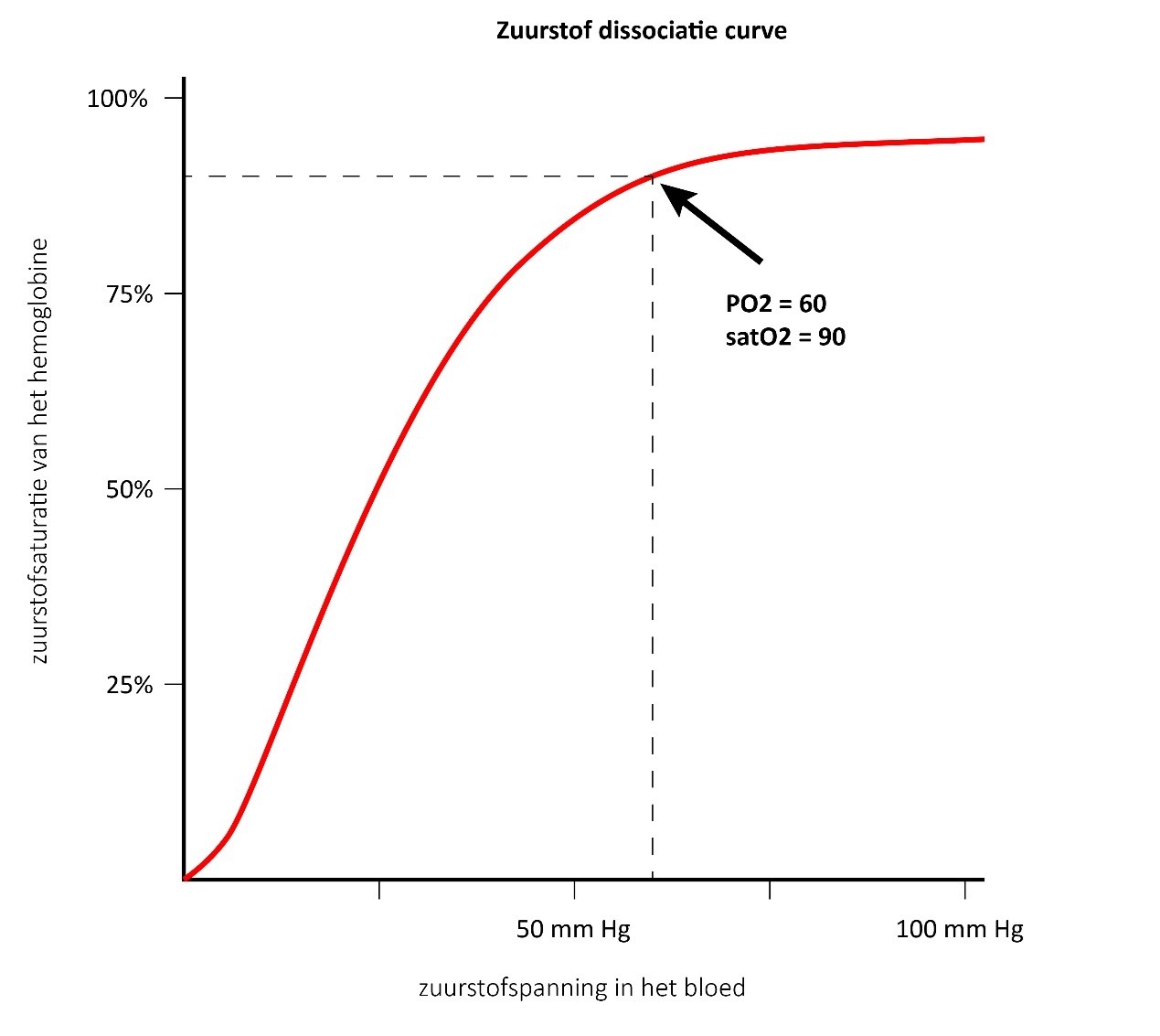
De oxyhemoglobine-dissociatiecurve beschrijft de relatie tussen de partiële zuurstofdruk in het bloed (x-as) en de zuurstofverzadiging van de hemoglobine (y-as). De affiniteit van hemoglobine voor zuurstof neemt toe naarmate meer zuurstofmoleculen binden. Er binden meer moleculen naarmate de zuurstofdruk toeneemt, totdat de maximale hoeveelheid is bereikt die kan worden gebonden. Naarmate deze limiet nadert, raakt de hemoglobine meer verzadigd met zuurstof en vindt er zeer weinig extra binding plaats, hierdoor wordt de curve vlakker. Vandaar dat de curve een sigmoïdale of S-vorm heeft. Bij drukken boven ongeveer 60 mmHg is de dissociatiecurve relatief vlak, wat betekent dat het zuurstofgehalte van de hemoglobine niet veel verandert, zelfs niet bij grote stijgingen van de zuurstofdruk.
Evidence tables
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomization |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/ unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation? (unlikely/likely/ unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/ unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Cunningham, 2015 |
|
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Van Hasselt, 2019 |
Inadequate I: level of SpO2 in the population was not a prognostic factor and SpO2 in the two groups compared was too high at 94-95% to infer anything, wrong Outcome, that didn't say anything about clinical course/worse outcomes |
|
Pruikkonen, 2014 |
Wrong PICO (all) |
|
Vincent, 2017 |
Narrative review |
|
O’Brien, 2019 |
Guideline that didn't provide extra information / studies we missed. |
|
Schuh, 2014 |
Would have answered our question, but included population does not answer our question: SpO2 in both arms is high with medians of 96 %(C) and 98 %(I), rendering their manipulation of oximeter +3% in I an inadequate I-C comparison to answer our question. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 02-08-2023
Beoordeeld op geldigheid : 28-06-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen met bronchiolitis in de tweede lijn.
Werkgroep
- Dr. C.C. (Chris) de Kruiff, kinderarts, werkzaam in het Amsterdam UMC, afgevaardigd namens NVK (voorzitter)
- Dr. T. (Tessa) Sieswerda, kinderarts, werkzaam in het Amsterdam UMC, afgevaardigd namens NVK (vice voorzitter)
- Drs. M. (Miranda) Wiggelinkhuizen, kinderarts en fellow kinderintensivist, werkzaam in het RadboudUMC Amalia kinderziekenhuis te Nijmgen, afgevaardigd namens NVK SICK
- Dr. E.M. (Marije) van den Beukel-Bakker, kinderlongarts, werkzaam in het ErasmusUMC Sophia kinderziekenhuis te Rotterdam, afgevaardigd namens NVK
- A. (Annelies) van der Kolk, verpleegkundig specialist kinderallergologie, werkzaam in het Deventer ziekenhuis, afgevaardigd namens V&VN Verpleegkundig specialisten
Klankbordgroep
- J. (Janine) Pingen, junior projectmanager en beleidsmedewerker, Stichting Kind en Ziekenhuis, afgevaardigd namens Stichting Kind en Ziekenhuis (tot 01-12-2020)
- R. (Rowy) Uitzinger, junior projectmanager en beleidsmedewerker, Stichting Kind en Ziekenhuis, afgevaardigd namens Stichting Kind en Ziekenhuis (van 01-12-2020 tot 01-06-2022)
- E.C. (Esen) Doganer, junior projectmanager en beleidsmedewerker, Stichting Kind en Ziekenhuis, afgevaardigd namens Stichting Kind en Ziekenhuis (vanaf 01-06-2022)
- M. (Maria) van ’t Erve, verpleegkundig specialist kindergeneeskunde, werkzaam bij het Isala ziekenhuis te Zwolle, afgevaardigd namens V&VN
- Dr. M.J.C. (Marjolein) Schot, huisarts, werkzaam bij Groepspraktijk d’n Iemhof te Oss, afgevaardigd namens NHG
- Drs. P.M. (Petra-Marije) Greidanus, algemeen kinderarts, werkzaam in ziekenhuis Amstelland te Amstelveen, afgevaardigd namens NVK
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst – Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. (Mattias) Göthlin, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. T. (Tim) Christen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
de Kruiff |
Functie: Kinderarts algemene pediatrie, Hoofd vakgroep algemene kindergeneeskunde, Amsterdam UMC |
Redactielid Praktische Pediatrie, waarvoor honorarium ontvangen wordt; Voorzitter NVK congres (onbetaald). |
Geen |
Geen actie |
|
Sieswerda |
Kinderarts, algemene pediatrie, AUMC Per 01-07-2020 fellow sociale pediatrie, AUMC |
Lid NVK commissie richtlijnen, onbetaald Vice-voorzitter revisie NVK richtlijn dehydratie en bronchiolitis, waarvoor vacatiegelden worden ontvangen |
Geen |
Geen actie |
|
Van den Beukel-Bakker |
Kinderlongarts in het ErasmusMC - Sophia kinderziekenhuis |
CSO visitaties voor kinderlongarts, onkostenvergoeding |
Geen |
Geen actie |
|
van der Kolk |
Verpleegkundig specialist kinderallergologie, Deventer ziekenhuis |
Lid van de stichting verpleegkundig specialisten kinderlongziekten en aanverwante aandoeningen (onbetaald). |
Studie met sponsoring van Teva Pharma |
Geen actie |
|
Wiggelinkhuizen |
Kinderarts, kinderintensivist in opleiding Radboudumc – Amalia kinderziekenhuis |
Commissielid commissie PatientVeiligheid NVK (onbetaalde functie) |
Geen |
Geen actie |
|
Klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Pingen |
Junior projectmanager en beleidsmedewerker Stichting Kind en Ziekenhuis |
Geen |
Geen |
Geen actie |
|
Uitzinger (tot 10 mei 2022) |
Junior projectmanager en beleidsmedewerker Stichting Kind en Ziekenhuis |
Geen |
Geen |
Geen actie |
|
Cingir-Doganer (vanaf 10 mei 2022) |
Junior projectmanager en beleidsmedewerker Stichting Kind en Ziekenhuis |
Geen |
Geen |
Geen actie |
|
Schot |
Praktijkhoudend huisarts |
Geen |
Geen |
Geen actie |
|
van ’t Erve |
Verpleegkundig specialist kindergeneeskunde Isala ziekenhuis Zwolle |
Geen |
Geen |
Geen actie |
|
Greidanus |
Kinderarts Ziekenhuis Amsterland |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door afgevaardigde patiëntenvereniging Stichting Kind & Ziekenhuis in de klankbordgroep. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Implementatie
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er (waarschijnlijk geen) substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Vernevelingen bij bronchiolitis |
geen financiële gevolgen |
Aantal patiënten |
|
Module Indicatie zuurstoftoediening |
geen financiële gevolgen |
Aantal patiënten |
|
Module Apneurisico |
geen financiële gevolgen |
Aantal patiënten |
|
Module Cohortverpleging bij bronchiolitis |
geen financiële gevolgen |
Aantal patiënten |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor kinderen met bronchiolitis. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule (Nederlandse Vereniging voor Kindergeneeskunde, 2011) op noodzaak tot revisie. Tevens zijn er via een enquête knelpunten aangedragen door de stakeholders in onderstaande tabel. Een verslag hiervan is opgenomen onder aanverwante producten.
|
Nederlandse Vereniging voor Kindergeneeskunde (NVK) |
|
Nederlands Huisartsen Genootschap (NHG) |
|
Verpleegkundigen & Verzorgenden Nederland (V&VN) |
|
Stichting Kind en Ziekenhuis, |
|
Inspectie Gezondheidszorg en Jeugd (IGJ) |
|
Nederlandse Vereniging van Ziekenhuizen (NVZ) |
|
Zorginstituut Nederland (ZiNL) |
|
Zelfstandige Klinieken Nederland (ZKN) |
|
Zorgverzekeraars Nederland (ZN) |
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. Doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. Doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. Doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. Doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. Doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. Doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Embase
|
No. |
Query |
Results |
|
#11 |
#8 OR #9 OR #10 |
333 |
|
#10 |
#4 AND #7 NOT (#8 OR #9) = observationeel |
103 |
|
#9 |
#4 AND #6 NOT #8 = RCT |
175 |
|
#8 |
#4 AND #5 = SR |
55 |
|
#7 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'cohort analysis'/de OR cohort*:ab,ti OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
5768288 |
|
#6 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomized controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3169446 |
|
#5 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
685636 |
|
#4 |
#1 AND #2 AND #3 AND ((english)/lim OR (dutch)/lim) AND (2000-2020)/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
488 |
|
#3 |
'oxygen saturation'/exp OR (((oxygen OR o2) NEAR/2 saturation):ti,ab,kw) OR 'oximetry'/exp |
91632 |
|
#2 |
'bronchiolitis'/exp OR bronchiolitis:ti,ab,kw |
25781 |
|
#1 |
infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR picu:ti,ab,kw OR nicu:ti,ab,kw OR 'baby'/exp OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR 'minors'/exp/mj OR minors*:ti,ab OR 'boy'/exp OR boy*:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR 'child'/exp OR child*:ti,ab OR children*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab OR 'pediatrics'/exp OR 'pediatric patient'/exp |
4086045 |
Ovid/Medline
|
# |
Searches |
Results |
|
12 |
9 or 10 or 11 |
174 |
|
11 |
(5 and 8) not (9 or 10) = observationeel |
61 |
|
10 |
(5 and 7) not 9 = RCT |
84 |
|
9 |
5 and 6 = SR |
29 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort*.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3719038 |
|
7 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2232660 |
|
6 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
488072 |
|
5 |
limit 4 to (english language and yr="2000 -Current") |
231 |
|
4 |
1 and 2 and 3 |
306 |
|
3 |
exp Oximetry/ or ((oxygen or O2) adj2 saturation).ti,ab,kf. |
40154 |
|
2 |
exp Bronchiolitis/ or bronchiolitis.ti,ab,kf. |
13734 |
|
1 |
neonates/ or premature infants/ or preterm*.ti,ab. or prematur*.ti,ab. or perinat*.ti,ab. or neonat*.ti,ab. or newborn*.ti,ab. or "new-born".ti,ab. or infant, newborn/ or picu.ti,ab. or nicu.ti,ab. or infant/ or infan*.ti,ab. or toddler*.ti,ab. or baby*.ti,ab. or babies.ti,ab. or pediatrics/ or paediat*.ti,ab. or pediat*.ti,ab. or child/ or child*.ti,ab. or kid.ti,ab. or kids.ti,ab. or boy*.ti,ab. or girl*.ti,ab,kf. or child, preschool/ or preschool*.ti,ab. |
3391789 |
