Onderhoudsbehandeling bij bronchiëctasieën
Uitgangsvraag
Wat is de waarde/positie van de onderhoudsbehandeling met antimicrobiële middelen bij patiënten met bronchiëctasieën?
De uitgangsvraag bestaat uit de volgende deelvragen:
- Wat is de effectiviteit van een onderhoudsbehandeling met orale systemische antimicrobiële middelen voor ten minste zes maanden vergeleken met reguliere zorg of placebo bij patiënten met bronchiëctasieën?
- Wat is de effectiviteit van een onderhoudsbehandeling met inhalatie antimicrobiële middelen voor ten minste zes maanden vergeleken met reguliere zorg of placebo bij patiënten met bronchiëctasieën?
Aanbeveling
Start bij patiënten met ernstige, frequente (≥2x per jaar) exacerbaties ondanks maximale conservatieve therapie van bronchiëctasieën met een orale onderhoudsbehandeling van macroliden. De werkgroep verstaat onder maximale conservatieve behandeling: verwijzing naar een fysiotherapeut voor het aanleren van sputumevacuerende technieken, inhalatie met (hypertoon) zoutoplossing, diagnostiek en behandeling van onderliggende oorzaken.
Voor de start van een onderhoudsbehandeling met een macrolide:
- maak bij patiënten met bronchiëctasieën een ECG en herhaal het ECG op indicatie na start van de behandeling. Alleen bij een normaal QTc-interval (<450 ms bij afwezigheid van ritme-beïnvloedende medicatie) kan worden gestart met behandeling. In de overige gevallen dient een cardioloog te worden geraadpleegd;
- controleer bij de start van de behandeling en bij eerste controle de leverenzymen;
- controleer van tevoren middels één sputumkweek op mycobacteriën, om aanwezigheid van NTM uit te sluiten.
Stel voor de start van behandeling samen met de patiënt de behandeldoelen vast en evalueer deze doelen (exacerbatiefrequentie dan wel klachtenpatroon) na zes maanden.
Geef bij voorkeur oraal azitromycine 250 mg per dag of 500 mg driemaal per week. Bij patiënten met persisterende ernstige klachten ondanks maximale conservatieve behandeling, behandeling met een macrolide en bewezen therapietrouw valt inhalatie-antibiotica te overwegen.
Van de andere groepen antimicrobiële middelen is alleen amoxicilline onderzocht; de werkgroep ontraadt het gebruik van andere middelen als onderhoudsbehandeling. Vooral het gebruik van fluorchinolonen (ciprofloxacin, levofloxacin, ofloxacin) is geassocieerd met het ontstaan van geneesmiddelresistentie.
Overweeg een behandelstop na een jaar indien een remissie is bereikt.
Overwegingen
Systemische antimicrobiële middelen
Macroliden lijken vanwege het antibacteriële en anti-inflammatoire werkingsprofiel bij uitstek geschikt om gebruikt te worden als antimicrobieel onderhoudsmiddel bij patiënten met frequente (≥2x/jaar) exacerbaties van bronchiëctasieën. Het effect van een onderhoudsbehandeling met een macrolide is dan ook goed onderzocht in deze patiëntenpopulatie. Op basis van vijf uit zes geïncludeerde trials was het risico op een exacerbatie 31% lager bij gebruik van antimicrobiële middelen vergeleken met placebo of reguliere zorg (RR 0,69 95%BI: 0,50 tot 0,94).
Het bijwerkingenprofiel was doorgaans mild. Het belangrijkste bezwaar is het gevaar op resistentieontwikkeling.
Macrolide antimicrobiële middelen– en dus ook azitromycine – kunnen de QTc tijd verlengen via concentratie-afhankelijke blokkade van het ‘snel activerende vertraagd corrigerende’ IKr kalium-kanaal; in vergelijking met erytromycine, claritromycine en moxifloxacine is de benodigde concentratie voor een 50% blokkade in vitro relatief hoog (Abo Salem, 2014). Een verlengde QTc tijd kan resulteren in een dodelijke ritmestoornis: Torsade de Pointes (TdP) (Abo Salem, 2014; Albert, 2014). In een groot observationeel retrospectief onderzoek hadden patiënten die een kuur van 5 dagen azitromycine kregen in vergelijking met personen die geen azitromycine maar wel amoxicilline kregen, een toegenomen risico op cardiovasculaire sterfte (HR 2,88 95%BI: 1,79 tot 4,63) en risico op overlijden door welke oorzaak ook (HR 1,85 95%BI: 1,25 tot 2,75) (Ray, 2012). Een meta-analyse waarin gegevens tot april 2015 over ritmestoornissen en cardiovasculaire sterfte in associatie met macrolide antimicrobiële middelen heeft geanalyseerd van bijna 21 miljoen behandelde personen, liet een RR 3,4 voor azitromycine zien; het RR voor claritromycine was 2,2 en van erytromycine was het RR 3,6 (Cheng, 2015). Het IKr kalium-kanaal wordt extra geblokkeerd door comedicatie (met name CYP3A4 remmers), hypokaliaemie en tevoren bestaande cardiovasculaire ziekte (Abo Salem, 2014; Albert, 2014; Mosholder, 2013). Bij patiënten met COPD en frequente exacerbaties werd azitromycine in een onderhoudsdosering van 250 mg per dag gedurende een jaar gegeven; 570 patiënten werden gerandomiseerd naar actieve behandeling, 572 patiënten kregen placebo. De sterfte in beide groepen was niet verschillend; 3% in de azitromycinegroep en 4% in de placebogroep (P=0.87). Cardiovasculaire sterfte was 0,2% in beide groepen (P=1,00) (Albert, 2011). Ook al lijkt het absolute risico op TdP bij onderhoudsmedicatie met azitromycine gering, toch beveelt de werkgroep aan om voor de start met azitromycine onderhoudsmedicatie het QTc-interval vast te leggen op een ECG en herhaal het ECG op indicatie na de start van behandeling. De werkgroep overwoog dat juist kwetsbare ouderen vaak lijden aan bronchiëctasieën, en dat in deze groep cardiovasculaire comorbiditeit en comedicatie vaak voorkomt. Bij een QT-interval >450 ms beveelt de werkgroep overleg met een cardioloog aan alvorens te starten met azitromycine onderhoudsmedicatie.
De effectgrootte van de onderhoudsbehandeling is vrij groot (>30% reductie in exacerbaties/behandeljaar) zeker bij patiënten met frequente en/of ernstige exacerbaties; als ziekenhuisopnames worden voorkomen kan potentieel veel geld bespaard worden.
Kosteneffectiviteit is niet bestudeerd, en op basis van de verzamelde gegevens is duidelijk dat verschillende scenario’s voor het indiceren van onderhoudsbehandeling moeten worden geanalyseerd. Patiënten met frequente, ernstige exacerbaties kunnen veel baat hebben bij azitromycine onderhoudsbehandeling, en kosten kunnen bespaard worden door het vermijden van ziekenhuisopnames - maar zij lopen ook meer risico op resistentieontwikkeling, wat weer excessieve kosten kan genereren met het risico op verspreiding van resistente micro-organismen.
In gepubliceerde studies zijn patiënten 6 tot 12 maanden behandeld en tot drie maanden na behandeling gevolgd. Lange termijnstudies zijn niet uitgevoerd, en lange termijn gevolgen zijn dus ook niet bestudeerd. In hoeverre onderhoudsbehandeling gedurende meerdere jaren nuttig, veilig en nodig is kan op basis van studies niet worden aangegeven.
Inhalatie antimicrobiële middelen
Er is een groot gebrek aan fase III studies die het effect van inhalatie antimicrobiële middelenonderzoeken bij bronchiëctasieën. Geen van de hier genoemde studies heeft het aantal exacerbaties als primair eindpunt genomen. Het zelfberekende risico op een exacerbatie was in de studies van Haworth (2014), Serisier (2013b) en Murray (2011), respectievelijk, potentieel 17%, 29% en 58% lager bij een behandeling met inhalatie antimicrobiële middelen vergeleken met een placebo.
Naast de beperkte verbetering in uitkomstmaten is de mate van therapietrouw ook een belangrijke factor in het behalen van succes. Uit de studie van Haworth (2014) bleek in een subgroep-analyse dat bij de patiënten die wel therapietrouw waren (43% van de patiënten in de colistine inhalatiegroep waren >90% therapietrouw) er een significant verschil was in tijd tot de eerste exacerbatie. De mediane tijd (25% kwartiel) tot exacerbatie was 168 dagen (65 dagen) in de colistine inhalatiegroep en 103 dagen (37 dagen) in de placebogroep (p=0,028).
Het gebruik van antimicrobiële middelen via inhalatie kost tijd, daarnaast dient de vernevelaar regelmatig zelf schoongemaakt te worden en kunnen bijwerkingen optreden bij de inhalatie van de antimicrobiële middelen. In de genoemde literatuur werd echter geen bewijs gevonden voor het significant frequenter optreden van bijwerkingen als hoestklachten en/of kortademigheid. Indien gebruik van antimicrobiële middelen via inhalatie wordt overwogen, is het aan te bevelen klinisch een proefverneveling uit te voeren met de voor te schrijven antimicrobiële middelen ter beoordeling van het voorkomen van bijwerkingen.
De vraag is welke patiënten in aanmerking komen voor antimicrobiële middelen via inhalatie. De British Thoracic Society richtlijnen geven aan dat patiënten met drie of meer exacerbaties in aanmerking komen voor deze vorm van behandeling. In de door ons uitgevoerde search bleek maar in één studie dat de beste resultaten met inhalatie antimicrobiële middelen bereikt werden bij patiënten die meerdere exacerbaties doormaakten in het jaar voorafgaande aan de studie (Murray, 2011). Op basis van deze beperkte gegevens kan daarom geen duidelijke conclusie getrokken worden voor de vraag wat de beste indicatie is van het starten met inhalatie antimicrobiële middelen.
Onderbouwing
Achtergrond
Patiënten met bronchiëctasieën krijgen vaak te maken met infectieuze exacerbaties waarbij zij toename van hoestklachten, gepaard met toegenomen volume en veranderd aspect van sputum (groener, taaier, soms met bloed vermengd) rapporteren. De huidige standaardbehandeling bestaat uit het uitsluitend behandelen van deze exacerbaties met antimicrobiële therapie, doorgaans gebaseerd op eerdere kweekuitslagen.
Exacerbaties gaan gepaard met toegenomen klachten van malaise, arbeidsverzuim en andere vormen van verminderde sociale participatie, en soms is ziekenhuisopname nodig voor de behandeling van deze exacerbaties om intraveneuze antimicrobiële therapie mogelijk te maken. Patiënten lijdend aan bronchiëctasieën met frequente (≥2x/jaar) exacerbaties zijn mogelijk gebaat bij antimicrobiële onderhoudsbehandeling. Onderhoudsbehandeling wordt echter niet alleen geïnitieerd door de frequentie maar ook door de ernst van exacerbaties. De vraag is of hierdoor de exacerbatiefrequentie belangrijk daalt met verbetering van hun kwaliteit van leven waaronder verstaan verbeterde maatschappelijke participatie. Hierbij moet wel rekening gehouden worden met het mogelijk optreden van belangrijke bijwerkingen van die behandeling zoals resistentieontwikkeling, ritmestoornissen, buikklachten, nierschade, gehoorschade en stoornissen in het evenwichtsorgaan.
Conclusies / Summary of Findings
1. Orale systemische antimicrobiële middelen
|
Matig GRADE |
Een onderhoudsbehandeling met een antimicrobiële middel gedurende zes tot 12 maanden verlaagt het risico op een exacerbatie vergeleken met reguliere zorg of placebo bij patiënten met bronchiëctasieën.
Bronnen (Liu, 2014; Altenburg, 2013; Serisier, 2013a; Wong, 2012; Currie, 1990) |
|
- GRADE |
Het is onduidelijk of kwaliteit van leven verbetert bij gebruik van macroliden gedurende zes tot 12 maanden vergeleken met reguliere zorg of placebo bij patiënten met bronchiëctasieën.
Bronnen (Liu, 2014; Altenburg, 2013; Serisier, 2013a; Wong, 2012) |
|
Zeer laag GRADE |
Het risico op resistentie tegen macroliden bij gebruik van macroliden gedurende zes tot 12 maanden is mogelijk verhoogd vergeleken met placebo bij patiënten met bronchiëctasieën.
Bronnen (Altenburg, 2013; Serisier, 2013a; Wong, 2012) |
2. Inhalatie antimicrobiële middelen
|
- GRADE |
Het is onduidelijk of een onderhoudsbehandeling met geïnhaleerde antimicrobiële middelen voor ten minste zes maanden resulteert in een verlaagd risico op exacerbaties bij patiënten met bronchiëctasieën.
Bronnen (Haworth, 2014; Serisier, 2013b; Murray, 2011; Drobnic, 2005) |
|
- GRADE |
Het is onduidelijk of een onderhoudsbehandeling met inhalatie antimicrobiële middelen voor ten minste zes maanden leidt tot een verbetering in kwaliteit leven bij patiënten met bronchiëctasieën.
Bronnen (Haworth, 2014; Serisier, 2013b; Murray, 2011; Drobnic, 2005) |
|
- GRADE |
Het is onduidelijk of een onderhoudsbehandeling met inhalatie antimicrobiële middelen voor ten minste zes maanden leidt tot een verhoogd risico op bronchospasme of hoestklachten bij patiënten met bronchiëctasieën.
Bronnen (Drobnic, 2005; Orriols, 1999) |
Samenvatting literatuur
1. Orale systemische antimicrobiële middelen
Beschrijving studies
Liu (2014) beoordeelde de effectiviteit van roxitromycine op luchtwegontstekingen en remodellering van de bronchus bij stabiele patiënten met bronchiëctasieën. 52 patiënten die voldeden aan de selectiecriteria, werden geïncludeerd. 26 patiënten ontvingen gedurende zes maanden oraal 150 mg roxitromycine per dag en 26 patiënten ontvingen geen medicatie. Het was onbekend of de patiënten zonder medicatie reguliere zorg kregen en of ze tijdens de studies antimicrobiële middelen ontvingen.
Altenburg (2013) ondernam een gerandomiseerd, dubbelblind, placebogecontroleerde trial naar de effectiviteit van een macrolide onderhoudsbehandeling bij volwassen patiënten met bronchiëctasieën. Ter beoordeling van klinische stabiliteit werden patiënten na randomisatie gedurende twee weken geobserveerd. Patiënten met drie of meer infectieuze exacerbaties in het afgelopen jaar kwamen in aanmerking voor inclusie. Patiënten kregen 250 mg azitromycine eenmaal daags (n=45) of een vergelijkbare placebo (n=44) voor 52 weken.
Serisier (2013a) evalueerde de klinische effectiviteit en antimicrobiële resistentie van erytromycine bij patiënten met bronchiëctasieën met een geschiedenis van frequente luchtweg exacerbaties. Patiënten met twee of meer exacerbaties van bronchiëctasieën in het afgelopen jaar waren gerekruteerd. Patiënten werden naar 400 mg erytromycine tweemaal daags (n=59) of naar een vergelijkbare placebo (n=58) gerandomiseerd gedurende 48 weken.
Wong (2012) onderzocht de hypothese dat azitromycine leidt tot een afname in frequentie van exacerbaties, een toename in longfunctie en een verbetering in kwaliteit van leven bij patiënten met bronchiëctasieën. De auteurs voerden een gerandomiseerd, dubbelblind, placebogecontroleerde trial uit. Volwassen patiënten met ten minste één exacerbatie met een behandeling van antimicrobiële middelen tot gevolg, kwamen in aanmerking. 71 patiënten kregen 500 mg azitromycine op drie dagen (maandag, woensdag, vrijdag) gedurende de week voor zes maanden. 70 patiënten kregen een vergelijkbaar placebo. Na behandeling werden patiënten nog gedurende zes maanden gevolgd.
Cymbala (2005) onderzocht of de toevoeging van azitromycine tweemaal per week gedurende zes maanden aan het bestaande behandelingsregiem bij patiënten met bronchiëctasieën het aantal exacerbaties deed verminderen en de longfunctie verbeterde vergeleken met geen toevoeging. Patiënten ouder dan 18 jaar met een klinisch diagnose bronchiëctasieën bevestigd met een hoog resolutie CT-scan werden gerekruteerd. Patiënten werden naar een toevoeging met azitromycine (500 mg tweemaal per week) gerandomiseerd of naar geen toevoeging gedurende zes maanden. Na zes maanden volgden de patiënten de andere interventie. In totaal deden 12 patiënten mee aan de cross-over trial.
Currie (1990) onderzocht de waarde van een onderhoudsbehandeling met een hoge dosering orale amoxicilline bij patiënten met bronchiëctasieën. Patiënten met bronchiëctasieën zonder allergische bronchopulmonaire aspergillose of primaire ciliaire dyskinesie kwamen in aanmerking voor deelname aan de trial. In totaal werden 38 patiënten gerekruteerd en gerandomiseerd naar tweemaal daags 3g amoxicilline (n=19) of een vergelijkbare placebo (n=19) gedurende 32 weken. Randomisatie was op het niveau van FEV1 (gemeten waarde lager dan twee standaarddeviaties of meer dan twee standaarddeviaties) en 24-uurs sputum volume (lager of gelijk aan 25 ml of meer dan 25 ml) gestratificeerd. Patiënten werden na behandeling nog voor 20 weken gevolgd.
Resultaten
Exacerbaties
Bij vijf van de zes geïncludeerde trials hebben de onderzoekers het aantal patiënten gerapporteerd dat na het starten met behandeling een exacerbatie kreeg. In totaal kregen van 220 patiënten die een antimicrobieel middel kregen 109 (50%) een exacerbatie. Onder groep die een placebo of geen behandeling kregen, hadden uit 217 patiënten 155 (71%) een exacerbatie. Het risico op een exacerbatie is 31% lager bij gebruik van een antimicrobieel middel vergeleken met placebo of geen behandeling (RR 0,69 95%BI: 0,60 tot 0,81).
Figuur 1 Meta-analyse uitkomst: het aantal exacerbaties
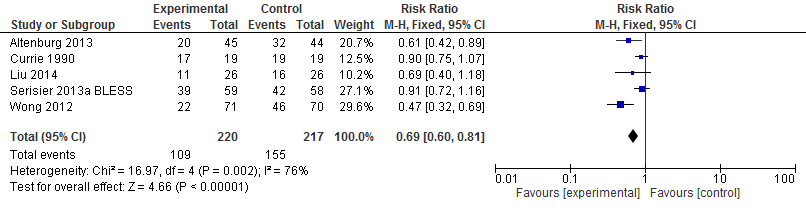
Kwaliteit van leven
Vier uit zes trials hebben kwaliteit van leven aan de hand van de St George’s Respiratory Questionnaire beoordeeld. Vanwege de wijze waarop de resultaten waren gerapporteerd was het niet mogelijk om de resultaten te poolen, maar zijn hieronder kort beschreven.
Liu (2014) observeerde een gemiddelde score van St George’s Respiratory Questionnaire van 42,7 (SD 13,5) onder patiënten die roxitromycine kregen vergeleken met 55,4 (SD 15,0) onder patiënten die placebo ontvingen. De score van St George’s Respiratory Questionnaire nam 12,70 meer af bij gebruik van roxitromycine vergeleken met placebo (MD -12,70 95%BI: -21,24 tot -4,16).
Altenburg (2013) heeft kwaliteit van leven met de St George’s Respiratory Questionnaire op baseline, na zes en twaalf maanden geëvalueerd. Als resultaat werd gerapporteerd dat de score met 6,09 punten per zes maanden afneemt bij gebruik van azitromycine vergeleken met 2,06 punten afname bij gebruik van een placebo.
Serisier (2013a) heeft de verandering in kwaliteit van leven, gemeten met de St George’s Respiratory Questionnaire, gerapporteerd. Het is echter niet te herleiden of dit direct na het stoppen van behandeling is gemeten of aan het eind van follow-up vier weken na het stoppen van behandeling. Patiënten in de interventiegroep rapporteerden een gemiddelde afname van 3,9 (SD 10) vergeleken met een afname van 1,3 (SD 14,5) bij patiënten in de controlegroep. Kwaliteit van leven verbeterde met een afname van 2,60 (95%BI: -1,92 tot 7,12) in het voordeel van erytromycine.
Wong (2012) heeft kwaliteit van leven direct na het stoppen van behandeling geëvalueerd en aan het eind van follow-up zes maanden na het stoppen van behandeling. Het gemiddelde verschil in verandering ten opzichte van baseline was -3,25 (95%BI -7,21 tot 0,72) direct na het stoppen van behandeling in het voordeel van azitromycine. Aan het eind van follow-up was het gemiddelde verschil tussen interventie- en controlegroep 1,82 (95%BI -0,27 tot 6,32).
Resistentie
Altenburg (2013) testte vanaf baseline bij ieder vervolgbezoek op resistentie tegen macrolide onder de gekweekte luchtwegpathogenen. Gedurende de behandeling met azitromycine bleken 53 van de 60 (88%) geteste pathogenen in het sputum van 20 patiënten resistent te zijn vergeleken met 29 uit 112 (26%) pathogenen bij 22 patiënten die een placebo kregen.
Serisier (2013a) heeft de resistentie van commensaal aanwezige orofaryngeale streptokokken tegen macroliden getest. Erytromycine resulteerde in een stijging van het aantal streptokokken resistent tegen macrolide ten opzichte van baseline (mediaan verschil 28%, IQR: 0 tot 41) vergeleken met geen verandering bij gebruik van een placebo (mediaan verschil 0%, IQR: -2 tot 2).
Wong (2012) heeft data over het risico op resistentie tegen antimicrobiële middelentijdens gebruik gerapporteerd. Onder 46 patiënten die azitromycine kregen, ontwikkelden twee patiënten resistentie gedurende de studie in vergelijking met nul uit 45 patiënten die een placebo kregen. Echter, Wong, 2012 testte niet routinematig voor resistentie tegen macroliden.
Bewijskracht van de literatuur
Exacerbaties
De bewijskracht voor de uitkomstmaat aantal patiënten met exacerbaties is met één niveau verlaagd gezien tegenstrijdige resultaten (inconsistentie).
Kwaliteit van leven
De bewijskracht voor de uitkomstmaat kwaliteit van leven is niet gegradeerd gezien de wijze waarop de resultaten waren gerapporteerd en het niet kunnen poolen van de resultaten.
Resistentie
De bewijskracht voor de uitkomstmaat resistentie tegen macroliden is met drie niveaus verlaagd gezien extrapoleerbaarheid (bias ten gevolge van indirectheid: één trial heeft maar onder een deel van patiënten bacteriën in sputum gekweekt en getest en één trial heeft resistentie uitgedrukt als het voorkomen onder patiënten en niet zozeer onder geïsoleerde potentiele bacteriële pathogenen) en het geringe aantal pathogenen/patiënten (imprecisie).
2. Inhalatie antimicrobiële middelen
Beschrijving studies
Haworth (2014) voerde een gerandomiseerde, placebogecontroleerde trial uit naar de effectiviteit en veiligheid van geïnhaleerde colistine bij patiënten met bronchiëctasieën en een chronische P. aeruginosa infectie. Patiënten met bronchiëctasieën en een chronisch P. aeruginosa infectie die een 21 dagen durende kuur voor een exacerbatie kregen, kwamen in aanmerking voor inclusie. In totaal werden 144 patiënten geïncludeerd en gerandomiseerd naar tweemaal daags een miljoen internationale units van colistine (n=73) of naar placebo (n=71) toegediend via een vernevelaar. Als placebo kregen patiënten een zoutoplossing van 0,45%. De duur van behandeling was zes maanden. Deze trial werd door de industrie gesponsord en heeft vermeld dat een extern bedrijf de statistische analyse heeft uitgevoerd. Het is onbekend wat de rol van de sponsor was bij deze trial. De primaire uitkomst in deze trial was tijd tot een exacerbatie.
Serisier (2013b) evalueerde de microbiologische effectiviteit van een behandeling met geïnhaleerde duale afgifte van ciprofloxacine. Klinisch stabiele patiënten met bronchiëctasieën bevestigd met CT werden gescreend voor inclusie. In totaal werden 42 patiënten geïncludeerd en gerandomiseerd naar geïnhaleerde ciprofloxacine (n=20) of naar een vergelijkbare placebo (n=22). Ciprofloxacine werd in een dosering van eenmaal daags 150 mg liposomen in 3 mL en 60 mg vrij ciprofloxacine in een vernevelaar gegeven voor 28 dagen. Patiënten volgden een totaalaantal van drie behandelingscycli, bestaande uit 28 dagen behandeling gevolgd door 28 dagen geen behandeling. Patiënten in de controlegroep kregen controle liposomen in een dosering van 15 mg in 3 mL en een zoutoplossing van 0,9%. In totaal duurde de trial 168 dagen (de totale duur van drie behandelingscycli). De trial werd door de industrie gesponsord en een aantal auteurs waren ook in dienst bij de sponsor. Verandering in bacteriële dichtheid van P. aeruginosa in het sputum was de primaire uitkomst.
Murray (2011) ondernam een gerandomiseerde en gecontroleerde trial naar de effectiviteit van vernevelde gentamicine bij patiënten met bronchiëctasieën. 65 patiënten werden naar tweemaal daags vernevelde gentamicine (80 mg) (n=32) of vernevelde zoutoplossing (0,9%) (n=33) gerandomiseerd. De duur van behandeling betrof 12 maanden. Patiënten werden geselecteerd op hun vermogen om vernevelde gentamicine te tolereren. Dit werd mede beoordeeld op de afwezigheid van bronchospasme na het geven van vernevelde gentamicine. Er heeft dus selectie plaats gevonden op een van de benoemde uitkomstmaten en hiermee wordt een associatie tussen de interventie en deze uitkomst geïntroduceerd. Daarom worden de resultaten van deze uitkomstmaat niet meegenomen. Een afname in bacteriële dichtheid was de primaire uitkomst.
Drobnic (2005) bepaalde of direct vernevelde toediening van tobramycine leidde tot een betere controle van infecties en of het leidde tot een lage systemische toxiciteit. Auteurs hebben een dubbel geblindeerde cross-over trial uitgevoerd. 30 patiënten werden gerandomiseerd naar vernevelde tobramycine (300 mg) tweemaal daags of naar een vernevelde zoutoplossing (0,9%) voor zes maanden. Na één maand washout-periode kregen patiënten de andere behandeling. Voordat patiënten werden gerandomiseerd, werden alle patiënten opgenomen voor een twee weken durende IV-behandeling van ceftazidime (100 mg per kg per dag) en tobramycine (4 mg per kg per dag). De volgende uitkomsten waren genoemd als primaire uitkomsten: aantal exacerbaties, het aantal en duur van ziekenhuisopname.
Orriols (1999) onderzocht het langetermijneffect en veiligheid van een behandeling met vernevelde antimicrobiële middelen bij patiënten met bronchiëctasieën en een chronische infectie van P. aeruginosa. Alleen patiënten bij wie een standaard intraveneuze en orale behandeling voor lange termijncontrole van een infectie had gefaald, werden geïncludeerd. Alle patiënten werden eerst opgenomen voor een twee weken durende IV-behandeling van ceftazidime (100 mg per kg per dag) en tobramycine (4 mg per kg per dag). Vervolgens werden patiënten gerandomiseerd naar tweemaal daags verneveld ceftazidime (1000 mg per 12 uur) en tobramycine (100 mg per 12 uur) of naar een symptomatische behandeling voor twaalf maanden. Behandeling van symptomen bestond uit zuurstof, bronchusverwijders en corticosteroïden. De auteurs maakten geen onderscheid in primaire en secundaire uitkomsten.
Resultaten
Exacerbaties
Haworth (2014) rapporteerde dat gedurende de studie 36 (49%) patiënten uit de interventiegroep een exacerbatie kregen vergeleken met 42 (59%) patiënten uit de placebogroep. Het door ons berekende risico op een exacerbatie was potentieel 17% lager bij gebruik van vernevelde colistine vergeleken met een zoutoplossing (RR 0,83 95%BI 0,62 tot 1,12).
Serisier (2013b) observeerde dat gedurende de studieperiode (168 dagen) 11 (55%) patiënten uit de ciprofloxacinegroep een exacerbatie kregen, vergeleken met 17 (77%) patiënten uit de controlegroep. Het door ons berekende risico op een exacerbatie was potentieel 29% lager bij een behandeling met ciprofloxacine vergeleken met een placebo (RR 0,71 95%BI: 0,45 tot 1,12).
Murray (2011) observeerde dat 33% van patiënten in de interventiegroep een exacerbatie ontwikkelden gedurende de 12 maanden van behandeling vergeleken met 80% van de patiënten in de controlegroep. In het artikel werden geen aantallen patiënten met een exacerbatie benoemd. Met behulp van het gegeven percentage en het aantal patiënten in de interventie- en controlegroep is het aantal patiënten met een exacerbaties berekend en gebruikt voor het berekenen van de risk ratio. De kans op een exacerbatie was 58% lager bij gebruik van vernevelde gentamicine vergeleken met een vernevelde zoutoplossing (RR 0,42 95%BI 0,24 tot 0,73).
Drobnic (2005) rapporteerde alleen het gemiddelde aantal exacerbaties. Ten tijde van een behandeling met tobramycine kregen patiënten gemiddeld 0,9 exacerbaties vergeleken met 1,3 exacerbaties bij een behandeling met een zoutoplossing (p=0,330). Gezien het cross-over design van de studie is het niet mogelijk een gemiddeld verschil met betrouwbaarheidsinterval te berekenen.
Orriols (1999) rapporteerde geen data over het aantal exacerbaties.
Kwaliteit van leven
Haworth (2014) evalueerde kwaliteit van leven aan de hand van de St George’s Respiratory Questionnaire na 12 weken en na 26 weken. In de interventiegroep was de gemiddelde verandering ten opzichte van baseline na 12 weken -2,8 (SD 14,5) en in de controlegroep -2,2 (SD 10,5). Het gemiddelde verschil tussen de interventiegroep en controlegroep was -1,09 (95%BI -5,18 tot 2,99). Met andere woorden, na 12 weken was er geen verschil in kwaliteit van leven tussen de interventie- en controlegroep. Na 26 weken was de gemiddelde verandering ten opzichte van baseline in de interventiegroep -10,4 (SD 19,6) en in de controlegroep -0,4 (SD 13,2). Het gemiddelde verschil tussen interventie en controle was -10,51 (95%BI -17,87 tot -3,14). Na 26 weken was er een klinische relevante verbetering in kwaliteit van leven in het voordeel van vernevelde colistine.
Serisier (2013b) heeft alleen kwaliteit van leven met de St George Respiratory Questionnaire gemeten na de eerste 28 dagen. In de interventiegroep nam de totale score af met 1,3 (SD 7,16) en in de controlegroep met 6,4 (SD 9.8). Het zelfberekende gemiddelde verschil in totale score was 5,1 (95%BI: -0,3 tot 10,5). Met andere woorden: de patiënten uit de controlegroep hadden een klinisch relevante verbetering in kwaliteit van leven vergeleken met patiënten uit de interventiegroep.
Murray (2011) beoordeelde kwaliteit van leven met de St George’s Respiratory Questionnaire. Voor het beoordelen van het effect van de interventie werd gebruik gemaakt van een klinisch relevant verschil, gedefinieerd door Jones, 2002, van een afname van 4 of meer punten. Vervolgens werd op verschillende tijdsmomenten (na 3, 6, 9, 12 en 15 maanden) het percentage patiënten gerapporteerd die een afname van ten minste 4 punten rapporteerden. Op elk tijdsmoment lag het percentage hoger in de interventiegroep dan in de controlegroep (p>0,05). Met andere woorden, meer patiënten die vernevelde gentamicine kregen, rapporteerden een klinisch relevante verbetering in kwaliteit van leven dan patiënten die een vernevelde zoutoplossing kregen. Ook Drobnic (2005) heeft bij patiënten de St George’s Respiratory Questionnaire afgenomen ter beoordeling van kwaliteit van leven. Na de interventie behandeling van zes maanden was de gemiddelde verandering ten opzichte van het begin van behandeling -0,90 (SD 3,93) en bij placebo -0,83 (SD 6,89) (p=0,97). Het was niet mogelijk om met de gerapporteerde getallen een gemiddeld verschil met betrouwbaarheidsinterval te berekenen vanwege het cross-over design.
Orriols (1999) rapporteerde geen data over kwaliteit van leven.
Bronchospasme
Haworth, 2014 rapporteerde alleen gegevens over een bronchospasme na het geven van de eerste dosering. Vijf patiënten uit de interventiegroep kregen een bronchospasme binnen 30 minuten na toediening van colistine vergeleken met één patiënt uit de placebogroep. Bij deze patiënten werd de behandeling niet voortgezet. Het is onduidelijk of deze resultaten geëxtrapoleerd kunnen worden voor de gehele behandeling.
Data van Murray (2011) over bronchospasme kon niet worden geïnterpreteerd vanwege de eerder benoemde reden.
Serisier (2013b) rapporteerde geen gegevens over bronchospasme.
Drobnic (2005) observeerde dat drie patiënten (10%) ten tijde van een behandeling met tobramycine een bronchospasme ontwikkelden. Geen enkele patiënt kreeg een bronchospasme gedurende een behandeling met een zoutoplossing. Er was verder geen statistische analyse uitgevoerd voor het evalueren van het verschil in het risico op een bronchospasme tussen een behandeling met vernevelde tobramycine en een zoutoplossing van 0,9%.
Orriols (1999) rapporteerde dat één (13%) patiënt uit de interventiegroep een bronchospasme ontwikkelde vergeleken met geen patiënt uit de controlegroep. Er was verder geen statistische analyse uitgevoerd voor het evalueren van het verschil in het risico op een bronchospasme tussen een behandeling met vernevelde ceftazidime en tobramycine en een zoutoplossing van 0,9%.
Hoestklachten
Haworth (2014), Serisier (2013b), Murray (2011), Drobnic (2005) en Orriols (1999) rapporteerden geen gegevens over hoestklachten.
Bewijskracht van de literatuur
Exacerbaties
Vanwege het verschil in duur van behandeling en toedieningswijze is het niet mogelijk om de bewijskracht te graderen over het effect van een onderhoudsbehandeling met inhalatie antimicrobiële middelen op exacerbaties.
Kwaliteit van leven
Vanwege het verschil in duur van behandeling en toedieningswijze is het niet mogelijk om de bewijskracht te graderen over het effect van een onderhoudsbehandeling met inhalatie antimicrobiële middelen op kwaliteit van leven.
Bronchospasme of hoestklachten
Vanwege het ontbreken van effectschatters is het niet mogelijk om een conclusie te formuleren of de bewijskracht te graderen over het effect van een onderhoudsbehandeling met inhalatie antimicrobiële middelen op bronchospasme of hoestklachten bij patiënten met bronchiëctasieën.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende twee zoekvragen:
1. Wat is de effectiviteit van een onderhoudsbehandeling met orale systemische antimicrobiële middelen voor ten minste zes maanden vergeleken met reguliere zorg of placebo bij patiënten met bronchiëctasieën?
P: patiënten met bronchiëctasieën van een bepaalde ernst;
I: onderhoudsbehandeling met orale systemische antimicrobiële middelen (i.e. macroliden) voor ten minste zes maanden;
C: reguliere zorg/ alleen orale systemische antimicrobiële middelen bij exacerbaties;
O: aantal exacerbaties/ kwaliteit van leven/ complicaties (resistentie, ritmestoornissen, secundaire infecties, leverfunctiestoornissen, doofheid, bronchospasme, hoestklachten).
2. Wat is de effectiviteit van een onderhoudsbehandeling met inhalatie antimicrobiële middelen voor ten minste zes maanden vergeleken met reguliere zorg of placebo bij patiënten met bronchiëctasieën?
P: patiënten met bronchiëctasieën van een bepaalde ernst;
I: onderhoudsbehandeling met inhalatie antimicrobiële middelen voor ten minste zes maanden;
C: reguliere zorg/ alleen orale systemische antimicrobiële middelen bij exacerbaties;
O: aantal exacerbaties/ kwaliteit van leven/ complicaties (resistentie, ritmestoornissen, secundaire infecties, leverfunctiestoornissen, doofheid, bronchospasme, hoestklachten).
Relevante uitkomstmaten
De werkgroep achtte verminderde exacerbatiefrequentie, en verbeterde kwaliteit van leven voor de besluitvorming kritieke uitkomstmaten; evenals het bijwerkingenprofiel met daaronder begrepen, het optreden van belangrijke resistentieontwikkeling, en van andere bijwerkingen van de antimicrobiële onderhoudstherapie, zoals ritmestoornissen, buikklachten, nierschade, gehoorschade en stoornis in het evenwichtsorgaan voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Klinisch relevant verschil
Aantal exacerbaties
De werkgroep definieerde een reductie van >50% in exacerbatiefrequentie als een klinisch (patiënt) relevant verschil.
Kwaliteit van leven
De werkgroep definieerde een afname van 4 punten of meer als een klinisch relevant verschil gemeten met de St George’s Respiratory Questionnaire (Jones, 2002).
Bijwerkingen
De werkgroep definieerde een graad 3 tot 4 nier-, gehoor- of evenwichtsstoornissen of buikklachten die leiden tot stoppen van behandeling bij >10% van studieparticipanten/ patiënten als een klinisch (patiënt) relevant verschil. Aangezien er niet gekozen is voor een bepaalde definitie van resistentieontwikkeling maar de definities in de studies te hanteren, is het niet mogelijk om een klinisch relevant verschil te benoemen.
De gradering van de ernst van bijwerkingen volgt de indeling zoals voorgesteld door de Amerikaanse National Institute of Health Common Terminology Criteria for Adverse Events (CTCAE) Version 4.0, gepubliceerd op 28-5-2009 (v4.03: 14 juni 2010). Graad 1 tot 2 bijwerkingen zijn milde en matige bijwerkingen; graad 3 ernstige, niet levensbedreigende effecten die het dagelijks leven beïnvloeden; graad 4 ernstige, levensbedreigende effecten die medisch ingrijpen noodzakelijk maken en graad 5 overlijden.
1. Orale systemische antimicrobiële middelen
Zoeken en selecteren (Methode)
In de databases Medline (OVID) en Embase is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd, gecontroleerde trials. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 413 treffers op. Reviews werden geselecteerd op grond van de volgende selectiecriteria: systematische zoekactie in tenminste twee databases met een beschikbare gedetailleerde zoekstrategie, evidencetabellen en risk of bias beoordeling van RCT’s van patiënten met bronchiëctasieën die een onderhoudsbehandeling met systemische antimicrobiële middelen voor ten minste zes maanden kregen vergeleken met reguliere zorg of placebo. RCT’s werden geselecteerd op grond van de volgende selectiecriteria: patiënten met bronchiëctasieën, een onderhoudsbehandeling met systemische antimicrobiële middelen voor ten minste zes maanden en vergeleken met reguliere zorg of placebo. Op basis van titel en abstract werden in eerste instantie 13 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 11 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en twee studies definitief geselecteerd. Een systematische review en een RCT gepubliceerd na de systematische review kwamen in aanmerking. De systematische review (Hnin, 2015) includeerden RCT’s met als interventie antimicrobiële middelen voor ten minste vier weken, ongeacht of dit orale of inhalatie antimicrobiële middelen betrof. Voor de uitwerking van de deelvraag werden alleen RCT’s beschreven die als interventie orale antimicrobiële middelen voor ten minste zes maanden onderzochten. Vijf RCT’s uit de review van Hnin, 2015 en één additioneel geïncludeerde RCT (Liu, 2014) werden vervolgens beschreven.
(Resultaten)
Zes onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
2. Inhalatie antimicrobiële middelen
Zoeken en selecteren (Methode)
In de databases Medline (OVID) en Embase is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd gecontroleerde trials. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 115 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews (met gedetailleerde zoekstrategie, risk of bias beoordeling en evidence-tabellen) en gerandomiseerd gecontroleerde trials van inhalatie antimicrobiële middelen (ten minste behandeld voor zes maanden) vergeleken met reguliere zorg of placebo bij patiënten met bronchiëctasieën. Op basis van titel en abstract werden in eerste instantie 28 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 23 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vijf studies definitief geselecteerd.
(Resultaten)
Vijf onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Abo-Salem E, Fowler JC, Attari M, et al. Antibiotic-induced cardiac arrhythmias. Cardiovasc Ther. 2014;32(1):19-25. doi: 10.1111/1755-5922.12054. Review. PubMed PMID: 24428853.
- Albert RK, Connett J, Bailey WC, et al. Azithromycin for prevention of exacerbations of COPD. N Engl J Med. 2011;365(8):689-98. doi: 10.1056/NEJMoa1104623. Erratum in: N Engl J Med. 2012;366(14):1356. PubMed PMID: 21864166; PubMed Central PMCID: PMC3220999.
- Albert RK, Schuller JL; COPD Clinical Research Network. Macrolide antibiotics and the risk of cardiac arrhythmias. Am J Respir Crit Care Med. 2014;189(10):1173-80. doi: 10.1164/rccm.201402-0385CI. Review. PubMed PMID: 24707986; PubMed Central PMCID: PMC4061901.
- Altenburg J, de Graaff CS, Stienstra Y, et al. Effect of azithromycin maintenance treatment on infectious exacerbations among patients with non-cystic fibrosis bronchiectasis: the BAT randomized controlled trial. JAMA. 2013;309(12):1251-9. doi: 10.1001/jama.2013.1937. PubMed PMID: 23532241.
- Cheng YJ, Nie XY, Chen XM, et al. The Role of Macrolide Antibiotics in Increasing Cardiovascular Risk. J Am Coll Cardiol. 2015;66(20):2173-84. doi: 10.1016/j.jacc.2015.09.029. PubMed PMID: 26564594.
- Currie DC, Garbett ND, Chan KL, et al. Double-blind randomized study of prolonged higher-dose oral amoxycillin in purulent bronchiectasis. Q J Med. 1990;76(280):799-816. PubMed PMID: 2217684.
- Cymbala AA, Edmonds LC, Bauer MA, et al. The disease-modifying effects of twice-weekly oral azithromycin in patients with bronchiectasis. Treat Respir Med. 2005;4(2):117-22. PubMed PMID: 15813663.
- Drobnic ME, Suñé P, Montoro JB, et al. Inhaled tobramycin in non-cystic fibrosis patients with bronchiectasis and chronic bronchial infection with Pseudomonas aeruginosa. Ann Pharmacother. 2005;39(1):39-44. Epub 2004 Nov 23. PubMed PMID: 15562142.
- Haworth CS, Foweraker JE, Wilkinson P, et al. Inhaled colistin in patients with bronchiectasis and chronic Pseudomonas aeruginosa infection. Am J Respir Crit Care Med. 2014;189(8):975-82. doi: 10.1164/rccm.201312-2208OC. PubMed PMID: 24625200; PubMed Central PMCID: PMC4098097.
- Hnin K, Nguyen C, Carson KV, et alBJ. Prolonged antibiotics for non-cystic fibrosis bronchiectasis in children and adults. Cochrane Database Syst Rev. 2015;(8):CD001392. doi: 10.1002/14651858.CD001392.pub3. Review. PubMed PMID: 26270620.
- Jones PW. Interpreting thresholds for a clinically significant change in health status in asthma and COPD. Eur Respir J. 2002;19(3):398-404. Review. PubMed PMID: 11936514.
- Liu J, Zhong X, He Z, et al. Effect of low-dose, long-term roxithromycin on airway inflammation and remodeling of stable noncystic fibrosis bronchiectasis. Mediators Inflamm. 2014;2014:708608. doi: 10.1155/2014/708608. Epub 2014 Nov 4. PubMed PMID: 25580060; PubMed Central PMCID: PMC4235134.
- Mosholder AD, Mathew J, Alexander JJ, et al. Cardiovascular risks with azithromycin and other antibacterial drugs. N Engl J Med. 2013;368(18):1665-8. doi: 10.1056/NEJMp1302726. PubMed PMID: 23635046.
- Murray MP, Govan JR, Doherty CJ, et al. A randomized controlled trial of nebulized gentamicin in non-cystic fibrosis bronchiectasis. Am J Respir Crit Care Med. 2011;183(4):491-9. doi: 10.1164/rccm.201005-0756OC. Epub 2010 Sep 24. PubMed PMID: 20870753.
- Orriols R, Roig J, Ferrer J, et al. Inhaled antibiotic therapy in non-cystic fibrosis patients with bronchiectasis and chronic bronchial infection by Pseudomonas aeruginosa. Respir Med. 1999;93(7):476-80. PubMed PMID: 10464834.
- Ray WA, Murray KT, Hall K, et al. Azithromycin and the risk of cardiovascular death. N Engl J Med. 2012;366(20):1881-90. doi: 10.1056/NEJMoa1003833. PubMed PMID: 22591294; PubMed Central PMCID: PMC3374857.
- Serisier DJ, Bilton D, De Soyza A, et al. Inhaled, dual release liposomal ciprofloxacin in non-cystic fibrosis bronchiectasis (ORBIT-2): a randomised, double-blind, placebo-controlled trial. Thorax. 2013b;68(9):812-7. doi: 10.1136/thoraxjnl-2013-203207. Epub 2013 May 16. PubMed PMID: 23681906; PubMed Central PMCID: PMC4770250.
- Serisier DJ, Martin ML, McGuckin MA, et al. Effect of long-term, low-dose erythromycin on pulmonary exacerbations among patients with non-cystic fibrosis bronchiectasis: the BLESS randomized controlled trial. JAMA. 2013a;309(12):1260-7. doi: 10.1001/jama.2013.2290. PubMed PMID: 23532242.
- Wong C, Jayaram L, Karalus N, et al. Azithromycin for prevention of exacerbations in non-cystic fibrosis bronchiectasis (EMBRACE): a randomised, double-blind, placebo-controlled trial. Lancet. 2012;380(9842):660-7. doi: 10.1016/S0140-6736(12)60953-2. PubMed PMID: 22901887.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Oral antibiotics |
|||||||
|
Liu, 2014 |
Type of study: RT [parallel]
Setting: Patients hospitalized at a Medical University hospital
Country: China
Source of funding: Non-commercial (the Special foundation for Chronic Respiratory Disease of Chinese Medical Association and Youth Science Fund of Guangxi Zhuang Autonomous Region) |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 26 Control: 26
Important prognostic factors2: Age ± SD: I: 47 (8) C: 49 (9)
Sex: I: 50% M C: 57% M
Baseline FEV (mean FEV1 L (SD)): I: 1.59 (0.37) C: 1.63 (0.42)
Baseline FEV (mean predicted FEV1 % (SD)): I: 67% (12) C: 67% (11)
Baseline exacerbations: Not reported
Groups comparable at baseline? Yes |
Oral roxithromycin (150 mg) daily for six months
|
No drug treatment
|
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: N=4 (15%) Reasons: 1 allergic to roxithromycin, 1 worsening of symptoms, 2 unknown
Control: N=5 (19%) Reasons: 3 worsening of symptoms, 2 unknown
Incomplete outcome data: Intervention: N=4 (15%) Reasons: 1 allergic to roxithromycin, 1 worsening of symptoms, 2 unknown
Control: N=5 (19%) Reasons: 3 worsening of symptoms, 2 unknown
|
1. Exacerbations Number of patients with exacerbation
I: 50% (->11 patients) C: 76.2% (->16 patients) RR 0.69 (95% 0.40-1.18)
2. Quality of life Measured with St George Respiratory questionnaire, mean (SD)
Baseline I: 56.7 (14.8) C: 58.3 (15.4) 6 months I: 42.7 (13.5) C: 55.4 (15.0) MD -12.70 (95%CI: -21.24 to -4.16)
3. Complications Data on resistance, arrhythmias, secondary infections, liver function disorders or deafness was not reported
|
|
|
Altenburg, 2013 |
Type of study: RCT
Setting: Outpatient
Country: The Netherlands
Source of funding: Industry sponsored |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 45 Control: 44
Important prognostic factors2:
Age ± SD: I: 59 (12) C: 64 (9)
Sex: I: 42% M C: 30% M
Baseline FEV (mean FEV1 L (SD)): Not reported
Baseline FEV (mean predicted FEV1 % (SD)): I: 24.4% C: 27.2%
Baseline exacerbations: I: 4 (3-9) C: 5.0 (3-12)
Groups comparable at baseline? Yes |
Azithromycin (250 mg) daily for 52 weeks
|
Placebo
|
Length of follow-up: 90 days after treatment
Loss-to-follow-up: Intervention: N = 3 (7%) Reasons: 1 exacerbation during run-in; 1 withdrew consent; 1 adverse effect
Control: N = 5 (11%) Reasons: 1 diagnosed with CVID; 1 exacerbation during run-in; 1 more than three exacerbations; 1 withdrew consent
Incomplete outcome data: Intervention: N = 3 (7%) Reasons: 1 exacerbation during run-in; 1 withdrew consent; 1 adverse effect
Control: N = 5 (11%) Reasons: 1 diagnosed with CVID; 1 exacerbation during run-in; 1 more than three exacerbations; 1 withdrew consent
|
1.Exacerbations Measured as frequency, mean (SD)
I: 0.84 (1.1) C: 2.05 (1.6) SMD -0.88 (95%CI: -1.33 to -0.43)
Measured as number of patients with at least 1 exacerbation
I: 20 (44%) C: 32 (73%) RR 0.61 (95%CI: 0.42 to 1.16)
2. Quality of life Measured with St George Respiratory questionnaire, change from baseline per 6 months, mean (SD)
I: -6.09 (13) C: -2.06 (9.3) MD -4.03 (95%CI: -8.87 to 0.81)
3. Complications Antibiotic resistance Measured at baseline and every follow-up visit
I: 53 out of 60 pathogens (88%) among 20 patients C: 29 out of 112 pathogens (26%) among 22 patients
Data on arrhythmias, secondary infections, liver function disorders or deafness was not reported
|
|
|
Serisier, 2013 |
Type of study: RCT
Setting: Clinics and homes
Country: Australia
Source of funding: Non-commercial |
Exclusion criteria:
N total at baseline: Intervention: 59 Control:58
Important prognostic factors2: Age ± SD: I: 61 (11) C: 63 (10)
Sex: I: 39% M C: 43% M
Baseline FEV (mean FEV1 L (SD)): I: 1.82 (0.65) C: 1.83 (0.77)
Baseline FEV (mean predicted FEV1 % (SD)): I: 66.9% (17.2) C: 70.1% (20.3)
Baseline exacerbations (>5/y): I: 22 (37%) C: 20 (35%)
Groups comparable at baseline? Yes
|
Oral erythromycin (400 mg) twice daily for 48 weeks
|
Matching placebo
|
Length of follow-up: 4 weeks after treatment
Loss-to-follow-up: Intervention: N = 5 (8%) Reasons: 2 lost; 1 QTc prolongation; 1 moved; 1 unable to continue
Control: N = 5 (9%) Reasons: 2 lost; 1 nausea; 1 withdrawn by physician; 1 unable to continue
Incomplete outcome data: Intervention: N = 5 (8%) Reasons: 2 lost; 1 QTc prolongation; 1 moved; 1 unable to continue
Control: N = 5 (9%) Reasons: 2 lost; 1 nausea; 1 withdrawn by physician; 1 unable to continue
|
1.Exacerbations Measured as frequency, mean (SD)
I: 1.29 (1.38) C: 1.97 (1.98) SMD -0.40 (95%CI: -0.76 to -0.03)
Measured as the number of patients with an exacerbation
I: 39 (66%) C: 42 (72%) RR 0.91 (95%CI 0.72 to 1.16)
2. Quality of life Measured with St George Respiratory questionnaire, change from baseline, mean (SD)
I: -3.9 (10) C: -1.3 (14.5) MD -2.60 (95%CI: -7.12 to 1.92)
3. Complications Antibiotic resistance Measured as resistance among commensal oropharyngeal streptococci, median change (IQR)
I: 28% (0 to 41) C: 0% (-2 to 2)
Data on arrhythmias, secondary infections, liver function disorders or deafness was not reported |
|
|
Wong, 2012 |
Type of study: RCT
Setting: Outpatient
Country: New Zealand
Source of funding: Non-commercial |
Exclusion criteria:
N total at baseline: Intervention: 71 Control: 70
Important prognostic factors2: Age ± SD: I: 60 (14) C: 59 (13)
Sex: I: 32% M C: 29% M
Baseline FEV (mean FEV1 L (SD)): I: 1.87 (0.74) C: 1.88 (0.69)
Baseline FEV (mean predicted FEV1 % (SD)): Not reported
Baseline exacerbations, mean (SD): I: 3.34 (2.61) C: 3.93 (2.49)
Groups comparable at baseline? Yes
|
Oral azithromycin (500 mg) three times per week (M/W/F) for 6 months
|
Placebo
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 4 (6%)
Control: N = 10 (14%)
Incomplete outcome data: Intervention: N = 4 (6%)
Control: N = 10 (14%)
|
Measured as the number of participants
I: 22 (31%) C: 46 (66%) RR 0.47 (95%CI 0.32 to 0.69)
2. Quality of life Measured with St George Respiratory questionnaire, change from baseline, mean (SD)
6 months (end of treatment) I: -5.17 C: -1.92 MD -3.25 (95%CI: -7.21 to 0.72)
12 months (end of follow-up) I: -2.89 C: -4.71 MD 1.82 (95%CI: -0.27 to 6.32)
3. Complications Antibiotic resistance Reported as the number of participants
I: 2/46 (4%) C: 0/45 (0%)
Data on arrhythmias, secondary infections, liver function disorders or deafness was not reported |
|
|
Cymbala, 2005 |
Type of study: RT (cross-over)
Setting: Clinics and homes
Country: USA
Source of funding: Industry-sponsored |
Exclusion criteria:
N total at baseline: Total: 12
Important prognostic factors2: Age ± SD: 70 (10)
Sex: 45% M
Baseline FEV: 48.5 (18.9)
Baseline exacerbations: not reported
Groups comparable at baseline? NA |
Azithromycin (500 mg) twice weekly for 6 months (1 month washout period)
|
Usual treatment regimen
|
Length of follow-up: I 13 months, C 12 months
Loss-to-follow-up: Intervention: N = 1 (%) Reasons (describe)
Control: N = 0 (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe) |
Not reported
2. Quality of life Not reported
3. Complications Data on resistance, arrhythmias, secondary infections, liver function disorders or deafness was not reported
|
|
|
Currie, 1990 |
Type of study: RCT
Setting: Clinics and homes
Country: UK
Source of funding: Non-commercial |
Exclusion criteria:
N total at baseline: Intervention: 19 Control: 19
Important prognostic factors2 Age, median: I: 54 C: 51
Sex: I: 60% M C: 71% M
Baseline FEV (mean FEV1 L (SD)): I: 1.9 (0.9) C: 1.6 (0.9)
Baseline FEV (median predicted FEV1 % (SD)): I: 54% C: 51%
Baseline exacerbations, 3 or more in the past year): I: 11 C: 15
Groups comparable at baseline? Yes |
Amoxycillin (6 g) daily for 32 weeks
|
Placebo
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 4 (21%)
Control: N = 5 (26%)
Incomplete outcome data: Intervention: N = 4 (21%)
Control: N = 5 (26%)
|
Measured as the number of participants
I: 17 (89%) C: 19 (100%) RR 0.90 (95%CI 0.75 to 1.07)
Not reported
Data on resistance, arrhythmias, secondary infections, liver function disorders or deafness was not reported
|
|
|
Inhalation antibiotics |
|||||||
|
Haworth, 2014 |
Type of study: RCT
Setting: patients completing a course of antipseudomonal antibiotics for an exacerbation
Country: United Kingdom, Russia, Ukraine
Source of funding: Industry sponsored |
Inclusion criteria:
N total at baseline: Intervention: 73 Control: 71
Important prognostic factors2: Age ± SD: I: 58 (15) C: 60 (15)
Sex: I: 37% M C: 48% M
FEV1, mean (SD) in L I: 1.55 (0.89) C: 1.56 (0.65)
Predicted FEV1, mean (SD) in % I: 55.9 (24.3) C: 57.6 (24.9)
Groups comparable at baseline? Yes
|
Colistin, 1 million international units, in 1-mL 0.45% saline, twice daily for six months
|
Placebo, in 1-mL 0.45% saline
|
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: N = 11 (15%) Reasons: 7 adverse event, 1 ineffective therapy, 2 withdrew consent, 1 other reason
Control: N = 11 (15%) Reasons: 4 adverse events, 2 ineffective therapy, 4 withdrew consent, 1 did not meet criteria
Incomplete outcome data: Intervention: N = 11 (15%) Reasons: 7 adverse event, 1 ineffective therapy, 2 withdrew consent, 1 other reason
Control: N = (15%) Reasons: 4 adverse events, 2 ineffective therapy, 4 withdrew consent, 1 did not meet criteria |
1. Exacerbations*
I: 36/73 (49%) C: 42/71 (59%) RR 0.83 (0.62-1.12)
2. Quality of life Measured with the SGRQ (total score), mean change from baseline (SD)
Week 12 I: -2.8 (14.5) C: -2.2 (10.5) MD -1.09 (95%CI: -5.18 to 2.99) Week 26 I: -10.4 (19.6) C: -0.4 (13.2) MD -10.51 (95%CI: -17.87 to -3.14)
3. Complications Defined as adverse events, specifically bronchospasm and coughing
Bronchospasm No data reported
Coughing
|
Statistical analyses were performed by an external company, Wilkinson Associates.
* Exacerbations were defined as the presence of three or more of the following signs or symptoms for at least 24 hours: increased cough, increased sputum volume, increased sputum purulence, hemoptysis, increased dyspnea, increased wheezing, fever (≥ 38° C) or malaise, and the treating physician agreed that antibiotic therapy was required. |
|
Serisier, 2013 |
Type of study: RCT
Setting: 11 sites
Country: Australia and New Zealand
Source of funding: Industry sponsored** |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 20 Control: 22
Important prognostic factors2: Age ± SD: I: 70 (6) C: 59 (13)
Sex: I: 41% M C: 50% M
FEV1, mean (SD) in L I: 1.47 (0.73) C: 1.57 (0.77)
Predicted FEV1, mean (SD) in % I: 53.1 (22.7) C: 60.7 (24.1)
Groups comparable at baseline? Yes, except for age |
Ciprofloxacin, liposomal (150 mg in 3 ml) and free (60 mg in 3ml), nebulized, once-daily for up to three treatment cycles of 28 days on and 28 days off inhaled therapy |
Matched placebo, control liposomes (15 mg in 3 ml) and normal saline (0.9%, 3 ml), nebulized, once-daily for up to three treatment cycles of 28 days on and 28 days off inhaled therapy |
Length of follow-up: 168 days
Loss-to-follow-up: Intervention: N = 3 (13%) Reasons: 1 protocol violation, 2 adverse events
Control: N = 2 (10%) Reasons: 1 adverse event, 1 pulmonary exacerbations
Incomplete outcome data: Intervention: N = 3 (13%) Reasons: 1 protocol violation, 2 adverse events
Control: N = 2 (10%) Reasons: 1 adverse event, 1 pulmonary exacerbations
|
1. Exacerbations* Measured at the end of follow-up (168 days)
I: 11/20 (55%) C: 17/22 (77%) RR 0.71 (0.45-1.12)
2. Quality of life Measured with the SGRQ (total score), mean change from baseline (SD)
Day 28 I: -1.3 (7.16) C: -6.4 (9.8) MD 5.1 (95%CI: -0.3 to 10.5)
3. Complications Defined as adverse events, specifically bronchospasm and coughing
Bronchospasm No data reported
Coughing
|
*Protocol-defined pulmonary exacerbation, using a modification of Fuchs criteria, was defined as deterioration in at least four of the following nine symptoms or signs: sputum production (volume, colour, consistency or haemoptysis), dyspnoea, cough, fever, wheezing, exercise tolerance (or fatigue/ lethargy/ malaise), FEV1 or FVC fall of at least 10%, new changes on chest radiograph and changes in chest sounds on auscultation.
**Some of the authors were employees of the sponsor. |
|
Murray, 2011 |
Type of study: RCT
Setting: Regional bronchiectasis service
Country: Scotland
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 32 (27 completed) Control: 33 (30 completed)
Important prognostic factors2: Of the population that completed the study Age, median (IQR): I: 58 (53-67) C: 64 (55.7-69)
Sex: I: 33% M C: 50% M
Groups comparable at baseline? Yes |
Gentamicin 80 mg reconstituted for nebulization in 0.9% saline, twice daily for 12 months
|
Nebulized 0.9% saline, 5 ml Twice daily for 12 months
|
Length of follow-up: 15 months
Loss-to-follow-up: Intervention: N = 5 (16%) Reasons: 2 deaths, 3 withdrawals (2 unable to tolerant nebulized therapy and 1 unable to commit to study review)
Control: N = 3 (9%) Reasons: 3 withdrawals (2 unable to tolerant nebulized therapy and 1 unable to commit to study review)
Incomplete outcome data: Intervention: N = 5 (16%) Reasons: 2 deaths, 3 withdrawals (2 unable to tolerant nebulized therapy and 1 unable to commit to study review)
Control: N = 3 (9%) Reasons: 3 withdrawals (2 unable to tolerant nebulized therapy and 1 unable to commit to study review)
|
4. Exacerbations*
I: 33% (9/27) C: 80% (24/30) RR 0.42 (0.24-0.73)
5. Quality of life Measured with the SGRQ (total score), percentage of participant with a clinically significant improvement (defined as ≥4 units)
Month 3 I: 78% C: 32% P=0.004 Month 6 I: 82% C: 35% P=0.004 Month 9 I: 71% C: 24% P=0.004 Month 12 I: 88% C: 19% P=0.004 Month 15 I: 61% C: 19% P=0.004
6. Complications Defined as adverse events, specifically bronchospasm and coughing
Bronchospasm** Data could not be interpreted.
Coughing Data not reported |
*An exacerbation was defined as a clinical deterioration with all of the following: increasing cough, increasing sputum volume and worsening sputum purulence. Only percentage were reported, numbers were calculated from percentages and number in each arm.
**Participants were included based on their tolerance tot gentamicin, which was defined as no bronchospasm or fall in FEV1 >15% and >200mL after nebulization of 80 mg gentamicin with or without prebronchodilation using nebulized 2.5 mg salbutamol. This outcome is selected on the intervention and any reported association may be biased. |
|
Drobnic, 2005 |
Type of study: RCT [crossover]
Setting: Tertiary referral center
Country: Spain
Source of funding: Not stated |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 30 patients
Important prognostic factors2: Not reported |
Tobramycin, 300 mg aerosolized, twice daily for 6 months
One month washout period
|
Placebo, 0.9% saline, twice daily for 6 months
|
Length of follow-up: 13 months
Loss-to-follow-up: N = 10 (33%) Reasons: 3 adverse events (bronchospasm), 1 change of residence, 1 failed to adhere, 5 deaths (respiratory failure)
Incomplete outcome data: N = 10 (33%) Reasons: 3 adverse events (bronchospasm), 1 change of residence, 1 failed to adhere, 5 deaths (respiratory failure)
|
1. Exacerbations* Reported as mean number I: 0.9 C: 1.3 P=0.330
2. Quality of life Measured with the SGRQ (total score), mean change from baseline (SD)
I: -0.90 (3.93) C: -0.83 (6.89) P=0.97
3. Complications Defined as adverse events, specifically bronchospasm and coughing
Bronchospasm I: 3 (10%) C: 0 (0%)
Coughing Data not reported |
*Exacerbations were defined as more frequent coughing, more dyspnea, and an increase in sputum volume and purulence. |
|
Orriols, 1999 |
Type of study: RCT
Setting: Two university centres
Country: Spain
Source of funding: No stated |
Inclusion criteria:
N total at baseline: Intervention: 8 (7 completed) Control: 9 (8 completed)
Important prognostic factors2: For patients that completed the study
Age ± SE: I: 62 (9) C: 61 (10)
Sex: I: 86% M C: 50% M
FEV1, mean (SE) in mL I: 1037 (386) C: 866 (225)
Predicted FEV1, mean (SE) in % I: 62.3 (19.9) C: 56.2 (21.4)
Groups comparable at baseline? Yes |
Ceftazidime 1000 mg per 12 hours and tobramycin 100mg per 12 hours, nebulised
|
Symptomatic treatment
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 1 (13%) Reason: Bronchospasm
Control: N = 1 (11%) Reason: Death (due to respiratory failure)
Incomplete outcome data: Intervention: N = 1 (13%) Reason: Bronchospasm
Control: N = 1 (11%) Reason: Death (due to respiratory failure)
|
1. Exacerbations* Data no reported
2. Quality of life Data no reported
3. Complications Defined as adverse events, specifically bronchospasm and coughing
Bronchospasm I: 1 (13%) C: 0 (0%)
Coughing Data not reported |
*Exacerbations were defined as more frequent coughing, more dyspnea, and an increase in sputum volume and purulence. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Oral antibiotics |
||||||||
|
Liu, 2014 |
“Eligible participants were randomly assigned to control and roxithromycin groups.” |
Unclear. Not mentioned |
Likely. No placebo was given. |
Likely. No placebo was given. |
Unclear. Not mentioned |
Unclear, the trial was not registered. |
Unlikely. Although 10% or more was lost to follow-up, the numbers were low (4 vs 5) and reasons didn’t differ substantially. |
Unlikely. Patients were most likely analysed according to assignment. |
|
Altenburg, 2013 |
“[…] a multicentre, double-blind, placebo-controlled, parallel-group study with equal randomization (1:1) […]. We used permuted block randomization, with equally sized blocks of 10. Randomization was performed centrally; no stratification for factors such as exacerbation frequency or study center was applied.” |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unclear |
|
Serisier, 2013 |
‘Computer-generated randomization sequences, blocked I random groups of 2, 4, and 8 and stratified for presence of sputum P. Aeruginosa at screening, were held […].” |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Wong, 2012 |
“Eligible patients were randomly assigned to receive either azithromycin or placebo by a statistician independent to the reporting statistician with a computer-generated random number list.” |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unclear |
|
Cymbala, 2005 |
“Randomization schedule via random numbers table” |
Likely |
Likely |
Likely |
Likely |
Likely |
Unclear |
Unclear |
|
Currie, 1990 |
“Patients were randomly allocated […].” |
Unclear. Not mentioned. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Inhalation antibiotics |
||||||||
|
Haworth, 2014 |
“Participants were randomly allocated (1:1) to colisin, 1 million internal units, in 1-ml 0.45% saline or placebo ( 1ml 0.45% saline).” |
Unclear. Not stated |
Unlikely. “The investigator and study participants were masked to treatment allocation.” |
Unlikely. “The investigator and study participants were masked to treatment allocation.” |
Unclear, not stated |
Unlikely. Outcomes reported in methods, are reported in results section |
Unlikely. Although in each arm 15% was lost to follow-up, reasons were similar. |
Unlikely. “All analyses were performed on the ITT population […].” |
|
Serisier, 2013 |
“Eligible subjects were centrally randomised 1:1, stratified by number of pulmonary exacerbations (2-3) or ≥ 4) in the preceding 12 months.” |
Unclear. Not stated |
Unlikely. Double-blind trial with matching placebo |
Unclear. Although stated to be double-blind, it is unclear who was blinded in addition to the patient. |
Unclear. Although stated to be double-blind, it is unclear who was blinded in addition to the patient. |
Unlikely. Outcomes reported in methods, are reported in results section |
Unlikely. Although loss-follow-up was 10% or more in both arms, reasons were similar. |
Unlikely. “The primary outcome was assessed on the mITT population […].” |
|
Murray, 2011 |
“Randomization was by the study pharmacist […].” |
Unclear. “The study pharmacist blindly randomised all patients to treatment […].” |
Likely. “Because of funding limitations, patients could not be masked.” |
Likely. Specialist nurses were not masked. |
Likely. Specialist nurses and study doctors were not masked. |
Unlikely. Outcomes reported in methods, are reported in results section |
Likely. Loss-to-follow-up was 16% in the intervention group and 9% in the control group. Two deaths occurred in the intervention group and zero in the control group. |
Likely. Statistical tests were used that cannot take into account any drop-out. |
|
Drobnic, 2005 |
“The study was a randomised, placebo-controlled, 2-period, cross-over design.” |
Unclear. Not stated. |
Unlikely. Placebo was used |
Unlikely. “[…] and then confirmed by an emergency department physician who was unaware of the study.” |
Unlikely. “The decision on hospital admission was made first by a blinded investigator [...].” |
Unlikely. Outcomes reported in methods, are reported in results section |
Likely. A third of patients was lost to follow-up. |
Likely. “Only patients who completed both treatment periods were included in the statistical analysis.”
Unlikely for outcome bronchospasm. “Safety was evaluated under intent-to-treat conditions, comparing the incidence of bronchospasm for each treatment group. |
|
Orriols, 1999 |
“Patients were then randomly allocated to a 12-month treatment […].” |
Unclear. Not stated. |
Likely. “This was a pilot, prospective, randomized, non-blinded trial.” |
Likely. “This was a pilot, prospective, randomized, non-blinded trial.” |
Likely. “This was a pilot, prospective, randomized, non-blinded trial.” |
Unlikely. Outcomes reported in methods, are reported in results section |
Unlikely. In both groups 1 patient was lost to follow-up. |
Likely. Statistical tests were used that cannot take into account any drop-out. |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Orale antimicrobiële middelen |
|
|
Welsh, 2015 |
Review naar alle beschikbare interventie voor bronchiëctasieën; specifieke review beschikbaar (Hnin, 2015) |
|
Magis-Escurra, 2015 |
Algemene review; geen gedetailleerde zoekstrategie beschikbaar |
|
Li, 2015 |
Commentaar op artikel |
|
Fan, 2015 |
Alle trials ook geïncludeerd in Hnin, 2015 |
|
Chalmers, 2015 |
Narratieve review |
|
Zhuo, 2014 |
Alle trials ook geïncludeerd in Hnin, 2015 |
|
Zhuo, 2014 |
Erratum |
|
Wu, 2014 |
Alle trials ook geïncludeerd in Hnin, 2015 |
|
Wang, 2014 |
Narratieve review |
|
Shi, 2014 |
Alle trials ook geïncludeerd in Hnin, 2015 |
|
Shi, 2014 |
Reactie op commentaar |
|
Serisier, 2014 |
Commentaar |
|
Serisier, 2014 |
Commentaar |
|
Parnham, 2014 |
Mechanisme van azitromycine |
|
Gao, 2014 |
Alle trials op 1 na ook geïncludeerd in Hnin, 2015; betrof een trial in kinderen met HIV en bronchiëctasieën. |
|
Albert, 2014 |
Review over mogelijke bijwerkingen bij gebruik van macroliden |
|
Adamantia, 2014 |
Review over behandeling van luchtweginfecties |
|
Whitters, 2013 |
Associatie tussen COPD en bronchiëctasieën |
|
Rademacher, 2011 |
Gezocht in 1 database |
|
Figueiredo, 2011 |
Gezocht tot juni 2011 en in 1 database |
|
Chang, 2010 |
Richtlijn |
|
Pappalettera, 2009 |
Gezocht tot november 2008 en in 1 database |
|
Evans, 2007 |
Gezocht in januari 2007 (recentere reviews zijn beschikbaar) |
|
Rosen, 2006 |
Gezocht in 2003 (recentere reviews zijn beschikbaar) |
|
|
RCT’s gepubliceerd na februari, 2014 (zoekstrategie van Hnin, 2014) |
|
Yap, 2015 |
Review |
|
Rogers, 2015 |
BLESS-trial al geïncludeerd in Hnin, 2015 |
|
Anonymus, 2015 |
Betreft correcties voor analyse |
|
Sidhu, 2014 |
Narratieve review |
|
Rogers, 2014 |
Effect van interventie op microbiota (analyse van BLESS, al geïncludeerd) |
|
Prickett, 2014 |
Narratieve review |
|
McNeill, 2014 |
Letter to the editor |
|
Lourdesamy, 2014 |
Behandeling voor 12 weken |
|
Haworth, 2014 |
Narratieve review |
|
Fan, 2014 |
Review |
|
Bilton, 2014 |
Algemene review |
|
Inhalatie antimicrobiële middelen |
|
|
Yang, 2015 |
Overlappend met Brodt, 2014 die een betere beschrijving van de zoekstrategie heeft. |
|
Falagas, 2015 |
Niet alleen RCT’s geïncludeerd, ook niet-gerandomiseerd studie en studies zonder vergelijkende groep |
|
Chalmers, 2015 |
Narratieve review |
|
Zhang, 2014 |
Conference abstract |
|
Brodt, 2014 |
Niet allen trials geïncludeerd over onderhoudsbehandeling; alle relevante trials worden ook gevonden met deze zoekactie |
|
Wurzel, 2012 |
Niet alleen volwassenen patiënten geïncludeerd; niet alleen inhalatie antimicrobiële middelen beoordeeld |
|
Wurzel, 2011 |
Duur van behandeling met antimicrobiële middelen |
|
Tay, 2015 |
Narratieve review |
|
Orriols, 2015 |
Duur van behandeling 3 maanden |
|
Prickett, 2014 |
Narratieve review |
|
Barker, 2014 |
Duur van behandeling 4 maanden (1 maand behandeling; 1 maand geen medicatie) |
|
Wilson, 2013 |
Duur van behandeling 28 dagen |
|
Stass, 2013 |
Volwassenen met CF |
|
Serisier, 2013 |
Duur van behandeling 6 maanden (1 maand behandeling; 1 maand geen medicatie) |
|
Antoniu, 2013 |
Geen beschrijving van een originele studie |
|
Antoniu, 2011 |
Narratieve review |
|
Pasteur, 2010 |
Richtlijn |
|
Steinfort, 2007 |
Case series; patiënten met bronchiale sepsis |
|
Bilton, 2006 |
Duur van behandeling 14 dagen |
|
Scheinberg, 2005 |
Duur van behandeling 12 weken
|
|
Couch, 2001 |
Duur van behandeling 4 weken |
|
Barker, 2000 |
Duur van behandeling 4 weken |
|
Crowther, 1999 |
Vergelijking tussen verschillende toedieningsmethode van hetzelfde antimicrobieel middel |
|
Lin, 1997 |
Behandeling van 3 dagen |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-06-2017
Beoordeeld op geldigheid : 19-06-2017
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2022 bepaalt het bestuur van de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijn is ter autorisatie/akkoord aangeboden aan de NVALT, NIV, NVMM, KNGF en het Longfonds.
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is het verkrijgen van meer uniformiteit met betrekking tot de diagnostiek, behandeling en begeleiding van patiënten met bronchiëctasieën.
Doelgroep
De gebruikers van de richtlijnmodules en het zorgpad betreffen naast de longartsen andere medische beroepsgroepen zoals fysiotherapeuten, (long) verpleegkundigen, verpleegkundig specialisten, internisten, internist-infectiologen en internist-immunologen, artsen-microbioloog, specialisten ouderengeneeskunde, geriaters en huisartsen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met bronchiëctasieën te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- prof. dr. T.S. van der Werf, longarts, Universitair Medisch Centrum Groningen, Groningen, NVALT (voorzitter);
- dr. M.M. van der Eerden, longarts, Erasmus Medisch Centrum, Rotterdam, NVALT;
- dr. M.H.E. Reijers, longarts, Radboud Universitair Medisch Centrum, Nijmegen, NVALT;
- dr. D. Snijders, longarts, Spaarne Gasthuis, Hoofddorp, NVALT;
- dr. V.A.S.H. Dalm, internist-klinisch immunoloog, Erasmus Medisch Centrum, Rotterdam, NIV;
- dr. F.L. van de Veerdonk, internist-infectioloog, Radboud Universitair Medisch Centrum, Nijmegen, NIV;
- dr. M.B. Ekkelenkamp, arts-microbioloog, Universitair Medisch Centrum Utrecht, Utrecht, NVMM;
- dr. H.J. Hulzebos, medisch fysioloog en (sport) fysiotherapeut, Universitair Medisch Centrum Utrecht, Utrecht, KNGF.
Meelezers:
- drs. L. Naber, coördinator zeldzame longziekten, Longfonds;
- drs. B. Holverda, senior projectmanager, Longfonds.
Met ondersteuning van:
- dr. B.H. Stegeman, adviseur, Kennisinstituut van Medisch Specialisten;
- P.H. Broos, MSc, senior adviseur, Kennisinstituut van Medisch Specialisten;
- M.E. Wessels, MSc, literatuurspecialist, Kennisinstituut van Medisch Specialisten;
- N.F. Bullock, projectsecretaresse, Kennisinstituut van Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van der Werf |
Longarts |
Lid Scientific Review Committee, NLR |
Lid ad hoc adviesraad Pfizer en Jansen Farmaceutica (antifungale middelen) |
Geen actie (betreft advies ten aanzien van antifungale middelen) |
|
Van der Eerden |
Longarts |
- |
Door Chieso gesponsord onderzoek naar inhalatie antibiotica |
Geen actie |
|
Reijers |
Longarts |
Auditor IWKV RadboudUMC |
Deelname ad hoc adviesbijeenkomsten (Novartis, Chiesi en aztreonam producent) |
Geen actie (betreft behandeling bij CF) |
|
Snijders |
Longarts |
WG-lid Slikstoornissen |
Geen |
Geen actie |
|
Dalm |
Internist-Klinisch immunoloog |
Secretaris Stichting Samenwerkende centra voor Primaire Immuun Deficiënties (SSPID) |
Onderzoeker geïnitieerd onderzoek naar pasireotide in fibrotische ziekte, gesponsord door Novartis; Sponsor geïnitieerd onderzoek naar biomarkers in systemische sclerosis, gesponsord door Actelion |
Geen actie |
|
Van de Veerdonk |
Internist-infectioloog |
- |
Geen |
Geen actie |
|
Ekkelenkamp |
Arts-microbioloog |
Romanschrijver |
Workpackage leider onderzoek, deels gesponsord door de farmaceutische industrie naar een nieuw beta-lactam antibioticum als inhalatietherapie bij CF en eventueel bronchiëctasieën |
Geen actie (betreft een nieuw antibioticum nog niet beschikbaar in NL) |
|
Hulzebos |
Medisch fysioloog en (sport) fysiotherapeut |
- |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het meelezen van teksten door het Longfonds. De conceptrichtlijn is tevens voor commentaar voorgelegd aan het Longfonds. Het Longfonds heeft een patiënt uitgenodigd voor het samen leveren van commentaar.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft tevens interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatorontwikkeling).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Vereniging Innovatieve Geneesmiddelen (voorheen Nefarma) via een enquête. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html. 2012.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Orale antimicrobiëele middelen |
||
|
Medline (OVID) Engels, 1980-okt. 2015
|
1 exp Bronchiectasis/ or (bronchiect$ or bronchoect$ or kartagener$ or (ciliary adj3 dyskinesia) or (bronchial$ adj3 dilat$)).ti,ab. (12032) 2 exp Macrolides/ (92787) 3 exp erythromycin/ [onder andere azithromycin/ or clarithromycin/ or roxithromycin/] (22355) 4 (antimicrobi* or antibiotic* or antibacterial or macrolide* or azithromycin* or erythromycin* or clarithromycin* or roxithromycin*).ti,ab. (374319) 5 2 or 3 or 4 (440249) 6 1 and 5 (1019) 13 limit 6 to (dutch or english) (711) 14 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (253940) 15 13 and 14 (47) 16 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or clinic$ trial$1.tw. or (clinic$ adj trial$1).tw. or ((singl$ or doubl$ or treb$ or tripl$) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo$.tw. or randomly allocated.tw. or (allocated adj2 random$).tw.) not (animals/ not humans/) (1234898) 17 13 and 16 (131) 18 15 or 17 (155) 19 12 and 18 (4) 20 17 not 15 (108) 21 remove duplicates from 15 (41) – 38 uniek 22 remove duplicates from 20 (105) – 105 uniek |
413 |
|
Embase (Elsevier) |
bronchiectasis'/exp OR bronchiect*:ab,ti OR bronchoect*:ab,ti OR kartagener*:ab,ti OR (ciliary NEAR/3 dyskinesia):ab,ti OR (bronchial* NEAR/3 dilat*):ab,ti NOT 'conference abstract':it
AND ('macrolide'/exp OR antimicrobi*:ab,ti OR antibiotic*:ab,ti OR antibacterial:ab,ti OR macrolide*:ab,ti OR azithromycin*:ab,ti OR erythromycin*:ab,ti OR clarithromycin*:ab,ti OR roxithromycin*:ab,ti)
AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [1980-2015]/py
AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) (46) – 31 uniek
AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it) (309) – 239 uniek |
|
|
Inhalatie antimicrobiëele middelen |
||
|
Medline (OVID)
1980-nov. 2015
Engels, |
1 exp Bronchiectasis/ or (bronchiect$ or bronchoect$ or kartagener$ or (ciliary adj3 dyskinesia) or (bronchial$ adj3 dilat$)).ti,ab. (12084) 7 exp aminoglycosides/ or exp gentamicins/ or Tobramycin/ or Amikacin/ or Colistin/ or Aztreonam/ or fluoroquinolones/ or ciprofloxacin/ or levofloxacin/ (159198) 8 (Aminoglycoside* or gentamicin* or Tobramycin* or Amikacin* or Colistin* or Aztreonam* or fluoroquinolone* or ciprofloxacin* or levofloxacin*).ti,ab. (68525) 9 exp Anti-Bacterial Agents/ (584521) 10 7 or 8 or 9 (668076) 11 "Administration, Inhalation"/ (25770) 12 exp "Nebulizers and Vaporizers"/ (9082) 13 (inhalation or aerosol* or "respiratory drug" or inhale* or nebuli* or vapori*).ti,ab. (116393) 14 11 or 12 or 13 (122914) 15 10 and 14 (3618) 16 ((inhalation or aerosol* or "respiratory drug" or inhale* or nebuli* or vapori*) adj3 (antimicrobi* or antibiotic* or antibacterial)).ti,ab. (740) 17 15 or 16 (3822) 18 1 and 17 (189) 19 limit 18 to (yr="1980 -Current" and (dutch or english)) (138) 20 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (257898) 21 19 and 20 (18) 22 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or clinic$ trial$1.tw. or (clinic$ adj trial$1).tw. or ((singl$ or doubl$ or treb$ or tripl$) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo$.tw. or randomly allocated.tw. or (allocated adj2 random$).tw.) not (animals/ not humans/) (1244200) 23 19 and 22 (60) 26 23 not 21 (49) 27 remove duplicates from 21 (16) 28 remove duplicates from 23 (56) |
|
|
Embase (Elsevier) |
'bronchiectasis'/exp OR bronchiect*:ab,ti OR bronchoect*:ab,ti OR kartagener*:ab,ti OR (ciliary NEAR/3 dyskinesia):ab,ti OR (bronchial* NEAR/3 dilat*):ab,ti AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [1980-2015]/py
AND (aminoglycoside*:ab,ti OR gentamicin*:ab,ti OR tobramycin*:ab,ti OR amikacin*:ab,ti OR colistin*:ab,ti OR aztreonam*:ab,ti OR fluoroquinolone*:ab,ti OR ciprofloxacin*:ab,ti OR levofloxacin*:ab,ti OR 'aminoglycoside antibiotic agent'/exp OR 'colistin'/exp OR 'aztreonam'/exp OR 'quinolone derivative'/exp
AND ('inhalational drug administration'/exp OR 'nebulizer'/exp OR inhalation:ab,ti OR aerosol*:ab,ti OR 'respiratory drug':ab,ti OR inhale*:ab,ti OR nebuli*:ab,ti OR vapori*:ab,ti) OR ((inhalation OR aerosol* OR 'respiratory drug' OR inhale* OR nebuli* OR vapori*) NEAR/3 (antimicrobi* OR antibiotic* OR antibacterial)):ab,ti)
AND 'meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)) (9) – 5 uniek
AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it (82) – 51 uniek |
|
