Lokale behandeling – radiotherapeutische behandeling van pijn
Uitgangsvraag
Wat is de aanbevolen radiotherapie voor de behandeling van pijn bij patiënten met botmetastasen: hoge dosis radiotherapie/stereotaxie of standaard dosis radiotherapie?
Aanbeveling
Behandel patiënten met ongecompliceerde pijnlijke botmetastasen met een éénmalige bestraling van 8Gy.
Wees terughoudend met SBRT. Overweeg SBRT alleen bij patiënten waarbij complete pijnrespons een te verwachten en benodigd doel van behandeling is.
Overwegingen
Voor- en nadelen en kwaliteit van bewijs
De uitgangsvraag van de werkgroep was wat de plaats is van hoge dosis radiotherapie (in de vorm van stereotactische radiotherapie) in de behandeling van pijnlijke ongecompliceerde botmetastasen.
Twee recente systematische reviews (Ito, 2022 en Bindels, 2024) vergeleken stereotactische radiotherapie (SBRT) met conventionele radiotherapie (cEBRT).
Daarmee voldoen deze reviews niet aan de uitgangsvraag, omdat er hier gekeken wordt naar techniek en niet naar dosis. Nadeel hiervan is dat in 2 van de 8 geïncludeerde studies een relatief hoge dosis (10 x 3 Gy) middels cEBRT vergeleken wordt met hogere dosis middels SBRT. In de studie van Nguyen leidt dit ertoe dat de radiobiologische dosis tussen beide armen niet veel verschilt, de BED van 10 x 3 Gy is 39 Gy (cEBRT), versus 26.4 Gy (1 x 12 Gy) en 41.6 Gy (1 x 16 Gy) (beiden SBRT). In de andere studie (Sprave et al) die 10 x 3 Gy gaf in de cEBRT-arm, is het verschil in radiobiologische dosis groter door een hogere radiobiologische dosis van SBRT (BED 39 Gy vs 81.6 Gy). In de Nederlandse studie van Pielkenrood werd ook 10x3Gy toegestaan in de cEBRT-arm, maar werden tevens andere fractioneringsschema’s gegeven (1 x 8 Gy en 5 x 4 Gy).
In de overige 5 studies wordt in de cEBRT-arm 1 x 8 Gy (3 studies) of 5 x 4 Gy (2 studies) gegeven.
In Nederland wordt een éénmalige fractie van 8 Gy als gouden standaard beschouwd voor behandeling van patiënten met ongecompliceerde pijnlijke botmetastasen, conform internationale literatuur (Rich, 2018).
Een andere beperking van de geselecteerde studies is dat drie van de acht geïncludeerde studies specifiek naar wervelmetastasen hebben gekeken, wat strikt genomen buiten de scope van deze richtlijn valt. Er zijn echter geen redenen om aan te nemen dat de lokalisatie van botmetastasen van invloed is op de onderzochte uitkomstmaten bij ongecompliceerde botmetastasen.
De bewijskracht voor de cruciale uitkomstmaten pijn, kwaliteit van leven en complicaties (pathologische fracturen, pijnflare, neurologische klachten en overige ‘adverse events’) werd beoordeeld als laag tot zeer laag vanwege twijfels over de methodologische kwaliteit van de studies, het ontbreken van blindering (relevant voor de uitkomstmaat pijn) en een grote spreiding rondom het geschatte effect. Hoewel altijd gedacht werd dat door SBRT er meer wervel-inzakkingsfracturen zouden zijn, resulteert SBRT wellicht in weinig tot geen verschil in pijn en complicaties vergeleken met conventionele radiotherapie. In de drie studies die specifiek naar patiënten met wervelmetastasen hebben gekeken, zijn grote onderlinge verschillen zichtbaar in fractuurrisico. In de grootste studies van Saghal (2021) en Ryu (2023) met respectievelijk 229 en 353 patiënten, is geen significant verschil gevonden in fractuurrisico (11% SBRT vs 17% cEBRT, respectievelijk 19% in beide armen). In de studie van Sprave met 60 patiënten in totaal, wordt na 1x24Gy SBRT 26% fractuurrisico gezien, versus 7% na 10x3Gy cEBRT.
Complete respons
Wanneer je kijkt naar de uitkomtmaat ‘complete respons’, valt op dat vijf studies (Berwouts, Sakr, Sahgal, Sprave, Mercier) 1, 3 en 6 maanden na behandeling, een significant voordeel zien voor SBRT in vergelijking met cEBRT.
De definitie van een complete respons is echter een pijnscore 0 zonder ophoging van analgetica. Bij de studie met het grootste aantal patiënten (Saghal, n=229) valt op dat de pijnscore bij inclusie relatief laag was (mediaan 5). Het is aannemelijk dat deze patiënten eerder voldoen aan de definitie van een complete respons dan patiënten die bij inclusie een pijnscore 8-9 hebben bijvoorbeeld. Bij Sprave et al. was de initiële pijnscore laag, namelijk 3.6 (SBRT) en 4.9 (cEBRT). Ook in de studie van Berwouts (n=30) hadden de patiënten in de cEBRT-arm een hogere pijnscore bij inclusie dan patiënten in de SBRT-arm (niet-significant). In de studie van Sakr (n=22) hadden SBRT-patiënten bij aanvang een hogere pijnscore dan de cEBRT-patiënten. In de studie van Mercier (n=126) was de mediane pijnscore bij aanvang gelijk voor beide behandelarmen (NRS 6), 30% van de SBRT-patiënten had een pijnscore 8-10, tegenover 14% van de cEBRT-patiënten.
Er zijn dus aanwijzingen dat SBRT kan leiden tot een hoger percentage patiënten met complete respons ten opzichte van cEBRT. Uit de bovengenoemde studies komt echter onvoldoende naar voren voor welke patiënten SBRT een substantieel voordeel heeft boven cEBRT. Ook kan hieruit geen uitspraak worden gedaan welke dosis of fractioneringsschema het meest optimaal is. Niet bekend is wat de duur is van de pijnrespons na SBRT. Daar komt bij dat Nederlands onderzoek bij 110 patiënten geen voordeel liet zien van SBRT boven cEBRT (Pielkenrood, 2020).
Bij de meeste patiënten zorgt afname van pijn (partiële respons), ongeacht uiteindelijk bereikt pijnniveau, al voor een substantiële verbetering van hun kwaliteit van leven (Westhoff 2015). Hoewel het logisch lijkt voor elke patiënt een complete pijnrespons te willen nastreven, ipv alleen een partiële respons, leert de ervaring dat dit vaak niet haalbaar is; de conditie gaat achteruit, andere pijnklachten komen op de voorgrond bijv.
Kortom, de groep patiënten met botmetastasen is een heel heterogene groep, waarbij nodig is verder te onderzoeken welke patiënten echt voordeel hebben van SBRT. De werkgroep denkt dat mogelijk patiënten met een verwachte lange overleving en een lage pijnscore bij aanvang van behandeling tot deze groep behoren.
Het ligt voor de hand om, indien wordt gekozen voor SBRT, te behandelen middels een zo min mogelijk belastende behandeling voor patiënt en afdeling: 1 of 2 fracties. Om meer bewijs te krijgen voor effectiviteit en identificatie van patiënten die er voordeel van hebben, zou je deze patiënten in studieverband willen behandelen, bijvoorbeeld in prospectieve cohorten of gerandomiseerde studies.
Duur van respons
Belangrijk is te vermelden dat in de genoemde RCT’s slechts gekeken is naar responspercentages, maar niet naar de duur van respons. Op basis van de literatuur is hierover dus geen uitspraak te doen.
Waarden en voorkeuren van patiënten (en evt. hun naasten)
Voordelen van een éénmalige fractie met 8 Gy is de snelheid van behandeling: er is vaak, op een plannings-CT voor radiotherapieplanning na, geen aanvullende voorbereiding nodig voor de behandeling en deze kan op de meeste radiotherapie-afdelingen in Nederland binnen enkele dagen na het consult plaatsvinden. Voor patiënten is het een snelle behandeling die enkele minuten duurt en hoeven zij hiervoor op de meeste afdelingen hooguit twee keer naar het ziekenhuis te komen (consult, plannings-CT en bestraling).
Bij behandeling middels SBRT is er vaak extra aanvullende voorbereiding nodig in de vorm van een plannings-MRI, in combinatie met de plannings-CT. Bij wervelbestralingen wordt er veelal gebruik gemaakt van een vacuümmatras, welke apart vervaardigd moet worden. Dit kost vaak 1-2 weken extra tijd voordat de behandeling kan starten. Het bestralen zelf neemt per keer meer tijd in beslag, ongeveer 10 min bij 1x 8 Gy tov 45 minuten bij SBRT.
Utrechtse onderzoekers van het Present-cohort hebben gekeken naar de bereidheid van 45 patiënten met wervelmetastasen om behandeling met SBRT te ondergaan in plaats van de standaard aangeboden cEBRT: 27% wijst SBRT af, met name vanwege de langere wachttijd tot start van de behandeling na de initiële intake (Pielkenrood, 2021).
Kosten
De kosten van behandeling middels SBRT liggen beduidend hoger dan behandeling met cEBRT.
Aanvaardbaarheid, haalbaarheid en implementatie
SBRT is een behandeling die op alle radiotherapie-afdelingen in Nederland aangeboden wordt. Gezien de aanbeveling van de werkgroep om bij pijnlijke botmetastasen in principe te behandelen met conventionele radiotherapie (1x8 Gy), zal dit niet leiden tot problemen in haalbaarheid en implementatie. Mochten radiotherapie-afdelingen overgaan tot het vaker inzetten van SBRT om te komen tot een complete respons, met opmerking dat de gegevens van deze patiënten bij voorkeur in een prospectieve database worden bijgehouden om meer inzicht te krijgen over de subgroep die hier echt baat bij heeft, zal dit leiden tot toename van administratielast.
Belangrijk is om te vermelden dat behandeling met cEBRT beduidend minder impact heeft op de toestelcapaciteit dan behandeling middels SBRT, gezien de lange behandelduur en complexiteit van laatstgenoemde behandeltechniek.
Onderbouwing
Achtergrond
Bij patiënten met pijnklachten van ongecompliceerde botmetastasen is behandeling met een éénmalige bestraling van 8Gy effectief gebleken.
Botmetastasen worden als ongecompliceerd beschouwd bij pijnklachten, zonder (dreigende) pathologische fractuur en zonder myelum- of caudacompressie, onafhankelijk van de grootte van de botmetastase (Van der Velden, 2022).
Meerdere RCT’s hebben verschillende fractioneringsschema’s vergeleken, waarbij de pijnrespons na 1 x 8 Gy vergelijkbaar is met de pijnrespons na meerdere fracties (intention to treat: >60% pijnrespons) en er geen verschil in toxiciteit wordt gezien. Dit maakt dat een éénmalige bestraling met 8 Gy de gouden standaard is bij pijnlijke botmetastasen (Rich, 2018). Vanuit patiëntenperspectief heeft de behandeling met het minst aantal fracties, bij gelijke effectiviteit en toxiciteit, ook de voorkeur, gezien in deze levensfase de minst belastende behandeling met zo min mogelijk ziekenhuisbezoek gewenst is.
Met de komst van stereotactische radiotherapie, een geavanceerde behandeltechniek, is het nu mogelijk om een hogere totaaldosis dan 8 Gy in een beperkt aantal fracties te geven.
De vraag vanuit de werkgroep is dan ook: wat is de plaats van een hogere dosis (met behulp van stereotactische radiotherapie) in de behandeling van pijnlijke, ongecompliceerde, botmetastasen?
Conclusies / Summary of Findings
|
Low GRADE |
The evidence suggests that SBRT results in little to no difference in overall pain response when compared with cEBRT in patients with bone metastases and pain.
The evidence suggests that SBRT results in more patients experiencing a complete pain response when compared with cEBRT in patients with bone metastases and pain.
Source: Bindels, 2024 |
|
Very low GRADE |
The evidence is very uncertain about the additive effect of SBRT on quality of life when compared with cEBRT in patients with bone metastases and pain.
Source: Ito 2022; Bindels, 2024 |
|
Very low GRADE |
It is unclear if there is a difference on complication rate (i.e. pathological fractures, pain flares, neurological injuries, other severe adverse events) of SBRT when compared with cEBRT in patients with bone metastases and pain.
Source: Ito, 2022, Bindels 2024 |
Samenvatting literatuur
Description of studies
Bindels (2024) performed a systematic review and meta-analysis to compare stereotactic body radiotherapy (SBRT) and conventional external beam radiotherapy (cEBRT) for the treatment of bone metastases (including vertebral metastases). Bindels (2024) searched PubMed, Embase, and Cochrane electronic databases on June 5, 2023. All comparative studies assessing pain response in patients with bone metastases from solid tumors who underwent cEBRT or SBRT were included. In total, 8 RCTs were included (Berwouts, 2015; Mercier, 2023; Nguyen, 2019; Pielkenrood, 2021; Ryu, 2023; Sahgal, 2021; Sakr, 2020; Sprave, 2018). Measured outcomes were overall pain response rates, complete pain response, local tumor control and progression-free survival, toxicity, pathological fractures, quality of life, and overall survival. Pain response was measured 1, 3, 6, 9 and 12 months after treatment. Bindels (2024) reported “overall pain response”, in line with the international consensus on palliative RT (complete response defined as a pain score of 0 on a scale from 0 to 10, without an increase in pain medication use; partial response a decline of at least 2 points or decline of an (oral morphine equivalent dose) OMED of at least 25%, or both.)
Risk of bias of the individual studies was assessed with the Cochrane risk of bias tool, but blinding of patients, clinicians or investigators was not reported and they assumed no blinding/masking was applied in the studies. For the outcome pain we assumed this could have introduced a potential risk of bias.
Bindels (2024) assessed seven trials used for analysis in their study, to have a low risk of bias or some methodological concerns, and one was considered to be at high risk of bias. Only RCTs were included in the meta-analysis.
Table 1. Characteristics of included studies in Bindels 2024.
|
Author, year |
No of patients |
cEBRT dose (Gy/fx) |
SBRT dose (Gy/fx) |
SBRT dose (BED10, Gy) |
Dose gradient inside the PTV in SBRT |
|
Berwouts 2015 |
30 |
8/1 |
16/1 |
41.6 |
PTV Dmax≤112.5% PD |
|
Mercier 2023 |
126 |
8/1 |
20/1 |
60.0 |
|
|
Nguyen 2019 |
160 |
30/10 |
12/1, 16/1 |
26.4, 41.6 |
PTV Dmax<115% PD |
|
Pielkenrood 2021 |
110 |
8/1, 20/5, 30/10 |
18/1, 30/3, 35/5 |
50.4, 60.0, 59.5 |
PD to the visible metastasis and ≤50% PD to the bony com- partment |
|
Ryu 2023 |
353 |
8/1 |
16/1, 18/1 |
41.6, 50.4 |
No rules |
|
Sakr 2020 |
22 |
20/5 |
27/3 |
51.3 |
Not available |
|
Sahgal 2021 |
229 |
20/5 |
24/2 |
52.8 |
PTV Dmax≤150% PD |
|
Sprave 2018 |
60 |
30/10 |
24/1 |
81.6 |
PD at the 80% isodose |
BED10 biological equivalent dose with α/β=10; cEBRT conventional external body radiotherapy; Dmax, maximum dose; ICPRE international consensus pain response endpoints; NRS numerical rating scale; PD prescribed dose; PTV planning target volume; SBRT stereotactic body radiotherapy
Results
1. Pain (critical)
Bindels (2024) reported the overall pain response rates at 3 months (figure 1) and 6 months (figure 2) separately.
3 months
Seven studies reported about the overall pain response rates at 3 months (Nguyen, 2019; Ryu, 2023; Sakr, 2020; Sahgal, 2021; Pielkenrood, 2021; Mercier, 2023; Sprave, 2018). A relative risk of 1.19 (95%CI 0.96 to 1.47) was found (Figure 1a). This effect estimate does not exceed the threshold of clinical relevance (i.e. RR>1.25), and the confidence interval includes ‘no effect’. Ryu 2023 confirmed the findings published in Ryu 2019: the results of NRG Oncology/RTOG 0631 RCT showed that the pain response at 3 months favored cEBRT (41.3% for SRS vs 60.5% for cEBRT; difference, -19 percentage points; 95% CI, -32.9 to -5.5).
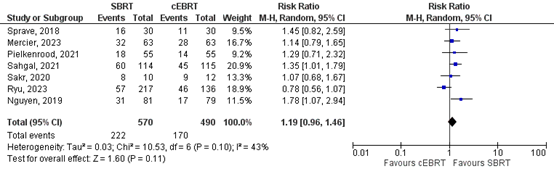
Figure 1a. Forest plot for overall pain response rates at 3 months
Five studies reported about complete pain response (Figure 1b). A relative risk of 1.80 (95%CI 1.15 to 2.82) was found (Bindels, 2014). This effect estimate exceeds the threshold of clinical relevance (i.e. RR>1.25).
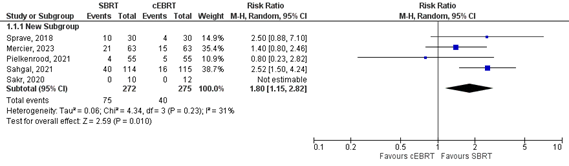
Figure 1b. Forest plot for complete pain response rates at 3 months
6 months
Four studies reported about the overall pain response rates at 6 months (Nguyen, 2019; Ryu, 2023; Sahgal, 2021; Sprave, 2018). A relative risk of 1.22 (95%CI 0.96 to 1.54) was found. This effect estimate does not exceed the threshold of clinical relevance (i.e. RR>1.25), and the confidence interval includes ‘no effect’.
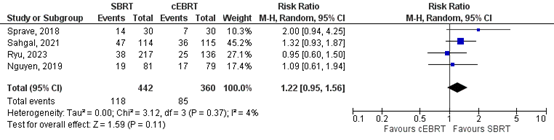
Figure 2. Forest plot for overall pain response rates at 6 months
Two studies reported about complete pain response at 6 months. In both studies, complete pain response at 6 months was higher in the SBRT group when compared to the cEBRT. Sprave (2018) found a RR of 5.00 (95% CI 1.19 to 20.92) and Sahgal (2021) found a RR 2.07 (1.26 to 3.42). (pooled effect estimate: RR 2.47, 95% CI 1.24 to 4.91). This effect estimate exceeds the threshold of clinical relevance (i.e. RR>1.25) (Bindels, 2024).
2. Quality of life (important)
Both Ito (2022) and Bindels (2024) included studies that reported the health-related quality of life with the European Organization for Research and Treatment of Cancer Quality of Life Questionnaire (EORTC QLQ) or another instrument (Table 2).
Seven quality of life instruments showed no significant difference between SBRT and cEBRT, two instruments favored SBRT, and three instruments favored cEBRT. Due to heterogeneity in measurement methods and follow-up, data were not pooled and no formal GRADE assessment was performed. Instead, study limitations among other relevant aspects were taken into account in formulating conclusions.
Table 2. Overview of studies in Ito (2022) reporting quality of life.
|
Study |
Quality of life instrument |
|
Nguyen, 2019 |
A quality-life-adjusted survival (using the Q-TWiST method): significantly higher in SBRT |
|
Berwouts, 2015 |
|
|
Ryu, 2019 |
|
|
Sahgal, 2021 |
|
|
Pielkenrood, 2021 |
|
|
Sprave, 2018 |
|
Abbreviations: EORTC QLQ: European Organization for Research and Treatment of Cancer Quality of Life Questionnaire; Q-TwiST: quality-adjusted time without symptoms of disease and toxicity; FACT-G: functional assessment of cancer therapy–general; QSC-R10: questionnaire on stress in cancer patients
3. Complications (important)
Ito (2022) reported pain flares, neurological injuries, and other severe adverse events. Bindels (2024) reported general toxicity and pathologic fractures. Radiation myelopathy was not confirmed in any study.
General toxicity
Six RCTs reported on toxicity rates (Bindels, 2024), defined as G3 or higher according to Common Terminology Criteria for Adverse Events (CTCAE) versions 3.0 to 6.0. None of them found a statistically significant difference between cEBRT and SBRT (Bindels, 2024). The incidence of toxicity after radiotherapy varied between the RCTs from 0% (Pielkenrood 2021) to 19% (Ryu, 2023).
Ito (2022) reported general toxicity, excluding fractures, pain flares and neurological injuries. Severe adverse events (³ grade 3) were experienced in 29 of the 497 patients (5.8%) who underwent SBRT as compared to 21 of the 415 patients (5.1%) who received cEBRT (RR=1.15, 95%CI 0.67 to 1.99). This difference does not exceed the threshold of clinical relevance (i.e. RR>1.25) and the confidence interval includes ‘no effect’.
Fractures
Ito (2022) reported that 24 of the 427 patients (5.6%) who underwent SBRT experienced pathological fractures as compared to 26 of 345 patients (7.5%) who received cEBRT (RR=0.75, 95%CI 0.44 to 1.28). This difference exceeds the threshold of clinical relevance (i.e. RR<0.8) favoring SBRT, but the confidence interval includes ‘no effect’.
Pain flares
Ito (2022) found that pain flares were reported in 10 of the 159 patients (6.3%) who underwent SBRT as compared to 6 of the 160 patients (3.8%) who received cEBRT (RR=1.68, 95%CI 0.62 to 4.50). This difference exceeds the threshold of clinical relevance (i.e. RR>1.25) favoring cEBRT, but the confidence interval includes ‘no effect’.
Neurological injuries
Neurological injuries (grade 1-2 neuropathy) was reported in 21 of the 217 patients (9.6%) who underwent SBRT as compared to 11 of the 136 patients (8.1%) who received cEBRT (RR=1.20, 95%CI 0.60 to 2.40). This difference does not exceed the threshold of clinical relevance (i.e. RR>1.25) and the confidence interval includes ‘no effect’ and ‘a large effect’. (Ito, 2022)
4. Survival
No survival differences were found between the SBRT and cEBRT arms in any of the studies. Median survival time ranged from 6.7 months to 7.9 months. (Bindels, 2024; Ito, 2022)
Level of evidence of the literature
According to GRADE, systematic reviews of RCTs start at a high level of evidence.
- Pain (crucial)
The level of evidence regarding the outcome measure pain (at 3 months and 6 months) was downgraded by two levels to low because of concerns regarding study quality (-1, risk of bias due to the absence of blinding of patients, clinicians and outcome assessors) and the 95% confidence interval enclosed both a clinically relevant effect and no effect (-1, imprecision).
- Quality of life (important)
The level of evidence regarding the outcome measure quality of life was assessed to be very low, due to serious risk of bias and inconsistency. We could not determine the direction of an, if any, effect.
- Complications
The level of evidence regarding the outcomes measure complications (pathological fractures, pain flares, neurological injuries and other severe adverse events) was downgraded by three levels to very low because the 95% confidence interval enclosed both a clinically relevant effect favouring SBRT and a clinically relevant effect favouring cEBRT (-3, very serious imprecision).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of high-dose radiotherapy/stereotaxis on pain, fracture risk, skeletal related events (SRE), quality of life and toxicity compared to conventional radiotherapy with standard doses in patients with bone metastasis and pain?
P: Patients with bone metastases and pain
I: High dose radiotherapy/ stereotactic radiotherapy: 5 x 7 Gy up to 1 x 24 Gy
C: Standard dose conventional radiotherapy: 1 x 8 Gy; 5 x 4 Gy, 10 x 3 Gy
O: Pain, fracture risk, skeletal related events (SRE), quality of life, toxicity
Relevant outcome measures
The guideline working group considered pain as a critical outcome measure for decision making, and fracture risk, skeletal related events (SRE), quality of life, and toxicity as important outcome measures for decision making.
Following international criteria, the working group defined a clinically (patient) important pain response as:
- a decrease in the initial pain score by at least 2 points (on a Visual Analogue Scale (VAS) from 0-10), without analgesic increase
or
- a decrease of ≥25% in analgesic use without an increase in pain score.
A difference of 25% in the relative risk for dichotomous outcomes (RR < 0.8 or > 1.25), and 0.5 SD or -0.5 < SMD > 0.5 for continuous outcomes was taken as a minimal clinically (patient) important difference.
The guideline working group considered the full context of the clinical question and balanced potential favorable effects of the interventions against the potential unfavorable effects.
Search and select (Methods)
Initial search and select
Three studies were initially selected by the working group based on their knowledge of the literature. After reading the full text, two studies were excluded (see the table with reasons for exclusion under the tab Methods), and one systematic review was included in the literature summary (Ito 2022). This systematic review has been published recently and the working group waived an additional search on this topic when considering efficient use of time and resources. According to the best of their knowledge, no additional trials were published, but they identified a full paper of a trial included in the systematic review (Ryu 2023) and an abstract about the results of the Robomet trial (Mercier, 2023). Ryu 2023 was then added to summary of the literature.
Update – January 2024
In January 2024, the systematic review of Bindels was accepted for publication (“Stereotactic body and conventional radiotherapy for painful bone metastases - an update of current systematic reviews and meta-analyses”). The working group decided to incorporate the findings of this systematic review in the literature review. No additional RCTs were found in this systematic review, but the abstract published by Mercier 2023 and the full paper from Ryu was included in the analyses.
Results
Two systematic reviews were included in the analysis of the literature (Bindels 2024; Ito 2022). Ito was used for the more detailed information about quality of life and toxicity. Study characteristics and results summarized in the evidence tables were drawn from Ito 2022. The assessment of the risk of bias is summarized in the table of quality assessment.
Referenties
- 1 - Bindels BJJ, Mercier C, Gal R, Verlaan JJ, Verhoeff JJC, Dirix P, Ost P, Kasperts N, van der Linden YM, Verkooijen HM, van der Velden JM. Stereotactic Body and Conventional Radiotherapy for Painful Bone Metastases: A Systematic Review and Meta-Analysis. JAMA Netw Open. 2024 Feb 5;7(2):e2355409. doi: 10.1001/jamanetworkopen.2023.55409. PMID: 38345820
- 2 - Ito K, Saito T, Nakamura N, Imano N, Hoskin P. Stereotactic body radiotherapy versus conventional radiotherapy for painful bone metastases: a systematic review and meta-analysis of randomised controlled trials. Radiat Oncol. 2022 Sep 13;17(1):156. doi: 10.1186/s13014-022-02128-w. PMID: 36100905; PMCID: PMC9472415.
- 3 - Pielkenrood BJ, van der Velden JM, van der Linden YM, Bartels MMT, Kasperts N, Verhoeff JJC, Eppinga WSC, Gal R, Verlaan JJ, Verkooijen HML. Pain Response After Stereotactic Body Radiation Therapy Versus Conventional Radiation Therapy in Patients With Bone Metastases-A Phase 2 Randomized Controlled Trial Within a Prospective Cohort. Int J Radiat Oncol Biol Phys. 2021 Jun 1;110(2):358-367. doi: 10.1016/j.ijrobp.2020.11.060. Epub 2020 Dec 14. PMID: 33333200.
- 4 - Rich SE, Chow R, Raman S, Zeng KL, Lutz S, Lam H, et al. Update of the systematic review of palliative radiation therapy fractionation for bone metastases. Radiother Oncol 2018; 126: 547-57.
- 5 - Ryu S, Deshmukh S, Timmerman RD, Movsas B, Gerszten P, Yin FF, Dicker A, Abraham CD, Zhong J, Shiao SL, Tuli R, Desai A, Mell LK, Iyengar P, Hitchcock YJ, Allen AM, Burton S, Brown D, Sharp HJ, Dunlap NE, Siddiqui MS, Chen TH, Pugh SL, Kachnic LA. Stereotactic Radiosurgery vs Conventional Radiotherapy for Localized Vertebral Metastases of the Spine: Phase 3 Results of NRG Oncology/RTOG 0631 Randomized Clinical Trial. JAMA Oncol. 2023 Jun 1;9(6):800-807. doi: 10.1001/jamaoncol.2023.0356.
- 6 - Van der Velden J, Willmann J, Spa?ek M, Oldenburger E, Brown S, Kazmierska J, Andratschke N, Menten J, van der Linden Y, Hoskin P. ESTRO ACROP guidelines for external beam radiotherapy of patients with uncomplicated bone metastases. Radiother Oncol. 2022 Aug;173:197-206. doi: 10.1016/j.radonc.2022.05.024. Epub 2022 May 31.PMID: 35661676
- 7 - Westhoff PG, de Graeff A, Monninkhof EM, Pomp J, van Vulpen M, Leer JW, Marijnen CA, van der Linden YM; Dutch Bone Metastasis Study Group. Quality of Life in Relation to Pain Response to Radiation Therapy for Painful Bone Metastases. Int J Radiat Oncol Biol Phys. 2015 Nov 1;93(3):694-701. doi: 10.1016/j.ijrobp.2015.06.024. Epub 2015 Jun 20. PMID: 26281825
Evidence tabellen
Research question: What are the (un)favorable effects of high-dose radiotherapy/stereotaxis on pain, fracture risk, skeletal related events (SRE), quality of life and toxicity compared to conventional radiotherapy with standard doses in patients with bone metastasis and pain?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Ito, 2022
(individual study characteristics deduced from Ito, 2022]
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to January/2022
A: Nguyen, 2019 B: Berwouts, 2015 C: Ryu, 2019 D: Sakr, 2020 E: Sahgal, 2021 F: Pielkenrood, 2021 G: Sprave, 2018
Study design: RCT
Setting and Country: Not reported for individual studies.
Source of funding and conflicts of interest: Not reported for individual studies.
|
Inclusion criteria SR: - Randomized controlled trials (RCTs) comparing SBRT with cEBRT for bone metastases - Sample size of ³ 10 patients in each arm
Exclusion criteria SR: Not reported.
7 studies included
Important patient characteristics at baseline: Number of patients A: 81 vs 79 B: 15 vs 15 C: 217 vs 136 D: 10 vs 12 E: 114 vs 115 F: 55 vs 55 G: 30 vs 30
Groups probably not comparable at baseline |
SBRT (stereotactic body radiotherapy)
A: 12 Gy, 16 Gy B: 16 Gy C: 16 Gy, 18 Gy D: 27 Gy E: 24 Gy F: 18 Gy, 30 Gy, 35 Gy G: 24 Gy
|
cEBRT (conventional external body radiotherapy)
A: 30 Gy B: 8 Gy C: 8 Gy D: 20 Gy E: 20 Gy F: 8 Gy, 20 Gy, 30 Gy G: 30 Gy
|
End-point of follow-up (median) A: Not available B: 6 months C: Not available D: Not available E: 6.7 months F: within 3 months G: mean 8.1 months
For how many participants were no complete outcome data available? Not reported.
|
Overall pain response Three months Effect measure: RR [95% CI]: A: 1.78 (1.07 to 2.94) B: 1.12 (0.60 to 2.11) C: 0.80 (0.57 to 1.11) D: 1.07 (0.68 to 1.67) E: 1.35 (1.01 to 1.79) F: 1.29 (0.71 to 2.32) G: 1.45 (0.82 to 2.59)
Pooled effect (random effects model): 1.19 [95% CI 0.93 to 1.53] favoring SBRT Heterogeneity (I2): 37%
Six months Effect measure: RR [95% CI]: A: 1.09 (0.61 to 1.94) C: 0.91 (0.52 to 1.59) E: 1.32 (0.93 to 1.87) G: 2.00 (0.94 to 4.25)
Pooled effect (random effects model): 1.24 [95% CI 0.82 to 1.87] favoring SBRT Heterogeneity (I2): 2%
Fracture risk Pathological fractures SBRT: 24/427 (5.6%) cEBRT: 26/345 (7.5%) RR=0.75, 95%CI 0.44 to 1.28
Vertebral compression fractures SBRT: 22/331 (6.6%) cEBRT: 25/251 (10%) RR=0.67, 95%CI 0.39 to 1.16
Quality of life Seven quality of life instruments showed no significant difference between SBRT and cEBRT, two instruments favored SBRT, and three instruments favored cEBRT
Toxicity Radiation myelopathy Not confirmed
Pain flares SBRT: 10/159 (6.3%) cEBRT: 6/160 (3.8%) RR=1.68, 95%CI 0.62 to 4.50
Neurological injuries (grade 1-2 neuropathy) SBRT: 21/217 (9.6%) cEBRT: 11/136 (8.1%) RR=1.20, 95%CI 0.60 to 2.40)
Other severe adverse events (³ grade 3) SBRT: 29/497 (5.8%) cEBRT: 21/415 (5.1%) RR=1.15, 95% 0.67 to 1.99 |
Risk of bias (high, some concerns or low): Tool used by authors: Cochrane risk of bias tool
A: Some concerns B: Low C: Low D: High E: Low F: High G: Low
Author’s conclusion The superiority of SBRT over cEBRT for pain palliation in bone metastases was not confirmed in this meta-analysis. Although SBRT is a standard of care for bone metastases, patients receiving SBRT should be selected appropriately.
Limitations - No access individual patient data: heterogenous population analysed as single population - Moderate to strong heterogeneity - Only two phase III trials with conflicting results
Sensitivity analyses None
Heterogeneity: Moderate to strong heterogeneity (assessed with Cochran’s Q test and I2 index)
|
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported
Yes/no/unclear |
|
Ito, 2022 |
Yes. Research question and inclusion criteria were clear. |
Yes. Search period and strategy were reported. PubMed was searched. |
No. Only mentioned that studies were excluded based on abovementioned criteria. |
No. Only limited information available about characteristics of participants included in these studies. |
Not applicable. |
Yes. Risk of bias of individual studies assessed with Cochrane risk of bias tool.
|
Yes. Heterogeneity was assessed using Cochran’s Q test and I2 index. |
Yes. Publication bias was assessed with a funnel plot. |
No. No conflicts of interest reported for individual studies. |
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Behroozian T, Navarro I, Hoskin P, Johnstone C, Recht A, Menten J, Oldenburger E, van der Linden Y, van der Velden JM, Nguyen QN, Simone CB 2nd, Johnstone P, Lutz S, Milton L, Andratschke N, Willmann J, Kazmierska J, Spałek M, Chow E, Raman S. Update on the systematic review/meta-analysis of uncomplicated bone metastases treated with external beam radiation. Radiother Oncol. 2022 Sep;174:109-110. doi: 10.1016/j.radonc.2022.07.010. Epub 2022 Jul 16. PMID: 35850265. |
Editorial |
|
Song X, Wei J, Sun R, Jiang W, Chen Y, Shao Y, Gu W. Stereotactic Body Radiation Therapy Versus Conventional Radiation Therapy in Pain Relief for Bone Metastases: A Systematic Review and Meta-Analysis. Int J Radiat Oncol Biol Phys. 2023 Mar 15;115(4):909-921. doi: 10.1016/j.ijrobp.2022.10.017. Epub 2022 Oct 21. PMID: 36273520. |
More suitable systematic review available (also included cohort studies and retrospective studies). All included studies were also included in Ito 2022 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-11-2024
Beoordeeld op geldigheid : 10-10-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Het initiatief voor deze richtlijn is afkomstig van Nederlandse Orthopaedische Vereniging (NOV). De richtlijn is opgesteld door een multidisciplinaire commissie met vertegenwoordigers vanuit de orthopedisch chirurgen, radiotherapeuten, radiologen, nucleair geneeskundigen, internist-oncologen, en chirurgen/traumatologen.
Het perspectief van patiënten werd ingebracht door een vertegenwoordiger van de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) samen met een aantal patiënten. Zie hiervoor ook de samenstelling van de werkgroep.
Werkgroep
- Dr. J.J.W. Ploegmakers, orthopedisch chirurg, Universitair Medisch Centrum Groningen, NOV (voorzitter)
- Dr. P.G. Westhoff, radiotherapeut-oncoloog, Radboud UMC Nijmegen, NVRO (vice-voorzitter)
- Dr. E.F. Dierselhuis, orthopedisch chirurg, Radboud UMC Nijmegen, NOV
- Drs. B. Meesters, traumachirurg, Zuyderland Medisch Centrum, NVVH NVT
- Dr. C.S.P. van Rijswijk, interventieradioloog, Leids Universitair Medisch Centrum, NVVR
- Dr. F. Intema, nucleair geneeskundige, Rijnstate Ziekenhuis, NVNG
- Prof. Dr. Y.M. van der Linden, radiotherapeut-oncoloog, Leids Universitair Medisch Centrum, NVRO
- Dr. mr. J.J. de Haan, internist-oncoloog, Universitair Medisch Centrum Groningen, NIV
- W. van der Veen, namens Borstkankervereniging Nederland (BVN) (tot juni 2023)
- E. Walrave, namens Longkanker Nederland (tot januari 2022)
- J. Rijlaarsdam, namens Longkanker Nederland (van februari 2022 tot september 2022)
- Dr. K.M. Holtzer, Nederlandse Federatie van Kankerpatiëntenorganisaties (vanaf september 2022)
Met ondersteuning van
- Dr. M.A. Pols, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs M. Oerbekke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot september 2022)
- Dr. J. Boschman, senior adviseur (vanaf september 2022)
- I. van Dusseldorp, senior informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Wilma van der Veen heeft namens de NFK/BVN een waardevolle bijdrage geleverd aan de totstandkoming van deze richtlijnmodules. Helaas heeft zij de afronding van de richtlijn niet meer mee mogen maken. De werkgroep is Wilma dankbaar voor de prettige en open samenwerking en heeft bewondering voor de manier waarop zij zich heeft ingezet voor huidige en toekomstige patiënten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
E. Dierselhuis
|
Orthopedisch chirurg |
Opleidingscommissie Nederlandse Orthopedische Vereniging (onbetaald) |
Betrokken bij onderzoek naar BOS-score (niet commercieel)
|
Geen restricties |
|
J. de Haan
|
Internist-oncoloog |
Geen |
Betrokken bij onderzoek van Astellas, Boehringer, Cogent, Incyte, Inhibrx, Zentalis, Zymeworks (geen relatie met onderwerp richtlijn, geen persoonlijke vergoeding) |
Geen restricties |
|
F. Intema |
Nucleair geneeskundige |
Geen |
Geen |
Geen restricties |
|
Y. van der Linden
|
Radiotherapeut-oncoloog. Hoofd expertisecentrum palliatieve zorg. |
Course director ESTRO cursus Palliative Care and Radiotherapy |
Betrokken bij onderzoek naar BOS-score (niet commercieel) AlpduZes UL 2013-6286 OPTIMAL study |
Geen restricties |
|
B. Meesters
|
Traumachirurg |
Bestuurslid Nederlandse Vereniging voor Trauma Chirurgie |
Geen |
Geen restricties |
|
J. Ploegmakers |
Orthopedisch chirurg |
Geen |
Stryker, 3M: honorarium dienstverlening (2020, 2021, geen relatie met onderwerp richtlijn)
|
Geen restricties |
|
J. Rijlaarsdam
|
Panellid Longkanker Nederland. Onbezoldigd |
Geen |
Geen |
Geen restricties |
|
C. van Rijswijk |
Interventieradioloog |
Geen |
PI van FLOW-project (met Philips): geen relatie met botmetastasen. W.L. Gore & Associates: honorarium dienstverlening (2021, 2022, geen relatie met onderwerp richtlijn Cordis Netherlands: honorarium dienstverlening (2022, geen relatie met onderwerp richtlijn) |
Geen restricties |
|
W. van der Veen |
Patient advocate Borstkankervereniging Nederland, onbetaald |
Vrijwilliger Abrona, dagbesteding, onbetaald |
Geen |
Geen restricties |
|
P. Westhoff |
Radiotherapeut-oncoloog |
Geen |
Betrokken bij onderzoek naar BOS-score (niet commercieel) |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname in de werkgroep van vertegenwoordigers vanuit patiëntenverenigingen en van de Nederlandse Federatie van Kankerpatiëntenorganisaties. De vertegenwoordigers zijn betrokken bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen en aanbevelingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan betrokken patiëntenverenigingen en de eventueel aangeleverde commentaren zijn besproken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Lokale behandeling – radiotherapeutische behandeling van pijn |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met botmetastasen door middel van een schriftelijke knelpuntenanalyse. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn Botmetastasen (IKNL, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de NVRO, IGJ, KNGF, NVKF, NVRO, NVKG. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van de specifieke uitgangsvraag zijn genoemd bij de overwegingen. Een aantal bijkomende aspecten van de organisatie van zorg worden behandeld in de modules Ondersteunende zorg en Multidisciplinaire zorg.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënten)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
