Nacontrole na een borstreconstructie
Uitgangsvraag
Hoe dient de nacontrole georganiseerd te zijn na een borstreconstructie?
Aanbeveling
Bij patiënten met borstreconstructie na ablatieve therapie i.v.m. borstkanker:
- Verwijs de patiënt terug naar de verwijzer of naar het mammateam, dat de oncologische controle uitvoert.
- Oncologische controle vindt daar plaats conform de Richtlijn Borstcarcinoom (NABON, 2012) d.m.v. klinisch borstonderzoek van de gereconstrueerde borst en klinisch borstonderzoek met mammografie van de contralaterale borst.
- Doe na een borstreconstructie geen nacontrole van de gereconstrueerde borst met mammografie, echografie of MRI; doe dit alleen bij symptomen.
Bij patiënten met borstreconstructie na borstsparende therapie of contralaterale borstreconstructie:
- Verwijs de patiënt terug naar de verwijzer of naar het mammateam, dat de oncologische controle uitvoert.
- Oncologische controle vindt daar plaats conform de Richtlijn Borstcarcinoom (NABON 2012) d.m.v. klinisch borstonderzoek en mammografie.
Bij hoog-risico patiënten met borstreconstructie na profylactische ablatio:
- Verwijs de patiënt terug naar de verwijzer, het mammateam of de polikliniek erfelijke tumoren.
- Oncologische controle vindt daar plaats d.m.v. klinisch borstonderzoek.
- Doe na een borstreconstructie geen nacontrole met mammografie, echografie of MRI, doe dit alleen bij symptomen.
- Bespreek de mogelijkheid van verwijzing naar maatschappelijk werker of psycholoog.
Bij alle patiënten:
- Bespreek met de patiënt met wie zij contact moet opnemen, als zij een nieuwe afwijking aan de geopereerde of aan de niet geopereerde borst heeft bemerkt.
- Bespreek een patiënt met een lokaal recidief altijd op het MDO.
Overwegingen
De indicatie voor follow-up in de betekenis van nacontrole hangt af van het restrisico op borstkanker of lokaal recidief, de sensitiviteit van de screeningsmethode en de kans op het bereiken van een gunstig effect op de overleving.
In de tekst is hiervoor gebruik gemaakt van de meta-analyse van Gieni et al (2012), gebaseerd op 10 retrospectieve cohortstudies en secundaire referenties en de review van Zakhireh et al (2010), die gebaseerd is op de algemene voorwaarden voor screening. Voor overige aspecten werden oorspronkelijke onderzoeken gebruikt.
a) Borstreconstructie na ablatio i.v.m. borstkanker (zie ook H3 Reconstructietechnieken)
Als de borstreconstructie heeft plaatsgevonden i.v.m. primaire borstkanker, of na salvage mastectomie bij een lokaal recidief, kan ook (weer) een lokaal recidief optreden. Zelfs primaire borstcarcinomen kunnen nog optreden, omdat niet altijd al het klierweefsel blijkt te zijn verwijderd. De lokaal recidieven treden op in het subcutane weefsel anterieur van de gereconstrueerde borst of in de diepere lagen, tegen de m. pectoralis major en de thoraxwand. Uit een retrospectieve studie bleek, dat ondanks het feit, dat het tijdstip van detectie hetzelfde was bij beide typen, de prognostische betekenis van de diepe lokaal recidieven ongunstiger is met hoger percentage afstandsmetastasen en lagere overleving (Langstein et al, 2003).
Enerzijds draagt het toenemend gebruik van adjuvante behandeling bij aan afname van het lokaal recidief percentage, anderzijds wordt door neoadjuvante chemotherapie mogelijk gemaakt, dat ook locaal uitgebreide carcinomen voor in opzet curatieve behandelingen met ablatie en reconstructie in aanmerking komen. Er werd berekend dat het percentage lokaal recidieven na ablatio en borstreconstructie gelijk is als na een mastectomie alleen (4,5–7%); er zijn geen aanwijzingen dat dit toeneemt bij een tepelsparende ingreep. Wel lijkt sprake van een oververtegenwoordiging van vrouwen met prognostisch ongunstige risicofactoren met betrekking tot het ontwikkelen van een lokaal recidief, zoals leeftijd jonger dan 35 jaar, T4 of T3 met positieve lymfklieren, positieve snijranden, meer dan 4 positieve klieren, Yp T3 met positieve klieren, initieel stadium IIIb met complete respons na neoadjuvante chemotherapie of stadium III met residuale tumor in klieren of borst (Zakhireh et al, 2010).
Tabel 1
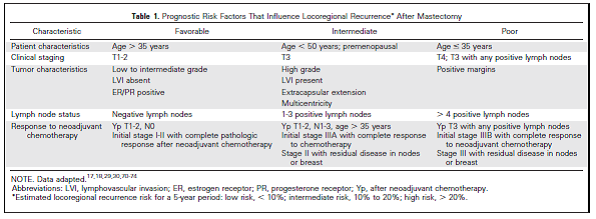
De meeste lokaal recidieven treden op in de eerste jaren na de ingreep, maar ook 10 jaar na de ingreep worden nog nieuwe lokaal recidieven gedetecteerd (Helvie et al, 2002). Ze worden meestal gevonden door middel van klinisch borstonderzoek: veranderingen in het litteken, huidafwijkingen en palpabele afwijkingen bij de oppervlakkige lokaal recidieven, pijn en malaise bij de diep gelegen lokaal recidieven. Op grond van deze symptomen leiden beeldvormend onderzoek en punctie in tweede instantie tot de uiteindelijke diagnose.
Beeldvormende techniek:
In de Richtlijn Borstcarcinoom wordt echografie als screeningsmethode niet geadviseerd (NABON, 2012). Er zijn ook geen studies geselecteerd, waarin dit werd onderzocht. Jaarlijks mammografisch onderzoek na iedere autologe reconstructie wordt in individuele studies weleens aanbevolen (Helvie et al, 2002), maar de detectie van een lokaal recidief bedraagt 0-1,9% en is te laag om dit te ondersteunen. Om MRI als screeningsmodaliteit in te zetten zou tenminste een lifetime risico (LTR)van 25% of meer aanwezig moeten zijn en hiervan is geen sprake (Zakhireh et al, 2010). Zij bepleiten wel nacontrole door middel van mammografie te overwegen bij die groep patiënten, waarbij het RR tenminste 2% per jaar bedraagt. Deze opvatting wordt niet gedeeld door de NABON (2012) en ook niet door Gieni et al (2012); door de kleine, retrospectieve series is echter geen zekere uitspraak mogelijk en is er geen evidence om te screenen met beeldvormende diagnostiek. Daarom is nacontrole met klinisch borstonderzoek bij de gehele populatie het onderzoek van keuze.
b) Borstreconstructie na profylactische ablatio bij hoog risico patiënten (zie ook H6 hoog risico patiënten)
BRCA 1 en 2 genmutatiedraagsters hebben een LTR om borstkanker te ontwikkelen van 60-85%. Na preventieve ablatio met reconstructie neemt dit LTR af naar 3-9% (vergelijk: het LTR in de gewone populatie bedraagt 11-13%).
De meeste carcinomen zullen optreden in het direct onder de huid gelegen subcutane vet als palpabele tumoren (50-72%), de overige zullen beginnen als een niet-palpabele tumor. Het LTR op een niet-palpabele tumor bedraagt 1-4%; dit is veel lager dan de geaccepteerde screeningsdrempel, zowel met mammografie als met MRI ( Zakhireh et al, 2010). Dit is conform de Richtlijn Borstcarcinoom (NABON, 2012).
De (jonge) hoog risico patiënten zijn een relatief kwetsbare groep en kunnen ook lange tijd na de profylactische ablatio problemen ervaren met de veranderingen van het lichaamsbeeld en de negatieve gevolgen hiervan op het zelfvertrouwen, intimiteit en de partnerrelatie (den Heijer et al, 2012; Gopie et al, 2013). Het is daarom van belang dit te bespreken tijdens de nacontrole en bij psychische problemen de weg te wijzen naar maatschappelijk werker of psycholoog (zie ook de module Borstreconstructie en systemische therapie).
c) Behandeling lokaal recidief of primaire borstkanker na reconstructie
Een patiënt met een lokaal recidief moet altijd besproken worden in het MDO.
Onderbouwing
Achtergrond
Nacontrole is gedefinieerd als de programmatische aanpak van nazorg die bestaat uit terugkerende contacten tussen de patiënt en zijn behandelaren (Gezondheidsraad, 2007).
In geval van oncologische nacontrole zijn van belang:
- Factoren bepalend voor de kans op een primair carcinoom of een lokaal recidief;
- Waarde van de detectie;
- Methode van detectie.
Het doel van deze nacontrole is het bereiken van een gunstig effect op de overleving. Omdat soms het lokaal recidief moet worden opgevat als uiting van gemetastaseerde ziekte en soms als een geïsoleerde bevinding, bestaan hierover nog veel onzekerheden.
In geval van plastisch chirurgische nacontrole is hierbij van belang:
- Signalering en behandeling van de gevolgen van de ingreep: niet-carcinoom gerelateerde klachten, directe en late complicaties.
Samenvatting literatuur
Uit de 231 gevonden zoekresultaten voldeed geen studie aan de selectiecriteria.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende vraagstelling:
Bij patiënten met borstreconstructie na ablatieve therapie: wat is het effect van nacontrole op de overleving in vergelijking tot geen nacontrole door middel van surveillance?
Zoeken en selecteren (Methode)
In de database Medline (OVID) is gezocht naar radiologische follow-up d.m.v. mammografie, US of MRI bij borstreconstructies na ablatieve therapie. De zoekverantwoording is weergegeven in de bijlage van deze module. De literatuurzoekactie leverde 231 treffers op. Studies die voldeden aan de volgende selectiecriteria zijn opgenomen in de samenvatting van de literatuur: origineel onderzoek; vergelijkend onderzoek (RCT, CCT); vergelijking van radiologische follow-up d.m.v. mammografie, US of MRI versus geen radiologische follow-up bij patiënten met borst-reconstructie na ablatieve therapie; en overleving als uitkomstmaat.
Er is niet gezocht op borstsparende therapie, hiervoor volstaat de Richtlijn Borstcarcinoom (NABON, 2012).
Referenties
- Den Heijer M, Seynaeve C,Timman R, et al. Body image and psychological distress after prophylactic mastectomy and breast reconstruction in genetically predisposed women: a prospective long-term follow-up study.Eur J Cancer. 2012;48:1263-8.
- Gieni M, Avram R, Dickson L, et al. Local breast cancer recurrence after mastectomy and immediate breast reconstruction for invasive cancer: a meta-analysis. The Breast 2012;21:230-6.
- Gopie JP, Mureau MA, Seynaeve C, et al. Body image issues after bilateral prophylactic mastectomy with breast reconstruction in healthy women at risk for hereditary breast cancer. Fam Cancer. 2013;12:479-87.
- Helvie MA, Bailey JE, Roubidoux MA, et al. Mammographic screening of TRAM flap breast reconstruction for detection of nonpalpable recurrent cancer. Radiology 2002;224:211-6.
- Langstein HN, Cheng M-H, Sigletary SE, et al. Breast cancer recurrence after immediate reconstruction: pattern and significance. Plast Reconstr Surg. 2003;111:712-22.
- Nacontrole in de Oncologie. www.gezondheidszorg.nl. Gezondheidsraad Rapport, 2007.
- National Breast Cancer Guideline. www.oncoline.nl/breastcancer. NABON, 2012.
- Zakhireh J, Fowble B, Esserman LJ. Application of screening principles to the reconstructed breast. J Clin Oncol. 2010;28:173-80.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 08-04-2019
Uiterlijk in 2018 bepaalt het bestuur van de Nederlandse Vereniging voor Plastische Chirurgie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Plastische Chirurgie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In 2017 tot 2018
De richtlijnontwikkeling werd ondersteund door J.J.A. de Beer, zelfstandig richtlijnmethodoloog en B. Niël-Weise, zelfstandig richtlijnmethodoloog en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
In 2011 tot 2013
De richtlijnontwikkeling werd ondersteund door B.S. Niël-Weise, arts-microbioloog (n.p.)/epidemioloog, senior adviseur, Kennisinstituut van Medisch Specialisten.
Doel en doelgroep
Doel
Ontwikkelen van een multidisciplinaire kwaliteitsrichtlijn voor borstreconstructies bij vrouwen na borstsparende therapie of ablatio vanwege borstkanker of na een profylactische ablatio.
Doelgroep
De richtlijn beoogt een praktisch handvat te bieden aan plastisch chirurgen en de leden van het multidisciplinair mammateam (oncologisch chirurg, internist-oncoloog, radiotherapeut-oncoloog, radioloog, patholoog, psycholoog, verpleegkundig specialist mammacare-verpleegkundige). Tevens is er een versie voor patiënten ontwikkeld welke zal worden aangepast met de herzieningen in 2018.
Samenstelling werkgroep
Voor het ontwikkelen van de module borstreconstructie en systemische therapie is in 2017 een werkgroep ingesteld, bestaand uit vertegenwoordigers van die specialismen die inhoudelijk direct gerelateerd zijn aan het betreffend onderwerp (zie hiervoor de samenstelling van de werkgroep).
Voor het ontwikkelen van de richtlijn is in oktober 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een borstreconstructie (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Voor de module borstreconstructie en systemische therapie (2017-2018):
Werkgroep
- Dr. M.A.M. Mureau (voorzitter), plastisch chirurg, Erasmus MC Kanker Instituut, Erasmus Universitair Medisch Centrum Rotterdam
- Prof. Dr. R. van der Hulst, plastisch chirurg, Maastricht Universitair Medisch Centrum/Orbis Medisch Centrum/Viecuri Medisch Centrum, Maastricht
- Dr. C.H. Smorenburg, internist-oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
- Mw. C. Willems, Borstkankervereniging Nederland, Utrecht
- Mevr. D. Ligtenberg, Borstkankervereniging Nederland, Utrecht
Meelezers:
- Dr. M.B.E. Menke-Pluijmers, oncologisch chirurg, Albert Schweitzer Ziekenhuis, Dordrecht
- Dr. N.S. Russell, radiotherapeut-oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
- Mw. D. van der Zee, V&VN Verpleegkundig Specialisten, Diakonessenhuis, Utrecht/Zeist.
Met ondersteuning van:
- Mw. B.S. Niël-Weise, arts-microbioloog (niet praktiserend), zelfstandig richtlijnmethodoloog, Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
Voor alle andere teksten (2011-2013):
- Dr. M.A.M. Mureau (voorzitter), plastisch chirurg, Erasmus MC Kanker Instituut, Erasmus Universitair Medisch Centrum Rotterdam
- Prof. Dr. R. van der Hulst, plastisch chirurg, Maastricht Universitair Medisch Centrum/Orbis Medisch Centrum/Viecuri Medisch Centrum, Maastricht
- Dr. L. A.E. Woerdeman, plastisch chirurg, Antoni van Leeuwenhoek / Nederlands Kanker instituut, Amsterdam
- Drs. A.A.W.M Turnhout, plastisch chirurg, Tergooi Ziekenhuis, locatie Hilversum
- Drs. N.A.S. Posch, plastisch chirurg, Haga-ziekenhuis, Den Haag
- Dr. M.B.E. Menke-Pluijmers, oncologisch chirurg, Albert Schweitzer Ziekenhuis, Dordrecht
- Dr. E.J.T. Luiten, oncologisch chirurg, Amphia Ziekenhuis, Breda
- Drs. A.H. Westenberg, radiotherapeut-oncoloog, Arnhems Radiotherapeutisch Instituut, Arnhem
- Dr. J.P. Gopie, psycholoog, Leids Universitair Medisch Centrum, Leiden
- Dr. H.M. Zonderland, radioloog, Academisch Medisch Centrum, Amsterdam
- Drs. M. Westerhof, Borstkankervereniging Nederland, Utrecht
- Mw. E.M.M.Krol-Warmerdam MA, V&VN Verpleegkundig Specialisten, Leids Universitair Medisch Centrum, Leiden
Met ondersteuning van
- Drs. B.S. Niël-Weise, arts-microbioloog (n.p.)/epidemioloog, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Een overzicht hiervan kunt u bij het secretariaat van het Kennisinstituut van Medisch specialisten (KiMS) opvragen en voor de revisie in 2017 bij de Nederlandse Vereniging voor Plastische Chirurgie. Een overzicht van de belangenverklaringen van de werkgroepleden in 2017 vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
Mureau |
Plastisch en reconstructief chirurg |
Voorzitter NVPC; voorzitter commissie kwaliteit; wetenschappelijk commissielid DBIR; lid Clinical Audit Board NBCA.
Behoudens vacatiegeld en km vergoeding zijn deze functies onbetaald. |
geen |
geen |
Voorzitter NVPC |
geen |
geen |
geen |
|
van der Hulst |
Plastisch chirurg |
Werkzaam in de mooi kliniek |
Aandelen in microsure, ontwikkeling robot voor microchirurgie nvty |
geen |
geen |
Hoofdonderzoeker verschillende BREAST trial, gerandomiseerde studie naar effectiviteit en veiligheid lipofilling voor volledige borstreconstructie |
geen |
geen |
|
Smorenburg |
Internist-oncoloog |
Voorzitter richtlijn Borstkanker |
geen |
geen |
geen |
geen |
geen |
geen |
|
Willems |
Namens BVN |
|
|
|
|
|
|
|
|
Ligtenberg |
Namens BVN |
|
|
|
|
|
|
|
|
Hans de Beer |
zelfstandig adviseur richtlijnontwikkeling /richtlijnmethodoloog |
onderzoeker als fellow (onbetaald) |
geen |
geen |
geen |
geen |
geen |
In 2015 en 2016 heb ik workshops over de GRADE-methodiek gegeven bij enkele farmaceuten. Deze activiteiten hebben geen consequenties voor de opdrachtgever of voor het onderhavige project. |
|
Barbara Niël-Weise |
zelfstandig adviseur richtlijnontwikkeling /richtlijnmethodoloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
In 2013 en 2017:
Borstkankervereniging Nederland (BVN) heeft schriftelijk input geleverd tijdens de knelpuntanalyse en in de commentaarfase. Patiënten werden tevens in de werkgroep vertegenwoordigd door een afgevaardigde van Borstkankervereniging Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep, de werkgroepleden en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Borstkankervereniging Nederland (BVN), Zorgverzekeraars Nederland (ZN), College voor Zorgverzekeringen (CvZ) en de Inspectie voor de Gezondheidszorg IGZ via een invitational conference in 2013 en schriftelijk in 2017 . Een verslag van de invitational conference kunt u vinden in de bijlage van deze module.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen [http://www.g-i-n.net/library/international-guidelines-library; www.guideline.gov] en naar systematische reviews [Cochrane Library; Medline]. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
|
|
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
|
|
|
|
|
|
|
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
|
|
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
|
|
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Organisatie van nazorg en nacontrole'.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Hiervoor werd gebruik gemaakt van de methodiek zoals beschreven in Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens werd de richtlijn voorgelegd aan de volgende organisaties ter becommentariëring: Borstkankervereniging Nederland (BVN), Nederlandse Vereniging voor Medische Oncologie (NVMO), Nederlands Huisartsen Genootschap (NHG), Zorgverzekeraars Nederland (ZN), Nederlandse zorgautoriteit (NZA), College voor Zorgverzekeringen (CvZ), Inspectie voor de Gezondheidszorg (IGZ), Achmea, CZ, Menzis en VGZ. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
