Endocriene therapie bij microvasculaire borstreconstructie
Uitgangsvraag
Wat is het beleid rond endocriene therapie bij microvasculaire borstreconstructie?
Aanbeveling
Bespreek met de patiënte voor een geplande microvasculaire borstreconstructie dat het effect op het optreden van microvasculaire complicaties van het al dan niet vier weken preoperatief stoppen van tamoxifen onzeker is.
Overwegingen
Kwaliteit van bewijs
Gezien de aanwezigheid van klinische heterogeniteit werden de data niet gepoold en konden ook geen conclusies worden getrokken. Vandaar dat de kwaliteit van het bewijs ook niet kon worden beoordeeld.
Waarden en voorkeuren
Op grond van eigen ervaring meent de richtlijncommissie dat bijna alle patiënten een voorkeur hebben om preoperatief correct geïnformeerd te worden, zodat ze vervolgens een eigen keuze kunnen maken.
Kosten en middelen
Het toepassen van de aanbevelingen zal naar verwachting van de richtlijncommissie geen effect hebben op de kosten, omdat de aanbevelingen grotendeels al aansluiten bij de huidige praktijk.
Professioneel perspectief
Het is bekend dat bij microchirurgische borstreconstructies met een abdominale lap (TRAM of DIEP) een licht verhoogd risico op het ontstaan van een longembolie bestaat. Met name vrouwen met een BMI>28 en BRCA gendraagsters (waarschijnlijk door dubbelzijdigheid, langere OK duur) hebben extra verhoogd risico op een longembolie (Enajat et al., 2013). Op basis van de conclusies van de literatuurstudie kan geen uitspraak worden gedaan of het gebruik van tamoxifen voorafgaand aan de microchirurgische ingreep het ontstaan van zowel systemische trombo-embolische complicaties als trombose van de microvasculaire anastomose verder verhoogt. Uit andere studies is echter wel bekend dat tamoxifen geassocieerd is met een verhoogd risico op systemische trombo-embolische complicaties (Aronson et al., 2016; Hernandez et al., 2009). Bij aromatase remmers is dit risico minder groot (Margolese et al., 2016). Tamoxifen wordt in de lever omgezet tot actieve metabolieten die een halfwaardetijd van 14 dagen hebben. Aangezien de halfwaardetijd van deze metabolieten 14 dagen bedraagt en deze een verhoogd risico op trombo-embolische complicaties bij microvasculaire chirurgie zouden kunnen geven, kan overwogen worden om minimaal twee keer de duur van de halfwaardetijd, i.e. 4 weken voor de ingreep, te stoppen met de medicatie (Jordan et al., 2007). Deze overweging geldt met name voor de groep vrouwen, zoals hierboven genoemd, die sowieso al een verhoogd risico op het ontstaan van een longembolie hebben. Echter, blijft overeind dat het effect van stoppen met tamoxifen op het risico op micro-complicaties onzeker blijft
Aanvaardbaarheid en haalbaarheid van de aanbeveling(en
Het willen en kunnen toepassen van de aanbevelingen zal naar verwachting van de richtlijncommissie aanvaardbaar zijn voor alle stakeholders, omdat de aanbevelingen louter informatief zijn en ook voor een groot deel aansluiten bij de huidige praktijk.
Balans van gewenste en ongewenste effecten
De balans van gewenste en ongewenste effecten kan niet worden opgemaakt, omdat op basis van bestaand onderzoek geen uitspraak kan worden gedaan worden of tijdelijk stoppen van endocriene therapie voorafgaand aan de ingreep een voordeel biedt ten opzichte van het niet-stoppen van endocriene therapie,
Rationale van de aanbeveling(en)
Leidend bij het opstellen van de aanbevelingen was het ontbreken van wetenschappelijk bewijs.
Onderbouwing
Achtergrond
Wanneer een patiënte wordt behandeld met endocriene therapie en de wens tot een microvasculaire borstreconstructie bestaat, is onvoldoende duidelijk of de endocriene therapie tijdelijk gestaakt dient te worden in verband met een mogelijk verhoogde kans op trombo-embolische complicaties, zowel bij de microanastomose als trombosebeen/longembolie.
Definities
- Endocriene therapie: tamoxifen, aromataseremmers.
Conclusies / Summary of Findings
|
GRADE niet te beoordelen |
Direct of uitgestelde microvasculaire borstreconstructie
Microvasculaire trombotische complicaties, totale lapnecrose, partiële lapnecrose Op basis van bestaand onderzoek kan geen uitspraak gedaan worden of tijdelijk stoppen van endocriene therapie voorafgaand aan de ingreep een voordeel biedt ten opzichte van het niet stoppen van endocriene therapie.
Bron: Salibian et al., 2016; Jokuszies et al., 2013; Kelley et al., 2012; Mirzabeigi et al., 2015 |
|
GRADE niet te beoordelen |
Direct of uitgestelde microvasculaire borstreconstructie
Er werden geen studies geïdentificeerd waarin esthetisch resultaat of patiënttevredenheid werden gehanteerd als uitkomstmaat. |
Samenvatting literatuur
Beschrijving studies
De vier geïncludeerde studies betreffen retrospectieve patiëntenseries ((Salibian et al., 2016; Jokuszies et al., 2013; Kelley et al., 2012; Mirzabeigi et al., 2015) (zie Tabel 1). Geen van de studies was als patiënt-controle of vergelijkend cohortonderzoek opgezet om microvasculaire borstreconstructie tijdens gebruik van endocriene therapie direct te vergelijken met microvasculaire reconstructie waarbij de endocriene therapie voor de ingreep tijdelijk werd gestopt. In de genoemde patiëntenseries worden deelseries van patiënten die wel/geen tamoxifen (in de voorafgaande maand) gebruikten, met elkaar vergeleken. Degenen die geen tamoxifen gebruikten kunnen als een ‘pseudo-controlegroep’ worden getypeerd.
Tabel 1 Studiedesign
|
|
Studiedesign |
Land |
|
Salibian et al., 2016 |
Retrospectieve patiëntenseries |
Eén zorginstelling in de USA |
|
Jokuszies et al., 2013 |
Retrospectieve patiëntenseries |
Eén zorginstelling in Duitsland |
|
Kelley et al., 2012 |
Retrospectieve patiëntenseries |
Eén zorginstelling in de USA |
|
Mirzabeigi et al., 2015 |
Retrospectieve patiëntenseries |
Eén zorginstelling in de USA |
Studiepopulaties
De studies onderzochten patiënten die een vrije DIEP-, (mini)-TRAM- of SIEA-lap borstreconstructie ondergingen (zie tabel 2). In twee studies werden de reconstructies uitgesteld uitgevoerd (Jokuszies et al., 2013; Kelley et al., 2012), in één studie direct of uitgesteld (Salibian et al., 2016) en in de studie van Mirzabeigi et al. (2015) is het tijdstip van reconstructie t.o.v. de mastectomie niet gerapporteerd.
De gemiddelde follow-up duur was 2 tot 2,5 jaar bij Kelley et al. (2012) en Salibian et al. (2016). Jokuszies et al. (2013) en Mirzabeigi et al. (2015) rapporteerden de gemiddelde follow-up duur niet.
Tabel 2 Studiepopulaties
|
|
Inclusiecriteria |
Exclusiecriteria |
|
Salibian et al., 2016 |
Patiënten met een mastectomie die in de afgelopen 20 jaar een vrije DIEP- of (mini)-TRAM-lap borstreconstructie ondergingen; direct of uitgesteld. |
- andere reconstructie-technieken dan DIEP- of TRAM-lap; - wanneer reconstructie-techniek niet in de status vermeld stond; - wanneer relevante gegevens over tamoxifen-status niet in de status vermeld stond. |
|
Jokuszies et al., 2013 |
Patiënten met een mastectomie vanwege borstkanker die in de periode van 2006 tot 2012 een uitgestelde vrije DIEP- of TRAM-lap borstreconstructie ondergingen. |
- niet vermeld. |
|
Kelley et al., 2012 |
Patiënten met een mastectomie vanwege borstkanker die in de periode van 2000 tot 2010 een uitgestelde vrije DIEP-, TRAM- of andere lap borstreconstructie ondergingen. |
- niet vermeld. |
|
Mirzabeigi et al., 2015 |
Patiënten met een mastectomie vanwege borstkanker die in de periode van 2008 tot 2012 een vrije DIEP-, TRAM- of SIEA-lap borstreconstructie ondergingen. |
- andere borstreconstructie-technieken. |
Interventies
In de ‘interventiegroepen’ varieerde het gebruik van tamoxifen tussen de studies (zie tabel 3). In de studie van Salibian et al. (2016) werd tamoxifen tot aan de ingreep gebruikt, in de studies van Jokuszies et al. (2013) en Kelley et al. (2012) gebruikten patiënten tamoxifen gedurende de maand voorafgaand aan de ingreep, en in de studie van Mirzabeigi et al. (2015) werd het gebruik van tamoxifen 2 weken voor de ingreep gestopt en 2 weken na de ingreep herstart. In de ‘pseudo-controlegroepen’ hebben patiënten tamoxifen nooit gebruikt of gebruikten tamoxifen niet tijdens de maand voorafgaand aan de ingreep.
Tabel 3 Interventies
|
|
Interventie |
Pseudo-controle |
|
Salibian et al., 2016 |
Gebruik van tamoxifen in de perioperatieve periode. |
Geen gebruik van tamoxifen in de perioperatieve periode |
|
Jokuszies et al., 2013 |
Gebruik van tamoxifen tijdens de maand voorafgaand aan de ingreep. |
Geen gebruik van tamoxifen tijdens de maand voorafgaand aan de ingreep. |
|
Kelley et al., 2012 |
Gebruik van tamoxifen tijdens de maand voorafgaand aan de ingreep. |
Geen gebruik van tamoxifen tijdens de maand voorafgaand aan de ingreep. |
|
Mirzabeigi et al., 2015 |
a) Gebruik van tamoxifen tot 2 weken voor de ingreep en herstarten 2 weken na de ingreep. b) Gebruik van aromatase-inhibitoren tot aan de dag van de ingreep en herstarten bij ontslag uit het ziekenhuis. |
Geen gebruik van endocriene therapie voorafgaand aan de ingreep. |
Trombotische complicaties
In de vier studies waren de definities van trombotische complicaties allemaal gerelateerd aan microvasculaire trombotische complicaties (zie tabel 4).
Tabel 4 Definities trombotische complicaties
|
Salibian et al., 2016 |
Lapcomplicaties ten gevolge van arteriële insufficiëntie, veneuze congestie, arteriële trombus, veneuze trombus, partiële lapnecrose, totale lapnecrose. |
|
Jokuszies et al., 2013 |
Lapcomplicaties ten gevolge van veneuze congestie of arteriële insufficiëntie t.h.v. de anastomose en microvasculaire trombose waardoor een heringreep vereist is. |
|
Kelley et al., 2012 |
Arteriële insufficiëntie, veneuze congestie, microvasculaire lapnecrose, heringreep noodzakelijk, partiële lapnecrose, totale lapnecrose, vetnecrose, longembolie. |
|
Mirzabeigi et al., 2015 |
Intra-operatieve arteriële of veneuze trombose, postoperatieve arteriële of veneuze trombose, partiële lapnecrose, totale lapnecrose. |
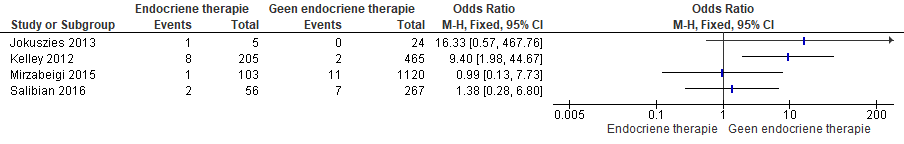
In drie studies was de puntschatter in het voordeel van ‘geen endocriene therapie’ (zie Figuur 1). Slechts in één studie (Kelley et al., 2012) was dit voordeel statistisch significant. Bij Salibian et al. (2016) daarentegen was de puntschatter in het voordeel van ‘endocriene therapie’, statistisch niet significant. Omdat geen van de studies primair opgezet was om endocriene therapie te vergelijken met tijdelijk gestopte endocriene therapie en de studies klinisch heterogeen zijn (zie tabel 2, 3 en 4), werden de data niet gepoold.
Ter info: Mirzabeigi et al. (2015) onderzochten ook het effect van aromatase inhibitoren en vonden een vergelijkbaar resultaat, i.e. een trend in het voordeel van de groep ‘geen endocriene therapie’ (7/113 (lappen) respectievelijk 67/1120 (lappen).
Figuur 1 Optreden van microvasculaire trombotische complicaties bij patiënten die een directe of uitgestelde microvasculaire borstreconstructie ondergaan

Totale lapnecrose
In drie studies was de puntschatter in het voordeel van ‘geen endocriene therapie’ (zie Figuur 2). Slechts in één studie (Kelley et al., 2012) was dit voordeel statistisch significant. De studie van Mirzabeigi et al. (2015) vond geen verschil tussen de groepen. Omdat geen van de studies primair opgezet was om endocriene therapie te vergelijken met tijdelijk gestopte endocriene therapie en de studies klinisch en statistisch heterogeen zijn (zie tabel 2, 3 en 4), werden de data niet gepoold.
Ter info: Mirzabeigi et al. (2015) onderzochten ook het effect van aromatase inhibitoren en vonden een vergelijkbaar resultaat, i.e. een trend in het voordeel van de groep ‘geen endocriene therapie’ (1/113 (lappen) respectievelijk 11/1120 (lappen).
Figuur 2 Optreden van totale lapnecrose bij patiënten die een directe of uitgestelde microvasculaire borstreconstructie ondergaan
Partiële lapnecrose
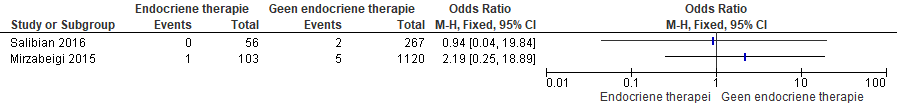
Twee studies hebben deze uitkomstmaat onderzocht. In één studie was de puntschatter in het voordeel van ‘geen endocriene therapie’ (Mirzabeigi et al., 2015; zie Figuur 3), de andere studie liet geen voordeel zien voor één van de twee onderzochte interventies.
Figuur 3 Optreden van partiële lapnecrose bij patiënten die een directe of uitgestelde microvasculaire borstreconstructie ondergaan
Esthetisch resultaat
Geen studie heeft dit als uitkomstmaat gehanteerd.
Patiënttevredenheid
Geen studie heeft dit als uitkomstmaat gehanteerd.
Kwaliteit van bewijs
De bewijskracht is niet te beoordelen, omdat geen conclusies kunnen worden getrokken.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep een systematische literatuuranalyse verricht met de volgende PICO-vraagstelling:
Wat is het verschil in effect van een microvasculaire borstreconstructie bij endocriene therapie op intra-operatieve en postoperatieve complicaties, esthetisch resultaat of patiënttevredenheid in vergelijking met een microvasculaire borstreconstructie bij tijdelijk gestopte endocriene therapie?
In de databases Medline (OVID), Embase and Cochrane is d.d. 99-99-2017 gezocht voor de onderstaande PICO-vraagstelling. De zoekverantwoording is weergegeven in bijlage 1.
Selectie- en exclusiecriteria:
|
Type studies |
|
|
Type patiënten |
|
|
Interventie |
|
|
Controle |
|
|
Type uitkomstmaten |
intra-operatieve complicaties: kritieke uitkomstmaat (GRADE)
postoperatieve complicaties: kritieke uitkomstmaten (GRADE)
|
|
Type setting |
|
|
Exclusiecriteria |
|
De literatuurzoekactie leverde 212 treffers op. Voor de selectie werden bovenstaande criteria gehanteerd. Negen studies werden geselecteerd op basis van titel en abstract (De Pinho Pessoa et al., 2007; Disa et al., 2012; Jokuszies et al., 2013; Kelley et al., 2012; Mirzabeigi et al., 2015; Parikh et al., 2017; Perez-de la Fuente et al., 2017; Salibian et al., 2016; Unukovych et al., 2016). Na het lezen van de volledige artikelen werden hiervan uiteindelijk vier studies meegenomen in de literatuuranalyse (Salibian et al., 2016; Jokuszies et al., 2013; Kelley et al., 2012; Mirzabeigi et al., 2015). In bijlage 2 staan de redenen van exclusie van de andere vijf studies vermeld. Ter informatie: ook de systematic review van Parikhk (2017) werd geëxcludeerd, omdat deze niet voldeed aan de vereiste AMSTAR-kwaliteitscriteria.
Referenties
- Aronson (2016). Meylers side effects of drugs. Sixteenth edition.
- De Pinho Pessoa, B. B., et al. Effect of tamoxifen on arterial microvascular anastomosis. Microsurg. 2007;27(4): 286-288.
- Disa, J. J. (2012). Discussion. Tamoxifen increases the risk of microvascular flap complications in patients undergoing microvascular breast reconstruction. Plastic & Reconstructive Surgery. 2012;129(2): 315-316.
- Enajat M, Damen TH, Geenen A, Timman R, van der Hulst RR, Mureau MA. Pulmonary embolism after abdominal flap breast reconstruction: prediction and prevention. Plast Reconstr Surg. 2013 Jun;131(6):1213-22.
- Hernandez et al. Tamoxifen treatment and risk of deep venous thrombosis and pulmonary embolism: a Danish population-based cohort study. Cancer. 2009;115, 4442-9.
- Jokuszies, A., et al. Is tamoxifen associated with an increased risk for thromboembolic complications in patients undergoing microvascular breast reconstruction? German Medical Science. 2013;11: Doc05.
- Jordan VC. New insights into the metabolism of tamoxifen and its role in the treatment and prevention of breast cancer. Steroids. 2007 Nov; 72(13): 829842.
- Kelley, B. P., et al. Tamoxifen increases the risk of microvascular flap complications in patients undergoing microvascular breast reconstruction." Plastic & Reconstructive Surgery. 2012;129(2): 305-314.
- Margolese RG et al. Anastrozole versus tamoxifen in postmenopausal women with ductal carcinoma in situ undergoing lumpectomy plus radiotherapy (NSABP B-35): a randomised, double-blind, phase 3 clinical trial. Lancet. 2016 Feb 27;387(10021):849-56.
- Mirzabeigi, M. N., et al. Tamoxifen (selective estrogen-receptor modulators) and aromatase inhibitors as potential perioperative thrombotic risk factors in free flap breast reconstruction. Plastic & Reconstructive Surgery. 2015;135(4): 670e-679e.
- Parikh, R. P., et al. Complications and thromboembolic events associated with tamoxifen therapy in patients with breast cancer undergoing microvascular breast reconstruction: a systematic review and meta-analysis. Breast Cancer Research & Treatment. 2017;163(1): 1-10.
- Perez-de la Fuente, T. Is It Necessary to Stop Tamoxifen Therapy in Microvascular Flap Breast Reconstruction? Annals of Plastic Surgery. 2017;78(4): 476-477.
- Salibian, A. A., et al. The Effects of Perioperative Tamoxifen Therapy on Microvascular Flap Complications in Transverse Rectus Abdominis Myocutaneous/Deep Inferior Epigastric Perforator Flap Breast Reconstruction. Annals of Plastic Surgery. 2016;77(6): 630-634.
- Unukovych, D., et al. Predictors of Reoperations in Deep Inferior Epigastric Perforator Flap Breast Reconstruction. Plastic and Reconstructive Surgery Global Open. 2016;4(8): e1016.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 08-04-2019
Beoordeeld op geldigheid : 08-04-2019
Uiterlijk in 2018 bepaalt het bestuur van de Nederlandse Vereniging voor Plastische Chirurgie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Plastische Chirurgie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In 2017 tot 2018
De richtlijnontwikkeling werd ondersteund door J.J.A. de Beer, zelfstandig richtlijnmethodoloog en B. Niël-Weise, zelfstandig richtlijnmethodoloog en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
In 2011 tot 2013
De richtlijnontwikkeling werd ondersteund door B.S. Niël-Weise, arts-microbioloog (n.p.)/epidemioloog, senior adviseur, Kennisinstituut van Medisch Specialisten.
Doel en doelgroep
Doel
Ontwikkelen van een multidisciplinaire kwaliteitsrichtlijn voor borstreconstructies bij vrouwen na borstsparende therapie of ablatio vanwege borstkanker of na een profylactische ablatio.
Doelgroep
De richtlijn beoogt een praktisch handvat te bieden aan plastisch chirurgen en de leden van het multidisciplinair mammateam (oncologisch chirurg, internist-oncoloog, radiotherapeut-oncoloog, radioloog, patholoog, psycholoog, verpleegkundig specialist mammacare-verpleegkundige). Tevens is er een versie voor patiënten ontwikkeld welke zal worden aangepast met de herzieningen in 2018.
Samenstelling werkgroep
Voor het ontwikkelen van de module borstreconstructie en systemische therapie is in 2017 een werkgroep ingesteld, bestaand uit vertegenwoordigers van die specialismen die inhoudelijk direct gerelateerd zijn aan het betreffend onderwerp (zie hiervoor de samenstelling van de werkgroep).
Voor het ontwikkelen van de richtlijn is in oktober 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een borstreconstructie (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Voor de module borstreconstructie en systemische therapie (2017-2018):
Werkgroep
- Dr. M.A.M. Mureau (voorzitter), plastisch chirurg, Erasmus MC Kanker Instituut, Erasmus Universitair Medisch Centrum Rotterdam
- Prof. Dr. R. van der Hulst, plastisch chirurg, Maastricht Universitair Medisch Centrum/Orbis Medisch Centrum/Viecuri Medisch Centrum, Maastricht
- Dr. C.H. Smorenburg, internist-oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
- Mw. C. Willems, Borstkankervereniging Nederland, Utrecht
- Mevr. D. Ligtenberg, Borstkankervereniging Nederland, Utrecht
Meelezers:
- Dr. M.B.E. Menke-Pluijmers, oncologisch chirurg, Albert Schweitzer Ziekenhuis, Dordrecht
- Dr. N.S. Russell, radiotherapeut-oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
- Mw. D. van der Zee, V&VN Verpleegkundig Specialisten, Diakonessenhuis, Utrecht/Zeist.
Met ondersteuning van:
- Mw. B.S. Niël-Weise, arts-microbioloog (niet praktiserend), zelfstandig richtlijnmethodoloog, Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
Voor alle andere teksten (2011-2013):
- Dr. M.A.M. Mureau (voorzitter), plastisch chirurg, Erasmus MC Kanker Instituut, Erasmus Universitair Medisch Centrum Rotterdam
- Prof. Dr. R. van der Hulst, plastisch chirurg, Maastricht Universitair Medisch Centrum/Orbis Medisch Centrum/Viecuri Medisch Centrum, Maastricht
- Dr. L. A.E. Woerdeman, plastisch chirurg, Antoni van Leeuwenhoek / Nederlands Kanker instituut, Amsterdam
- Drs. A.A.W.M Turnhout, plastisch chirurg, Tergooi Ziekenhuis, locatie Hilversum
- Drs. N.A.S. Posch, plastisch chirurg, Haga-ziekenhuis, Den Haag
- Dr. M.B.E. Menke-Pluijmers, oncologisch chirurg, Albert Schweitzer Ziekenhuis, Dordrecht
- Dr. E.J.T. Luiten, oncologisch chirurg, Amphia Ziekenhuis, Breda
- Drs. A.H. Westenberg, radiotherapeut-oncoloog, Arnhems Radiotherapeutisch Instituut, Arnhem
- Dr. J.P. Gopie, psycholoog, Leids Universitair Medisch Centrum, Leiden
- Dr. H.M. Zonderland, radioloog, Academisch Medisch Centrum, Amsterdam
- Drs. M. Westerhof, Borstkankervereniging Nederland, Utrecht
- Mw. E.M.M.Krol-Warmerdam MA, V&VN Verpleegkundig Specialisten, Leids Universitair Medisch Centrum, Leiden
Met ondersteuning van
- Drs. B.S. Niël-Weise, arts-microbioloog (n.p.)/epidemioloog, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Een overzicht hiervan kunt u bij het secretariaat van het Kennisinstituut van Medisch specialisten (KiMS) opvragen en voor de revisie in 2017 bij de Nederlandse Vereniging voor Plastische Chirurgie. Een overzicht van de belangenverklaringen van de werkgroepleden in 2017 vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
Mureau |
Plastisch en reconstructief chirurg |
Voorzitter NVPC; voorzitter commissie kwaliteit; wetenschappelijk commissielid DBIR; lid Clinical Audit Board NBCA.
Behoudens vacatiegeld en km vergoeding zijn deze functies onbetaald. |
geen |
geen |
Voorzitter NVPC |
geen |
geen |
geen |
|
van der Hulst |
Plastisch chirurg |
Werkzaam in de mooi kliniek |
Aandelen in microsure, ontwikkeling robot voor microchirurgie nvty |
geen |
geen |
Hoofdonderzoeker verschillende BREAST trial, gerandomiseerde studie naar effectiviteit en veiligheid lipofilling voor volledige borstreconstructie |
geen |
geen |
|
Smorenburg |
Internist-oncoloog |
Voorzitter richtlijn Borstkanker |
geen |
geen |
geen |
geen |
geen |
geen |
|
Willems |
Namens BVN |
|
|
|
|
|
|
|
|
Ligtenberg |
Namens BVN |
|
|
|
|
|
|
|
|
Hans de Beer |
zelfstandig adviseur richtlijnontwikkeling /richtlijnmethodoloog |
onderzoeker als fellow (onbetaald) |
geen |
geen |
geen |
geen |
geen |
In 2015 en 2016 heb ik workshops over de GRADE-methodiek gegeven bij enkele farmaceuten. Deze activiteiten hebben geen consequenties voor de opdrachtgever of voor het onderhavige project. |
|
Barbara Niël-Weise |
zelfstandig adviseur richtlijnontwikkeling /richtlijnmethodoloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
In 2013 en 2017:
Borstkankervereniging Nederland (BVN) heeft schriftelijk input geleverd tijdens de knelpuntanalyse en in de commentaarfase. Patiënten werden tevens in de werkgroep vertegenwoordigd door een afgevaardigde van Borstkankervereniging Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep, de werkgroepleden en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Borstkankervereniging Nederland (BVN), Zorgverzekeraars Nederland (ZN), College voor Zorgverzekeringen (CvZ) en de Inspectie voor de Gezondheidszorg IGZ via een invitational conference in 2013 en schriftelijk in 2017 . Een verslag van de invitational conference kunt u vinden in de bijlage van deze module.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen [http://www.g-i-n.net/library/international-guidelines-library; https://www.ahrq.gov] en naar systematische reviews [Cochrane Library; Medline]. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
|
|
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
|
|
|
|
|
|
|
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
|
|
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
|
|
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Organisatie van nazorg en nacontrole'.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Hiervoor werd gebruik gemaakt van de methodiek zoals beschreven in Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens werd de richtlijn voorgelegd aan de volgende organisaties ter becommentariëring: Borstkankervereniging Nederland (BVN), Nederlandse Vereniging voor Medische Oncologie (NVMO), Nederlands Huisartsen Genootschap (NHG), Zorgverzekeraars Nederland (ZN), Nederlandse zorgautoriteit (NZA), College voor Zorgverzekeringen (CvZ), Inspectie voor de Gezondheidszorg (IGZ), Achmea, CZ, Menzis en VGZ. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
Medline 1946 to Mei 2017
1 exp Breast Neoplasms/ (259777)
2 exp Breast/ (42040)
3 breast surgery.mp. (3263)
4 (breast* or mastectom*).ti,ab. (388122)
5 exp Breast Neoplasms/su (34472)
6 exp Breast/su (6050)
7 su.fs. (1803282)
8 (1 or 2) and 7 (42567)
9 3 or 4 or 5 or 6 or 8 (394130)
10 "concept P".ti. (1)
11 exp Borstplasty/ (10706)
12 Tissue Expansion Devices/ (1363)
13 Breast Implants/ (3976)
14 ((breast or mastectom* or borstplast* or mammoplast* or mastoplast*) adj6 reconstruct*).ti,ab. (8722)
15 Tissue Expansion/ (2066)
16 exp Surgical Flaps/ (54738)
17 (flap or flaps or 'transverse rectus abdominis' or tram or 'latissimus dorsi' or 'deep inferior epigastric perforator' or diep or 'superior gluteal artery perforator' or sgap or 'transverse musculocutaneous gracilis' or tmg or 'superficial inferior epigastric artery' or siea or expander*).ti,ab. (77053)
18 (tissue adj3 expander?).ti,ab. (1742)
19 (skin adj3 expansio*).ti,ab. (503)
20 ((breast or mastectom* or borstplast* or mammoplast* or mastoplast*) adj6 reconstruct*).kf. (695)
21 (flap or flaps or 'transverse rectus abdominis' or tram or 'latissimus dorsi' or 'deep inferior epigastric perforator' or diep or 'superior gluteal artery perforator' or sgap or 'transverse musculocutaneous gracilis' or tmg or 'superficial inferior epigastric artery' or siea or expander*).kf. (3947)
22 (tissue adj3 expander?).kf. (102)
23 (skin adj3 expansio*).kf. (12)
24 or/11-23 (101640)
25 antineoplastic protocols/ or antineoplastic combined chemotherapy protocols/ or exp combined modality therapy/ (321184)
26 ((systemic adj3 therap*) or antineoplast* or chemotherap* or radiochemotherap* or chemoradiotherap*).ab,ti. (386225)
27 ((systemic adj3 therap*) or antineoplast* or chemotherap* or radiochemotherap* or chemoradiotherap*).kf. (21647)
28 or/25-27 (593669)
29 9 and 24 and 28 (1390)
30 exp clinical trial/ (804076)
31 exp clinical study/ (841481)
32 cohort studies/ or follow-up studies/ or longitudinal studies/ or prospective studies/ or retrospective studies/ (1684740)
33 (trial* or clinical* or rct or prospect* or retrospect* or longitudin* or intervention* or cohort*).ti,ab. (4961218)
34 (follow adj up).ti,ab. (801754)
35 or/30-34 (5948260)
36 28 and 35 (325310)
37 36 (325310)
38 limit 37 to yr="2014 -Current" (67974)
39 12 or 15 or 16 or 17 or 18 or 19 (91355)
40 11 or 13 or 14 or 20 (16142)
41 39 and 40 (6111)
42 9 and 28 and 41 (601)
43 38 and 42 (123)
44 "filter systematic reviews".ti. (0)
45 meta analysis.pt. (80375)
46 (meta-anal$ or metaanal$).af. (142989)
47 (quantitativ$ adj10 (review$ or overview$)).tw. (6820)
48 (systematic$ adj10 (review$ or overview$)).tw. (118254)
49 (methodologic$ adj10 (review$ or overview$)).tw. (9092)
50 (quantitativ$ adj10 (review$ or overview$)).kf. (31)
51 (systematic$ adj10 (review$ or overview$)).kf. (8098)
52 (methodologic$ adj10 (review$ or overview$)).kf. (36)
53 medline.tw. and review.pt. (64021)
54 (pooled adj3 analy*).tw. (14009)
55 (pooled adj3 analy*).kf. (128)
56 "cochrane$".fc_jour. (13447)
57 or/45-56 (256270)
58 9 and 28 and 41 and 57 (12)
59 58 (12)
60 limit 59 to yr="2014 -Current" (4)
61 from 43 keep 1-113 (113)
62 from 58 keep 1-12 (12)
63 from 60 keep 1-4 (4)
64 "burger$".fc_auts. and "immediate breast ".fc_titl. and "2015".fc_pubyr. (1)
65 exp *Breast Neoplasms/su (14550)
66 exp *Breast/su (4023)
67 39 and (65 or 66) (2634)
68 9 and 28 and (40 or 67) (1294)
69 68 (1294)
70 limit 69 to yr="2014 -Current" (344)
71 70 and 57 (21)
72 (70 and 35) not 57 (251)
73 35 and 70 (270)
74 (dutch or german or french or english).la. (24786476)
75 73 and 74 (264)
76 75 not 57 (245)
77 "34".fc_vol. and "neoadjuvant".fc_titl. and "2014".fc_pubyr. and "6677".fc_pg. (1)
78 "lee$".fc_auts. and "oncologic safety of immediate".fc_titl. and "2016".fc_pubyr. (2)
79 from 78 keep 1 (1)
80 77 or 79 (2)
81 28 and 80 (2)
82 9 and 81 (2)
83 24 and 82 (2)
84 immediate.ti,ab. (172569)
85 immediate.kf. (1070)
86 ibr.ti,ab. (1063)
87 ibr.kf. (13)
88 or/84-87 (173703)
89 29 and 88 (556)
90 57 and 74 and 89 (14)
91 Time Factors/ (1114986)
92 (time or timing).ti,ab. (2655474)
93 (time or timing).kf. (26669)
94 or/91-93 (3473768)
95 89 and 94 (272)
96 delay*.ti,ab. (408154)
97 delay*.kf. (5728)
98 (underwent adj8 (mast* or reconst*)).ti,ab. (13285)
99 (underwent adj8 (mast* or reconst*)).kf. (0)
100 (underwent adj2 neo?adjuvan*).ti,ab. (596)
101 (underwent adj2 neo?adjuvan*).kf. (0)
102 Neoadjuvant Therapy/ (15592)
103 (neoadjuvant adj2 (therap* or treatment?)).ti,ab. (8354)
104 (neoadjuvant adj2 (therap* or treatment?)).kf. (638)
105 (after adj8 (mastec* or surg* or reconst* or mamm?plast*)).ti,ab. (325661)
106 (underwent adj8 (mastec* or surg* or reconst* or mamm?plast*)).ti,ab. (108004)
107 (after adj8 (mastec* or surg* or reconst* or mamm?plast*)).kf. (208)
108 (underwent adj8 (mastec* or surg* or reconst* or mamm?plast*)).kf. (0)
109 or/105-108 (401143)
110 or/100-104 (20612)
111 29 and 109 (653)
112 110 and 111 (65)
113 29 and 110 (121)
114 9 and 24 (16043)
115 114 and 110 (131)
116 94 or 96 or 97 or 106 or 107 or 108 (3816090)
117 110 and 114 and 116 (69)
118 117 and 57 (2)
119 (117 and 35) not 57 (57)
120 "radtke$".fc_auts. and "tamoxifen".fc_titl. and "2013".fc_pubyr. (1)
121 "kelley$".fc_auts. and "tamoxifen".fc_titl. and "2012".fc_pubyr. (1)
122 "nelson$".fc_auts. and "tamoxifen".fc_titl. and "2015".fc_pubyr. (1)
123 "evans$".fc_auts. and "effects of perioper*".fc_titl. and "2016".fc_pubyr. (1)
124 120 or 121 or 122 or 123 (4)
125 24 and 124 (4)
126 Microsurgery/ (24811)
127 Microvessels/ (5713)
128 Microcirculation/ (34731)
129 (microvascula* or microcirculat*).tw. (77367)
130 (microvascula* or microcirculat*).kf. (2853)
131 Free Tissue Flaps/ (2558)
132 (free adj2 flap?).tw. (10788)
133 (free adj2 flap?).kf. (732)
134 or/126-133 (122282)
135 125 and 134 (4)
136 24 and 134 (16320)
137 Neoplasms, Hormone-Dependent/ (5856)
138 exp Tamoxifen/ (20136)
139 (tamoxifen or nolvadex or hormone?dependent).tw. (21160)
140 (tamoxifen or nolvadex or hormone?dependent).kf. (952)
141 Aromatase Inhibitors/ (5520)
142 (aromatase adj3 inhibit*).tw. (7261)
143 (aromatase adj3 inhibit*).kf. (477)
144 (endocrine adj3 adjuvant* adj3 therap*).tw. (998)
145 (endocrine adj3 adjuvant* adj3 therap*).ti. (336)
146 Antineoplastic Agents, Hormonal/ (15129)
147 "Adjuvant endocrine therapy".kw. (30)
148 "Adjuvant endocrine therapy".kf. (33)
149 (endocrine adj3 adjuvant* adj3 therap*).kf. (34)
150 (adjuvant adj3 hormon* adj3 therap*).tw. (1306)
151 (adjuvant adj3 hormon* adj3 therap*).kf. (19)
152 or/137-151 (47458)
153 24 and 134 and 152 (16)
154 24 and 152 (146)
155 exp Aromatase Inhibitors/ (6869)
156 exp Antineoplastic Agents, Hormonal/ (163369)
157 152 or 155 or 156 (181748)
158 24 and 157 (305)
159 Surgical Flaps/ (51407)
160 134 or 159 (163493)
161 9 and 157 and 160 (55)
162 9 and 160 (5590)
163 (restart* or discontinua*).tw. (48914)
164 162 and 163 (5)
Embase 1980 to Mei 2017
1 "radtke$".fc_auts. and "tamoxifen".fc_titl. and "2013".fc_pubyr. (1)
2 "kelley$".fc_auts. and "tamoxifen".fc_titl. and "2012".fc_pubyr. (1)
3 "nelson$".fc_auts. and "tamoxifen".fc_titl. and "2015".fc_pubyr. (1)
4 "evans$".fc_auts. and "effects of perioper*".fc_titl. and "2016".fc_pubyr. (2)
5 "evans$".fc_auts. and "perioperative tamoxifen therapy".fc_titl. and "2016".fc_pubyr. (0)
6 "lee$".fc_auts. and "microvascular flap complications in transverse".fc_titl. (0)
7 1 or 2 or 3 (3)
8 exp breast tumor/ (441006)
9 breast surgery/ or exp breast reconstruction/ or exp mastectomy/ (64438)
10 ((breast or mastectom* or borstplast* or mammoplast* or mastoplast*) adj6 reconstruct*).ti,ab. (10529)
11 ((breast or mastectom* or borstplast* or mammoplast* or mastoplast*) adj6 reconstruct*).kw. (1873)
12 exp breast tumor/su (49325)
13 or/8-12 (459675)
14 or/9-12 (85266)
15 exp "antineoplastic hormone agonists and antagonists"/ (491318)
16 exp tamoxifen/ or endocrine adjuvant therapy.mp. or exp aromatase inhibitor/ (69570)
17 (tamoxifen or nolvadex or hormone?dependent).tw. (29220)
18 (tamoxifen or nolvadex or hormone?dependent).kw. (5573)
19 exp aromatase inhibitor/ (26529)
20 multimodality cancer therapy/ (63230)
21 neoplasm/dt (17518)
22 or/15-21 (568947)
23 14 and 22 (14104)
24 exp microsurgery/ or exp microvascular surgery/ or microvascular breast reconstruction.mp. (32225)
25 exp microvasculature/ (96034)
26 (microvascula* or microcirculat*).tw. (100637)
27 (microvascula* or microcirculat*).kw. (14574)
28 surgical flaps/ or free tissue graft/ (13856)
29 ((free or surgical) adj2 flap?).tw. (12718)
30 ((free or surgical) adj2 flap?).kw. (3279)
31 or/24-30 (220839)
32 23 and 31 (84)
Cochrane library: systematic reviews en controlled trial register
Gezocht met een hiervoor geschikte, wat bredere vraagstelling.
Tabel exclusie na het lezen van het volledige artikel
|
Auteur |
Redenen van exclusie |
|
De Pinho Pessoa et al., 2007 |
Study in animals |
|
Disa et al., 2012 |
Comment |
|
Parikh et al., 2017 |
The methodological quality, assessed by the AMSTAR checklist, was not enough. |
|
Perez-de la Fuente et al., 2017 |
Comment |
|
Unukovych et al., 2016 |
Other research question |
Beoordeling van systematic review van Paikh et al. (2017) met AMSTAR
|
Was an 'a priori' design provided? |
Yes The authors followed the PRISMA and MOOSE guidelines. |
|
Was there duplicate study selection and data extraction? |
Yes Titles and abstracts were screened independently by two reviewers, with discrepancies resolved by discussion. |
|
Was a comprehensive literature search performed? |
Yes A literature search was performed across six databases. |
|
Was the status of publication (i.e. grey literature) used as an inclusion criterion? |
Unclear The authors did not report wheather they searched for grey literature or unpublished literature. |
|
Was a list of studies (included and excluded) provided? |
No 32 full-text articles were assessed for eligibility. 28 articles were excluded because of lack of relevant interventions or outcomes of interest. The excluded studies were not referenced. |
|
Were the characteristics of the included studies provided? |
No |
|
Was the scientific quality of the included studies assessed and documented? |
No |
|
Was the scientific quality of the included studies used appropriately in formulating conclusions? |
Unclear |
|
Were the methods used to combine the findings of studies appropriate? |
No Meta-analyses of indirect evidence. |
|
Was the likelihood of publication bias assessed? |
Yes Publication bias was assessed by visual appraisal of funnel plots. |
|
Was the conflict of interest included? |
Yes |
