Directe borstreconstructie na neoadjuvante chemotherapie
Uitgangsvraag
Wat is de plaats van een directe borstreconstructie na neoadjuvante chemotherapie bij borstkanker?
Aanbeveling
Beschouw toediening van neoadjuvante chemotherapie bij invasieve borstkanker niet als een contra-indicatie voor directe borstreconstructie.
Overwegingen
Kwaliteit van bewijs
De algehele kwaliteit van bewijs is laag tot zeer laag. Met andere woorden, er is de nodige onzekerheid over de precieze grootte van de onderzochte effecten van de interventies (neoadjuvante chemotherapie versus geen neoadjuvante chemotherapie bij vrouwen die een mastectomie gecombineerd met een directe borstreconstructie hebben ondergaan; directe borstreconstructie versus geen directe borstreconstructie bij vrouwen die voorafgaand aan mastectomie neoadjuvante chemotherapie hebben gehad).
Waarden en voorkeuren van patiënten
Vrouwen die een mastectomie, voorafgegaan door neoadjuvante chemotherapie, ondergaan en opteren voor direct borstreconstructie, zullen de kans op intra- en postoperatieve complicaties en locoregionaal recidief zo klein mogelijk willen houden. Worden die kansen te groot dan zou dat een reden kunnen zijn om van directe borstreconstructie af te zien. Volgens de richtlijnwerkgroep verschillen vrouwen waarschijnlijk in wat zij acceptabele risico’s vinden. De behandelend arts dient dan ook bij de patiënten na te gaan welke inschatting zij maken wat betreft de verhouding van de baten, namelijk betere cosmetisch resultaten en verkorte totale operatie- en herstelperiode, en de risico’s op intra- en postoperatieve complicaties, heroperaties en locaal recidief (“benefit:risk ratio”).
Professioneel perspectief
Patiënt gebonden risicofactoren voor postoperatieve complicaties
Patiënt gebonden risicofactoren zoals roken of een BMI >30 kg/m2 voor postoperatieve complicaties, implantaatverlies en cosmetisch resultaat bij een directe borstreconstructie worden op pagina’s 31 en 32 van de richtlijn besproken.
Keuze implantaat versus autoloog
Wat betreft de keuze tussen implantaat dan wel autoloog wordt verwezen naar de module Reconstructietechnieken bij ablatieve therapie.
Toevoegen van ‘single agent targeted her-2 therapie’ aan neoadjuvante chemotherapie
Shammas et al. (2017) lieten zien dat toevoeging van ‘single agent targeted her-2 therapie’ met trastuzumab aan neoadjuvante chemotherapie over het geheel genomen niet tot meer complicaties (trombose, hematomen, seroomvorming, wonddehiscentie en necrose van de mastectomie huidlap) na reconstructie leidt. Wel was er een trend (p=0,09) naar meer wondinfecties die orale of intraveneuze toediening van antibiotica noodzakelijk maakten.
Balans van gewenste en ongewenste effecten
De voordelen van een directe borstreconstructie zijn in het algemeen:
- een beter cosmetisch resultaat doordat de huid en soms de tepel worden gespaard, de inframammairplooi behouden blijft en er doorgaans minder littekens op de borst zijn;
- een verkorte totale operatie- en herstelperiode.
Wanneer een directe borstreconstructie volgend op mastectomie plaatsvindt na voorafgaande chemotherapie lijken de risisico’s op intra- en postoperatieve complicaties niet verhoogd ten opzichte van geen voorafgaande chemotherapie. Mogelijk is er wel een iets grotere kans op wondcomplicaties, en op uitstel van de reconstructie en verlies van expander/prothese (mogelijk 13% respectievelijk 4% meer dan wanneer vooraf geen chemotherapie was gegeven).
Bij de besluitvorming tot neoadjuvante chemotherapie gevolgd door mastectomie en directe reconstructie dienen mogelijke voor- en nadelen van zowel de keuze van preoperatieve chemotherapie (in plaats van adjuvante chemotherapie) als de keuze van directe reconstructie (in plaats van geen of uitgestelde reconstructie) met de patiënt besproken te worden.
Kosten
De richtlijnwerkgroep heeft de kosten niet betrokken bij het opstellen van de aanbevelingen.
Aanvaardbaarheid en haalbaarheid
Mastectomie en directe borstreconstructie voorafgegaan door neoadjuvante chemotherapie is voor de meeste stakeholders (chirurgen, oncologen en patiënten) een aanvaardbare en haalbare optie.
Onderbouwing
Achtergrond
Directe borstreconstructie na een mastectomie vanwege borstkanker is veilig en wordt in toenemende mate toegepast. Mogelijke voordelen van een directe borstreconstructie boven een uitgestelde borstreconstructie zijn snellere en over het algemeen betere cosmetische resultaten (huid en soms tepel worden gespaard; de inframamairplooi blijft behouden; doorgaans minder littekens op de borst) en een verkorte totale operatie- en herstelperiode. Bij het gebruik van neoadjuvante chemotherapie, dus voorafgaand aan de operatie, doet zich de vraag voor of een directe borstreconstructie na mastectomie en na neoadjuvante chemotherapie wel even veilig is als een directe borstreconstructie zonder voorafgaande chemotherapie.
Definities
Neoadjuvante chemotherapie: chemotherapie voorafgaand aan therapeutische borstchirurgie bij invasieve borstkanker.
Conclusies / Summary of Findings
Ad review 1: directe reconstructie versus geen directe reconstructie bij patiënten die een mastectomie ondergaan en vooraf neoadjuvante chemotherapie hebben gekregen
|
Zeer laag
GRADE |
Vrouwen die voorafgaand aan mastectomie en borstreconstructie neoadjuvante chemotherapie hebben gehad
Locoregionaal recidief, postoperatieve complicaties (partiële necrose, seroomvorming en wondinfecties)
Mastectomie gevolgd door directe borstreconstructie na neoadjuvante chemotherapie lijkt geen nadelig effect te hebben op de uitkomstmaten locoregionaal recidief en postoperatieve complicaties in vergelijking met mastectomie zonder directe borstreconstructie na neoadjuvante chemotherapie.
Bron Ryu et al. (2016) |
|
|
Vrouwen die voorafgaand aan mastectomie en borstreconstructie neoadjuvante chemotherapie hebben gehad
Patiënttevredenheid
Voor de uitkomstmaat patiënttevredenheid werden geen studies gevonden.
|
Ad review 2: neoadjuvante chemotherapie versus geen neoadjuvante chemotherapie bij patiënten die een mastectomie ondergaan met een directe reconstructie
|
Zeer laag
GRADE |
Vrouwen die een mastectomie gecombineerd met een directe borstreconstructie ondergaan
Uitstel van directe borstreconstructie
Wellicht vergroot neoadjuvante chemotherapie de kans op het uitstellen van de directe borstreconstructie.
Bron Hu et al., 2011 |
|
Zeer laag
GRADE |
Vrouwen die een mastectomie gecombineerd met een directe borstreconstructie ondergaan
Totaal aantal complicaties Neoadjuvante chemotherapie voorafgaande aan mastectomie gecombineerd met een directe reconstructie lijkt het risico op het totaal aantal complicaties niet te vergroten.
Bronnen Donker et al., 2012; Godfrey et al., 1995; Hu et al., 2011; Liu et al., 2009; Radovanovic et al., 2010 |
|
Zeer laag
GRADE |
Vrouwen die een mastectomie gecombineerd met een directe borstreconstructie ondergaan
Wondcomplicaties Neoadjuvante chemotherapie geeft wellicht een iets groter risico op wondcomplicaties ten opzichte van geen neoadjuvante chemotherapie voorafgaand aan mastectomie en directe reconstructie.
Bron Decker et al., 2012 |
|
Zeer laag
GRADE |
Vrouwen die een mastectomie gecombineerd met een directe borstreconstructie ondergaan
Hematoom en seroomvorming Neoadjuvante chemotherapie lijkt geen groter risico op het optreden van hematoom of seroomvorming te geven ten opzichte van geen neoadjuvante chemotherapie voorafgaand aan mastectomie en directe reconstructie.
Bronnen Donker et al., 2012; Azzawi et al., 2010 (seroom); Frey et al.,2017; Narui et al., 2015; Peled et al., 2010 (hematoom); Liu et al., 2009; Zweifel-Schlatter et al., 2010; Godfrey et al., 1995 (seroom) |
|
Laag
GRADE |
Vrouwen die een mastectomie gecombineerd met een directe borstreconstructie ondergaan
Infecties Neoadjuvante chemotherapie lijkt geen groter risico op het optreden van infecties te geven ten opzichte van geen neoadjuvante chemotherapie voorafgaand aan mastectomie en directe reconstructie.
Bronnen Donker et al., 2012; Azzawi et al., 2010; Bowen et al., 2017; Frey et al., 2017; Narui et al., 2015; Peled et al., 2010; Tanaka et al, 2016 |
|
Laag
GRADE |
Vrouwen die een mastectomie gecombineerd met een directe borstreconstructie ondergaan
Heroperaties Er is vermoedelijk geen klinisch relevant verschil in effect op het optreden van heroperaties tussen neoadjuvante chemotherapie en het achterwege blijven van neoadjuvante chemotherapie voorafgaand aan mastectomie en directe reconstructie.
Bronnen Peled et al., 2010; Liu et al., 2009; Donker et al., 2012; Schaverien et al., 2013; Zweifel-Schlatter et al., 2010; Bowen et al., 2017 |
|
Zeer laag
GRADE |
Vrouwen die een mastectomie gecombineerd met een directe borstreconstructie ondergaan
Verlies van expander/prothese Neoadjuvante chemotherapie voorafgaand aan de gecombineerde ingrepen geeft wellicht een licht verhoogd risico op het verlies van de expander/prothese ten opzichte van geen neoadjuvante chemotherapie voorafgaand aan mastectomie en directe reconstructie.
Bronnen Donker et al., 2012; Frey et al., 2017; Jiminez-Puente et al., 2011; Peled et al., 2010; Radovanovic et al., 2010 |
|
Laag
GRADE |
Vrouwen die een mastectomie gecombineerd met een directe borstreconstructie ondergaan
Intra- en postoperatieve complicaties die (zeer) weinig voorkomen (tabel 4) Neoadjuvante chemotherapie lijkt ten opzichte van geen neoadjuvante chemotherapie geen groter risico op het optreden van (zeer) weinig voorkomende complicaties te geven voorafgaand aan mastectomie en directe reconstructie.
Bron Bowen et al., 2017 |
|
|
Vrouwen die een mastectomie gecombineerd met een directe borstreconstructie ondergaan
Patiënttevredenheid en verandering van oorspronkelijk operatieplan Er werden geen vergelijkende studies geïdentificeerd die deze uitkomstmaten hebben onderzocht bij vrouwen met wel of geen neoadjuvante chemotherapie voorafgaand aan mastectomie en directe reconstructie. |
Samenvatting literatuur
Ad review 1: directe reconstructie versus geen directe reconstructie bij patiënten die een mastectomie ondergaan en vooraf neoadjuvante chemotherapie hebben gekregen
Ryu et al. (2016) onderzochten in een single-center case-control studie wat de oncologische uitkomsten waren bij patiënten die na neoadjuvante chemotherapie (NACT) een totale mastectomie (controles, n=85) hadden ondergaan in vergelijking met patiënten (cases) die na NACT een huidsparende (SSM; n=18 [58,1%]) of tepelsparende mastectomie (NSM; n=13 [41,9%]) in combinatie met een borstreconstructie (IBR) hadden ondergaan.
Voor zowel de IBR- als controlegroep gold dat patiënten die zich tijdens NACT presenteerden met metastasen op afstand of ziekteprogressie werden geëxcludeerd. Patiënten werden gematcht op de volgende variabelen: leeftijd, klinische stadium van de tumor voorafgaande aan NACT, respons op NACT, en pathologisch stadium na NACT (ypTNM). Iedere patiënt die SSM of NSM had ondergaan werd met 5 controlepatiënten gematcht. Voorafgaande aan NACT werd met behulp van lichamelijk onderzoek, MRI, echo en mammografie het klinisch stadium van de tumor (cTNM) vastgesteld. Na NACT werd met MRI en echo de klinische respons op de primaire tumor en de lymfklieren nagegaan.
In de IBR-groep werd bij 20 (64.5%) patiënten een expander en bij 10 (32.3%) een (DIEP) flap toegepast. Ca. 90% van de patiënten kregen als NACT anthracycline en taxaan. Daarnaast kreeg 19.4% van de studiegroep en 31.8% van de controlegroep trastuzumab. Patiënten wier oorspronkelijke tumor groter was dan 5 cm (80 tot 88%) kregen adjuvante radiotherapie.
De enige oncologische uitkomst die aan de selectiecriteria (zie tabel selectie- en exclusiecriteria) voldeed was locoregionaal recidief, door Ryu et al. (2016) als volgt gedefinieerd: “tumor found within the ipsilateral chest wall (skin, subcutaneous tissue, and pectoralis muscle) or recurrence in ipsilateral axillary, supraclavicular, internal mammary or infra-clavicular lymph nodes”. Postoperatieve complicaties waarover werd gerapporteerd waren: partiële necrose, seroomvorming en wondinfecties. Er werd niet gerapporteerd over patiënttevredenheid, delay of afstel van reconstructie, en verandering van oorspronkelijk operatieplan.
De follow-up duur in de IBR-groep verschilde significant van die in de controlegroep (38,2 versus 45,8 maanden). Voor andere variabelen was er geen statistisch significant verschil.
De uitkomsten (locoregionaal recidief en postoperatieve complicaties) zijn per studiegroep weergegeven in tabel 1. Afstandsmetastasen traden op bij 22 patiënten (25.6%) in de controlegroep en bij 6 patiënten (19.4%) in de IBR groep.
Tabel 1. Locoregionaal recidief en postoperatieve complicaties
|
Variabele |
IBR-groep (n=20) |
Controlegroep (n=85) |
|
locoregionaal recidief (%) |
3 (9.7) |
6 (7.1) |
|
Postoperatieve complicaties (%) |
2 (6.5) |
1 (1.2) |
|
1 (3.2) |
0 (0.0) |
|
1 (3.2) |
0 (0.0) |
|
0 (0.0) |
1 (1.2) |
Aan de hand van cijfers in tabel 2 berekende de richtlijncommissie de volgende relatieve en absolute risico’s:
- locoregionaal recidief: RR=1.37 (95% BI: 0.37-5.15).
- postoperatieve complicaties: RR=5.48 (95% BI: 0.52-58.37).[1]
Er werd dus geen significant verschil gevonden in het optreden van een lokaal recidief of complicaties.
Kwaliteit van bewijs
De initiële kwaliteit van bewijs van een niet-gerandomiseerde studie is laag. Wat opzet en uitvoering van de studie betreft werd met één niveau afgewaardeerd voor de uitkomst locoregionaal recidief vanwege de relatief korte follow up (‘indirectness’). Zie bijlage 3 voor overige aspecten van opzet en uitvoering van deze studie.
Er werd voor geen van de uitkomstmaten afgewaardeerd voor inconsistentie en publicatiebias.
Voor zowel de uitkomst locoregionaal recidief als de uitkomst postoperatieve complicaties werd met één niveau afgewaardeerd vanwege onnauwkeurigheid (zie hiervoor de wijde betrouwbaarheidsintervallen die de commissie berekende). De kwaliteit van bewijs is dan ook voor beide uitkomstmaten zeer laag.
Ad review 2: neoadjuvante chemotherapie versus geen neoadjuvante chemotherapie bij patiënten die een mastectomie ondergaan met een directe reconstructie
Beschrijving studies
Song et al. (2014) hanteerden voor hun review de volgende inclusiecriteria:
- patiënten met directe borstreconstructie na mastectomie vanwege borstkanker;
- preoperatieve chemotherapie als onderdeel van de interventie;
- een ‘controle’-groep zonder preoperatieve chemotherapie;
- minimaal één relevante uitkomstmaat;
- follow-up duur ≥ 30 dagen.
De exclusiecriteria waren:
- afwezigheid van ‘controle’-groep;
- ontbreken van extraheerbare data;
- case reports, en
- reviews.
Onderzoeksdesigns
Tabel 2. Onderzoeksdesigns
|
Onderzoeksdesign |
Aantal studies |
|
Review van Song (2014) |
|
|
patiëntenseries |
10 studies Azzawi et al., 2010; Donker et al., 2012; Frey et al., 2017; Godfrey et al., 1995; Hu et al., 2011; Liu et al., 2009; Peled et al., 2010; Radovanovic et al., 2010; Schaverien et al., 2013; Zweifel-Schlatter et al., 2010 |
|
registratiedatabase |
1 studie Decker et al. 2012 |
|
Studies gepubliceerd na de review van Song |
|
|
patiëntenseries |
3 studies Narui et al., 2015; Tanaka et al., 2016; Bowen et al., 2017; Frey et al., 2017 |
|
propensity score matching’ |
1 studie Bowen et al., 2017 |
Ter informatie: bij de patiëntenseries werden groepen die preoperatieve chemotherapie hadden gekregen en groepen die geen preoperatieve chemotherapie hadden gekregen met elkaar vergeleken. Dit is wezenlijk verschillend van een gelijktijdige (concurrent) controlegroep in RCTs, cohort studies met een controlegroep of case-control studies.
Toelichting op propensity score matching: de kans om een bepaalde behandeling te krijgen (= propensity score) hangt af van een aantal confounders, zoals bijvoorbeeld leeftijd of co-morbiditeit. Een propensity score is een getal tussen 0 en 1: 0 betekent geen ingreep; 1 betekent een ingreep. Propensity-scoremethoden kunnen in observationeel onderzoek corrigeren voor gemeten confounders, maar niet voor ongemeten confounders. Groepen personen met dezelfde propensity-score zijn – gemiddeld genomen – vergelijkbaar ten aanzien van gemeten confounders. Propensity-scoremethoden kunnen doorgaans voor meer confounders corrigeren dan andere methoden, vooral wanneer de onderzochte uitkomst weinig voorkomt (Groenewold, 2013).
Landen waar studies zijn verricht
De meeste studies werden uitgevoerd in de Verenigde Staten en het Verenigd Koninkrijk. Eén studie is in Japan uitgevoerd (Narui et al., 2015).
Studiepopulatie
De mediane of gemiddelde leeftijd varieerde in de 15 studies van 38 tot 57 jaar. Het type reconstructie varieerde: patiënten ondergingen een autologe reconstructie (alleen autoloog weefsel om een reconstructie te verrichten), of een expander/prothese reconstructie (gebruiken van expanders of prothesen om borstweefsel te vervangen), of een combinatie van autoloog weefsel met expander/prothese reconstructie.
Neoadjuvante chemotherapie regimes
De verschillende chemotherapie regimes die in de 15 studies werden toegepast maakten gebruik van diverse schema’s van combinatiechemotherapie met een anthracycline en een taxaan.
Definities uitkomstmaten en follow-up duur
Song et al. (2014) onderzochten de volgende uitkomstmaten: totaal aantal complicaties, hematomen, seroomvorming, infecties, heroperaties en expander/protheseverlies. Daarbij werden definities gehanteerd zoals vermeld in tabel 3*. In de vier recente studies (Narui et al., 2015; Tanaka et al., 2016; Bowen et al., 2017; Frey et al., 2017)) werden één of meer van deze uitkomstmaten gerapporteerd overeenkomstig deze definities.
* Uitzondering hierop is de studie van Decker et al. (2012): deze auteurs gebruikten andere definities. Dit was de reden waarom Song et al. (2014) de data van Decker et al. niet hebben meegenomen in de meta-analyses.
Tabel 3. Definities van complicaties in Song et al. (2014)
|
Complicatie |
Omschrijving |
|
Lap verlies |
Totale necrose van autologe lap |
|
Infectie |
Lokaal of systemisch bewijs van een infectie leidend tot toediening van orale antibiotica of ziekenhuisopname voor intraveneuze antibiotica |
|
Hematoom |
Verzameling bloed in het chirurgisch gebied dat noopt tot chirurgische behandeling |
|
Seroomvorming |
Klinisch evidente verzameling van sereuze vloeistof in het chirurgisch gebied dat noopt tot aspiratie
|
De follow-up duur in de 15 studies varieerde tussen 1 tot 40 maanden, met een mediane waarde van 8 maanden.
Uitstel of afstel borstreconstructie
Hu et al. (2011) rapporteerden in een niet-gerandomiseerde retrospectieve studie over het ondergaan van een directe borstreconstructie bij patiënten die een mastectomie hadden ondergaan vanwege borstkanker (stadium I, II, III). In deze patiëntenserie kregen 180 vrouwen neoadjuvante chemotherapie en 485 vrouwen geen neoadjuvante chemotherapie. Na correctie van de resultaten voor onder andere leeftijd en ziektestadium, bleek neoadjuvante chemotherapie de kans op directe borstreconstructie bijna te halveren (ORadj: 0,57; 95% BI: 0,37–0,87). In absolute termen betekent dit: 13,1% (-3,4; -21,5%) minder kans op een directe borstreconstructie wanneer neoadjuvante chemotherapie wordt gegeven.
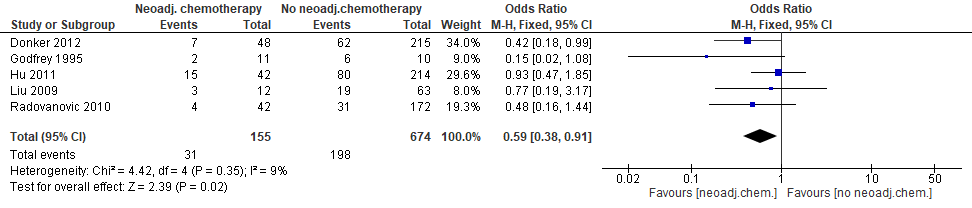
Totaal aantal complicaties
Vijf studies rapporteerden over het optreden van het totaal aantal complicaties (figuur 1). Donker et al. (2011) vonden significant minder complicaties (huidnecrose en heroperatie) bij patiënten die neoadjuvante chemotherapie kregen. In de andere studies was de puntschatter weliswaar steeds in het voordeel van de groep die neoadjuvante chemotherapie kreeg, maar was dit voordeel niet statistisch significant. De gecombineerde schatting is overigens wel statistisch significant. Dit betekent in absolute termen 9,7% (95% BI: –15,7; –1,9 %) minder complicaties bij patiënten met neoadjuvante chemotherapie.
Figuur 1. Optreden van totaal aantal complicaties bij patiënten die neoadjuvante of geen neoadjuvante chemotherapie kregen
Wondcomplicaties
Decker et al. (2012) definieerden wondcomplicaties als oppervlakkige infecties in het chirurgische gebied, diepe infecties (inclusief diepe infectie van het chirurgisch gebied en infectie van organen of anatomische ruimten), en wonddehiscentie. De resultaten van hun multivariate analyse bij 8.854 patiënten liet zien dat met neoadjuvante chemotherapie de kans op wondcomplicaties toenam (OR= 1,58; 95% BI: 0,98–2,58), een borderline significante uitkomst.
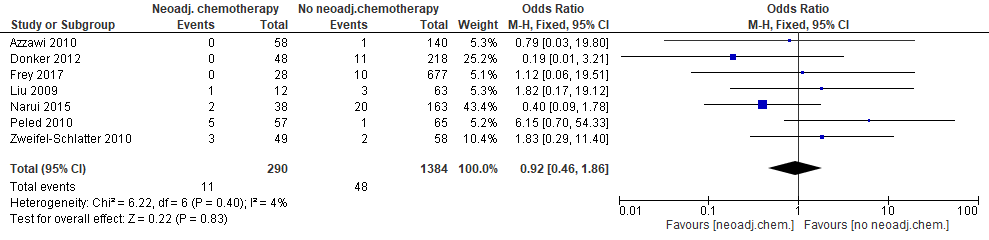
Hematomen
Zeven studies rapporteerden over het optreden van hematomen (figuur 2). In geen van de studies was sprake van een statistisch significant effect. Dit geldt tevens voor de gecombineerde schatting. De puntschatter wijst er niet op dat neoadjuvante chemotherapie het risico op hematomen verhoogt (in de groep met neoadjuvante chemotherapiekomen 0,3% (95% BI: –1,8%; +2,8%) minder hematomen voor) (bijlage 4).
Figuur 2. Optreden van hematomen bij patiënten met directe borstreconstructie na mastectomie die neoadjuvante of geen neoadjuvante chemotherapie kregen
Seroomvorming
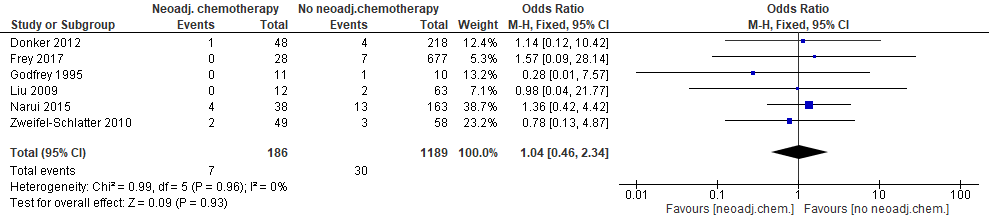
Zes studies rapporteerden over het optreden van seroomvorming (figuur 3). In geen van de studies was sprake van een statistisch significant effect. Dit geldt tevens voor de gecombineerde schatting. De puntschatter wijst er niet op dat neoadjuvante chemotherapie het risico op seroomvorming serieus verhoogt (in de groep met neoadjuvante chemotherapie komt 0,1% (95% BI: –1,3%; +3,2%) meer seroomvorming voor) (bijlage 4).
Figuur 3. Optreden van seroomvorming bij patiënten met directe borstreconstructie na mastectomie die neoadjuvante of geen neoadjuvante chemotherapie kregen
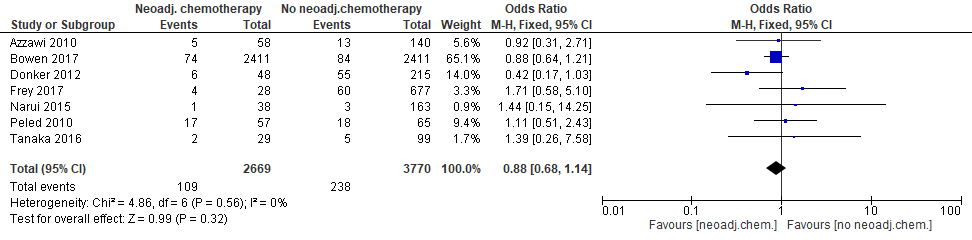
Infecties
Zeven studies, waaronder de studie met propensity score matching, rapporteerden over het optreden van infecties (figuur 4). In geen van de studies was sprake van een statistisch significant effect. Dit geldt tevens voor de gecombineerde schatting. De studie van Bowen et al. (2017) geeft de meest nauwkeurige uitkomst (‘smal betrouwbaarheidsinterval’) en bepaalt ook in sterke mate de gecombineerde uitkomst (“weight” is 65%). De puntschatter van de gecombineerde uitkomst wijst er niet op dat neoadjuvante chemotherapie het risico op infecties verhoogt: in absolute termen komen 0,7% (95% BI: –1,9%; +0,8%) minder infecties voor in de groep die neoadjuvante chemotherapie krijgt (bijlage 4).
Figuur 4. Optreden van infecties bij patiënten met directe borstreconstructie na mastectomie die neoadjuvante of geen neoadjuvante chemotherapie kregen
Heroperaties
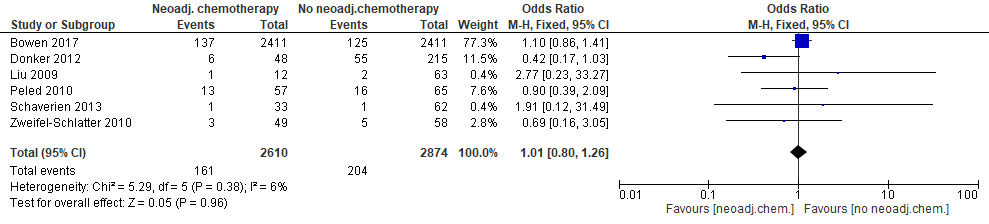
Zes studies rapporteerden over het optreden van heroperaties (figuur 5). In geen van de studies was sprake van een statistisch significant effect. Dit geldt tevens voor de gecombineerde schatting. De studie van Bowen et al. (2017) geeft de meest nauwkeurige uitkomst (‘smal betrouwbaarheidsinterval’) en bepaalt ook in sterke mate de gecombineerde uitkomst (“weight” is 81%). De puntschatter van de gecombineerde uitkomst wijst er niet op dat neoadjuvante chemotherapie het risico op heroperaties serieus verhoogt: in absolute termen komen er 0,3% (95% BI: –0,9%; +1,8%) meer heroperaties voor in de groep die neoadjuvante chemotherapie krijgt (bijlage 4).
Figuur 5. Optreden van heroperaties bij patiënten met directe borstreconstructie na mastectomie die neoadjuvante of geen neoadjuvante chemotherapie kregen
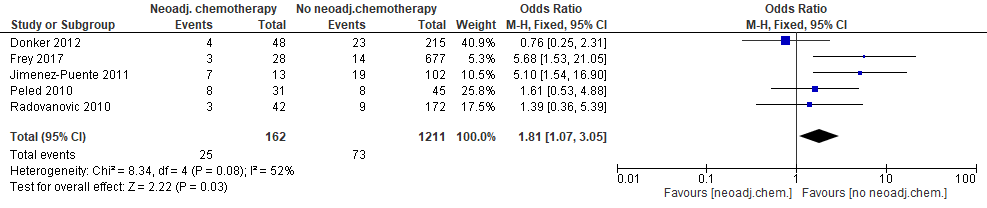
Vijf studies rapporteerden over het optreden van verlies van expander/prothese (figuur 6). In twee studies was sprake van een statistisch significant effect. In twee van de drie studies die geen statistisch significant effect lieten zien, wees de puntschatter wel in de richting van een groter risico bij neoadjuvante chemotherapie. De gecombineerde schatting wijst op een licht verhoogd risico op verlies van expander/prothese: in absolute termen komt 4,4% (95% BI: +0,4%; +10,3%) meer verlies van expander/prothese voor in de groep die neoadjuvante chemotherapie krijgt (bijlage 4).
Figuur 6. Optreden van verlies van expander/prothese bij patiënten met directe borstreconstructie na mastectomie die neoadjuvante of geen neoadjuvante chemotherapie kregen
Weinig voorkomende intra- en postoperatieve complicaties
Bowen et al. (2017) rapporteerden over deze complicaties (tabel 4). Voor geen van deze complicaties was er een statistisch significant verschil tussen patiënten die wel of geen neoadjuvante chemotherapie hadden gekregen. Let wel: deze complicaties hebben betrekking op vrouwen die wel (ca 40%) of geen (ca 60%) directe borstreconstructie na mastectomie vanwege borstkanker hebben ondergaan.
Tabel 4. Weinig voorkomende intra- en postoperatieve complicaties bij bij patiënten met directe borstreconstructie na mastectomie die neoadjuvante of geen neoadjuvante chemotherapie kregen.
|
Complicatie |
Neoadjuvante chemotherapie Percentage (n)
N=2411 |
Geen neoadjuvante chemotherapie Percentage (n)
N=2411 |
|
Pneumonie |
0,2 (6) |
0,1 (2) |
|
Re-intubatie |
0,2 (5) |
0,2 (4) |
|
Longembolie |
0,1 (3) |
0,0 (1) |
|
Niet spontaan ademen (weaning failure) |
0,1 (3) |
0,1 (2) |
|
Nierinsufficiëntie |
0,0 (0) |
0,2 (4) |
|
Acuut nierfalen |
0,1 (2) |
0,1 (2) |
|
Urineweginfectie |
0,3 (8) |
0,7 (17) |
|
Beroerte/cerebrovasculair accident |
0,0 (0) |
0,2 (5) |
|
Coma |
0,0 (1) |
0,0 (0) |
|
Perifeer zenuwletsel |
0,1 (3) |
0,0 (0) |
|
Hartstilstand |
0,1 (2) |
0,1 (2) |
|
Myocardinfarct |
0,1 (2) |
0,0 (1) |
|
Transfusie intra- of postoperatief |
1,3 (32) |
0,9 (21) |
|
Falen van transplantaat/prothese/lap |
0,6 (15) |
0,5 (11) |
|
Diepe veneuze trombose |
0,1 (2) |
0,2 (6) |
|
Septische shock |
0,0 (1) |
0,1 (3) |
Bron: Bowen et al. (2017)
Patiënttevredenheid en verandering van oorspronkelijk operatieplan
Geen studie heeft dit als uitkomstmaat gehanteerd.
Kwaliteit van bewijs
Uitstel of afstel borstreconstructie
De kwaliteit van bewijs voor deze uitkomstmaat verandert van hoog naar zeer laag, omdat de studie, een patiëntenserie, niet primair opgezet was om neoadjuvante chemotherapie direct te vergeleken met geen neoadjuvante chemotherapie (patiëntenserie). Bovendien is het betrouwbaarheidsinterval (-3,4%; -21,5%) dusdanig breed dat het zeer onzeker is hoeveel procent minder kans er op directe borstreconstructie is wanneer neoadjuvante chemotherapie wordt gegeven in vergelijking met geen neoadjuvante chemotherapie.
Totaal aantal complicaties, hematomen, seroomvorming en verlies expander/prothese
Voor de uitkomstmaten totaal aantal complicaties, hematomen, seroomvorming en verlies expander/prothese is de kwaliteit van bewijs zeer laag, omdat deze uitkomstmaten in patiëntenseries werden onderzocht waarbij een echte (‘concurrent’) controlegroep ontbrak, én waarbij ook multivariate analyses die corrigeerden voor bekende confounders meestal ontbraken.
Wondcomplicaties
Voor deze uitkomstmaat is een patiëntenserie beschikbaar waarvoor weliswaar een multivariate analyse werd verricht, maar waarbij sprake is van onnauwkeurigheid van de uitkomst: het betrouwbaarheidsinterval van de odds ratio (1,58; 95%BI: 0,98–2,58) wijst zowel op geen verhoging (odds ratio: 0,98) als op een matige verhoging (odds ratio: 2,58) van het risico op wondcomplicaties vanwege neoadjuvante chemotherapie.
Infecties en heroperaties
Omdat in de verrichte meta-analyse de propensity studie van Bowen (2017) het meeste gewicht geeft aan de gecombineerde uitkomst (weight 65% respectievelijk 81 %), worden bij de bepaling van de kwaliteit van bewijs de patiëntenseries buiten beschouwing gelaten.
De initiële kwaliteit van bewijs voor deze twee uitkomstmaten is hoog. Vanwege het risico op ‘confounding’ door onbekende prognostische factoren (in tegenstelling tot gerandomiseerde trials) is met één niveau afgewaardeerd voor het risico op bias (zie bijlage 3 voor de risk of bias beoordeling). Voor deze twee uitkomstmaten is verder afgewaardeerd tot laag vanwege indirect bewijs. In de studie van Bowen et al. (2017) heeft namelijk ‘slechts’ ca. 40% van de patiënten een directe borstreconstructie gehad. Voor deze 40% werden de uitkomsten niet afzonderlijk gerapporteerd, de uitkomsten werden per groep gerapporteerd: de groep met en de groep zonder neoadjuvante chemotherapie.
Weinig voorkomende intra- en postoperatieve complicaties
Voor de (zeer) weinig voorkomende post- en intra-operatieve complicaties (tabel 2) is de kwaliteit van bewijs laag om dezelfde redenen als voor de uitkomstmaten infecties en heroperaties. Zie hiervoor.
[1] In case-control studies worden gewoonlijk odds ratio’s berekend. Is de prevalentie in de controle groep echter <10% dan zijn odds ratio’s vrijwel gelijk aan relatieve risico’s.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep twee systematische literatuuranalyses verricht met de volgende PICO-vraagstellingen en selectiecriteria (tabel):
- Wat is het verschil in effect van neoadjuvante chemotherapie gevolgd door een mastectomie en directe borstreconstructie op het optreden van locoregionaal recidief, postoperatieve complicaties, esthetisch resultaat en patiënttevredenheid in vergelijking met neoadjuvante chemotherapie gevolgd door een mastectomie zonder directe borstreconstructie?
- Wat is het verschil in effect van neoadjuvante chemotherapie voorafgaand aan een mastectomie met een directe reconstructie op het optreden van intra- en postoperatieve complicaties en de patiënttevredenheid in vergelijking met geen neoadjuvante chemotherapie voorafgaand aan deze ingrepen?
Tabel 1a. Selectie- en exclusiecriteria PICO 1:
|
Type studies |
|
|
Type patiënten |
|
|
Interventie |
|
|
Controle |
|
|
Type uitkomstmaten |
complicaties: kritieke uitkomstmaten (GRADE)
|
|
Type setting |
|
|
Exclusiecriteria |
|
Tabel 1b. Selectie- en exclusiecriteria PICO 2:
|
Type studies |
|
|
Type patiënten |
|
|
Interventie |
|
|
Controle |
|
|
Type uitkomstmaten |
complicaties: kritieke uitkomstmaten (GRADE)
|
|
Type setting |
|
|
Exclusiecriteria |
|
Ad PICO 1:
D.d. 21 april 2017 werd een search verricht in Medline (Ovid SP) en de Cochrane Library (DARE en Central) met onder meer de volgende trefwoorden: breast surgery.mp., Mammaplasty, mastectom*, Breast Implants/, Neoadjuvant Therapy/. Zie voor details van de zoekstrategie bijlage 1.
Er werden 101 studies gevonden, waarvan eén studie (Ryu et al., 2016) – een case-control studie – voldeed aan de inclusiecriteria.
Ad PICO 2:
Bovenstaande zoekstrategie werd ook gebruikt voor PICO 2.
Er werd één systematische review gevonden waarvan de vraagstelling exact overeenkwam met de PICO van de werkgroep (Song et al., 2014). Deze review voldeed aan de AMSTAR-criteria (bijlage 2). De zoektermen van deze systematische review werden gebruikt om deze review te updaten; zie voor details van de zoekstrategie bijlage 1. Na lezing van de titels/abstracts van de primaire studies werd van 8 studies de volledige tekst opgevraagd. Hiervan werden er 4 geëxcludeerd, omdat deze neoadjuvante chemotherapie niet bleken te vergelijken met ‘geen neoadjuvante’ chemotherapie (Wengler et al., 2017; Hanwright et al., 2013; Santanelli et al., 2013; Abt et al., 2014). De overige 4 studies werden geïncludeerd (Narui et al., 2015; Tanaka et al., 2016; Bowen et al., 2017; Frey et al., 2017).
Voor (weinig frequente) postoperatieve complicaties die Song et al. (2014) niet onderzochten, zoals een longembolie/ diepe veneuze trombose of sepsis, heeft de werkgroep de studie van Bowen et al. (2017) geselecteerd.
Voor de uitkomstmaten uitstel of afstel van reconstructie, patiënttevredenheid en verandering in operatieplan werden de titels/abstracts van zowel de search voor PICO 1 als de search voor het updaten van de systematische review (Song et al., 2014) gelezen. Van één studie werd de volledige tekst opgevraagd, en na lezing geïncludeerd (Hu et al., 2011).
Referenties
- Abt NB, Flores JM, Baltodano PA, Sarhane KA, Abreu FM, Cooney CM, Manahan MA, Stearns V, Makary MA, Rosson GD. Neoadjuvant chemotherapy and short-term morbidity in patients undergoing mastectomy with and without breast reconstruction. JAMA Surg. 2014 Oct;149(10):1068-76.
- Azzawi K, Ismail A, Earl H, Forouhi P, Malata CM et al. Influence of neoadjuvant chemotherapy on outcomes of immediate breast reconstruction. Plast. Reconstr. Surg 2010;126: 1.
- Bowen ME, Mone MC, Buys SS, Sheng X, Nelson EW. Surgical Outcomes for Mastectomy Patients Receiving Neoadjuvant Chemotherapy: A Propensity-Matched Analysis. Ann Surg. 2017 Mar;265(3):448-456.
- Decker MR, Greenblatt DY, Havlena J, Wilke LG, Greenberg CC et al. Impact of neoadjuvant chemotherapy on wound complications after breast surgery. Surgery 2012;152: 382388.
- Donker M, Hage JJ, Woerdeman LA, Rutgers EJ, Sonke GS et al. Surgical complications of skin sparing mastectomy and immediate prosthetic reconstruction after NAC for invasive breast cancer. Eur J Surg Oncol 2012;38: 2530.
- Frey JD, Choi M, Karp NS. The Effect of Neoadjuvant Chemotherapy Compared to Adjuvant Chemotherapy in Healing after Nipple-Sparing Mastectomy. Plast Reconstr Surg. 2017 Jan;139(1):10e-19e.
- Godfrey PM, Godfrey NV, Romita MC. Immediate autogenous breast reconstruction in clinically advanced disease. Plast Reconstr Surg. 1995 May;95(6):1039-44.
- Groenewold RHH. Propensity scores in observationeel onderzoek. Ned Tijdschr Geneeskd. 2013;157:A6179.
- Hu YY, Weeks CM, In H, Dodgion CM, Golshan M et al. Impact of neoadjuvant chemotherapy on breast reconstruction. Cancer 2011;117: 283341.
- Jime´nez-Puente A, Prieto-Lara E, Rueda-Domi´nguez A, Maano´n-Di Leo C, Benitez-Parejo N et al. Complications in immediate breast reconstruction after mastectomy. Int J Technol Assess Health Care 2011;27: 4, 298304.
- Narui K, Ishikawa T, Satake T, Adachi S, Yamada A, Shimada K, Shimizu D, Kida K, Sugae S, Ichikawa Y, Tanabe M, Sasaki T, Endo I. Outcomes of immediate perforator flap reconstruction after skin-sparing mastectomy following neoadjuvant chemotherapy. Eur J Surg Oncol. 2015 Jan;41(1):94-9.
- Peled AW, Itakura K, Foster RD, Hamolsky D, Tanaka J et al. Impact of chemotherapy on postoperative complications after mastectomy and immediate breast reconstruction. Arch Surg 2010;145(9): 880885.
- Ryu, J. M., et al. (2016). "Oncologic Safety of Immediate Breast Reconstruction in Breast Cancer Patients Who Underwent Neoadjuvant Chemotherapy: Short-Term Outcomes of a Matched Case-Control Study." Clinical Breast Cancer 27: 27.
- Wengler CA, Valente SA, Al-Hilli Z, Woody NM, Muntean JH, Abraham J, Tendulkar RD, Djohan R, O'Rourke C, Crowe JP, Grobmyer SR. Determinants of short and long term outcomes in patients undergoing immediate breast reconstruction following neoadjuvant chemotherapy. J Surg Oncol. 2017 Jul 11.
- Radovanovic Z, Radovanovic1 D, Golubovic1 A, Ivkovic-Kapicl T, Bokorov B et al. Early complications after nipple-sparing mastectomy and immediate breast reconstruction with silicone prosthesis: results of 214 procedures. Scand J Surg 2010;99: 115118.
- Ryu, J. M., et al. (2017). "Oncologic Safety of Immediate Breast Reconstruction in Breast Cancer Patients Who Underwent Neoadjuvant Chemotherapy: Short-Term Outcomes of a Matched Case-Control Study." Clinical Breast Cancer 27: 27.
- Santanelli F, Longo B, Sorotos M, Farcomeni A, Paolini G. Flap survival of skin-sparing mastectomy type IV: a retrospective cohort study of 75 consecutive cases. Ann Surg Oncol. 2013 Mar;20(3):981-9.
- Schaverien MV, Munnoch DA. Effect of neoadjuvant chemotherapy on outcomes of immediate free autologous breast reconstruction. Eur J Surg Oncol 2013;39: 430436.
- Shammas RL, Cho EH, Glener AD, Poveromo LP, Mundy LR, Greenup RA, Blackwell KL, Hollenbeck ST. Association Between Targeted HER-2 Therapy and Breast Reconstruction Outcomes: A Propensity Score-Matched Analysis. J Am Coll Surg. 2017 Sep 26.
- Song, J., et al. (2014). "Impact of neoadjuvant chemotherapy on immediate breast reconstruction: a meta-analysis." PLoS ONE [Electronic Resource] 9(5): e98225.
- Tanaka S, Hayek G, Jayapratap P, Yerrasetti S, Hilaire HS, Sadeghi A, Corsetti R, Fuhrman G. The Impact of Chemotherapy on Complications Associated with Mastectomy and Immediate Autologous Tissue Reconstruction. Am Surg. 2016 Aug;82(8):713-7.
- Zweifel-Schlatter M, Darhouse N, Roblin P, Ross D, Zweifel M et al. Immediate microvascular breast reconstruction after neoadjuvant chemotherapy: complication rates and effect on start of adjuvant treatment. Ann Surg Oncol 2010;17: 29452950.
Evidence tabellen
Risk of bias beoordeling Bowen et al. (2017).
Studies die gebruik maken van technieken zoals propensity score matching zijn vooral van belang in situaties waarin gerandomiseerde studies om ethische redenen niet mogelijk zijn of anderszins niet haalbaar zijn. Volgens Bowen et al. (2017): “There is a low likelihood that a randomized controlled trial (RCT) will be undertaken to define the true added risk for surgical morbidity or specifically delineate the postoperative complications related to neoadjuvant chemotherapy in breast cancer patients. (…) If a RCT study that examined the effect of neoadjuvant chemotherapy on surgical morbidity was performed, the type of chemotherapy and surgical procedures would have to be specified, and patients with various morbidities would likely be excluded. This is often the criticism of a RCT, for which the inclusion criteria are too limiting to be representative of the general population. Propensity analysis, and particularly matching, allows for a wide range of covariates to be considered within the analysis and also allows inclusion of a diverse population, permitting the results to be generalized to a wider population.
Bias due to confounding
Confounding expected, all known important confounding domains were appropriately measured and controlled for. Reliability and validity of measurement of important domains were sufficient, such that we do not expect serious residual confounding.
Risk of bias judgement: moderate (the study is sound for a non-randomized study with regard to this domain but cannot be considered comparable to a well-performed randomized trial).
Bias in selection of participants into the study
Selection into the study may have been related to intervention and outcome (“from 2011 onwards the variable for preoperative chemotherapy treatment became optional, making the rate of neoadjuvant chemotherapy use seem to decline”).
Risk of bias judgement: moderate
Bias in classification of interventions
Intervention status is well defined and intervention definition is based solely on information collected at the time of intervention.
Risk of bias judgement: low
Bias due to deviations from intended interventions
No information was provided on whether there were deviations from the intended intervention beyond what would be expected in usual practice.
Risk of bias judgement: unclear
Bias due to missing data
8,392 participants were excluded due to missing data on variables needed for propensity matching. No information was provided on whether or not the proportion of missing participants were similar across interventions (or the reasons for missing). Total number of patients: c. 34,000, i.e. number of excluded eligible participants exceeds 20%.
Risk of bias judgement: moderate to serious (study may have some important problems)
Bias in measurement of outcomes
The methods of outcome assessment were comparable across intervention groups and the outcome measure was unlikely to be influenced by knowledge of the intervention
Risk of bias judgement: low
Bias in selection of the reported result
The reported effect estimates were unlikely to be selected, on the basis of the results.
Risk of bias judgement: low
Overall bias: moderate to serious
|
Summary of findings: |
|||||
|
Neoadjuvant chemotherapy compared to no adjuvant chemotherapy for patients undergoing mastectomy and immediate breast reconstruction |
|||||
|
Patient or population: patients undergoing mastectomy and direct mamma reconstruction Setting: Intervention: neoadjuvant chemotherapy Comparison: no adjuvant chemotherapy |
|||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of participants |
Certainty of the evidence |
|
|
Risk with no adjuvant chemotherapy |
Risk with neoadjuvant chemotherapy |
||||
|
Overall complications |
294 per 1.000 |
197 per 1.000 |
OR 0.59 |
829 |
⨁◯◯◯ |
|
Hematomas |
35 per 1.000 |
32 per 1.000 |
OR 0.92 |
1674 |
⨁◯◯◯ |
|
Seromas |
25 per 1.000 |
26 per 1.000 |
OR 1.04 |
1375 |
⨁◯◯◯ |
|
Infections |
63 per 1.000 |
56 per 1.000 |
OR 0.88 |
6439 |
⨁⨁◯◯ |
|
Reoperations |
62 per 1.000 |
65 per 1.000 |
OR 1.05 |
5484 |
⨁⨁◯◯ |
|
Loss of expander/implant |
60 per 1.000 |
104 per 1.000 |
OR 1.81 |
1373 |
⨁◯◯◯ |
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
|||||
|
GRADE Working Group grades of evidence |
|||||
Explanations
a. case series: therefore downgraded by 1 level (observational studies with concurrent control group start low).
b. Some confounding (due to unknown confounders) could not be excluded. Downgraded with 1 level (from high to moderate).
c. About 40% of the patient population studied by Bowen et al. had undergone immediate breast reconstruction. This study contributes significantly to the pooled estimate. Therefore rated down because of indirectness by 1 level (from moderate to low).
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 08-04-2019
Beoordeeld op geldigheid : 08-04-2019
Uiterlijk in 2018 bepaalt het bestuur van de Nederlandse Vereniging voor Plastische Chirurgie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Plastische Chirurgie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In 2017 tot 2018
De richtlijnontwikkeling werd ondersteund door J.J.A. de Beer, zelfstandig richtlijnmethodoloog en B. Niël-Weise, zelfstandig richtlijnmethodoloog en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
In 2011 tot 2013
De richtlijnontwikkeling werd ondersteund door B.S. Niël-Weise, arts-microbioloog (n.p.)/epidemioloog, senior adviseur, Kennisinstituut van Medisch Specialisten.
Doel en doelgroep
Doel
Ontwikkelen van een multidisciplinaire kwaliteitsrichtlijn voor borstreconstructies bij vrouwen na borstsparende therapie of ablatio vanwege borstkanker of na een profylactische ablatio.
Doelgroep
De richtlijn beoogt een praktisch handvat te bieden aan plastisch chirurgen en de leden van het multidisciplinair mammateam (oncologisch chirurg, internist-oncoloog, radiotherapeut-oncoloog, radioloog, patholoog, psycholoog, verpleegkundig specialist mammacare-verpleegkundige). Tevens is er een versie voor patiënten ontwikkeld welke zal worden aangepast met de herzieningen in 2018.
Samenstelling werkgroep
Voor het ontwikkelen van de module borstreconstructie en systemische therapie is in 2017 een werkgroep ingesteld, bestaand uit vertegenwoordigers van die specialismen die inhoudelijk direct gerelateerd zijn aan het betreffend onderwerp (zie hiervoor de samenstelling van de werkgroep).
Voor het ontwikkelen van de richtlijn is in oktober 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een borstreconstructie (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Voor de module borstreconstructie en systemische therapie (2017-2018):
Werkgroep
- Dr. M.A.M. Mureau (voorzitter), plastisch chirurg, Erasmus MC Kanker Instituut, Erasmus Universitair Medisch Centrum Rotterdam
- Prof. Dr. R. van der Hulst, plastisch chirurg, Maastricht Universitair Medisch Centrum/Orbis Medisch Centrum/Viecuri Medisch Centrum, Maastricht
- Dr. C.H. Smorenburg, internist-oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
- Mw. C. Willems, Borstkankervereniging Nederland, Utrecht
- Mevr. D. Ligtenberg, Borstkankervereniging Nederland, Utrecht
Meelezers:
- Dr. M.B.E. Menke-Pluijmers, oncologisch chirurg, Albert Schweitzer Ziekenhuis, Dordrecht
- Dr. N.S. Russell, radiotherapeut-oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
- Mw. D. van der Zee, V&VN Verpleegkundig Specialisten, Diakonessenhuis, Utrecht/Zeist.
Met ondersteuning van:
- Mw. B.S. Niël-Weise, arts-microbioloog (niet praktiserend), zelfstandig richtlijnmethodoloog, Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
Voor alle andere teksten (2011-2013):
- Dr. M.A.M. Mureau (voorzitter), plastisch chirurg, Erasmus MC Kanker Instituut, Erasmus Universitair Medisch Centrum Rotterdam
- Prof. Dr. R. van der Hulst, plastisch chirurg, Maastricht Universitair Medisch Centrum/Orbis Medisch Centrum/Viecuri Medisch Centrum, Maastricht
- Dr. L. A.E. Woerdeman, plastisch chirurg, Antoni van Leeuwenhoek / Nederlands Kanker instituut, Amsterdam
- Drs. A.A.W.M Turnhout, plastisch chirurg, Tergooi Ziekenhuis, locatie Hilversum
- Drs. N.A.S. Posch, plastisch chirurg, Haga-ziekenhuis, Den Haag
- Dr. M.B.E. Menke-Pluijmers, oncologisch chirurg, Albert Schweitzer Ziekenhuis, Dordrecht
- Dr. E.J.T. Luiten, oncologisch chirurg, Amphia Ziekenhuis, Breda
- Drs. A.H. Westenberg, radiotherapeut-oncoloog, Arnhems Radiotherapeutisch Instituut, Arnhem
- Dr. J.P. Gopie, psycholoog, Leids Universitair Medisch Centrum, Leiden
- Dr. H.M. Zonderland, radioloog, Academisch Medisch Centrum, Amsterdam
- Drs. M. Westerhof, Borstkankervereniging Nederland, Utrecht
- Mw. E.M.M.Krol-Warmerdam MA, V&VN Verpleegkundig Specialisten, Leids Universitair Medisch Centrum, Leiden
Met ondersteuning van
- Drs. B.S. Niël-Weise, arts-microbioloog (n.p.)/epidemioloog, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Een overzicht hiervan kunt u bij het secretariaat van het Kennisinstituut van Medisch specialisten (KiMS) opvragen en voor de revisie in 2017 bij de Nederlandse Vereniging voor Plastische Chirurgie. Een overzicht van de belangenverklaringen van de werkgroepleden in 2017 vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
Mureau |
Plastisch en reconstructief chirurg |
Voorzitter NVPC; voorzitter commissie kwaliteit; wetenschappelijk commissielid DBIR; lid Clinical Audit Board NBCA.
Behoudens vacatiegeld en km vergoeding zijn deze functies onbetaald. |
geen |
geen |
Voorzitter NVPC |
geen |
geen |
geen |
|
van der Hulst |
Plastisch chirurg |
Werkzaam in de mooi kliniek |
Aandelen in microsure, ontwikkeling robot voor microchirurgie nvty |
geen |
geen |
Hoofdonderzoeker verschillende BREAST trial, gerandomiseerde studie naar effectiviteit en veiligheid lipofilling voor volledige borstreconstructie |
geen |
geen |
|
Smorenburg |
Internist-oncoloog |
Voorzitter richtlijn Borstkanker |
geen |
geen |
geen |
geen |
geen |
geen |
|
Willems |
Namens BVN |
|
|
|
|
|
|
|
|
Ligtenberg |
Namens BVN |
|
|
|
|
|
|
|
|
Hans de Beer |
zelfstandig adviseur richtlijnontwikkeling /richtlijnmethodoloog |
onderzoeker als fellow (onbetaald) |
geen |
geen |
geen |
geen |
geen |
In 2015 en 2016 heb ik workshops over de GRADE-methodiek gegeven bij enkele farmaceuten. Deze activiteiten hebben geen consequenties voor de opdrachtgever of voor het onderhavige project. |
|
Barbara Niël-Weise |
zelfstandig adviseur richtlijnontwikkeling /richtlijnmethodoloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
In 2013 en 2017:
Borstkankervereniging Nederland (BVN) heeft schriftelijk input geleverd tijdens de knelpuntanalyse en in de commentaarfase. Patiënten werden tevens in de werkgroep vertegenwoordigd door een afgevaardigde van Borstkankervereniging Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep, de werkgroepleden en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Borstkankervereniging Nederland (BVN), Zorgverzekeraars Nederland (ZN), College voor Zorgverzekeringen (CvZ) en de Inspectie voor de Gezondheidszorg IGZ via een invitational conference in 2013 en schriftelijk in 2017 . Een verslag van de invitational conference kunt u vinden in de bijlage van deze module.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen [http://www.g-i-n.net/library/international-guidelines-library; https://www.ahrq.gov] en naar systematische reviews [Cochrane Library; Medline]. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
|
|
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
|
|
|
|
|
|
|
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
|
|
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
|
|
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Organisatie van nazorg en nacontrole'.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Hiervoor werd gebruik gemaakt van de methodiek zoals beschreven in Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens werd de richtlijn voorgelegd aan de volgende organisaties ter becommentariëring: Borstkankervereniging Nederland (BVN), Nederlandse Vereniging voor Medische Oncologie (NVMO), Nederlands Huisartsen Genootschap (NHG), Zorgverzekeraars Nederland (ZN), Nederlandse zorgautoriteit (NZA), College voor Zorgverzekeringen (CvZ), Inspectie voor de Gezondheidszorg (IGZ), Achmea, CZ, Menzis en VGZ. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
Oriënterende search
Cochrane Library (CENTRAL) : 7 trials.
Cochrane Library (CDSR): 1 systematic review
Cochrane Library (DARE): 1 systematic review.
Medline: 91 trials en observationele studies; 1 systematische review.
Database: MEDLINE <1946 to Present, updated daily>
Search Strategy:
--------------------------------------------------------------------------------
1 "22".fc_vol. and "chang$".fc_auts. and "2013".fc_pubyr. and "64".fc_pg. (5)
2 from 1 keep 3 (1)
3 "127".fc_vol. and "eriksen$".fc_auts. and "2011".fc_pubyr. and "439".fc_pg. (1)
4 "22".fc_vol. and "hamahata$".fc_auts. and "2013".fc_pubyr. and "1".fc_pg. (0)
5 "22".fc_vol. and "hamahata$".fc_auts. and "2013".fc_pubyr. (0)
6 "14".fc_vol. and "lee$".fc_auts. and "2011".fc_pubyr. and "322".fc_pg. (1)
7 "139".fc_vol. and "mortenson$".fc_auts. and "2004".fc_pubyr. and "988".fc_pg. (1)
8 "6".fc_vol. and "newman$".fc_auts. and "1999".fc_pubyr. and "671".fc_pg. (1)
9 "55".fc_vol. and "rey$".fc_auts. and "2005".fc_pubyr. and "250".fc_pg. (1)
10 "19".fc_vol. and "zhong$".fc_auts. and "2012".fc_pubyr. and "560".fc_pg. (1)
11 "22".fc_vol. and "kubo$".fc_auts. and "2013".fc_pubyr. (16)
12 "impact of immediate breast reconstruction on post*".fc_titl. (2)
13 from 12 keep 1 (1)
14 2 or 3 or 6 or 7 or 8 or 9 or 10 or 13 (8)
15 "controle refs uit artikel".ti. (0)
16 exp Breast Neoplasms/ (258577)
17 exp Breast/ (41847)
18 breast surgery.mp. (3226)
19 (breast* or mastectom*).ti,ab. (385073)
20 exp Breast Neoplasms/su (34344)
21 exp Breast/su (6018)
22 su.fs. (1795677)
23 (16 or 17) and 22 (42410)
24 18 or 19 or 20 or 21 or 23 (391066)
25 "concept P".ti. (1)
26 exp Mammaplasty/ (10596)
27 Tissue Expansion Devices/ (1345)
28 Breast Implants/ (3946)
29 ((breast or mastectom* or mammaplast* or mammoplast* or mastoplast*) adj6 reconstruct*).ti,ab. (8633)
30 Tissue Expansion/ (2050)
31 exp Surgical Flaps/ (54458)
32 (flap or flaps or 'transverse rectus abdominis' or tram or 'latissimus dorsi' or 'deep inferior epigastric perforator' or diep or 'superior gluteal artery perforator' or sgap or 'transverse musculocutaneous gracilis' or tmg or 'superficial inferior epigastric artery' or siea or expander*).ti,ab. (76646)
33 (tissue adj3 expander?).ti,ab. (1728)
34 (skin adj3 expansio*).ti,ab. (501)
35 ((breast or mastectom* or mammaplast* or mammoplast* or mastoplast*) adj6 reconstruct*).kf. (677)
36 (flap or flaps or 'transverse rectus abdominis' or tram or 'latissimus dorsi' or 'deep inferior epigastric perforator' or diep or 'superior gluteal artery perforator' or sgap or 'transverse musculocutaneous gracilis' or tmg or 'superficial inferior epigastric artery' or siea or expander*).kf. (3852)
37 (tissue adj3 expander?).kf. (100)
38 (skin adj3 expansio*).kf. (11)
39 or/26-38 (101098)
40 antineoplastic protocols/ or antineoplastic combined chemotherapy protocols/ or exp combined modality therapy/ (319660)
41 ((systemic adj3 therap*) or antineoplast* or chemotherap* or radiochemotherap* or chemoradiotherap*).ab,ti. (383369)
42 ((systemic adj3 therap*) or antineoplast* or chemotherap* or radiochemotherap* or chemoradiotherap*).kf. (21076)
43 or/40-42 (589775)
44 24 and 39 and 43 (1376)
45 exp clinical trial/ (800177)
46 exp clinical study/ (836156)
47 cohort studies/ or follow-up studies/ or longitudinal studies/ or prospective studies/ or retrospective studies/ (1672594)
48 (trial* or clinical* or rct or prospect* or retrospect* or longitudin* or intervention* or cohort*).ti,ab. (4917934)
49 (follow adj up).ti,ab. (794945)
50 or/45-49 (5900922)
51 43 and 50 (322940)
52 51 (322940)
53 limit 52 to yr="2014 -Current" (65710)
54 27 or 30 or 31 or 32 or 33 or 34 (90902)
55 26 or 28 or 29 or 35 (16000)
56 54 and 55 (6053)
57 24 and 43 and 56 (596)
58 53 and 57 (118)
59 "filter systematic reviews".ti. (0)
60 meta analysis.pt. (79154)
61 (meta-anal$ or metaanal$).af. (140722)
62 (quantitativ$ adj10 (review$ or overview$)).tw. (6728)
63 (systematic$ adj10 (review$ or overview$)).tw. (115908)
64 (methodologic$ adj10 (review$ or overview$)).tw. (8970)
65 (quantitativ$ adj10 (review$ or overview$)).kf. (29)
66 (systematic$ adj10 (review$ or overview$)).kf. (7756)
67 (methodologic$ adj10 (review$ or overview$)).kf. (36)
68 medline.tw. and review.pt. (63124)
69 (pooled adj3 analy*).tw. (13766)
70 (pooled adj3 analy*).kf. (122)
71 "cochrane$".fc_jour. (13259)
72 or/60-71 (252379)
73 24 and 43 and 56 and 72 (12)
74 73 (12)
75 limit 74 to yr="2014 -Current" (4)
76 from 58 keep 1-113 (113)
77 from 73 keep 1-12 (12)
78 from 75 keep 1-4 (4)
79 "burger$".fc_auts. and "immediate breast ".fc_titl. and "2015".fc_pubyr. (1)
80 exp *Breast Neoplasms/su (14492)
81 exp *Breast/su (4011)
82 54 and (80 or 81) (2616)
83 24 and 43 and (55 or 82) (1281)
84 83 (1281)
85 limit 84 to yr="2014 -Current" (331)
86 85 and 72 (19)
87 (85 and 50) not 72 (241)
88 14 and 83 (8)
89 50 and 85 (258)
90 (dutch or german or french or english).la. (24655001)
91 89 and 90 (252)
92 91 not 72 (235)
93 "34".fc_vol. and "neoadjuvant".fc_titl. and "2014".fc_pubyr. and "6677".fc_pg. (1)
94 "lee$".fc_auts. and "oncologic safety of immediate".fc_titl. and "2016".fc_pubyr. (2)
95 from 94 keep 1 (1)
96 93 or 95 (2)
97 43 and 96 (2)
98 24 and 97 (2)
99 39 and 98 (2)
100 immediate.ti,ab. (171504)
101 immediate.kf. (1050)
102 ibr.ti,ab. (1052)
103 ibr.kf. (13)
104 or/100-103 (172627)
105 44 and 104 (551)
106 72 and 90 and 105 (13)
107 Time Factors/ (1111240)
108 (time or timing).ti,ab. (2633538)
109 (time or timing).kf. (25833)
110 or/107-109 (3449469)
111 105 and 110 (269)
112 delay*.ti,ab. (405429)
113 delay*.kf. (5532)
114 (underwent adj8 (mast* or reconst*)).ti,ab. (13173)
115 (underwent adj8 (mast* or reconst*)).kf. (0)
116 (underwent adj2 neo?adjuvan*).ti,ab. (584)
117 (underwent adj2 neo?adjuvan*).kf. (0)
118 Neoadjuvant Therapy/ (15461)
119 (neoadjuvant adj2 (therap* or treatment?)).ti,ab. (8273)
120 (neoadjuvant adj2 (therap* or treatment?)).kf. (616)
121 (after adj8 (mastec* or surg* or reconst* or mamm?plast*)).ti,ab. (323261)
122 (underwent adj8 (mastec* or surg* or reconst* or mamm?plast*)).ti,ab. (106967)
123 (after adj8 (mastec* or surg* or reconst* or mamm?plast*)).kf. (199)
124 (underwent adj8 (mastec* or surg* or reconst* or mamm?plast*)).kf. (0)
125 or/121-124 (398010)
126 or/116-120 (20431) neoadjuvante therapie
127 44 and 125 (645)
128 126 and 127 (65)
129 44 and 126 (121)
130 24 and 39 (15901)
131 130 and 126 (130)
132 110 or 112 or 113 or 122 or 123 or 124 (3789260)
133 126 and 130 and 132 (68)
134 133 and 72 (2) systrev
135 (133 and 50) not 72 (56) trials etc
136 24 and 39 and 104 and 126 (56)
137 24 and 39 and 126 and (125 or 110 or 112 or 113 or 114 or 115) (87)
138 136 or 137 (92)
139 138 and 72 (2) SR
140 (138 and 50) not 72 (74) trials etc
141 138 not (72 or 50) (16) rest
Search voor update systematische review van Song et al. (2016)
((preoperative[All Fields] AND ("drug therapy"[Subheading] OR ("drug"[All Fields] AND "therapy"[All Fields]) OR "drug therapy"[All Fields] OR "chemotherapy"[All Fields] OR "drug therapy"[MeSH Terms] OR ("drug"[All Fields] AND "therapy"[All Fields]) OR "chemotherapy"[All Fields])) OR (("neoadjuvant therapy"[MeSH Terms] OR ("neoadjuvant"[All Fields] AND "therapy"[All Fields]) OR "neoadjuvant therapy"[All Fields] OR "neoadjuvant"[All Fields]) AND ("drug therapy"[Subheading] OR ("drug"[All Fields] AND "therapy"[All Fields]) OR "drug therapy"[All Fields] OR "chemotherapy"[All Fields] OR "drug therapy"[MeSH Terms] OR ("drug"[All Fields] AND "therapy"[All Fields]) OR "chemotherapy"[All Fields]))) AND ("mammaplasty"[MeSH Terms] OR "mammaplasty"[All Fields] OR ("breast"[All Fields] AND "reconstruction"[All Fields]) OR "breast reconstruction"[All Fields]) AND (outcomes[All Fields] OR ("complications"[Subheading] OR "complications"[All Fields]))
PubMed/Medline: 10-10-2017
|
Was an 'a priori' design provided? |
Yes The authors followed the PRISMA guidelines. |
|
Was there duplicate study selection and data extraction? |
Yes The 2 authors (Song and Li) independently examined the titles and abstracts of citations, and they obtained the full text of potentially eligible trials. Disagreements between the authors were resolved by discussion. |
|
Was a comprehensive literature search performed? |
Yes The literature was searched by using PubMed, EMBASE, Google Scholar, the Cochrane Library, the China National Knowledge Infrastructure whole article database, and the VIP Chinese Journals Database. |
|
Was the status of publication (i.e. grey literature) used as an inclusion criterion? |
Unclear The authors did not report whether they searched for grey literature. Unpublished studies were not included in the analysis |
|
Was a list of studies (included and excluded) provided? |
No 37 full-text articles were assessed for eligibility. 26 articles were excluded because data of interest were not reported, impact of neoadjuvant chemotherapy was not evaluated or articles were narrative reviews. |
|
Were the characteristics of the included studies provided? |
Yes
|
|
Was the scientific quality of the included studies assessed and documented? |
Yes Authors used the Newcastle Ottawa scale for nonrandomized studies. They independently assessed the included studies and disagreements were resolved by discussion. |
|
Was the scientific quality of the included studies used appropriately in formulating conclusions? |
Yes |
|
Were the methods used to combine the findings of studies appropriate? |
No Meta-analyses of relevant outcomes measures were provided. |
|
Was the likelihood of publication bias assessed? |
Yes Publication bias was assessed by visual inspection of funnel plots. |
|
Was the conflict of interest included? |
Yes The authors have declared that no competing interests exist |
