Directe borstreconstructie bij adjuvante chemotherapie
Uitgangsvraag
Wat is de plaats van een directe borstreconstructie indien in het preoperatieve multidisciplinaire overleg duidelijk is dat adjuvante chemotherapie waarschijnlijk dan wel noodzakelijk is?
Aanbeveling
Beschouw adjuvante chemotherapie niet als contra-indicatie voor een directe borstrecon-structie.
Overwegingen
Kwaliteit van bewijs
De kwaliteit van bewijs is zeer laag.
Waarden en voorkeuren van patiënten
Voor een meerderheid van vrouwen levert een directe reconstructie een acceptabele kwaliteit van leven op en zorgt voor minder psychische morbiditeit (Pusic et al., 2017). Anderzijds kan een uitgestelde reconstructie vrouwen meer tijd geven om te bepalen welk type reconstructie zij willen en om te herstellen van de borstkankerbehandeling, zowel fysiek als emotioneel (Agarwal et al., 2011; Murray et al., 2015; Gopie et al., 2011).
Balans van gewenste en ongewenste uitkomsten
Gewenste uitkomsten zijn: gunstige esthetische uitkomst, minder psychologische belasting en minder additionele operaties en ziekenhuisopnames. Ongewenste uitkomsten zijn: uitstel, meer postoperatieve complicaties, mogelijk slechtere overleving.
Er werd alleen een systematische literatuursearch verricht naar uitstel omdat de review van Harmeling et al. (2015) als uitgangspunt werd gekozen voor een update van de literatuur. In genoemde review was uitstel namelijk de primaire uitkomstmaat.
Mastectomie in combinatie met directe reconstructie leidt, zo wijst het literatuuronderzoek uit, wellicht niet tot meer klinisch relevante vertraging in het starten met adjuvante chemotherapie dan mastectomie alleen. Een odds-ratio van 1,298 voor vertraging (>42 dagen; figuur 2) kan als een niet klinisch-relevante vertraging worden beschouwd.
Harmeling et al. (2015) haalden een review (Oh et al., 2012) aan dat rapporteerde dat de combinatie van adjuvante chemotherapie en directe borstreconstructie geen negatief effect had op postoperatieve wondgenezing, risico op reconstructief falen of het esthetisch resultaat.
De studie van Chavez-MacGregor et al. (2016) gaf aanwijzingen dat wanneer patiënten pas vanaf 91 dagen na definitieve chirurgie adjuvante chemotherapie kregen, het risico op algehele en kanker-specifieke sterfte toenam (hazard ratio: 1,34; 95% BI, 1,15-1,57 respectievelijk 1,27; 95% BI: 1,05-1,53).
De richtlijncommissie meent dat wanneer binnen 42 dagen maar toch uiterlijk binnen 91 dagen (13 weken) de start van de chemotherapie na definitieve chirurgie ligt, de gunstige effecten van directe borstreconstructie zoals minder psychologische belasting en minder operaties zwaarder wegen dan mogelijk ongunstige effecten. Voor een directe borstreconstructie na mastectomie zijn met het oog op het geven van adjuvante chemotherapie geen contra-indicaties aanwezig.
Kosten
Mastectomie gevolgd door directe borstreconstructie vergt minder kosten dan wanneer de borstreconstructie op een later tijdstip wordt uitgevoerd. In het laatste geval is namelijk een extra ziekenhuisopname noodzakelijk.
Aanvaardbaarheid en haalbaarheid
Mastectomie en directe borstreconstructie gevolgd door adjuvante chemotherapie is voor de meeste stakeholders (chirurgen, oncologen en patiënten) een aanvaardbare en haalbare optie.
Onderbouwing
Achtergrond
Tussen 30% en 40% van alle patiënten met borstkanker of ductaal carcinoom in situ ondergaat een mastectomie in Nederland (Van Bommel et al., 2017). Verlies van een borst kan een negatief effect hebben op het zelfbeeld, seksualiteit en gevoel van vrouwelijkheid. Borstreconstructie beoogt de negatieve psychologische effecten van mastectomie te verminderen en zo de kwaliteit van leven te verbeteren.
Borstreconstructie kan direct na mastectomie tijdens dezelfde operatie plaatsvinden (directe reconstructie) of als een uitgestelde behandeling, d.w.z. na voltooiing van de gehele oncologische behandeling. Directe borstreconstructie (IBR) heeft verschillende voordelen t.o.v. uitgestelde reconstructie, zoals gunstige esthetische uitkomsten en minder psychologische belasting, en geen bijkomende operaties, ziekenhuisopnamen en kosten. Daar staat tegenover dat IBR de tijd tot adjuvante chemotherapie kan verlengen, wat een negatief effect zou kunnen hebben op percentages recidief en overleving.
In deze module wordt nagegaan wat de plaats is van een directe reconstructie wanneer in het preoperatieve multidisciplinaire overleg duidelijk is dat adjuvante chemotherapie waarschijnlijk noodzakelijk is.
Definities
- Adjuvante chemotherapie: chemotherapie die wordt gegeven na de mastectomie.
- Vertraging van start adjuvante chemotherapie door directe borstreconstructie: start van chemotherapie na meer dan 6 weken na mastectomie (Treek-norm 2014).
Conclusies / Summary of Findings
|
Zeer laag
GRADE |
Vrouwen die een mastectomie met borstreconstructie hebben gehad
Tijd tot start adjuvante chemotherapie (uitstel)
Directe borstreconstructie na mastectomie lijkt niet te resulteren in een klinisch relevante vertraging van de behandeling met adjuvante chemotherapie.
Harmeling et al. (2015); Losk et al. (2016); Chavez-MacGregor et al. (2016); Johnson et al. (2016) |
Samenvatting literatuur
Review van Harmeling et al. (2015)
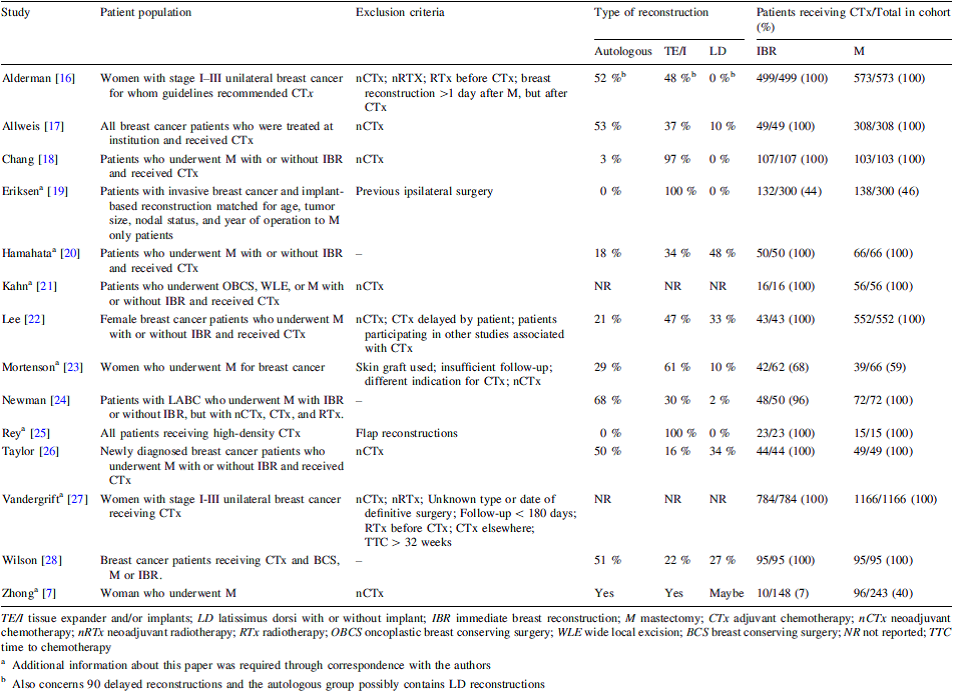
De review van Harmeling et al. had tot doel na te gaan in hoeverre de tijd tot adjuvante chemotherapie bij patiënten die een mastectomie ondergaan wordt beïnvloed door directe borstreconstructie in vergelijking met patiënten die alleen een mastectomie ondergaan. De meeste studies die aan de inclusiecriteria voldeden waren gebaseerd op (regionale) kankerregistraties, werden tussen 1990 en 2011 uitgevoerd en rapporteerden over een periode van 4-7 jaar. De belangrijkste karakteristieken van deze studies staan vermeld in bijlage 3.
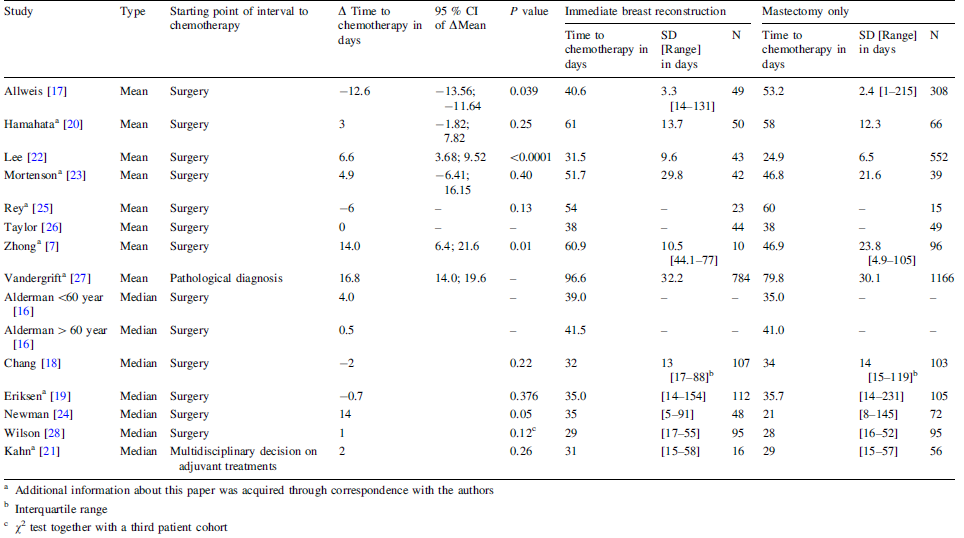
De reviewers vonden 14 studies waarin een gemiddelde (7 studies) of een mediaan (7 studies) werd gerapporteerd. Voor zover het gemiddelde tijden tot adjuvante chemotherapie betreft, valt een sterke statistische heterogeniteit waar te nemen: in één studie was de gemiddelde tijd tot adjuvante chemotherapie in geval van directe borstreconstructie en mastectomie bijna 13 dagen minder, in een andere studie was vanwege directe borstreconstructie de gemiddelde tijd tot adjuvante chemotherapie bijna 17 dagen meer (Figuur 1). Hierbij moet worden opgemerkt dat de studie van Vandergrift et al. de tijd tot adjuvante chemotherapie mat vanaf het stellen van de pathologische diagnose, en niet vanaf het moment van definitieve chirurgie. Drie andere studies die een gemiddelde presenteerden, lieten geen statistisch significant effect zien. Vier studies die een mediane waarde presenteerden lieten eveneens geen statistisch significant effect zien (Figuur 1).
Figuur 1. Verschillen in tijd in dagen (gemiddeld of mediaan) tot adjuvante chemotherapie tussen directe borstreconstructie + mastectomie en alleen mastectomie
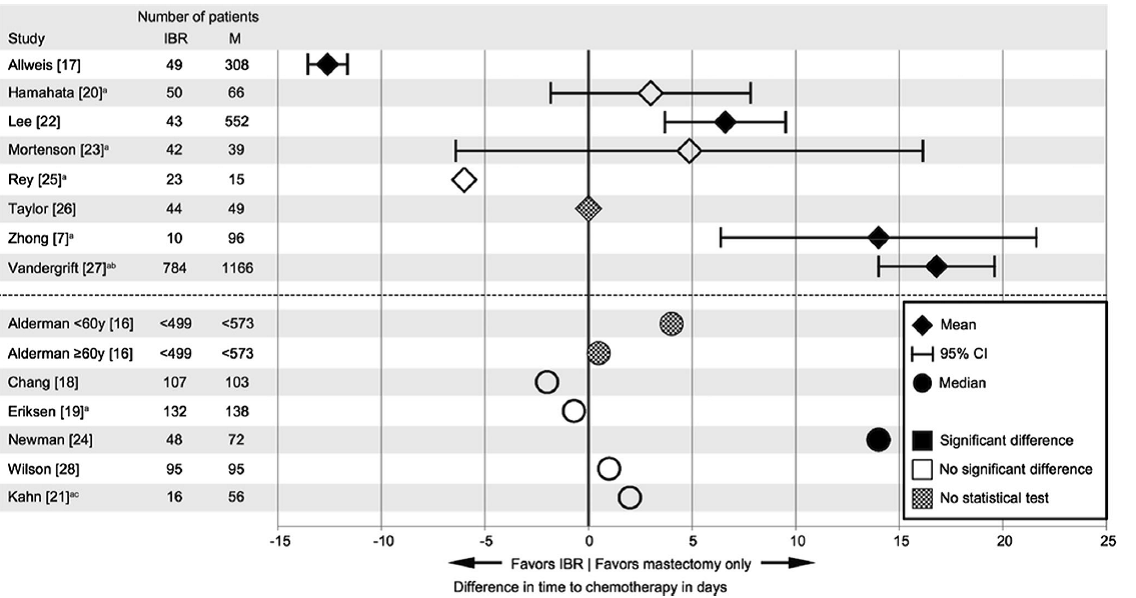
Bron: Harmeling et a. (2015).
Opm.: IBR= directe borstreconstructie + mastectomie; M=mastectomie alleen.
Nieuwe studies
De drie recent gepubliceerde studies (Chavez-MacGregor et al., 2016; Johnson et al., 2016; Losk et al., 2016) rapporteerden op verschillende wijzen de uitkomstmaat tijd tot adjuvante chemotherapie en analyseerden deze verschillend:
- Losk et al. (2016) rapporteerden hun resultaten in drie frequentieklassen: tijd tot adjuvante chemotherapie <28 dagen; 29< tijd tot adjuvante chemotherapie <41 dagen; tijd tot adjuvante chemotherapie ≥42 dagen. In deze studie werden tijden tot adjuvante chemotherapie van patiënten die mastectomie én directe borstreconstructie ondergingen vergeleken met tijden tot adjuvante chemotherapie van patiënten die alleen mastectomie hadden ondergaan;
- Johnson et al. (2016) rapporteerden het aantal weken tot adjuvante chemotherapie als onderdeel van een multivariate regressieanalyse. In deze analyse werden patiënten die mastectomie én directe borstreconstructie hadden ondergaan vergeleken met de totale groep van patiënten die mastectomie of borstsparende therapie hadden ondergaan;
- Chavez-MacGregor et al. (2016) rapporteerden odds ratio’s voor delay (tijd tot adjuvante chemotherapie ≥91 dagen) in een multivariate logistische regressie. In deze analyse werden patiënten die mastectomie én directe borstreconstructie hadden ondergaan, vergeleken met de totale groep van patiënten die mastectomie of borstsparende therapie hadden ondergaan.
Ter informatie: Zowel de studie van Johnson et al. als die van Chavez-MacGregor et al. zijn indirect bewijs, omdat in de multivariate analyses de referentiegroep – de groep waarmee patiënten die mastectomie en direct reconstructie ondergingen werden vergeleken – naast patiënten die mastectomie hadden ondergaan, ook patiënten bevatte die een borstsparende therapie hadden ondergaan.
Tijd tot adjuvante chemotherapie (update systematische review van Harmeling met studie van Losk)
Voor Losk et al. was een uitstel onaanvaardbaar lang als de periode tussen chirurgie en het starten van de chemotherapie 42 dagen of meer was.
De mediane tijd tot adjuvante chemotherapie was 34,0 dagen (IQR: 15,0 dagen) en 26,9% van de vrouwen (gemiddeld 51 jaar oud) had een uitstel van adjuvante chemotherapie van 6 weken of langer. Tussen vrouwen die alleen een mastectomie en vrouwen die een mastectomie met directe borstreconstructie hadden ondergaan was geen statistisch significant verschil in tijd tot adjuvante chemotherapie (tabel 1).
Tabel 1. Tijd tot adjuvante chemotherapie
|
|
Tijd tot adjuvante chemotherapie |
||
|
<28 dagen |
29-41 dagen |
≥42 dagen |
|
|
Mastectomie |
23 (25.8%) |
32 (36.0%) |
34 (38.2%) |
|
mastectomie + borstreconstructie |
36(21.3%) |
74(43.8%) |
59 (34.9%) |
|
Total |
59 |
106 |
93 |
Opm.: Pearson Chi-kwadraat: 1,571; df=2; p=0,456.[1]
De studie van Losk et al. (2016) – de enige studie met direct bewijs – kan worden gebruikt voor een meta-analyse waarbij het risico op tijd tot adjuvante chemotherapie > 42 dagen als effectmaat voor uitstel wordt gebruikt. Hiertoe is van de studies die in Figuur 1 werden vermeld, en voor zover deze gemiddelden en standaarddeviaties of IQR rapporteerden, berekend wat het percentage uitstel van adjuvante chemotherapie was onder de aanname van een normale verdeling (Figuur 2).
Figuur 2. Risico op uitstel (>42 dagen tot adjuvante chemotherapie) van adjuvante chemotherapie bij vrouwen die mastectomie en directe borstreconstructie hebben ondergaan vergeleken met vrouwen met alleen mastectomie; meta-analyse van cohortstudies

Opm.: 1. random effect meta-analyse uitgevoerd door richtlijncommissie. Odds ratio > 1 impliceert grotere kans op uitstel in geval van mastectomie + directe reconstructie.
2. Sensitiviteitsanalyse liet zien dat de studie van Van der Grift et al. (2013) geen significant effect op de gepoolde uitkomst had.
Vrouwen die mastectomie met directe borstreconstructie hebben ondergaan, hebben volgens de meta-analyse (fig. 2) een grotere kans op uitstel (odds ratio: 1,298; 95% BI: 0,525 – 3,210) dan vrouwen die alleen mastectomie hebben ondergaan. Dit kan echter op toeval (de odds ratio van 1,298 is niet statistisch significant verschillend van 1,0) berusten en er is tevens sprake van een zeer grote statistische heterogeniteit (I2 > 75%) van de individuele odds ratio’s.
De multivariate analyse van Losk et al. (2016) liet na correctie voor potentiële confounders als leeftijd, etniciteit, verzekeringsstatus, datum van chirurgie, tumorstadium, tumor subtype, late uitslag pathologie ook een statistisch niet significant verhoogd risico op uitstel zien (odds ratio: 1,53; 95% BI: 0,77–3,04).
Tijd tot adjuvante chemotherapie (studies van Johnson en Chavez-MacGregor; indirect bewijs)
Johnson et al. (2016) definieerden tijd tot adjuvante chemotherapie als de tijd vanaf de initiële diagnose (klinisch of microscopisch bevestigd) tot aan de start van adjuvante chemotherapie. De gemiddelde tijd tot adjuvante chemotherapie was 10,2 weken, ofwel 71,4 dagen. Zesentachtig procent van de vrouwen was tussen 40 en 64 jaar oud.
Vrouwen die een directe borstreconstructie hadden ondergaan, startten volgens de uitkomsten van een multipele regressieanalyse gemiddeld 2,22 weken (95% BI: 1,13 – 3,31) later met adjuvante chemotherapie in vergelijking met vrouwen die geen directe borstreconstructie hadden ondergaan. Deze laatste groep bestond niet alleen uit vrouwen die mastectomie hadden ondergaan maar ook uit vrouwen bij wie een borstsparende ingreep was verricht, een ingreep die volgens de uitkomsten van de multivariate analyse 0,66 weken minder vertraging van adjuvante chemotherapie opleverde. Met andere woorden, deze 2,22 weken zijn een overschatting. In deze multivariate analyse werd gecorrigeerd voor de volgende factoren: geografische herkomst (stad/platteland), aanrijdtijd tot ziekenhuis, ziekenhuis, woonregio, tumorsublocatie, tumorhistologie, tumorstadium, type chirurgie, borstreconstructie, leeftijd van de patiënt op het moment van diagnose.
Chavez-MacGregor et al. (2016) definieerden tijd tot adjuvante chemotherapie als de tijd tussen de datum van definitieve chirurgie tot de datum van de eerste toediening van adjuvante chemotherapie. De mediane tijd tot adjuvante chemotherapie was 46 dagen bij vrouwen met een mediane leeftijd van 53 jaar.
Uitstel in tijd tot adjuvante chemotherapie werd gedefinieerd als toediening van chemotherapie vanaf 91 dagen of later. Vrouwen die een directe borstreconstructie hadden ondergaan, hadden volgens de uitkomsten van een logistische regressie een groter risico op delay dan vrouwen die geen borstreconstructie hadden ondergaan (odds ratio: 1,51; 95% BI: 1,31-1,74). Deze laatste groep vrouwen bestond niet alleen uit vrouwen die mastectomie hadden ondergaan maar ook uit vrouwen bij wie een borstsparende ingreep was verricht, een ingreep die volgens de uitkomsten van de multivariate analyse minder risico op delay van adjuvante chemotherapie opleverde (odds ratio: 0,90; 95% BI: 0,82-0,99). Met andere woorden, de odds ratio van 1,51 overschat het risico. In deze multivariate analyse werd gecorrigeerd voor de volgende factoren: leeftijd, etniciteit, jaar van diagnose, sociaaleconomische status, tumorstadium, subtype borstkanker, huwelijkse status, type borstchirurgie, verzekeringsstatus, en of de patiënt werd behandeld in een door de NCI aangewezen centrum voor behandeling van kanker.
Omdat in de gehele groep vrouwen (mastectomie ± directe borstreconstructie en borstsparende therapie) het percentage uitstel 9,8 was, kan de odds ratio van 1,51 ook geduid worden als een relatief risico. Met andere woorden, vrouwen die een borstreconstructie hadden ondergaan, hadden in plaats van 9,8% een 1,5 maal grotere kans op uitstel, namelijk 14,8%, dan vrouwen die geen borstreconstructie hadden ondergaan. Nota bene: dit percentage is een overschatting vanwege de hiervoor genoemde reden.[2]
Kwaliteit van bewijs
Harmeling et al. (2015) rapporteerden dat de meeste studies niet voldoende corrigeerden voor potentiële confounders als roken en type reconstructie (autoloog, tissue expander, latissimus dorsi +/- implantaat) en de follow-up niet lang genoeg was, incompleet was of verschilde tussen beide groepen (mastectomie + borstreconstructie vs. mastectomie). In de studie van Losk et al. (2016) werd eveneens onvoldoende gecorrigeerd voor potentiële confounders en werd geen informatie over verlies voor follow-up verstrekt. Er is dan ook sprake van een ernstig risico op bias. Daarnaast was sprake van zeer ernstige statistische heterogeniteit van de effectschattingen.
De geïncludeerde studies kunnen als prognostische studies worden getypeerd. Prognostische studies die opgezet zijn om te bevestigen dat er een onafhankelijke relatie bestaat tussen een specifieke potentiele prognostische factor en een uitkomstmaat starten initieel als hoge kwaliteit van bewijs. Prognostische studies die zijn opgezet om associaties op te sporen tussen
potentiële prognostische factoren en een uitkomstmaat starten als redelijke kwaliteit van bewijs.
In alle studies die werden geïncludeerd in de review van Harmeling et al. en de drie studies die in het voorgaande werden besproken is sprake van studies die zijn opgezet om associaties van potentiële prognostische factoren en de uitkomst tijd tot adjuvante chemotherapie op te sporen.[3],[4] De initiële kwaliteit van bewijs is dan ook redelijk. Vanwege ernstig risico op bias en vanwege ernstige inconsistentie werd met twee niveaus afgewaardeerd: van redelijk naar zeer laag.
[1] Berekend door richtlijncommissie.
[2] In de multivariate analyse werden de risico’s van mastectomie alleen en mastectomie met mammareconstructie beide vergeleken met lumpectomie als referentiecategorie (odds ratio: 1). De respectievelijke odds ratio’s zijn 3,32 en 5,09. Met andere woorden, de odds ratio voor mastectomie met mammareconstructie vs. mastectomie alleen is 5,09/3,32= 1,53.
[3] Zie Huguet A, Hayden JA, Stinson J, McGrath PJ, Chambers CT, Tougas ME, Wozney L. Judging the quality of evidence in reviews of prognostic factor research: adapting the GRADE framework. Syst Rev. 2013 Sep 5;2:71.
[4] Omdat de studies van Johnson et al. (2016) en van Chavez-MacGregor et al. (2016) door hun indirecte bewijs niets toevoegen aan de kwaliteit van bewijs, zijn ze verder buiten beschouwing gelaten in de beoordeling.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep een systematische literatuuranalyse verricht met de volgende PICO-vraagstelling en de in Tabel 1 aangegeven selectiecriteria:
Wat is het verschil in effect van een mastectomie en directe reconstructie gevolgd door chemotherapie op uitstel van adjuvante chemotherapie in vergelijking met een mastectomie zonder directe reconstructie gevolgd door chemotherapie?
Tabel 1. Selectiecriteria
|
Type studies |
|
|
Type patiënten |
|
|
Interventie |
|
|
Controle |
|
|
Type uitkomstmaten |
ongewenste effecten ten gevolge van chirurgie en/of chemotherapie: kritieke uitkomstmaten (GRADE)
|
|
Type setting |
|
|
Exclusiecriteria |
|
Uitgangspunt voor de literatuuranalyse was de systematische review van Harmeling et al. (2015). De zoekstrategie van deze review werd gebruikt voor een update (zie bijlage 1).
D.d. 14 maart 2017 werd een search verricht in Medline (Ovid SP) en de Cochrane Library (DARE en Central) waarbij gezocht werd naar studies die vanaf 2014 werden gepubliceerd. In Medline werden 238 en in de Cochrane Library 14 studies gevonden. Hiervan leken op basis van titel/abstract 7 studies bruikbaar (El-Sabawi et al., 2015; Barry et al., 2014; Chavez-MacGregor et al., 2016; Dolen et al., 2016; Hamahata et al., 2015; Johnson et al., 2016; Losk et al., 2016).
Na beoordeling van de volledige tekst werden de studies van Barry et al., El-Sabawi et al. en Dolen et al. geëxcludeerd (zie bijlage 2 voor redenen van exclusie). De studie van Hamahata et al. was reeds opgenomen in Harmeling et al. (2015). Geïncludeerd werden dus de studies van Chavez-MacGregor et al., Johnson et al. en Losk et al. De studies van Chavez-MacGregor et al., Johnson et al. en Losk et al. zijn alle cohortstudies waarin patiënten werden geïncludeerd die borstsparende therapie of mastectomie, al of niet in combinatie met directe borstreconstructie, hadden ondergaan, waarbij door middel van univariate of multivariate analysen het effect van directe borstreconstructie werd onderzocht.
Referenties
- Agarwal, P., Patel, A. K., Saxena, A., & Mishra, A. Assessment of quality of life after breast reconstructive surgery following mastectomy for carcinoma breast. J Surg Pak. 2011;16(2):50-55.
- Van Bommel et al., 2017) Clinical auditing as an instrument for quality improvement in breast cancer care in the Netherlands: The national NABON Breast Cancer Audit. J Surg Oncol. 2017;115(3):243-249.
- Chavez-MacGregor, M., et al. Delayed initiation of adjuvant chemotherapy among patients with breast cancer. JAMA Oncol. 2016;2(3):322-329.
- Gopie JP, Hilhorst MT, Kleijne A, Timman R, Menke-Pluymers MB, Hofer SO, Mureau MA, Tibben A. Women's motives to opt for either implant or DIEP-flap breast reconstruction. J Plast Reconstr Aesthet Surg. 2011;64(8):1062-7.
- Johnson, A., et al. Access to care in Vermont: factors linked with time to chemotherapy for women with breast cancer-a retrospective cohort study. J Oncol Pract. 2016;12(9):e848-857.
- Losk, K., et al. Factors associated with delays in chemotherapy initiation among patients with breast cancer at a comprehensive cancer center. J Nat Compreh Cancer Netw. 2016;14(12):1519-1526.
- Murray CD, Turner A, Rehan C, Kovacs T. Satisfaction following immediate breast reconstruction: Experiences in the early post-operative stage. Br J Health Psychol. 2015;20(3):579-93.
- Oh E, Chim H, Soltanian HT. The effects of neoadjuvant and adjuvant chemotherapy on the surgical outcomes of breast reconstruction. J Plast Reconstr Aesthet Surg. 2012;65(10):e267280.
- Pusic AL, Matros E, Fine N, Buchel E, Gordillo GM, Hamill JB, Kim HM, Qi J, Albornoz C, Klassen AF, Wilkins EG. Patient-reported outcomes 1 year after immediate breast reconstruction: results of the mastectomy reconstruction outcomes consortium study. J Clin Oncol. 2017;35(22):2499-2506.
- Xavier Harmeling J, Kouwenberg CA, Bijlard E, Burger KN, Jager A, Mureau MA. The effect of immediate breast reconstruction on the timing of adjuvant chemotherapy: a systematic review. Breast Cancer Res Treat. 2015; 153(2):241-51.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 08-04-2019
Beoordeeld op geldigheid : 08-04-2019
Uiterlijk in 2018 bepaalt het bestuur van de Nederlandse Vereniging voor Plastische Chirurgie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Plastische Chirurgie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In 2017 tot 2018
De richtlijnontwikkeling werd ondersteund door J.J.A. de Beer, zelfstandig richtlijnmethodoloog en B. Niël-Weise, zelfstandig richtlijnmethodoloog en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
In 2011 tot 2013
De richtlijnontwikkeling werd ondersteund door B.S. Niël-Weise, arts-microbioloog (n.p.)/epidemioloog, senior adviseur, Kennisinstituut van Medisch Specialisten.
Doel en doelgroep
Doel
Ontwikkelen van een multidisciplinaire kwaliteitsrichtlijn voor borstreconstructies bij vrouwen na borstsparende therapie of ablatio vanwege borstkanker of na een profylactische ablatio.
Doelgroep
De richtlijn beoogt een praktisch handvat te bieden aan plastisch chirurgen en de leden van het multidisciplinair mammateam (oncologisch chirurg, internist-oncoloog, radiotherapeut-oncoloog, radioloog, patholoog, psycholoog, verpleegkundig specialist mammacare-verpleegkundige). Tevens is er een versie voor patiënten ontwikkeld welke zal worden aangepast met de herzieningen in 2018.
Samenstelling werkgroep
Voor het ontwikkelen van de module borstreconstructie en systemische therapie is in 2017 een werkgroep ingesteld, bestaand uit vertegenwoordigers van die specialismen die inhoudelijk direct gerelateerd zijn aan het betreffend onderwerp (zie hiervoor de samenstelling van de werkgroep).
Voor het ontwikkelen van de richtlijn is in oktober 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een borstreconstructie (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Voor de module borstreconstructie en systemische therapie (2017-2018):
Werkgroep
- Dr. M.A.M. Mureau (voorzitter), plastisch chirurg, Erasmus MC Kanker Instituut, Erasmus Universitair Medisch Centrum Rotterdam
- Prof. Dr. R. van der Hulst, plastisch chirurg, Maastricht Universitair Medisch Centrum/Orbis Medisch Centrum/Viecuri Medisch Centrum, Maastricht
- Dr. C.H. Smorenburg, internist-oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
- Mw. C. Willems, Borstkankervereniging Nederland, Utrecht
- Mevr. D. Ligtenberg, Borstkankervereniging Nederland, Utrecht
Meelezers:
- Dr. M.B.E. Menke-Pluijmers, oncologisch chirurg, Albert Schweitzer Ziekenhuis, Dordrecht
- Dr. N.S. Russell, radiotherapeut-oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
- Mw. D. van der Zee, V&VN Verpleegkundig Specialisten, Diakonessenhuis, Utrecht/Zeist.
Met ondersteuning van:
- Mw. B.S. Niël-Weise, arts-microbioloog (niet praktiserend), zelfstandig richtlijnmethodoloog, Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
Voor alle andere teksten (2011-2013):
- Dr. M.A.M. Mureau (voorzitter), plastisch chirurg, Erasmus MC Kanker Instituut, Erasmus Universitair Medisch Centrum Rotterdam
- Prof. Dr. R. van der Hulst, plastisch chirurg, Maastricht Universitair Medisch Centrum/Orbis Medisch Centrum/Viecuri Medisch Centrum, Maastricht
- Dr. L. A.E. Woerdeman, plastisch chirurg, Antoni van Leeuwenhoek / Nederlands Kanker instituut, Amsterdam
- Drs. A.A.W.M Turnhout, plastisch chirurg, Tergooi Ziekenhuis, locatie Hilversum
- Drs. N.A.S. Posch, plastisch chirurg, Haga-ziekenhuis, Den Haag
- Dr. M.B.E. Menke-Pluijmers, oncologisch chirurg, Albert Schweitzer Ziekenhuis, Dordrecht
- Dr. E.J.T. Luiten, oncologisch chirurg, Amphia Ziekenhuis, Breda
- Drs. A.H. Westenberg, radiotherapeut-oncoloog, Arnhems Radiotherapeutisch Instituut, Arnhem
- Dr. J.P. Gopie, psycholoog, Leids Universitair Medisch Centrum, Leiden
- Dr. H.M. Zonderland, radioloog, Academisch Medisch Centrum, Amsterdam
- Drs. M. Westerhof, Borstkankervereniging Nederland, Utrecht
- Mw. E.M.M.Krol-Warmerdam MA, V&VN Verpleegkundig Specialisten, Leids Universitair Medisch Centrum, Leiden
Met ondersteuning van
- Drs. B.S. Niël-Weise, arts-microbioloog (n.p.)/epidemioloog, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Een overzicht hiervan kunt u bij het secretariaat van het Kennisinstituut van Medisch specialisten (KiMS) opvragen en voor de revisie in 2017 bij de Nederlandse Vereniging voor Plastische Chirurgie. Een overzicht van de belangenverklaringen van de werkgroepleden in 2017 vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
Mureau |
Plastisch en reconstructief chirurg |
Voorzitter NVPC; voorzitter commissie kwaliteit; wetenschappelijk commissielid DBIR; lid Clinical Audit Board NBCA.
Behoudens vacatiegeld en km vergoeding zijn deze functies onbetaald. |
geen |
geen |
Voorzitter NVPC |
geen |
geen |
geen |
|
van der Hulst |
Plastisch chirurg |
Werkzaam in de mooi kliniek |
Aandelen in microsure, ontwikkeling robot voor microchirurgie nvty |
geen |
geen |
Hoofdonderzoeker verschillende BREAST trial, gerandomiseerde studie naar effectiviteit en veiligheid lipofilling voor volledige borstreconstructie |
geen |
geen |
|
Smorenburg |
Internist-oncoloog |
Voorzitter richtlijn Borstkanker |
geen |
geen |
geen |
geen |
geen |
geen |
|
Willems |
Namens BVN |
|
|
|
|
|
|
|
|
Ligtenberg |
Namens BVN |
|
|
|
|
|
|
|
|
Hans de Beer |
zelfstandig adviseur richtlijnontwikkeling /richtlijnmethodoloog |
onderzoeker als fellow (onbetaald) |
geen |
geen |
geen |
geen |
geen |
In 2015 en 2016 heb ik workshops over de GRADE-methodiek gegeven bij enkele farmaceuten. Deze activiteiten hebben geen consequenties voor de opdrachtgever of voor het onderhavige project. |
|
Barbara Niël-Weise |
zelfstandig adviseur richtlijnontwikkeling /richtlijnmethodoloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
In 2013 en 2017:
Borstkankervereniging Nederland (BVN) heeft schriftelijk input geleverd tijdens de knelpuntanalyse en in de commentaarfase. Patiënten werden tevens in de werkgroep vertegenwoordigd door een afgevaardigde van Borstkankervereniging Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep, de werkgroepleden en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Borstkankervereniging Nederland (BVN), Zorgverzekeraars Nederland (ZN), College voor Zorgverzekeringen (CvZ) en de Inspectie voor de Gezondheidszorg IGZ via een invitational conference in 2013 en schriftelijk in 2017 . Een verslag van de invitational conference kunt u vinden in de bijlage van deze module.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen [http://www.g-i-n.net/library/international-guidelines-library; https://www.ahrq.gov] en naar systematische reviews [Cochrane Library; Medline]. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
|
|
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
|
|
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
|
|
|
|
|
|
|
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
|
|
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
|
|
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Organisatie van nazorg en nacontrole'.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Hiervoor werd gebruik gemaakt van de methodiek zoals beschreven in Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens werd de richtlijn voorgelegd aan de volgende organisaties ter becommentariëring: Borstkankervereniging Nederland (BVN), Nederlandse Vereniging voor Medische Oncologie (NVMO), Nederlands Huisartsen Genootschap (NHG), Zorgverzekeraars Nederland (ZN), Nederlandse zorgautoriteit (NZA), College voor Zorgverzekeringen (CvZ), Inspectie voor de Gezondheidszorg (IGZ), Achmea, CZ, Menzis en VGZ. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
Database: MEDLINE <1946 to Present incl: Epub Ahead of Print, In-Process & Other Non-Indexed Citations, and MEDLINE Daily>
--------------------------------------------------------------------------------
1 "22".fc_vol. and "chang$".fc_auts. and "2013".fc_pubyr. and "64".fc_pg. (4)
2 from 1 keep 3 (1)
3 "127".fc_vol. and "eriksen$".fc_auts. and "2011".fc_pubyr. and "439".fc_pg. (1)
4 "22".fc_vol. and "hamahata$".fc_auts. and "2013".fc_pubyr. and "1".fc_pg. (0)
5 "22".fc_vol. and "hamahata$".fc_auts. and "2013".fc_pubyr. (0)
6 "14".fc_vol. and "lee$".fc_auts. and "2011".fc_pubyr. and "322".fc_pg. (1)
7 "139".fc_vol. and "mortenson$".fc_auts. and "2004".fc_pubyr. and "988".fc_pg. (1)
8 "6".fc_vol. and "newman$".fc_auts. and "1999".fc_pubyr. and "671".fc_pg. (1)
9 "55".fc_vol. and "rey$".fc_auts. and "2005".fc_pubyr. and "250".fc_pg. (1)
10 "19".fc_vol. and "zhong$".fc_auts. and "2012".fc_pubyr. and "560".fc_pg. (1)
11 "22".fc_vol. and "kubo$".fc_auts. and "2013".fc_pubyr. (16)
12 "impact of immediate breast reconstruction on post*".fc_titl. (2)
13 from 12 keep 1 (1)
14 2 or 3 or 6 or 7 or 8 or 9 or 10 or 13 (8)
15 "controle refs uit artikel".ti. (0)
16 exp Breast Neoplasms/ (255036)
17 exp Breast/ (41487)
18 breast surgery.mp. (3174)
19 (breast* or mastectom*).ti,ab. (379900)
20 exp Breast Neoplasms/su (34005)
21 exp Breast/su (5957)
22 su.fs. (1779206)
23 (16 or 17) and 22 (42002)
24 18 or 19 or 20 or 21 or 23 (385868)
25 "concept P".ti. (1)
26 exp Mammaplasty/ (10465)
27 Tissue Expansion Devices/ (1333)
28 Breast Implants/ (3912)
29 ((breast or mastectom* or mammaplast* or mammoplast* or mastoplast*) adj6 reconstruct*).ti,ab. (8542)
30 Tissue Expansion/ (2028)
31 exp Surgical Flaps/ (54057)
32 (flap or flaps or 'transverse rectus abdominis' or tram or 'latissimus dorsi' or 'deep inferior epigastric perforator' or diep or 'superior gluteal artery perforator' or sgap or 'transverse musculocutaneous gracilis' or tmg or 'superficial inferior epigastric artery' or siea or expander*).ti,ab. (76128)
33 (tissue adj3 expander?).ti,ab. (1714)
34 (skin adj3 expansio*).ti,ab. (497)
35 ((breast or mastectom* or mammaplast* or mammoplast* or mastoplast*) adj6 reconstruct*).kf. (663)
36 (flap or flaps or 'transverse rectus abdominis' or tram or 'latissimus dorsi' or 'deep inferior epigastric perforator' or diep or 'superior gluteal artery perforator' or sgap or 'transverse musculocutaneous gracilis' or tmg or 'superficial inferior epigastric artery' or siea or expander*).kf. (3739)
37 (tissue adj3 expander?).kf. (97)
38 (skin adj3 expansio*).kf. (11)
39 or/26-38 (100373)
40 antineoplastic protocols/ or antineoplastic combined chemotherapy protocols/ or exp combined modality therapy/ (316009)
41 ((systemic adj3 therap*) or antineoplast* or chemotherap* or radiochemotherap* or chemoradiotherap*).ab,ti. (379175)
42 ((systemic adj3 therap*) or antineoplast* or chemotherap* or radiochemotherap* or chemoradiotherap*).kf. (20546)
43 or/40-42 (583442)
44 24 and 39 and 43 (1354)
45 exp clinical trial/ (793992)
46 exp clinical study/ (827657)
47 cohort studies/ or follow-up studies/ or longitudinal studies/ or prospective studies/ or retrospective studies/ (1648698)
48 (trial* or clinical* or rct or prospect* or retrospect* or longitudin* or intervention* or cohort*).ti,ab. (4858802)
49 (follow adj up).ti,ab. (785517)
50 or/45-49 (5832401)
51 43 and 50 (319011)
52 51 (319011)
53 limit 52 to yr="2014 -Current" (62633)
54 27 or 30 or 31 or 32 or 33 or 34 (90285)
55 26 or 28 or 29 or 35 (15850)
56 54 and 55 (6003)
57 24 and 43 and 56 (592)
58 53 and 57 (115)
59 "filter systematic reviews".ti. (0)
60 meta analysis.pt. (76630)
61 (meta-anal$ or metaanal$).af. (137153)
62 (quantitativ$ adj10 (review$ or overview$)).tw. (6643)
63 (systematic$ adj10 (review$ or overview$)).tw. (113170)
64 (methodologic$ adj10 (review$ or overview$)).tw. (8849)
65 (quantitativ$ adj10 (review$ or overview$)).kf. (27)
66 (systematic$ adj10 (review$ or overview$)).kf. (7421)
67 (methodologic$ adj10 (review$ or overview$)).kf. (35)
68 medline.tw. and review.pt. (61982)
69 (pooled adj3 analy*).tw. (13434)
70 (pooled adj3 analy*).kf. (113)
71 "cochrane$".fc_jour. (13068)
72 or/60-71 (246978)
73 24 and 43 and 56 and 72 (12)
74 73 (12)
75 limit 74 to yr="2014 -Current" (4)
76 from 58 keep 1-113 (113)
77 from 73 keep 1-12 (12)
78 from 75 keep 1-4 (4)
79 "burger$".fc_auts. and "immediate breast ".fc_titl. and "2015".fc_pubyr. (1)
80 exp *Breast Neoplasms/su (14328)
81 exp *Breast/su (3981)
82 54 and (80 or 81) (2595)
83 24 and 43 and (55 or 82) (1260)
84 83 (1260)
85 limit 84 to yr="2014 -Current" (311)
86 85 and 72 (16) systrev
87 (85 and 50) not 72 (228)
88 14 and 83 (8)
89 50 and 85 (242)
90 (dutch or german or french or english).la. (24462446)
91 89 and 90 (236)
92 91 not 72 (222)
Cochrane zoekstrategie
Search Name: mammareconstructie maart 2017
Last Saved: 14/03/2017 14:59:32.723
Description:
ID Search
#1 (breast* or mastectom*):ti,ab
#2 MeSH descriptor: [Breast] explode all trees
#3 MeSH descriptor: [Breast Neoplasms] explode all trees
#4 MeSH descriptor: [Breast Neoplasms] explode all trees and with qualifier(s): [Surgery - SU]
#5 MeSH descriptor: [Breast] explode all trees and with qualifier(s): [Surgery - SU]
#6 #1 or #4 or #5
#7 MeSH descriptor: [Mammaplasty] explode all trees
#8 MeSH descriptor: [Tissue Expansion Devices] explode all trees
#9 MeSH descriptor: [Breast Implants] explode all trees
#10 ((breast or mastectom* or mammaplast* or mammoplast* or mastoplast*) near/6 reconstruct*):ti,ab
#11 MeSH descriptor: [Tissue Expansion] explode all trees
#12 MeSH descriptor: [Surgical Flaps] explode all trees
#13 (flap or flaps or 'transverse rectus abdominis' or tram or 'latissimus dorsi' or 'deep inferior epigastric perforator' or diep or 'superior gluteal artery perforator' or sgap or 'transverse musculocutaneous gracilis' or tmg or 'superficial inferior epigastric artery' or siea or expander*):ti,ab
#14 (tissue near/3 expander*):ti,ab
#15 (skin near/3 expansio*):ti,ab
#16 #7 or #8 or #9 or #10 or #11 or #12 or #13 or #14 or #15
#17 #6 and #16
#18 MeSH descriptor: [Antineoplastic Protocols] explode all trees
#19 MeSH descriptor: [Antineoplastic Combined Chemotherapy Protocols] explode all trees
#20 MeSH descriptor: [Combined Modality Therapy] explode all trees
#21 ((systemic near/3 therap*) or antineoplast* or chemotherap* or radiochemotherap* or chemoradiotherap*):ti,ab
#22 #18 or #19 or #20 or #21
#23 #17 and #22
#24 #22 and #6 and #16
Exclusietabellen
|
Studie |
Reden van exclusie |
|
Barry et al., 2014 |
Vrouwen die mastectomie, directe borstreconstructie en adjuvante chemotherapie kregen werden vergeleken met vrouwen die borstsparende therapie en adjuvante chemotherapie kregen. |
|
El-Sabawi et al., 2015 |
Dit betreft een niet goed uitgevoerde systematic review: de zoektermen zijn onvolledig, de inclusiecriteria verschillen essentieel van de systematische review van Harmeling et al. (2015) die uitgangspunt is voor de update, en een beoordeling van de methodologische kwaliteit van de studies is afwezig. |
|
Dolen et al., 2016 |
Deze studie betreft de gevolgen van chemotherapie voor de borstreconstructie. |
Barry, P. N., et al. (2014). "Delay of adjuvant chemotherapy after elective mastectomy and immediate reconstruction in breast-conservation candidates: a matched-pair analysis." American Journal of Clinical Oncology 37(6): 575-579.
Dolen, U. C., et al. (2016). "Impact of Neoadjuvant and Adjuvant Chemotherapy on Immediate Tissue Expander Breast Reconstruction." Annals of Surgical Oncology 23(7): 2357-2366.
El-Sabawi, B., et al. (2015). "Breast reconstruction and adjuvant therapy: A systematic review of surgical outcomes." Journal of Surgical Oncology 112(5): 458-464.
|
Study[1] |
Patient population |
Exclusion criteria |
Type of reconstruction |
Patients receiving ctx |
|
|
|
|
|
|
IBR |
M |
|
Losk et al. (2016) |
Women with invasive Stage I–III breast cancer who underwent surgery at 1 of 2 surgical sites At the Dana-Farber/Brigham and Women’s Cancer Center (DF/BWCC), a Harvard-affiliated NCI-Designated Comprehensive Cancer Center |
Patients who received neoadjuvant or investigational Therapy or preoperative radiation therapy, patients With stage IV disease, and male patients were excluded |
Not reported |
169/169 |
89/89 |
|
Study |
Type |
Starting point of interval to chemotherapy |
Frequencies |
p-value of chi-square test of differences in relative frequencies |
|
Losk et al. (2016) |
Frequency classes (≤28 Days, N = 160; 29–41 Days, N=122; ≥42 Days, N=141) |
Surgery |
Table 1 in text |
Table 1 in text |
[1] De studies die niet zijn beoordeeld voor de kwaliteit van bewijs zijn om deze reden niet tabellarisch samengevat.
