Leefstijl en borstkanker
Uitgangsvraag
Wat is het optimale beleid ten aanzien van leefstijlinterventies voor patiënten met borstkanker (en ter preventie van borstkanker)?
Aanbeveling
Universele (primaire) preventie borstkanker
Geef – naar behoefte van de patiënt - voorlichting over het verhoogde risico op borstkanker bij roken, inactiviteit, overgewicht en alcoholgebruik en over de mogelijkheden voor doorverwijzing met behulp van een plan van aanpak.
Bespreek daarbij de volgende punten met de patiënt:
- Zowel actief als passief roken is geassocieerd met een verhoogd risico op het ontwikkelen van borstkanker.
- Overgewicht en obesitas leiden tot een verhoogd risico op het krijgen van borstkanker. Bij postmenopausale vrouwen is de associatie aanwezig met ER-positief borstkanker, bij premenopausale vrouwen met ER-negatieve en triple-negatieve borstkanker.
- Voldoende lichaamsbeweging (30 minuten per dag of 150 minuten per week matig tot zware inspanning) is geassocieerd met een verminderd risico op het krijgen van borstkanker.
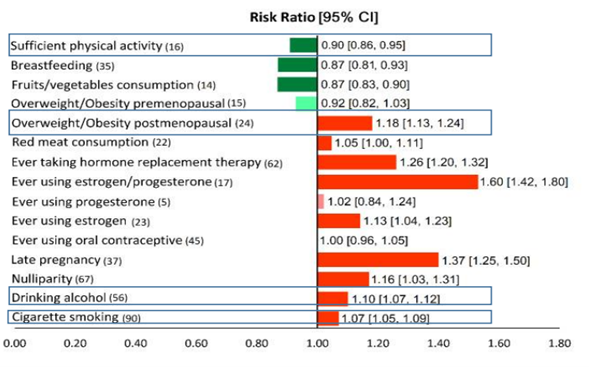
In bovenstaande figuur zijn factoren in kaart gebracht die de kans op borstkanker verhogen of verlagen. Bron: Poorolajal, et al. Factors for the Primary Prevention of Breast Cancer: A Meta-Analysis of Prospective Cohort Studies. J Res Health Sci. 2021 Jul 20;21(3):e00520
Voor adviezen ten aanzien van een plan van aanpak zie onderaan de aanbevelingen
Zorggerelateerde/secundaire preventie na borstkanker
Informeer patiënten met borstkanker naar behoefte over de risico's van alcoholgebruik, roken, gebrek aan beweging en overgewicht in relatie tot de kans op terugkeer van de ziekte en hun overlevingskansen. Adviseer hen om deze factoren aan te pakken. Bespreek daarbij de volgende punten:
- Roken verhoogt de kans op terugkeer van borstkanker en heeft een negatieve invloed op de overleving. Daarnaast vergroot roken de kans op borstkanker aan de andere borst. Bij patiënten die radiotherapie krijgen, is er mogelijk ook een verhoogd risico op longkanker door roken.
- Overgewicht en obesitas zijn onafhankelijke risicofactoren voor een hoger risico op terugkeer van borstkanker en verminderen de overlevingskansen.
- Lichaamsbeweging verbetert de kwaliteit van leven en verlaagt de (borstkanker-gerelateerde) sterfte.
- Alcoholgebruik van meer dan één eenheid per dag kan mogelijk het risico op terugkeer van borstkanker verhogen. Dit risico is groter bij postmenopauzale vrouwen en vrouwen met obesitas.
Voor adviezen ten aanzien van een plan van aanpak zie onderaan de aanbevelingen
(Neo-)adjuvante behandeling en metastasering
-
- Roken: er is een mogelijk verband tussen roken en verminderde effectiviteit van (neo-) adjuvante behandelingen bij borstkanker. Daarnaast kan roken mogelijk bijdragen aan de metastasering van borstkanker, al is het bewijs hiervoor nog onzeker.
- Overgewicht/obesitas: het voorkómen van gewichtstoename tijdens (neoadjuvante) chemotherapie kan mogelijk leiden tot betere oncologische uitkomsten.
- Bewegen: Er is minder bekend over het effect van lichaamsbeweging specifiek tijdens de behandeling van borstkanker. Toch mag worden aangenomen dat, zoals in andere gevallen, de belangrijkste voordelen liggen in het verbeteren van de kwaliteit van leven.
Aanbeveling:
-
- Ten aanzien van overgewicht/obesitas: als een patiënt overgewicht of obesitas heeft bij de diagnose borstkanker, is het niet realistisch om gewichtsverlies te adviseren vóór de start van chemotherapie. Bij neoadjuvante behandeling begint de therapie vaak binnen enkele weken, en in de adjuvante setting zal eerst een operatie en eventueel bestraling plaatsvinden. Beide situaties zijn ongeschikt voor gewichtsverlies. Begeleid de patiënt voorafgaand aan en tijdens chemotherapie met advies over voeding en beweging, gericht op het voorkomen van gewichtstoename en het verbeteren van de kwaliteit van leven. Overweeg hierbij de expertise van fysiotherapeuten en diëtisten in te schakelen.
Voor adviezen ten aanzien van een plan van aanpak zie onderaan de aanbevelingen
Complicaties van behandelingen voor borstkanker
- Roken: het risico op postoperatieve complicaties bij borstoperaties, met of zonder reconstructie, is significant verhoogd bij patiënten die roken. Mogelijke complicaties zijn onder andere wondinfecties, skin flap necrose, epidermolyse, kapselcontractie en lapfalen. Ook het risico op complicaties van radiotherapie bij borstsparende therapie is verhoogd bij rokers. Roken verhoogt mogelijk het risico op het ontwikkelen van huidreacties bij radiotherapie, en ook het al bestaande risico op longkanker.
- Overgewicht/obesitas: patiënten met obesitas lopen een groter risico op perioperatieve en postoperatieve complicaties bij mammachirurgie (in de breedste zin), vergeleken met patiënten met een BMI onder de 25 kg/m². De cosmetische resultaten van de chirurgie zijn vaak ook minder gunstig bij patiënten met obesitas, en het risico op complicaties bij reconstructieve ingrepen is sterk verhoogd.
- Alcohol: er is momenteel weinig en tegenstrijdig bewijs over de invloed van alcoholgebruik op het risico van postoperatieve complicaties.
Aanbeveling:
- Bespreek de risico's van roken met patiënten tijdens hun behandeltraject, vooral de sterk verhoogde kans op complicaties na borstchirurgie. Overweeg af te zien van een directe borstreconstructie bij patiënten die roken en niet kunnen stoppen.
- Bespreek met patiënten het verhoogde risico op peri- en postoperatieve complicaties als gevolg van overgewicht of obesitas. Maak voor elke patiënt een individuele risico-inschatting op basis van de tumoreigenschappen, andere gezondheidsproblemen (co-morbiditeiten), en leeftijd.
Voor adviezen ten aanzien van een plan van aanpak zie onderaan de aanbevelingen
Medicatie en leefstijlfactoren
Bekijk de ‘factsheet van de richtlijn Overgewicht en Obesitas bij volwassenen’ voor meer informatie over de invloed van medicatie op overgewicht. Mogelijke bespreekpunten met de patiënt zijn:
- Vraag medicatiegebruik goed uit in de spreekkamer. Het is belangrijk niet alleen te informeren naar medicatie die gericht is op gewichtsverlies, maar ook naar middelen die het gewicht kunnen verhogen.
- Controleer of het mogelijk is om deze medicatie af te bouwen of te stoppen. Dit kan bijdragen aan gewichtsvermindering en mogelijk gunstige effecten hebben op de behandeling van borstkanker.
Plan van aanpak verschillende leefstijlaanpassingen
|
Algemeen: Geef – naar behoefte van de patiënt - voorlichting over de verschillende leefstijlfactoren en bespreek of de patiënt behoefte heeft aan begeleiding bij leefstijlverandering. Dit kan via de eerste lijn verlopen. Maak samen met de patiënt een plan waarbij gebruik kan worden gemaakt van onderstaande mogelijkheden: Stoppen met roken: Bespreek en verwijs naar bijvoorbeeld de huisarts of de ‘stoppen met roken poli’ in uw ziekenhuis.
Overgewicht/obesitas: Partnerschap Overgewicht Nederland
Bewegen: Nederlandse Norm Gezond Bewegen (NNGB)
Alcohol: Advies alcoholgebruik volwassenen - ALCOHOLinfo.nl
Inmiddels zijn er verschillende ziekenhuizen met een leefstijlloket of leefstijlpoli. Patiënten kunnen vanuit daar begeleid worden of zij kunnen verwezen worden naar een andere instantie voor begeleiding.
Uiteraard dient een plan te worden aangepast aan de patiënt en de geldende omstandigheden.
|
Overwegingen
Onderstaand een overzicht van het effect van leefstijl op de universele preventie van borstkanker, de zorggerelateerde preventie na borstkanker en de complicaties van behandeling.
Deze module behandelt de volgende onderwerpen:
- Universele preventie borstkanker
- Zorggerelateerde (secundaire) preventie na mammacarcinoom
- Leefstijlinterventies tijdens of na (neo-)adjuvante behandeling en metastasering
- Complicaties van operatieve en bestralingsbehandelingen voor borstkanker
- Medicatie en leefstijlfactoren
- Het effect van leefstijlinterventies op de kwaliteit van leven na de behandeling voor borstkanker
- Waarden en voorkeuren van patiënten (en evt. hun naasten)
- Kosten (middelenbeslag)
1. Universele preventie borstkanker
Roken
De schadelijke effecten van tabaksrook, waaronder de kankerverwekkende (carcinogene) effecten, zijn algemeen bekend (Agency research cancer, 2012). Roken beïnvloedt onder andere de hormoonhuishouding. Nicotine zorgt ervoor dat er meer adrenale androgenen (mannelijke hormonen) worden geproduceerd via de stimulatie van adrenocorticotrope hormonen (ACTH) (Baron, 1990). Daarnaast vermindert roken de activiteit van aromatase, een enzym dat androgenen omzet in oestrogenen (vrouwelijke hormonen), waardoor minder oestrogenen worden aangemaakt (MacMahon, 1982; Khaw, 1988; Baron, 1990; Ihenacho, 2022). Hoge niveaus van androgenen in het bloed worden in verband gebracht met een verhoogd risico op borstkanker bij zowel pre- als postmenopauzale vrouwen (Key, 2002; Key, 2013; Ihenacho, 2022). Een grote Zweedse cohortstudie onder 65.000 postmenopauzale vrouwen toonde aan dat hoge testosteronspiegels in het bloed gerelateerd waren aan roken (OR 1,85 [95% CI 1,06-3,23]). Daarnaast bleek dat het roken van 10 sigaretten per dag het risico op borstkanker met een factor 1,55 verhoogde (Manjer, 2005).
Epidemiologisch onderzoek heeft aangetoond dat zowel actief als passief roken het risico op borstkanker verhoogt. Dit wordt ondersteund door verschillende studies, meta-analyses en systematische reviews (Morabia, 2002; Hamajima, 2002; Gaudet, 2013; Macau, 2015). Morabia (2002) publiceerde een overzicht van het epidemiologische bewijs voor deze relatie, zonder een meta-analyse uit te voeren. Hoewel alle geïncludeerde studies een relatief risico (RR) van 1,1 tot 3,5 voor actief roken en borstkanker rapporteerden, werd slechts in 6 van de 12 studies statistische significantie bereikt. Het verhoogde risico werd ook bevestigd door een grote gecombineerde cohortstudie van de ‘Collaborative Group’ uit datzelfde jaar, waarbij meer dan 58.000 borstkankergevallen werden onderzocht. Na correctie voor alcoholgebruik werd een RR van 1,05 (95% CI 1,01-1,09) voor actief roken gevonden (Hamajima, 2002). In 2013 werden meer dan 73.000 Amerikaanse vrouwen geanalyseerd, van wie er 3.721 borstkanker ontwikkelden gedurende een mediane follow-up van bijna 14 jaar (Gaudet, 2013). Voor zowel actieve rokers als ex-rokers werd een verhoogd risico gevonden, met respectievelijke hazard ratios (HR) van 1,25 [95% CI 1,07-1,42] en 1,13 [95% CI 1,06-1,21]. Een meta-analyse uit dezelfde studie toonde eveneens een verhoogd risico voor actieve rokers (HR 1,12 [95% CI 1,08-1,16]) en ex-rokers (HR 1,09 [95% CI 1,04-1,15]) (Gaudet, 2013).
Het risico op borstkanker lijkt dus te verschillen tussen ex-rokers en actieve rokers. Dit werd in 2015 opnieuw bevestigd met een meta-analyse (Macacu, 2015). Hoewel zowel prospectieve als retrospectieve studies waren opgenomen, toonde de analyse van alleen de prospectieve studies (n=31, met lage heterogeniteit, I2 = 0%) een relatief risico (RR) van 1,13 (95% CI 1,09-1,17) voor actief roken (Macacu, 2015). Zelfs wanneer ex-rokers werden meegerekend, bleef het risico verhoogd, met een RR van 1,10 (95% CI 1,09-1,12) (Macacu, 2015). Passief roken werd onderzocht in elf prospectieve studies en liet een RR van 1,07 (95% CI 1,02-1,13) zien, met een lage heterogeniteit (I2 = 1%) (Macacu, 2015). In 2017 werd een cohort van bijna 103.000 vrouwen onderzocht, waarvan er 1.815 borstkanker ontwikkelden tijdens een gemiddelde follow-up van 7,7 jaar. De hazard ratio (HR) voor ex- en actieve rokers was 1,14 (95% CI 1,03-1,25) (Jones, 2017). Nyante, et al. volgden een cohort van 186.000 vrouwen waarvan er bijna 7.500 borstkanker ontwikkelden gedurende een gemiddelde follow-up van 9,6 jaar (Nyante, 2014). Dit onderzoek liet zien dat zowel actieve als ex-rokers een verhoogd risico hadden, met HR's van respectievelijk 1,19 (95% CI 1,10-1,28) en 1,07 (95% CI 1,01-1,13) (Nyante, 2014). Alle bovengenoemde meta-analyses en cohortstudies wijzen op een consistent verhoogd risico (HR 1,1-1,2) op borstkanker voor zowel actieve als voormalige rokers.
In 2015 werd in een meta-analyse de "summary slope estimate"-methode gebruikt om het risico op borstkanker per jaar actief roken te berekenen. Deze summary slope estimate kwam uit op 1,005. Dit betekent dat elk extra jaar roken het relatieve risico (RR) op borstkanker met 1,005 vermenigvuldigt. Omgerekend leidt dit tot een verhoging van het relatieve risico op borstkanker met 5%, 10% en 16% na respectievelijk 10, 20 en 30 jaar roken (Macacu, 2015).
Overgewicht
Naast borstkanker zijn er minstens 13 andere kankersoorten die in verband worden gebracht met obesitas (World Cancer Research Fund, 2018). Verschillende lokale en systemische factoren zijn van invloed op de relatie tussen obesitas en het ontwikkelen van borstkanker, zoals verhoogde niveaus van circulerende insuline, glucose en oestrogenen, die worden geproduceerd door vetcellen (adipocyten). Ook adipokines en ontstekingsmediatoren spelen een rol in dit proces (Brown, 2021).
Een grote prospectieve cohortstudie uit 2007 (Million Women Study, Reeves 2007) toonde aan dat een verhoogde BMI het risico op borstkanker bij postmenopauzale vrouwen vergroot, met een relatief risico van 1,4 per 10 BMI-punten. Binnen deze groep is vooral het risico op oestrogeengevoelige carcinomen verhoogd. In een meta-analyse van Munsel et al. (2014) werd aangetoond dat een BMI boven de 30 geassocieerd is met een summary risk ratio van 1,39 (95% CI: 1,14-1,70) voor receptor-positieve postmenopauzale borstkankers.
Een verhoogde BMI bij premenopauzale vrouwen blijkt het risico op borstkanker juist te verlagen, met een relatief risico (RR) van 0,86 per 10 BMI-punten. Echter, binnen deze groep obese premenopauzale vrouwen is er wel een verhoogd risico op het ontwikkelen van oestrogeenreceptor (ER)-negatieve en triple-negatieve borstkanker. Bij ER-negatieve/HER2-positieve mammacarcinomen is het risico licht verhoogd, maar bij triple-negatieve borstkanker tonen twee meta-analyses een aanzienlijk verhoogd risico van respectievelijk 80% en 43% in geval van obesitas (Picon-Ruiz, 2017).
Voor zowel pre- als postmenopauzale vrouwen is het risico op inflammatoir mammacarcinoom drie tot vijf keer hoger bij obesitas (Picon-Ruiz, 2017). Gewichtsverlies, eventueel door middel van bariatrische chirurgie, verlaagt het risico op het ontwikkelen van borstkanker (Picon-Ruiz, 2017). Daarnaast blijkt een BMI boven de 30 een onafhankelijke risicofactor te zijn voor borstkanker-specifiek overlijden, met een relatief risico (RR) van 1,63 bij een BMI >30 en 2,12 bij een BMI >40. Dit komt mede door de verhoogde kans op recidief (zie ‘preventie na borstkanker’ hieronder) (Calle, 2003).
Lichaamsbeweging
Er zijn honderden observationele studies die beogen het verband tussen lichaamsbeweging en borstkankerrisico in kaart te brengen. Deze studies verschillen echter sterk in opzet, populatie, definities van (voldoende) lichaamsbeweging, duur van de follow-up en de mate waarin er gecorrigeerd wordt voor mogelijke confounders.
Enkele meta-analysen hebben de resultaten van de prospectieve studies gepoold. Een meta-analyse van Poorolajal et al. onderzocht verschillende risicofactoren voor borstkanker, waaronder lichaamsbeweging (Poorolajal, 2021). Deze studie vond een relatief risico (RR) van 0,90 (95% CI 0,86-0,95) voor het ontwikkelen van borstkanker bij "voldoende lichaamsbeweging" (gedefinieerd als minstens 30 minuten matige tot zware fysieke inspanning per dag of 150 minuten per week) in vergelijking met onvoldoende lichaamsbeweging. De resultaten worden echter niet verder uitgesplitst in subcategorieën.
Een eerdere meta-analyse van prospectieve studies die specifiek naar lichaamsbeweging en borstkanker keek (Wu, 2013), evenals een recentere studie (Chen, 2019) maakten wel onderscheid tussen type, hoeveelheid en timing van lichaamsbeweging en het subtype borstkanker. Beide studies rapporteren een relatief risico (RR) op het ontwikkelen van borstkanker van 0,88 (95%CI 0,85-0,91) voor Wu (2013) en 0,87 (95%CI 0,84-0,90) voor Chen (2019) bij voldoende lichaamsbeweging.
Beide meta-analysen beschrijven vergelijkbare resultaten wat betreft verschillende subcategorieën van lichaamsbeweging en type borstkanker. Er werd geen verschil gevonden tussen werkgerelateerde lichaamsbeweging of lichaamsbeweging in de vrije tijd, noch tussen Europese, Aziatische of Amerikaanse populaties. Het verlaagde risico bij voldoende lichaamsbeweging werd gezien bij zowel vrouwen met een BMI onder als boven de 25kg/m2, alsook bij premenopauzale en postmenopauzale vrouwen, en voor zowel ER/PR (progesteron-receptor)-positieve als -negatieve tumoren.
Wu (2013) beschrijft dat het relatieve risico bij voldoende lichaamsbeweging lager is voor premenopauzale vrouwen (RR 0,77 [95% BI 0,72-0,84]), vrouwen met een BMI onder de 25 kg/m² (RR 0,72 [95% CI 0,65-0,81]), en voor ER/PR-negatieve tumoren (RR 0,80 [95% CI 0,73-0,87]). Lichaamsbeweging in alle levensfasen (≤25 jaar, 26-50 jaar, en >50 jaar) is ook geassocieerd met een verlaagd risico op borstkanker (Wu, 2013).
Daarnaast werd er een lineaire dosis-effectrelatie gevonden: hoe meer lichaamsbeweging, hoe lager het risico. Wu (2013) geeft aan dat voor elke extra twee uur matige tot zware recreatieve inspanning per week de kans op borstkanker met 5% afneemt (RR 0,95 [95% CI 0,93-0,97]). Chen (2019) beschrijft ook dat langdurig voldoende lichaamsbeweging (< 1 jaar, 1-5 jaar, > 5 jaar, levenslang) geassocieerd is met een lagere kans op borstkanker.
Deze meta-analyses van observationele studies hebben verschillende beperkingen. Ondanks het gebruik van prospectieve gegevens, kan er bijvoorbeeld sprake zijn van publicatiebias, selectiebias en onbetrouwbare metingen. Daarnaast kunnen verschillende definities van lichaamsbeweging, evenals confounding en covariantie tussen risicofactoren, de resultaten beïnvloeden. Hoewel deze studies een associatie aantonen tussen meer lichaamsbeweging en een lager risico op borstkanker, is er (nog) geen bewijs voor causaliteit.
Concluderend tonen meta-analyses van prospectief observationeel onderzoek aan dat voldoende lichaamsbeweging - meestal gedefinieerd als 30 minuten per dag of 150 minuten per week van matige tot zware inspanning - geassocieerd is met een lagere kans op borstkanker, met een relatief risico (RR) rond de 0,88. Er lijkt een dosis-effectrelatie te zijn: een toename in matige en zware lichaamsbeweging leidt tot een verdere verlaging van het risico op borstkanker. Dit effect lijkt van toepassing op alle leeftijdscategorieën, zowel bij mensen met als zonder overgewicht, en voor zowel pre- als postmenopauzale vrouwen, evenals voor ER/PR-positieve en -negatieve borstkanker. Het is echter moeilijk om een causaal verband te bewijzen, aangezien lichaamsbeweging vaak samenhangt met andere leefstijlfactoren.
Alcoholconsumptie
De consumptie van alcohol verhoogt het risico op verschillende vormen van kanker, waaronder borstkanker (Suzuki, 2005; Agabio, 2022; Zhou X. Yu, 2022; Donat-Vargas, 2021; Freudenheim, 2020; Howell, 2014). Zowel postmenopauzale als premenopauzale vrouwen hebben een verhoogde kans op borstkanker bij alcoholgebruik, waarbij het sterkste bewijs voor een oorzakelijke relatie met borstkanker geldt voor postmenopauzale vrouwen (World Cancer Research Fund, 2018). In een Europese studie werd een sterkere associatie tussen alcoholconsumptie en ER-positieve tumoren vastgesteld (Assi, 2020). Een Amerikaanse studie daarentegen vond geen verschil tussen ER-positieve en ER-negatieve borstkanker, terwijl een onderzoek onder een Afrikaans cohort een sterkere associatie voor triple-negatieve tumoren liet zien (Key, 2019; Baglia, 2018; Jung, 2016).
Het relatieve risico op borstkanker stijgt met 7-10% per 10 gram alcoholinname per dag (World Cancer Research Fund, 2018). Een standaardconsumptie bevat ongeveer 14 gram alcohol. Hoe meer alcohol iemand gedurende zijn leven heeft gedronken, hoe hoger het risico op borstkanker (Donat-Vargas, 2021). Vrouwen die dagelijks één eenheid alcohol consumeren, hebben een lifetime risk op borstkanker dat 7-10% hoger is dan vrouwen die niet drinken. Bij een alcoholinname van vier eenheden per dag is het relatieve risico 50% hoger (Chen, 2011).
De associatie tussen alcoholconsumptie en risico op borstkanker lijkt geen genetische basis te hebben. Onderzoek naar varianten in genen die coderen voor alcoholdehydrogenases - enzymen die essentieel zijn voor de verwerking van alcohol in het lichaam - heeft geen effect op het borstkankerrisico aangetoond (Hahn, 2018). Daarnaast vertoonden patiënten met BRCA1- of BRCA2-genmutaties ook geen extra verhoogd risico op borstkanker als gevolg van alcoholgebruik (Cybulski, 2015).
De onderliggende mechanismen die de relatie tussen alcoholconsumptie en het risico op borstkanker zouden kunnen verklaren, zijn nog onvoldoende onderzocht. Er zijn verschillende hypothesen beschreven, waaronder oxidatieve stress, celproliferatie en hormonaal gestuurde mechanismen (met name gerelateerd aan steroïden) (Yu, 2022). Ethanol verhoogt de expressie van oestrogenen en stimuleert de proliferatie van ER-positieve borstkankercellen (Fan, 2000; Singletary, 2001; Suzuki, 2005). Vanaf een alcoholconsumptie van 15-30 gram per dag stijgt het oestrogeengehalte in het serum (Shield, 2016).
Naast hormonale factoren lijkt ook DNA-schade door acetaldehyde - een metaboliet van alcohol die zich kan ophopen in borstcellen - een rol te spelen bij de inductie van carcinogenese (IARC, 2010). Bovendien kan alcohol het microbioom aantasten, wat mogelijk invloed heeft op het risico op borstkanker (Engen, 2015).
2. Zorggerelateerde (secundaire) preventie na mammacarcinoom
Roken
In een recent gepubliceerde systematische review van Alkhaifi en collega’s werd een significant verhoogde kans op recidief gevonden bij actieve rokers met stadium I-III borstkanker (Alkhaifi, 2022). Dit bevestigt de bevinding in de studie van Pierce et al. die de relatie tussen levenslang roken en de prognose van borstkanker onderzochten (Pierce, 2014). In hun studie bleek dat de kans op recidief 41% groter was voor actieve rokers (n = 710) in vergelijking met niet-rokers (n = 4.812) met een hazard ratio (HR) van 1,41 [95% CI 1,16-1,71]) (Pierce, 2014). Voor ex-rokers werd een dosisafhankelijke relatie gevonden tussen het aantal pakjaren en de kans op recidief borstkanker. Ex-rokers met 20-34,9 pakjaren (n = 808) hadden een 22% hogere kans op recidief vergeleken met niet-rokers (HR 1,22 (95%CI 1,01-1,48)), terwijl het risico met 37% toenam bij ex-rokers met 35 of meer pakjaren (HR 1,37 (95%CI 1,13-1,66) (Pierce, 2014). Deze dosisafhankelijke relatie werd ook aangetoond in de recente studie van Wu (2020). De toegenomen kans op recidief zou kunnen worden verklaard door de cumulatieve schade door tabak-geïnduceerde carcinogenen in de loop der tijd (Pierce, 2014).
Naast het effect van roken op de kans op een locoregionaal recidief, wijzen verschillende onderzoeken ook op een relatie tussen roken en het ontstaan van metastasen bij borstkanker.
Een studie van Huszno et al. (2015) onderzocht deze relatie specifiek voor HER2-positieve borstkanker en vond dat roken een risicofactor was voor de ontwikkeling van levermetastasen tijdens de therapie met trastuzumab. Een eerdere studie (Murin, 2001) vond ook een associatie tussen roken en de ontwikkeling van longmetastasen bij borstkankerpatiënten, maar de auteur gaf ook aan dat verder onderzoek noodzakelijk was (Murin, 2001).
In vitro-studies hebben de onderliggende mechanismen van het verhoogde risico op metastasering door roken onderzocht en geconcludeerd dat borstkankercellen die aan sigarettenrook zijn blootgesteld, fenotypes aannemen die metastasering bevorderen. Dit omvat onder andere verhoogde motiliteit, toegenomen invasiviteit en epitheliale-mesenchymale transitie (Kispert, 2015; Di Cello, 2013).
Samenvattend wijzen deze studies erop dat roken een mogelijke risicofactor is voor metastasering bij borstkanker, maar dat verder onderzoek nodig is om deze relatie te bevestigen. Daarnaast was het risico om te overlijden aan borstkanker 60% hoger onder rokers (HR 1,61 [95% CI 1,28-2,03]), en hadden deze patiënten een twee keer zo hoog risico op overall mortaliteit (HR 2,17 [95% CI 1,85-2,54]) (Pierce, 2014). Dit werd ook bevestigd door de studie van Wu et al. (2020), waarin werd gevonden dat het aantal pakjaren significant geassocieerd was met verhoogde totale en borstkanker-specifieke mortaliteit (Wu, 2020).
Concluderend tonen recente studies een associatie aan tussen roken en de kans op recidief bij borstkanker. Daarbij blijkt de kans op recidief ook afhankelijk te zijn van het aantal pakjaren en of iemand nog actief rookt ten tijde van de diagnose of behandeling. Het is belangrijk om te benoemen dat roken niet alleen het risico op recidief verhoogt, maar ook de kans op overlijden bij borstkankerpatiënten vergroot.
Overgewicht
Obesitas is geassocieerd met slechtere uitkomsten bij borstkankerpatiënten (Lynch, 2011; Vernaci, 2019). Vernaci (2019) vond dat obesitas een onafhankelijke prognostische factor is voor het ontwikkelen van recidief borstkanker, en rapporteerde dat patiënten met obesitas een slechtere overall survival vertoonden na 15 jaar follow-up. Een hogere BMI gaat vaak gepaard met verhoogde insulineresistentie, wat op zijn beurt de kans op recidief vergroot (Gordon, 2021; Sinicrope, 2011). Bovendien produceert meer vetweefsel (en dus meer adipocyten) hogere niveaus van oestrogenen, adipokines en cytokines, met name in postmenopauzale vrouwen (Lyengar, 2018).
Het is bekend dat de oestrogeenhuishouding een significante invloed heeft op het ontwikkelen van borstkanker (Brown, 2021). Circa 84% van alle mammacarcinomen is ER-positief (Mesa-Eguiagaray, 2020). Een verhoogde oestrogeenproductie veroorzaakt, door middel van pro-inflammatoire cytokines, een chronische (subklinische) inflammatie, wat de kans op het ontwikkelen van carcinomen vergroot (Lyengar, 2018; McTiernan, 2018). Bij patiënten met ER-positieve borstkanker blijft het risico op een recidief langer aanhouden (Pan, 2017).
Ook heeft een verhoogde hoeveelheid vetweefsel en/of een hoog BMI een ongunstig effect op de recidiefkans bij patiënten met een triple-negatief mammacarcinoom. Onder andere Widschwenter, et al. vinden een significant slechtere ziektevrije overleving bij patiënten met een BMI boven de 40 (HR 3,02 [95%CI 1,50–6,08]). Dit kan deels verklaard worden door de bovengenoemde toegenomen insulineresistentie en de verhoogde cytokine-afgifte door het vetweefsel, wat de groei van carcinomen beïnvloedt (Zhang, 2022). Hierdoor is de prognose voor triple-negatieve borstkanker bij patiënten met obesitas slechter in vergelijking met die met een gezond lichaamsgewicht (Widschwendter, 2015; Zhang, 2022).
Onderzoek naar de relatie tussen gewichtsverlies na de diagnose en het effect op de recidiefkansen is nog gaande en laat wisselende resultaten zien. Hoewel het behoud van een gezond gewicht over het algemeen wordt geassocieerd met betere gezondheidsuitkomsten, is de specifieke impact van gewichtsverlies op het verminderen van het risico op terugkeer van borstkanker minder duidelijk.
Lichaamsbeweging en leefstijlinterventies
Meerdere studies hebben aangetoond dat er een reductie in de borstkanker-geassocieerde mortaliteit kan optreden van meer dan 25% wanneer patiënten meer dan 10 Metabolic Equivalent of Task (MET) uren per week aan fysieke activiteit ondernemen (Beasly, 2012; Lynch, 2011; Ibrahim, 2010; Borugian, 2004). De mechanismen die aan deze observatie ten grondslag liggen zijn vergelijkbaar met die bij obesitas en omvatten factoren zoals hormoonhuishouding, insulineresistentie, adipokines, en de daaruit voortvloeiende chronische inflammatie (Lynch, 2011).
Daarnaast geeft toename van lichaamsbeweging niet alleen een verlaagd risico op borstkanker-geassocieerde mortaliteit maar ook op de overall mortaliteit (Lynch, 2011). Gewichtstoename na de behandeling voor borstkanker is juist geassocieerd met een slechtere overleving (Camoriano, 1990; Kroenke, 2005). Interventies op het gebied van dieet én lichaamsbeweging zouden deze risico’s kunnen reduceren. Daarnaast heeft bewegen een positieve invloed op de kwaliteit van leven.
Een meta-analyse uit 2020 heeft aangetoond dat er geen significant verschil was in de incidentie van borstkankerrecidief tussen de groep die een leefstijlinterventie onderging en de controlegroep (RR 1,95 [95%CI 0,68-5,60]) (Shaik, 2020). Dit wijst op de noodzaak voor verder onderzoek naar de effectiviteit van gecombineerde leefstijlinterventies (GLI) met betrekking tot de recidiefkans van borstkanker.
Alcoholconsumptie
Het is aangetoond dat alcoholconsumptie gerelateerd is aan het ontwikkelen van borstkanker (Zhou, 2022; Sun, 2020). Het daarnaast van belang om de invloed van alcohol op de ontwikkeling van recidief borstkanker te onderzoeken. In een systematische literatuurreview uit 2016, waarin verschillende studies werden samengevoegd, werd gekeken naar deze relatie (Simapivapan, 2016). Van de 16 geïncludeerde studies toonden 11 studies een licht verhoogde kans op borstkankerrecidief bij patiënten met een hogere alcoholconsumptie. Het vergelijken van deze studies bleek moeilijk vanwege de heterogeniteit in zowel de patiëntenpopulaties als de methodologie (Simapivapan, 2016). Een latere review uit 2021, uitgevoerd door Terry et al., bevatte een aanzienlijk aantal overlappende studies en kwam tot vergelijkbare conclusies (Terry, 2021). De associaties met recidieven leken al op te treden bij een alcoholinname van ongeveer 6 gram per dag (1 glas bevat ongeveer 10 gram alcohol) (Simapivapan, 2016).
De effecten lijken voornamelijk aanwezig te zijn bij postmenopauzale vrouwen, waar een hazard ratio van 1,51 werd gevonden (95%CI 1,05-2,19), en bij vrouwen met overgewicht (HR 1,60 [95% CI 1,08-2,38]) (Kwan, 2010; Simapivapan, 2016).
In 2018 publiceerden Lafourcade et al. een studie die de factoren onderzocht die geassocieerd zijn met borstkankerrecidief binnen een Frans cohort (Lafourcade, 2018). Deze studie maakte gebruik van een subpopulatie uit de E3N-studie (Étude Épidémiologique auprès de Femmes de la Mutuelle Générale de l’Éducation Nationale), een prospectieve studie die diverse factoren en hun associaties met verschillende vormen van kanker evalueert. De substudie van Lafourcade omvatte 4.926 vrouwelijke deelnemers met borstkanker, met een gemiddelde follow-up van 7,2 jaar. Van de deelnemers gebruikten 4.105 vrouwen alcohol ten tijde van hun diagnose, terwijl 523 vrouwen geen alcohol consumeerden. Er werd geen associatie gevonden tussen alcoholconsumptie en de kans op een recidief. Verder vonden ook Schmidt (2020) en Kreklau (2021) geen associatie tussen alcoholconsumptie en borstkankerrecidief in hun onderzoeken (Schmidt, 2020; Kreklau, 2021). Het betrof hier zowel prospectieve als retrospectieve studies. Net als in de studie van Lafourcade werd in deze onderzoeken alcoholconsumptie als dichotome variabele geanalyseerd zonder gedetailleerde rapportage van consumptie-eenheden.
Een belangrijke factor in het onderzoek naar de relatie tussen alcoholconsumptie en borstkankerrecidief is dat de meeste studies vertrouwen op zelfgerapporteerde alcoholconsumptie, wat waarschijnlijk leidt tot een onderschatting van de werkelijke consumptieniveaus (Stockwell, 2004).
Samenvattend is er aanzienlijke heterogeniteit tussen de verschillende studies en is er momenteel weinig bewijs dat alcoholconsumptie een significante rol speelt in de verhoogde kans op recidief borstkanker.
3. Leefstijlinterventies tijdens of na (neo-)adjuvante behandeling en metastasering
Roken en (neo-)adjuvante therapie
Er is nog weinig onderzoek gedaan naar de invloed van roken op de resultaten van verschillende behandelingen bij borstkanker. Wel zijn er studies die suggereren dat roken de reactie op chemo- en radiotherapie bij andere soorten kanker beïnvloedt (Persson, 2016), en mogelijk de effectiviteit van deze behandelingen verlaagt (An, 2012). Zo onderzocht Hoff (2012) het effect van roken op de respons op radiotherapie bij patiënten met hoofd-halskanker en ontdekte een significant negatief effect van roken (Hoff, 2012). Dit negatieve effect kan worden verklaard door de weefselhypoxie die ontstaat door de stoffen die vrijkomen door roken. Omdat zuurstof belangrijk is voor het doden van kankercellen tijdens radiotherapie, maakt hypoxie kankercellen minder gevoelig voor deze behandeling (Bishop, 2013).
Het effect van roken op de effectiviteit van chemotherapie bij borstkankerpatiënten is nog nauwelijks onderzocht. De studies die deze relatie wel bespreken, zijn voornamelijk in vitro-onderzoeken waarin het effect van sigarettenrook op celniveau wordt bestudeerd. Uit diverse onderzoeken blijkt dat sigarettenrook resistentie tegen chemotherapie kan veroorzaken op celniveau, wat wordt toegeschreven aan het feit dat nicotine de door chemotherapie geïnduceerde apoptose remt (Persson, 2016; An, 2012).
Hormoontherapie is een van de meest effectieve behandelingen voor oestrogeenreceptorpositieve mammacarcinomen. Er is echter nog weinig onderzoek gedaan naar de invloed van roken op de effectiviteit van hormoontherapie bij borstkanker. In een prospectieve studie onderzochten Persson et al. (2016) de impact van roken bij een cohort van 1065 borstkankerpatiënten, waarvan 87,1% ER-positief was. Bij patiënten met een ER-positieve tumor die werden behandeld met aromataseremmers, werd een verband gevonden tussen roken en een verhoogd risico op lokaal of regionaal recidief en nieuwe primaire borstkanker (HR 2,97 [95%CI 1,44-6,13]), het ontwikkelen van metastasen (HR 4,19 [95%CI 1,81-9,72]), en zelfs verhoogde mortaliteit (HR 3,52 [95%CI 1,59-7,81]) (Persson, 2016).
Samenvattend zijn er aanwijzingen voor een associatie tussen roken en een verminderde effectiviteit van (neo-)adjuvante behandelingen bij borstkanker, zowel voor systemische therapieën als mogelijk voor radiotherapie, hoewel dat laatste nog niet specifiek voor borstkanker is onderzocht. Er wordt gesuggereerd dat roken niet alleen de effectiviteit van behandelingen verlaagt, maar ook dat kankercellen blootgesteld aan sigarettenrook fenotypen ontwikkelen die metastasering bevorderen. Dit wijst erop dat roken mogelijk ook een rol speelt in de ontwikkeling van metastasen bij borstkanker. Verdere studies zijn nodig om deze relatie verder te onderzoeken.
Overgewicht en chemotherapie
Chemotherapie vermindert de kans op afstandsmetastasen bij borstkanker (Early Breast Cancer Trialists' Collaborative Group, 2002). Het is echter bekend dat vrouwen met borstkanker en overgewicht (BMI 25-30) of obesitas (BMI > 30) een verhoogd risico hebben op het ontwikkelen van metastasen op afstand (Picon-Ruiz, 2017). Dit verhoogde risico kan deels worden verklaard door een verminderde effectiviteit van chemotherapie bij patiënten met een hoge BMI (Ewertz, 2010). In de literatuur worden verschillende mechanismen genoemd die dit kunnen verklaren (Ewertz, 2010): patiënten met een hoge BMI hebben een veranderde farmacokinetiek, krijgen vaak lagere doseringen vanwege een verminderde tolerantie voor chemotherapie, en verkeren in een toestand van laaggradige chronische inflammatie en metabole ontregeling.
Chemotherapie voor borstkanker verkleint de kans op afstandsmetastasering (Early Breast Cancer Trialists' Collaborative Group, 2002). Het is bekend dat vrouwen met borstkanker en overgewicht (overgewicht=BMI 25-30, obesitas=BMI > 30) meer kans hebben op metastasen op afstand (Picon- Ruiz 2017). Dit zou deels verklaard kunnen worden door een verminderde werking van chemotherapie bij patiënten met een hoge BMI (Ewertz, 2010). Er worden verschillende mechanismen beschreven in de literatuur die hieraan ten grondslag kunnen liggen (Ewertz, 2010): Patiënten met een hoge BMI hebben een veranderde farmacokinetiek, krijgen een lagere medicatiedosering bij verminderde tolerantie van de chemotherapie en verkeren in een staat van laaggradige chronische inflammatie en metabole disregulatie.
Neoadjuvante chemotherapie (NAC) wordt steeds vaker toegepast bij patiënten met borstkanker. Een pathologisch complete respons (pCR) is geassocieerd met een verbeterde (ziektevrije) overleving. Een belangrijk voordeel van de neoadjuvante setting is dat de chemosensitiviteit in vivo kan worden beoordeeld. Verschillende studies hebben daarom het effect van BMI op de effectiviteit van NAC en de kans op een pCR onderzocht (Wang, 2021; Raman, 2016; Karatas, 2016).
Wang (2021) heeft in een meta-analyse het effect van BMI op het bereiken van een pathologische complete respons na neoadjuvante chemotherapie bij borstkanker onderzocht. In totaal werden 13 studies met 18.702 vrouwen geïncludeerd. Twee van deze studies waren gepoolde analyses van prospectieve klinische onderzoeken (10.669 patiënten), terwijl de overige case-controlstudies waren (8.033 patiënten). Alle studies hanteerden dezelfde BMI-afkapwaarden (BMI < 25 versus BMI ≥ 25). De gepoolde resultaten toonden aan dat vrouwen met overgewicht of obesitas minder kans hadden op een pCR na NAC in vergelijking met vrouwen met ondergewicht of met een normaal gewicht (OR 0,80 [95% CI 0,68-0,93]). Van de 13 studies voerden 11 ook analyses uit met drie BMI-categorieën (BMI < 25, 25 ≤ BMI < 30, BMI ≥ 30), waaruit bleek dat zowel de groep met overgewicht als de groep met obesitas minder kans hadden om pCR te bereiken in vergelijking met vrouwen met ondergewicht of met een normaal gewicht (OR 0,77 [95% CI 0,65-0,93] en OR 0,68 [95% CI 0,61-0,77]). Verdere prospectieve studies zijn nodig om deze bevindingen te bevestigen en de mogelijke onderliggende mechanismen te onderzoeken (Wang, 2021).
Daarnaast blijkt een relatief groot aantal borstkankerpatiënten tijdens (neoadjuvante) chemotherapie aan te komen in gewicht. Slechts een beperkt aantal studies heeft gekeken naar het effect van gewichtstoename tijdens NAC op pCR-kans en overleving. Fang (2019) vond in een retrospectieve studie dat een toename van de BMI met meer dan 2 kg/m² tijdens (neo-)adjuvante chemotherapie geassocieerd is met een slechtere overleving, hoewel de kans op pCR niet verschilde. Kogawa (2018) vond vergelijkbare resultaten in een studie met meer dan 4.000 vrouwen die neoadjuvant werden behandeld: een toename van een normaal naar een hoog BMI tijdens NAC was geassocieerd met een significant slechtere overleving (HR 1,637; 95% CI 1,066-2,514). Daarnaast zijn er aanwijzingen dat verlies van skeletspiermassa tijdens chemotherapie prognostisch ongunstig kan zijn (Amitani, 2022).
Overgewicht en hormonale therapie
De relatie tussen obesitas en de prognose van borstkanker in combinatie met hormonale therapie is complex. Verhoogde aromatasespiegels in het vetweefsel van postmenopauzale vrouwen met overgewicht kunnen zorgen voor een suboptimale onderdrukking van systemische oestrogenen.
Hoewel er studies zijn uitgevoerd naar het gebruik van diverse hormonale therapieën, met de nadruk op aromataseremmers (AI’s), en de klinische uitkomsten bij vrouwen met overgewicht en vroege borstkanker, zijn de resultaten gemengd.
Een systematisch literatuuronderzoek, uitgevoerd volgens de PRISMA-richtlijnen, onderzocht de invloed van obesitas op de werkzaamheid van hormonale therapie, met een focus op AI’s bij hormoonreceptor-positieve borstkanker in een vroeg stadium (Shirdarreh, 2021). De primaire uitkomstmaten waren ziektevrije overleving, recidiefvrije overleving, verre recidiefvrije overleving, borstkankervrije overleving en algehele overleving. Secundaire uitkomsten omvatten therapietrouw en het effect van hormonale therapie bij gemetastaseerde borstkanker bij overgewicht, evenals het verloop van het gewicht tijdens de hormonale therapie.
Van de 491 geïdentificeerde studies voldeden er acht aan de inclusiecriteria voor in de review van Shirdarreh (2021): drie retrospectieve cohortstudies, één prospectieve cohortstudie en vier gerandomiseerde gecontroleerde onderzoeken. Vier studies beperkten zich tot postmenopauzale vrouwen. Het percentage patiënten met overgewicht in de studies varieerde van 10 tot 30 procent. Twee studies onderzochten het gebruik van AI's alleen, terwijl de overige studies patiënten includeerden die werden behandeld met ofwel AI's ofwel tamoxifen (Shirdarreh, 2021).
Vijf van de zeven studies suggereerden een negatief effect van obesitas op de werkzaamheid van AI's, inclusief de enige studie die premenopauzale patiënten includeerde (Pfeiler, 2011; Gnant, 2011; Wisse, 2018; Wolters, 2012; Jiralersprong, 2013). Twee studies vonden geen effect (Sendur, 2012; Ewertz, 2012). De risico’s verschillen aanzienlijk: in de studies waarin een verschil werd gevonden, was er sprake van een tot 60% hogere kans op recidief en een 200% hogere kans op overlijden bij vrouwen met overgewicht in vergelijking met vrouwen met een BMI < 25 (Pfeiler, 2011; Sestak, 2010; Gnant, 2011; Dignam, 2003). Het blijft echter onduidelijk of dit verschil veroorzaakt wordt door het overgewicht zelf of door de verminderde effectiviteit van hormonale therapie (Wisse, 2018; Sestak, 2010; Gnant, 2011).
Slechts één studie onderzocht het effect van verlengd gebruik van AI’s, waarbij werd gevonden dat patiënten met een normaal gewicht bij verlengd AI-gebruik een aanzienlijk lager risico hadden op recidief en overlijden (relatief risico ongeveer gehalveerd), terwijl patiënten met overgewicht geen winst behaalden (Gnant, 2013).
Wat betreft tamoxifen laten vijf studies geen verschil zien in werkzaamheid bij verschillende BMI-categorieën (Sestak, 2010; Ewertz, 2012; Wisse, 2018; Wolters, 2012; Pfeiler, 2013). Twee studies tonen echter een slechtere ziektevrije en/of totale overleving bij patiënten met overgewicht (Pfeiler, 2011; Jiralersprong, 2013), wat mogelijk wijst op een BMI-onafhankelijk effect bij tamoxifen, in tegenstelling tot AI’s. De verschillende studies hanteren echter verschillende uitkomstmaten en ook verschillende BMI-afkappunten, wat de interpretatie bemoeilijkt (Shirdarreh, 2021).
In de gemetastaseerde setting liet de combinatie van fulvestrant en AI vergelijkbare effecten zien bij verschillende BMI-categorieën. Abemaciclib gecombineerd met AI toonde mogelijk betere resultaten bij patiënten met een lager of normaal gewicht. Een normaal gewicht lijkt in de gemetastaseerde setting ook een beschermende rol te spelen (Zewenghiel, 2018; Franzoi, 2021).
Een betere therapietrouw en een hogere BMI worden geassocieerd met meer klachten bij hormonale therapie. Meer klachten kunnen weer leiden tot een slechtere therapietrouw, maar BMI zelf bleek daarnaast een onafhankelijke voorspeller van korter gebruik van AI’s (Hagen, 2019; Cho, 2022). In grote klinische studies werd geen relevante of significante gewichtstoename gezien (Nyrop, 2016).
De resultaten van de systematische review benadrukken de noodzaak van verder onderzoek naar de optimale hormonale therapie voor vrouwen met overgewicht (Shirdarreh, 2021). Er is op dit moment onvoldoende bewijs om aan te bevelen de adjuvante hormonale therapie af te stemmen op het gebruik van specifieke AI's of de dosering van AI's bij deze patiëntenpopulatie aan te passen. Dit verdient verdere aandacht.
Ook is meer aandacht voor therapietrouw en bijwerkingen noodzakelijk bij de behandeling van vrouwen met overgewicht of obesitas met hormonale therapie.
Bewegen en (neo)adjuvante chemotherapie
Er zijn diverse studies uitgevoerd naar de effecten van beweging en sporten tijdens (neo-)adjuvante chemotherapie. Een Cochrane-review uit 2016 stelde dat extra beweging tijdens therapie mogelijk enige voordelen kan bieden (Furmaniak, 2016). In deze meta-analyse werden 22 studies opgenomen. De resultaten toonden aan dat sporten leidde tot vermindering van vermoeidheid en verbetering van de fysieke fitheid, evenals een verbeterde cognitieve functie. Wat betreft de kans op depressies en de algemene of kankergerelateerde kwaliteit van leven, werd geen effect waargenomen. De review concludeerde dat het bewijs voor deze effecten nog beperkt is en benadrukte de noodzaak van verdere studies om de voordelen en nadelen van beweging tijdens neoadjuvante chemotherapie te onderzoeken.
Een studie uit de adjuvante setting is de Nederlandse PACES-studie uit 2016. Deze onderzocht het effect van laag- en midden/hoog-intensieve fysieke activiteit tijdens adjuvante chemotherapie op fysieke fitheid, vermoeidheid en het voltooien van de chemotherapie (Hanna van Waart et al., 2016). In deze studie werden 230 patiënten gerandomiseerd in twee groepen: één groep voerde thuis een beweegprogramma uit, een andere groep volgde een begeleid aerobicsprogramma, en beide werden vergeleken met een controlegroep. De resultaten toonden aan dat patiënten die bewogen (in beide interventiegroepen) een kleinere afname in cardiopulmonale fitheid hadden (p < 0.001), beter fysiek functioneerden (p < 0.001), en minder misselijkheid en braken ervoeren (p = 0.029 en p = 0.031), evenals minder pijn (p = 0.03 en p = 0.11), vergeleken met de controlegroep. In de hoge-intensiteitsgroep waren er bovendien verbeteringen in spierkracht (p = 0.002) en fysieke vermoeidheid (p < 0.001). Ook hadden patiënten in deze groep minder vaak een dosisreductie van de chemotherapie nodig (p = 0.002)dan in beide andere groepen (p 0.002).
Verder bleken patiënten in beide interventiegroepen sneller weer aan het werk te gaan (p = 0.012) en meer uren te werken (p = 0.014) dan de controlegroep. Na zes maanden follow-up (na het stoppen met zowel de chemotherapie als het sporten) keerden de meeste resultaten echter weer terug naar het baselineniveau in alle drie de groepen. De studie concludeerde dat begeleid sporten met een hoog-intensief aerobicsprogramma het meest effectief is voor patiënten tijdens chemotherapie, maar dat thuis sporten een goed alternatief kan zijn.
Hoewel het nog wachten is op de resultaten van grotere studies, wijzen de bestaande bevindingen op een (klein en tijdelijk) positief effect van sporten tijdens neoadjuvante chemotherapie voor borstkankerpatiënten, zowel op fysiek als psychisch vlak. Er is geen bewijs gevonden voor negatieve effecten van sporten, wat betekent dat bewegen de voorkeur heeft boven niet bewegen.
Bewegen en (neo)adjuvante hormonale therapie
In 2015 toonde Irwin aan dat patiënten die tijdens hun hormonale therapie deelnamen aan een gesuperviseerd beweegprogramma significant minder last hadden van gewrichtspijnen in vergelijking met patiënten in de controlegroep. Na één jaar rapporteerde de interventiegroep een afname van klachten van 29%, terwijl de controlegroep juist een toename van 3% zag (p < 0.001) (Irwin, 2015).
Een andere studie onderzocht de effecten van gesuperviseerd sporten op kwaliteit van leven en fysieke fitheid direct na het beëindigen van adjuvante endocriene therapie. In deze studie werden 100 patiënten gerandomiseerd in een groep die gesuperviseerd sportte en een standaard controlegroep. Na drie maanden gesuperviseerd sporten werd een significante verbetering gerapporteerd in zowel de kwaliteit van leven als fysieke fitheid ten opzichte van de controlegroep (Dieli-Conwright, 2018).
Er zijn momenteel nog geen studies bekend die specifiek de invloed van beweging op de effectiviteit van de endocriene therapie of op de therapietrouw (adherentie) hebben onderzocht.
De bevindingen suggereren dat beweging tijdens adjuvante endocriene therapie een gunstig effect kan hebben op gewrichtspijnen en fysieke fitheid. Verder onderzoek is echter nodig om de mogelijke invloed van beweging op de effectiviteit en adherentie van endocriene therapie te verhelderen.
Alcoholconsumptie en (neo-)adjuvante therapie
Op het gebied van alcohol in relatie tot (neo-)adjuvante behandeling is weinig bekend in de huidige literatuur.
In 2013 publiceerde Lemieux et al. een retrospectieve cohortstudie over het verband tussen alcoholconsumptie en cardiotoxiciteit bij 299 vrouwen met HER2-positieve invasieve borstkanker die trastuzumab ontvingen in de (neo-)adjuvante setting. In een subgroep van 139 vrouwen werd consumptie van veel alcohol (>10 glazen per week) geassocieerd met een verhoogd risico op cardiotoxiciteit (OR 8,77 [95%CI 1,54-50,14]), zelfs na correctie voor mogelijke confounders (OR 7,42 [95%CI 1,09–50,38]). De andere hoeveelheden alcoholconsumptie binnen deze studie lieten geen associatie met cardiotoxiciteit zien. Omdat het een retrospectieve studie is en het aantal vrouwen dat meer dan 10 glazen per week dronk klein was (n=6), is voorzichtigheid geboden bij het interpreteren van deze resultaten (Lemieux, 2013).
Hoewel er enkele aanwijzingen zijn dat alcoholconsumptie van invloed kan zijn op de uitkomsten van (neo-)adjuvante behandelingen is de bewijslast op dit gebied nog beperkt. De huidige literatuur laat mogelijke associaties zien, met name in relatie tot trastuzumab, alcohol en cardiotoxiciteit, maar de uitkomsten variëren tussen studies (Kowalski 2018, Furrer 2017), en er zijn nog veel onzekerheden. Verdere studies zijn nodig om de effecten van alcoholconsumptie op de werkzaamheid en bijwerkingen van (neo-)adjuvante therapieën, zoals chemotherapie, hormoontherapie en doelgerichte therapieën zoals trastuzumab, beter te begrijpen.
4. Complicaties van operatieve en bestralingsbehandelingen voor borstkanker
Roken en mastectomie met reconstructie (zie ook richtlijn borstreconstructie 2019)
In een systematische review van Wong et al. (2020) werd het verband onderzocht tussen roken en het risico op complicaties na een mastectomie met reconstructie bij patiënten met borstkanker. Alle zes de geïncludeerde studies vonden dat reconstructie-falen en complicaties significant vaker voorkwamen bij rokers. Niet alleen kwamen complicaties bij rokers vaker voor, ook bleken de complicaties ernstiger van aard te zijn vergeleken met niet-rokers (Wong, 2020). De prospectieve cohortstudie van Sadok et al. (2020) met 56 borstkankerpatiënten die een borstreconstructie met implantaat ondergingen, vond dat rokers een verhoogd risico hadden op ernstige complicaties in vergelijking met niet-rokers (OR 8,0 [95% CI 1,3-49]) (Sadok, 2020). Dit werd verder bevestigd door de retrospectieve studie van Hall et al. (2020), uitgevoerd bij 41 borstkankerpatiënten die mastectomie met een directe of latere reconstructie ondergingen. Dit onderzoek richtte zich op factoren die het ontstaan van reconstructieve complicaties beïnvloedden. Hieruit bleek dat rokers significant meer reconstructieve complicaties hadden dan niet-rokers, namelijk 58% versus 17% (p=0,02) (Hall, 2022).
Uit meerdere recente studies blijkt dat roken de voornaamste risicofactor is voor het ontstaan van postoperatieve complicaties bij borstreconstructies na borstkanker (Vanaclocha, 2021; Park, 2020; Thorarinsson, 2017). De complicaties die hierbij het meest voorkomen zijn onder andere kapselcontractie, slechte wondgenezing, necrose en hematoomvorming (Wong, 2020; Vanaclocha, 2021; Prantl, 2020). Daarnaast komen operatiegerelateerde infecties vaker voor bij rokers (Chung, 2015; Davis, 2013). Prantl (2020) toonde ook aan dat partial flap loss en vertraagde wondgenezing significant vaker voorkwamen bij rokers. De studie van Prantl et al (2020) identificeerde roken zelfs als een onafhankelijke risicofactor voor revisiechirurgie. Roken lijkt dus niet alleen een groter risico op complicaties bij behandelingen van borstkanker te geven, het lijkt ook de kans op revisiechirurgie te vergroten. Dit wordt ondersteund door de bevinding van Manyam (2019) dat roken een significante voorspeller is voor het ontwikkelen van complicaties die revisiechirurgie vereisten (Manyam, 2019). Een kleine studie van Duraes et al. (2015) (n=130) bevestigde dat actief roken een significante risicofactor is voor complicaties en revisiechirurgie (Duraes, 2015).
Roken en mammasparende therapie
De studies van Lyngholm (2013) en Munhoz (2011) laten zien dat roken het risico op complicaties bij borstsparende therapie verhoogt (Munhoz, 2011; Lyngholm 2013). Lyngholm (2103) vond dat één op de vier patiënten die radiotherapie onderging in het kader van borstsparende behandeling matige tot ernstige fibrose ontwikkelde. Deze complicatie bleek, naast chemotherapie, ook geassocieerd te zijn met roken, hoewel het effect van roken in een multivariate analyse niet statistisch significant was. De studie van Munhoz (2011) richtte zich op complicaties na oncoplastische reconstructie bij mammasparende therapieën en vond dat roken zowel in univariate als multivariate analyses significant gerelateerd was aan complicaties (OR 4,3 [95% CI 1,5-12,5], P=0,006).
In een cohortstudie van borstkankerpatiënten die zowel met mastectomie (50%) als met borstsparende operaties (50%) behandeld waren, werd aangetoond dat zowel lichte als zware rokers een verhoogd risico hadden op complicaties, waaronder wondinfecties, skin flap necrose en epidermolysis (Sorenson, 2002). Een kanttekening bij deze studie is dat de resultaten van beide operaties samen werden geanalyseerd, en dat borstsparende operaties vrijwel altijd gevolgd worden door radiotherapie. Hierdoor kunnen eventuele effecten van roken op radiotherapie-uitkomsten een rol spelen. Er is verder onderzoek nodig om het afzonderlijke effect van roken op zowel de operatie als de radiotherapie-uitkomsten te onderzoeken.
Roken en radiotherapie
Acute bijwerkingen van radiotherapie bij borstkanker betreffen voornamelijk huidreacties, zoals dermatitis. Uit onderzoek blijkt dat roken een van de belangrijkste risicofactoren is voor het ontwikkelen van acute huidreacties tijdens radiotherapie (Sharp, 2013). De systematische review van Wong (2020) concludeerde dat borstkankerpatiënten die roken significant meer huidtoxiciteit vertonen tijdens radiotherapie. In 10 studies binnen deze review werd aangetoond dat rokers aanzienlijk slechtere radiotherapie-uitkomsten hadden met betrekking tot bijwerkingen in vergelijking met niet-rokers (Wong, 2020).
Daarnaast lopen rokers die radiotherapie ondergaan mogelijk een verhoogd risico op het ontwikkelen van longcarcinoom. Dit risico is afhankelijk van factoren zoals de gemiddelde longdosis, de duur van het roken en de leeftijd van de patiënt (Wennstig, 2021; Taylor, 2017; Ford, 2003).
Overgewicht/obesitas en peri- en postoperatieve complicaties
Obesitas brengt verschillende perioperatieve uitdagingen met zich mee. Studies hebben aangetoond dat patiënten met obesitas, en hieraan gerelateerde comorbiditeiten zoals OSAS, een verhoogd risico lopen op complicaties tijdens algehele anesthesie, waaronder luchtwegproblemen, hartritmestoornissen en awareness (Cook, 2024; Members, 2014; Pandit, 2014). Naast een verhoogd risico op anesthesiologische complicaties, hebben deze patiënten ook een grotere kans op chirurgische complicaties, zoals tromboflebitis, wondinfecties en slechtere wondgenezing (Pierpont, 2014). Ook op de lange termijn hebben patiënten met obesitas een verhoogde kans op complicaties, zoals chronische pijn (Leysen, 2017).
Overgewicht/obesitas en mammasparende operatie (Cochrane, 2003)
Verschillende observationele studies die laten zien dat de cosmetische uitkomst na borstsparende behandeling slechter is bij obese patiënten dan bij niet-obese patiënten (Moody, 1994; Meshulam-Derazon, 2023; Kimoto, 2023). Een recente Braziliaanse studie onder 300 vrouwen die oncoplastische chirurgie ondergingen, toont bovendien aan dat een verhoogde BMI significant geassocieerd is met verminderde tevredenheid over het cosmetisch resultaat (de Oliveira-Junior, 2023). Daarnaast toonde één studie een verhoogd risico op chronische postoperatieve pijn bij obese patiënten na oncoplastische chirurgie (Maggi, 2023). Een andere studie onder meer dan 800 Nederlandse vrouwen identificeerde een BMI >30 als een risicofactor voor postoperatieve wondinfecties (Wijgman, 2017), wat wordt ondersteund door bevindingen uit grote internationale datasets (de Blacam, 2012; Teija-Kaisa, 2013; Xue, 2012). Een gerandomiseerde studie naar het effect van profylactische antibiotica bij borstkankeroperaties toonde een verhoogd risico op wondinfectie bij patiënten met een verhoogde BMI, maar vond geen significant of klinisch relevant voordeel van profylactische behandeling met antibiotica in deze groep (Stallard, 2022).
Aan de andere kant leiden borstsparende behandelingen met oncoplastische chirurgie bij vrouwen met obesitas tot minder complicaties dan ablatieve behandelingen met reconstructie (Tong, 2016). De auteurs concluderen daarom dat oncoplastische reductie een acceptabele optie is voor deze patiënten, mits zij goed geïnformeerd worden over de operatierisico’s (Fortenbery, 2024).
Overgewicht/obesitas en mastectomie.
Bij patiënten die een mastectomie ondergaan lijkt obesitas geassocieerd met een verhoogd risico op wondinfectie, evenals op minder ernstige (zoals urineweginfectie) en ernstige complicaties (zoals veneuze trombo-embolieën, cardiale complicaties of ernstige wondgenezingsstoornissen) (Garland, 2018). In een grote Amerikaanse populatiestudie waren obesitas en roken de enige twee vormen van comorbiditeit die onafhankelijk geassocieerd waren met het risico op heropname na mastectomie (Chow, 2015). Een systematische review uit 2018 laat zien dat patiënten met obesitas een 2,3 keer hoger risico hebben op postoperatieve complicaties na reconstructieve chirurgie dan vrouwen met een normaal gewicht. De kans op wonddehiscentie was 2,5 keer groter, en de kans op heroperatie 1,9 keer (Panaya, 2018). Tot 25% van de patiënten met obesitas loopt risico op verlies van de prothese door complicaties zoals huidnecrose en infecties (Fischer, 2013). Ook bij autologe reconstructies is het risico op complicaties zoals falen van de reconstructie, hematoomvorming, necrose, infecties, wondgenezingsproblemen, seroom en herniatie groter bij patiënten met obesitas (Lee, 2019; Mrad, 2022). Bovendien zijn patiënten met protheses vaak minder tevreden over het resultaat, waarschijnlijk omdat het bij een groter borstvolume moeilijker is om een symmetrisch resultaat te bereiken.
Overgewicht/obesitas en axillaire chirurgie.
Grote multicentrische studies tonen aan dat het bij patiënten met een hogere BMI vaker voorkomt dat de schildwachtklier (sentinel node) niet geïdentificeerd kan worden (Derossis, 2003). Daarnaast is een hogere BMI geassocieerd met problemen bij de preoperatieve lokalisatie (“mapping”) van de schildwachtklier (Cox, 2002). Bij patiënten die een okselklierdissectie ondergaan, blijkt een hogere BMI gerelateerd aan een verhoogd risico op het ontwikkelen van lymfoedeem (Boyages, 2023; Shen, 2024).
Overgewicht/obesitas en radiotherapie.
Een recente systematische meta-analyse heeft aangetoond dat een verhoogde BMI en een groter borstvolume significante voorspellers zijn voor het ontwikkelen van acute radiatie-dermatitis (Xie, 2021). BMI is sterk geassocieerd met borstvolume (Steele, 2020), en patiënten met grotere borsten kunnen door hun anatomie (door de positie van de borsten ten opzichte van de borstwand in rugligging) blootstaan aan verhoogde doses radiotherapie op vitale organen, zoals het hart en de longen. Dit verhoogt het risico op radiatiepneumonitis bij patiënten met overgewicht (Allen, 2005). Ondanks deze risico's, lijkt hypofractionering van radiotherapie ook bij vrouwen met obesitas veilig te zijn (Dorn, 2012; Weng, 2021; Xie, 2021).
Alcoholconsumptie
In tegenstelling tot de associatie tussen roken en complicaties bij met name operatieve behandeling, is er nog weinig onderzoek gedaan naar de relatie tussen alcoholconsumptie en het risico op postoperatieve complicaties bij borstkanker (Menezes, 2020). Een studie uit 2002, gericht op de effecten van roken op uitkomsten en complicaties na borstkankeroperaties, suggereerde dat het consumeren van meer dan 14 glazen alcohol per week (vergeleken met onthouding) geassocieerd is met een verhoogd risico op wondinfecties na een operatie (OR 3,08 [95% CI 1,11-8,84]) (Sorensen, 2002). Echter, een recenter onderzoek uit 2020 vond geen significante associatie tussen alcoholconsumptie en een verhoogd risico op wondinfecties of andere complicaties na een borstkankeroperatie (Menezes, 2020). Deze prospectieve cohortstudie onderzocht 458 vrouwen tussen de 40 en 69 jaar en analyseerde de relatie tussen alcoholgebruik in de 30 dagen voorafgaand aan de operatie en verschillende wondcomplicaties. Uit de resultaten bleek dat 315 patiënten (65,2%) enige vorm van postoperatieve wondcomplicaties rapporteerden. Zowel matige alcoholconsumptie (OR 1,12 [95% CI 0,55-2,21]) als regelmatige alcoholconsumptie (OR 0,76 [95% CI 0,43-1,35]) toonden echter geen associatie met een verhoogd risico op postoperatieve complicaties vergeleken met vrouwen die niet dronken (Menezes, 2020).
Afgezien van deze studies is er weinig literatuur beschikbaar over de relatie tussen alcoholconsumptie en het risico op postoperatieve complicaties specifiek bij borstkanker. In tegenstelling tot de bevindingen uit 2002, werd in het recentere onderzoek uit 2020 geen associatie gevonden. Een mogelijke complicerende factor bij studies over alcoholconsumptie is dat alcoholgebruik vaak zelf-gerapporteerd is, wat kan leiden tot onderrapportage (Stockwell, 2004). Over het algemeen lijkt er weinig overtuigend bewijs te zijn voor een associatie tussen alcoholconsumptie en het risico op complicaties bij borstkankeroperaties.
Alcohol en radiotherapie
Er is weinig literatuur beschikbaar over het effect van alcoholconsumptie op radiotherapie bij borstkankerpatiënten.
Tweede primaire tumor: Een retrospectieve studie onder 10.676 vrouwen met borstkanker onderzocht de invloed van alcohol op de incidentie van een tweede primaire tumor. Deze studie concludeerde dat alcohol geen invloed had op de ontwikkeling van een tweede primaire tumor na een mediane follow-up van 6,2 jaar. Het onderzoek rapporteerde alcohol echter als een dichotome variabele en vermeldde niet de mate van alcoholinname (DiMarzio, 2018).
Toxiciteit: In een prospectieve studie van Macchia et al. werden 321 borstkankerpatiënten geëvalueerd die na een borstsparende operatie adjuvante intensiteits-gemoduleerde radiotherapie (50 Gy) kregen, met een boost van 10 Gy (totaal 25 bestralingen). Na een mediane follow-up van 52 maanden werd er geen ongunstig effect van alcoholconsumptie (minstens 1 glas per dag) gezien op het ontwikkelen van cutane of subcutane toxiciteit (Macchia, 2020).
Concluderend is het bewijs voor de invloed van alcoholconsumptie op (neo-)adjuvante therapie momenteel zeer beperkt, waardoor er geen duidelijke aanbevelingen gedaan kunnen worden op basis van de beschikbare gegevens.
5. Medicatie en leefstijlfactoren
Medicatie en gewichtsverandering
Het gebruik van bepaalde medicatie kan de energiehomeostase verstoren, wat de positieve effecten van leefstijlinterventies belemmert. Voorbeelden hiervan zijn antidepressiva, antipsychotica, insuline en corticosteroïden (Verhaegen, 2021). Het is daarom van belang om met patiënten te bespreken of zij gewichtstoename-inducerende medicatie gebruiken, aangezien het stoppen of afbouwen van deze middelen gewichtsverlies zou kunnen bevorderen. Dit kan op zijn beurt gunstige effecten hebben op de behandeling van borstkanker.
Een recente observationele studie liet bij een cohort van 76.252 postmenopauzale vrouwen (50-89 jaar) een significante toename in BMI zien bij patiënten die antidepressiva, bètablokkers of insuline gebruikten (Stanford, 2020). Het mechanisme waardoor deze medicamenten bijdragen aan gewichtstoename varieert per type middel. Zo kunnen sommige antidepressiva en antipsychotica de eetlust verhogen en/of de stofwisseling vertragen (Savas, 2019). Gewichtstoename door corticosteroïden is voornamelijk te wijten aan een toename van centrale adipogenese, verhoogde lipolyse en verminderde lipoproteïne-lipase-activiteit in perifeer vet (Fardet, 2014). Daarnaast kunnen corticosteroïden de eetlust stimuleren, de stofwisseling vertragen en vochtretentie veroorzaken. Gewichtstoename door insulinegebruik wordt voornamelijk toegeschreven aan een verhoogde calorische inname en het anabole effect van insuline, vooral bij (te) hoge doseringen (Russell-Jones, 2007).
Voor verdere details over dit onderwerp verwijzen wij naar de richtlijn ‘Overgewicht en obesitas bij volwassenen’.
Medicatie als behandeling van obesitas
Er zijn medicijnen beschikbaar die obesitas kunnen behandelen als aanvulling op leefstijlinterventies Voor de meest recente informatie hieromtrent wordt verwezen naar de richtlijn ‘Overgewicht en obesitas bij volwassenen’.
6. Het effect van leefstijlinterventies op de kwaliteit van leven na de behandeling voor borstkanker
Vrouwen die in het verleden borstkanker hebben gehad, worden geconfronteerd met verschillende uitdagingen op het gebied van de kwaliteit van leven (QoL) na hun behandeling (Denmark-Wahnefried, 2015). Deze kwaliteit van leven wordt niet alleen beïnvloed door de psychologische impact van de ziekte, maar ook door de ongunstige bijwerkingen van de therapieën die zij hebben ondergaan.
Vrouwen met obesitas en een inactieve leefstijl na de behandeling van borstkanker lopen een hoger risico op terugkeer van de ziekte dan vrouwen die lichamelijk actief zijn (Speck, 2010; Holmes, 2005; Winkels, 2017). Bovendien heeft een hoge BMI (>25 kg/m²) na de behandeling een negatief effect op de gezondheid-gerelateerde kwaliteit van leven (Imayama, 2013). Het is daarom cruciaal om bij herstellende borstkankerpatiënten met obesitas het metabool syndroom te behandelen, met behulp van dieet en lichaamsbeweging, om het risico op comorbiditeiten te verlagen en de lange-termijnuitkomsten van borstkanker te verbeteren (Dieli-Conwright, 2018). Ondanks dat onderzoek heeft aangetoond dat overgewicht en lichamelijke inactiviteit het risico op terugkeer van borstkanker verhogen (Speck, 2010; Holmes, 2005; Winkels, 2017), zijn gecombineerde leefstijlinterventies voor deze populatie nog steeds geen gangbare praktijk na de behandeling van borstkanker.
Tot op heden zijn er verschillende gecombineerde leefstijlinterventies toegepast bij patiënten die de behandeling voor borstkanker succesvol hebben doorstaan, waarbij de kwaliteit van leven na behandeling gemeten is (Rock, 2015; Befort, 2012; Brown, 2022; Brown, 2021; Goodwin, 2014).
In 2015 vond de eerste grote gerandomiseerde trial (ENERGY) plaats met 692 vrouwen met borstkanker in de voorgeschiedenis, met een gemiddelde leeftijd van 56,2 ± 9,5 jaar en met obesitas (BMI 31,6 ± 0,5 kg/m²). Deze trial had als doel om een gewichtsreductie van 7% te bereiken na twee jaar (Rock, 2015). Na een jaar bleek het gemiddelde gewichtsverlies in de interventiegroep 6,0% van het oorspronkelijke gewicht te zijn, vergeleken met 1,5% in de controlegroep (p<0,0001). Dit resultaat werd behaald door een negatieve calorie-inname van 500-1000 kcal per dag en dagelijkse fysieke activiteit van 60 minuten op gemiddelde intensiteit. Een andere studie van Befort (2012) toonde ook een significante vermindering van depressieve symptomen aan na een 6-maands gecombineerde leefstijlinterventie, vergeleken met de baseline (p=0,001) bij 34 personen met een BMI van 33,7 ± 4,4 kg/m² en een geschiedenis van borstkanker. Daarnaast verbeterde het fysiek functioneren aanzienlijk na zes maanden (p<0,001), met een gemiddelde gewichtsreductie van 12,8% ten opzichte van de baseline. Een beperking van deze studie was echter het ontbreken van een controlegroep.
In 2021 volgden echter trials met een controlegroep; onder andere een gerandomiseerde 2x2 factoriale gecontroleerde studie met 351 deelnemers (59,4 ± 8,7 jaar) met een BMI van 34,0 ± 5,9 kg/m² en een voorgeschiedenis van borstkanker. In deze studie leidde een gecombineerde interventie na een jaar tot significante verbeteringen op de symptoomschaal voor fysiek functioneren (main effect 5,39; 95% BI 0,55-10,22) van de Short Form Health Survey (SF-36) (Brown, 2021). Deze interventie bestond uit twee keer per week krachttraining en 180 minuten cardio per week op gemiddelde intensiteit. In vergelijking met de ENERGY trial was deze interventie iets minder intensief, wat mogelijk leidt tot betere resultaten op het gebied van kwaliteit van leven.
Naast deze lange interventie van een jaar toonde in 2021 een 15-weeks gecombineerde leefstijlinterventie goede resultaten op de kwaliteit van leven aan bij 60 deelnemers (52 ± 9 jaar) met obesitas (BMI 31,8 ± 5,4 kg/m²), waarvan 76,7% eerder borstkanker had gehad(Brown, 2022). De interventiegroep nam deel aan een groepsinterventie gericht op een gewichtsverlies van 7%. Na 15 weken was er een gemiddelde gewichtsreductie van 4,6 ± 3,9 kg in de interventiegroep en verbeterde het lichamelijk functioneren (6,2 ± 2,9, p=0,02), terwijl slapeloosheid (-17,1 ± 7,4, p=0,03) en slaapstoornissen (-4,9 ± 1,6, p=0,005) verminderden vergeleken met de controlegroep. Het gewichtsverlies dat door deze 15-weekse interventie werd geïnduceerd, bleef tot 30 weken behouden. Een 15-weekse klinische groepsinterventie lijkt dus qua intensiteit en duur voldoende om gezondheidsgerelateerde parameters na borstkankerbehandeling te verbeteren. De LISA-trial was de eerste studie waarin geïndividualiseerde coaching werd toegepast (Goodwin, 2014). Deze trial omvatte 336 deelnemers (61,6 ± 6,7 jaar) met obesitas (BMI 31,4 ± 5,0) en een voorgeschiedenis van borstkanker. Er werd een snellere toename in lichamelijk functioneren gemeten op de 36-SF in de interventiegroep vergeleken met de controlegroep bij alle halfjaarlijkse metingen tot en met twee jaar (p=0,005).
7. Waarden en voorkeuren van patiënten (en evt. hun naasten)
De ontwikkeling van borstkanker wordt door meerdere factoren beïnvloed. Leefstijl speelt een rol bij zowel het ontstaan van borstkanker als bij het succes van de behandeling. Preventie is essentieel voordat borstkanker zich ontwikkelt, en deze richtlijn richt zich daar gedeeltelijk op. Bij de diagnose van borstkanker hebben patiënten behoefte aan informatie over welke leefstijlaanpassingen een positief effect kunnen hebben en hoe groot dat effect kan zijn.
Passende voorlichting is de eerste stap in het gezamenlijke besluitvormingsproces rondom de behandeling van borstkanker. Patiënten moeten – afgestemd op hun behoefte - geïnformeerd worden over de risico's van leefstijlfactoren en de mogelijke voor- en nadelen van leefstijlaanpassingen vóór, tijdens en na de behandeling. Op basis van deze informatie wordt samen met de patiënt een behandelplan opgesteld (samen beslissen). Patiënten moeten ook de mogelijkheid krijgen om na te denken over het behandelplan via een time-out.
Factoren zoals sociaal-economische status, omgeving en cultuur spelen een belangrijke rol bij het succes van leefstijlinterventies. Deze aspecten moeten meegenomen worden in het gesprek over leefstijl en bij het aanbieden van leefstijlinterventies (Wang, 2023; Streur-Kranenburg, 2023).
Het moment waarop leefstijl wordt besproken is ook van belang. Onderzoeken tonen aan dat het bespreken van leefstijl het meeste effect heeft rond de diagnose. Een nieuwe kankerdiagnose blijkt vaak de sterkste motivatie voor patiënten om hun leefstijl aan te passen (Westmaas, 2015; Maunsell, 2002). Patiëntenorganisaties geven aan dat het belangrijk is om informatie en keuzes herhaaldelijk te bespreken gedurende meerdere gesprekken.
BVN pleit voor bewustwording van de mogelijke risicoverhoging door bepaalde leefstijlelementen, maar benadrukt dat iedere persoon zijn of haar eigen keuzes kan maken, afhankelijk van de context en persoonlijke mogelijkheden.
8. Kosten (middelenbeslag)
Adviezen over leefstijl voor patiënten met borstkanker zullen naar verwachting leiden tot minder kosten. Hoewel er bewijs is dat leefstijlaanpassingen de kwaliteit van leven kunnen verbeteren en mogelijk het risico op terugkeer van borstkanker kunnen verminderen, zijn er ook andere overwegingen bij het beoordelen van kostenbesparingen.
Kosten van leefstijlinterventies: deze kunnen bestaan uit programma's voor voeding, lichaamsbeweging, counseling en andere ondersteunende diensten. Bij het evalueren van de totale kosteneffectiviteit is het belangrijk deze kosten in verhouding te zien tot de kosten van een ongezonde leefstijl, zoals roken en obesitas, die jaarlijks ten minste €10.000 kunnen bedragen.
Daarnaast worden veel leefstijlinterventies vergoed vanuit het basispakket, zoals stoppen-met-roken-programma's. Gemeenten bieden vaak kosteloze faciliteiten aan, zoals sportprogramma's om leefstijl te verbeteren.
Gezondheidsresultaten: als leefstijlaanpassingen leiden tot een betere gezondheid en minder kans op terugkeer van borstkanker, resulteert dit niet alleen in een betere kwaliteit van leven en betere overleving, maar ook in minder dure behandelingen.
Voorkomen van comorbiditeiten: leefstijlaanpassingen kunnen ook het risico op andere gezondheidsproblemen, zoals hart- en vaatziekten of diabetes, verminderen, wat op zijn beurt weer kostenbesparend kan werken door het vermijden van medische kosten gerelateerd aan deze aandoeningen.
Universele (primaire) preventie borstkanker
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De huidige risicoprofileringstools, zoals PREDICT 2.0, Adjuvant! en Memorial Sloan Kettering Cancer Center, houden nog geen rekening met de performance status van de patiënt en andere patiëntspecifieke kenmerken. Het is echter slechts een kwestie van tijd voordat deze factoren worden opgenomen in de berekeningen om het risico op recidief en metastasering nauwkeuriger te voorspellen.
Zorggerelateerde/secundaire preventie na borstkanker
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
Secundaire preventie omvat zowel de zorg voor patiënten met een benigne aandoening zoals een fibroadenoom als de zorg voor patiënten met borstkanker. In het geval van een benigne aandoening wordt verwezen naar de aanbevelingen genoemd onder universele/primaire preventie. In geval van borstkanker geldt het volgende.
Medicatie en leefstijlfactoren
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
Verschillende veel voorgeschreven geneesmiddelen, zoals insuline, corticosteroïden en antidepressiva, zijn een belangrijke factor bij het ontstaan van overgewicht en obesitas.
Onderbouwing
Achtergrond
In de huidige maatschappij en gezondheidszorg wordt veel aandacht besteed aan een gezonde leefstijl. Leefstijlinterventies (zoals stoppen met roken, verminderen van alcoholgebruik, meer lichaamsbeweging, gewichtsverlies, voldoende slaap, medicamenteuze interventies) hebben niet alleen een positief effect op het psychologische welzijn van een patiënt, maar blijken tevens een significante invloed te hebben op de incidentie van borstkanker en op de uitkomsten van borstkankerbehandelingen (Shaikh, 2020; Lahart, 2018). De literatuur over dit onderwerp is in de laatste jaren verder uitgebreid en heeft een heldere boodschap: leefstijlfactoren hebben een significant effect op de morbiditeit en mortaliteit van borstkanker.
Het bespreken van leefstijl en, indien nodig, het toepassen van leefstijlinterventies bij elke patiënt, inclusief patiënten met borstkanker, lijkt essentieel om de behandelresultaten en prognose te optimaliseren.
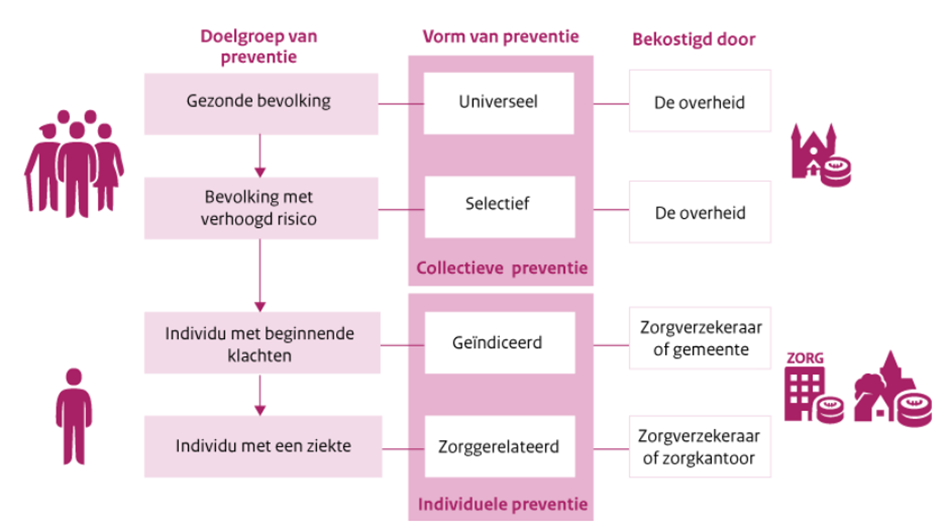
Dit plaatje toont de verschillende vormen van preventie (universeel, selectief, geïndiceerd en zorggerelateerd) gericht op specifieke doelgroepen (gezonde bevolking, mensen met verhoogd risico, mensen met beginnende klachten en mensen met een ziekte) en wie verantwoordelijk is voor de bekostiging (overheid, zorgverzekeraar of gemeente).
Zoeken en selecteren
Er is voor deze uitvraag geen systematische literatuuranalyse uitgevoerd. De aanbevelingen zijn gebaseerd op literatuur die door de expertisegroep leden is aangedragen.
Referenties
- 1 - Aaseth J, Ellefsen S, Alehagen U, Sundfør TM, Alexander J. Diets and drugs for weight loss and health in obesity - An update. Biomed Pharmacother. 2021 Aug;140:111789.
- 2 - Agabio R, Madeddu C, Contu P, Cosentino S, Deiana M, Massa E, Mereu A, Politi C, Sardu C, Sinclair JMA. (2022) Alcohol consumption is a modifiable risk factor for breast cancer: Are women aware of this relationship? Alcohol Alcohol 2022 Sep 10;57(5):533-539. PMID: 34155515 DOI: 10.1093/alcalc/agab042.
- 3 - Allen AM, Prosnitz RG, Ten Haken RK, Normolle DP, Yu X, Zhou SM, Marsh R, Marks LB, Pierce LJ. Body mass index predicts the incidence of radiation pneumonitis in breast cancer patients. Cancer J. 2005 Sep-Oct;11(5):390-8. doi: 10.1097/00130404-200509000-00006. PMID: 16267908.
- 4 - Amitani M, Oba T, Kiyosawa N, Morikawa H, Chino T, Soma A, Shimizu T, Ohno K, Ono M, Ito T, Kanai T, Maeno K, Ito KI. Skeletal muscle loss during neoadjuvant chemotherapy predicts poor prognosis in patients with breast cancer. BMC Cancer. 2022 Mar 26;22(1):327. doi: 10.1186/s12885-022-09443-1. PMID: 35346102.
- 6 - Assi N, Rinaldi S, Viallon V, et al. Mediation analysis of the alcohol-postmenopausal breast cancer relationship by sexhormones in the EPIC cohort. Int J Cancer. 2020;146(3):759-768.
- 7 - Baglia ML, Cook LS, Mei-Tzu C, et al. Alcohol, smoking, and risk of HER2-overexpressing and triple-negative breast cancer relative to estrogen receptor-positive breast cancer. Int J Cancer. 2018;143(8):1849-1857.
- 8 - Baron JA, La Vecchia C, Levi F. (1990). The antiestrogenic effect of cigarette smoking in women. Am J Obstet Gynecol 162:502–514.
- 9 - Beasley JM, Kwan ML, Chen WY, Weltzien EK, Kroenke CH, Lu W, Nechuta SJ, Cadmus-Bertram L, Patterson RE, Sternfeld B, Shu XO, Pierce JP, Caan BJ. Meeting the physical activity guidelines and survival after breast cancer: findings from the after breast cancer pooling project. Breast Cancer Res Treat. 2012 Jan;131(2):637-43. doi: 10.1007/s10549-011-1770-1. Epub 2011 Sep 21. PMID: 21935600.
- 10 - Befort CA, Klemp JR, Austin HL, Perri MG, Schmitz KH, Sullivan DK, et al. Outcomes of a weight loss intervention among rural breast cancer survivors. Breast Cancer Res Treat. 2012;132(2):631-9.
- 11 - de Blacam C, Ogunleye AA, Momoh AO, Colakoglu S, Tobias AM, Sharma R, Houlihan MJ, Lee BT. High body mass index and smoking predict morbidity in breast cancer surgery: a multivariate analysis of 26,988 patients from the national surgical quality improvement program database. Ann Surg. 2012 Mar;255(3):551-5. doi: 10.1097/SLA.0b013e318246c294. PMID: 22330036.
- 12 - Borugian MJ, Sheps SB, Kim-Sing C, Van Patten C, Potter JD, Dunn B, Gallagher RP, Hislop TG. Insulin, macronutrient intake, and physical activity: are potential indicators of insulin resistance associated with mortality from breast cancer? Cancer epidemiology, biomarkers & prevention : a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology. 2004; 13(7):1163–1172.
- 13 - Boyages J, Vicini FA, Manavi BA, Gaw RL, Koelmeyer LA, Ridner SH, Shah C. Axillary Treatment and Chronic Breast Cancer-Related Lymphedema: Implications for Prospective Surveillance and Intervention From a Randomized Controlled Trial. JCO Oncol Pract. 2023 Dec;19(12):1116-1124. doi: 10.1200/OP.23.00060. Epub 2023 Oct 10. PMID: 37816208; PMCID: PMC10732511.
- 14 - Brown JC, Giobbie-Hurder A, Yung RL, Mayer EL, Tolaney SM, Partridge AH, et al. The effects of a clinic-based weight loss program on health-related quality of life and weight maintenance in cancer survivors: A randomized controlled trial. Psychooncology. 2022;31(2):326-33.
- 15 - Brown JC, Sarwer DB, Troxel AB, Sturgeon K, DeMichele AM, Denlinger CS, et al. A randomized trial of exercise and diet on health-related quality of life in survivors of breast cancer with overweight or obesity. Cancer. 2021;127(20):3856-64.
- 16 - Brown KA. 2021: Metabolic pathways in obesity-related breast cancer. Nature Reviews 17:350-363.
- 17 - Calle EE, Rodriguez C, Walker-Thurmond K et al. Overweight, obesity and mortality from cancer in a prospectively studied cohort of U.S. adults. N Eng J Med. 2003;348:1625-1638. Cochrane Database Syst Rev Early breast cancer Triaslists’ Collaborative Group. Review update in cochrane database syst.Rev. vol. 2008. 2001.
- 18 - Chen X, Wang Q, Zhang Y, Xie Q, Tan X. Physical Activity and Risk of Breast Cancer: A Meta-Analysis of 38 Cohort Studies in 45 Study Reports. Value Health. 2019 Jan;22(1):104-128. doi: 10.1016/j.jval.2018.06.020. Epub 2018 Dec 14. PMID: 30661625.
- 19 - Chen WY. Rosner B, Hankinson SE, Colditz GA, Willett WC. Moderate alcohol consumption during adult life, drinking patterns, and breast cancer risk. JAMA. 2011 Nov 2; 306(17): 1884–1890.
- 20 - Cho B, Pérez M, Jeffe DB, Kreuter MW, Margenthaler JA, Colditz GA, Liu Y. Factors associated with initiation and continuation of endocrine therapy in women with hormone receptor-positive breast cancer. BMC Cancer. 2022 Aug 1;22(1):837. doi: 10.1186/s12885-022-09946-x.
- 21 - Chow I, Hanwright PJ, Hansen NM, Leilabadi SN, Kim JY. Predictors of 30-day readmission after mastectomy: A multi-institutional analysis of 21,271 patients. Breast Dis. 2015;35(4):221-31. doi: 10.3233/BD-150412. PMID: 26397768.
- 22 - Cochrane RA, Valasiadou P, Wilson AR, Al-Ghazal SK, Macmillan RD. Cosmesis and satisfaction after breast-conserving surgery correlates with the percentage of breast volume excised. Br J Surg. 2003 Dec;90(12):1505-9. doi: 10.1002/bjs.4344. PMID: 14648728.
- 23 - Collishaw NE, Boyd NF, Cantor KP, Hammond SK, Johnson KC, MIllar J, Miller AB, MIller M, Palmer JR, Salmon AG, Turcotte F (2009) Canadian Expert Panel on Tobacco Smoke and Breast Cancer Risk. In: OTRU Special Report Series. Ontario Tobacco Research Unit, Toronto, Canada
- 24 - Cook TM, Oglesby F, Kane AD, Armstrong RA, Kursumovic E, Soar J. Airway and respiratory complications during anaesthesia and associated with peri-operative cardiac arrest as reported to the 7th National Audit Project of the Royal College of Anaesthetists. Anaesthesia. 2024 Apr;79(4):368-379. doi: 10.1111/anae.16187. Epub 2023 Nov 30. PMID: 38031494.
- 25 - Cox CE, Dupont E, Whitehead GF, Ebert MD, Nguyen K, Peltz ES, Peckham D, Cantor A, Reintgen DS. Age and body mass index may increase the chance of failure in sentinel lymph node biopsy for women with breast cancer. Breast J. 2002 Mar-Apr;8(2):88-91. doi: 10.1046/j.1524-4741.2002.08203.x. PMID: 11896753.
- 26 - Cybulski C, Lubinski J, Huzarski T, et al. Prospective evaluation of alcohol consumption and the risk of breast cancer in BRCA1 and BRCA2 mutation carriers. Breast Cancer Res Treat. 2015;151(2):435-441.
- 27 - Demark-Wahnefried W, Colditz GA, Rock CL, Sedjo RL, Liu J, Wolin KY, et al. Quality of life outcomes from the Exercise and Nutrition Enhance Recovery and Good Health for You (ENERGY)-randomized weight loss trial among breast cancer survivors. Breast Cancer Res Treat. 2015;154(2):329-37.
- 28 - Derossis AM, Fey JV, Cody HS 3rd, Borgen PI. Obesity influences outcome of sentinel lymph node biopsy in early-stage breast cancer. J Am Coll Surg. 2003 Dec;197(6):896-901. doi: 10.1016/j.jamcollsurg.2003.08.005. PMID: 14644276.
- 29 - Dieli-Conwright CM, Courneya KS, Demark-Wahnefried W, Sami N, Lee K, Buchanan TA, et al. Effects of Aerobic and Resistance Exercise on Metabolic Syndrome, Sarcopenic Obesity, and Circulating Biomarkers in Overweight or Obese Survivors of Breast Cancer: A Randomized Controlled Trial. J Clin Oncol. 2018;36(9):875-83.
- 30 - Dignam JJ, Wieand K, Johnson KA, Fisher B, Xu L, Mamounas EP . Obesity, tamoxifen use, and outcomes in women with estrogen receptor-positive early-stage breast cancer. J Natl Cancer Inst. 2003 Oct 1;95(19):1467-76. doi: 10.1093/jnci/djg060. PMID: 14519753 Free PMC article. Clinical Trial.
- 31 - Donat-Vargas C, Guerrero-Zotano Á, Casas A, Baena-Cañada JM, Lope V, Antolín S, Garcia-Saénz JÁ, Bermejo B, Muñoz M, Ramos M, de Juan A, Jara Sánchez C, Sánchez-Rovira P, Antón A, Brunet J, Gavilá J, Salvador J, Arriola Arellano E, Bezares S, Fernández de Larrea-Baz N, Pérez-Gómez B, Martín M, Pollán M. Trajectories of alcohol consumption during life and the risk of developing breast cancer. Br J Cancer. 2021 Oct;125(8):1168-1176. doi: 10.1038/s41416-021-01492-w. Epub 2021 Sep 6. PMID: 34483338.
- 32 - Dorn PL, Corbin KS, Al-Hallaq H, Hasan Y, Chmura SJ. Feasibility and acute toxicity of hypofractionated radiation in large-breasted patients. Int J Radiat Oncol Biol Phys. 2012 May 1;83(1):79-83. doi: 10.1016/j.ijrobp.2011.05.074. Epub 2011 Oct 27. PMID: 22035661.
- 33 - Dossus et al. Hormonal, metabolic, and inflammatory profiles and endometrial cancer risk within the EPIC cohort--a factor analysis. Am J Epidemiol. 2013 Apr 15;177(8):787-99.
- 34 - Early Breast Cancer Trialists' Collaborative Group. Multi-agent chemotherapy for early breast cancer. Cochrane Database Syst Rev. 2002;(1):CD000487. doi: 10.1002/14651858.CD000487. Update in: Cochrane Database Syst Rev. 2008;(4):CD000487. PMID: 11869577.
- 35 - Engen PA, Green SJ, Voigt RM, et al. The gastrointestinal microbiome. Alcohol effects on the composition of intestinal microbiota. Alcohol Res. 2015;37(2):223-236.
- 36 - Ewertz M, Gray KP, Regan MM, et al. Obesity and risk of recurrence or death after adjuvant endocrine therapy with letrozole or tamoxifen in the breast international group 1–98 trial. JCO. 2012;30:3967–75. https://doi.org/10.1200/JCO.2011.40.8666.
- 37 - Ewertz M, Jensen MB, Gunnarsdóttir KÁ, Højris I, Jakobsen EH, Nielsen D, Stenbygaard LE, Tange UB, Cold S. Effect of obesity on prognosis after early-stage breast cancer. J Clin Oncol. 2011 Jan 1;29(1):25-31. doi: 10.1200/JCO.2010.29.7614. Epub 2010 Nov 29. PMID: 21115856.
- 38 - Fan S, Meng Q, Gao B, Grossman J, Yadegari M, Goldberg ID, et al. Alcohol stimulates estrogen receptor signaling in human breast cancer celllines. Cancer Res 2000 ; 60 : 5635 – 9.
- 39 - Fang Q, Huang J, Gan L, Shen K, Chen X, Wu B. Weight Gain during Neoadjuvant Chemotherapy is Associated with Worse Outcome among the Patients with Operable Breast Cancer. J Breast Cancer. 2019 Sep;22(3):399-411. doi: 10.4048/jbc.2019.22.e37. PMID: 31598340.
- 40 - Fardet L, Fève B. Systemic glucocorticoid therapy: a review of its metabolic and cardiovascular adverse events. Drugs. 2014 Oct;74(15):1731-45.
- 41 - Fischer JP, Nelson JA, Kovach SJ, Serletti JM, Wu LC, Kanchwala S. Impact of obesity on outcomes in breast reconstruction: analysis of 15,937 patients from the ACS-NSQIP datasets. J Am Coll Surg. 2013 Oct;217(4):656-64. doi: 10.1016/j.jamcollsurg.2013.03.031. Epub 2013 Jul 25. PMID: 23891077.
- 42 - Ford MB, Sigurdson AJ, Petrulis ES, Ng CS, Kemp B, Cooksley C, McNeese M, Selwyn BJ, Spitz MR, Bondy ML. Effects of smoking and radiotherapy on lung carcinoma in breast carcinoma survivors. Cancer. 2003 Oct 1;98(7):1457-64. doi: 10.1002/cncr.11669. PMID: 14508833.
- 43 - Fortenbery GW, Todd L, Nazir N, Dalla S, Collins M. Oncoplastic Breast Reconstruction in Morbidly Obese Patients: An Acceptable Practice. Plast Reconstr Surg Glob Open. 2024 Feb 12;12(2):e5601. doi: 10.1097/GOX.0000000000005601. PMID: 38348460; PMCID: PMC10861004.
- 44 - Franzoi MA, Eiger D, Ameye L, Ponde N, Caparica R, De Angelis C, Brandão M, Desmedt C, Di Cosimo S, Kotecki N, Lambertini M, Awada A, Piccart M, Azambuja E. Clinical Implications of Body Mass Index in Metastatic Breast Cancer Patients Treated With Abemaciclib and Endocrine Therapy. J Natl Cancer Inst. 2021 Apr 6;113(4):462-470. doi: 10.1093/jnci/djaa116.
- 45 - Freudenheim 2020 Alcohol’s effects on breast cancer in women Alcohol Res 2020;40(2):11.
- 46 - Greenway FL, Fujioka K, Plodkowski RA, Mudaliar S, Guttadauria M, Erickson J, Kim DD, Dunayevich E; COR-I Study Group. Effect of naltrexone plus bupropion on weight loss in overweight and obese adults (COR-I): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2010 Aug 21;376(9741):595-605.
- 47 - Furmaniak AC, Menig M, Markes MH. Exercise for women receiving adjuvant therapy for breast cancer. Cochrane Database Syst Rev. 2016 Sep 21;9(9):CD005001. doi: 10.1002/14651858.CD005001.pub3. PMID: 27650122; PMCID: PMC6457768.
- 48 - Garland M, Hsu FC, Clark C, Chiba A, Howard-McNatt M. The impact of obesity on outcomes for patients undergoing mastectomy using the ACS-NSQIP data set. Breast Cancer Res Treat. 2018 Apr;168(3):723-726. doi: 10.1007/s10549-017-4651-4. Epub 2018 Jan 11. PMID: 29327298.
- 49 - Gnagnarella P, Draga D, Baggi F, Simoncini MC, Sabbatini A, Mazzocco K, et al. Promoting weight loss through diet and exercise in overweight or obese breast cancer survivors (InForma): study protocol for a randomized controlled trial. Trials. 2016;17:363.
- 50 - Gnant M, Mlineritsch B, Stoeger H, et al. Adjuvant endocrine therapy plus zoledronic acid in premenopausal women with early-stage breast cancer: 62-month follow-up from the ABCSG-12 randomised trial. Lancet Oncol. 2011;12:631–41. https://doi.org/10.1016/S1470-2045(11)70122-X.
- 51 - Gnant M, Pfeiler G, Stöger H, Mlineritsch B, Fitzal F, Balic M, Kwasny W, Seifert M, Stierer M, Dubsky P, Greil R, Steger G, Samonigg H, Fesl C, Jakesz R. The predictive impact of body mass index on the efficacy of extended adjuvant endocrine treatment with anastrozole in postmenopausal patients with breast cancer: an analysis of the randomised ABCSG-6a trial. Br J Cancer. 2013 Aug 6;109(3):589-96. doi: 10.1038/bjc.2013.367. Epub 2013 Jul 18.
- 52 - Goodwin PJ, Segal RJ, Vallis M, Ligibel JA, Pond GR, Robidoux A, et al. Randomized trial of a telephone-based weight loss intervention in postmenopausal women with breast cancer receiving letrozole: the LISA trial. J Clin Oncol. 2014;32(21):2231-9.
- 53 - Greenlee HA, Crew KD, Mata JM, McKinley PS, Rundle AG, Zhang W, Liao Y, Tsai WY, Hershman DL. A pilot randomized controlled trial of a commercial diet and exercise weight loss program in minority breast cancer survivors. Obesity (Silver Spring). 2013 Jan;21(1):65-76. doi: 10.1002/oby.20245. PMID: 23505170
- 54 - Hagen KB, Aas T, Kvaløy JT, Søiland H, Lind R. Adherence to adjuvant endocrine therapy in postmenopausal breast cancer patients: A 5-year prospective study. Breast. 2019 Apr;44:52-58. doi: 10.1016/j.breast.2019.01.003. Epub 2019 Jan 8.
- 55 - Hahn M, Simons CCJM, Weijenberg MP, et al. Alcohol drinking, ADH1B and ADH1C genotypes and the risk of postmenopausal breast cancer by hormone receptor status: The Netherlands Cohort Study on diet and cancer. Carcinogenesis. 2018;39(11):1342-1351. https://doi.org/10.1093/carcin/bgy101.
- 56 - Hamajima N, Hirose K, Tajima K, et al. (2002) Alcohol, tobacco and breast cancer--collaborative reanalysis of individual data from 53 epidemiological studies, including 58,515 women with breast cancer and 95,067 women without the disease. Br J Cancer 87:1234-1245.
- 57 - Hollywood A, Ogden J. Taking Orlistat: Predicting Weight Loss over 6 Months. J Obes. 2011; 2011: 806896.
- 58 - Holmes MD, Chen WY, Feskanich D, Kroenke CH, Colditz GA. Physical activity and survival after breast cancer diagnosis. JAMA. 2005;293(20):2479-86.
- 59 - Howell et al. 2014 Risk determination and prevention of breast cancer. Breast Cancer Res. 2014 Sep 28;16(5):446. doi: 10.1186/s13058-014-0446-2
- 60 - IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Personal habits and indoor combustions. Volume 100 E. A review of human carcinogens. IARC Monogr Eval Carcinog Risks Hum. 2012;100(Pt E):1–538.
- 61 - IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Alcohol consumption and ethyl carbamate. IARC Monogr Eval Carcinog Risks Hum. 2010;96:3-1383.
- 62 - Ibrahim EM, Al-Homaidh A. Physical activity and survival after breast cancer diagnosis: meta-analysis of published studies. Med Oncol. 2011 Sep;28(3):753-65. doi: 10.1007/s12032-010-9536-x. Epub 2010 Apr 22. PMID: 20411366
- 63 - Imayama I, Alfano CM, Neuhouser ML, George SM, Wilder Smith A, Baumgartner RN, et al. Weight, inflammation, cancer-related symptoms and health related quality of life among breast cancer survivors. Breast Cancer Res Treat. 2013;140(1):159-76.
- 64 - International Agency for Research on Cancer (2009) A review of human carcinogens. Part E: Personal habits and indoor combustions. Lyon, France.
- 65 - Irwin ML, Cartmel B, Gross CP, Ercolano E, Li F, Yao X, Fiellin M, Capozza S, Rothbard M, Zhou Y, Harrigan M, Sanft T, Schmitz K, Neogi T, Hershman D, Ligibel J. Randomized exercise trial of aromatase inhibitor-induced arthralgia in breast cancer survivors. J Clin Oncol. 2015 Apr 1;33(10):1104-11. doi: 10.1200/JCO.2014.57.1547. Epub 2014 Dec 1. PMID: 25452437; PMCID: PMC4372849.
- 66 - Iyengar N.M., Chen I.C., Zhou X.K. et al. Adiposity, inflammation and breast cancer phatogenesis in Asian woman. Cancer Prev Res. 2018; 11: 227-236.
- 67 - Jiralerspong S, Kim ES, Dong W, et al. Obesity, diabetes, and survival outcomes in a large cohort of early-stage breast cancer patients. Ann Oncol. 2013;24:2506–14. https://doi.org/10.1093/annonc/mdt224.
- 68 - Jung S, Wang M, Anderson K, et al. Alcohol consumption and breast cancer risk by estrogen receptor status: In a pooled analysis of 20 studies. Int J Epidemiol. 2016;45(3):916-928. https://doi.org/10.1093/ije/dyv156.
- 69 - Zhang K, Chen L, Zheng H, Zeng Y. Cytokines secreted from adipose tissues mediate tumor proliferation and metastasis in triple negative breast cancer. BMC Cancer. 2022 Aug 13;22(1):886. doi: 10.1186/s12885-022-09959-6.
- 70 - Karatas F, Erdem GU, Sahin S, Aytekin A, Yuce D, Sever AR, Babacan T, Ates O, Ozisik Y, Altundag K. Obesity is an independent prognostic factor of decreased pathological complete response to neoadjuvant chemotherapy in breast cancer patients. Breast. 2017 Apr;32:237-244. doi: 10.1016/j.breast.2016.05.013. Epub 2016 Jun 16. PMID: 27318645.
- 71 - Key T, Appleby P, Barnes I, Reeves G; Endogenous Hormones and Breast Cancer Collaborative Group. (2002). Endogenous sex hormones and breast cancer in postmenopausal women: reanalysis of nine prospective studies. J Natl Cancer Inst 94:606–616.
- 72 - Key TJ, Balkwill A, Bradbury KE, et al. Foods, macronutrients and breast cancer risk in postmenopausal women: A large UK cohort. Int J Epidemiol. 2019;48(2):489-500. https://doi. org/10.1093/ije/dyy238.
- 73 - Key TJ, Appleby PN, Reeves GK, Travis RC, Alberg AJ, et al; Endogenous Hormones Breast Cancer Collaborative Group. (2013). Sex hormones and risk of breast cancer in premenopausal women: a collaborative reanalysis of individual participant data from seven prospective studies. Lancet Oncol 14:1009–1019
- 74 - Kimoto M, Ishitobi M, Imai N, Nakamura K, Kojima R, Hatakawa E, Ogawa T. Long-term course of the changes in the nipple position after breast-conserving surgery. Surg Today. 2023 Jan;53(1):52-61. doi: 10.1007/s00595-022-02531-6. Epub 2022 Jun 14. PMID: 35701689.
- 75 - Khaw K-T, Tazuke S, Barrett-Connor E. Cigarette smoking and levels of adrenal androgens in postmenopausal women. N Engl J Med 1988; 318: 1705–9.
- 76 - Kreklau A, Nel I, Kasimir-Bauer S, Kimmig R, Frackenpohl AC, Aktas B. An observational study on breast cancer survival and lifestyle related risk factors. In Vivo March 2021, 35 (2) 1007-1015; DOI: https://doi.org/10.21873/invivo.12344.
- 77 - Lynch et al. Physical activity and breast cancer prevention. Recent Results Cancer Res. 2011;186:13-42.
- 78 - Kogawa T, Fujii T, Fouad TM, Liu DD, Harano K, Masuda H, Iwase T, Barnett C, Park YS, Lim B, Tripathy D, Litton JK, Ueno NT. Impact of change in body mass index during neoadjuvant chemotherapy and survival among breast cancer subtypes. Breast Cancer Res Treat. 2018 Sep;171(2):501-511. doi: 10.1007/s10549-018-4853-4. Epub 2018 Jun 18. PMID: 29915946.
- 79 - Krengli M, Masini L, Caltavuturo T, Pisani C, Apicella G, Negri E, Deantonio L, Brambilla M, Gambaro G. Prone versus supine position for adjuvant breast radiotherapy: a prospective study in patients with pendulous breasts. Radiat Oncol. 2013 Oct 8;8:232. doi: 10.1186/1748-717X-8-232. PMID: 24103708; PMCID: PMC3852328.
- 80 - Kwiatkowski F, Mouret-Reynier M-A, Duclos M, Bridon F, Hanh T, Van Praagh-Doreau I, et al. Long-term improvement of breast cancer survivors’ quality of life by a 2-week group physical and educational intervention: 5-year update of the ‘PACThe’ trial. British Journal of Cancer. 2017;116(11):1389-93.
- 81 - Lee K, Kruper L, Dieli-Conwright CM, Mortimer JE. The Impact of Obesity on Breast Cancer Diagnosis and Treatment. Curr Oncol Rep. 2019 Mar 27;21(5):41. doi: 10.1007/s11912-019-0787-1. PMID: 30919143; PMCID: PMC6437123.
- 82 - Leysen L, Beckwée D, Nijs J, Pas R, Bilterys T, Vermeir S, Adriaenssens N. Risk factors of pain in breast cancer survivors: a systematic review and meta-analysis. Support Care Cancer. 2017 Dec;25(12):3607-3643. doi: 10.1007/s00520-017-3824-3. Epub 2017 Aug 10. PMID: 28799015.
- 83 - Macacu A, Autier P, Boniol M, Boyle P. Active and passive smoking and risk of breast cancer: a meta-analysis. Breast Cancer Res Treat 2015; 154, 213–224. https://doi.org/10.1007/s10549-015-3628-4.
- 84 - MacMahon BE, Trichopoulos D, Cole P et al. Cigarette smoking and urinary estrogens. N Engl J Med 1982; 307: 1062–5. 2.
- 85 - Maggi N, Rais D, Nussbaumer R, Levy J, Schwab FD, Kurzeder C, Heidinger M, Weber WP. The American Society of Breast Surgeons classification system for oncoplastic breast conserving surgery independently predicts the risk of delayed wound healing. Eur J Surg Oncol. 2023 Oct;49(10):107032. doi: 10.1016/j.ejso.2023.107032. Epub 2023 Aug 16. PMID: 37619374.
- 86 - Manjer J, Johansson R, Lenner P (2005). Smoking as a determinant for plasma levels of testosterone, androstenedione, and DHEAs in postmenopausal women. Eur J Epidemiol 20:331–337
- 87 - Maunsell E, Drolet M, Brisson J, Robert J, Deschenes L. Dietary change after breast cancer: extent, predictors, and relation with psychological distress. J Clin Oncol 2002; 20: 1017–1025.
- 88 - McTiernan A. Weight physical activity and breast cancer survival. Proc Nutr Soc. 2018; 77: 403-411.
- 89 - Mefferd K, Nichols JF, Pakiz B, Rock CL. A cognitive behavioral therapy intervention to promote weight loss improves body composition and blood lipid profiles among overweight breast cancer survivors. Breast Cancer Research and Treatment. 2007;104(2):145-52.
- 90 - Members of the Working Party; Nightingale CE, Margarson MP, Shearer E, Redman JW, Lucas DN, Cousins JM, Fox WT, Kennedy NJ, Venn PJ, Skues M, Gabbott D, Misra U, Pandit JJ, Popat MT, Griffiths R; Association of Anaesthetists of Great Britain; Ireland Society for Obesity and Bariatric Anaesthesia. Peri-operative management of the obese surgical patient 2015: Association of Anaesthetists of Great Britain and Ireland Society for Obesity and Bariatric Anaesthesia. Anaesthesia. 2015 Jul;70(7):859-76. doi: 10.1111/anae.13101. Epub 2015 May 7. PMID: 25950621; PMCID: PMC5029585.
- 91 - Mesa-Eguiagaray I, Wild SH, Rosenberg PS, Bird SM, Brewster DH, Hall PS, Cameron DA, Morrison D, Figueroa JD. Distinct temporal trends in breast cancer incidence from 1997 to 2016 by molecular subtypes: a population-based study of Scottish cancer registry data. Br J Cancer. 2020 Sep;123(5):852-859. doi: 10.1038/s41416-020-0938-z. Epub 2020 Jun 19. PMID: 32555534; PMCID: PMC7463252.
- 92 - Meshulam-Derazon S, Yaacobi DS, Ben-David MA, Lvovsky A, Hadanny A, Ganor O, Amir A, Ad-El D, Wertman M. Identifying the Variables for Oncoplastic Reconstruction: Preoperative Assessment Tool for Breast Conserving Treatment. Aesthetic Plast Surg. 2023 Oct 23. doi: 10.1007/s00266-023-03701-8. Epub ahead of print. PMID: 37872221.
- 93 - Moody AM, Mayles WP, Bliss JM, A'Hern RP, Owen JR, Regan J, Broad B, Yarnold JR. The influence of breast size on late radiation effects and association with radiotherapy dose inhomogeneity. Radiother Oncol. 1994 Nov;33(2):106-12. doi: 10.1016/0167-8140(94)90063-9. PMID: 7708953.
- 94 - Mrad MA, Al Qurashi AA, Shah Mardan QNM, Alqarni MD, Alhenaki GA, Alghamdi MS, Fathi AB, Alobaidi HA, Alnamlah AA, Aljehani SK, Daghistani G, Alsharif TH. Predictors of Complications after Breast Reconstruction Surgery: A Systematic Review and Meta-analysis. Plast Reconstr Surg Glob Open. 2022 Dec 13;10(12):e4693. doi: 10.1097/GOX.0000000000004693. PMID: 36583164; PMCID: PMC9750533.
- 95 - Munsell MF, Sprague BL, Berry DA et al. Body Mass index and breast cancer risk according to postmenopausal estrogen-progestin-use and hormone receptor status. Epidemiol Rev. 2014;36:114-136.
- 96 - Nyrop KA, Williams GR, Muss HB, Shachar SS. Weight gain during adjuvant endocrine treatment for early-stage breast cancer: What is the evidence? Breast Cancer Res Treat. 2016 Jul;158(2):203-17. doi: 10.1007/s10549-016-3874-0. Epub 2016 Jun 24.
- 97 - de Oliveira-Junior I, da Costa Vieira RA, Biller G, Sarri AJ, da Silva FCB, Nahás EAP. Factors associated with unsatisfactory cosmetic results in oncoplastic surgery. Front Oncol. 2023 Jul 24;13:1071127. doi: 10.3389/fonc.2023.1071127. PMID: 37554162; PMCID: PMC10405917.
- 98 - Pan H., Gray R., Braybrooke J. et al. 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years. N Engl J Med. 2017; 377: 1836-1846.
- 99 - Picon-Ruiz M, Morata-Tarifa C, Valle-Goffin JJ et al. Obesity and Adverse Breast Cancer Risk and Outcome: Mechanistic Insughts and Strategies for Intervention. Ca Cancer J Clin 2017;67:378-397.
- 100 - Panayi AC, Agha RA, Sieber BA, Orgill DP. Impact of Obesity on Outcomes in Breast Reconstruction: A Systematic Review and Meta-Analysis. J Reconstr Microsurg. 2018 Jun;34(5):363-375. doi: 10.1055/s-0038-1627449. Epub 2018 Mar 6. PMID: 29510420.
- 101 - Pandit JJ, Andrade J, Bogod DG, Hitchman JM, Jonker WR, Lucas N, Mackay JH, Nimmo AF, O'Connor K, O'Sullivan EP, Paul RG, Palmer JH, Plaat F, Radcliffe JJ, Sury MR, Torevell HE, Wang M, Hainsworth J, Cook TM; Royal College of Anaesthetists and the Association of Anaesthetists of Great Britain and Ireland. The 5th National Audit Project (NAP5) on accidental awareness during general anaesthesia: summary of main findings and risk factors. Anaesthesia. 2014 Oct;69(10):1089-101. doi: 10.1111/anae.12826. PMID: 25204236.
- 102 - Pfeiler G, Königsberg R, Fesl C, et al. Impact of body mass index on the efficacy of endocrine therapy in premenopausal patients with breast cancer: an analysis of the prospective ABCSG-12 trial. JCO. 2011;29:2653–9. https://doi.org/10.1200/JCO.2010.33.2585.
- 103 - Pfeiler G, Stöger H, Dubsky P, Mlineritsch B, Singer C, Balic M, Fitzal F, Moik M, Kwasny W, Selim U, Renner K, Ploner F, Steger GG, Seifert M, Hofbauer F, Sandbichler P, Samonigg H, Jakesz R, Greil R, Fesl C, Gnant M; ABCSG. Efficacy of tamoxifen ± aminoglutethimide in normal weight and overweight postmenopausal patients with hormone receptor-positive breast cancer: an analysis of 1509 patients of the ABCSG-06 trial. Br J Cancer. 2013 Apr 16;108(7):1408-14. doi: 10.1038/bjc.2013.114. Epub 2013 Mar 19. PMID: 23511562.
- 104 - Pierpont YN, Dinh TP, Salas RE, Johnson EL, Wright TG, Robson MC, Payne WG. Obesity and surgical wound healing: a current review. ISRN Obes. 2014 Feb 20;2014:638936. doi: 10.1155/2014/638936. PMID: 24701367; PMCID: PMC3950544.
- 105 - Pires de Carvalho K, Miranda Lima MT, Mazzutti FS, Dias Custódio ID, Lajolo Canto PP, Paiva CE, Paiva Maia YC. Longer Times of Receipt of Adjuvant Endocrine Therapy Correspond to Improved Functional Capacity and Lower Adiposity in Women Receiving Adjuvant Therapy. Clin Breast Cancer. 2019 Feb;19(1):e208-e219. doi: 10.1016/j.clbc.2018.09.003. Epub 2018 Sep 13.
- 106 - Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M, Lau DC, le Roux CW, Violante Ortiz R, Jensen CB, Wilding JP; SCALE Obesity and Prediabetes NN8022-1839 Study Group. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med. 2015 Jul 2;373(1):11-22.
- 107 - Poorolajal J, Heidarimoghis F, Karami M, Cheraghi Z, Gohari-Ensaf F, Shahbazi F, Zareie B, Ameri P, Sahraee F. Factors for the Primary Prevention of Breast Cancer: A Meta-Analysis of Prospective Cohort Studies. J Res Health Sci. 2021 Jul 20;21(3):e00520. doi: 10.34172/jrhs.2021.57. PMID: 34698654; PMCID: PMC8957681.
- 108 - Raman R, Mott SL, Schroeder MC, Phadke S, El Masri J, Thomas A. Effect of Body Mass Index- and Actual Weight-Based Neoadjuvant Chemotherapy Doses on Pathologic Complete Response in Operable Breast Cancer. Clin Breast Cancer. 2016 Dec;16(6):480-486. doi: 10.1016/j.clbc.2016.06.008. Epub 2016 Jun 23. PMID: 27431461; PMCID: PMC5801768.
- 109 - Reeves GK, Pirie K, Beral V et al. Cancer incidende and mortality in relation to body mass index in the Million Women Study: cohort study [serial online]. BMJ. 2007;335:1134.
- 110 - Ren Y, Chase E, d'Almeida T, Allègre J, Latino-Martel P, Deschamps V, Arwidson P, Etilé F, Hercberg S, Touvier M, Julia C. Modelling the number of avoidable new cancer cases in France attributable to alcohol consumption by following official recommendations: a simulation study. Addiction. 2021 Sep;116(9):2316-2325. doi: 10.1111/add.15426. Epub 2021 Feb 18. PMID: 33565659.
- 111 - Robinson WR, Tse CK, Olshan AF et al. Body size across the life course and risk of premenopausal and postmenopausal breast cancer in black women, the Carolina Breast Study. 1993-2001. Cancer Causes Control. 2014;25:1101-1117.
- 112 - Rock CL, Flatt SW, Byers TE, Colditz GA, Demark-Wahnefried W, Ganz PA, et al. Results of the Exercise and Nutrition to Enhance Recovery and Good Health for You (ENERGY) Trial: A Behavioral Weight Loss Intervention in Overweight or Obese Breast Cancer Survivors. J Clin Oncol. 2015;33(28):3169-76.
- 113 - Russell-Jones D, Khan R. Insulin-associated weight gain in diabetes--causes, effects and coping strategies. Diabetes Obes Metab. 2007 Nov;9(6):799-812.
- 114 - Savas M, Wester VL, Visser JA, Kleinendorst L, van der Zwaag B, van Haelst MM, van den Akker ELT, van Rossum EFC. Extensive Phenotyping for Potential Weight-Inducing Factors in an Outpatient Population with Obesity. Obes Facts. 2019;12(4):369-384.
- 115 - Sendur MAN, Aksoy S, Zengin N, Altundag K. Efficacy of adjuvant aromatase inhibitor in hormone receptor-positive postmenopausal breast cancer patients according to the body mass index. Br J Cancer. 2012;107:1815–9. https://doi.org/10.1038/bjc.2012.473.
- 116 - Schatzkin A et al. Alcohol consumption and breast cancer in the epidemiologic follow-up study of the First National Health and Nutrition Examination Study. New Engl J Med. 1987;316(19):1169-1173. https://doi.org/0.1056/NEJM198705073161901.
- 117 - Schmidt G, Schneider C, Gerlinger C. Endrikat J, Gabriel L, Ströder R, Müller C, Juhasz-Böss I, Solomayer E-F. Impact of body mass index, smoking habit, alcohol consumption, physical activity and parity on disease course of women with triple-negative breast cancer. Arch Gynecol Obstet 301, 603–609 (2020). https://doi.org/10.1007/s00404-019-05413-4.
- 118 - Sestak I, Distler W, Forbes JF, et al. Effect of body mass index on recurrences in tamoxifen and anastrozole treated women: an exploratory analysis from the ATAC trial. JCO. 2010;28:3411–5. https://doi.org/10.1200/JCO.2009.27.2021.
- 119 - Shen A, Qiang W, Zhang L, Bian J, Zhu F, Zhang Z, Lu Q. Risk Factors for Breast Cancer-Related Lymphedema: An Umbrella Review. Ann Surg Oncol. 2024 Jan;31(1):284-302. doi: 10.1245/s10434-023-14277-7. Epub 2023 Sep 19. PMID: 37725224.
- 120 - Shield KD, Soerjomataram I, Rehm J. Alcohol use and breast cancer: A critical review. Alcohol Clin Exp Res. 2016;40(6):1166- 1181. https://doi.org/10.1111/acer.13071.
- 121 - Shirdarreh M, Pezo RC. Impact of obesity on clinical outcomes in hormone receptor-positive breast cancer: a systematic review. Breast Cancer. 2021 May;28(3):755-764. doi: 10.1007/s12282-020-01213-w. Epub 2021 Jan 11. PMID: 33428124.
- 122 - Sinclair J et al. 2019 The acceptability of addressing alcohol consumption as a modifiable risk factor for breast cancer: a mixed method study within breast screeningservices and symptomatic breast clinics. BMJOpen9:e027371.
- 123 - Sinicrope F.A., Dannenberg A.J. Obesity and breast cancer prognosis: weight of evidence. J Clin Oncol. 2011; 29: 4-7.
- 124 - Singletary KW, Frey RS, Yan W. Effect of ethanol on proliferation and estrogen receptor-alpha expression in human breast cancer cells. CancerLett 2001 ; 165 : 131 – 7.
- 125 - Shaikh H, Bradhurst P, Ma LX, Tan SYC, Egger SJ, Vardy JL. Body weight management in overweight and obese breast cancer survivors. Cochrane Database Syst Rev. 2020;12:CD012110.
- 126 - Sheppard VB, Hicks J, Makambi K, Hurtado-de-Mendoza A, Demark-Wahnefried W, Adams-Campbell L. The feasibility and acceptability of a diet and exercise trial in overweight and obese black breast cancer survivors: The Stepping STONE study. Contemporary Clinical Trials. 2016;46:106-13.
- 127 - Speck RM, Courneya KS, Masse LC, Duval S, Schmitz KH. An update of controlled physical activity trials in cancer survivors: a systematic review and meta-analysis. J Cancer Surviv. 2010;4(2):87-100.
- 128 - Stallard S, Savioli F, McConnachie A, Norrie J, Dudman K, Morrow ES, Romics L. Antibiotic prophylaxis in breast cancer surgery (PAUS trial): randomised clinical double-blind parallel-group multicentre superiority trial. Br J Surg. 2022 Nov 22;109(12):1224-1231. doi: 10.1093/bjs/znac280. PMID: 35932230; PMCID: PMC10364710
- 129 - Stanford FC, Cena H, Biino G, Umoren O, Jimenez M, Freeman MP, Shadyab AH, Wild RA, Womack CR, Banack HR, Manson JE. The association between weight-promoting medication use and weight gain in postmenopausal women: findings from the Women's Health Initiative. Menopause. 2020 Oct;27(10):1117-1125.
- 130 - Steele JR, Coltman CE, McGhee DE. Effects of Obesity on Breast Size, Thoracic Spine Structure and Function, Upper Torso Musculoskeletal Pain and Physical Activity in Women. J Sport Health Sci (2020) 9(2):140–8. doi: 10.1016/j.jshs.2019.05.003
- 131 - Streur-Kranenburg, M. (2023). Gedrag. In: Leefstijlgeneeskunde in de praktijk. Bohn Stafleu van Loghum, Houten. https://doi.org/10.1007/978-90-368-2863-5_12
- 132 - Strong et al. Obesity associated alterations in the biology of adipose stem cells mediate enhanced tumorigenesis by estrogen dependent pathways. Breast Cancer Res. 2013;15(5):R102. doi: 10.1186/bcr3569.
- 133 - Suzuki R, Ye W., Rylander-Rudqvist, Saji, Colditz, Wok (2005) Alcohol and Postmenopausal Breast Cancer Risk Defined by Estrogen and Proesterone Receptor Status: A Prospective Cohort Study. 10.1093/jnci/dji341.
- 134 - Taylor C, Correa C, Duane FK, Aznar MC, Anderson SJ, Bergh J, Dodwell D, Ewertz M, Gray R, Jagsi R, Pierce L, Pritchard KI, Swain S, Wang Z, Wang Y, Whelan T, Peto R, McGale P; Early Breast Cancer Trialists’ Collaborative Group. Estimating the Risks of Breast Cancer Radiotherapy: Evidence From Modern Radiation Doses to the Lungs and Heart and From Previous Randomized Trials. J Clin Oncol. 2017 May 20;35(15):1641-1649. doi: 10.1200/JCO.2016.72.0722. Epub 2017 Mar 20. PMID: 28319436; PMCID: PMC5548226.
- 135 - Teija-Kaisa A, Eija M, Marja S, Outi L. Risk factors for surgical site infection in breast surgery. J Clin Nurs. 2013 Apr;22(7-8):948-57. doi: 10.1111/jocn.12009. Epub 2012 Nov 2. Erratum in: J Clin Nurs. 2015 Oct;24(19-20):3020. PMID: 23121264.
- 136 - Tong WMY, Baumann DP, Villa MT, Mittendorf EA, Liu J, Robb GL, Kronowitz SJ, Garvey PB. Obese Women Experience Fewer Complications after Oncoplastic Breast Repair following Partial Mastectomy Than after Immediate Total Breast Reconstruction. Plast Reconstr Surg. 2016 Mar;137(3):777-791. doi: 10.1097/01.prs.0000479939.69211.19. PMID: 26910658.
- 137 - Verhaegen AA, Van Gaal LF. Drugs Affecting Body Weight, Body Fat Distribution, and Metabolic Function-Mechanisms and Possible Therapeutic or Preventive Measures: an Update. Curr Obes Rep. 2021 Mar;10(1):1-13.
- 138 - Vernaci et al. BMI is an independent prognostic factor for late outcome in patients diagnosed with early breast cancer: A landmark survival analysis Breast. 2019 Oct;47:77-84. doi: 10.1016/j.breast.2019.07.003. Epub 2019 Jul 20.
- 139 - Wang EY, Borno HT, Washington SL III, Friedlander T, Zhang S, Trejo E, Van Blarigan EL, Chan JM, Shariff-Marco S, Beatty AL, Kenfield SA. Engaging men of diverse racial and ethnic groups with advanced prostate cancer in the design of an mhealth diet and exercise intervention: focus group study. JMIR Cancer. 2023 Jun 1:9:e45432. PMID: 37261885 PMCID: PMC10273032 DOI: 10.2196/45432.
- 140 - Wang H, Zhang S, Yee D, Basu S, Beckwith H, Potter D, Blaes A. Impact of body mass index on pathological complete response following neoadjuvant chemotherapy in operable breast cancer: a meta-analysis. Breast Cancer. 2021 May;28(3):618-629. doi: 10.1007/s12282-020-01194-w. Epub 2021 Jan 2. PMID: 33387284.
- 141 - Weng JK, Lei X, Schlembach P, Bloom ES, Shaitelman SF, Arzu IY, Chronowski G, Dvorak T, Grade E, Hoffman K, Perkins G, Reed VK, Shah SJ, Stauder MC, Strom EA, Tereffe W, Woodward WA, Hortobagyi GN, Hunt KK, Buchholz TA, Smith BD. Five-Year Longitudinal Analysis of Patient-Reported Outcomes and Cosmesis in a Randomized Trial of Conventionally Fractionated Versus Hypofractionated Whole-Breast Irradiation. Int J Radiat Oncol Biol Phys. 2021 Oct 1;111(2):360-370. doi: 10.1016/j.ijrobp.2021.05.004. Epub 2021 May 13. PMID: 33992718; PMCID: PMC9057640.
- 142 - Wennstig AK, Wadsten C, Garmo H, Johansson M, Fredriksson I, Blomqvist C, Holmberg L, Nilsson G, Sund M. Risk of primary lung cancer after adjuvant radiotherapy in breast cancer-a large population-based study. NPJ Breast Cancer. 2021 Jun 1;7(1):71. doi: 10.1038/s41523-021-00280-2. PMID: 34075042; PMCID: PMC8169889.
- 143 - Westmaas JL, Newton CC, Stevens VL, Flanders WD, Gapstur SM, Jacobs EJ. Does a recent cancer diagnosis predict smoking cessation? An analysis from a large prospective US cohort. J Clin Oncol. 2015 May 20;33(15):1647-52. doi: 10.1200/JCO.2014.58.3088. Epub 2015 Apr 20. PMID: 25897151.
- 144 - Widschwendter P, Friedl TW, Schwentner L, DeGregorio N, Jaeger B, Schramm A, Bekes I, Deniz M, Lato K, Weissenbacher T, Kost B, Andergassen U, Jueckstock J, Neugebauer J, Trapp E, Fasching PA, Beckmann MW, Schneeweiss A, Schrader I, Rack B, Janni W, Scholz C. The influence of obesity on survival in early, high-risk breast cancer: results from the randomized SUCCESS A trial. Breast Cancer Res. 2015 Sep 18;17(1):129. doi: 10.1186/s13058-015-0639-3. PMID: 26385214; PMCID: PMC4575482.
- 145 - Wijgman DJ, Ten Wolde B, van Groesen NR, Keemers-Gels ME, van den Wildenberg FJ, Strobbe LJ. Short term safety of oncoplastic breast conserving surgery for larger tumors. Eur J Surg Oncol. 2017 Apr;43(4):665-671. doi: 10.1016/j.ejso.2016.11.021. Epub 2016 Dec 18. PMID: 28041648.
- 146 - Willet et al. Moderate alcohol consumption and the risk of breast cancer. New Engl J Med. 1987;316(19):1174-1180. https://doi.org/10.1056/nejm198705073161902.
- 147 - Wisse A, Tryggvadottir H, Simonsson M, et al. Increasing preoperative body size in breast cancer patients between 2002 and 2016: implications for prognosis. Cancer Causes Control. 2018;29:643–56. https://doi.org/10.1007/s10552-018-1042-z.
- 148 - Winkels RM, Sturgeon KM, Kallan MJ, Dean LT, Zhang Z, Evangelisti M, et al. The women in steady exercise research (WISER) survivor trial: The innovative transdisciplinary design of a randomized controlled trial of exercise and weight-loss interventions among breast cancer survivors with lymphedema. Contemp Clin Trials. 2017;61:63-72.
- 149 - Wolters R, Schwentner L, Regierer A, Wischnewsky M, Kreienberg R, Wöckel A. Endocrine therapy in obese patients with primary breast cancer: another piece of evidence in an unfinished puzzle. Breast Cancer Res Treat. 2012 Feb;131(3):925-31. doi: 10.1007/s10549-011-1874-7. Epub 2011 Nov 13. PMID: 22080246.
- 150 - Wong G, Lam E, Karam I, Yee C, Drost L, Tam S, Lam H, McCarvell A, McKenzie E, Chow E. The impact of smoking on adjuvant breast cancer radiation treatment: A systematic review. Cancer Treat Res Commun. 2020;24:100185. doi: 10.1016/j.ctarc.2020.100185. Epub 2020 Jun 20. PMID: 32593846.
- 151 - World Cancer Research Fund, American Institute for Cancer Research. Continuous Update Project Expert Report. Diet, Nutrition, Physical Activity and Breast Cancer: A Global Perspective. https://www.wcrf.org/dietandcancer/about.
- 152 - Wu Y, Zhang D, Kang S. Physical activity and risk of breast cancer: a meta-analysis of prospective studies. Breast Cancer Res Treat. 2013 Feb;137(3):869-82. doi: 10.1007/s10549-012-2396-7. Epub 2012 Dec 30. PMID: 23274845.
- 153 - Xie Y, Wang Q, Hu T, Chen R, Wang J, Chang H, Cheng J. Risk Factors Related to Acute Radiation Dermatitis in Breast Cancer Patients After Radiotherapy: A Systematic Review and Meta-Analysis. Front Oncol. 2021 Nov 29;11:738851. doi: 10.3389/fonc.2021.738851. PMID: 34912704; PMCID: PMC8667470.
- 154 - Xue DQ, Qian C, Yang L, Wang XF. Risk factors for surgical site infections after breast surgery: a systematic review and meta-analysis. Eur J Surg Oncol 2012 May;38(5):375-81.
- 155 - Yancy WS, Westman EC, McDuffie JR, et al. A Randomized Trial of a Low-Carbohydrate Diet vs Orlistat Plus a Low-Fat Diet for Weight Loss. Arch Intern Med. 2010;170(2):136–145.
- 156 - Yang XR, Chang-Claude J, Goode EL et al. Associations of breast cancer risk factors with tumor subtypes: a pooled analysis from the breast Cancer Association Consortium studies. J Natl Cancer Inst. 2011: 103:250-263.
- 157 - Zewenghiel L, Lindman H, Valachis A. Impact of body mass index on the efficacy of endocrine therapy in patients with metastatic breast cancer - A retrospective two-center cohort study. Breast. 2018 Aug;40:136-140. doi: 10.1016/j.breast.2018.05.005.
- 158 - Zhou X. Yu L. Wang L. Xiao J. Sun J. Zhou Y. Xu X. Xu W. Spiliopoulou A. Timofeeva M. Zhang X. He Y. Yang H. Campbell H. Zhang B. Zhu Y. Theodoratou E. Li X. (2022) Alcohol consumption, blood DNA methylation and breast cancer: a Mendelian randomisation study, European Journal of Epidemiology 37:701-712
- 159 - Zorginstituut Nederland. GVS-advies naltrexon in combinatie met bupropion voor behandeling van obesitas. 2022. Geraadpleegd op 14 juli 2023. Beschikbaar via: https://www.zorginstituutnederland.nl/publicaties/adviezen/2022/05/17/gvs-advies-naltrexon-in-combinatie-met-bupropion-mysimba.
Evidence tabellen
Niet van toepassing.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-07-2025
Beoordeeld op geldigheid : 01-06-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met borstkanker.
|
Werkgroeplid |
Namens |
|
M.A.W.M.C. (Marlene) Hoynck van Papendrecht |
BVN |
|
C. (Cristina) Guerrero Paez |
BVN |
|
M.A. (Marjolein) Scholten |
BVN |
|
C.M. (Marco) van Esterik |
Contactgroep Phyllodes |
|
M. (Michelle) Verseveld MSc |
KNGF |
|
S.W.M.C. (Saskia) Accord-Maass |
NHG |
|
B.E.P.J. (Birgit) Vriens |
NIV |
|
A. (Agnes) Jager |
NIV |
|
C.H. (Carolien) Smorenburg, voorzitter |
NIV |
|
H. (Hiltje) de Graaf |
NIV |
|
J.R. (Judith) Kroep |
NIV |
|
A. (Anne) Lukas |
NVA |
|
H.H. (Huub) van Rossum |
NVKC |
|
C. (Christiaan) van Swol |
NVKF |
|
F. (Frederiek) van den Bos |
NVKG |
|
L.A.E. (Leonie) Woerdeman |
NVPC |
|
M.A.M. (Marc) Mureau |
NVPC |
|
A.N. (Astrid) Scholten |
NVRO |
|
H.J.G.D. (Desiree) van den Bongard |
NVRO |
|
J.H. (John) Maduro |
NVRO |
|
M.J.C. (Maurice) van der Sangen |
NVRO |
|
N. (Nina) Bijker |
NVRO |
|
L.J. (Liesbeth) Boersma |
NVRO |
|
D.J.P. (Dominique) van Uden |
NVvH |
|
E.L. (Emily) Postma |
NVvH |
|
J.H. (José) Volders |
NVvH |
|
L.J.A. (Luc) Strobbe |
NVvH |
|
F.H. (Frederieke) van Duijnhoven |
NVvH |
|
E.M. (Elise) Bekers |
NVVP |
|
A.I.M. (Inge-Marie) Obdeijn |
NVvR |
|
C.E. (Claudette) Loo |
NVvR |
|
M.B.I. (Marc) Lobbes |
NVvR |
|
C. (Carla) Meeuwis |
NVvR |
|
L.M.H. (Lidy) Wijers |
NVvR |
|
M.W. (Mechli) Imhof-Tas |
NVvR |
|
A. (Angelie) van den Bosch |
V&VN |
|
A.M.J. (Antoinette) Holterman |
V&VN oncologie |
|
J.M. (Margriet) Collée |
VKGN |
|
M. (Marijke) Wevers |
VKGN |
Met dank aan:
- S. de Goijer, onderzoeker/ ANIOS chirurgie, Noordwest Ziekenhuisgroep
- C. Mulder, onderzoeker, Maastricht University
- L. van Hout, onderzoeker, Maastricht University
- Dr. M. Bakens, chirurg, Van Weel-Bethesda
- Dr. E. Boerma, chirurg, Zuyderland Medisch Centrum
- Dr. S. Engelen, chirurg, Maastricht Universitair Medisch Centrum
- Dr. M. Moossdorff, chirurg, Maastricht Universitair Medisch Centrum
- Dr. F. Gillissen, chirurg, Jeroen Bosch Ziekenhuis
- Dr. J. van Iersel, chirurg, Amphia Ziekenhuis
- Dr. J. ’t Lam-Boer, chirurg, Isala
- Dr. W. Zwaans, chirurg, Máxima MC
- Dr. A. Bosmans, chirurg, Noordwest Ziekenhuisgroep
Met ondersteuning van
- S.N. (Sarah) van Duijn, adviseur Kennisinstituut van Federatie van Medisch specialisten (2024)
- dr. L. (Linda) Oostendorp, senior adviseur Kennisinstituut van Federatie van Medisch specialisten (2023)
- M. (Miriam) te Lintel Hekkert, adviseur Kennisinstituut van Federatie van Medisch specialisten (2023)
- N. (Nadine) Zielonke, adviseur Kennisinstituut van Federatie van Medisch specialisten (2023)
- J. (Joppe) Tra, senior adviseur Kennisinstituut van Federatie van Medisch specialisten (2023-2024)
- dr. M.A. (Margreet) Pols, adjunct directeur Kennisintituut van Federatie van Medisch specialisten (2024-2025)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
|
Smorenburg (voorzitter) |
* Internist-oncoloog Antoni van Leeuwenhoek |
Lid Bestuur gasthuis Antoni van Leeuwenhoek (onbetaald) |
In 2018 een vergoeding van €1307,00 ontvangen van Pfizer.
|
|
Guerrero Paez |
Directeur Borstkanker Vereniging Nederland |
Lid Raad van Toezicht SPL te Leiden (onbetaald) |
Als patiëntenorganisatie leveren wij vanuit partïëntenperspectief advies aan. Persoonlijk ben ik alleen betrokken bij het Covid consorium waar we onderzoek doen naar Covid en Borstkanker. Trekker is IKNL (geen rol als projectleider). Verder werken wij met de PAG samen en allerlei vrijwillgers. Wij ontvangen van de farmacie gelden voor specifieke projecten op het gebied van informatievoorziening en/of lotgenotencontact. Deze zijn multisponsored en worden altijd opgenomen in het transparantieregister. |
|
Vriens |
Internist-oncoloog Catherinaziekenhuis Eindhoven |
In 2018 een vergoeding van €870,00 ontvangen van Novartis. |
|
|
Mureau |
Plastisch chirurg, Erasmus MC, Universitair Medisch Centrum Rotterdam |
* Maatschapslid AZR>SFG, werkzaamheden als plastisch chirurg (betaald) |
Polytech Health & Asethetics GmbH - Long-term results of breast reconstruction with polyurethane covered implants: a multicenter randomized controlled trial - Projectleider |
|
Bongard, van den |
Radiotherapeut-oncoloog, Amsterdam UMC |
* Lid NABON bestuur (onbetaald) |
* KWF/ Pink Ribbon - Eenmalige hoge dosis radiotherapie mammacarcinooom (ABLATIVE project, 2013 en 2020) - Projectleider; VARIAN grant voor Adaptive Radiotherapy in Breast Cancer patients (BREAST-ART, 2020) - Projectleider. * Lid landelijke werkgroep hypofractionering mammacarcinoom |
|
Van Swol |
* Klinisch Fysicus, St. Antonius Ziekenhuis (0,9 fte) |
Voorzitter Bestuur Stichting Opleiding Klinische Fysica - onbetaald. Zie www.stichtingokf.nl |
Geen |
|
Van Duijnhoven |
Chirurg-oncoloog, Nederlands Kanker Instituut / Antoni van Leeuwenhoek Ziekenhuis |
* European Organization for Research and Treatment of Cancer, secretary of the Breast Cancer Group |
* Innovatiefonds Zorgverzekeraars - Towards omitting breast surgery in patients with a complete response to neoadjuvant chemotherapy - biopten past NAC ter evaluatie respons onderzoek inmiddels afgerond- Geen projectleider, co-PI * KWF - Management of low risk ductal carcinoma in situ (low-risk DCIS): a non-randomized, multicenter, non-inferiority trial between standard therapy approch versus active surveillance - clinical trial ongoing - Geen projectleider, co-PI * KWF - Clinically node negative breast cancer patients undergoing breast conserving therapy: Sentinel lymph node procedure versus follow-up - randomized clinical trial, accural complete January 2022 - Geen projectleider, local PI * EORTC-quality of life group - Follow-up in Early and Locally Advanced Breast Cancer Patients: An EORTC QLG-BCG-ROG Protocol - clinical study in which quality of life data are registered in patients treated for breast cancer < 3 years ago - Geen projectleider, local PI * Als arts ook betrokken bij de patiëntenvereniging voor Phyllodes tumoren van de borst, wat 1 van de geformuleerde knelpunten vanuit onze beroepsvereniging is. |
|
Volders |
Oncologische chirurg |
* Bestuurslid werkgroep Mammachirurgie NVCO - onbetaald |
Geen |
Clusterexpertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
|
Wijers |
Mamma- en neuroradioloog Alrijne Zorggroep (Leiderdorp - Leinden - Alphen) |
* Lid NABON |
In 2020 een vergoeding van €1270,00 ontvangen van Bayer. |
|
Collée |
Klinisch geneticus, Erasmus MC Rotterdam |
Geen |
* KWF - Nationwide infrastructure integrating research and health care to improve management for Dutch women with familial breast cancer risk Infrastructure Initiatives – * KWF Building in the Archipelago of Ovarian Cancer Research - Geen projectleider |
|
Rossum, van |
Laboratorium specialist Klinische Chemie, Afdeling Algemeen Klinisch Laboratorium Antoni van Leeuwenhoek Ziekenhuis Amsterdam |
* Eigenaar en directeur Huvaros B.V. (onbetaald) |
* Health Holland - Subsidie voor vingerprik bloedafname systeem voor Covid-19 serologie - Projectleider |
|
Bos, van den |
Internist-ouderengeneeskunde LUMC |
Voorzitter kerngroep ouderen NIV (onbetaald) |
SKMS - Keuzehulpen nij patiënten met multimorbiditeit - Projectleider
|
|
Verseveld |
* Bestuurslid Nederlandse Vereniging voor fysiotherapie bij Lymfologie en Oncologie, portefeuilehouder Wetenschap Oedeem en Oncologie: 8 uur per week |
* NVFL: vrijwillige functie |
Geen |
|
Loo |
Radioloog, gespecialiseerd mammaradiologie & sreening BVO (regio midden west). NKI-AVL (Nederlands Kanker Instituut, Antoni van Leeuwenhoek) en BVO midden west |
* Wetenschappelijke cie NBCA (deels betaals/vacatie) |
In 2019 een vergoeding van €1749,00 ontvangen van Bayer. |
|
Meeuwis |
Mammaradioloog Ziekenhuis Rijnstate |
* NABON - werkgroep standaardisatie verslaglegging (onbetaald) |
* SENO medical - Echografie gecombineerd met laserlicht voor de diagostiek bij verdachte massa's in de borst - Projectleider
|
|
Jager |
Internist-oncoloog Erasmus MC Kanker Instituut Rotterdam |
* Voorzitter Stichting BOOG (Borstkaner onderzoeksgroep) - onbezoldigd |
* KWF - Prediction of Breast Cancer chemotherapy response in patients by determination of chemosensitivity in tumoer tissue ex vivo - Projectleider In 2019 een vergoeding van €980,00 ontvangen van Roche Pharma. |
|
Maduro |
Radiotherapeut oncoloog, Universitaire Medische Centrum Groningen en Prinses Maxima Centrum voor kinderoncologie |
Bestuur BOOG, onbetaald |
EU - HARMONIC, gevolgen straling bij kinderen - Geen projectleider
|
|
Postma |
Oncologisch chirurg Antonius Ziekenhuis Nieuwegein |
* Bestuurslid werkgroep Mammachirurgie NVCO - onbetaald NVCO werkgroep Mammachirurgie Bestuurslid NVCO |
Geen |
|
Uden |
Fellow chirurgische oncologie: per 17-1-2022 te Gelre Ziekenhuizen (hiervoor fellow chirurgische oncologie in het Rijnstate Ziekenhuis) |
Niet van toepassing |
Onbetaald en ongefinancierd promotie onderzoek naar inflammatoir mammacarcinoom: nu geen aandachtspunt voor de revisie. |
|
Woerdeman |
Plastisch chirurg Antoni van Leeuwenhoek Amsteram |
* Hoofd afdeling plastische chirurgie Antoni van Leeuwenhoek |
Dutch Cancer Society, Grand/Award Number: - Ontwikkeling borst reconstructie keuzehulp - Projectleider
|
|
Esterik, van |
Tot 2014 zelfstandige als Invalbakker |
* Brood en Banker Bakker |
Geen |
|
Scholten, M |
* Belangenbehartiger bij BVN (Borstkankervereniging) |
* Zitting in Patiënten Advies Raad Parkinsonvereniging (vrijwillig) en Maatschappelijke Adviesraad ParkinsonNL |
Geen |
|
Hoynck van Papendrecht |
Vrijwilligster BVN |
* Gepensioneerd arts |
Geen |
|
Lukas |
Anesthesioloog-pijnspecialist MUMC+ |
Samenwerking met BVN die dateert uit 2010 als expert voor pijnklachten tijdens en na borstkankerbehandeling |
Pink Ribbon KWF - AMAZONE: preventie van persisterende pijn na borstkankerbehandeling – Co-Principal Investigator ESAIC - AMAZONE: preventie van persisterende pijn na borstkankerbehandeling – Co-Principal Investigator
|
|
Wevers |
Klinisch geneticus bij Radboudumc |
Geen |
Pink Ribbon en KWF – betrokken bij diverse onderzoeksprojecten vanuit HEBON (onderzoek naar erfelijke borst- en eierstokkanker, www.hebon.nl) als lid van de stuurgroep HEBON. |
|
Willems-Blom
|
WW Grain Brokers BV - Financial controller
|
Stichting Erfelijke Kanker Nederland - Bestuurslid
|
Geen |
|
Vreuls
|
UMCU, Patholoog
|
Geen |
Geen |
|
Smidt
|
Oncologisch chirurg MUMC+
|
Research / Onderwijs
|
* Nutricia - Microbioom, CRC, chemotherapie en prebiotica - Projectleider |
|
Engelen
|
Chirurg-oncoloog Maastricht UMC+
|
Geen |
Geen |
|
Accord-Maass
|
* Huisarts, in dienst van Huisartspraktijk van Bracht en Dorgelo in Drachten, 0.7 fte
|
* Meedenken over "Late gevolgen" borstkankervereniging onderzoeksagenda door de borstkankervereniging (onbetaald)
|
* 2011.WO18.C118/Pink Ribbon Foundation - BLOC-I - Long-term outcome of cardiac function in a population-based cohort of breast cancer survivors - Geen projectleider
|
|
Liefers
|
Hoofd chirurgische oncologie, LUMC
|
Geen |
* HOLOGIC - BCI, Elderly studie - Projectleider |
|
Intema
|
Nucleair geneeskundige CMSR Rijnstate Ziekenhuis Arnhem
|
* Werkgroep richtlijn botmetastasen
|
Inkomsten binnen CMSR Rijnstate zijn zeer beperkt gerelateerd aan aantal radiologische en nucleaire verrichtingen dat geadviseerd wordt in de richtlijn. Dit effect wordt echter nagenoeg opgeheven door landelijke normering van aantallen naar fte.
|
|
Teske
|
Staflid cardiologie, afdeling cardiologie, divisie hart en longen, Universitair medisch centrum Utrecht
|
Geen |
Geen |
|
Plieger - Bos
|
Belangenbehartiger Borstkankervereniging Nederland
|
Geen |
Geen |
|
Schipper
|
Oncologisch chirurg - Catharina ziekenhuis Eindhoven
|
Geen |
Geen |
|
Boer, de
|
Internist-oncoloog in Maastricht Universitair Medisch Centrum
|
Lid van Data Safety Monitoring Board van BYL719C2303 studie (Novartis), betaald (uurtarief voor voorbereidingstijd en vergadertijd; 2 vergaderingen per jaar)
|
* Novartis, E. Lilly, Pfizer, Roche, AstraZeneca, Daiichi Sankyo, Gilead - Institutioneel onderzoeksgeld voor de SONABRE studie: een observationele cohortstudie van patiënten met gemetastaseerd mammacarcinoom - Geen projectleider
Sprekersvergoeding voor modereren van nascholing december 2023 (SABCS in het Bos). Deze nascholing werd gesponsord door Pfizer en Eli Lilly. De sprekervergoeding is betaald aan het Maastricht UMC+.
|
|
Appelman
|
* Mammaradioloog, Alexander Monro Ziekenhuis
|
* Bestuurslid sectie mammaradiologie (NVvR)
|
ZonMw - Volgorde beeldvorming bij focale klachten; initiële echografie en de meerwaarde van mammografie in deze setting - Geen projectleider
Intellectuele bekangen: O.b.v. onderzoeksresultaten bij vrouwen met focale klachten en huidige inzichten in de literatuur zou ik eens de richtlijnencommissie willen benaderen voor objectieve toetsing om de leeftijdgrenst voor initiële echografie te verhoven naar 40 jaar (i.p.v. 30 jaar -> huidige richtlijn)
|
|
Berg, van den |
Plastisch chirurg, NKI-AVL
|
Geen |
Geen |
|
Piatkowski de Grzymala
|
* Plastisch chirurg en Plaatsvervangend Hoofd / MUMC+ / 0,8 FTE
|
|
Aandeelhouder MOOI kliniek * ZonMw - BREAST2, prospectieve cohort onderzoek i.v.n. AFT reconstructie van de borst, lange termijn veiligheid - Projectleider
Intellectueel belang: Bekendheid van de AFT-procedure
|
|
Vegt, van der
|
Patholoog, Universitair Medisch Centrum Groningen
|
* Patholoog, Academisch Borstcentrum Groningen, Martini Ziekenhuis Groningen (detachering)
|
DEKRA, extern adviseur * GE Healthcare - Digital spatial profiling of metastatic breast cancer - Projectleider
|
|
Leij, van der
|
Radiotherapeut-oncoloog UMC Utrecht
|
Geen |
Geen |
|
Westhoff
|
Radiotherapeut-oncoloog Radboudumc (betaald)
|
Geen |
Betrokken bij BOS-studie (fractuurpredictie femurmetastasen) (onbetaald, geen Projectleider)
|
|
Bosma
|
Radiotherapeut-oncoloog, LUMC (per 1-11-2024)
|
Geen |
Geen |
|
Crijns
|
Radiotherapeut Oncoloog UMCG (Hans Langendijk) |
Geen |
1. Euratom research&training programme 2014-2018 grant agreement N0 755523 - EDIRAD BRACE en EARLY HEART; prediction models for radiation induced cardiac events; detection of the most important cardiac imaging (ECHO-ST, CT and MRI) and circulating biomarkers of radiation-induced cardiovascular changes -Projectleider 2. ZonMw - CONRAD project: borstreconstructie en radiotherapie; praktijkvariatie en zoektocht naar optimale strategie - Geen projectleider 3. From the European Partnership for Radiation Protection Research (Pianoforte) and the Saxon Ministry of Science (SMWK) - KAYAC; therefore explore which approaches in radiation therapy can improve treatment outcomes and prevent the occurrence of secondary tumors in adolescents and young adults - Lokale projectleider 4. CIHR; Canadian Institutes of Health Research / Instituts de recherche en santé du Canada - Development of a novel risk prediction model for chronic postsurgical pain after breast cancer surgery - Geen projectleider |
|
Immink
|
Radiotherapeut-oncoloog in LUMC en gedetacheerd naar afdeling radiotherapie RdG en mammapoli Alrijne (0,8 FTE)
|
* NTG mammacarcinoom regiio Zuid-Holland-West, lid, onbetaald
|
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de Borstkankervereniging Nederland (BVN) uit te nodigen voor de invitational conference en de werkgroep. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan BVN en de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK). De eventueel aangeleverde commentaren zijn bekeken en waar mogelijk verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz.
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er [waarschijnlijk geen/ mogelijk] substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Leefstijl en borstkanker
|
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep schriftelijk de knelpunten in de zorg voor patiënten met borstkanker. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model met behulp van Review Manager 5.4. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.