Informatieparagraaf
Inleiding
In dit document bevat informatie over de informatiestandaard mammacarcinoom aangeleverd in de vorm van een informatieparagraaf van een kwaliteitsstandaard. Voor de eisen aan de informatieparagraaf is het volgende document gebruikt: Toetsingskader kwaliteitsstandaarden en meetinstrumenten (versie 3.0), versie 14 januari 2020.
Het document is op de volgende manier opgebouwd:
- Hoofdstuk 2: Procesbeschrijving, waarin een beschrijving van het zorgproces mammacarcinoom wordt gegeven. In het zorgproces is aangegeven voor welke gebruikte gegevenssets in het zorgproces eenheid van taal is ontwikkeld.
- Hoofdstuk 3: Informatiestandaard, waarin de afstemming van de informatiestandaard mammacarcinoom op andere standaarden zoals de TNM-classificatie, BIRADS-atlas, etc beschreven.
Dit document kent daarnaast een aantal bijlagen:
- Bijlage B1 bevat detaillering van de procesbeschrijving van verschillende type MDO’s die kunnen plaatsvinden in het zorgtraject voor mammacarcinoom.
- Bijlage B2 bevat achtergrondinformatie over de aanleiding,ontwikkeling, implementatie en beheer van de informatiestandaard mammacarcinoom opgenomen. Deze informatie is ook te vinden is op de website van het Nationaal Borstkanker Overleg Nederland (NABON) en op Amigo! (beheerd door Nictiz).
Procesbeschrijving
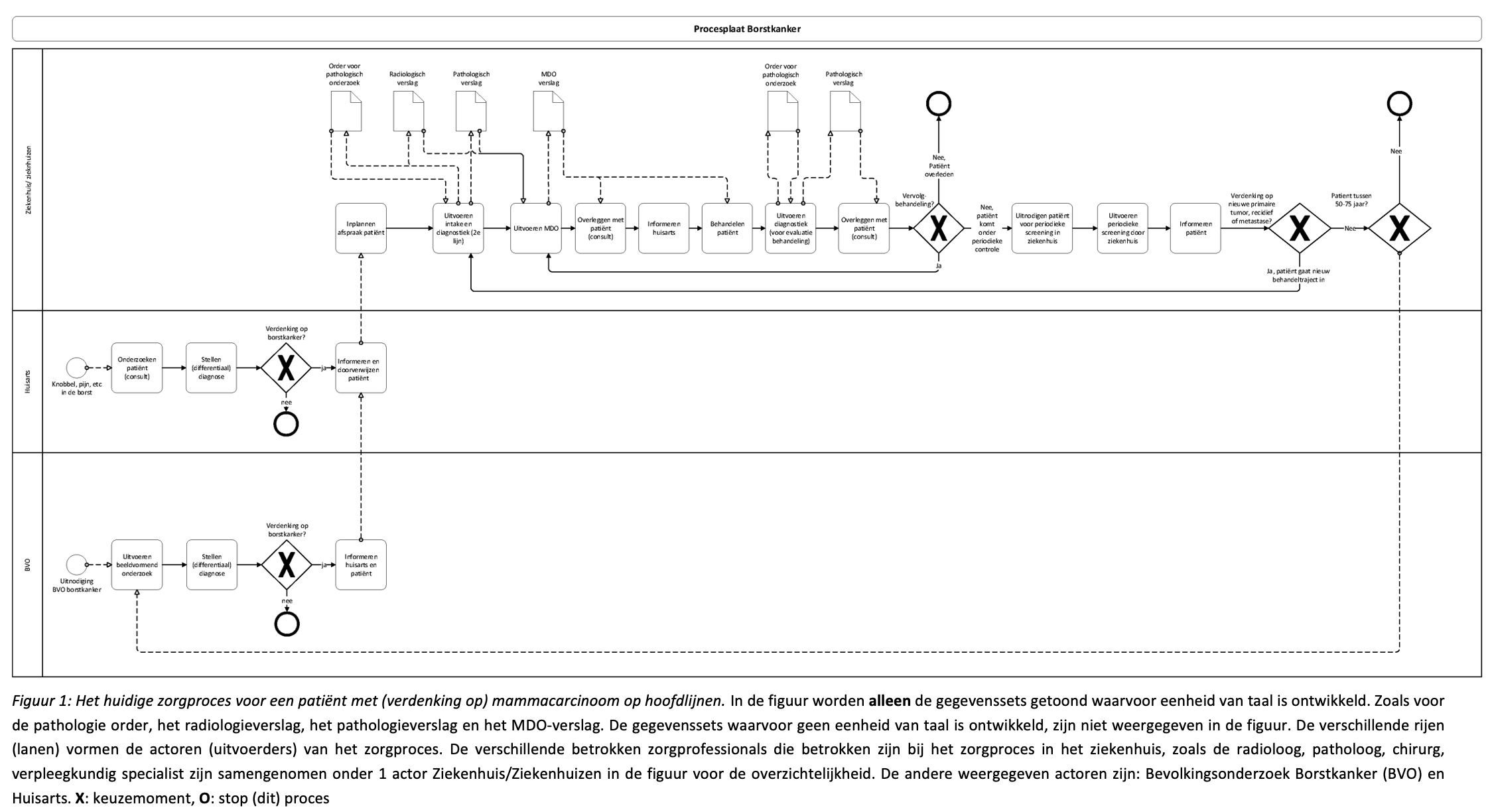
In figuur 1 staat het zorgproces voor mammacarcinoom op hoofdlijnen weergegeven. In de figuur worden alleen de gegevenssets getoond waarvoor eenheid van taal is ontwikkeld. Zoals voor het radiologieverslag, de pathologie order, het pathologieverslag en het MDO-verslag. Deze gegevenssets vormen de input & output bij een stap in het zorgproces en vormen samen de informatiestandaard mammacarcinoom. Gegevenssets waarvoor geen eenheid van taal is ontwikkeld, zijn niet weergegeven in de figuur.
De ontwikkeling van eenheid van taal is in 2014 gestart door de NABON richtlijncommissie en overgenomen door de NABON commissie standaardisering verslaglegging. Deze commissie bestaat sinds 2018 en is gestart met eenheid van taal voor het Multidisciplinair Overleg (MDO) en de radiologieverslaglegging. Hiervoor hebben zij een landelijke gestructureerde gegevensset vastgesteld voor wat er minimaal in het verslag moet staan. Deze gegevensset is afgestemd op de landelijke zorginformatiebouwstenen versie 2017 en de Gegevensset Oncologie Algemeen. Er is gestart met het MDO omdat hier de diagnose en het behandeladvies van de patiënt in overleg met de betrokken zorgverleners wordt bepaald. In het MDO worden de gegevens uit verschillende bronnen bij elkaar gebracht en besproken. Doordat veel gegevens hier overgetypt moeten worden is de wens voor gestructureerde – en waar mogelijk discrete – verslaglegging en automatisch hergebruik van gegevens groot.
De intentie is om in de komende jaren om gegevenssets in de andere stappen van het zorgproces te ontwikkelen en hiermee de informatiestandaard mammacarcinoom uit te breiden.
De verschillende rijen (lanen) in figuur 1 vormen de actoren (uitvoerders) van het zorgproces. De verschillende betrokken zorgprofessionals die betrokken zijn bij het zorgproces in het ziekenhuis,
In de tabel wordt de figuur verder toegelicht. Er wordt een toelichting gegeven per actor van:
- De trigger of processtap
- De actoren
- De getoonde gegevenssets in figuur 1 die gebruikt en uitgewisseld worden (de zogenoemde informatiestromen) en waarvoor eenheid van taal is ontwikkeld .
- In welk informatiesyste(e)m(en) deze gegevenssets vastgelegd worden
- Een hyperlink naar relevante documentatie.
|
Actor |
Trigger of Processtap |
Toelichting actoren |
Informatiestromen |
Toelichting stap in zorgproces |
Gebruikte informatie-systemen |
Relevante aanvullende documentatie |
|
Huisarts |
Knobbel, pijn, etc in de borst |
|
|
De patiënt komt met klachten aan de borst (knobbel, pijn, etc) bij de huisarts
|
|
|
|
Huisarts |
Onderzoeken patiënt (consult) |
|
|
De huisarts vraagt de patiënt naar de voorgeschiedenis, klachten, etc. en onderzoekt de patiënt.
|
Huisarts informatie systeem |
|
|
Huisarts |
Stellen (differentiaal) diagnose |
|
|
De huisarts noteert onder andere voorgeschiedenis, anamnese, uitslag van het lichamelijk onderzoek, etc in het consultverslag.
|
Huisarts informatie systeem |
|
|
Huisarts |
Informeren en doorverwijzen patiënt |
|
|
Indien er een verdenking op mammacarcinoom bestaat, verwijst de huisarts de patiënt naar het ziekenhuis.
|
Huisarts informatie systeem, ZorgDomein
|
|
|
BVO borstkanker |
Uitnodiging BVO borstkanker |
|
|
De patiënt ontvangt een uitnodiging voor het bevolkingsonderzoek borstkanker (BVO) en komt voor het onderzoek |
|
|
|
BVO borstkanker |
Uitvoeren beeldvormend onderzoek
|
Screeningsradioloog, radiodiagnostisch laborant, administratief medewerker |
|
De zorgprofessional voert het onderzoek uit. |
|
|
|
BVO borstkanker |
Stellen (differentiaal) diagnose |
|
|
De beelden en verslagen van de beeldvorming van het BVO worden voor de ziekenhuizen beschikbaar gesteld.
|
Radiologie informatiesysteem en PACS van de screening (Screen IT) |
|
|
BVO borstkanker |
Informeren huisarts en patiënt |
Screeningsradioloog, administratief medewerker |
|
De screeningsradioloog informeert de huisarts over de uitslag. Daarnaast ontvangt de patiënt de uitslag.
|
Screen IT |
|
|
Ziekenhuis |
Inplannen afspraak patiënt |
Secretariaat |
|
Het secretariaat gebruikt de verwijzing van de huisarts om contact op te nemen met de patiënt voor het plannen van een afspraak.
|
|
|
|
Ziekenhuis |
Uitvoeren intake en diagnostiek (2e lijn) |
Verpleegkundig specialist, oncologisch chirurg, radiologisch laborant, radioloog, patholoog, nucleair geneeskundige, medisch nucleair werker, klinisch geneticus |
Input en output van deze processtap: order(s) voor pathologisch onderzoek
Output: radiologisch verslag en pathologisch verslag |
Er wordt een intake van de patiënt gedaan. Er wordt daarnaast een order uitgezet voor radiologisch onderzoek, dit wordt uitgevoerd en verslagen.
Indien er (een verdenking op) mammacarcinoom is, worden verdere orders voor aanvullend onderzoek uitgezet, uitgevoerd en verslagen zoals onderzoek door de patholoog en, klinisch geneticus, etc. |
EPD, Radiologie informatiesysteem, PACS, Pathologie informatiesysteem, informatiesysteem van de klinisch genetici |
De gegevensset voor de pathologie-order en de gegevensset voor gestructureerde verslaglegging voor de radiologie zijn hier beschikbaar. Deze zijn ontwikkeld door de NABON en de NVvR.
De gegevensset voor gestructureerde verslaglegging voor de pathologie wordt ontwikkeld en beheerd door de NVVP en PALGA en is hier te vinden.
Overige relevante documentatie: Landelijke richtlijn mammacarcinoom
|
|
Ziekenhuis |
Uitvoeren MDO (MultiDisciplinair Overleg) |
Verpleegkundig specialist, radioloog, patholoog, internist-oncoloog, oncologisch chirurg, radiotherapeut, plastisch chirurg, nucleair geneeskundige, klinisch geneticus |
Input: Radiologisch verslag en pathologisch verslag. Output: MDO-verslag
|
De patiënt wordt aangemeld voor het MDO, voorbereid door de zorgprofessionals en besproken op het MDO.
Van de uitkomsten van het MDO wordt een MDO-verslag gemaakt. |
EPD, Radiologie informatiesysteem en PACS, Pathologie informatie systeem
Indien MDO transmuraal gehouden wordt; transmurale MDO applicatie
|
Voor het MDO is de gestructureerde gegevensset vastgesteld door de NABON. De gegevens die nodig zijn voor het vaststellen van de diagnose en behandeling verschilt per behandelfase (preoperatief, tijdens/na neoadjuvante behandeling, postoperatief en gemetastaseerd) en ook per ziektekenmerken (wel/niet gemetastaseerd). Daarom is voor elk type MDO een gegevensset ontwikkeld. Deze zijn hier te vinden. Daarnaast wordt een toelichting van de typen MDO’s gegeven in de tabel in bijlage B1.
Overige relevante documentatie: IHE handreiking transmuraal MDO mammacarcinoom
|
|
Ziekenhuis |
Overleggen met patiënt (consult) |
Oncologisch chirurg, internist-oncoloog, radiotherapeut, plastisch chirurg, verpleegkundig specialist, klinisch geneticus |
Input: MDO-verslag
|
De uitkomsten van het MDO worden met de patiënt besproken. In overleg met de patiënt wordt het behandelplan afgesproken.
|
EPD
|
|
|
Ziekenhuis |
Informeren huisarts |
internist-oncoloog, oncologisch chirurg, radiotherapeut, plastisch chirurg, administratief medewerker |
|
De huisarts wordt geïnformeerd over de diagnose en het behandelplan middels een brief |
EPD
|
|
|
Ziekenhuis |
Behandelen patiënt |
internist-oncoloog, oncologisch chirurg, radiotherapeut, plastisch chirurg, paramedische zorgverleners |
Input: MDO-verslag
|
De patiënt wordt behandeld. |
EPD Informatiesysteem van de radiotherapie, Voor medicatie: Apotheek informatie systeem en cytostatica informatiesysteem
|
|
|
Ziekenhuis |
Uitvoeren diagnostiek (voor evaluatie behandeling) |
Oncologisch chirurg, verpleegkundig specialist, Radiologisch laborant, radioloog, patholoog, nucleair medewerker, nucleair geneeskundige, administratief medewerker. |
Input en output van deze processtap: order(s) voor pathologisch onderzoek
Output: pathologisch verslag
|
De behandeling van de patiënt wordt geëvalueerd aan de hand van aanvullend onderzoek. Als de patiënt geopereerd is, wordt er een pathologisch onderzoek gedaan van het uitgenomen weefsel |
EPD, Radiologie informatiesysteem en PACS, Pathologie informatie systeem |
De gegevensset voor de pathologie-order, komt hier beschikbaar. Deze is ontwikkeld door de NABON.
De gegevensset voor gestructureerde verslaglegging voor de pathologie wordt ontwikkeld en beheerd door de NVVP en PALGA en is hier te vinden.
|
|
Ziekenhuis |
Overleggen met patiënt overleggen (consult) |
Oncologisch chirurg, internist-oncoloog, , radiotherapeut, plastisch chirurg, verpleegkundig specialist |
|
De uitkomsten van de behandeling en het aanvullend onderzoek worden met de patiënt besproken. Indien nodig, wordt het vervolg van de behandeling besproken.
|
EPD
|
|
|
Ziekenhuis |
Uitnodigen patiënt voor periodieke screening in ziekenhuis |
Secretariaat |
|
Na de behandeling van mammacarcinoom wordt de patiënt op regelmatige basis uitgenodigd door het ziekenhuis voor een periodieke screening. Om te beoordelen of de mammacarcinoom wegblijft.
|
EPD |
|
|
Ziekenhuis |
Uitvoeren periodieke screening |
Oncologisch chirurg, verpleegkundig specialist in ziekenhuis, radiotherapeut, radiodiagnostisch laborant, Radioloog, internist oncoloog, administratief medewerker
BVO: screeningsradioloog, radiodiagnostisch laborant |
|
Het radiologisch onderzoek voor de periodieke screening wordt uitgevoerd. |
EPD, Radiologie informatiesysteem en PACS
|
|
|
Ziekenhuis |
Informeren patiënt |
Oncologisch chirurg, of verpleegkundig specialist in ziekenhuis of internist-oncoloog |
|
De patiënt wordt geïnformeerd over de uitkomsten van het radiologisch onderzoek.
|
|
|
Verwijzing naar een ander ziekenhuis
De verwijzing naar een ander ziekenhuis in hierboven niet meegenomen. Wanneer een patiënt verwezen wordt naar een ander ziekenhuis voor aanvullende diagnostiek, second opinion of behandeling gaat in ieder geval een verwijsbrief mee. Deze kan vergezeld zijn van aanvullend klinisch relevante gegevens zoals beeldvorming, en bijbehorende verslaglegging.
Informatiestandaard mammacarcinoom en afstemming op bestaande standaarden
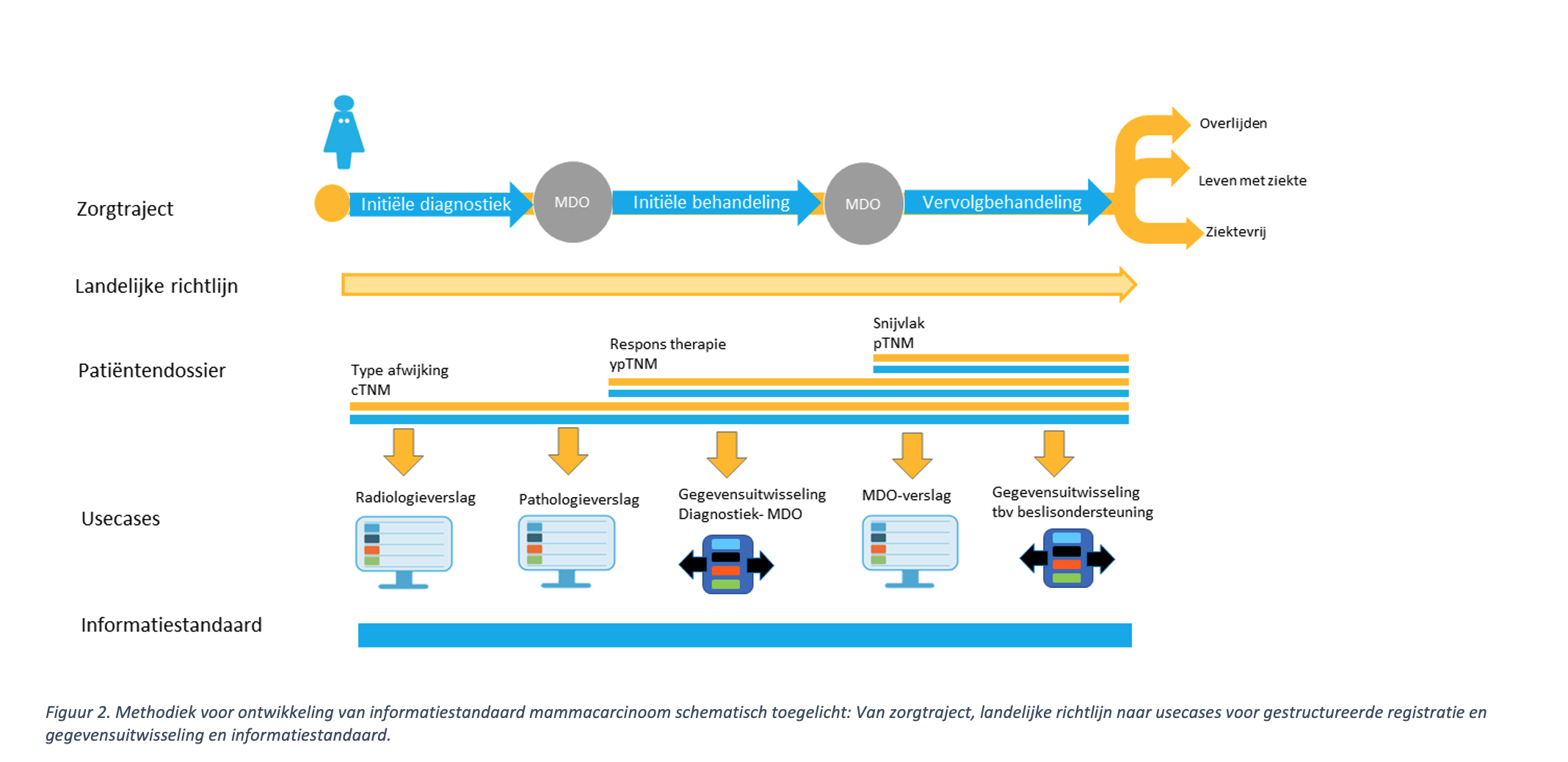
De ontwikkelde gegevenssets zijn gebaseerd op bestaande standaarden als de zorginformatiebouwstenen (zibs) versie 2017, Gegevensset Oncologie Algemeen (GOA), en terminologiestelsels zoals SNOMED CT, TNM of LOINC. Voor deze afstemming is de volgende methodiek gevolgd:
- De richtlijncommissie van het NABON heeft de landelijke – geautoriseerde - tekstuele richtlijn vertaald naar beslisbomen. In een beslisboom wordt getoond welke aanbevelingen de richtlijn doet op basis van specifieke (eenduidig gedefinieerde) patiënt- en tumorkenmerken. Deze kenmerken vormen de uitgangsset van gegevens in de informatiestandaard mammacarcinoom, zie ook figuur 2.
- Deze gegevens zijn vervolgens aangevuld met klinisch relevante gegevens die niet in de beslisbomen voorkwamen, maar wel relevant zijn voor het MDO en het radiologieverslag. Hierbij wordt voor borging van de eenheid van taal het volgende uitgangspunt gehanteerd: Gegevens die zowel gebruikt worden in het MDO- en radiologieverslagen, de richtlijn en de beslisbomen én waarmee precies hetzelfde bedoeld wordt, moeten overal volgens dezelfde definitie gebruikt worden. Dus hetzelfde datatype, eenheid en onderliggende internationale SNOMED CT codering. De tumordiameter moet bijvoorbeeld overal vastgelegd worden met eenheid cm (en niet mm).
Voor de informatiestandaard mammacarcinoom is hieronder een overzicht gegeven op welke standaarden is afgestemd:
|
Standaard |
Beheerder |
Toelichting |
|
Nictiz |
Een zorginformatiebouwsteen (zib) definieert een klinisch concept zodanig, dat deze als bouwsteen bruikbaar is in verschillende zorgsituaties en -informatiesystemen. Zibs vormen daarmee de basis voor standaardisatie van zorginformatie. |
|
|
Regionale Oncologienetwerken |
De Gegevensset Oncologie Algemeen bevat oncologie-generieke gegevens waarvan de verwachting is dat deze in ieder oncologisch zorgproces klinisch relevant zijn. |
|
|
Landelijke richtlijncommissie van het NABON |
De richtlijn is te vinden op www.richtlijnendatabase.nl |
|
|
NVVP en PALGA |
Pathologen werken door middel van landelijke protocollen: voor iedere patiënt, in elk ziekenhuis in Nederland wordt dezelfde informatie verzameld en op een duidelijke en overzichtelijke manier gepresenteerd. |
|
|
American College of Radiology. De Nederlandse vertaling hiervan wordt beheerd door de NVVR/DCBI |
Door een uniforme verslaglegging en werkwijze wordt communicatie verbeterd, het overleg tussen ziekenhuizen vergemakkelijkt en wetenschappelijk onderzoek eenvoudiger. Zie ook: radiologen.nl/secties/mammaradiologie |
|
|
RIVM |
De dataset is beschikbaar op ART-DECOR: https://decor.nictiz.nl/ART-DECOR/decor-project--rivmbk-- |
|
|
Union for International Cancer Control's (UICC) |
|
|
|
World Health Organization (WHO) |
|
|
|
International Classification of Diseases for Oncology, 3rd Edition (ICD-O-3) |
World Health Organization (WHO) |
|
|
SNOMED-CT international. In Nederland is Nictiz het National Release Center (NRC) van SNOMED |
SNOMED CT is een medische standaard voor het documenteren en coderen van medische gegevens. SNOMED CT bestaat uit een verzameling medische termen die zijn gecodeerd om door een computer verwerkt te worden. Het omvat gebieden als ziektes, symptomen, verrichtingen, behandelingen, apparatuur en medicatie. |
In de figuur hieronder is de gebruikte methodiek schematisch toegelicht. In elke use case (MDO-, radiologieverslaglegging, beslisbomen) wordt een deel van de gegevens uit de informatiestandaard gebruikt. De gegevenssets voor de use cases zijn overlappend omdat zij voor een deel dezelfde gegevens gebruiken. In bijna elke use case is bijvoorbeeld de tumordiameter, klierstatus, leeftijd en TNM classificatie van belang. De gehele informatiestandaard is te vinden op ART-DECOR en tevens als Excel te downloaden via https://www.nabon.nl/standaardisatie-epd/.
Toelichting verschillende type MDO’s
Voor het MDO is de gestructureerde gegevensset vastgesteld door de NABON commissie standaardisatie verslaglegging. De gegevens die nodig zijn voor het vaststellen van de diagnose en maken behandelplan verschilt per MDO (preoperatief, tijdens/na neoadjuvante behandeling, postoperatief en in gemetastaseerde setting). Daarom is per type MDO een (unieke)gegevensset ontwikkeld. Deze gegevenssets zijn hier te vinden. Hieronder wordt toegelicht welk type MDO voor welke patiëntgroep in welke behandelfase is bedoeld.
|
Type MDO |
Beschrijving patiëntengroep |
|
MDO Preoperatief |
Bedoeld voor de voorbereiding en bespreking van de volgende patiëntgroepen:
Opmerkingen:
|
|
MDO Neoadjuvant |
Bedoeld voor de voorbereiding en bespreking van de volgende patiëntgroepen:
|
|
MDO Postoperatief |
Bedoeld voor de voorbereiding en bespreking van de volgende patiëntgroepen:
|
|
MDO Gemetastaseerd & palliatief |
Bedoeld voor de voorbereiding en bespreking van de volgende patiëntgroepen:
|
Achtergrondinformatie
Deze achtergrondinformatie is tevens te vinden op de NABON website, pagina Informatiestandaard.
B2.1 Aanleiding ontwikkeling informatiestandaard mammacarcinoom
Dezelfde gegevens voor een patiënt met mammacarcinoom in een ziekenhuis moeten tot wel 40 keer opnieuw ingevoerd worden. Het gevolg: meer risico op fouten en onnodig veel administratie. In juni 2018 startte het NABON (Nationaal Borstkanker Overleg Nederland) daarom met de commissie standaardisatie verslaglegging van het NABON[1] voor het maken van landelijke afspraken over eenheid van taal bij mammacarcinoom.
De commissie heeft als doel de eenheid van taal in de dossiervoering voor mammacarcinoompatiënten in de verschillende zorginformatiesystemen en de (automatische) gegevensuitwisseling tussen zorginformatiesystemen in Nederland verbeteren. De eerste stap hiervoor was het ontwikkelen van de informatiestandaard mammacarcinoom. De informatiestandaard mammacarcinoom is gepubliceerd op het platform ART-DECOR van Nictiz. Aanvullende informatie is te vinden op de NABON-website en op Amigo!.
B.2.2 Huidige implementatie van de informatiestandaard mammacarcinoom
De standaard voor de verslaglegging van het MDO mammacarcinoom en de radiologie is geïmplementeerd in Chipsoft standaard content versie 6.2 en hoger.
B2.3 Beheerproces
Informatiestandaarden veranderen op regelmatige basis. Het vaststellen van de informatiestandaard mammacarcinoom is daarmee geen eenmalige exercitie maar een cyclus, die op geordende wijze afgehandeld wordt. De informatiestandaard wordt beheerd door de multidisciplinaire NABON commissie Standaardisering verslaglegging, bestaande uit gemandateerde zorgverleners van de verschillende Nederlandse ziekenhuizen ondersteund door een secretaris en klinisch informaticus van IKNL.
In de tabel hieronder staat weergegeven uit welke stappen de beheercyclus bestaat:
[1] De richtlijncommissie die de kwaliteitsstandaard mammacarcinoom beheert is tevens onderdeel van het NABON.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-12-2023
Beoordeeld op geldigheid : 01-11-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor de patiënt met (verdenking op) borstkanker of voor hen die voor screening in aanmerking komen. De richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de screening, diagnostiek, behandeling en nazorg van borstkanker. Tevens wordt deze richtlijn gebruikt voor het maken van informatiemateriaal voor patiënten, in samenwerking met kanker.nl en thuisarts.nl. Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van deze richtlijn hebben bijgedragen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met borstkanker.
|
Werkgroeplid |
Namens |
|
dr. M.A.W.M.C. (Marlene) Hoynck van Papendrecht |
BVN |
|
drs. C. (Cristina) Guerrero Paez |
BVN |
|
drs. M.A. (Marjolein) Scholten |
BVN |
|
C.M. (Marco) van Esterik |
Contactgroep Phyllodes |
|
M. (Michelle) Verseveld MSc |
KNGF |
|
prof. dr. G.H. (Truuske) de Bock |
NHG |
|
dr. B.E.P.J. (Birgit) Vriens |
NIV |
|
dr. A. (Agnes) Jager |
NIV |
|
dr. C.H. (Carolien) Smorenburg, voorzitter |
NIV |
|
dr. H. (Hiltje) de Graaf |
NIV |
|
dr. J.R. (Judith) Kroep |
NIV |
|
dr. H.H. (Huub) van Rossum |
NVKC |
|
dr. ir. C. (Christiaan) van Swol |
NVKF |
|
dr. F. (Frederiek) van den Bos |
NVKG |
|
dr. C.D.L. (Carine) Bavelaar-Croon |
NVNG |
|
dr. L.A.E. (Leonie) Woerdeman |
NVPC |
|
prof. dr. M.A.M. (Marc) Mureau |
NVPC |
|
dr. A.N. (Astrid) Scholten |
NVRO |
|
dr. H.J.G.D. (Desiree) van den Bongard |
NVRO |
|
dr. J.H. (John) Maduro |
NVRO |
|
dr. M.J.C. (Maurice) van der Sangen |
NVRO |
|
dr. N. (Nina) Bijker |
NVRO |
|
prof. dr. L.J. (Liesbeth) Boersma |
NVRO |
|
dr. D.J.P. (Dominique) van Uden |
NVvH |
|
dr. E.L. (Emily) Postma |
NVvH |
|
dr. J.H. (José) Volders |
NVvH |
|
dr. L.J.A. (Luc) Strobbe |
NVvH |
|
mr. dr. F.H. (Frederieke) van Duijnhoven |
NVvH |
|
drs. E.M. (Elise) Bekers |
NVVP |
|
dr. A.I.M. (Inge-Marie) Obdeijn |
NVvR |
|
dr. C.E. (Claudette) Loo |
NVvR |
|
dr. M.B.I. (Marc) Lobbes |
NVvR |
|
dr. C. (Carla) Meeuwis |
NVvR |
|
drs. L.M.H. (Lidy) Wijers |
NVvR |
|
drs. M.W. (Mechli) Imhof-Tas |
NVvR |
|
A. (Angelie) van den Bosch |
V&VN |
|
C. (Celine) Zoetbrood |
V&VN |
|
A.M.J. (Antoinette) Holterman |
V&VN oncologie |
|
drs. J.M. (Margriet) Collée |
VKGN |
Met ondersteuning van
Drs. S.N. (Sarah) van Duijn
Dr. L. (Linda) Oostendorp
Drs. M. (Miriam) te Lintel Hekkert
Dr. N. (Nadine) Zielonke
Dr. J. (Joppe) Tra
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
|
Smorenburg (voorzitter) |
* Internist-oncoloog Antoni van Leeuwenhoek (0,9 fte - betaald) |
Lid Bestuur gasthuis Antoni van Leeuwenhoek (onbetaald) |
In 2018 een vergoeding van €1,307,00 ontvangen van Pfizer.
|
|
Guerrero Paez |
Directeur Borstkanker Vereniging Nederland |
Lid Raad van Toezicht SPL te Leiden (onbetaald) |
Als patiëntenorganisatie leveren wij vanuit patïëntenperspectief advies aan. Persoonlijk ben ik alleen betrokken bij het Covid consortium waar we onderzoek doen naar Covid en Borstkanker. Trekker is IKNL (geen rol als projectleider). Verder werken wij met de PAG samen en allerlei vrijwilligers. Wij ontvangen van de farmacie gelden voor specifieke projecten op het gebied van informatievoorziening en/of lotgenotencontact. Deze zijn multisponsored en worden altijd opgenomen in het transparantieregister. |
|
Vriens |
Internist-oncoloog Catherinaziekenhuis Eindhoven |
In 2018 een vergoeding van €870,00 ontvangen van Novartis. |
|
|
Mureau |
Plastisch chirurg, Erasmus MC, Universitair Medisch Centrum Rotterdam |
* Maatschapslid AZR>SFG, werkzaamheden als plastisch chirurg (betaald) |
Polytech Health & Aesthetics GmbH - Long-term results of breast reconstruction with polyurethane covered implants: a multicenter randomized controlled trial - Projectleider |
|
Lobbes |
* Radioloog - Zuyderland Medisch Centrum, afdeling Medische Beeldvorming (0,9 fte) |
Lid wetenschappelijke adviesraad LRCB - Lid wetenschappelijke raad Zuyderland Medisch Centrum |
* GE Healtcare - Rapid Access to Contrast-Enchanced mammography in Recalls form breast cancer screening (RACER) – Projectleider * Boegbeeldfunctie wereldwijd van contrast-enhance mammography (CEM) * Betrokkenen heeft financiële vergoedingen gekregen voor het verzorgen van workshops, presentatie en deelname van medical advisory boards van onder andere GE Healthcare, Hologic, Tromp Medical, Suazio, Bayer |
|
Bosch, van den |
Verpleegkundig specialist mammacarcinoom in het Catherinaziekenhuis te Eindhoven |
Gast-docent HBO-V studenten aan Fontys Hogeschool te Eindhoven (betaald) |
Geen |
|
Bongard, van den |
Radiotherapeut-oncoloog, Amsterdam UMC |
* Lid NABON bestuur (onbetaald) |
* KWF/ Pink Ribbon - Eenmalige hoge dosis radiotherapie mammacarcinooom (ABLATIVE project, 2013 en 2020) - Projectleider; VARIAN grant voor Adaptive Radiotherapy in Breast Cancer patients (BREAST-ART, 2020) - Projectleider. * Lid landelijke werkgroep hypofractionering mammacarcinoom |
|
Van Swol |
* Klinisch Fysicus, St. Antonius Ziekenhuis (0,9 fte) |
Voorzitter Bestuur Stichting Opleiding Klinische Fysica - onbetaald. Zie www.stichtingokf.nl |
Geen |
|
Van Duijnhoven |
Chirurg-oncoloog, Nederlands Kanker Instituut / Antoni van Leeuwenhoek Ziekenhuis |
* European Organization for Research and Treatment of Cancer, secretary of the Breast Cancer Group |
* Innovatiefonds Zorgverzekeraars - Towards omitting breast surgery in patients with a complete response to neoadjuvant chemotherapy - biopten past NAC ter evaluatie respons onderzoek inmiddels afgerond- Geen projectleider, co-PI * KWF - Management of low risk ductal carcinoma in situ (low-risk DCIS): a non-randomized, multicenter, non-inferiority trial between standard therapy approach versus active surveillance - clinical trial ongoing - Geen projectleider, co-PI * KWF - Clinically node negative breast cancer patients undergoing breast conserving therapy: Sentinel lymph node procedure versus follow-up - randomized clinical trial, accural complete January 2022 - Geen projectleider, local PI * EORTC-quality of life group - Follow-up in Early and Locally Advanced Breast Cancer Patients: An EORTC QLG-BCG-ROG Protocol - clinical study in which quality of life data are registered in patients treated for breast cancer < 3 years ago - Geen projectleider, local PI * Als arts ook betrokken bij de patiëntenvereniging voor Phyllodes tumoren van de borst, wat 1 van de geformuleerde knelpunten vanuit onze beroepsvereniging is. |
|
Volders |
Oncologische chirurg |
* Bestuurslid werkgroep Mammachirurgie NVCO - onbetaald |
Geen |
|
Van der Sangen |
Radiotherapeut-oncoloog, afdeling Radiotherapie, Catharina Ziekenhuis Eindhoven |
Bestuurslid BOOG (Borstkanker Onderzoeksgroep Nederland), onbetaald |
NVRO/IKNL - Retrospectief onderzoek naar het gebruik van radiotherapie in Nederland - Geen projectleider |
Clusterexpertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
|
Bavelaar-Croon |
Nucleair Geneeskundige - Ziekenhuis Gelderse Vallei in Ede |
* Voorzitter werkgroep mammacarcinoom NVNG (Nederlandse Vereniging Nucleaire Geneeskunde) |
Geen |
|
Imhof-Tas |
Mammaradioloog en screeningsradioloog Radboud UMC (100%) |
Geen |
Geen |
|
Obdeijn |
Mammaradioloog in het Erasmus MC |
Geen |
* ZonMw - KWF, Sisters Hope, Pink Ribbon Stichting… - MRI versus mammography for breast cancer screening in women with familial risk (FAMRIsc: a multicentre randomised, controlled trial (Lancet Oncology 2019) |
|
Wijers |
Mamma- en neuroradioloog Alrijne Zorggroep (Leiderdorp - Leiden - Alphen) |
* Lid NABON |
In 2020 een vergoeding van €1270,00 ontvangen van Bayer. |
|
Collée |
Klinisch geneticus, Erasmus MC Rotterdam |
Geen |
* KWF - Nationwide infrastructure integrating research and health care to improve management for Dutch women with familial breast cancer risk Infrastructure Initiatives – * KWF Building in the Archipelago of Ovarian Cancer Research - Geen projectleider |
|
Rossum, van |
Laboratorium specialist Klinische Chemie, Afdeling Algemeen Klinisch Laboratorium Antoni van Leeuwenhoek Ziekenhuis Amsterdam |
* Eigenaar en directeur Huvaros B.V. (onbetaald) |
* Health Holland - Subsidie voor vingerprik bloedafname systeem voor Covid-19 serologie - Projectleider
|
|
Bock, de |
Hoogleraar oncologische epidemiologie en interim afdelingshoofd afdeling Epidemiologie van het UMCG (voltijds aanstelling) |
* Lid werkgroep herziening richtlijn familiaire en erfelijke eierstokkanker |
* W.J. Thijnstichting - STIC, het begin of het einde - Projectleider samen met gynaecoloog
|
|
Bos, van den |
Internist-ouderengeneeskunde LUMC |
Voorzitter kerngroep ouderen NIV (onbetaald) |
SKMS - Keuzehulpen nij patiënten met multimorbiditeit - Projectleider
|
|
Verseveld |
* Bestuurslid Nederlandse Vereniging voor fysiotherapie bij Lymfologie en Oncologie, portefeuilehouder Wetenschap Oedeem en Oncologie: 8 uur per week |
* NVFL: vrijwillige functie |
Geen |
|
Loo |
Radioloog, gespecialiseerd mammaradiologie & screening BVO (regio midden west). NKI-AVL (Nederlands Kanker Instituut, Antoni van Leeuwenhoek) en BVO midden west |
* Wetenschappelijke cie NBCA (deels betaals/vacatie) |
In 2019 een vergoeding van €1749,00 ontvangen van Bayer. |
|
Meeuwis |
Mammaradioloog Ziekenhuis Rijnstate |
* NABON - werkgroep standaardisatie verslaglegging (onbetaald) |
* SENO medical - Echografie gecombineerd met laserlicht voor de diagnostiek bij verdachte massa's in de borst - Projectleider
|
|
Louwe |
Gynaecoloog, 0,9 aanstelling Leids Universitair Medisch Centrum |
Geen |
Geen |
|
Graaf, de |
Internist-oncoloog MCL |
Lid commissie kwaliteit NVMO. Medisch manager Oncologisch Netwerk Friesland (ONF) Coach Coassistenten Lid raad van toezicht zorg en welzijn |
Geen |
|
Jager |
Internist-oncoloog Erasmus MC Kanker Instituut Rotterdam |
* Voorzitter Stichting BOOG (Borstkanker onderzoeksgroep) - onbezoldigd |
* KWF - Prediction of Breast Cancer chemotherapy response in patients by determination of chemosensitivity in tumor tissue ex vivo - Projectleider In 2019 een vergoeding van €980,00 ontvangen van Roche Pharma. |
|
Strobbe |
Borstkankerchirurg CWZ Nijmegen fulltime staflid |
Geen |
Geen |
|
Maduro |
Radiotherapeut oncoloog, Universitaire Medische Centrum Groningen en Prinses Maxima Centrum voor kinderoncologie |
Bestuur BOOG, onbetaald |
EU - HARMONIC, gevolgen straling bij kinderen - Geen projectleider
|
|
Boersma |
Radiotherapeut-oncoloog Maastro, Maastricht |
* Klinische werkzaamheden en wetenschappelijke werkzaamheden * Voorzitter van Landelijk Platform Protonentherapie en lid van commissie kwaliteit NVRO |
ZonMw - MOVE project: verbeteren zorgpaden protonentherapie; SKMS project: INNOVATE: verbeteren implementatie van innovaties. KWF: Descartes studie: de-escalatie van bestraling bij patiënten met pCR na Neoadjuvante chemotherapie
|
|
Scholten |
Radiotherapeut-oncoloog, NKI-AVL |
- |
KWF - PPAPBI-2 trial - Projectleider
|
|
Postma |
Oncologisch chirurg Antonius Ziekenhuis Nieuwegein |
Geen |
Geen |
|
Uden |
Fellow chirurgische oncologie: per 17-1-2022 te Gelre Ziekenhuizen (hiervoor fellow chirurgische oncologie in het Rijnstate Ziekenhuis) |
Niet van toepassing |
Onbetaald en ongefinancierd promotie onderzoek naar inflammatoir mammacarcinoom: nu geen aandachtspunt voor de revisie. |
|
Bijker |
Radiotherapeut-oncoloog Amsterdam UMC |
* Kartrekker lateralisatie mammazorg AmsterdamUMC, onbetaald |
* KWF 12900 - Reduction of organ motion during radiotherapy by non-invasive mechanical ventilation supported berating control - Geen projectleider
|
|
Kroep |
Internist-Oncoloog, LUMC |
Betaald adviseurschap: AstraZeneca, GSK, Eisai, Lilly, MSD, Novartis |
* AstraZeneca - FAB, DOMEC en MMRd-GREEN studie; behandeling ovariumca (FAB) en endometrium carcinoom (DOMEC en MMRd-GREEN) drugs (olaparib, durvalumab) en onregstricted grant - Projectleider * Novartis - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. ribociclib en unregstricted grant - Projectleider * Philips - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. unrestricted grant - Projectleider |
|
Woerdeman |
Plastisch chirurg Antoni van Leeuwenhoek Amsterdam |
* Hoofd afdeling plastische chirurgie Antoni van Leeuwenhoek |
Dutch Cancer Society, Grand/Award Number: - Ontwikkeling borst reconstructie keuzehulp - Projectleider
|
|
Esterik, van |
Tot 2014 zelfstandige als Invalbakker |
* Brood en Banker Bakker |
Geen |
|
Scholten, M |
* Belangenbehartiger bij BVN (Borstkankervereniging), 50% |
* Zitting in Medische Advies Raad Parkinsonvereniging (vrijwillig) |
Geen |
|
Hoynck van Papendrecht |
Vrijwilligster BVN |
* Gepensioneerd arts |
Geen |
|
Bekers |
Patholoog, Antoni van Leeuwenhoek Ziekenhuis |
Geen |
Geen |
|
Zoetbrood |
|
|
|
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep schriftelijk de knelpunten in de zorg voor patiënten met borstkanker. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model met behulp van Review Manager 5.4. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.