Immuuntherapie gemetastaseerde setting
Uitgangsvraag
Wat is de plaats van checkpointremmers bij gemetastaseerd triple-negatief mammacarcinoom in de eerste lijn?
Aanbeveling
Overweeg bij behandeling van patiënten met een gemetastaseerd triple negatief
mammacarcinoom en een PD-L1-expressie met een CPS van 10 of hoger behandeling met pembrolizumab1 gecombineerd met chemotherapie (nab-paclitaxel; paclitaxel of gemcitabine gecombineerd met carboplatin) in de eerste lijn, indien het tijdsinterval tussen operatie van het mammacarcinoom of beëindigen systeemtherapie en optreden van recidief > 6 maanden was.
1 er is nog geen besluit genomen of pembrolizumab vergoed wordt vanuit het basispakket.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de systematische review van Villacampa (2022) worden drie gerandomiseerde studies besproken die het toevoegen van checkpointremmers aan chemotherapie bij patiënten met een gemetastaseerd triple-negatief mammacarcinoom onderzoeken. Van sommige geïncludeerde studies zijn vervolgpublicaties beschikbaar, waaronder de landmark studie (KEYNOTE-355) van Cortes (2022).
Voor de cruciale uitkomstmaten progressievrije overleving en totale overleving werden in de gehele populatie geen klinisch relevante verschillen gevonden voor het effect van checkpointremmers in combinatie met chemotherapie in vergelijking met chemotherapie alleen. Wel werd er een klinisch relevant verschil voor toxiciteit gerapporteerd (ongewenste voorvallen grade 3 of hoger). Voor kwaliteit van leven waren de verschillen niet klinisch relevant. De bewijskracht voor alle uitkomstmaten was laag of zeer laag, met name vanwege beperkingen in studieopzet van de systematische review (beperkte search) en indirectheid (ook PD-L1 negatieve patiënten geïncludeerd).
Villacampa (2022) rapporteerde progressievrije overleving en totale overleving ook voor de PD-L1 positieve subgroep. Het verschil voor het effect van checkpointremmers in combinatie met chemotherapie op progressievrije totale overleving in vergelijking met chemotherapie alleen was klinisch relevant. Voor totale overleving was dit verschil niet klinisch relevant. Voor de andere uitkomsten was geen subgroep analyse beschikbaar.
De PD-L1 status werd met verschillende technieken vastgesteld in de geïncludeerde studies.
IMpassion131 studie laat zien dat atezolizumab toegevoegd aan paclitaxel geen verbetering geeft in progressievrije en totale overleving.
De IMpassion130 studie, waarin het effect van atezolizumab toegevoegd aan nab-paclitaxel wordt beoordeeld, voldoet niet aan de PASKWIL criteria voor een positief advies van de commissie Beoordeling Oncologische middelen.
De KEYNOTE-355-studie voldoet aan de PASKWIL criteria voor een positief advies van de commissie Beoordeling Oncologische middelen. Bij patiënten met een lokaal irresectabel gerecidiveerd of gemetastaseerd tripelnegatief mammacarcinoom en een PD-L1-expressie met een CPS van 10 of hoger geeft behandeling met pembrolizumab aan behandeling met chemotherapie (nab-paclitaxel; paclitaxel of gemcitabine gecombineerd met carboplatin) in vergelijking met placebo-chemotherapie een statistisch significante verlenging van de OS (HR: 0,73 [95%-BI: 0,55-0,95]; P = 0,0093). De mediane totale overleving neemt toe van 16,1 naar 23,0 maanden. Eerdere (neo)adjuvante behandeling met chemotherapie of radiotherapie met curatieve intentie was toegestaan met een interval van minimaal 6 maanden; patiënten die een taxaan, gemcitabine of platinabevattende neoadjuvante of adjuvante behandeling hadden ondergaan, mochten hetzelfde middel krijgen indien het interval 12 maanden of langer was.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Patiënten hechten waarden aan overleving afgezet tegen het effect van de behandeling op de kwaliteit van het leven.
Het toevoegen van pembrolizumab geeft een statisch significante verlenging van de progressie vrije overleving en de totale overleving. De immuun gemedieerde toxiciteit komt wel vaker voor bij patiënten behandeld met pembrolizumab.
De meeste immuungerelateerde bijwerkingen zijn reversibel en goed onder controle te krijgen door onderbreken van de behandeling, toediening van corticosteroïden en/of ondersteunende zorg. Aangezien pembrolizumab gerelateerde bijwerkingen ernstig en permanent kunnen zijn, is zorgvuldige screening op en behandeling van veelvoorkomende toxiciteiten vereist.
Immuungerelateerde bijwerkingen kunnen ook nog ná de behandeling met pembrolizumab ontstaan. Er werd geen relevant verschil in kwaliteit van leven gerapporteerd.
De voor- en nadelen van de verschillende behandelopties dienen met de patiënt besproken te worden via de vier stappen van samen beslissen en met behulp van een time out.
Kosten (middelenbeslag)
Het rapport van de commissie BOM berekende de kosten per cyclus op € 5.721 (3 weken voor pembrolizumab) en een totaalbedrag van € 45.768 (bij een mediane behandelduur van 8 cycli pembrolizumab).
De beroepsvereniging NVMO stelt dat bij een positief advies van de commissie BOM er een indicatie is voor het gebruik en dat de effecten de extra middelen waard zijn.
Er is echter nog geen besluit genomen over vergoeding van pembrolizumab vanuit het basispakket.
Aanvaardbaarheid, haalbaarheid en implementatie
In de KEYNOTE-355-studie werd pembrolizumab 200 mg elke drie weken gegeven. Overwogen kan worden om pembrolizumab in een schema van 400 mg elke zes weken toe te dienen, analoog aan de huidige behandeling met pembrolizumab bij onder andere melanoom en niet-kleincellig longcarcinoom (zie ook Farmacotherapeutisch Kompas).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
In de KEYNOTE-355-studie bij patiënten met een lokaal irresectabel gerecidiveerd of gemetastaseerd tripelnegatief mammacarcinoom en een PD-L1-expressie met een CPS van 10 of hoger geeft behandeling met pembrolizumab-chemotherapie in vergelijking met placebo-chemotherapie een statistisch significante verlenging van de OS (HR: 0,73 [95%-BI: 0,55-0,95]; P = 0,0093). De mediane OS nam toe van 16,1 naar 23,0 maanden. Immuungerelateerde bijwerkingen kwamen vaker voor in de pembrolizumab-groep maar waren in het algemeen hanteerbaar. De resultaten van dit eindpunt voldoen aan de PASKWIL-criteria voor een positief advies.
Onderbouwing
Achtergrond
De standaardbehandeling van patiënten met gemetastaseerd triple-negatief mammacarcinoom bestaat uit chemotherapie.
Onderstaand wordt de meerwaarde van checkpointremmers gecombineerd met chemotherapie in de eerste lijn onderzocht bij patiënten met een gemetastaseerd triple negatief mammacarcinoom en PD-L1-expressie met een Combined Positive Score (CPS) van 10 of hoger.
Er zijn meerdere checkpointremmers onderzocht voor de behandeling van gemetastaseerd triple negatief mammacarcinoom. IMpassion131 studie laat zien dat atezolizumab toegevoegd aan paclitaxel geen verbetering geeft in progressievrije en totale overleving (Miles, 2021).
De IMpassion130 studie (Schmid, 2018), waarin het effect van atezolizumab gecombineerd met nab-paclitaxel beoordeeld wordt, voldoet niet aan de PASKWIL criteria voor een positief advies van de commissie Beoordeling Oncologische middelen (cie-BOM).
Recent is voor pembrolizumab een positief advies afgegeven door de cie-BOM (NVMO-commissie BOM, 2022). Pembrolizumab is een monoklonaal antilichaam gericht tegen de immune checkpoint programmed death-1 receptor (PD-1-receptor). Pembrolizumab werd gecombineerd met standaard chemotherapie in de eerste lijn bij patiënten met een gemetastaseerd triple-negatief mammacarcinoom en een CPS-score >= 10 (KEYNOTE-355-studie, Cortes 2022).
Conclusies / Summary of Findings
Progression-free survival
|
Low GRADE |
The evidence suggests that checkpoint inhibitor therapy in combination with chemotherapy results in little to no difference in progression-free survival when compared with chemotherapy alone in patients with metastatic triple-negative breast cancer.
For the PD-L1 positive population (CPS≥10), the evidence suggests that checkpoint inhibitor therapy in combination with chemotherapy increases progression-free survival when compared with chemotherapy alone.
Source: Cortes, 2022; Miles, 2021; Schmid, 2020 |
Overall survival
|
Low GRADE |
The evidence suggests that checkpoint inhibitor therapy in combination with chemotherapy results in little to no difference in overall survival when compared with chemotherapy alone in patients with metastatic triple-negative breast cancer.
The same conclusion applies to the PD-L1 positive population (CPS≥10).
Source: Cortes, 2022; Miles, 2021; Schmid, 2020 |
Toxicity
|
Low GRADE |
The evidence suggests that checkpoint inhibitor therapy in combination with chemotherapy increases toxicity when compared with chemotherapy alone in patients with metastatic triple-negative breast cancer.
No conclusion could be drawn on the PD-L1 positive population (CPS≥10).
Source: Cortes, 2020; Miles, 2021; Schmid, 2018 |
Quality of life
|
Very low GRADE |
The evidence is very uncertain about the effect of checkpoint inhibitor therapy in combination with chemotherapy on quality of life when compared with chemotherapy alone in patients with metastatic triple-negative breast cancer.
No conclusion could be drawn on the PD-L1 positive population (CPS≥10).
Source: Adams, 2020; Miles, 2021 |
Samenvatting literatuur
Description of studies
Villacampa (2022) conducted a systematic review and meta-analysis to compare the combination of anti-PD1/PD-L1 immune checkpoint inhibitors (ICI) plus chemotherapy (CT) versus CT alone in untreated triple negative breast cancer (TNBC) patients. One database (PubMed) was searched up to July 2021. Randomized controlled trials comparing the combination of ICI plus CT to CT alone in previously untreated metastatic TNBC patients were included. Three RCTs (Cortes, 2020; Miles, 2021; Schmid, 2018) with a total of 2400 patients were included, of whom 1448 (60%) received ICI plus CT and 952 (40%) CT alone. ICI treatment consisted of atezolizumab or pembrolizumab and CT treatment consisted of nab-paclitaxel, paclitaxel or gemcitabine-carboplatin. The PD-L1 positive subset of patients ranged from 38.1% to 44.9% in the three study populations. The systematic review assessed the outcomes progression-free survival, overall survival, objective response rate and adverse events.
Results of subgroup analyses for PD-L1 expression were reported, split by age, CT regimen, ECOG performance status, previous neoadjuvant or adjuvant CT and number of metastatic sites. It should be noted that the PD-L1 assessment technique was not homogenous across the included trials and was not always characterized by the CPS.
Reporting of adverse events was heterogenous across the included trials. The systematic review only included adverse events which were reported in all the included trials.
Cortes (2022) reported the final analysis of overall survival in the KEYNOTE-355 trial (Cortes, 2020).
Schmid (2020) reported the second interim analysis of overall survival in the IMpassion130 trial (Schmid, 2018). Emens (2021) reported the final analysis of overall survival in the IMpassion130 trial and reported safety outcomes. Adams (2020) reported patient-reported outcome data from the IMpassion130 trial. Physical function, role function and health-related quality of life were assessed (QLQ-C30 and QLQ-BR23).
To the best of our knowledge, no follow-up results of the IMpassion131 study (Miles, 2021) were published.
Results
Progression-free survival (crucial)
Villacampa (2022) defined progression-free survival (PFS) as the time from the date of randomization to the date of first documentation of disease progression according to RECIST 1.1 or death due to any cause.
Three studies reported PFS (figure 1). The pooled hazard ratio (HR) was 0.82 (95% CI: 0.75 to 0.90) with an I2 of 0% in favor of ICI with CT. This was not considered clinically relevant.
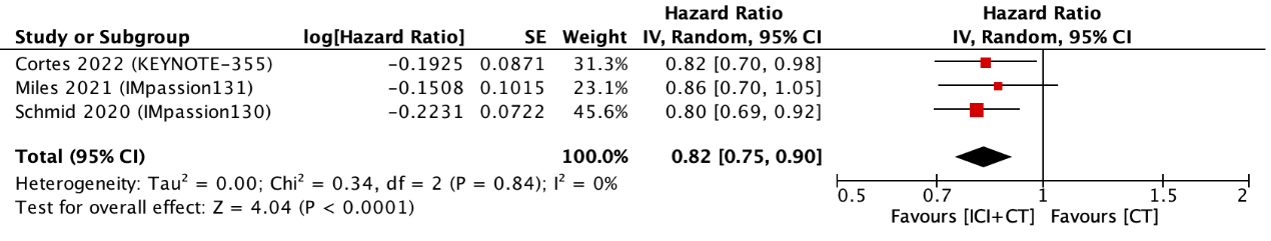
Figure 1. Outcome progression-free survival with immune checkpoint inhibitors with chemotherapy versus chemotherapy alone
In the PD-L1-positive population, the pooled HR was 0.67 (95% CI: 0.58 to 0.79) with an I2 of 4% (Villacampa, 2022). This was considered clinically relevant.
Overall survival (crucial)
Villacampa (2022) defined overall survival (OS) as time from randomization to death due to any cause.
Three studies reported OS (figure 2). The pooled HR was 0.93 (95% CI: 0.81 to 1.07) with an I2 of 39% in favor of ICI with CT. This was not considered clinically relevant.
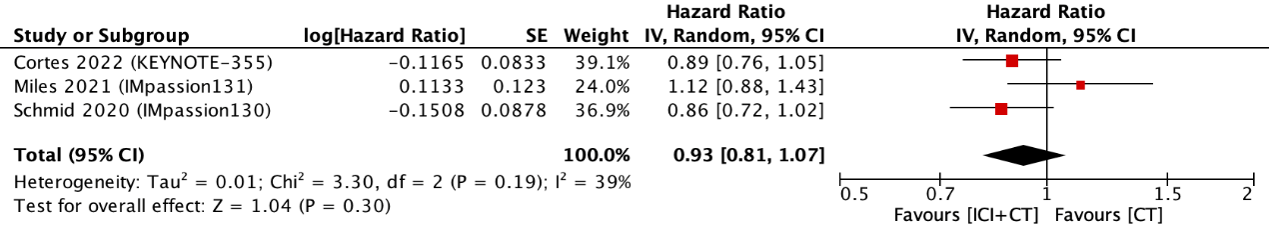
Figure 2. Outcome overall survival with immune checkpoint inhibitors with chemotherapy versus chemotherapy alone
In the PD-L1-positive population, the pooled HR was 0.79 (95% CI: 0.60 to 1.03) with an I2 of 60% (Villacampa, 2022). This was not considered clinically relevant.
Toxicity (important)
Three studies reported adverse events (AEs) of grade 3 or higher (figure 3). The pooled odds ratio (OR) was 1.33 (95% CI: 1.12 to 1.59) with an I2 of 0% in favor of CT alone. This was considered clinically relevant. Hypothyroidism and hyperthyroidism were the most frequent immune-related AEs of any grade in the ICI with CT group. The most frequent immune-related AEs of grade 3 or higher were not specified in the systematic review.
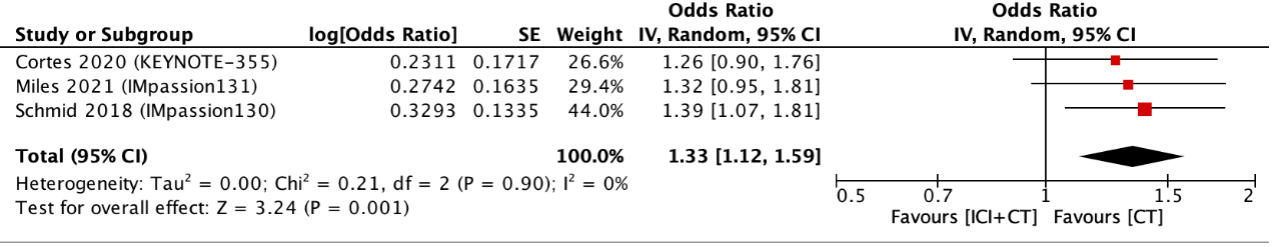
Figure 3. Outcome grade ≥3 adverse events with immune checkpoint inhibitors with chemotherapy versus chemotherapy alone
Cortes (2022) (KEYNOTE-355) reported adverse events of grade ≥3 in 77.9% of the ICI plus CT group and in 73.3% of the CT group. AEs grade ≥3 that were attributed to the trial regimen occurred in 68.1% and 66.9% of the patients, respectively. Immune-mediated AEs grade ≥3 occurred in 5.3% and 6.4% of the patients, respectively. These differences were considered not clinically relevant.
Miles (2021) (IMpassion131) reported adverse events of grade ≥3 in 55% of the ICI plus CT group and in 48% of the CT group. This difference was considered not clinically relevant.
Emens (2021) (IMpassion 130) reported adverse events of grade ≥3 in 52% of the ICI plus CT group and in 43.3% of the CT group. Treatment-related AEs grade ≥3 occurred in 41.9% and 30.2% of the patients, respectively. These differences were considered not clinically relevant.
Results on the PD-L1 population were not reported for this outcome.
Quality of life (important)
Two studies reported quality of life.
Miles (2021) (IMpassion131) reported global health status (GHS)/health-related quality of life (HRQoL) and physical, role, and cognitive functioning (EORTC QLQ-C30). The HR for time to deterioration (TTD) in GHS/HRQoL was 0.97 (95% CI: 0.73 to 1.30) in favor of the ICI plus CT group. The HR for TTD in physical functioning was 1.11 (95% CI: 0.84 to 1.48) in favor of the CT group. The HR for TTD in role functioning was 1.05 (95% CI: 0.80 to 1.38) in favor of the CT group. The HR for TTD in cognitive functioning was 1.04 (95% CI: 0.78 to 1.38) in favor of the CT group. These differences were considered not clinically relevant.
Adams (2020) (IMpassion130) reported GHS/HRQoL and physical, role, and cognitive functioning (EORTC QLQ-C30 and QLQ-BR23). The HR for time to deterioration (TTD) in GHS/HRQoL was 0.97 (95% CI: 0.80 to 1.18) in favor of the ICI plus CT group. The HR for TTD in physical functioning was 1.04 (95% CI: 0.86 to 1.26) in favor of the CT group. The HR for TTD in role functioning was 1.01 (95% CI: 0.83 to 1.22) in favor of the CT group. The HR for TTD in cognitive functioning was 0.93 (95% CI: 0.76 to 1.14) in favor of the ICI plus CT group. These differences were considered not clinically relevant.
Results on the PD-L1 population were not reported for this outcome.
The quality of life analysis of the KEYNOTE-355 study were not published yet. The results are available in an abstract (Cescon, 2022). As the results were not presented in an appropriate format, the study was not included in this literature analysis. However, the authors concluded that addition of ICI to CT did not result in a decreased HRQoL.
Level of evidence of the literature
The evidence was derived from a systematic review of RCTs. Therefore, the level of evidence starts at high GRADE.
Progression-free survival
The level of evidence regarding the outcome measure progression-free survival was downgraded by two levels because of study limitations (-1; risk of bias systematic review, mainly because of limitations in search strategy); and applicability (-1; bias due to indirectness regarding the population). Therefore, the evidence was graded as low.
Progression-free survival (PD-L1 positive subpopulation)
The level of evidence regarding the outcome measure progression-free survival was downgraded by two levels because of study limitations (-1; risk of bias systematic review, mainly because of limitations in search strategy); and number of included patients (-1; imprecision because the confidence interval includes the possibility of no effect or a favourable effect). Therefore, the evidence was graded as low.
Overall survival
The level of evidence regarding the outcome measure overall survival was downgraded by two levels because of study limitations (-1; risk of bias systematic review, mainly because of limitations in search strategy); and applicability (-1; bias due to indirectness regarding the population). Therefore, the evidence was graded as low.
Overall survival (PD-L1 positive subpopulation)
The level of evidence regarding the outcome measure overall survival was downgraded by two levels because of study limitations (-1; risk of bias systematic review, mainly because of limitations in search strategy); and number of included patients (-1; imprecision because of small number of events). Therefore, the evidence was graded as low.
Toxicity
The level of evidence regarding the outcome measure toxicity was downgraded by two levels because of study limitations (-1; risk of bias systematic review, mainly because of limitations in search strategy); and applicability (-1; bias due to indirectness regarding the population). Therefore, the evidence was graded as low.
Quality of life
The level of evidence regarding the outcome measure quality of life was downgraded by four levels because of study limitations (-1; risk of bias systematic review, mainly because of limitations in search strategy); conflicting results (-1; inconsistency); applicability (-1; bias due to indirectness regarding the population) and number of included patients (-1; imprecision because of small number of events). Therefore, the evidence was graded as very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of checkpoint inhibitor therapy in combination with chemotherapy when compared with chemotherapy alone on progression-free survival, overall survival, toxicity, and quality of life in patients with metastatic triple-negative breast cancer with a PD-L1 combined positive score (CPS) of 10 or higher?
P: Patients with metastatic triple-negative breast cancer with a PD-L1 combined positive score (CPS) of 10 or higher
I: Checkpoint inhibitor therapy in combination with chemotherapy
C: Chemotherapy alone
O: Progression-free survival, overall survival, toxicity, quality of life
Relevant outcome measures
The guideline development group considered progression-free survival and overall survival as critical outcome measures for decision making; and toxicity and quality of life as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The guideline development group defined the following differences as a minimal clinically (patient) important difference:
- Progression-free survival: >12 weeks or Hazard Ratio (HR)<0.7
- Overall survival: >12 weeks or HR<0.7
- Toxicity: lethal complications ³5% or serious complications ³25%
- Quality of life: ³10 points on the EORTC QLQ-C30 or a difference of a similar magnitude on other validated quality of life instruments or HR<0.7
Search and select (Methods)
The search was developed for both the metastasized setting (this module) and the module immunotherapy in the neoadjuvant setting. The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2010 until 03-08-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 1079 hits. Studies were selected based on the following criteria:
- Systematic reviews or randomized controlled trials;
- full-text English language publication;
- complying with the PICO criteria.
The guideline development group screened the 322 systematic reviews. Twenty-three studies were initially selected based on title and abstract screening. After reading the full text, twenty-two studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included. Additionally, results of follow-up studies of primary RCTs included in the systematic review were analyzed.
Results
One systematic review (Villacampa, 2022) was included in the analysis of the literature. This systematic review included three RCTs. Data from four follow-up studies or analyses of the primary RCTs included in the systematic review were added, among which the landmark paper of Cortes (2022). Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- 1 - Adams S, Diéras V, Barrios CH, Winer EP, Schneeweiss A, Iwata H, Loi S, Patel S, Henschel V, Chui SY, Rugo HS, Emens LA, Schmid P. Patient-reported outcomes from the phase III IMpassion130 trial of atezolizumab plus nab-paclitaxel in metastatic triple-negative breast cancer. Ann Oncol. 2020 May;31(5):582-589. doi: 10.1016/j.annonc.2020.02.003. Epub 2020 Feb 20. PMID: 32178964.
- 2 - Cescon, D. W., Schmid, P., Rugo, H. S., Im, S. A., Yusof, M. M., Gallardo, C. E., ... & Cortés, J. (2022). 164O Health-related quality of life (HRQoL) with pembrolizumab (pembro)+ chemotherapy (chemo) vs placebo (pbo)+ chemo as 1L treatment for advanced triple-negative breast cancer (TNBC): Results from KEYNOTE-355. Annals of Oncology, 33, S197-S198.
- 3 - Cortes J, Cescon DW, Rugo HS, Nowecki Z, Im SA, Yusof MM, Gallardo C, Lipatov O, Barrios CH, Holgado E, Iwata H, Masuda N, Otero MT, Gokmen E, Loi S, Guo Z, Zhao J, Aktan G, Karantza V, Schmid P; KEYNOTE-355 Investigators. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet. 2020 Dec 5;396(10265):1817-1828. doi: 10.1016/S0140-6736(20)32531-9. PMID: 33278935.
- 4 - Cortes J, Rugo HS, Cescon DW, Im SA, Yusof MM, Gallardo C, Lipatov O, Barrios CH, Perez-Garcia J, Iwata H, Masuda N, Torregroza Otero M, Gokmen E, Loi S, Guo Z, Zhou X, Karantza V, Pan W, Schmid P; KEYNOTE-355 Investigators. Pembrolizumab plus Chemotherapy in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2022 Jul 21;387(3):217-226. doi: 10.1056/NEJMoa2202809. PMID: 35857659.
- 5 - Emens LA, Adams S, Barrios CH, Diéras V, Iwata H, Loi S, Rugo HS, Schneeweiss A, Winer EP, Patel S, Henschel V, Swat A, Kaul M, Molinero L, Patel S, Chui SY, Schmid P. First-line atezolizumab plus nab-paclitaxel for unresectable, locally advanced, or metastatic triple-negative breast cancer: IMpassion130 final overall survival analysis. Ann Oncol. 2021 Aug;32(8):983-993. doi: 10.1016/j.annonc.2021.05.355. Epub 2021 Jul 1. Erratum in: Ann Oncol. 2021 Aug 2;: Erratum in: Ann Oncol. 2021 Dec;32(12):1650. PMID: 34272041.
- 6 - Miles D, Gligorov J, André F, Cameron D, Schneeweiss A, Barrios C, Xu B, Wardley A, Kaen D, Andrade L, Semiglazov V, Reinisch M, Patel S, Patre M, Morales L, Patel SL, Kaul M, Barata T, O'Shaughnessy J; IMpassion131 investigators. Primary results from IMpassion131, a double-blind, placebo-controlled, randomised phase III trial of first-line paclitaxel with or without atezolizumab for unresectable locally advanced/metastatic triple-negative breast cancer. Ann Oncol. 2021 Aug;32(8):994-1004. doi: 10.1016/j.annonc.2021.05.801. Epub 2021 Jul 1. PMID: 34219000.
- 7 - NVMO-commissie BOM. Pembrolizumab en chemotherapie als eerstelijnsbehandeling bij het lokaal irresectabel gerecidiveerd of gemetastaseerd tripelnegatief mammacarcinoom. Med Oncol 2022; Epub 2022 Aug 26.
- 8 - Schmid P, Adams S, Rugo HS, Schneeweiss A, Barrios CH, Iwata H, Diéras V, Hegg R, Im SA, Shaw Wright G, Henschel V, Molinero L, Chui SY, Funke R, Husain A, Winer EP, Loi S, Emens LA; IMpassion130 Trial Investigators. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2018 Nov 29;379(22):2108-2121. doi: 10.1056/NEJMoa1809615. Epub 2018 Oct 20. PMID: 30345906.
- 9 - Schmid P, Rugo HS, Adams S, Schneeweiss A, Barrios CH, Iwata H, Diéras V, Henschel V, Molinero L, Chui SY, Maiya V, Husain A, Winer EP, Loi S, Emens LA; IMpassion130 Investigators. Atezolizumab plus nab-paclitaxel as first-line treatment for unresectable, locally advanced or metastatic triple-negative breast cancer (IMpassion130): updated efficacy results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2020 Jan;21(1):44-59. doi: 10.1016/S1470-2045(19)30689-8. Epub 2019 Nov 27. PMID: 31786121.
- 10 - Villacampa G, Tolosa P, Salvador F, Sánchez-Bayona R, Villanueva L, Dienstmann R, Ciruelos E, Pascual T. Addition of immune checkpoint inhibitors to chemotherapy versus chemotherapy alone in first-line metastatic triple-negative breast cancer: A systematic review and meta-analysis. Cancer Treat Rev. 2022 Mar;104:102352. doi: 10.1016/j.ctrv.2022.102352. Epub 2022 Feb 2. PMID: 35144055.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What is the effect of checkpoint inhibitor therapy in combination with chemotherapy when compared with chemotherapy alone on progression-free survival, overall survival, toxicity and quality of life in patients with metastatic triple-negative breast cancer with a PD-L1 combined positive score (CPS) of 10 or higher?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Villacampa, 2022
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to July 2021
A: IMpassion130, Schmid (2018) B: KEYNOTE-355, Cortes (2020) C: IMpassion131, Miles (2021)
Study design: RCT
Setting and Country: A: International, multicentera B: International, multicentera C: International, multicentera Source of funding and conflicts of interest: Source of funding was not reported in SR. The authors have not performed any trials in the subject and thus, declare no conflict of interest in the selection of the studies to be included. |
Inclusion criteria SR: of ICI plus CT in comparison with CT alone - in previously untreated metastatic TNBC patients - with available information on survival efficacy outcomes with hazard ratio (HR) and confidence intervals (CI)
Exclusion criteria SR: trials - trials that did not use CT as a control arm - trials that did not use an anti-PD1/PD-L1 treatments in the experiment arm - ongoing studies with unpublished results at the time of the literature search
Three studies included
Important patient characteristics at baseline:
Number of patients A: 902 B: 847 C: 651
Age >65 years A: 24.3% B: 21.3% C: NR (median 54)
ECOG 0 A: 58.3% B: 59.6% C: 60.2%
Metastatic sites A: 25.1% B: 43.1% C: 23.5%
Liver metastases A: 27.1% B: 29.4% C: 27.5%
Prior chemotherapy A: 51.1% (taxane) B: 63.5% C: 48.4% (taxane)
Type of tumor Tumor expressing PD-L1: A: N=369 (40.9%) B: N=323 (38.1%) C: N=292 (44.9%)
No evaluation possible whether groups are comparable at baseline |
Describe intervention: Immune checkpoint inhibitors (ICI) + chemotherapy (CT)
A: Atezolizumab + Nab-paclitaxel B: Pembrolizumab + Chemotherapy (nab-paclitaxel; paclitaxel; or gemcitabine plus carboplatin) C: Atezolizumab + Paclitaxel
|
Describe control: Chemotherapy (CT)
A: Placebo + Nab-paclitaxel B: Placebo + Chemotherapy (nab-paclitaxel; paclitaxel; or gemcitabine plus carboplatin) C: Placebo + Paclitaxel
|
End-point of follow-up:
A: 18.8 months median follow-up (IQR 8.9-34.7)b B: 44.1 months median follow-up (IQR 36.1-53.2)d C: PFS: 8.8 months median (I), 8.5 months (C)a OS: 14.2 months median (I), 14.5 months median (C)a
For how many participants were no complete outcome data available? A: I: 16 patients, 3.6% C: 20 patients, 4.5%a B: NR C: NR
|
Progression-free survival
Effect measure: HR [95% CI]: A: 0.80 [0.69-0.92]b B: 0.82 [0.70-0.98]d C: 0.86 [0.70-1.05]
Pooled effect (random effects model): 0.82 [95% CI 0.75 to 0.90] favoring ICI + CT Heterogeneity (I2): 0%
PD-L1-positive population Effect measure: HR [95% CI]: A: 0.62 [0.49-0.78] B: 0.65 [0.49-0.86] C: 0.82 [0.60-1.12]
Pooled effect (random effects model): 0.67 [95% CI 0.58 to 0.79] favoring ICI + CT Heterogeneity (I2): 4%
Overall survival
Effect measure: HR [95% CI]: A: 0.86 [0.72-1.02]b B: 0.89 [0.76-1.05]d C: 1.12 [0.88-1.43]
Pooled effect (random effects model): 0.93 [95% CI 0.81 to 1.07] favoring ICI + CT Heterogeneity (I2): 39%
PD-L1-positive population Effect measure: HR [95% CI]: A: 0.67 [0.53-0.86] B: 0.73 [0.55-0.95] C: 1.11 [0.76-1.64]
Pooled effect (random effects model): 0.79 [95% CI 0.60 to 1.03] favoring ICI + CT Heterogeneity (I2): 60%
Toxicity Defined as grade ≥3 adverse events
Effect measure: OR [95% CI]: A: 1.39 [1.07-1.81] B: 1.26 [0.90-1.76] C: 1.32 [0.95-1.81]
Pooled effect (random effects model): 1.33 [95% CI 1.12 to 1.59] with a higher odds for ICI+CT Heterogeneity (I2): 0%
Quality of life According to QLQ-C30 and QLQ-BR23 questionnaire
Mean score [95% CI]: A: Time to deterioration (TTD) in GHS/HRQoL HR: 0.97 [0.80-1.18]c Functioning: Physical: 1.04 [0.86-1.26]c Role: 1.01 [0.83-1.22]c Cognitive: 0.93 [0.76-1.14]c
B: NR
C: Time to deterioration (TTD) in GHS/HRQoL HR: 0.97 [0.73-1.30]
Functioning: Physical: 1.11 [0.84–1.48] Role: 1.05 [0.80–1.38] Cognitive: 1.04 [0.78–1.38]
|
Author’s conclusion: ICI plus CT improves PFS and OS in PD-L1-positive population. A greater benefit in CT naïve patients was observed for the PD-L1-positive population while no difference was observed between taxane regimes used. PD-L1 testing assays were different across trials.
|
|
NR: Not reported; a Data extracted from individual studies; b Data extracted from IMpassion130 trial, Schmid (2020)/Emens (2021); c Data extracted from IMpassion130 trial, Adams (2020); d Data extracted from follow-up of KEYNOTE-355 trial, Cortes (2022). |
|||||||
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Villacampa, 2022 |
Yes;
Reason: the PICO elements are incorporated in the inclusion criteria. |
No;
Reason: search period, search strategy and the searched database were described. However, only Medline was searched (not EMBASE). |
No;
Reason: potentially relevant studies that were excluded at final selection were not referenced and did not have an individual reason of exclusion. |
Yes;
Reason: main characteristics of individual studies were reported. |
Not applicable. |
Yes;
Reason: risks of bias were graphically summarized. |
Yes;
Reason: the studies show enough similarities to allow pooling. |
Yes;
Reason: publication bias was assessed by a funnel plot and Egger’s test. No evidence for publication bias was found. In addition, this review included only three RCTs and therefore, it is difficult to assess publication bias. |
No;
Reason: sources of support and conflicts of interest were reported in the included studies (except for one included abstract). However, the source of support of the systematic review was not reported. |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Adams S, Gatti-Mays ME, Kalinsky K, Korde LA, Sharon E, Amiri-Kordestani L, Bear H, McArthur HL, Frank E, Perlmutter J, Page DB, Vincent B, Hayes JF, Gulley JL, Litton JK, Hortobagyi GN, Chia S, Krop I, White J, Sparano J, Disis ML, Mittendorf EA. Current Landscape of Immunotherapy in Breast Cancer: A Review. JAMA Oncol. 2019 Aug 1;5(8):1205-1214. doi: 10.1001/jamaoncol.2018.7147. PMID: 30973611; PMCID: PMC8452050. |
Wrong publication type (narrative review). |
|
Ali MA, Aiman W, Shah SS, Hussain M, Kashyap R. Efficacy and safety of pembrolizumab based therapies in triple-negative breast cancer: A systematic review of clinical trials. Crit Rev Oncol Hematol. 2021 Jan;157:103197. doi: 10.1016/j.critrevonc.2020.103197. Epub 2020 Dec 10. PMID: 33309890. |
Wrong population (both early and metastatic breast cancer). |
|
Balibegloo M, Nejadghaderi SA, Sadeghalvad M, Soleymanitabar A, Salehi Nezamabadi S, Saghazadeh A, Rezaei N. Adverse events associated with immune checkpoint inhibitors in patients with breast cancer: A systematic review and meta-analysis. Int Immunopharmacol. 2021 Jul;96:107796. doi: 10.1016/j.intimp.2021.107796. Epub 2021 May 25. PMID: 34162158. |
Wrong population (both early and metastatic breast cancer). |
|
Diana A, Franzese E, Centonze S, Carlino F, Della Corte CM, Ventriglia J, Petrillo A, De Vita F, Alfano R, Ciardiello F, Orditura M. Triple-Negative Breast Cancers: Systematic Review of the Literature on Molecular and Clinical Features with a Focus on Treatment with Innovative Drugs. Curr Oncol Rep. 2018 Aug 20;20(10):76. doi: 10.1007/s11912-018-0726-6. PMID: 30128845. |
Wrong publication type (non-systematic). |
|
Huo X, Shen G, Liu Z, Liang Y, Li J, Zhao F, Ren D, Zhao J. Addition of immunotherapy to chemotherapy for metastatic triple-negative breast cancer: A systematic review and meta-analysis of randomized clinical trials. Crit Rev Oncol Hematol. 2021 Dec;168:103530. doi: 10.1016/j.critrevonc.2021.103530. Epub 2021 Nov 18. PMID: 34801695. |
Overlap with selected systematic review (Villacampa, 2022). |
|
Ji Q, Ding J, Hao M, Luo N, Huang J, Zhang W. Immune Checkpoint Inhibitors Combined With Chemotherapy Compared With Chemotherapy Alone for Triple-Negative Breast Cancer: A Systematic Review and Meta-Analysis. Front Oncol. 2021 Dec 16;11:795650. doi: 10.3389/fonc.2021.795650. PMID: 34976837; PMCID: PMC8716854. |
Wrong population (both early and metastatic breast cancer). |
|
Korde, L. A., Somerfield, M. R., Carey, L. A., Crews, J. R., Denduluri, N., Hwang, E. S., ... & Hershman, D. L. (2021). Neoadjuvant chemotherapy, endocrine therapy, and targeted therapy for breast cancer: ASCO guideline. Journal of clinical oncology, 39(13), 1485-1505. |
Wrong publication type (guideline). |
|
Latif F, Bint Abdul Jabbar H, Malik H, Sadaf H, Sarfraz A, Sarfraz Z, Cherrez-Ojeda I. Atezolizumab and pembrolizumab in triple-negative breast cancer: a meta-analysis. Expert Rev Anticancer Ther. 2022 Feb;22(2):229-235. doi: 10.1080/14737140.2022.2023011. Epub 2022 Jan 24. PMID: 34949142. |
Wrong population (both early and metastatic breast cancer). |
|
Lazarus G, Audrey J, Iskandar AWB. Efficacy and safety profiles of programmed cell death-1/programmed cell death ligand-1 inhibitors in the treatment of triple-negative breast cancer: A comprehensive systematic review. Oncol Rev. 2019 Oct 10;13(2):425. doi: 10.4081/oncol.2019.425. PMID: 31857857; PMCID: PMC6886008. |
Wrong population (both early and metastatic breast cancer). |
|
Longo V, Brunetti O, Azzariti A, Galetta D, Nardulli P, Leonetti F, Silvestris N. Strategies to Improve Cancer Immune Checkpoint Inhibitors Efficacy, Other Than Abscopal Effect: A Systematic Review. Cancers (Basel). 2019 Apr 15;11(4):539. doi: 10.3390/cancers11040539. PMID: 30991686; PMCID: PMC6521062. |
Wrong intervention (broader than the PICO). |
|
Luftner, D., & Hegewisch-Becker, S. (2021). News on systemic therapy of primary breast cancer ESMO 2020-SABCS 2020-St. Gallen 2021-ASCO 2021. ONKOLOGE, 27(12), 1206-1212. |
Full text in German. |
|
MacDonald I, Nixon NA, Khan OF. Triple-Negative Breast Cancer: A Review of Current Curative Intent Therapies. Curr Oncol. 2022 Jul 7;29(7):4768-4778. doi: 10.3390/curroncol29070378. PMID: 35877238; PMCID: PMC9317013. |
Wrong publication type (narrative review). |
|
Marinelli D, Mazzotta M, Pizzuti L, Krasniqi E, Gamucci T, Natoli C, Grassadonia A, Tinari N, Tomao S, Sperduti I, Sanguineti G, Botticelli A, Fabbri A, Botti C, Ciliberto G, Barba M, Vici P. Neoadjuvant Immune-Checkpoint Blockade in Triple-Negative Breast Cancer: Current Evidence and Literature-Based Meta-Analysis of Randomized Trials. Cancers (Basel). 2020 Sep 3;12(9):2497. doi: 10.3390/cancers12092497. PMID: 32899209; PMCID: PMC7565914. |
Wrong publication type (non-systematic). |
|
Moy B, Rumble RB, Come SE, Davidson NE, Di Leo A, Gralow JR, Hortobagyi GN, Yee D, Smith IE, Chavez-MacGregor M, Nanda R, McArthur HL, Spring L, Reeder-Hayes KE, Ruddy KJ, Unger PS, Vinayak S, Irvin WJ Jr, Armaghani A, Danso MA, Dickson N, Turner SS, Perkins CL, Carey LA. Chemotherapy and Targeted Therapy for Patients With Human Epidermal Growth Factor Receptor 2-Negative Metastatic Breast Cancer That is Either Endocrine-Pretreated or Hormone Receptor-Negative: ASCO Guideline Update. J Clin Oncol. 2021 Dec 10;39(35):3938-3958. doi: 10.1200/JCO.21.01374. Epub 2021 Jul 29. PMID: 34324366. |
Wrong publication type (guideline). |
|
O'Reilly D, Sendi MA, Kelly CM. Overview of recent advances in metastatic triple negative breast cancer. World J Clin Oncol. 2021 Mar 24;12(3):164-182. doi: 10.5306/wjco.v12.i3.164. PMID: 33767972; PMCID: PMC7968109. |
Wrong publication type (narrative review). |
|
Smith BD, Goetz MP, Boughey JC. Multidisciplinary Management of Breast Cancer With Extensive Regional Nodal Involvement. J Clin Oncol. 2020 Jul 10;38(20):2290-2298. doi: 10.1200/JCO.19.03036. Epub 2020 May 22. PMID: 32442073; PMCID: PMC7343438. |
Wrong publication type (case presentation). |
|
Sternschuss M, Yerushalmi R, Saleh RR, Amir E, Goldvaser H. Efficacy and safety of neoadjuvant immune checkpoint inhibitors in early-stage triple-negative breast cancer: a systematic review and meta-analysis. J Cancer Res Clin Oncol. 2021 Nov;147(11):3369-3379. doi: 10.1007/s00432-021-03591-w. Epub 2021 Mar 21. PMID: 33745080. |
Wrong population (early breast cancer). |
|
Tarantino P, Gandini S, Trapani D, Criscitiello C, Curigliano G. Immunotherapy addition to neoadjuvant chemotherapy for early triple negative breast cancer: A systematic review and meta-analysis of randomized clinical trials. Crit Rev Oncol Hematol. 2021 Mar;159:103223. doi: 10.1016/j.critrevonc.2021.103223. Epub 2021 Jan 19. PMID: 33482345. |
Wrong population (early breast cancer). |
|
Tavares DF, Chaves Ribeiro V, Andrade MAV, Moreira Cardoso-Júnior L, Rhangel Gomes Teixeira T, Ramos Varrone G, Lopes Britto R. Immunotherapy using PD-1/PDL-1 inhibitors in metastatic triple-negative breast cancer: A systematic review. Oncol Rev. 2021 Dec 6;15(2):497. doi: 10.4081/oncol.2021.497. PMID: 35003528; PMCID: PMC8678626. |
Wrong comparison (no chemotherapy in the intervention and control group). |
|
Xiao BY, Lin GH, Zhao YX, Wang BC. The efficacy and safety of PD-1/PD-L1 inhibitors in breast cancer: a systematic review and meta-analysis. Transl Cancer Res. 2020 Jun;9(6):3804-3818. doi: 10.21037/tcr-19-3020. PMID: 35117748; PMCID: PMC8797420. |
Wrong population (both early and metastatic breast cancer). |
|
Xin Y, Shen G, Zheng Y, Guan Y, Huo X, Li J, Ren D, Zhao F, Liu Z, Li Z, Zhao J. Immune checkpoint inhibitors plus neoadjuvant chemotherapy in early triple-negative breast cancer: a systematic review and meta-analysis. BMC Cancer. 2021 Nov 23;21(1):1261. doi: 10.1186/s12885-021-08997-w. PMID: 34814874; PMCID: PMC8609839. |
Wrong population (early breast cancer). |
|
Zou Y, Zou X, Zheng S, Tang H, Zhang L, Liu P, Xie X. Efficacy and predictive factors of immune checkpoint inhibitors in metastatic breast cancer: a systematic review and meta-analysis. Ther Adv Med Oncol. 2020 Aug 17;12:1758835920940928. doi: 10.1177/1758835920940928. PMID: 32874208; PMCID: PMC7436841. |
Wrong study design (prognostic). |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-12-2023
Beoordeeld op geldigheid : 01-11-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor de patiënt met (verdenking op) borstkanker of voor hen die voor screening in aanmerking komen. De richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de screening, diagnostiek, behandeling en nazorg van borstkanker. Tevens wordt deze richtlijn gebruikt voor het maken van informatiemateriaal voor patiënten, in samenwerking met kanker.nl en thuisarts.nl. Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van deze richtlijn hebben bijgedragen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met borstkanker.
|
Werkgroeplid |
Namens |
|
dr. M.A.W.M.C. (Marlene) Hoynck van Papendrecht |
BVN |
|
drs. C. (Cristina) Guerrero Paez |
BVN |
|
drs. M.A. (Marjolein) Scholten |
BVN |
|
C.M. (Marco) van Esterik |
Contactgroep Phyllodes |
|
M. (Michelle) Verseveld MSc |
KNGF |
|
prof. dr. G.H. (Truuske) de Bock |
NHG |
|
dr. B.E.P.J. (Birgit) Vriens |
NIV |
|
dr. A. (Agnes) Jager |
NIV |
|
dr. C.H. (Carolien) Smorenburg, voorzitter |
NIV |
|
dr. H. (Hiltje) de Graaf |
NIV |
|
dr. J.R. (Judith) Kroep |
NIV |
|
dr. H.H. (Huub) van Rossum |
NVKC |
|
dr. ir. C. (Christiaan) van Swol |
NVKF |
|
dr. F. (Frederiek) van den Bos |
NVKG |
|
dr. C.D.L. (Carine) Bavelaar-Croon |
NVNG |
|
dr. L.A.E. (Leonie) Woerdeman |
NVPC |
|
prof. dr. M.A.M. (Marc) Mureau |
NVPC |
|
dr. A.N. (Astrid) Scholten |
NVRO |
|
dr. H.J.G.D. (Desiree) van den Bongard |
NVRO |
|
dr. J.H. (John) Maduro |
NVRO |
|
dr. M.J.C. (Maurice) van der Sangen |
NVRO |
|
dr. N. (Nina) Bijker |
NVRO |
|
prof. dr. L.J. (Liesbeth) Boersma |
NVRO |
|
dr. D.J.P. (Dominique) van Uden |
NVvH |
|
dr. E.L. (Emily) Postma |
NVvH |
|
dr. J.H. (José) Volders |
NVvH |
|
dr. L.J.A. (Luc) Strobbe |
NVvH |
|
mr. dr. F.H. (Frederieke) van Duijnhoven |
NVvH |
|
drs. E.M. (Elise) Bekers |
NVVP |
|
dr. A.I.M. (Inge-Marie) Obdeijn |
NVvR |
|
dr. C.E. (Claudette) Loo |
NVvR |
|
dr. M.B.I. (Marc) Lobbes |
NVvR |
|
dr. C. (Carla) Meeuwis |
NVvR |
|
drs. L.M.H. (Lidy) Wijers |
NVvR |
|
drs. M.W. (Mechli) Imhof-Tas |
NVvR |
|
A. (Angelie) van den Bosch |
V&VN |
|
C. (Celine) Zoetbrood |
V&VN |
|
A.M.J. (Antoinette) Holterman |
V&VN oncologie |
|
drs. J.M. (Margriet) Collée |
VKGN |
Met ondersteuning van
Drs. S.N. (Sarah) van Duijn
Dr. L. (Linda) Oostendorp
Drs. M. (Miriam) te Lintel Hekkert
Dr. N. (Nadine) Zielonke
Dr. J. (Joppe) Tra
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
|
Smorenburg (voorzitter) |
* Internist-oncoloog Antoni van Leeuwenhoek (0,9 fte - betaald) |
Lid Bestuur gasthuis Antoni van Leeuwenhoek (onbetaald) |
In 2018 een vergoeding van €1,307,00 ontvangen van Pfizer.
|
|
Guerrero Paez |
Directeur Borstkanker Vereniging Nederland |
Lid Raad van Toezicht SPL te Leiden (onbetaald) |
Als patiëntenorganisatie leveren wij vanuit patïëntenperspectief advies aan. Persoonlijk ben ik alleen betrokken bij het Covid consortium waar we onderzoek doen naar Covid en Borstkanker. Trekker is IKNL (geen rol als projectleider). Verder werken wij met de PAG samen en allerlei vrijwilligers. Wij ontvangen van de farmacie gelden voor specifieke projecten op het gebied van informatievoorziening en/of lotgenotencontact. Deze zijn multisponsored en worden altijd opgenomen in het transparantieregister. |
|
Vriens |
Internist-oncoloog Catherinaziekenhuis Eindhoven |
In 2018 een vergoeding van €870,00 ontvangen van Novartis. |
|
|
Mureau |
Plastisch chirurg, Erasmus MC, Universitair Medisch Centrum Rotterdam |
* Maatschapslid AZR>SFG, werkzaamheden als plastisch chirurg (betaald) |
Polytech Health & Aesthetics GmbH - Long-term results of breast reconstruction with polyurethane covered implants: a multicenter randomized controlled trial - Projectleider |
|
Lobbes |
* Radioloog - Zuyderland Medisch Centrum, afdeling Medische Beeldvorming (0,9 fte) |
Lid wetenschappelijke adviesraad LRCB - Lid wetenschappelijke raad Zuyderland Medisch Centrum |
* GE Healtcare - Rapid Access to Contrast-Enchanced mammography in Recalls form breast cancer screening (RACER) – Projectleider * Boegbeeldfunctie wereldwijd van contrast-enhance mammography (CEM) * Betrokkenen heeft financiële vergoedingen gekregen voor het verzorgen van workshops, presentatie en deelname van medical advisory boards van onder andere GE Healthcare, Hologic, Tromp Medical, Suazio, Bayer |
|
Bosch, van den |
Verpleegkundig specialist mammacarcinoom in het Catherinaziekenhuis te Eindhoven |
Gast-docent HBO-V studenten aan Fontys Hogeschool te Eindhoven (betaald) |
Geen |
|
Bongard, van den |
Radiotherapeut-oncoloog, Amsterdam UMC |
* Lid NABON bestuur (onbetaald) |
* KWF/ Pink Ribbon - Eenmalige hoge dosis radiotherapie mammacarcinooom (ABLATIVE project, 2013 en 2020) - Projectleider; VARIAN grant voor Adaptive Radiotherapy in Breast Cancer patients (BREAST-ART, 2020) - Projectleider. * Lid landelijke werkgroep hypofractionering mammacarcinoom |
|
Van Swol |
* Klinisch Fysicus, St. Antonius Ziekenhuis (0,9 fte) |
Voorzitter Bestuur Stichting Opleiding Klinische Fysica - onbetaald. Zie www.stichtingokf.nl |
Geen |
|
Van Duijnhoven |
Chirurg-oncoloog, Nederlands Kanker Instituut / Antoni van Leeuwenhoek Ziekenhuis |
* European Organization for Research and Treatment of Cancer, secretary of the Breast Cancer Group |
* Innovatiefonds Zorgverzekeraars - Towards omitting breast surgery in patients with a complete response to neoadjuvant chemotherapy - biopten past NAC ter evaluatie respons onderzoek inmiddels afgerond- Geen projectleider, co-PI * KWF - Management of low risk ductal carcinoma in situ (low-risk DCIS): a non-randomized, multicenter, non-inferiority trial between standard therapy approach versus active surveillance - clinical trial ongoing - Geen projectleider, co-PI * KWF - Clinically node negative breast cancer patients undergoing breast conserving therapy: Sentinel lymph node procedure versus follow-up - randomized clinical trial, accural complete January 2022 - Geen projectleider, local PI * EORTC-quality of life group - Follow-up in Early and Locally Advanced Breast Cancer Patients: An EORTC QLG-BCG-ROG Protocol - clinical study in which quality of life data are registered in patients treated for breast cancer < 3 years ago - Geen projectleider, local PI * Als arts ook betrokken bij de patiëntenvereniging voor Phyllodes tumoren van de borst, wat 1 van de geformuleerde knelpunten vanuit onze beroepsvereniging is. |
|
Volders |
Oncologische chirurg |
* Bestuurslid werkgroep Mammachirurgie NVCO - onbetaald |
Geen |
|
Van der Sangen |
Radiotherapeut-oncoloog, afdeling Radiotherapie, Catharina Ziekenhuis Eindhoven |
Bestuurslid BOOG (Borstkanker Onderzoeksgroep Nederland), onbetaald |
NVRO/IKNL - Retrospectief onderzoek naar het gebruik van radiotherapie in Nederland - Geen projectleider |
Clusterexpertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
|
Bavelaar-Croon |
Nucleair Geneeskundige - Ziekenhuis Gelderse Vallei in Ede |
* Voorzitter werkgroep mammacarcinoom NVNG (Nederlandse Vereniging Nucleaire Geneeskunde) |
Geen |
|
Imhof-Tas |
Mammaradioloog en screeningsradioloog Radboud UMC (100%) |
Geen |
Geen |
|
Obdeijn |
Mammaradioloog in het Erasmus MC |
Geen |
* ZonMw - KWF, Sisters Hope, Pink Ribbon Stichting… - MRI versus mammography for breast cancer screening in women with familial risk (FAMRIsc: a multicentre randomised, controlled trial (Lancet Oncology 2019) |
|
Wijers |
Mamma- en neuroradioloog Alrijne Zorggroep (Leiderdorp - Leiden - Alphen) |
* Lid NABON |
In 2020 een vergoeding van €1270,00 ontvangen van Bayer. |
|
Collée |
Klinisch geneticus, Erasmus MC Rotterdam |
Geen |
* KWF - Nationwide infrastructure integrating research and health care to improve management for Dutch women with familial breast cancer risk Infrastructure Initiatives – * KWF Building in the Archipelago of Ovarian Cancer Research - Geen projectleider |
|
Rossum, van |
Laboratorium specialist Klinische Chemie, Afdeling Algemeen Klinisch Laboratorium Antoni van Leeuwenhoek Ziekenhuis Amsterdam |
* Eigenaar en directeur Huvaros B.V. (onbetaald) |
* Health Holland - Subsidie voor vingerprik bloedafname systeem voor Covid-19 serologie - Projectleider
|
|
Bock, de |
Hoogleraar oncologische epidemiologie en interim afdelingshoofd afdeling Epidemiologie van het UMCG (voltijds aanstelling) |
* Lid werkgroep herziening richtlijn familiaire en erfelijke eierstokkanker |
* W.J. Thijnstichting - STIC, het begin of het einde - Projectleider samen met gynaecoloog
|
|
Bos, van den |
Internist-ouderengeneeskunde LUMC |
Voorzitter kerngroep ouderen NIV (onbetaald) |
SKMS - Keuzehulpen nij patiënten met multimorbiditeit - Projectleider
|
|
Verseveld |
* Bestuurslid Nederlandse Vereniging voor fysiotherapie bij Lymfologie en Oncologie, portefeuilehouder Wetenschap Oedeem en Oncologie: 8 uur per week |
* NVFL: vrijwillige functie |
Geen |
|
Loo |
Radioloog, gespecialiseerd mammaradiologie & screening BVO (regio midden west). NKI-AVL (Nederlands Kanker Instituut, Antoni van Leeuwenhoek) en BVO midden west |
* Wetenschappelijke cie NBCA (deels betaals/vacatie) |
In 2019 een vergoeding van €1749,00 ontvangen van Bayer. |
|
Meeuwis |
Mammaradioloog Ziekenhuis Rijnstate |
* NABON - werkgroep standaardisatie verslaglegging (onbetaald) |
* SENO medical - Echografie gecombineerd met laserlicht voor de diagnostiek bij verdachte massa's in de borst - Projectleider
|
|
Louwe |
Gynaecoloog, 0,9 aanstelling Leids Universitair Medisch Centrum |
Geen |
Geen |
|
Graaf, de |
Internist-oncoloog MCL |
Lid commissie kwaliteit NVMO. Medisch manager Oncologisch Netwerk Friesland (ONF) Coach Coassistenten Lid raad van toezicht zorg en welzijn |
Geen |
|
Jager |
Internist-oncoloog Erasmus MC Kanker Instituut Rotterdam |
* Voorzitter Stichting BOOG (Borstkanker onderzoeksgroep) - onbezoldigd |
* KWF - Prediction of Breast Cancer chemotherapy response in patients by determination of chemosensitivity in tumor tissue ex vivo - Projectleider In 2019 een vergoeding van €980,00 ontvangen van Roche Pharma. |
|
Strobbe |
Borstkankerchirurg CWZ Nijmegen fulltime staflid |
Geen |
Geen |
|
Maduro |
Radiotherapeut oncoloog, Universitaire Medische Centrum Groningen en Prinses Maxima Centrum voor kinderoncologie |
Bestuur BOOG, onbetaald |
EU - HARMONIC, gevolgen straling bij kinderen - Geen projectleider
|
|
Boersma |
Radiotherapeut-oncoloog Maastro, Maastricht |
* Klinische werkzaamheden en wetenschappelijke werkzaamheden * Voorzitter van Landelijk Platform Protonentherapie en lid van commissie kwaliteit NVRO |
ZonMw - MOVE project: verbeteren zorgpaden protonentherapie; SKMS project: INNOVATE: verbeteren implementatie van innovaties. KWF: Descartes studie: de-escalatie van bestraling bij patiënten met pCR na Neoadjuvante chemotherapie
|
|
Scholten |
Radiotherapeut-oncoloog, NKI-AVL |
- |
KWF - PPAPBI-2 trial - Projectleider
|
|
Postma |
Oncologisch chirurg Antonius Ziekenhuis Nieuwegein |
Geen |
Geen |
|
Uden |
Fellow chirurgische oncologie: per 17-1-2022 te Gelre Ziekenhuizen (hiervoor fellow chirurgische oncologie in het Rijnstate Ziekenhuis) |
Niet van toepassing |
Onbetaald en ongefinancierd promotie onderzoek naar inflammatoir mammacarcinoom: nu geen aandachtspunt voor de revisie. |
|
Bijker |
Radiotherapeut-oncoloog Amsterdam UMC |
* Kartrekker lateralisatie mammazorg AmsterdamUMC, onbetaald |
* KWF 12900 - Reduction of organ motion during radiotherapy by non-invasive mechanical ventilation supported berating control - Geen projectleider
|
|
Kroep |
Internist-Oncoloog, LUMC |
Betaald adviseurschap: AstraZeneca, GSK, Eisai, Lilly, MSD, Novartis |
* AstraZeneca - FAB, DOMEC en MMRd-GREEN studie; behandeling ovariumca (FAB) en endometrium carcinoom (DOMEC en MMRd-GREEN) drugs (olaparib, durvalumab) en onregstricted grant - Projectleider * Novartis - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. ribociclib en unregstricted grant - Projectleider * Philips - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. unrestricted grant - Projectleider |
|
Woerdeman |
Plastisch chirurg Antoni van Leeuwenhoek Amsterdam |
* Hoofd afdeling plastische chirurgie Antoni van Leeuwenhoek |
Dutch Cancer Society, Grand/Award Number: - Ontwikkeling borst reconstructie keuzehulp - Projectleider
|
|
Esterik, van |
Tot 2014 zelfstandige als Invalbakker |
* Brood en Banker Bakker |
Geen |
|
Scholten, M |
* Belangenbehartiger bij BVN (Borstkankervereniging), 50% |
* Zitting in Medische Advies Raad Parkinsonvereniging (vrijwillig) |
Geen |
|
Hoynck van Papendrecht |
Vrijwilligster BVN |
* Gepensioneerd arts |
Geen |
|
Bekers |
Patholoog, Antoni van Leeuwenhoek Ziekenhuis |
Geen |
Geen |
|
Zoetbrood |
|
|
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de Borstkankervereniging Nederland (BVN) uit te nodigen voor de invitational conference en de werkgroep. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan BVN en de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK). De eventueel aangeleverde commentaren zijn bekeken en waar mogelijk verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er [waarschijnlijk geen/ mogelijk] substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module HER2-gerichte therapie in adjuvante setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met HER2-positieve borstkanker) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module HER2-gerichte therapie in gemetastaseerde setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met HER2-positieve borstkanker) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module immuuntherapie in gemetastaseerde setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker en indicatie immuuntherapie in gemetastaseerde setting) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module directe borstreconstructie en radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker, directe borstreconstructie en radiotherapie) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module uitgestelde borstreconstructie en radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker, uitgestelde borstreconstructie en radiotherapie) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module nacontrole: detectie van nieuwe carcinoom manifestaties |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>5.000 patiënten jaarlijks in nacontrole voor borstkanker), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Phyllodestumoren – beeldvorming en pathologie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren - radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren – resectiemarges |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren – systemische therapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Phyllodestumoren - nacontrole |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module screening buiten het bevolkingsonderzoek tijdens zwangerschap en borstvoeding |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met indicatie screening buiten het bevolkingsonderzoek tijdens zwangerschap en borstvoeding) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module immuuntherapie in neoadjuvante setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker en indicatie immuuntherapie in neoadjuvante setting) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep schriftelijk de knelpunten in de zorg voor patiënten met borstkanker. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model met behulp van Review Manager 5.4. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: Borstkanker-Immuuntherapie |
|
|
Uitgangsvraag:
|
|
|
Database(s): Embase, Pubmed |
Datum 2-8-2022, 3-8-2022 |
|
Periode: 2010-heden |
Talen: nvt |
|
Literatuurspecialist: Eugenie Delvaux |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
In overleg met de adviseur in 1 search de 2 PICO’s gezocht. Er is gezocht met de volgende elementen: ‘triple-negatief mammacarcinoom’ EN ‘chemotherapie’ EN ’checkpointremmers’. Het sleutelartikel van Schmid P wordt gevonden. Advies is om eerst te starten met de SR’s. Er worden veel RCT’s gevonden. |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase.com en Pubmed is op met relevante zoektermen gezocht naar Systematic Reviews, RCT’s over ‘triple-negatief mammacarcinoom’ EN ‘chemotherapie’ EN ’checkpointremmers’ De literatuurzoekactie leverde 1079 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/Medline |
Ontdubbeld |
|
SRs |
304 |
94 |
322 |
|
RCTs |
383 |
588 |
757 |
|
Totaal |
678 |
682 |
1079 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#10 |
#6 AND #8 |
383 |
|
#9 |
#6 AND #7 |
304 |
|
#8 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1941474 |
|
#7 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
846277 |
|
#6 |
#5 AND [1-1-2010]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
5074 |
|
#5 |
#1 AND #4 |
12022 |
|
#4 |
#2 AND #3 |
239624 |
|
#3 |
'chemotherapy'/exp OR 'neoadjuvant therapy'/exp OR 'adjuvant chemotherapy'/exp OR 'adjuvant chemotherap*':ti,ab,kw OR 'chemotherapeutics':ti,ab,kw OR 'chemotherap*':ti,ab,kw OR 'antineoplastic monoclonal antibody'/exp OR 'antineoplastic monoclonal antibod*':ti,ab,kw OR 'antineoplastic agent'/exp OR 'anti cancer drug*':ti,ab,kw OR 'anti neoplastic agent*':ti,ab,kw OR 'anticancer agent*':ti,ab,kw OR 'anticancer drug*':ti,ab,kw OR 'anticancerogen':ti,ab,kw OR 'anticarcinogen':ti,ab,kw OR 'anticarcinogenic agent*':ti,ab,kw OR 'antineoplastic agent*':ti,ab,kw OR 'antineoplastic combined chemotherapy protocols':ti,ab,kw OR 'antineoplastic drug*':ti,ab,kw OR 'antineoplastic peptide*':ti,ab,kw OR 'antineoplastics':ti,ab,kw OR 'antitumor agent*':ti,ab,kw OR 'antitumor drug*':ti,ab,kw OR 'antitumour agent*':ti,ab,kw OR 'antitumour drug*':ti,ab,kw OR 'cancer chemotherapeutic agent*':ti,ab,kw OR 'cancer inhibitor*':ti,ab,kw OR 'carcinostatic drug*':ti,ab,kw OR 'tumor inhibitor*':ti,ab,kw OR 'tumour inhibitor*':ti,ab,kw OR 'cytostatic agent'/exp OR 'cytostatic*':ti,ab,kw OR 'cytostatic agent*':ti,ab,kw OR 'cytostatic drug*':ti,ab,kw OR 'cytostatic factor':ti,ab,kw OR 'neo-adjuvant chemotherap*':ti,ab,kw OR 'neoadjuvant chemotherap*':ti,ab,kw OR 'anthracycline antibiotic agent'/exp OR 'anthracycline antibiotic*':ti,ab,kw OR 'anthracycline antibiotic agent*':ti,ab,kw |
3104897 |
|
#2 |
'immunotherapy'/exp OR 'brm therap*':ti,ab,kw OR 'biologic response modifier therap*':ti,ab,kw OR 'biological response modifier therap*':ti,ab,kw OR 'immune therap*':ti,ab,kw OR 'immunogenic therap*':ti,ab,kw OR 'immunoglobulin therap*':ti,ab,kw OR 'immunological therap*':ti,ab,kw OR 'immunological treatment*':ti,ab,kw OR 'immunomodulant therap*':ti,ab,kw OR 'immunomodulary therap*':ti,ab,kw OR 'immunomodulating therap*':ti,ab,kw OR 'immunomodulation therap*':ti,ab,kw OR 'immunomodulative therap*':ti,ab,kw OR 'immunomodulator therap*':ti,ab,kw OR 'immunomodulatory intervention*':ti,ab,kw OR 'immunomodulatory therap*':ti,ab,kw OR 'immunomoduling therap*':ti,ab,kw OR 'immunomodurating therap*':ti,ab,kw OR 'immunotherap*':ti,ab,kw OR 'checkpoint inhibitor'/exp OR 'checkpoint inhibitor*':ti,ab,kw OR ici:ti,ab,kw OR 'immune checkpoint*':ti,ab,kw OR 'immunostimulating agent'/exp OR 'immunostimulant agent*':ti,ab,kw OR 'immunostimulating agent*':ti,ab,kw OR 'immunomodulating agent*':ti,ab,kw |
479293 |
|
#1 |
((triple NEAR/2 negative NEAR/2 receptor):ti,ab,kw) OR (((breast OR mammar*) NEAR/3 (cancer* OR carcinoma* OR neoplasm* OR bc OR tumor* OR tumour*)):ti,ab,kw) OR tnbc:ti,ab,kw |
562763 |
Ovid/Medline
|
# |
Searches |
Results |
|
10 |
6 and 8 |
587 |
|
9 |
6 and 7 |
94 |
|
8 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2485039 |
|
7 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
582217 |
|
6 |
limit 5 to yr="2010 -Current" |
2251 |
|
5 |
1 and 4 |
3724 |
|
4 |
2 and 3 |
76587 |
|
3 |
exp Chemotherapy, Adjuvant/ or chemotherap*.ti,ab,kw. or exp Antineoplastic Agents/ or antineoplastic.ti,ab,kf. or 'anti cancer drug*'.ti,ab,kf. or 'anti neoplastic agent*'.ti,ab,kf. or 'anticancer agent*'.ti,ab,kf. or 'anticancer drug*'.ti,ab,kf. or 'anticancerogen'.ti,ab,kf. or 'anticarcinogen'.ti,ab,kf. or 'anticarcinogenic agent*'.ti,ab,kf. or 'cancer inhibitor*'.ti,ab,kf. or 'tumor inhibitor*'.ti,ab,kf. or 'tumour inhibitor*'.ti,ab,kf. or exp Cytostatic Agents/ or 'cytostatic agent*'.ti,ab,kf. or 'antitumor agent*'.ti,ab,kf. or 'antitumor drug*'.ti,ab,kf. or 'antitumour agent*'.ti,ab,kf. or 'antitumour drug*'.ti,ab,kf. or 'cancer chemotherapeutic agent*'.ti,ab,kf. or carcinostatic drug*'.ti,ab,kf. or cytostatic*.ti,ab,kf. or 'cytostatic drug*'.ti,ab,kf. or 'cytostatic factor'.ti,ab,kf. or exp Neoadjuvant Therapy/ or 'neo-adjuvant chemotherap*'.ti,ab,kf. or 'neoadjuvant chemotherapy*'.ti,ab,kf. or exp Anthracyclines/ or 'anthracycline*'.ti,ab,kf. |
1525912 |
|
2 |
exp Immunotherapy/ or immunotherap*.ti,ab,kf. or 'brm therap*'.ti,ab,kf. or 'biologic response modifier therap*'.ti,ab,kf. or 'biological response modifier therap*'.ti,ab,kf. or 'immune therap*'.ti,ab,kf. or 'immunogenic therap*'.ti,ab,kf. or 'immunoglobulin therap*'.ti,ab,kf. or 'immunological therap*'.ti,ab,kf. or 'immunological treatment*'.ti,ab,kf. or 'immunomodulant therap*'.ti,ab,kf. or 'immunomodulary therap*'.ti,ab,kf. or 'immunomodulating therap*'.ti,ab,kf. or 'immunomodulation therap*'.ti,ab,kf. or 'immunomodulative therap*'.ti,ab,kf. or 'immunomodulator therap*'.ti,ab,kf. or 'immunomodulatory intervention*'.ti,ab,kf. or 'immunomodulatory therap*'.ti,ab,kf. or 'immunomoduling therap*'.ti,ab,kf. or 'immunomodurating therap*'.ti,ab,kf. or 'immunotherap*'.ti,ab,kf. or exp Immunomodulating Agents/ or 'immunomodulating agent*'.ti,ab,kf. or 'immunostimulant agent*'.ti,ab,kf. or 'immunostimulating agent*'.ti,ab,kf. or 'checkpoint inhibitor*'.ti,ab,kf. or ici.ti,ab,kf. |
414040 |
|
1 |
exp Triple Negative Breast Neoplasms/ or (triple adj2 negative adj2 receptor).ti,ab,kf. or ((breast or mammar*) adj3 (cancer* or carcinoma* or neoplasm* or bc or tumor* or tumour*)).ti,ab,kf. or tnbc.ti,ab,kf. |
394724 |
