Triple negatieve borstkanker - Immuuntherapie
Uitgangsvraag
Wat is de plaats van checkpointremmers in neoadjuvante setting bij triple-negatief mammacarcinoom?
Aanbeveling
- Overweeg neoadjuvante/perioperatieve behandeling met pembrolizumab1 volgens de KEYNOTE-522 studie indien er geen contra-indicaties zijn voor behandeling met immuuntherapie bij patiënten met stadium II/III TNBC ongeacht PD-L1 status.
- Overweeg bij een dose dense AC schema om de pembrolizumab elke zes weken toe te dienen.
1 er is nog geen besluit genomen of pembrolizumab vergoed wordt vanuit het basispakket.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de systematische review van Tarantino (2021) worden vijf gerandomiseerde studies besproken die het toevoegen van checkpointremmers aan neoadjuvante chemotherapie bij patiënten met triple-negatieve borstkanker in een vroeg stadium onderzoeken. Van sommige van deze geïncludeerde studies zijn vervolgpublicaties beschikbaar, waaronder de landmark studie (KEYNOTE-522) van Schmid (2022).
Voor de cruciale uitkomstmaat eventvrije overleving werd een klinisch relevant verschil gevonden voor het effect van checkpointremmers in combinatie met neoadjuvante chemotherapie (al dan niet voortgezet als monotherapie checkpointremming in adjuvante setting) in vergelijking met neoadjuvante chemotherapie alleen, ten gunste van de combinatiebehandeling. Er werd geen klinisch relevant verschil gevonden voor de tweede cruciale uitkomstmaat totale overleving, wel een trend ten faveure van checkpoint remming. Daarnaast werd er een klinisch relevant verschil gevonden voor de uitkomst pathologische complete respons, ook ten gunste van de combinatiebehandeling. Voor toxiciteit en kwaliteit van leven werden er geen klinisch relevante verschillen gevonden. De bewijskracht voor alle uitkomstmaten was laag of zeer laag, met name vanwege beperkingen in studieopzet van de systematische review en imprecisie (onzekerheid in de grootte van het effect).
De meeste immuungerelateerde bijwerkingen zijn reversibel en goed onder controle te krijgen door onderbreken van de behandeling, toediening van corticosteroïden en/of ondersteunende zorg. Aangezien pembrolizumab gerelateerde bijwerkingen ernstig en permanent kunnen zijn, is zorgvuldige screening op en behandeling van veelvoorkomende toxiciteiten vereist.
Sinds de start van de KEYNOTE-522 studie is het behandellandschap voor niet gemetastaseerd tripelnegatief mammacarcinoom (TNBC) veranderd. Bij TNBC patiënten die geen pathologische complete respons (pCR) bereiken met neoadjuvante chemotherapie is er bewijs uit gerandomiseerde studies dat adjuvant capecitabine (all-comers) (Masuda, 2017) en olaparib (BRCA1/2 kiembaanmutatie draagsters) (Tutt, 2021) leiden tot verbetering van overleving. Advies van commissie BOM komt hiermee overeen (commissie BOM, 2023). Over het eventuele toevoegen van adjuvante pembrolizumab aan capecitabine of olaparib en het effect op overleving hiervan zijn geen gegevens bekend. Voor de patiënten zonder pCR kan adjuvante behandeling met capecitabine en voor patiënten zonder pCR en met een BRCA kiembaanmutatie kan adjuvant olaparib gegeven worden.
In de KEYNOTE-522 studie werd gestart met carboplatin/paclitaxel chemotherapie en werd vervolgens AC chemotherapie elke 3 weken gegeven. Dit is omgekeerd aan het gebruikelijke schema in de huidige Nederlandse praktijk, waarin gestart wordt met AC in een dose dense schema (2 in plaats van 3 weken, met G-CSF ondersteuning) gevolgd door paclitaxel ± carboplatin. Het advies is om het huidige Nederlandse schema te handhaven.
In de KEYNOTE-522 studie werd het effect van pembrolizumab onderzocht bij patiënten met een niet gemetastaseerd tripelnegatief mammacarcinoom, toegevoegd aan neoadjuvante chemotherapie en in adjuvante setting als monotherapie. De EMA en commissie BOM heeft pembrolizumab goedgekeurd voor de behandeling van volwassenen met een lokaal gevorderd of vroeg stadium tripelnegatief mammacarcinoom met een hoog risico op een recidief, als neoadjuvante behandeling in combinatie met chemotherapie en voortgezet als monotherapie in adjuvante setting. Momenteel lopen bij mammacarcinoom studies naar de waarde van adjuvante immuuntherapie na eerdere neoadjuvante behandeling (Optimice-pCR studie en NSABP B-59/GBG 96-GeparDouze) en zijn toekomstige studies naar ‘fine-tuning’ van gebruik van chemotherapie en/of immuuntherapie interessant.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Patiënten in de curatieve setting vinden over het algemeen de event-free survival (EFS) en overall survival (OS) het meest belangrijk naast kwaliteit van leven. De verlenging van EFS met pembrolizumab toegevoegd aan neoadjuvante chemotherapie en adjuvant als monotherapie werd waargenomen in alle subgroepen (Schmid, 2022). Zowel de EFS als het hogere percentage patiënten met een pathologische complete respons bij toevoeging van pembrolizumab aan neoadjuvante chemotherapie was onafhankelijk van de PD-L1-expressie. Overlevingsdata zijn nog niet matuur. Na verdere follow-up sinds het vorige rapport zijn er geen nieuwe veiligheidssignalen geïdentificeerd.
Aangezien pembrolizumab gerelateerde bijwerkingen ernstig en permanent kunnen zijn, is Zorgvuldige screening op en behandeling van veelvoorkomende toxiciteiten vereist. De perioperatieve behandeling met pembrolizumab wordt op basis van significante verbetering van EFS en pCR geadviseerd indien er geen contraindicaties zijn voor behandeling met immuuntherapie (bijvoorbeeld actieve autoimmuunziekte) (Schmid, 2022; Schmid, 2020).
De voor- en nadelen van de verschillende behandelopties dienen met de patiënt besproken te worden via de vier stappen van samen beslissen en met behulp van een time out.
Kosten (middelenbeslag)
Het toevoegen van pembrolizumab resulteert in een significante verbetering van EFS welke voldoet aan de PASKWIL-criteria (conform Advies commissie BOM, 2023).
De neoadjuvante en adjuvante behandeling wordt geadviseerd indien er geen contraindicaties zijn voor behandeling met immuuntherapie (bijvoorbeeld actieve autoimmuunziekte) (Schmid, 2022).
Er is nog geen besluit genomen over vergoeding van pembrolizumab vanuit het basispakket.
Aanvaardbaarheid, haalbaarheid en implementatie
Dit is gesteund door de EMA en commissie BOM en afhankelijk van de vergoeding door zorgverzekeraars.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De perioperatieve behandeling met pembrolizumab wordt geadviseerd indien er geen contraindicaties zijn voor behandeling met immuuntherapie (bijvoorbeeld actieve autoimmuunziekte) (Schmid, 2022).
Gezien de bewezen overlevingswinst blijft het advies om dose dense AC chemotherapie (ddAC) te geven (EBCTCG, 2019). Op basis van het werkingsmechanisme van anti-PD(L)1 en andere studies bij TNBC met dose dense AC zijn er geen aanwijzingen dat dose dense schema’s dan wel het gebruik van G-CSF schadelijk zijn indien gegeven samen met anti-PD1(L)1 (Mittendorf, 2020; Loibl, 2019).
In de KEYNOTE-522 studie werd pembrolizumab elke 3 weken gegeven, wat bij een dose dense AC schema van 2 weken extra bezoek aan de dagbehandeling voor de patiënt betekent. Geadviseerd wordt om analoog aan de huidige behandeling met pembrolizumab bij melanoom en NSCLC bij het neoadjuvante chemotherapieschema van 4 x ddAC (q 2 wkn) gevolgd door 4 x paclitaxel (+/- carboplatin) (q 3 wkn) pembrolizumab in een schema van 400mg elke 6 weken toe te dienen (zie ook Farmacotherapeutisch Kompas).
Onderbouwing
Achtergrond
In Nederland worden patiënten met een triple negatieve borstkanker (TNBC) die in aanmerking komen voor neoadjuvante chemotherapie behandeld met dose dense AC (ddAC q2 weken) gevolgd door 12 keer wekelijks paclitaxel, meestal gecombineerd met 4 kuren carboplatin q3 weken.
Naar aanleiding van de fase III KEYNOTE-522 studie (Schmid, 2022) beoordelen we de vraag betreffende het toevoegen van pembrolizumab (anti-PD1) aan de behandeling met neoadjuvante chemotherapie bij patiënten met stadium II/III TNBC.
Conclusies / Summary of Findings
Event-free survival
|
Low GRADE |
The evidence suggests that checkpoint inhibitor therapy in combination with neoadjuvant chemotherapy increases the event-free survival when compared with neoadjuvant chemotherapy alone in patients with stage 2-3 triple-negative breast cancer.
Source: Mittendorf, 2020; Nanda, 2020; Schmid, 2022 |
Overall survival
|
Low GRADE |
The evidence is uncertain about the effect of checkpoint inhibitor therapy in combination with neoadjuvant chemotherapy on overall survival when compared with neoadjuvant chemotherapy alone in patients with stage 2-3 triple-negative breast cancer.
Source: Schmid, 2022 |
Pathologic complete response
|
Low GRADE |
The evidence suggests that checkpoint inhibitor therapy in combination with neoadjuvant chemotherapy increases the pathologic complete response when compared with neoadjuvant chemotherapy alone in patients with stage 2-3 triple-negative breast cancer.
Source: Gianni, 2022; Loibl, 2019; Mittendorf, 2020; Nanda, 2020; Schmid, 2020 |
Toxicity
|
Very low GRADE |
The evidence is very uncertain about the effect of checkpoint inhibitor therapy in combination with neoadjuvant chemotherapy on toxicity when compared with neoadjuvant chemotherapy alone in patients with stage 2-3 triple-negative breast cancer.
Source: Tarantino, 2021 |
Quality of life
|
Very low GRADE |
The evidence is very uncertain about the effect of checkpoint inhibitor therapy in combination with neoadjuvant chemotherapy on quality of life when compared with neoadjuvant chemotherapy alone in patients with stage 2-3 triple-negative breast cancer.
Source: Barrios, 2022 |
Samenvatting literatuur
Description of studies
Tarantino (2021) conducted a systematic review and meta-analysis to compare the activity of chemotherapy combined with programmed cell death 1 (PD1) or programmed cell death ligand 1 (PD-L1) blockade versus chemotherapy alone as neoadjuvant treatment for triple negative breast cancer (TNBC) patients. Multiple databases (PubMed, Cochrane CENTRAL and EMBASE) were searched up to November 2020. Randomized controlled trials comparing neoadjuvant chemotherapy (NACT) plus PD1 or PD-L1 to NACT alone in TNBC patients were included. Five RCTs (Gianni, 2019; Loibl, 2019; Mittendorf, 2020; Nanda, 2020; Schmid, 2020) with a total of 1496 patients were included, of whom 820 (55%) received PD-(L)1 blockade with NACT and 676 (45%) received NACT. Four trials adopted an anthracycline- and taxane-based neoadjuvant chemotherapy (dose dense or non-dose dense) and two trials included a platinum agent. Adjuvant treatment also differed between the trials (pembrolizumab, atezolizumab, capecitabine, anthracyclines or physician’s choice). Four trials reported the tumor PD-L1 status, which was positive in most patients (944 patients versus 422 patients). The systematic review assessed the outcomes event-free survival, pathological complete response and toxicity. Results of subgroup analyses for PD-L1 expression and risk profile were also reported.
It should be noted that the neoadjuvant chemotherapy schedules and the adjuvant treatment in the studies were not entirely similar to the current Dutch medical practice.
Gianni (2022) reported the complete results of the NeoTRIP study (Gianni, 2019). The results of the study by Gianni (2019) were only available as an abstract at the time of publication of the systematic review.
Barrios (2022) reported patient-reported outcome data from the IMpassion031 study (Mittendorf, 2020). Physical function, role function and health-related quality of life were assessed (QLQ-C30 and FACT-G single-item GP5).
Schmid (2022) reported the results for event-free survival and additional efficacy and safety data of the KEYNOTE-522 study (Schmid, 2020).
To the best of our knowledge, no follow-up results of the GeparNuevo study (Loibl, 2019) and the I-SPY2 study (Nanda, 2020) were published.
Results
Event-free survival (crucial)
Three studies reported event-free survival.
Schmid (2022) reported a HR of 0.61 (95% CI: 0.46 to 0.82) in favor of PD-(L)1 blockade with NACT after a follow-up of 39.1 months. This was considered clinically relevant.
Mittendorf (2020) reported a HR of 0.76 (0.40 to 1.44) in favor of PD-(L)1 blockade with NACT after a follow-up of 20.6 months. This was not considered clinically relevant.
Nanda (2020) reported a HR of 0.60 (95% CI: not reported) in favor of PD-(L)1 blockade with NACT after 2.8-3.5 years of median follow-up depending on the arm. This was considered clinically relevant.
Overall survival (crucial)
Overall survival was not reported in the systematic review of Tarantino (2021).
Schmid (2022) reported that 80 patients (10.2%) in the group with PD-(L)1 blockade and NACT died and 55 patients (14.1%) in the NACT alone group after a follow-up of 39.1 months. The hazard ratio (HR) was 0.72 (95% CI 0.51 to 1.02) in favor of PD-(L)1 blockade with NACT. This was considered not clinically relevant.
Pathological complete response (important)
Five studies reported pCR (figure 1). The pooled odds ratio (OR) was 1.78 (95% CI: 1.27 to 2.50) with an I2 of 55% in favor of PD-(L)1 blockade with NACT. The pCR rate difference in each individual study was higher than 5% in favor of PD-(L)1 blockade with NACT (Schmid 2020: 65% vs. 51%, Nanda 2020: 60% vs. 22%, Mittendorf 2020: 58% vs. 41%, Loibl 2019: 53% vs. 44%, Gianni 2022: 49% vs. 44%). This was considered clinically relevant.
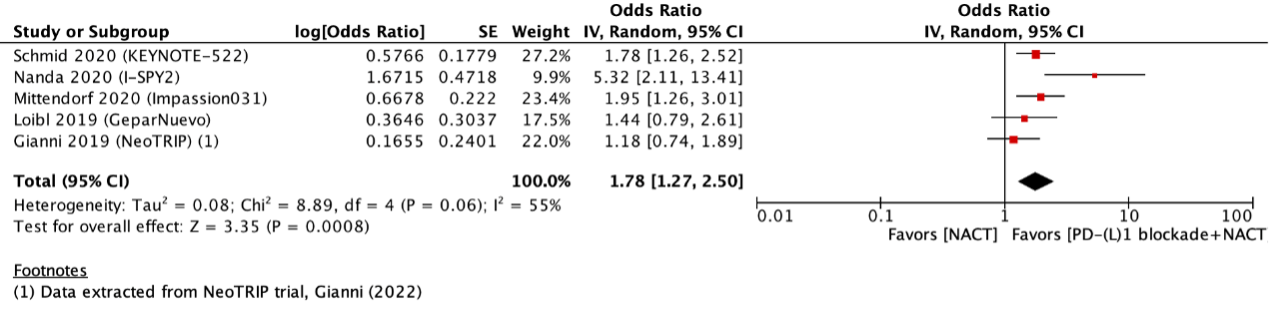
Figure 1. Outcome pathological complete response with neoadjuvant chemotherapy plus PD1 or PD-L1 versus neoadjuvant chemotherapy alone
Toxicity (important)
Tarantino (2021) reported a pooled OR of 1.30 (95% CI: 0.74 to 2.29) for grade 3 and 4 adverse events in favor of NACT. The individual ORs per study were not reported.
Schmid (2022) reported adverse events of grade ≥3 in 82.4% of the PD-(L)1 blockade with NACT group and in 78.7% of the NACT group. Treatment-related AEs grade ≥3 occurred in 77.1% and 73.3% of the patients, respectively. Immune-mediated AEs grade ≥3 occurred in 12.9% and 1.0% of the patients, respectively. These differences were considered not clinically relevant.
Nanda (2020) reported grade 3-4 adverse events and adverse events of special interest (including immune-related toxic effects) but did not report total percentages for both groups.
Mittendorf (2020) reported grade 3-4 adverse events in 63% of the PD-(L)1 blockade with NACT group and in 60% of the NACT group. Treatment-related AEs grade ≥3 occurred in 57% and 53% of the patients, respectively. AEs of special interest grade ≥3 occurred in 15% and 12% of the patients, respectively. These differences were considered not clinically relevant.
Loibl (2019) reported grade 3-4 adverse events and adverse events of special interest but did not report total percentages for both groups.
Gianni (2022) reported drug-related adverse events of grade ≥3 in 77.5% of the PD-(L)1 blockade with NACT group and in 70% of the NACT group. This difference was considered not clinically relevant.
Quality of life (important)
Quality of life was not reported in the systematic review of Tarantino (2021).
Barrios (2022) reported global health status (GHS)/health-related quality of life (HRQoL) and physical and role functioning (EORTC QLQ-C30 and FACT-G single-item GP5). The mean values on baseline were similar in the two groups. Study assessments were done on the first day of each cycle, at the treatment discontinuation visit and during follow-up (year 1: every 3 months, year 2 and 3: every 6 months, thereafter: annually). Results were graphically reported.
The GHS/QoL score at 12 months was 86.9 for the PD-(L)1 blockade with NACT group and 82.9 for the NACT group. The physical functioning score at 12 months was 82.7 for the PD-(L)1 blockade with NACT group and 86.6 for the NACT group. The role functioning score at 12 months was 74.9 for the PD-(L)1 blockade with NACT group and 83.6 for the NACT group. These differences were considered not clinically relevant.
Level of evidence of the literature
The evidence was derived from a systematic review of RCTs. Therefore, the level of evidence starts at high GRADE.
Event-free survival
The level of evidence regarding the outcome measure event-free survival was downgraded by two levels because of study limitations (-1; risk of bias systematic review, limited information and lacking quality assessment of individual studies); and number of included patients (-1; imprecision because the confidence interval includes the possibility of no effect or a favourable effect). Therefore, the evidence was graded as low.
Overall survival
Although the duration of follow-up at the time of this analysis (39.1 month) precludes the assessment of mature data regarding overall survival and follow-up, data are awaited. The level of evidence regarding the outcome measure overall survival was downgraded by two levels because of study limitations (-1; risk of bias systematic review, limited information and lacking quality assessment of individual studies); and number of included patients (-1; imprecision because of small number of events). Therefore, the evidence was graded as low.
Pathological Complete Response
The level of evidence regarding the outcome measure pathological complete response was downgraded by two levels because of study limitations (-1; risk of bias systematic review, limited information and lacking quality assessment of individual studies); and number of included patients (-1; imprecision because of small number of events). Therefore, the evidence was graded as low.
Toxicity
The level of evidence regarding the outcome measure toxicity was downgraded by three levels because of study limitations (-1; risk of bias systematic review, limited information and lacking quality assessment of individual studies); applicability (-1; bias due to indirectness regarding the outcome); and number of included patients (-1; imprecision because of small number of events). Therefore, the evidence was graded as very low.
Quality of life
The level of evidence regarding the outcome measure quality of life was downgraded by three levels because of study limitations (-1; risk of bias systematic review, limited information and lacking quality assessment of individual studies); applicability (-1; bias due to indirectness regarding the outcome); and number of included patients (-1; imprecision because of small number of events). Therefore, the evidence was graded as very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of checkpoint inhibitor therapy in combination with neoadjuvant chemotherapy when compared with neoadjuvant chemotherapy alone on event-free survival, overall survival, toxicity, quality of life and pathological Complete Response (pCR) in patients with stage 2-3 triple-negative breast cancer?
P: Patients with stage 2-3 triple-negative breast cancer (TNBC)
I: Checkpoint inhibitor therapy in combination with neoadjuvant chemotherapy
C: Neoadjuvant chemotherapy alone
O: Event-free survival, overall survival, pathologic complete response, toxicity, quality of life
Relevant outcome measures
The guideline development group considered event-free survival and overall survival as critical outcome measures for decision making; and pathologic complete response, toxicity and quality of life as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The guideline development group defined the following differences as a minimal clinically (patient) important difference:
- Event-free survival: >5% or >3% and Hazard Ratio (HR)<0.7
- Overall survival: >5% or >3% and HR<0.7
- Pathologic complete response: >5% or >3% and Odds Ratio (OR)<0.7
- Toxicity: lethal complications ³5% or serious complications ³25%
- Quality of life: ³10 points on the EORTC QLQ-C30 or a difference of a similar magnitude on other validated quality of life instruments
Search and select (Methods)
The search was developed for both the neoadjuvant setting (this module) and the metastasized setting. The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2010 until 03-08-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 1079 hits. Studies were selected based on the following criteria:
- Systematic reviews or randomized controlled trials;
- full-text English language publication;
- complying with the PICO criteria.
The guideline development group only screened the 322 systematic reviews. Twenty-three studies were initially selected based on title and abstract screening. After reading the full text, twenty-two studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included. Additionally, results of follow-up studies of primary RCTs included in the systematic review were analyzed.
Results
One systematic review (Tarantino, 2021) was included in the analysis of the literature. This systematic review included five RCTs. Data from three follow-up studies or analyses of the primary RCTs included in the systematic review were added, among which the landmark paper of Schmid (2022). Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- 1 - Barrios CH, Saji S, Harbeck N, Zhang H, Jung KH, Patel S, Patel S, Duc AN, Liste-Hermoso M, Chui SY, Mittendorf EA. Patient-reported outcomes from a randomized trial of neoadjuvant atezolizumab-chemotherapy in early triple-negative breast cancer. NPJ Breast Cancer. 2022 Sep 19;8(1):108. doi: 10.1038/s41523-022-00457-3. PMID: 36123366; PMCID: PMC9485121.
- 2 - Bonadio RC, Tarantino P, Testa L, Punie K, Pernas S, Barrios C, Curigliano G, Tolaney SM, Barroso-Sousa R. Management of patients with early-stage triple-negative breast cancer following pembrolizumab-based neoadjuvant therapy: What are the evidences? Cancer Treat Rev. 2022 Nov;110:102459. doi: 10.1016/j.ctrv.2022.102459. Epub 2022 Aug 18. PMID: 35998514.
- 3 - Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Increasing the dose intensity of chemotherapy by more frequent administration or sequential scheduling: a patient-level meta-analysis of 37 298 women with early breast cancer in 26 randomised trials. Lancet. 2019 Apr 6;393(10179):1440-1452. doi: 10.1016/S0140-6736(18)33137-4. Epub 2019 Feb 8. PMID: 30739743; PMCID: PMC6451189.
- 4 - Gianni, L., Huang, C.-S., Egle, D., Et, A., 2019. Pathologic Complete Response (pCR) to Neoadjuvant Treatment With or Without Atezolizumab in Triple Negative, Early High-Risk and Locally Advanced Breast Cancer. NeoTRIPaPDL1 Michelangelo Randomized Study. Sabcs.
- 5 - Gianni L, Huang CS, Egle D, Bermejo B, Zamagni C, Thill M, Anton A, Zambelli S, Bianchini G, Russo S, Ciruelos EM, Greil R, Semiglazov V, Colleoni M, Kelly C, Mariani G, Del Mastro L, Maffeis I, Valagussa P, Viale G. Pathologic complete response (pCR) to neoadjuvant treatment with or without atezolizumab in triple-negative, early high-risk and locally advanced breast cancer: NeoTRIP Michelangelo randomized study. Ann Oncol. 2022 May;33(5):534-543. doi: 10.1016/j.annonc.2022.02.004. Epub 2022 Feb 17. PMID: 35182721.
- 6 - Liu J, Blake SJ, Yong MC, Harjunpää H, Ngiow SF, Takeda K, Young A, O'Donnell JS, Allen S, Smyth MJ, Teng MW. Improved Efficacy of Neoadjuvant Compared to Adjuvant Immunotherapy to Eradicate Metastatic Disease. Cancer Discov. 2016 Dec;6(12):1382-1399. doi: 10.1158/2159-8290.CD-16-0577. Epub 2016 Sep 23. PMID: 27663893.
- 7 - Loibl S, Untch M, Burchardi N, Huober J, Sinn BV, Blohmer JU, Grischke EM, Furlanetto J, Tesch H, Hanusch C, Engels K, Rezai M, Jackisch C, Schmitt WD, von Minckwitz G, Thomalla J, Kümmel S, Rautenberg B, Fasching PA, Weber K, Rhiem K, Denkert C, Schneeweiss A. A randomised phase II study investigating durvalumab in addition to an anthracycline taxane-based neoadjuvant therapy in early triple-negative breast cancer: clinical results and biomarker analysis of GeparNuevo study. Ann Oncol. 2019 Aug 1;30(8):1279-1288. doi: 10.1093/annonc/mdz158. Erratum in: Ann Oncol. 2022 Jul;33(7):743-744. PMID: 31095287.
- 8 - Masuda N, Lee SJ, Ohtani S, Im YH, Lee ES, Yokota I, Kuroi K, Im SA, Park BW, Kim SB, Yanagita Y, Ohno S, Takao S, Aogi K, Iwata H, Jeong J, Kim A, Park KH, Sasano H, Ohashi Y, Toi M. Adjuvant Capecitabine for Breast Cancer after Preoperative Chemotherapy. N Engl J Med. 2017 Jun 1;376(22):2147-2159. doi: 10.1056/NEJMoa1612645. PMID: 28564564.
- 9 - Mittendorf EA, Zhang H, Barrios CH, Saji S, Jung KH, Hegg R, Koehler A, Sohn J, Iwata H, Telli ML, Ferrario C, Punie K, Penault-Llorca F, Patel S, Duc AN, Liste-Hermoso M, Maiya V, Molinero L, Chui SY, Harbeck N. Neoadjuvant atezolizumab in combination with sequential nab-paclitaxel and anthracycline-based chemotherapy versus placebo and chemotherapy in patients with early-stage triple-negative breast cancer (IMpassion031): a randomised, double-blind, phase 3 trial. Lancet. 2020 Oct 10;396(10257):1090-1100. doi: 10.1016/S0140-6736(20)31953-X. Epub 2020 Sep 20. PMID: 32966830.
- 10 - Nanda R, Liu MC, Yau C, Shatsky R, Pusztai L, Wallace A, Chien AJ, Forero-Torres A, Ellis E, Han H, Clark A, Albain K, Boughey JC, Jaskowiak NT, Elias A, Isaacs C, Kemmer K, Helsten T, Majure M, Stringer-Reasor E, Parker C, Lee MC, Haddad T, Cohen RN, Asare S, Wilson A, Hirst GL, Singhrao R, Steeg K, Asare A, Matthews JB, Berry S, Sanil A, Schwab R, Symmans WF, van 't Veer L, Yee D, DeMichele A, Hylton NM, Melisko M, Perlmutter J, Rugo HS, Berry DA, Esserman LJ. Effect of Pembrolizumab Plus Neoadjuvant Chemotherapy on Pathologic Complete Response in Women With Early-Stage Breast Cancer: An Analysis of the Ongoing Phase 2 Adaptively Randomized I-SPY2 Trial. JAMA Oncol. 2020 May 1;6(5):676-684. doi: 10.1001/jamaoncol.2019.6650. PMID: 32053137; PMCID: PMC7058271.
- 11 - NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Pembrolizumab en chemotherapie in neoadjuvante en adjuvante setting bij het tripelnegatief mammacarcinoom. Med Oncol 2023;26(1).
- 12 - Schmid P, Cortes J, Pusztai L, McArthur H, Kümmel S, Bergh J, Denkert C, Park YH, Hui R, Harbeck N, Takahashi M, Foukakis T, Fasching PA, Cardoso F, Untch M, Jia L, Karantza V, Zhao J, Aktan G, Dent R, O'Shaughnessy J; KEYNOTE-522 Investigators. Pembrolizumab for Early Triple-Negative Breast Cancer. N Engl J Med. 2020 Feb 27;382(9):810-821. doi: 10.1056/NEJMoa1910549. PMID: 32101663.
- 13 - Schmid P, Cortes J, Dent R, Pusztai L, McArthur H, Kümmel S, Bergh J, Denkert C, Park YH, Hui R, Harbeck N, Takahashi M, Untch M, Fasching PA, Cardoso F, Andersen J, Patt D, Danso M, Ferreira M, Mouret-Reynier MA, Im SA, Ahn JH, Gion M, Baron-Hay S, Boileau JF, Ding Y, Tryfonidis K, Aktan G, Karantza V, O'Shaughnessy J; KEYNOTE-522 Investigators. Event-free Survival with Pembrolizumab in Early Triple-Negative Breast Cancer. N Engl J Med. 2022 Feb 10;386(6):556-567. doi: 10.1056/NEJMoa2112651. PMID: 35139274.
- 14 - Tarantino P, Gandini S, Trapani D, Criscitiello C, Curigliano G. Immunotherapy addition to neoadjuvant chemotherapy for early triple negative breast cancer: A systematic review and meta-analysis of randomized clinical trials. Crit Rev Oncol Hematol. 2021 Mar;159:103223. doi: 10.1016/j.critrevonc.2021.103223. Epub 2021 Jan 19. PMID: 33482345.
- 15 - Tutt ANJ, Garber JE, Kaufman B, Viale G, Fumagalli D, Rastogi P, Gelber RD, de Azambuja E, Fielding A, Balmaña J, Domchek SM, Gelmon KA, Hollingsworth SJ, Korde LA, Linderholm B, Bandos H, Senkus E, Suga JM, Shao Z, Pippas AW, Nowecki Z, Huzarski T, Ganz PA, Lucas PC, Baker N, Loibl S, McConnell R, Piccart M, Schmutzler R, Steger GG, Costantino JP, Arahmani A, Wolmark N, McFadden E, Karantza V, Lakhani SR, Yothers G, Campbell C, Geyer CE Jr; OlympiA Clinical Trial Steering Committee and Investigators. Adjuvant Olaparib for Patients with BRCA1- or BRCA2-Mutated Breast Cancer. N Engl J Med. 2021 Jun 24;384(25):2394-2405. doi: 10.1056/NEJMoa2105215. Epub 2021 Jun 3. PMID: 34081848; PMCID: PMC9126186.
- 16 - Versluis JM, Long GV, Blank CU. Learning from clinical trials of neoadjuvant checkpoint blockade. Nat Med. 2020 Apr;26(4):475-484. doi: 10.1038/s41591-020-0829-0. Epub 2020 Apr 9. PMID: 32273608.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What is the effect of neoadjuvant checkpoint inhibitor therapy in combination with chemotherapy compared with neoadjuvant chemotherapy alone for patients with triple-negative breast cancer stage II-III?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Tarantino, 2021
PS. Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to November 2020
A: KEYNOTE-522 Trial, Schmid (2020) B: IMpassion031, Mittendorf (2020) C: NeoTRIPaPDL1, Gianni (2019) D: GeparNuevo, Loibl (2019) E: I-SPY2, Nanda (2020)
Study design: RCT
Setting and Country: A: International, multicentera B: International, multicentera C: International, multicentera D: Double-blind, phase II single center study, Frankfurt Germanya E: Open-label, phase II multicenter study, internationala
Source of funding and conflicts of interest: Not reported in SR
|
Inclusion criteria SR: - Prospective, randomized clinical trials for patients with early breast cancer - Enrolling Triple Negative Breast Cancer (TNBC) patients receiving neoadjuvant chemotherapy plus programmed cell death 1 (PD1) or PDL1 blockade in the experimental arm and neoadjuvant chemotherapy alone in the control arm (for trials enrolling patients with different breast cancer subtypes, only those with available results in the TNBC cohort were included) - Provide data on pCR after neoadjuvant treatment in the experimental and control arm
Exclusion criteria SR: - Case reports, reviews, meta-analyses, animal or in vitro studies - Observational studies - Ongoing studies with results not presented nor published at the time of the literature search
Five studies included
Important patient characteristics at baseline:
Number of patients A: 602, 1174b B: 333 C: 280 D: 174 E: 107
I: N=820 (55%) C: N=676 (45%)
Type of tumor* Tumor expressing PD-L1: N=944 (63%)
PDL1-negative tumor: N=422 (28%)
Missing: N=130 (9%)
Type of taxane A: Paclitaxel B: Nab-Pac C: Nab-Pac D: Nab-Pac E: Paclitaxel
Anthracycline A: Yes B: Yes (dose dense) C: No D: Yes (dose dense) E: Yes (dose dense or non-dose dense)
Platinum (carbo or cis) A: Yes B: No C: Yes D: No E: No
Adjuvant treatment A: Pembro (or placebo) for 1 year, no capecitabine B: Atezo (or placebo) for 1 year, capecitabine allowed C: Anthracyclines D: Physician’s choice E: Physician’s choice
No evaluation possible whether groups are comparable at baseline |
Describe intervention: PD-(L)1 blockade + neoadjuvant chemotherapy (NACT)
A: Pembrolizumab for 1 year, no capecitabine B: Atezo for 1 year, capecitabine allowed C: Neoadjuvant carboplatin AUC 2 and nab-paclitaxel on days 1 and 8 with atezolizumab on day 1, every 3 weeks for eight cyclesd D: Durvalumab every 4 weeks in addition to nab-paclitaxel followed by standard epirubicina E: Standart NACT plus pembrolizumab every 3 weeks for 4 cyclues concurrently with paclitaxela
|
Describe control: Neoadjuvant chemotherapy (NACT)
A: Placebo for 1 year, no capecitabine B Placebo for 1 year, capecitabine allowed C: Neoadjuvant carboplatin AUC 2 and nab-paclitaxel on days 1 and 8 without atezolizumab on day 1, every 3 weeks for eight cyclesd D: Placebo every 4 weeks in addition to nab-paclitaxel followed by standard epirubicina E: Standard NACT for 12 weeks, followed by 4 cycles of doxorubicin plus intravenous cyclophosphamide every 2 to 3 weeksa
|
End-point of follow-up:
A: 18 months; 39.1 monthsa B: 20.6 months C: NR D: NR E: 2.8-3.5 years median follow-up
For how many participants were no complete outcome data available? (intervention/control) A: NR B: NR C: I: 9% / C: 8%d D: I: 36% / C: 41%a E: I: 9%/ C: 5%a
|
Event-free survival
Effect measure: HR [95% CI]: A: 0.61 [0.46-0.82]b B: 0.76 [0.40-1.44] C: NR D: NR E: 0.60 [NR]
No pooled data available
Overall survival
Effect measure: OR [95% CI]: A: 0.72 [0.51-1.02]b B: NR C: NR D: NR E: NR
Pathological complete response (pCR)
Effect measure: OR [95% CI]: A: 1.78 [1.26-2.52] B: 1.95 [1.26-3.01] C: 1.18 [0.74-1.89]d D: 1.44 [0.79-2.61] E: 5.32 [2.11-13.41]
Pooled overall effect (random effects model): 1.78 [95%CI 1.27 to 2.50] favouring PD-(L)1 blockade + NACT Heterogeneity (I2): 55%
Toxicity Defined as grade ≥3 adverse events
Pooled overall effect (random effects model): 1.30 (95% CI 0.74 to 2.29) favouring NACT
Quality of life According to QLQ-C30 questionnaire
Mean score A: NR B: GHS/QoL score at 12 months I: 86.9c C: 82.9c
Physical functioning score at 12 months I: 82.7c C: 86.6c
Role functioning score at 12 months I: 74.9c C: 83.6c
C: NR D: NR E: NR
|
Author’s conclusion: PD-L1 testing assays were different across trials. A sensitivity analysis was conducted to examine the impact of inclusion criteria on the summary results.
Heterogeneity: Summary estimate of association of PD1/PD-L1 blockade with pCR increased when excluding Gianni (2019) from analysis (OR 1.90; I2 48%). |
|
NR: Not reported; a Data extracted from individual studies; b Data extracted from follow-up of KEYNOTE-522 trial, Schmid (2022); c Data extracted from IMpassion031 trial, Barrios (2022); d Data extracted from NeoTRIP trial, Gianni (2022); * different PD-L1 testing assays across trials |
|||||||
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Tarantino, 2022 |
Yes;
Reason: the PICO elements are incorporated in the inclusion criteria. |
Yes;
Reason: search period, search terms and databases were described. |
No;
Reason: potentially relevant studies that were excluded at final selection were not referenced and did not have an individual reason of exclusion. |
No;
Reason: limited baseline characteristics were provided in table of the systematic review. |
Not applicable. |
No;
Reason: quality of individual studies was not assessed. |
Yes;
Reason: no heterogeneity was detected between the included studies in the meta-analysis. |
Yes;
Reason: no indication for publication bias, as assessed by applying the Macaskill test, was found. |
Yes;
Reason: funding and conflicts of interest were reported in the systematic review and in the included studies (except for one included abstract). |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Adams S, Gatti-Mays ME, Kalinsky K, Korde LA, Sharon E, Amiri-Kordestani L, Bear H, McArthur HL, Frank E, Perlmutter J, Page DB, Vincent B, Hayes JF, Gulley JL, Litton JK, Hortobagyi GN, Chia S, Krop I, White J, Sparano J, Disis ML, Mittendorf EA. Current Landscape of Immunotherapy in Breast Cancer: A Review. JAMA Oncol. 2019 Aug 1;5(8):1205-1214. doi: 10.1001/jamaoncol.2018.7147. PMID: 30973611; PMCID: PMC8452050. |
Wrong publication type (narrative review). |
|
Ali MA, Aiman W, Shah SS, Hussain M, Kashyap R. Efficacy and safety of pembrolizumab based therapies in triple-negative breast cancer: A systematic review of clinical trials. Crit Rev Oncol Hematol. 2021 Jan;157:103197. doi: 10.1016/j.critrevonc.2020.103197. Epub 2020 Dec 10. PMID: 33309890. |
Wrong population (both early and metastatic breast cancer). |
|
Balibegloo M, Nejadghaderi SA, Sadeghalvad M, Soleymanitabar A, Salehi Nezamabadi S, Saghazadeh A, Rezaei N. Adverse events associated with immune checkpoint inhibitors in patients with breast cancer: A systematic review and meta-analysis. Int Immunopharmacol. 2021 Jul;96:107796. doi: 10.1016/j.intimp.2021.107796. Epub 2021 May 25. PMID: 34162158. |
Wrong population (both early and metastatic breast cancer). |
|
Diana A, Franzese E, Centonze S, Carlino F, Della Corte CM, Ventriglia J, Petrillo A, De Vita F, Alfano R, Ciardiello F, Orditura M. Triple-Negative Breast Cancers: Systematic Review of the Literature on Molecular and Clinical Features with a Focus on Treatment with Innovative Drugs. Curr Oncol Rep. 2018 Aug 20;20(10):76. doi: 10.1007/s11912-018-0726-6. PMID: 30128845. |
Wrong publication type (non-systematic). |
|
Huo X, Shen G, Liu Z, Liang Y, Li J, Zhao F, Ren D, Zhao J. Addition of immunotherapy to chemotherapy for metastatic triple-negative breast cancer: A systematic review and meta-analysis of randomized clinical trials. Crit Rev Oncol Hematol. 2021 Dec;168:103530. doi: 10.1016/j.critrevonc.2021.103530. Epub 2021 Nov 18. PMID: 34801695. |
Wrong population (metastatic breast cancer). |
|
Ji Q, Ding J, Hao M, Luo N, Huang J, Zhang W. Immune Checkpoint Inhibitors Combined With Chemotherapy Compared With Chemotherapy Alone for Triple-Negative Breast Cancer: A Systematic Review and Meta-Analysis. Front Oncol. 2021 Dec 16;11:795650. doi: 10.3389/fonc.2021.795650. PMID: 34976837; PMCID: PMC8716854. |
Wrong population (both early and metastatic breast cancer). |
|
Korde, L. A., Somerfield, M. R., Carey, L. A., Crews, J. R., Denduluri, N., Hwang, E. S., ... & Hershman, D. L. (2021). Neoadjuvant chemotherapy, endocrine therapy, and targeted therapy for breast cancer: ASCO guideline. Journal of clinical oncology, 39(13), 1485-1505. |
Wrong publication type (guideline). |
|
Latif F, Bint Abdul Jabbar H, Malik H, Sadaf H, Sarfraz A, Sarfraz Z, Cherrez-Ojeda I. Atezolizumab and pembrolizumab in triple-negative breast cancer: a meta-analysis. Expert Rev Anticancer Ther. 2022 Feb;22(2):229-235. doi: 10.1080/14737140.2022.2023011. Epub 2022 Jan 24. PMID: 34949142. |
Wrong population (both early and metastatic breast cancer). |
|
Lazarus G, Audrey J, Iskandar AWB. Efficacy and safety profiles of programmed cell death-1/programmed cell death ligand-1 inhibitors in the treatment of triple-negative breast cancer: A comprehensive systematic review. Oncol Rev. 2019 Oct 10;13(2):425. doi: 10.4081/oncol.2019.425. PMID: 31857857; PMCID: PMC6886008. |
Wrong population (both early and metastatic breast cancer). |
|
Longo V, Brunetti O, Azzariti A, Galetta D, Nardulli P, Leonetti F, Silvestris N. Strategies to Improve Cancer Immune Checkpoint Inhibitors Efficacy, Other Than Abscopal Effect: A Systematic Review. Cancers (Basel). 2019 Apr 15;11(4):539. doi: 10.3390/cancers11040539. PMID: 30991686; PMCID: PMC6521062. |
Wrong intervention (broader than the PICO). |
|
Luftner, D., & Hegewisch-Becker, S. (2021). News on systemic therapy of primary breast cancer ESMO 2020-SABCS 2020-St. Gallen 2021-ASCO 2021. ONKOLOGE, 27(12), 1206-1212. |
Full text in German. |
|
MacDonald I, Nixon NA, Khan OF. Triple-Negative Breast Cancer: A Review of Current Curative Intent Therapies. Curr Oncol. 2022 Jul 7;29(7):4768-4778. doi: 10.3390/curroncol29070378. PMID: 35877238; PMCID: PMC9317013. |
Wrong publication type (narrative review). |
|
Marinelli D, Mazzotta M, Pizzuti L, Krasniqi E, Gamucci T, Natoli C, Grassadonia A, Tinari N, Tomao S, Sperduti I, Sanguineti G, Botticelli A, Fabbri A, Botti C, Ciliberto G, Barba M, Vici P. Neoadjuvant Immune-Checkpoint Blockade in Triple-Negative Breast Cancer: Current Evidence and Literature-Based Meta-Analysis of Randomized Trials. Cancers (Basel). 2020 Sep 3;12(9):2497. doi: 10.3390/cancers12092497. PMID: 32899209; PMCID: PMC7565914. |
Wrong publication type (non-systematic). |
|
Moy B, Rumble RB, Come SE, Davidson NE, Di Leo A, Gralow JR, Hortobagyi GN, Yee D, Smith IE, Chavez-MacGregor M, Nanda R, McArthur HL, Spring L, Reeder-Hayes KE, Ruddy KJ, Unger PS, Vinayak S, Irvin WJ Jr, Armaghani A, Danso MA, Dickson N, Turner SS, Perkins CL, Carey LA. Chemotherapy and Targeted Therapy for Patients With Human Epidermal Growth Factor Receptor 2-Negative Metastatic Breast Cancer That is Either Endocrine-Pretreated or Hormone Receptor-Negative: ASCO Guideline Update. J Clin Oncol. 2021 Dec 10;39(35):3938-3958. doi: 10.1200/JCO.21.01374. Epub 2021 Jul 29. PMID: 34324366. |
Wrong publication type (guideline). |
|
O'Reilly D, Sendi MA, Kelly CM. Overview of recent advances in metastatic triple negative breast cancer. World J Clin Oncol. 2021 Mar 24;12(3):164-182. doi: 10.5306/wjco.v12.i3.164. PMID: 33767972; PMCID: PMC7968109. |
Wrong publication type (narrative review). |
|
Smith BD, Goetz MP, Boughey JC. Multidisciplinary Management of Breast Cancer With Extensive Regional Nodal Involvement. J Clin Oncol. 2020 Jul 10;38(20):2290-2298. doi: 10.1200/JCO.19.03036. Epub 2020 May 22. PMID: 32442073; PMCID: PMC7343438. |
Wrong publication type (case presentation). |
|
Sternschuss M, Yerushalmi R, Saleh RR, Amir E, Goldvaser H. Efficacy and safety of neoadjuvant immune checkpoint inhibitors in early-stage triple-negative breast cancer: a systematic review and meta-analysis. J Cancer Res Clin Oncol. 2021 Nov;147(11):3369-3379. doi: 10.1007/s00432-021-03591-w. Epub 2021 Mar 21. PMID: 33745080. |
Overlap with selected systematic review (Tarantino, 2021). |
|
Tavares DF, Chaves Ribeiro V, Andrade MAV, Moreira Cardoso-Júnior L, Rhangel Gomes Teixeira T, Ramos Varrone G, Lopes Britto R. Immunotherapy using PD-1/PDL-1 inhibitors in metastatic triple-negative breast cancer: A systematic review. Oncol Rev. 2021 Dec 6;15(2):497. doi: 10.4081/oncol.2021.497. PMID: 35003528; PMCID: PMC8678626. |
Wrong population (metastatic breast cancer). |
|
Villacampa G, Tolosa P, Salvador F, Sánchez-Bayona R, Villanueva L, Dienstmann R, Ciruelos E, Pascual T. Addition of immune checkpoint inhibitors to chemotherapy versus chemotherapy alone in first-line metastatic triple-negative breast cancer: A systematic review and meta-analysis. Cancer Treat Rev. 2022 Mar;104:102352. doi: 10.1016/j.ctrv.2022.102352. Epub 2022 Feb 2. PMID: 35144055. |
Wrong population (metastatic breast cancer). |
|
Xiao BY, Lin GH, Zhao YX, Wang BC. The efficacy and safety of PD-1/PD-L1 inhibitors in breast cancer: a systematic review and meta-analysis. Transl Cancer Res. 2020 Jun;9(6):3804-3818. doi: 10.21037/tcr-19-3020. PMID: 35117748; PMCID: PMC8797420. |
Wrong population (both early and metastatic breast cancer). |
|
Xin Y, Shen G, Zheng Y, Guan Y, Huo X, Li J, Ren D, Zhao F, Liu Z, Li Z, Zhao J. Immune checkpoint inhibitors plus neoadjuvant chemotherapy in early triple-negative breast cancer: a systematic review and meta-analysis. BMC Cancer. 2021 Nov 23;21(1):1261. doi: 10.1186/s12885-021-08997-w. PMID: 34814874; PMCID: PMC8609839. |
Overlap with selected systematic review (Tarantino, 2021). |
|
Zou Y, Zou X, Zheng S, Tang H, Zhang L, Liu P, Xie X. Efficacy and predictive factors of immune checkpoint inhibitors in metastatic breast cancer: a systematic review and meta-analysis. Ther Adv Med Oncol. 2020 Aug 17;12:1758835920940928. doi: 10.1177/1758835920940928. PMID: 32874208; PMCID: PMC7436841. |
Wrong population (metastatic breast cancer). |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-11-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor de patiënt met (verdenking op) borstkanker of voor hen die voor screening in aanmerking komen. De richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de screening, diagnostiek, behandeling en nazorg van borstkanker. Tevens wordt deze richtlijn gebruikt voor het maken van informatiemateriaal voor patiënten, in samenwerking met kanker.nl en thuisarts.nl. Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van deze richtlijn hebben bijgedragen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met borstkanker.
|
Werkgroeplid |
Namens |
|
dr. M.A.W.M.C. (Marlene) Hoynck van Papendrecht |
BVN |
|
drs. C. (Cristina) Guerrero Paez |
BVN |
|
drs. M.A. (Marjolein) Scholten |
BVN |
|
C.M. (Marco) van Esterik |
Contactgroep Phyllodes |
|
M. (Michelle) Verseveld MSc |
KNGF |
|
prof. dr. G.H. (Truuske) de Bock |
NHG |
|
dr. B.E.P.J. (Birgit) Vriens |
NIV |
|
dr. A. (Agnes) Jager |
NIV |
|
dr. C.H. (Carolien) Smorenburg, voorzitter |
NIV |
|
dr. H. (Hiltje) de Graaf |
NIV |
|
dr. J.R. (Judith) Kroep |
NIV |
|
dr. H.H. (Huub) van Rossum |
NVKC |
|
dr. ir. C. (Christiaan) van Swol |
NVKF |
|
dr. F. (Frederiek) van den Bos |
NVKG |
|
dr. C.D.L. (Carine) Bavelaar-Croon |
NVNG |
|
dr. L.A.E. (Leonie) Woerdeman |
NVPC |
|
prof. dr. M.A.M. (Marc) Mureau |
NVPC |
|
dr. A.N. (Astrid) Scholten |
NVRO |
|
dr. H.J.G.D. (Desiree) van den Bongard |
NVRO |
|
dr. J.H. (John) Maduro |
NVRO |
|
dr. M.J.C. (Maurice) van der Sangen |
NVRO |
|
dr. N. (Nina) Bijker |
NVRO |
|
prof. dr. L.J. (Liesbeth) Boersma |
NVRO |
|
dr. D.J.P. (Dominique) van Uden |
NVvH |
|
dr. E.L. (Emily) Postma |
NVvH |
|
dr. J.H. (José) Volders |
NVvH |
|
dr. L.J.A. (Luc) Strobbe |
NVvH |
|
mr. dr. F.H. (Frederieke) van Duijnhoven |
NVvH |
|
drs. E.M. (Elise) Bekers |
NVVP |
|
dr. A.I.M. (Inge-Marie) Obdeijn |
NVvR |
|
dr. C.E. (Claudette) Loo |
NVvR |
|
dr. M.B.I. (Marc) Lobbes |
NVvR |
|
dr. C. (Carla) Meeuwis |
NVvR |
|
drs. L.M.H. (Lidy) Wijers |
NVvR |
|
drs. M.W. (Mechli) Imhof-Tas |
NVvR |
|
A. (Angelie) van den Bosch |
V&VN |
|
C. (Celine) Zoetbrood |
V&VN |
|
A.M.J. (Antoinette) Holterman |
V&VN oncologie |
|
drs. J.M. (Margriet) Collée |
VKGN |
Met ondersteuning van
Drs. S.N. (Sarah) van Duijn
Dr. L. (Linda) Oostendorp
Drs. M. (Miriam) te Lintel Hekkert
Dr. N. (Nadine) Zielonke
Dr. J. (Joppe) Tra
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
|
Smorenburg (voorzitter) |
* Internist-oncoloog Antoni van Leeuwenhoek (0,9 fte - betaald) |
Lid Bestuur gasthuis Antoni van Leeuwenhoek (onbetaald) |
In 2018 een vergoeding van €1,307,00 ontvangen van Pfizer.
|
|
Guerrero Paez |
Directeur Borstkanker Vereniging Nederland |
Lid Raad van Toezicht SPL te Leiden (onbetaald) |
Als patiëntenorganisatie leveren wij vanuit patïëntenperspectief advies aan. Persoonlijk ben ik alleen betrokken bij het Covid consortium waar we onderzoek doen naar Covid en Borstkanker. Trekker is IKNL (geen rol als projectleider). Verder werken wij met de PAG samen en allerlei vrijwilligers. Wij ontvangen van de farmacie gelden voor specifieke projecten op het gebied van informatievoorziening en/of lotgenotencontact. Deze zijn multisponsored en worden altijd opgenomen in het transparantieregister. |
|
Vriens |
Internist-oncoloog Catherinaziekenhuis Eindhoven |
In 2018 een vergoeding van €870,00 ontvangen van Novartis. |
|
|
Mureau |
Plastisch chirurg, Erasmus MC, Universitair Medisch Centrum Rotterdam |
* Maatschapslid AZR>SFG, werkzaamheden als plastisch chirurg (betaald) |
Polytech Health & Aesthetics GmbH - Long-term results of breast reconstruction with polyurethane covered implants: a multicenter randomized controlled trial - Projectleider |
|
Lobbes |
* Radioloog - Zuyderland Medisch Centrum, afdeling Medische Beeldvorming (0,9 fte) |
Lid wetenschappelijke adviesraad LRCB - Lid wetenschappelijke raad Zuyderland Medisch Centrum |
* GE Healtcare - Rapid Access to Contrast-Enchanced mammography in Recalls form breast cancer screening (RACER) – Projectleider * Boegbeeldfunctie wereldwijd van contrast-enhance mammography (CEM) * Betrokkenen heeft financiële vergoedingen gekregen voor het verzorgen van workshops, presentatie en deelname van medical advisory boards van onder andere GE Healthcare, Hologic, Tromp Medical, Suazio, Bayer |
|
Bosch, van den |
Verpleegkundig specialist mammacarcinoom in het Catherinaziekenhuis te Eindhoven |
Gast-docent HBO-V studenten aan Fontys Hogeschool te Eindhoven (betaald) |
Geen |
|
Bongard, van den |
Radiotherapeut-oncoloog, Amsterdam UMC |
* Lid NABON bestuur (onbetaald) |
* KWF/ Pink Ribbon - Eenmalige hoge dosis radiotherapie mammacarcinooom (ABLATIVE project, 2013 en 2020) - Projectleider; VARIAN grant voor Adaptive Radiotherapy in Breast Cancer patients (BREAST-ART, 2020) - Projectleider. * Lid landelijke werkgroep hypofractionering mammacarcinoom |
|
Van Swol |
* Klinisch Fysicus, St. Antonius Ziekenhuis (0,9 fte) |
Voorzitter Bestuur Stichting Opleiding Klinische Fysica - onbetaald. Zie www.stichtingokf.nl |
Geen |
|
Van Duijnhoven |
Chirurg-oncoloog, Nederlands Kanker Instituut / Antoni van Leeuwenhoek Ziekenhuis |
* European Organization for Research and Treatment of Cancer, secretary of the Breast Cancer Group |
* Innovatiefonds Zorgverzekeraars - Towards omitting breast surgery in patients with a complete response to neoadjuvant chemotherapy - biopten past NAC ter evaluatie respons onderzoek inmiddels afgerond- Geen projectleider, co-PI * KWF - Management of low risk ductal carcinoma in situ (low-risk DCIS): a non-randomized, multicenter, non-inferiority trial between standard therapy approach versus active surveillance - clinical trial ongoing - Geen projectleider, co-PI * KWF - Clinically node negative breast cancer patients undergoing breast conserving therapy: Sentinel lymph node procedure versus follow-up - randomized clinical trial, accural complete January 2022 - Geen projectleider, local PI * EORTC-quality of life group - Follow-up in Early and Locally Advanced Breast Cancer Patients: An EORTC QLG-BCG-ROG Protocol - clinical study in which quality of life data are registered in patients treated for breast cancer < 3 years ago - Geen projectleider, local PI * Als arts ook betrokken bij de patiëntenvereniging voor Phyllodes tumoren van de borst, wat 1 van de geformuleerde knelpunten vanuit onze beroepsvereniging is. |
|
Volders |
Oncologische chirurg |
* Bestuurslid werkgroep Mammachirurgie NVCO - onbetaald |
Geen |
|
Van der Sangen |
Radiotherapeut-oncoloog, afdeling Radiotherapie, Catharina Ziekenhuis Eindhoven |
Bestuurslid BOOG (Borstkanker Onderzoeksgroep Nederland), onbetaald |
NVRO/IKNL - Retrospectief onderzoek naar het gebruik van radiotherapie in Nederland - Geen projectleider |
Clusterexpertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
|
Bavelaar-Croon |
Nucleair Geneeskundige - Ziekenhuis Gelderse Vallei in Ede |
* Voorzitter werkgroep mammacarcinoom NVNG (Nederlandse Vereniging Nucleaire Geneeskunde) |
Geen |
|
Imhof-Tas |
Mammaradioloog en screeningsradioloog Radboud UMC (100%) |
Geen |
Geen |
|
Obdeijn |
Mammaradioloog in het Erasmus MC |
Geen |
* ZonMw - KWF, Sisters Hope, Pink Ribbon Stichting… - MRI versus mammography for breast cancer screening in women with familial risk (FAMRIsc: a multicentre randomised, controlled trial (Lancet Oncology 2019) |
|
Wijers |
Mamma- en neuroradioloog Alrijne Zorggroep (Leiderdorp - Leiden - Alphen) |
* Lid NABON |
In 2020 een vergoeding van €1270,00 ontvangen van Bayer. |
|
Collée |
Klinisch geneticus, Erasmus MC Rotterdam |
Geen |
* KWF - Nationwide infrastructure integrating research and health care to improve management for Dutch women with familial breast cancer risk Infrastructure Initiatives – * KWF Building in the Archipelago of Ovarian Cancer Research - Geen projectleider |
|
Rossum, van |
Laboratorium specialist Klinische Chemie, Afdeling Algemeen Klinisch Laboratorium Antoni van Leeuwenhoek Ziekenhuis Amsterdam |
* Eigenaar en directeur Huvaros B.V. (onbetaald) |
* Health Holland - Subsidie voor vingerprik bloedafname systeem voor Covid-19 serologie - Projectleider
|
|
Bock, de |
Hoogleraar oncologische epidemiologie en interim afdelingshoofd afdeling Epidemiologie van het UMCG (voltijds aanstelling) |
* Lid werkgroep herziening richtlijn familiaire en erfelijke eierstokkanker |
* W.J. Thijnstichting - STIC, het begin of het einde - Projectleider samen met gynaecoloog
|
|
Bos, van den |
Internist-ouderengeneeskunde LUMC |
Voorzitter kerngroep ouderen NIV (onbetaald) |
SKMS - Keuzehulpen nij patiënten met multimorbiditeit - Projectleider
|
|
Verseveld |
* Bestuurslid Nederlandse Vereniging voor fysiotherapie bij Lymfologie en Oncologie, portefeuilehouder Wetenschap Oedeem en Oncologie: 8 uur per week |
* NVFL: vrijwillige functie |
Geen |
|
Loo |
Radioloog, gespecialiseerd mammaradiologie & screening BVO (regio midden west). NKI-AVL (Nederlands Kanker Instituut, Antoni van Leeuwenhoek) en BVO midden west |
* Wetenschappelijke cie NBCA (deels betaals/vacatie) |
In 2019 een vergoeding van €1749,00 ontvangen van Bayer. |
|
Meeuwis |
Mammaradioloog Ziekenhuis Rijnstate |
* NABON - werkgroep standaardisatie verslaglegging (onbetaald) |
* SENO medical - Echografie gecombineerd met laserlicht voor de diagnostiek bij verdachte massa's in de borst - Projectleider
|
|
Louwe |
Gynaecoloog, 0,9 aanstelling Leids Universitair Medisch Centrum |
Geen |
Geen |
|
Graaf, de |
Internist-oncoloog MCL |
Lid commissie kwaliteit NVMO. Medisch manager Oncologisch Netwerk Friesland (ONF) Coach Coassistenten Lid raad van toezicht zorg en welzijn |
Geen |
|
Jager |
Internist-oncoloog Erasmus MC Kanker Instituut Rotterdam |
* Voorzitter Stichting BOOG (Borstkanker onderzoeksgroep) - onbezoldigd |
* KWF - Prediction of Breast Cancer chemotherapy response in patients by determination of chemosensitivity in tumor tissue ex vivo - Projectleider In 2019 een vergoeding van €980,00 ontvangen van Roche Pharma. |
|
Strobbe |
Borstkankerchirurg CWZ Nijmegen fulltime staflid |
Geen |
Geen |
|
Maduro |
Radiotherapeut oncoloog, Universitaire Medische Centrum Groningen en Prinses Maxima Centrum voor kinderoncologie |
Bestuur BOOG, onbetaald |
EU - HARMONIC, gevolgen straling bij kinderen - Geen projectleider
|
|
Boersma |
Radiotherapeut-oncoloog Maastro, Maastricht |
* Klinische werkzaamheden en wetenschappelijke werkzaamheden * Voorzitter van Landelijk Platform Protonentherapie en lid van commissie kwaliteit NVRO |
ZonMw - MOVE project: verbeteren zorgpaden protonentherapie; SKMS project: INNOVATE: verbeteren implementatie van innovaties. KWF: Descartes studie: de-escalatie van bestraling bij patiënten met pCR na Neoadjuvante chemotherapie
|
|
Scholten |
Radiotherapeut-oncoloog, NKI-AVL |
- |
KWF - PPAPBI-2 trial - Projectleider
|
|
Postma |
Oncologisch chirurg Antonius Ziekenhuis Nieuwegein |
Geen |
Geen |
|
Uden |
Fellow chirurgische oncologie: per 17-1-2022 te Gelre Ziekenhuizen (hiervoor fellow chirurgische oncologie in het Rijnstate Ziekenhuis) |
Niet van toepassing |
Onbetaald en ongefinancierd promotie onderzoek naar inflammatoir mammacarcinoom: nu geen aandachtspunt voor de revisie. |
|
Bijker |
Radiotherapeut-oncoloog Amsterdam UMC |
* Kartrekker lateralisatie mammazorg AmsterdamUMC, onbetaald |
* KWF 12900 - Reduction of organ motion during radiotherapy by non-invasive mechanical ventilation supported berating control - Geen projectleider
|
|
Kroep |
Internist-Oncoloog, LUMC |
Betaald adviseurschap: AstraZeneca, GSK, Eisai, Lilly, MSD, Novartis |
* AstraZeneca - FAB, DOMEC en MMRd-GREEN studie; behandeling ovariumca (FAB) en endometrium carcinoom (DOMEC en MMRd-GREEN) drugs (olaparib, durvalumab) en onregstricted grant - Projectleider * Novartis - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. ribociclib en unregstricted grant - Projectleider * Philips - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. unrestricted grant - Projectleider |
|
Woerdeman |
Plastisch chirurg Antoni van Leeuwenhoek Amsterdam |
* Hoofd afdeling plastische chirurgie Antoni van Leeuwenhoek |
Dutch Cancer Society, Grand/Award Number: - Ontwikkeling borst reconstructie keuzehulp - Projectleider
|
|
Esterik, van |
Tot 2014 zelfstandige als Invalbakker |
* Brood en Banker Bakker |
Geen |
|
Scholten, M |
* Belangenbehartiger bij BVN (Borstkankervereniging), 50% |
* Zitting in Medische Advies Raad Parkinsonvereniging (vrijwillig) |
Geen |
|
Hoynck van Papendrecht |
Vrijwilligster BVN |
* Gepensioneerd arts |
Geen |
|
Bekers |
Patholoog, Antoni van Leeuwenhoek Ziekenhuis |
Geen |
Geen |
|
Zoetbrood |
|
|
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de Borstkankervereniging Nederland (BVN) uit te nodigen voor de invitational conference en de werkgroep. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan BVN en de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK). De eventueel aangeleverde commentaren zijn bekeken en waar mogelijk verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er [waarschijnlijk geen/ mogelijk] substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module HER2-gerichte therapie in adjuvante setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met HER2-positieve borstkanker) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module HER2-gerichte therapie in gemetastaseerde setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met HER2-positieve borstkanker) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module immuuntherapie in gemetastaseerde setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker en indicatie immuuntherapie in gemetastaseerde setting) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module directe borstreconstructie en radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker, directe borstreconstructie en radiotherapie) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module uitgestelde borstreconstructie en radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker, uitgestelde borstreconstructie en radiotherapie) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module nacontrole: detectie van nieuwe carcinoom manifestaties |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>5.000 patiënten jaarlijks in nacontrole voor borstkanker), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Phyllodestumoren – beeldvorming en pathologie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren - radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren – resectiemarges |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren – systemische therapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Phyllodestumoren - nacontrole |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module screening buiten het bevolkingsonderzoek tijdens zwangerschap en borstvoeding |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met indicatie screening buiten het bevolkingsonderzoek tijdens zwangerschap en borstvoeding) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module immuuntherapie in neoadjuvante setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker en indicatie immuuntherapie in neoadjuvante setting) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep schriftelijk de knelpunten in de zorg voor patiënten met borstkanker. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model met behulp van Review Manager 5.4. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
