HER2-positieve borstkanker - Anti-HER2 therapie
Uitgangsvraag
Wat is de optimale behandeling met human epidermal growth factor receptor (HER)2-gerichte therapie bij vrouwen met HER2-positieve borstkanker in de adjuvante setting?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de plaats van trastuzumab emtansine (T-DM1) bij de behandeling van vrouwen met HER2-positieve borstkanker in de adjuvante setting?
- Wat is de plaats van zes maanden adjuvante HER2-gerichte therapie in vergelijking met twaalf maanden adjuvante HER2-gerichte therapie bij vrouwen met HER2-positieve borstkanker?
Aanbeveling
Aanbeveling 1
Behandel patiënten met nog aanwezig invasief HER2-positief mammacarcinoom (geen pathologische complete remissie) na neoadjuvante behandeling met chemotherapie en HER2-blokkade bij voorkeur adjuvant met T-DM1 in plaats van adjuvant trastuzumab. Bespreek en vervolg de mogelijke bijwerkingen met de patiënt waarbij aangegeven wordt dat de bijwerkingen van T-DM1 meer kunnen zijn dan die van alleen trastuzumab.
Aanbeveling 2
Behandel patiënten met een stadium I of II invasief HER2-positief mammacarcinoom met een pathologische complete remissie na neoadjuvante behandeling met chemotherapie en HER2-blokkade met totaal zes maanden trastuzumab in plaats van 12 maanden. De behandelduur van stadium III invasief HER2-positief mammacarcinoom met een pathologische complete remissie na neoadjuvante behandeling blijft totaal 12 maanden trastuzumab.
Aanbeveling 3
Geef bij een volledig adjuvante behandeling van een invasief HER2-positief mammacarcinoom (pT1N0) trastuzumab voor een totale behandelingsduur van 12 maanden.
Overweeg bij een volledig adjuvante behandeling op individuele basis bij geselecteerde patiënten met een zeer laag risico HER2-positief mammacarcinoom (pT1N0) en/of bij patiënten met cardiale toxiciteit een behandelduur van 6 maanden trastuzumab.
Overwegingen
Deelvraag 1 - Plaats van T-DM1 bij behandeling in adjuvante setting
Met betrekking tot de eerste deelvraag waar de behandeling met adjuvant T-DM1 vergeleken wordt met behandeling met trastuzumab bij patiënten met nog aanwezige restziekte (geen pathologisch complete respons) na neoadjuvante behandeling met chemotherapie en anti-HER2 therapie, heeft de commissie beoordeling van oncologische middelen (BOM) een advies opgesteld op basis van de resultaten van de KATHERINE trial (Von Minckwitz, 2019). Er is daarna nog een studie gepubliceerd met beschrijvende data over bijwerkingen en subgroep analyses voor ziektevrije overleving (Mamounas, 2021).
Voor beide cruciale uitkomstmaten (algehele overleving en ziektevrije overleving) zijn uitkomsten gerapporteerd.
Met betrekking tot invasieve ziektevrije overleving is het gerapporteerde verschil tussen de behandelgroepen klinisch relevant. De geschatte 3-jaars invasieve ziektevrije overleving in de T-DM1 behandelgroep was 88.3 procent en in de trastuzumab behandelgroep 77.0 procent. Adjuvante behandeling met T-DM1 leidt tot een significante verbetering van invasieve ziektevrijeoverleving (iDFS) in vergelijking met adjuvante behandeling met trastuzumab (HR: 0,50 [95%-BI: 0,39-0,64]; P < 0,001). In de groep patiënten in de neoadjuvante setting behandeld met trastuzumab gecombineerd met andere HER2-gerichte therapie (lees: pertuzumab) bedroeg de 3-jaars-iDFS 90,9 procent in de T-DM1- groep en 81,8 procent in de trastuzumab-groep (HR: 0,54 [95%-BI: 0,27-1,06]). Het betreft hier een kleine subgroep (13 procent), terwijl duale Her2-blokkade met chemotherapie in Nederland de meest gebruikelijke neoadjuvante behandeling is. Meer dan driekwart van de patienten (76,9%) had neoadjuvant een antracycline gehad, terwijl een antracycline-vrij neoadjuvant chemotherapie schema in Nederland inmiddels gebruikelijk is. De verbetering in iDFS met adjuvant T-DM1 was ongeacht hormoonreceptor-status (HR 0.48 en 0.50 voor hormoonreceptor-positieve respectievelijk hormoonrecpetor-negative ziekte), ypN status of type neoadjuvante chemotherapie (wel of niet met antracyclines). In 77 patienten met cT1 cN) tumoren werd ook een voordeel van T-DM1 gezien. Met een mediane follow-up van 41 maanden zijn de data van de totale overleving echter nog onvoldoende matuur. Voor de algehele overleving was het verschil tussen de behandel groepen niet klinisch relevant. In de T-DM1 behandel groep zijn 42 patiënten (5.7%) overleden en in de trastuzumab behandelgroep zijn er 56 patiënten (7.5%) overleden.
Toxiciteit is uitgebreid onderzocht in de KATHERINE trial. Er was sprake van vroegtijdig staken van de behandeling bij 28,5 procent van de patiënten in de T-DM1- groep en bij 18,2 procent van de patiënten in de trastuzumab-groep (BOM, 2019). Bij 17,9 procent van de patiënten in de T-DM1-groep en bij 2 procent van de patiënten in de trastuzumab-groep waren bijwerkingen daarvan de oorzaak. De meest gerapporteerde bijwerkingen van graad 3-4 in de T-DM1-groep waren trombocytopenie (3,6 procent), hypertensie (2 procent), bestralingsgerelateerde huidklachten (1,4 procent), neutropenie (0,7 procent), neuropathie (1,4 procent), hypokaliëmie (1,2 procent), moeheid (1,1 procent) en anemie (1,1 procent). Neuropathie werd gerapporteerd door 18,6 procent van de patiënten in de T-DM1-groep en door 6,9 procent van de patiënten in de trastuzumab-groep, dit was bij driekwart tijdelijk. Er was een aanzienlijke cross-over (bijna 10 procent) van T-DM1 naar trastuzumab
vanwege bijwerkingen.
De commissie BOM geeft een voorlopig positief advies over adjuvant T-DM1. Er zijn meer bijwerkingen bij behandeling met T-DM1 dan met trastuzumab. Slechts 18 procent van de
patiënten in de studie kreeg neoadjuvant duale HER2- blokkade, hetgeen in Nederland wel gebruikelijk is. Als de totale overlevingsdata met een minimale follow-up van 3 jaar bekend worden, zullen de resultaten van de studie opnieuw beoordeeld worden.
Deelvraag 2 – 6 versus 12 maanden adjuvante behandeling
Met betrekking tot de tweede deelvraag is gekeken of adjuvante behandeling voor de duur van zes maanden met HER2-gerichte therapie met trastuzumab non-inferieur is aan een behandelduur van twaalf maanden bij vrouwen met HER-2 positief mammacarcinoom. Hier
Zijn meerdere systematische literatuuronderzoek gedaan waarvan de twee meest recente, die ook een meta-analyse hebben verrichten, beschreven worden (Gulia 2020, Wang, 2021). Vijf gepubliceerd meta-analyses van studies naar 6 versus 12 maanden adjuvant trastuzumab zijn om methodologische redenen geexcludeerd in de zoekvraag van deze module (Goldvaser 2017, Chen 2019, Deng 2020, Ma 2021, Earl 221). Met uitzondering van Earl gaven 4 meta-analyses eenzelfde conclusie als de meta-analyses van Wang en Gulia en beoordeelden 6 maanden trastuzumab als niet non-inferieur aan een behandelduur van 12 maanden. De studie van Gulia omvat individuele patient resultaten van de PERSEPHONE studie, de HORG studie, de PHARE studie (6 vs 12 maanden trastuzumab) en van 3 studies die een nog kortere duur van trastuzumab onderzochten (SOLD, Short-HER, and E 2198). Gulia et al hebben zelf de non-inferiority grens gedefinieerd op basis van de gemiddelde non-inferiority marges van de zes geanalyseerde studies resulterend in een bovenste non-inferiority grens van 1,30. Van de studies waren de individuele resultaten beschikbaar van in totaal 11.736 patiënten met 5-jr DFS van 85.42% versus 87.12% voor respectievelijk 6 en 12 maanden adjuvante trastuzumab met een HR van 1,14 (95%CI 1,03 -1,25) en daarmee in deze meta-analyse dus aangetoond dat 6 mnd adjuvant trastuzumab niet inferieur is aan 12 maanden trastuzumab. Voor de totale overleving wordt geen non-inferiority marge beschreven. Wel toonde deze studie dat de 5 jaars totale overleving over de vijf studies 92,39% versus 93,46% was met een HR van 1,17 (95% CI 1,02-1,33).
In het artikel van Wang et al werden drie afzonderlijke gerandomiseerde studies besproken (PERSEPHONE studie, Earl, 2019; HORG studie, Mavroudis, 2015; PHARE studie, Pivot, 2019). Zij hebben een non-inferiority marge beschreven die zij zouden gaan hanteren voor de beoordeling van non-inferiority voor primaire (DFS) als ook het secundaire (totale overleving) eindpunt. Voor het primaire eindpunt was dit een bovenste non-inferiority grens van 1.20; voor het secundaire eindpunt was dit een bovenste non-inferiority grens van 1.40.
Voor beide cruciale uitkomstmaten (algehele overleving en ziektevrije overleving) zijn uitkomsten gerapporteerd. Voor de DFS was de HR 1.18 (95%CI 0.97-1.44), en toonde deze meta-analyse dus niet een non-inferiority.
Betreffende de drie afzonderlijke studies van 6 versus 12 maanden trastuzumab zijn met een mediane follow-up van 4.3 jaar (HORG studie) en 5.4 jaar (PERSEPHONE studie) de data van de totale overleving nog onvoldoende matuur. Alleen de PHARE studie van Pivot had een langere mediane follow-up van 7.5 jaar (Pivot, 2019). Alle drie de studies hadden een langzame inclusie (5-8 jaar) en includeerden voornamelijk patiënten die primair geopereerd waren en vervolgens adjuvant chemotherapie en trastuzumab kregen. Alleen in de PERSEPHONE studie zijn ook patiënten geincludeerd na neo-adjuvante anti-HER2 therapie (15%) (Earl, 2019). De drie genoemde studies includeerden deels een groep patiënten met laag-risco ziekte met T1 (40-45%) N0 (55-60%) tumoren waarbij een aanzienlijk deel (42-53%) sequentieel adjuvant chemotherapie en trastuzumab kregen. De Engelse PERSEPHONE studie was met ruim 4000 patienten de grootste studie en heeft in de meta-analyses dus de grootste impact. In deze studie, die 8 jaar duurde, had 47% een T1 tumor en 59% N0 ziekte en werd 53% sequentieel eerst met chemotherapie en vervolgens met trastuzumab behandeld. In een geplande subgroep-analyse van de PERSPHONE studie werd voor een concurrent schema een significant DFS voordeel van 12 maanden trastuzumab gevonden (HR 2.47 (95% CI 1.31-4.62).
Voor de algehele overleving werd in de meta-analyse van Wang geen klinisch relevant verschil gevonden tussen 6 of 12 maanden adjuvante behandeling met HER2-gerichte therapie met trastuzumab (Wang, 2021).
Voor ziektevrije overleving is er een weliswaar klein maar klinisch relevant verschil gevonden tussen zes en twaalf maanden behandeling waarbij er een voordeel wordt gevonden voor twaalf maanden adjuvante behandeling met HER2-gerichte therapie. In de HORG studie was de 3-jaars ziektevrije overleving met 12 maanden trastuzumab 95.7 procent en in de 6 maanden behandel groep 93.3 procent (HR 1.57; 95%CI 0.86 – 2.10) (Mavroudis, 2015). De PHARE studie vond na een mediane follow-up van 7.5 jaar met 12 maanden trastuzumab een ziektevrije overleving van 79.6 procent en in de 6 maanden behandel groep 78.8 procent (HR 1.08; 95%CI 0.93 -1.25) (Pivot, 2019). In de PERSEPHONE studie was de 4-jaars ziektevrije overleving met 12 maanden trastuzumab 89.8 procent en in de 6 maanden behandel groep 89.4 procent (HR 1.07; 95%CI 0.93 – 1.24) (Earl, 2019). Te vermelden valt dat het gevonden verschil in DFS in de studies in absolute zin voor de hele groep beperkt is (<2%), maar dat bij eenzelfde Hazard Ratio het verschil in absolute zin groter is bij een hoger risico op recidief ziekte. In de onderzochte studies is het aantal patienten met hoog risico ziekte (stadium III) sterk ondervertegenwoordigd.
Een gepoolde analyse van Swain et al van 1763 patiënten uit 5 gerandomiseerde neoadjuvante trials met neoadjuvante HER2-gerichte therapie met een mediane follow-up van ruim 5 jaar toont dat patiënten met een pCR veel minder kans op recidief ziekte hebben (HR EFS = 0.35; 95% CI: 0.27–0.46) dan patienten zonder een pCR, maar laat ook duidelijk zien dat de 5 jaars DFS bij stadium 3 ziekte met een pCR met geschat 81% duidelijk slechter is dan de geschatte 5 jaars DFS van 93% bij stadium 2 ziekte met een pCR (Swain, 2022). De studie van Mackelenberg bevestigt dat de overleving na neoadjuvante HER2-gerichte therapie afhangt van het bereiken van een pCR en ook bij pCR minder goed is bij een hoger cTcN stadium van ziekte ten tijde van de diagnose (Mackelenberg, 2023).
De EBCTCG meta-analyse van 7 gerandomiseerde studies met adjuvant trastuzumab bij 13864 patiënten met een mediane follow-up van bijna 11 jaar bevestigt de effectiviteit en veiligheid van adjuvant 12 maanden trastuzumab, met een derde minder recidief ziekte en een derde minder borstkanker-gerelateerde sterfte (EBCTCG, 2021). Ook hier is de winst in absolute zin grote bij een hoger stadium ziekte (5 jaars winst in DFS voor N0 ziekte 5.7%, 5 jaars winst in DFS voor N4+ ziekte 10.7%).
Bij patiënten met HER2-positief mammacarcinoom die primair geopeerd zijn en die vervolgens alleen adjuvant behandeld worden zijn de uitkomsten bij een hoger stadium minder goed dan bij stadium I (met goede resultaten van het Tolaney schema), en ontbreekt informatie wie een pCR gehad zouden kunnen hebben evenals de mogelijkheid van aanvullende behandeling met pertuzumab en/of T-DM1.
Waarden en voorkeuren van patiënten (en hun verzorgers)
Patiënten hechten waarde aan overleving afgezet tegen het effect van de behandeling op de kwaliteit van leven. Om een goede keuze te kunnen maken HER2-gerichte therapie is het beschikken over de juiste informatie essentieel. Door goede voorlichting over de overleving en de te verwachten voor- en nadelen, kan in gesprek (volgens het principe van samen beslissen en bij voorkeur met behulp van een (te ontwikkelen) keuzehulp) tussen behandelaar en de patiënt een keuze gemaakt worden. Ook moeten patiënten de mogelijkheid geboden worden om eerst nog na te denken over het behandelplan (time out).
Kosten (middelenbeslag)
De commissie BOM heeft in het rapport over de behandeling met adjuvant T-DM1 de kosten voor behandeling met T-DM1 beschreven en de kosten voor behandeling met trastuzumab (BOM, 2019). De beroepsvereniging Nederlandse Vereniging voor Medische Oncologie (NVMO) stelt dat bij een positief advies van de commissie BOM er een indicatie is voor de adjuvante behandeling met T-DM1 en dat de effecten de extra middelen waard zijn.
Rationale aanbeveling 1
De behandeling van het HER2-positief mammacarcinoom na neoadjuvante behandeling zal worden aangepast.
Dit betreft een intensivering van de behandeling bij patiënten die geen pathologische complete remissie hebben na de neoadjuvante behandeling door toevoeging van 14 kuren T-DM1 in adjuvante setting in plaats van voortzetten van trastuzumab.
Rationale aanbeveling 2
De behandeling van het HER2-positief mammacarcinoom zal een de-escalatie bevatten van de behandeling bij patiënten met een stadium I of II invasief HER2-positief mammacarcinoom die een pathologische complete remissie hebben na de neoadjuvante behandeling door zes maanden trastuzumab te geven in plaats van 12 maanden.
Rationale aanbeveling 3
Bij volledige adjuvante behandeling (dus zonder neo-adjuvante behandeling) blijft het advies om totaal 12 maanden trastuzumab te geven daar er geen onderscheid gemaakt kan worden op basis van de respons op therapie. Op individuele basis kan bij geselecteerde patiënten met een zeer laag risico HER2-positief mammacarcinoom (pT1N0) en/of bij patiënten met cardiale toxiciteit gekozen worden voor een behandelduur van 6 maanden anti-HER2 therapie met trastuzumab.
Onderbouwing
Achtergrond
De commissie beoordeling van oncologische middelen (BOM) heeft trastuzumab emtansine als adjuvante behandeling bij HER2-positieve borstkanker beoordeeld maar deze beoordeling is nog niet in de richtlijn opgenomen. Onderzocht is of behandeling met adjuvant T-DM1 bij patiënten met vroegstadium HER2-positief mammacarcinoom met nog aanwezige restziekte (geen pathologisch complete respons) na neoadjuvante behandeling met chemotherapie en anti-HER gerichte therapie betere uitkomsten geeft dan behandeling met adjuvant trastuzumab. Daarnaast is de duur van de adjuvante trastuzumab bij HER2-positief mammacarcinoom onderzocht. In de richtlijn uit 2017 wordt een totale duur van 12 maanden HER2-gerichte therapie met trastuzumab aanbevolen in de (neo)adjuvante setting bij HER2-positief mammacarcinoom. Gezien het belang van de-escalatie, de belasting voor de patiënt en dagbehandeling en mogelijke (cardiale) bijwerkingen is de vraag of HER2-gerichte therapie ook korter gegeven kan worden.
Conclusies / Summary of Findings
1. Trastuzumab emtansine (T-DM1) compared with trastuzumab
Overall survival
|
Very low GRADE |
The evidence is very uncertain about the effect of adjuvant treatment with T-DM1 on overall survival when compared with treatment with trastuzumab in patients with residual disease after neoadjuvant treatment for HER2-positive breast cancer.
Source: Von Minckwitz (2019) |
Disease-free survival
|
Low GRADE |
Adjuvant treatment with T-DM1 may increase disease-free survival when compared with treatment with trastuzumab in patients with residual disease after neoadjuvant treatment for HER2-positive breast cancer.
Source: Von Minckwitz (2019) |
Toxicity
|
Low GRADE |
Adjuvant treatment with T-DM1 is likely to result in more toxicity when compared with treatment with trastuzumab in patients with residual disease after neoadjuvant treatment for HER2-positive breast cancer.
Source: Von Minckwitz (2019); Mamounas (2021) |
Quality of life
|
No GRADE |
|
2. Six months HER2 therapy compared with twelve months HER2 therapy
Overall survival
|
Moderate GRADE |
Six months of adjuvant HER2-targeted therapy likely results in little to no difference in overall survival when compared with twelve months adjuvant HER2-targeted therapy in patients with HER2-positive early breast cancer.
Source: Wang, 2021 |
Disease-free survival
|
Moderate GRADE |
Six months of adjuvant HER2-targeted therapy may result in a lower disease-free survival when compared with twelve months adjuvant HER2-targeted therapy in patients with HER2-positive early breast cancer.
Source: Wang, 2021 |
Toxicity
|
Low GRADE |
Six months of adjuvant HER2-targeted therapy is likely to result in little to no difference in toxicity when compared with twelve months of adjuvant HER2-targeted therapy in patients with HER2-positive early breast cancer.
Source: Wang, 2021 |
Quality of life
|
No GRADE |
|
Samenvatting literatuur
Description of studies
1. Trastuzumab emtansine (T-DM1) compared with trastuzumab
Von Minckwitz (2019) performed an international multicentre open-label phase III trial (the KATHERINE trial). Women with histologically confirmed HER2-positive, non-metastatic, invasive primary breast cancer and residual disease (no pathologic complete response (pCR)) after completion of at least six cycles of conventional preoperative chemotherapy containing a minimum of nine weeks of taxane-based therapy and nine weeks of trastuzumab therapy were randomly assigned to adjuvant treatment with trastuzumab emtansine (T-DM1) or adjuvant treatment with trastuzumab. The T-DM1 treatment consisted of fourteen cycles of 3.6 milligram T-DM1 per kilogram bodyweight, intravenously administered every three weeks. Trastuzumab treatment consisted of fourteen cycles of 6 milligram trastuzumab per kilogram bodyweight, intravenously administered every three weeks.
An interim analysis was performed when approximately 67% of the expected invasive-disease events had occurred. At that point, the early stopping boundary for benefit of T-DM1 was crossed and a full analysis was performed. The target sample size of 1484 patients was reached. The T-DM1 group consisted of 743 patients with a median age of 49 years. The trastuzumab group consisted of 743 patients with a median age of 49 years. Median follow-up in the Katherine study was 41 months. Approximately 80 percent of the women in the study population received neoadjuvant HER2-targeted therapy with trastuzumab alone. Neoadjuvant HER2-targeted therapy of trastuzumab plus pertuzumab was administered to 17.9 percent of the women in the T-DM1 group and in 18.7 percent of the trastuzumab group. Neoadjuvant HER2-targeted therapy of trastuzumab plus other HER2-targeted therapies were administered to 1.1 percent of the women in the T-DM1 group and 1.3 percent in the trastuzumab group.
All 14 cycles of assigned therapy were completed in 71.4% of patients who received T-DM1 and 81.0% of patients who received trastuzumab. Of 133 patients who discontinued T-DM1 early, 71 switched to trastuzumab of whom 63 completed a total of 14 cycles of HER2-targeted treatment.
Von Minckwitz (2019) reported overall survival, disease-free survival and toxicity.
Mamounas (2021) performed descriptive analyses using the data of the KATHERINE trial as described by Von Minckwitz (2019). Inclusion and exclusion criteria and intervention and control treatment were as reported by Von Minckwitz (2019). Mamounas performed safety analyses using the safety population of the KATHERINE trial.
Mamounas (2021) reported treatment-emergent peripheral neuropathy, treatment-emergent thrombocytopenia and pulmonary toxicity.
2. Six months HER2 therapy compared with twelve months HER2 therapy
Wang (2021) performed a systematic review of the literature. Prospective Randomized Controlled Trials (RCT) which included patients diagnosed as early-stage HER2-positive breast cancer and which compared six months trastuzumab 6mg/kg bodyweight after a loading dose of 8 mg/kg intravenously with twelve months trastuzumab 6 mg/kg bodyweight after a loading dose of 8 mg/kg intravenously were included in this review. This search was performed to identify relevant articles up to January 2020. Wang (2021) included three multicenter open-label phase III trials (Pivot, 2019; Earl, 2019; Mavroudis, 2015). Wang (2021) performed a risk of bias assessment using the Cochrane Risk of Bias Tool.
In total 7,954 patients were included in the analysis. The mean age ranged from 54 to 56. In two studies, patients received different types of concomitant of following chemotherapy regimens including taxane and anthracycline, anthracycline only, taxane only or without taxane or anthracycline (Pivot, 2019; Earl, 2019). One study only used one chemotherapy regimen which consisted of epirubicin, cyclophosphamide and 5-fluorouracil (Mavroudis, 2015). One study used six milligrams per kilogram trastuzumab (Mavroudis, 2015) while the other two studies used an initial dose of eight milligrams per kilogram trastuzumab (Pivot, 2019; Earl, 2019).
Median follow-up was between 3.9 and 7.5 years. Wang (2021) performed a meta-analysis regarding the outcomes overall survival, disease-free survival and toxicity.
Results
1. Trastuzumab emtansine (T-DM1) compared with trastuzumab
Overall survival
Von Minckwitz (2019) reported three-year overall survival. In the T-DM1 group 42 deaths (5.7%) were reported and in the trastuzumab group 56 deaths (7.5%) (HR 0.70 [95%CI 0.47-1.05]). This difference is not clinically relevant.
Disease-free survival
Von Minckwitz (2019) reported three-year invasive disease-free survival which was defined as time from randomization until the date of first occurrence of one of the following: Recurrence of ipsilateral invasive breast tumor, recurrence of ipsilateral locoregional invasive breast cancer, contralateral invasive breast cancer, a distant disease recurrence or death from any cause. The estimated three-year invasive disease-free survival rate was 88.3 percent in the T-DM1 group and 77.0 percent in the trastuzumab group (HR 0.50 [95%CI 0.39-0.64]). This difference is clinically relevant.
Von Minckwitz (2019) performed a subgroup analysis regarding invasive-disease events for women who received trastuzumab plus additional HER2-directed agents. For 13 patients (9%) in the T-DM1 group an invasive-disease event occurred and for 24 patients (16%) in the trastuzumab group HR 0.54 [95%CI 0.27-1.06]).
Toxicity
Von Minckwitz (2019) reported adverse events as any adverse events, grade three or higher adverse events, serious adverse events and adverse events leading to death.
Regarding the outcome any adverse events, 731 patients in the T-DM1 group (98.8%) experienced at least one adverse event (98.8%), while 672 patients in the trastuzumab group experienced at least one adverse event (93.3%).
Grade three or higher adverse events were reported for 190 patients (25.7%) patients in the T-DM1 group and for 111 patients (15.4%) in the trastuzumab group.
Serious adverse events were reported for 94 patients (12.7%) in the T-DM1 group and for 58 patients (8.1%) in the trastuzumab group. Adverse events leading to death were reported for one patient (0.1%) in the T-DM1 group and for no patients in the trastuzumab group.
These differences are not clinically relevant.
Mamounas (2021) reported grade three to four treatment-emergent peripheral neuropathy, grade three to four treatment-emergent thrombocytopenia and grade three to four pulmonary toxicity.
Grade three to four treatment-emergent peripheral neuropathy occurred in twelve patients (1.6%) in the T-DM1 group and in one patient (0.1%) in the trastuzumab group.
Grade three to four treatment-emergent thrombocytopenia occurred in 42 patients (5.7%) in the T-DM1 group and in two patients (0.27%) in the trastuzumab group.
Pulmonary toxicity only occurred in patients receiving adjuvant radiotherapy (82.2%). Grade three to four pulmonary toxicity occurred in 21 patients (3.4%) in the T-DM1 group and in six patients (1%) in the trastuzumab group.
This difference is not clinically relevant.
Quality of Life
The included studies did not report quality of life.
2. Six months HER2 therapy compared with twelve months HER2 therapy
Overall survival
Overall survival was reported in all three studies included in the review of Wang (2021) (Pivot, 2019; Earl, 2019; Mavroudis, 2015). The results of the studies are presented in figure 1. The pooled Hazard Ratio (HR) was 1.14 (95%CI 0.98-1.32). Regarding the definition of clinical relevancy as stated in the review of Wang (2021), this difference is not clinically relevant.
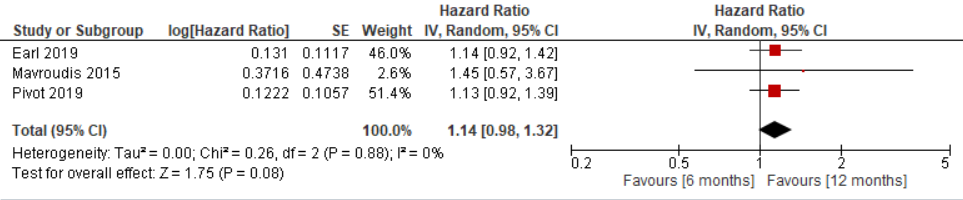
Figure 1. Outcome Overall Survival with 6-months versus 12-months HER2-targeted therapy
Z: p-value of pooled effect; df: degrees of freedom, Tau2: statistical heterogeneity, Chi2: statistical heterogeneity, CI: confidence interval
Disease-free survival
Disease-free survival was reported in all three studies included in the review of Wang (2021) (Pivot, 2019; Earl, 2019; Mavroudis, 2015). The results of the studies are presented in figure 2. The pooled HR was 1.18 (95%CI 0.97-1.44). Regarding the definition of clinical relevancy as stated in the review of Wang (2021), this difference is clinically relevant.
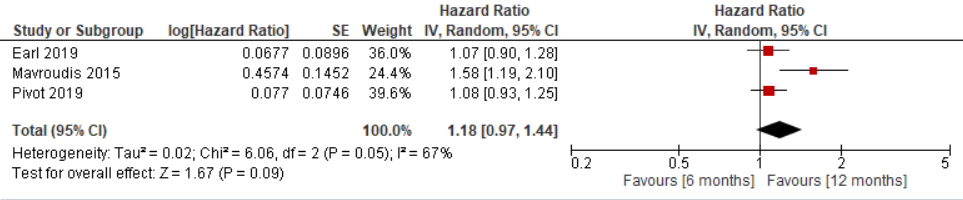
Figure 2. Outcome Disease-free survival with 6-months versus 12-months HER2-targeted therapy
Z: p-value of pooled effect; df: degrees of freedom, Tau2: statistical heterogeneity, Chi2: statistical heterogeneity, CI: confidence interval
Toxicity
The review of Wang (2021) defined toxicity as cardiac toxicity. The study of Pivot (2019) did not find any difference between the treatment groups. The study of Earl (2019) reported clinical cardiac toxicity in eight percent of the patients in the six-months treatment group and in eleven percent of the patients in the twelve-months treatment group.
The study of Mavroudis (2015) reported two patients (0.8%) with cardiac toxicity in the six-months treatment group and no patients in the twelve-months treatment group.
These differences are not clinically relevant.
Quality of Life
None of the studies in the review of Wang (2021) reported outcome measures regarding quality of life.
Level of evidence of the literature
1. Trastuzumab emtansine (T-DM1) compared with trastuzumab
Overall survival
The level of evidence regarding the outcome measure overall survival was downgraded by three level because of study limitations (-1 risk of bias because of potential selective outcome reporting and involvement by the sponsor) and two levels because of imprecision (-2; imprecision because of small number of events and the confidence interval including the possibility of a positive or no effect). Therefore the evidence was graded as very low.
Disease-free survival
The level of evidence regarding the outcome measure disease-free survival was downgraded by two levels because of study limitations (-1 risk of bias because of potential selective outcome reporting and involvement by the sponsor) and number of included patients (-1; imprecision because of small number of events). Therefore the evidence was graded as low.
Toxicity
The level of evidence regarding the outcome measure toxicity was downgraded by two levels because of study limitations (-1; risk of bias because of the lack of blinding, potential selective outcome reporting and involvement by the sponsor) and number of included patients (-1; imprecision because of small number of events). Therefore the evidence was graded as low.
Quality of Life
The level of evidence regarding the outcome measure quality of life could not be assessed by GRADE.
2. Six months HER2 therapy compared with twelve months HER2 therapy
Overall survival
The level of evidence regarding the outcome measure overall survival was downgraded by one level because of number of included patients (-1; imprecision because the confidence interval includes the possibility of no effect or a negative effect).
Therefore the evidence was graded as moderate.
Disease-free survival
The level of evidence regarding the outcome measure disease-free survival was downgraded by one level because of number of included patients (-1; imprecision because the confidence interval is inconclusive about whether the intervention is non-inferior)
Therefore the evidence was graded as moderate.
Toxicity
The level of evidence regarding the outcome measure toxicity was downgraded by two levels because of study limitations (-1; risk of bias regarding lack of blinding and possible sponsor involvement) and number of included patients (-1; imprecision because of small number of events). Therefore the evidence was graded as low.
Quality of Life
The level of evidence regarding the outcome measure quality of life could not be assessed by GRADE.
Zoeken en selecteren
A review of the literature was performed to answer the following question:
1. What is the effect of adjuvant therapy with trastuzumab emtansine (T-DM1) compared with adjuvant therapy with trastuzumab on overall survival, disease-free survival, toxicity and quality of life for women diagnosed with HER2-positive breast cancer?
P: Women diagnosed with HER2-positive breast cancer
I: Adjuvant therapy with trastuzumab emtansine (T-DM1)
C: Adjuvant therapy with trastuzumab
O: Overall survival, disease-free survival, toxicity, quality of life
2. Is six months treatment with adjuvant HER2 therapy non-inferior to twelve months treatment with HER2 therapy for women diagnosed with HER2-positive breast cancer regarding overall survival, disease-free survival, toxicity and quality of life?
P: Women diagnosed with HER2-positive breast cancer
I: Six months adjuvant HER2 therapy
C: Twelve months adjuvant HER2 therapy
O: Overall survival, disease-free survival, toxicity, quality of life
Relevant outcome measures
The guideline development group considered overall survival and disease-free survival as critical outcome measures for decision making and toxicity and quality of life as important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following differences as a minimal clinically (patient) important difference regarding sub question 1:
- Overall survival: >5% or >3% and HR<0.7 (BOM, 2018)
- Disease-free survival: HR<0.7 (BOM, 2018)
- Toxicity: Lethal complications ³5% or serious complications ³25% (BOM, 2016)
- Quality of life: ³ 10 points on the EORTC QLQ-C30 or a difference of a similar magnitude on other quality of life instruments
The working group defined the following differences as a minimal clinically (patient) important difference regarding sub question 2:
- Overall survival: Following study design significant non-inferior (BOM, 2016)
- Disease-free survival: Following study design significant non-inferior
- Toxicity: Lethal complications <5% or serious complications <25% (BOM, 2016)
- Quality of life: < 10 points on the EORTC QLQ-C30 or a difference of a similar magnitude on other quality of life instruments
Search and select (Methods)
1. Trastuzumab emtansine (T-DM1) compared with trastuzumab
Regarding sub question one, the report of the Dutch evaluation committee of oncological drugs (BOM committee) was used to answer this question (BOM, 2019). The BOM committee evaluated the KATHERINE trial (Von Minckwitz, 2019) following the registration of adjuvant T-DM1 by the European Medicines Agency (EMA) registration. Regarding the KATHERINE trial, two follow-up studies (Conte, 2020; Mamounas, 2021) were published with data from the KATHERINE trial after the publishing date of the report of the BOM committee. The study of Conte (2020) reported quality of life but did not comprise follow-up scores to compare quality of life between treatment groups, only mean change from baseline score was reported and therefore, this study was not included in the analysis.
The follow-up study of Mamounas (2021) was included in the analysis of the literature. Besides the outcome toxicity, Mamounas (2021) reported several sub-group analyses regarding invasive disease-free survival and adverse events by type of neoadjuvant chemotherapy treatment regimen.
2. Six months HER2 therapy compared with twelve months HER2 therapy
Regarding sub question two, the databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 07-08-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 133 hits. Studies were selected based on the following criteria:
- The study population had to meet the criteria as defined in the PICO;
- The intervention and comparison had to be as defined in the PICO;
- Reported at least one of the outcomes as defined in the PICO;
- Research type: Systematic review or randomized-controlled trial;
- Articles written in English or Dutch
Eighteen studies were initially selected based on title and abstract screening. After reading the full text, fourteen studies were excluded (see the table with reasons for exclusion under the tab Methods), one systematic review was included which included three RCT’s also included by the working group members.
Results
1. Trastuzumab emtansine (T-DM1) compared with trastuzumab
Two studies were included in the analysis of the literature. Important study characteristics and results are summarized in evidence table 1. The assessment of the risk of bias is summarized in risk of bias table 1.
2. Six months HER2 therapy compared with twelve months HER2 therapy
One systematic review comprising the systematic review of three RCTs, was included in the analysis of the literature. Important study characteristics and results are summarized in evidence table 2. The assessment of the risk of bias is summarized in risk of bias table 2.
Referenties
- 1 - PASKWIL-criteria 2016: palliatieve behandeling. Available from: https://www.nvmo.org/over-de-adviezen/
- 2 - PASKWIL-criteria 2016: non-inferioriteit. Available from: https://www.nvmo.org/over-de-adviezen/
- 3 - PASKWIL-criteria 2018: adjuvante behandeling. Available from: https://www.nvmo.org/over-de-adviezen/
- 4 - Trastuzumab-emtansine als adjuvante behandeling na neoadjuvante chemotherapie en doelgerichte therapy bij het HER2-positief mammacarcinoom. Medische oncologie. 2019. December, 37.
- 5 - Conte P, Schneeweiss A, Loibl S, Mamounas EP, von Minckwitz G, Mano MS, Untch M, Huang CS, Wolmark N, Rastogi P, D'Hondt V, Redondo A, Stamatovic L, Bonnefoi H, Castro-Salguero H, Fischer HH, Wahl T, Song C, Boulet T, Trask P, Geyer CE Jr. Patient-reported outcomes from KATHERINE: A phase 3 study of adjuvant trastuzumab emtansine versus trastuzumab in patients with residual invasive disease after neoadjuvant therapy for human epidermal growth factor receptor 2-positive breast cancer. Cancer. 2020 Jul 1;126(13):3132-3139. doi: 10.1002/cncr.32873. Epub 2020 Apr 14. PMID: 32286687; PMCID: PMC7317721.
- 6 - Earl HM, Hiller L, Vallier AL, Loi S, McAdam K, Hughes-Davies L, Harnett AN, Ah-See ML, Simcock R, Rea D, Raj S, Woodings P, Harries M, Howe D, Raynes K, Higgins HB, Wilcox M, Plummer C, Mansi J, Gounaris I, Mahler-Araujo B, Provenzano E, Chhabra A, Abraham JE, Caldas C, Hall PS, McCabe C, Hulme C, Miles D, Wardley AM, Cameron DA, Dunn JA; PERSEPHONE Steering Committee and Trial Investigators. 6 versus 12 months of adjuvant trastuzumab for HER2-positive early breast cancer (PERSEPHONE): 4-year disease-free survival results of a randomised phase 3 non-inferiority trial. Lancet. 2019 Jun 29;393(10191):2599-2612. doi: 10.1016/S0140-6736(19)30650-6. Epub 2019 Jun 6. PMID: 31178152; PMCID: PMC6615016.
- 7 - Early Breast Cancer Trialists’ Collaborative group (EBCTCG). Trastuzumab for early-stage, HER2-positive breast cancer: a meta-analysis of 13 864 women in seven randomised trials. Lancet Oncol 2021; 22: 1139–50.
- 8 - Gulia S, Kannan S, Badwe R, et al. Evaluation of 1-Year vs Shorter Durations of Adjuvant Trastuzumab Among Patients With Early Breast Cancer. An Individual Participant Data and Trial-Level Meta-analysis. JAMA 2020;3(8):e2011777.
- 9 - Mamounas EP, Untch M, Mano MS, Huang CS, Geyer CE Jr, von Minckwitz G, Wolmark N, Pivot X, Kuemmel S, DiGiovanna MP, Kaufman B, Kunz G, Conlin AK, Alcedo JC, Kuehn T, Wapnir I, Fontana A, Hackmann J, Polikoff J, Saghatchian M, Brufsky A, Yang Y, Zimovjanova M, Boulet T, Liu H, Tesarowski D, Lam LH, Song C, Smitt M, Loibl S. Adjuvant T-DM1 versus trastuzumab in patients with residual invasive disease after neoadjuvant therapy for HER2-positive breast cancer: subgroup analyses from KATHERINE. Ann Oncol. 2021 Aug;32(8):1005-1014. doi: 10.1016/j.annonc.2021.04.011. Epub 2021 Apr 28. PMID: 33932503.
- 10 - Mavroudis D, Saloustros E, Malamos N, Kakolyris S, Boukovinas I, Papakotoulas P, Kentepozidis N, Ziras N, Georgoulias V; Breast Cancer Investigators of Hellenic Oncology Research Group (HORG), Athens, Greece. Six versus 12 months of adjuvant trastuzumab in combination with dose-dense chemotherapy for women with HER2-positive breast cancer: a multicenter randomized study by the Hellenic Oncology Research Group (HORG). Ann Oncol. 2015 Jul;26(7):1333-40. doi: 10.1093/annonc/mdv213. Epub 2015 May 1. Erratum in: Ann Oncol. 2020 Mar;31(3):444-445. PMID: 25935793.
- 11 - Pivot X, Romieu G, Debled M, Pierga JY, Kerbrat P, Bachelot T, Lortholary A, Espié M, Fumoleau P, Serin D, Jacquin JP, Jouannaud C, Rios M, Abadie-Lacourtoisie S, Venat-Bouvet L, Cany L, Catala S, Khayat D, Gambotti L, Pauporté I, Faure-Mercier C, Paget-Bailly S, Henriques J, Grouin JM; PHARE trial investigators. 6 months versus 12 months of adjuvant trastuzumab in early breast cancer (PHARE): final analysis of a multicentre, open-label, phase 3 randomised trial. Lancet. 2019 Jun 29;393(10191):2591-2598. doi: 10.1016/S0140-6736(19)30653-1. Epub 2019 Jun 6. PMID: 31178155.
- 12 - Swain S, Macharia H, Cortes J, et al. Event-Free Survival in Patients with Early HER2-Positive Breast Cancer with a Pathological Complete Response after HER2-Targeted Therapy: A Pooled Analysis. Cancers 2022, 14, 5051.
- 13 - Von Minckwitz G, Huang CS, Mano MS, Loibl S, Mamounas EP, Untch M, Wolmark N, Rastogi P, Schneeweiss A, Redondo A, Fischer HH, Jacot W, Conlin AK, Arce-Salinas C, Wapnir IL, Jackisch C, DiGiovanna MP, Fasching PA, Crown JP, Wülfing P, Shao Z, Rota Caremoli E, Wu H, Lam LH, Tesarowski D, Smitt M, Douthwaite H, Singel SM, Geyer CE Jr; KATHERINE Investigators. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med. 2019 Feb 14;380(7):617-628. doi: 10.1056/NEJMoa1814017. Epub 2018 Dec 5. PMID: 30516102.
- 14 - Wang BC, Xiao BY, Fan JQ, Lin GH, Wang C, Liu Q, Zhao YX. 6 versus 12 months of adjuvant trastuzumab in HER2+ early breast cancer: A systematic review and meta-analysis. Medicine (Baltimore). 2021 Mar 12;100(10):e24995. doi: 10.1097/MD.0000000000024995. PMID: 33725875; PMCID: PMC7969267.
Evidence tabellen
Evidence table 1
Research question: What is the effect of adjuvant therapy with trastuzumab emtansine (T-DM1) compared with adjuvant therapy with trastuzumab on overall survival, disease-free survival, toxicity and quality of life for women diagnosed with HER2-positive breast cancer?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Von Minckwitz, 2019
Mamounas, 2021
(KATHERINE trial) |
Type of study: Randomized phase III trial.
Setting and country: Open label, multicenter study, 28 countries
Funding and conflicts of interest: Funded by Hoffmann-La Roche/Genentech. The sponsor was involved in the design of the trial and review of the results, and the paper was written with assistance from a medical writer paid by the sponsor. |
Inclusion criteria: - Patients with histologically confirmed HER2-positive, non-metastatic, invasive primary breast cancer (clinical tumor stage T1 to T4, nodal stage N0 to N3 and metastasis stage M0 at presentation - Residual invasive disease pathologically detected in the surgical specimen of the breast or axillary lymph nodes after completion of taxane-based neoadjuvant chemotherapy administered with trastuzumab - HER2 status assessed in pre-treatment biopsy samples or surgical sample - Completion of at least six cycles (16 weeks) of a conventional preoperative chemotherapy containing a minimum of 9 weeks of taxane-based therapy and 9 weeks of trastuzumab therapy
Exclusion criteria: - Clinical stage T1aN0 or T1bn0 - Gross residual disease remaining after mastectomy or positive margins after breast-conserving surgery - Progressive disease during neoadjuvant therapy - Cardiopulmonary dysfunction including NYHA class II or higher - History of reduction in the left ventricular ejection fraction to <40% with previous treatment - Prior cumulative anthracycline exposure exceeding a doxorubicin 240 mg/m2 equivalent
N total at baseline: Intervention: 743 Control: 743
Important prognostic factors2: Median age in years (range): I: 49 (24-79) C: 49 (23-80)
Clinical stage at presentation - Inoperable breast cancer: I: N=185 (24.9%) C: N=190 (25.6%)
Operable breast cancer: I: N=558 (75.1%) C: N=553 (74.4%)
Neoadjuvant HER2-targeted therapy – trastuzumab alone: I: N=600 (80.8%) C: N=596 (80.2%)
Trastuzumab plus pertuzumab: I: N=133 (17.9%) C: N=139 (18.7%)
Trastuzumab plus other HER2-targeted therapy: I: N=8 (1.1%) C: N=10 (1.3%)
Adjuvant radiotherapya: C: N=597 (80%)
Groups are comparable at baseline
|
Adjuvant treatment with T-DM1 3,6mg. per kilogram of body weight intravenous every three weeks for 14 cycles. When T-DM1 was discontinued early because of toxic effects, 14 cycles of trial could be completed with trastuzumab.
|
Adjuvant treatment with trastuzumab 6 mg. per kilogram body weight intravenous every three weeks for 14 cycles. A loading dose of 8 mg. of trastuzumab per kilogram was administered if more than 6 weeks had elapsed since the preceding dose of trastuzumab.
|
Length of follow-up: I: Median 41.4 months (range 0.1-62.7) C: Median 40.9 months (range 0.1-62.7)
Loss to follow-up: Intervention: N=108 discontinued study N=42 died N=50 patient decision N=8 lost to follow-up N=3 physician decision N=5 other
Control: N=146 discontinued study N=56 died N=72 patient decision N=12 lost to follow-up N=1 physician decision N=5 other
|
Outcome measures and effect size (include 95%CI and p-value if available):
Overall survival Patients with event: I: N=42 (5.7%) C: N=56 (7.5%) HR 0.70 (95%CI 0.47-1.05)
Invasive disease-free survival Patients with event: I: N=91 (12.2%) C: N=165 (22.2%) HR 0.50 (95%CI 0.39-0.64)
Invasive disease-events in patients who received trastuzumab plus additional HER2-directed agents: I: N=13 (9%) C: N=24 (16%) HR 0.54 (95%CI 0.27-1.06)
Adverse events Any adverse event: I: N=731 (98.8%) C: N=672 (93.3%) RR 1.09 (95%CI 1.04-1.08)
Grade ³ 3 adverse event: I: N=190 (25.7%) C: N=111 (15.4%) RR 1.67 (95%CI 1.35-2.06)
Serious adverse event: I: N=94 (12.7%) C: N=58 (8.1%) RR 1.58 (95%CI 1.16-2.15)
Adverse event leading to death: I: N=1 (0.1%) C: N=0 (0%)
Treatment-emergent peripheral neuropathya All grades: I: N=239 (32.3%) C: N=122 (16.9%)
Grade ³ 3: I: N=12 (1.6%) C: N=1 (0.1%)
Treatment-emergent thrombocytopeniaa All grades: C: N=17 (2.4%)
Grade ³ 3: I: N=42 (5.7%) C: N=2 (0.3%)
Pulmonary toxicity (only in patients who received adjuvant radiotherapy)a Pulmonary toxicity: I: N=21 (3.4%) C: N=6 (1.0%)
Radiation pneumonitis: I: N=11 (52.3%) C: N=5 (83.3%)
Central nervous system (CNS) recurrence eventsa Overall CNS recurrence: I: N=45 (6.1%) C: N=40 (5.4%)
Median time to CNS recurrence in months: I: 17.5 C: 11.9 |
Authors conclusion: In conclusion, in this randomized, phase 3 trial, among patients with HER2-positive early breast cancer who had residual invasive disease after completion of neoadjuvant therapy with a trastuzumab-containing regimen, the risk of recurrence of invasive breast cancer or death was 50% lower with adjuvant T-DM1 than with trastuzumab alone. The homogeneity of benefit was seen across all subgroups. Only 18% of the patients in the study received neoadjuvant dual HER2-blockade
An interim analysis was performed when approximately 67% of the expected invasive-disease events had occurred. At that point, the early stopping boundary for benefit of T-DM1 was crossed and a full analysis was performed. The target sample size of 1484 patients was reached.
All 14 cycles of assigned therapy were completed in 71.4% of patients who received T-DM1 and 81.0% of patients who received trastuzumab.
In the T-DM1 group, 77 patients (10.4%) had one dose-level reduction and 29 (3.9%) had a second dose-level reduction.
Of 133 patients who discontinued T-DM1 early, 71 switched to trastuzumab of whom 63 completed a total of 14 cyclus of HER2-targeted treatment.
|
|
a Data from follow-up study by Mamounas (2021) using data from the KATHERINE trial |
|||||||
Evidence table 2
Research question: Is six months treatment with adjuvant HER2 therapy non-inferior to twelve months treatment with HER2 therapy for women diagnosed with HER2-positive breast cancer regarding overall survival, disease-free survival, toxicity and quality of life?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Wang, 2021
PS. Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to January 2020
A: Pivot, 2019 (PHARE trial) B: Earl, 2019 (PERSEPHONE trial) C: Mavroudis, 2015 (HORG trial)
Study design: RCT [Open label]
Setting and Countrya: A: Multicenter, France B: Multicenter, United Kingdom C: Multicenter, Greece
Source of funding and conflicts of interesta: A: Funding by the French National Cancer Institute. Funder was responsible for data collection but had no role in study design, data analysis or data interpretation. B: Funding by UK National Institue for Health Research, Health Thechnology Assessment Programma. Funder had no role in study design, data collection, data analysis, interpretation or writing of the report. C: Funding by Hellenic Oncology Research Group (HORG).
|
Inclusion criteria SR: - Studies were prospective randomized clinical trials - Patients were diagnosed as early-stage HER2-positive breast cancer - 6 months versus 12 months adjuvant treatment - Studies were full-text articles and published in English
Exclusion criteria SR: - Reviews - Conference abstracts - Study protocols - Single-arm studies - Retrospective studies
Three studies included
Important patient characteristics at baseline:
N, mean age A: I: 1693, 55 years C: 1691, 54 years B: I: 2044, 56 years C: 2045, 56 years C: I: 240, 56 years, C: 241, 56 years
Types of (concomitant with or following) chemotherapy a: A: Taxane and anthracycline: I: N=1229 (72.7%) C: N=1249 (73.9%) Anthracycline only: I: N=262 (15.5%) C: N=268 (15.9%) Taxane only: C: N=171 (10.1%) Without taxane or anthracycline: I: N=3 (0.2%) C: N=2 (0.1%)
B: Taxane and anthracycline based: I: N=991 (49%) C: N=989 (48%) Anthracycline based: I: N=846 (41%) C: N=854 (42%) Taxane based: I: N=203 (10%) C: N=200 (10%) No taxane and no anthracycline: I: N=3 (<1%) C: N=2 (<1%)
C: Only one chemotherapy regimen was used (epirubicin, cyclophosphamide and 5-fluorouracil)
Groups are comparable at baseline |
Intervention:
A: 6 months trastuzumab intravenously 8mg/kg initial, 6mg/kg thereafter B: 6 months trastuzumab either intravenously 8mg/kg initial, 6mg/kg thereafter, or subcutaneously: 600mg C: 6 months trastuzumab intravenously 6 mg/kg, initial 4-6mg/kg thereafter
|
Control:
A: 12 months trastuzumab intravenously 8mg/kg initial, 6mg/kg thereafter B: 12 months trastuzumab intravenously 8mg/kg initial, 6mg/kg thereafter, subcutaneously: 600mg C: 12 months trastuzumab intravenously 6 mg/kg, initial 4-6mg/kg thereafter
|
Median follow-up:
A: 7.5 years B: 5.4 years C: I: 4.3 years C: 3.9 years
For how many participants were no complete outcome data availablea? (intervention/control) Not reported in SR
|
Outcome measure-1 Defined as overall survival
Effect measure: HR [95%CI]: A: 1.13 [0.92-1.39] B: 1.14 [0.92-1.42] C: 1.45 [0.57-3.67]
Pooled effect (random effects model): 1.14 [95% CI 0.92 to 1.32] Heterogeneity (Chi2): 0.26
Outcome measure-2 Defined as disease-free survival
Effect measure: HR [95% CI]: A: 1.08 [0.93-1.25] B: 1.07 [0.90-1.28] C: 1.58 [1.19-2.10]
Pooled effect (random effects model): 1.18 [95% CI 0.97 to 1.44] Heterogeneity (Chi2): 6.06
Outcome measure-3 Defined as cardiac toxicity A: No difference B: I: 8% C: 11% C: I: N=2 (0.8%) C: N=0 (0%)
|
Facultative: Brief description of author’s conclusion: Non-inferiority regarding OS was found for 6- month adjuvant trastuzumab (adjusted HR 1.14, 95% CI 0.98– 1.32, non-inferiority margin = 1.43). Nevertheless, it could not be concluded that 6 months trastuzumab treatment was non-inferior to 12 months treatment, since subsequent-line therapies (e.g. chemotherapy, radiotherapy, endocrine therapy or target-therapy) will be administered after they experience a DFS event Patients in study of Mavroudis (2015) only received one chemotherapy regimen (epirubicin, cyclophosphamide and 5-fluorouracil followed by docetaxel). Patients in other two studies were treated with at least four types of chemotherapy modalities
Sensitivity analyses: Not performed
Heterogeneity: Heterogeneity was found in the analysis of DFS but not OS. Wang (2021) used a random-effect model to solve the heterogeneity. |
|
a Study characteristics extracted from individual studies |
|||||||
Risk of bias table 1
Research question: What is the effect of adjuvant therapy with trastuzumab emtansine (T-DM1) compared with adjuvant therapy with trastuzumab on overall survival, disease-free survival, toxicity and quality of life for women diagnosed with HER2-positive breast cancer?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH |
|
Von Minckwitz, 2019 Mamounas, 2021
KATHERINE trial |
Probably yes
Reason: A permuted-block randomization scheme was used with stratification according to four factors: (1) clinical stage at presentation (2) hormone-receptor status according to local laboratory assessment (3) preoperative HER2-directed therapy (4) pathological nodal status evaluated after neoadjuvant therapy |
Probably yes;
Reason: Central interactive voice-response/web-response system was used |
Definitely no;
Reason: Open-label trial |
Probably yes;
Reason: Loss to follow-up was comparable between treatment groups |
Probably no;
Reason: Compared to the clinical trial registry, not all outcomes were reported (Cardiac dysfunction,).
|
Probably no;
Reason: Involvement of the sponsor in study design, review of the results and writing of the manuscript |
Some concerns (overall survival and disease-free survival)
Some concerns (toxicity) |
Risk of Bias table 2
Based on AMSTAR checklist
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Wang, 2021 |
Yes |
No |
No |
Yes |
Not applicable |
Yes, a Risk of Bias assessment was performed using the Cochrane Risk of Bias tool. Regarding blinding of participants, personnel and outcome assessment a high risk of bias was found. |
Yes |
Yes, publication bias could not be assessed because there were fewer than 10 included studies. |
No, the authors of the review reported no conflicts of interest. This information was not reported for the three RCTs included in the review and was derived from individual studies. |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Chen L, Zhou W, Hu X, Yi M, Ye C, Yao G. Short-duration versus 1-year adjuvant trastuzumab in early HER2 positive breast cancer: A meta-analysis of randomized controlled trials. Cancer Treat Rev. 2019 May;75:12-19. doi: 10.1016/j.ctrv.2019.02.003. Epub 2019 Feb 28. PMID: 30856373. |
No clear search; Included three original RCT’s; Not the most recent SR |
|
Goldvaser H, Korzets Y, Shepshelovich D, Yerushalmi R, Sarfaty M, Ribnikar D, Thavendiranathan P, Amir E. Deescalating Adjuvant Trastuzumab in HER2-Positive Early-Stage Breast Cancer: A Systemic Review and Meta-Analysis. JNCI Cancer Spectr. 2019 May 11;3(2):pkz033. doi: 10.1093/jncics/pkz033. PMID: 31360906; PMCID: PMC6649709. |
No clear search; Included three original RCT’s; Not the most recent SR |
|
Guarneri V, Frassoldati A, Bruzzi P, D'Amico R, Belfiglio M, Molino A, Bertetto O, Cascinu S, Cognetti F, Di Leo A, Pronzato P, Crinó L, Agostara B, Conte P. Multicentric, randomized phase III trial of two different adjuvant chemotherapy regimens plus three versus twelve months of trastuzumab in patients with HER2- positive breast cancer (Short-HER Trial; NCT00629278). Clin Breast Cancer. 2008 Oct;8(5):453-6. doi: 10.3816/CBC.2008.n.056. PMID: 18952561. |
Wrong comparison |
|
Gyawali B, Niraula S. Duration of adjuvant trastuzumab in HER2 positive breast cancer: Overall and disease free survival results from meta-analyses of randomized controlled trials. Cancer Treat Rev. 2017 Nov;60:18-23. doi: 10.1016/j.ctrv.2017.08.001. Epub 2017 Aug 19. PMID: 28863313. |
No clear search; Included three original RCT’s; Not the most recent SR |
|
Hiller L, Dunn JA, Loi S, Vallier AL, Howe DL, Cameron DA, Miles D, Wardley AM, Earl HM. Adjuvant trastuzumab duration trials in HER2 positive breast cancer - what results would be practice-changing? Persephone investigator questionnaire prior to primary endpoint results. BMC Cancer. 2018 Apr 5;18(1):391. doi: 10.1186/s12885-018-4307-8. PMID: 29621991; PMCID: PMC5887251. |
Wrong design: No systematic review |
|
Inno A, Barni S, Ghidini A, Zaniboni A, Petrelli F. One year versus a shorter duration of adjuvant trastuzumab for HER2-positive early breast cancer: a systematic review and meta-analysis. Breast Cancer Res Treat. 2019 Jan;173(2):247-254. doi: 10.1007/s10549-018-5001-x. Epub 2018 Oct 13. PMID: 30317424. |
No clear search; Included three original RCT’s; Not the most recent SR |
|
Joensuu H, Fraser J, Wildiers H, Huovinen R, Auvinen P, Utriainen M, Nyandoto P, Villman KK, Halonen P, Granstam-Björneklett H, Lundgren L, Sailas L, Turpeenniemi-Hujanen T, Tanner M, Yachnin J, Ritchie D, Johansson O, Huttunen T, Neven P, Canney P, Harvey VJ, Kellokumpu-Lehtinen PL, Lindman H. Effect of Adjuvant Trastuzumab for a Duration of 9 Weeks vs 1 Year With Concomitant Chemotherapy for Early Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer: The SOLD Randomized Clinical Trial. JAMA Oncol. 2018 Sep 1;4(9):1199-1206. doi: 10.1001/jamaoncol.2018.1380. PMID: 29852043; PMCID: PMC6143012. |
Wrong intervention: 9-weeks HER2-targeted therapy |
|
Kramar A, Bachelot T, Madrange N, Pierga JY, Kerbrat P, Espié M, Fumoleau P, Pauporté I, Khayat D, Romieu G, Pivot X. Trastuzumab duration effects within patient prognostic subgroups in the PHARE trial. Ann Oncol. 2014 Aug;25(8):1563-70. doi: 10.1093/annonc/mdu177. Epub 2014 May 14. PMID: 24827132. |
Wrong outcomes |
|
Ma J, Tang X, Hu Q, Wang Q, Chen Y, Li X, Luo T, Cao D. Optimum adjuvant trastuzumab duration for human epidermal growth factor receptor-2 positive breast cancer: a network meta-analysis of randomized trials. Transl Cancer Res. 2021 Apr;10(4):1628-1643. doi: 10.21037/tcr-20-2378. PMID: 35116489; PMCID: PMC8799215. |
Data regarding DFS are not according to the original studies |
|
Morganti S, Bianchini G, Giordano A, Giuliano M, Curigliano G, Criscitiello C. How I treat HER2-positive early breast cancer: how long adjuvant trastuzumab is needed? ESMO Open. 2022 Apr;7(2):100428. doi: 10.1016/j.esmoop.2022.100428. Epub 2022 Mar 7. PMID: 35272131; PMCID: PMC8908056. |
Wrong design: No systematic review; Not the most recent SR |
|
Niraula S, Gyawali B. Optimal duration of adjuvant trastuzumab in treatment of early breast cancer: a meta-analysis of randomized controlled trials. Breast Cancer Res Treat. 2019 Jan;173(1):103-109. doi: 10.1007/s10549-018-4967-8. Epub 2018 Sep 20. PMID: 30238273. |
No clear search; Included three original RCT’s; Not the most recent SR |
|
Pivot X, Romieu G, Debled M, Pierga JY, Kerbrat P, Bachelot T, Lortholary A, Espié M, Fumoleau P, Serin D, Jacquin JP, Jouannaud C, Rios M, Abadie-Lacourtoisie S, Tubiana-Mathieu N, Cany L, Catala S, Khayat D, Pauporté I, Kramar A; PHARE trial investigators. 6 months versus 12 months of adjuvant trastuzumab for patients with HER2-positive early breast cancer (PHARE): a randomised phase 3 trial. Lancet Oncol. 2013 Jul;14(8):741-8. doi: 10.1016/S1470-2045(13)70225-0. Epub 2013 Jun 11. PMID: 23764181. |
Study with more recent data was published in 2019 |
|
Stewart P, Blanchette P, Shah PS, Ye XY, Boldt RG, Fernandes R, Vandenberg T, Raphael J. Do all patients with HER2 positive breast cancer require one year of adjuvant trastuzumab? A systematic review and meta-analysis. Breast. 2020 Dec;54:203-210. doi: 10.1016/j.breast.2020.10.003. Epub 2020 Oct 21. PMID: 33130486; PMCID: PMC7599130. |
No clear search; Included three original RCT’s; Not the most recent SR |
|
Wang BC, Xiao BY, Fan JQ, Lin GH, Wang C, Liu Q, Zhao YX. 6 versus 12 months of adjuvant trastuzumab in HER2+ early breast cancer: A systematic review and meta-analysis. Medicine (Baltimore). 2021 Mar 12;100(10):e24995. doi: 10.1097/MD.0000000000024995. PMID: 33725875; PMCID: PMC7969267. |
Duplicate article |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-11-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor de patiënt met (verdenking op) borstkanker of voor hen die voor screening in aanmerking komen. De richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de screening, diagnostiek, behandeling en nazorg van borstkanker. Tevens wordt deze richtlijn gebruikt voor het maken van informatiemateriaal voor patiënten, in samenwerking met kanker.nl en thuisarts.nl. Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van deze richtlijn hebben bijgedragen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met borstkanker.
|
Werkgroeplid |
Namens |
|
dr. M.A.W.M.C. (Marlene) Hoynck van Papendrecht |
BVN |
|
drs. C. (Cristina) Guerrero Paez |
BVN |
|
drs. M.A. (Marjolein) Scholten |
BVN |
|
C.M. (Marco) van Esterik |
Contactgroep Phyllodes |
|
M. (Michelle) Verseveld MSc |
KNGF |
|
prof. dr. G.H. (Truuske) de Bock |
NHG |
|
dr. B.E.P.J. (Birgit) Vriens |
NIV |
|
dr. A. (Agnes) Jager |
NIV |
|
dr. C.H. (Carolien) Smorenburg, voorzitter |
NIV |
|
dr. H. (Hiltje) de Graaf |
NIV |
|
dr. J.R. (Judith) Kroep |
NIV |
|
dr. H.H. (Huub) van Rossum |
NVKC |
|
dr. ir. C. (Christiaan) van Swol |
NVKF |
|
dr. F. (Frederiek) van den Bos |
NVKG |
|
dr. C.D.L. (Carine) Bavelaar-Croon |
NVNG |
|
dr. L.A.E. (Leonie) Woerdeman |
NVPC |
|
prof. dr. M.A.M. (Marc) Mureau |
NVPC |
|
dr. A.N. (Astrid) Scholten |
NVRO |
|
dr. H.J.G.D. (Desiree) van den Bongard |
NVRO |
|
dr. J.H. (John) Maduro |
NVRO |
|
dr. M.J.C. (Maurice) van der Sangen |
NVRO |
|
dr. N. (Nina) Bijker |
NVRO |
|
prof. dr. L.J. (Liesbeth) Boersma |
NVRO |
|
dr. D.J.P. (Dominique) van Uden |
NVvH |
|
dr. E.L. (Emily) Postma |
NVvH |
|
dr. J.H. (José) Volders |
NVvH |
|
dr. L.J.A. (Luc) Strobbe |
NVvH |
|
mr. dr. F.H. (Frederieke) van Duijnhoven |
NVvH |
|
drs. E.M. (Elise) Bekers |
NVVP |
|
dr. A.I.M. (Inge-Marie) Obdeijn |
NVvR |
|
dr. C.E. (Claudette) Loo |
NVvR |
|
dr. M.B.I. (Marc) Lobbes |
NVvR |
|
dr. C. (Carla) Meeuwis |
NVvR |
|
drs. L.M.H. (Lidy) Wijers |
NVvR |
|
drs. M.W. (Mechli) Imhof-Tas |
NVvR |
|
A. (Angelie) van den Bosch |
V&VN |
|
C. (Celine) Zoetbrood |
V&VN |
|
A.M.J. (Antoinette) Holterman |
V&VN oncologie |
|
drs. J.M. (Margriet) Collée |
VKGN |
Met ondersteuning van
Drs. S.N. (Sarah) van Duijn
Dr. L. (Linda) Oostendorp
Drs. M. (Miriam) te Lintel Hekkert
Dr. N. (Nadine) Zielonke
Dr. J. (Joppe) Tra
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
|
Smorenburg (voorzitter) |
* Internist-oncoloog Antoni van Leeuwenhoek (0,9 fte - betaald) |
Lid Bestuur gasthuis Antoni van Leeuwenhoek (onbetaald) |
In 2018 een vergoeding van €1,307,00 ontvangen van Pfizer.
|
|
Guerrero Paez |
Directeur Borstkanker Vereniging Nederland |
Lid Raad van Toezicht SPL te Leiden (onbetaald) |
Als patiëntenorganisatie leveren wij vanuit patïëntenperspectief advies aan. Persoonlijk ben ik alleen betrokken bij het Covid consortium waar we onderzoek doen naar Covid en Borstkanker. Trekker is IKNL (geen rol als projectleider). Verder werken wij met de PAG samen en allerlei vrijwilligers. Wij ontvangen van de farmacie gelden voor specifieke projecten op het gebied van informatievoorziening en/of lotgenotencontact. Deze zijn multisponsored en worden altijd opgenomen in het transparantieregister. |
|
Vriens |
Internist-oncoloog Catherinaziekenhuis Eindhoven |
In 2018 een vergoeding van €870,00 ontvangen van Novartis. |
|
|
Mureau |
Plastisch chirurg, Erasmus MC, Universitair Medisch Centrum Rotterdam |
* Maatschapslid AZR>SFG, werkzaamheden als plastisch chirurg (betaald) |
Polytech Health & Aesthetics GmbH - Long-term results of breast reconstruction with polyurethane covered implants: a multicenter randomized controlled trial - Projectleider |
|
Lobbes |
* Radioloog - Zuyderland Medisch Centrum, afdeling Medische Beeldvorming (0,9 fte) |
Lid wetenschappelijke adviesraad LRCB - Lid wetenschappelijke raad Zuyderland Medisch Centrum |
* GE Healtcare - Rapid Access to Contrast-Enchanced mammography in Recalls form breast cancer screening (RACER) – Projectleider * Boegbeeldfunctie wereldwijd van contrast-enhance mammography (CEM) * Betrokkenen heeft financiële vergoedingen gekregen voor het verzorgen van workshops, presentatie en deelname van medical advisory boards van onder andere GE Healthcare, Hologic, Tromp Medical, Suazio, Bayer |
|
Bosch, van den |
Verpleegkundig specialist mammacarcinoom in het Catherinaziekenhuis te Eindhoven |
Gast-docent HBO-V studenten aan Fontys Hogeschool te Eindhoven (betaald) |
Geen |
|
Bongard, van den |
Radiotherapeut-oncoloog, Amsterdam UMC |
* Lid NABON bestuur (onbetaald) |
* KWF/ Pink Ribbon - Eenmalige hoge dosis radiotherapie mammacarcinooom (ABLATIVE project, 2013 en 2020) - Projectleider; VARIAN grant voor Adaptive Radiotherapy in Breast Cancer patients (BREAST-ART, 2020) - Projectleider. * Lid landelijke werkgroep hypofractionering mammacarcinoom |
|
Van Swol |
* Klinisch Fysicus, St. Antonius Ziekenhuis (0,9 fte) |
Voorzitter Bestuur Stichting Opleiding Klinische Fysica - onbetaald. Zie www.stichtingokf.nl |
Geen |
|
Van Duijnhoven |
Chirurg-oncoloog, Nederlands Kanker Instituut / Antoni van Leeuwenhoek Ziekenhuis |
* European Organization for Research and Treatment of Cancer, secretary of the Breast Cancer Group |
* Innovatiefonds Zorgverzekeraars - Towards omitting breast surgery in patients with a complete response to neoadjuvant chemotherapy - biopten past NAC ter evaluatie respons onderzoek inmiddels afgerond- Geen projectleider, co-PI * KWF - Management of low risk ductal carcinoma in situ (low-risk DCIS): a non-randomized, multicenter, non-inferiority trial between standard therapy approach versus active surveillance - clinical trial ongoing - Geen projectleider, co-PI * KWF - Clinically node negative breast cancer patients undergoing breast conserving therapy: Sentinel lymph node procedure versus follow-up - randomized clinical trial, accural complete January 2022 - Geen projectleider, local PI * EORTC-quality of life group - Follow-up in Early and Locally Advanced Breast Cancer Patients: An EORTC QLG-BCG-ROG Protocol - clinical study in which quality of life data are registered in patients treated for breast cancer < 3 years ago - Geen projectleider, local PI * Als arts ook betrokken bij de patiëntenvereniging voor Phyllodes tumoren van de borst, wat 1 van de geformuleerde knelpunten vanuit onze beroepsvereniging is. |
|
Volders |
Oncologische chirurg |
* Bestuurslid werkgroep Mammachirurgie NVCO - onbetaald |
Geen |
|
Van der Sangen |
Radiotherapeut-oncoloog, afdeling Radiotherapie, Catharina Ziekenhuis Eindhoven |
Bestuurslid BOOG (Borstkanker Onderzoeksgroep Nederland), onbetaald |
NVRO/IKNL - Retrospectief onderzoek naar het gebruik van radiotherapie in Nederland - Geen projectleider |
Clusterexpertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
|
Bavelaar-Croon |
Nucleair Geneeskundige - Ziekenhuis Gelderse Vallei in Ede |
* Voorzitter werkgroep mammacarcinoom NVNG (Nederlandse Vereniging Nucleaire Geneeskunde) |
Geen |
|
Imhof-Tas |
Mammaradioloog en screeningsradioloog Radboud UMC (100%) |
Geen |
Geen |
|
Obdeijn |
Mammaradioloog in het Erasmus MC |
Geen |
* ZonMw - KWF, Sisters Hope, Pink Ribbon Stichting… - MRI versus mammography for breast cancer screening in women with familial risk (FAMRIsc: a multicentre randomised, controlled trial (Lancet Oncology 2019) |
|
Wijers |
Mamma- en neuroradioloog Alrijne Zorggroep (Leiderdorp - Leiden - Alphen) |
* Lid NABON |
In 2020 een vergoeding van €1270,00 ontvangen van Bayer. |
|
Collée |
Klinisch geneticus, Erasmus MC Rotterdam |
Geen |
* KWF - Nationwide infrastructure integrating research and health care to improve management for Dutch women with familial breast cancer risk Infrastructure Initiatives – * KWF Building in the Archipelago of Ovarian Cancer Research - Geen projectleider |
|
Rossum, van |
Laboratorium specialist Klinische Chemie, Afdeling Algemeen Klinisch Laboratorium Antoni van Leeuwenhoek Ziekenhuis Amsterdam |
* Eigenaar en directeur Huvaros B.V. (onbetaald) |
* Health Holland - Subsidie voor vingerprik bloedafname systeem voor Covid-19 serologie - Projectleider
|
|
Bock, de |
Hoogleraar oncologische epidemiologie en interim afdelingshoofd afdeling Epidemiologie van het UMCG (voltijds aanstelling) |
* Lid werkgroep herziening richtlijn familiaire en erfelijke eierstokkanker |
* W.J. Thijnstichting - STIC, het begin of het einde - Projectleider samen met gynaecoloog
|
|
Bos, van den |
Internist-ouderengeneeskunde LUMC |
Voorzitter kerngroep ouderen NIV (onbetaald) |
SKMS - Keuzehulpen nij patiënten met multimorbiditeit - Projectleider
|
|
Verseveld |
* Bestuurslid Nederlandse Vereniging voor fysiotherapie bij Lymfologie en Oncologie, portefeuilehouder Wetenschap Oedeem en Oncologie: 8 uur per week |
* NVFL: vrijwillige functie |
Geen |
|
Loo |
Radioloog, gespecialiseerd mammaradiologie & screening BVO (regio midden west). NKI-AVL (Nederlands Kanker Instituut, Antoni van Leeuwenhoek) en BVO midden west |
* Wetenschappelijke cie NBCA (deels betaals/vacatie) |
In 2019 een vergoeding van €1749,00 ontvangen van Bayer. |
|
Meeuwis |
Mammaradioloog Ziekenhuis Rijnstate |
* NABON - werkgroep standaardisatie verslaglegging (onbetaald) |
* SENO medical - Echografie gecombineerd met laserlicht voor de diagnostiek bij verdachte massa's in de borst - Projectleider
|
|
Louwe |
Gynaecoloog, 0,9 aanstelling Leids Universitair Medisch Centrum |
Geen |
Geen |
|
Graaf, de |
Internist-oncoloog MCL |
Lid commissie kwaliteit NVMO. Medisch manager Oncologisch Netwerk Friesland (ONF) Coach Coassistenten Lid raad van toezicht zorg en welzijn |
Geen |
|
Jager |
Internist-oncoloog Erasmus MC Kanker Instituut Rotterdam |
* Voorzitter Stichting BOOG (Borstkanker onderzoeksgroep) - onbezoldigd |
* KWF - Prediction of Breast Cancer chemotherapy response in patients by determination of chemosensitivity in tumor tissue ex vivo - Projectleider In 2019 een vergoeding van €980,00 ontvangen van Roche Pharma. |
|
Strobbe |
Borstkankerchirurg CWZ Nijmegen fulltime staflid |
Geen |
Geen |
|
Maduro |
Radiotherapeut oncoloog, Universitaire Medische Centrum Groningen en Prinses Maxima Centrum voor kinderoncologie |
Bestuur BOOG, onbetaald |
EU - HARMONIC, gevolgen straling bij kinderen - Geen projectleider
|
|
Boersma |
Radiotherapeut-oncoloog Maastro, Maastricht |
* Klinische werkzaamheden en wetenschappelijke werkzaamheden * Voorzitter van Landelijk Platform Protonentherapie en lid van commissie kwaliteit NVRO |
ZonMw - MOVE project: verbeteren zorgpaden protonentherapie; SKMS project: INNOVATE: verbeteren implementatie van innovaties. KWF: Descartes studie: de-escalatie van bestraling bij patiënten met pCR na Neoadjuvante chemotherapie
|
|
Scholten |
Radiotherapeut-oncoloog, NKI-AVL |
- |
KWF - PPAPBI-2 trial - Projectleider
|
|
Postma |
Oncologisch chirurg Antonius Ziekenhuis Nieuwegein |
Geen |
Geen |
|
Uden |
Fellow chirurgische oncologie: per 17-1-2022 te Gelre Ziekenhuizen (hiervoor fellow chirurgische oncologie in het Rijnstate Ziekenhuis) |
Niet van toepassing |
Onbetaald en ongefinancierd promotie onderzoek naar inflammatoir mammacarcinoom: nu geen aandachtspunt voor de revisie. |
|
Bijker |
Radiotherapeut-oncoloog Amsterdam UMC |
* Kartrekker lateralisatie mammazorg AmsterdamUMC, onbetaald |
* KWF 12900 - Reduction of organ motion during radiotherapy by non-invasive mechanical ventilation supported berating control - Geen projectleider
|
|
Kroep |
Internist-Oncoloog, LUMC |
Betaald adviseurschap: AstraZeneca, GSK, Eisai, Lilly, MSD, Novartis |
* AstraZeneca - FAB, DOMEC en MMRd-GREEN studie; behandeling ovariumca (FAB) en endometrium carcinoom (DOMEC en MMRd-GREEN) drugs (olaparib, durvalumab) en onregstricted grant - Projectleider * Novartis - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. ribociclib en unregstricted grant - Projectleider * Philips - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. unrestricted grant - Projectleider |
|
Woerdeman |
Plastisch chirurg Antoni van Leeuwenhoek Amsterdam |
* Hoofd afdeling plastische chirurgie Antoni van Leeuwenhoek |
Dutch Cancer Society, Grand/Award Number: - Ontwikkeling borst reconstructie keuzehulp - Projectleider
|
|
Esterik, van |
Tot 2014 zelfstandige als Invalbakker |
* Brood en Banker Bakker |
Geen |
|
Scholten, M |
* Belangenbehartiger bij BVN (Borstkankervereniging), 50% |
* Zitting in Medische Advies Raad Parkinsonvereniging (vrijwillig) |
Geen |
|
Hoynck van Papendrecht |
Vrijwilligster BVN |
* Gepensioneerd arts |
Geen |
|
Bekers |
Patholoog, Antoni van Leeuwenhoek Ziekenhuis |
Geen |
Geen |
|
Zoetbrood |
|
|
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de Borstkankervereniging Nederland (BVN) uit te nodigen voor de invitational conference en de werkgroep. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan BVN en de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK). De eventueel aangeleverde commentaren zijn bekeken en waar mogelijk verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er [waarschijnlijk geen/ mogelijk] substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module HER2-gerichte therapie in adjuvante setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met HER2-positieve borstkanker) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module HER2-gerichte therapie in gemetastaseerde setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met HER2-positieve borstkanker) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module immuuntherapie in gemetastaseerde setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker en indicatie immuuntherapie in gemetastaseerde setting) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module directe borstreconstructie en radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker, directe borstreconstructie en radiotherapie) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module uitgestelde borstreconstructie en radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker, uitgestelde borstreconstructie en radiotherapie) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module nacontrole: detectie van nieuwe carcinoom manifestaties |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>5.000 patiënten jaarlijks in nacontrole voor borstkanker), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Phyllodestumoren – beeldvorming en pathologie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren - radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren – resectiemarges |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren – systemische therapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Phyllodestumoren - nacontrole |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module screening buiten het bevolkingsonderzoek tijdens zwangerschap en borstvoeding |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met indicatie screening buiten het bevolkingsonderzoek tijdens zwangerschap en borstvoeding) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module immuuntherapie in neoadjuvante setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker en indicatie immuuntherapie in neoadjuvante setting) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep schriftelijk de knelpunten in de zorg voor patiënten met borstkanker. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model met behulp van Review Manager 5.4. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
