Beleid bij trombocytopenie door tijdelijke aanmaakstoornis
Uitgangsvraag
Is een profylactische trombocytentransfusie geïndiceerd bij volwassenen en kinderen met een trombocytopenie (trombocytenaantal lager dan 10*109/L) door een tijdelijke aanmaakstoornis?
Aanbeveling
Geef volwassenen en kinderen met een trombocytengetal van lager dan 10*109 per liter als gevolg van een tijdelijke aanmaakstoornis door een hemato-oncologische aandoening dan wel de behandeling daarvan een profylactische trombocyten transfusie met standaarddosis trombocytenconcentraat per keer gevolgd door een opbrengstmeting (na 1 uur en/of zo mogelijk ook na 24 uur).
Geef kinderen met een trombocytengetal van lager dan 10*109 per liter als gevolg van een tijdelijke aanmaakstoornis door een hemato-oncologische aandoening dan wel de behandeling daarvan een profylactische trombocyten transfusie met 15-20ml/kg tot maximum 1 standaarddosis trombocytenconcentraat per keer gevolgd door een opbrengstmeting (na 1 uur en/of zo mogelijk ook na 24 uur).
Overwegingen
Het is tot op heden moeilijk gebleken om tot een goede bewijsvoering te komen voor het profylactisch transfunderen van trombocyten bij patiënten met een tijdelijke trombocytopenie als gevolg van een hematologische aandoening, chemotherapie en/of stamceltransplantatie. In de afgelopen jaren zijn er 2 grote RCT’s geweest, die getracht hebben tot een gefundeerd antwoord op deze vraag te komen bij patiënten ouder dan 16 jaar (Stanworth, 2013; Wandt, 2012). Voor kinderen is er slechts één wat langer geleden uitgevoerde RCT (Murphy, 1982). Ondanks de zorgvuldige studie opzet van de drie RCT’s blijft sprake van uiteenlopende methodologische gebreken en vooral ook heterogeniteit, waardoor het trekken van conclusies met de nodige voorzichtigheid moet worden betracht. Uit een recent verschenen review (Kumar, 2015) die ook observationele studies includeerde, als ook uit de recent opnieuw gepubliceerde Cochrane (Crighton, 2016) analyse blijkt vrij consistent dat het risico op graad 2 of hogere bloedingen lager is bij profylactische trombocyten transfusies vergeleken met een therapeutisch beleid. Hoewel formeel niet bewezen, lijkt dit verschil ten nadele van een therapeutische strategie vooral te bestaan bij patiënten met een acute leukemie. Dit gaat ten koste van een groter verbruik aan trombocyten producten en naar verwachting (echter niet bewezen) een groter risico op voor de patiënt nadelige transfusiereacties. Al hoewel kinderen met een trombocytopenie een hoger bloedingsrisico leken te hebben in de PLADO-trial (Josephson, 2012), lijkt het op basis van de beperkte literatuur niet aannemelijk dat het verschil in bloedingsrisico tussen beide strategieën bij kinderen zeer afwijkt van de gevonden verschillen bij volwassenen. Hoewel methodologisch zeer heterogeen lijken de studies, die een lage trombocyten trigger (doorgaans 10*109 trombocyten per liter) hebben vergeleken met hogere triggers erop te wijzen, dat bij patiënten zonder additionele risicofactoren of actieve bloedingen een lage transfusie trigger niet leidt tot een groter bloedingsrisico. Hogere triggers leiden zeer waarschijnlijk wel tot een groter verbruik van trombocyten producten. Op basis van het huidige wetenschappelijke bewijs lijkt er een voorkeur te zijn voor een profylactische trombocyten transfusiebeleid met een lage trigger, conform de huidige praktijk.
Onderbouwing
Achtergrond
Trombocytopenie kan leiden tot bloedingen variërend van milde (bijvoorbeeld huidbloedingen) tot levensbedreigende (bijvoorbeeld cerebrale) bloedingen. Een profylactisch trombocytentransfusiebeleid wordt op dit moment aanbevolen bij patiënten met een verworven aanmaakstoornis, zoals bij chemotherapie, met een trombocyten aantal van lager dan 10*109/L.
Trombocytentransfusies kunnen schadelijke transfusiereacties veroorzaken. Milde tot matige reacties op trombocytentransfusies zijn koude rillingen, koorts en urticaria (Crighton, 2015). Deze reacties zijn veelal niet levensbedreigend maar kunnen extreem stressvol zijn voor de patiënt. Meer zeldzaam maar ernstiger zijn: anafylactische reacties, transfusie overdraagbare infecties, Transfusion-Related Acute Lung Injury (TRALI) en volumeoverbelasting door transfusie (TACO= Transfusion Associated Circulatory Overload). Elke strategie die veilig het aantal profylactische trombocytentransfusies kan verlagen zal belangrijke logistieke en financiële implicaties hebben als ook de blootstelling aan de risico’s van trombocytentransfusies voor patiënten verlagen.
Het is de vraag of een therapeutisch trombocytentransfusie beleid (transfusie wanneer de patiënt bloedt) even effectief en veilig is als een profylactische trombocytentransfusie beleid (transfusie aan de patiënt om bloeden te voorkomen, meestal gegeven wanneer het aantal trombocyten onder een bepaalde trigger valt) bij patiënten met trombocytopenie.
Conclusies / Summary of Findings
Profylactische versus therapeutisch trombocytentransfusie beleid bij volwassen patiënten
Bloedingsevent (WHO-graad 2 of hoger)
|
Zeer laag GRADE |
Bij patiënten met trombocytopenie (lager dan 10*109/L) is het mogelijk dat het aantal patiënten met een bloedingsevent (WHO-graad 2 of hoger) lager is met een profylactisch trombocyten transfusiebeleid in vergelijking met een therapeutisch trombocyten transfusiebeleid
Bronnen (NICE, 2015) |
Aantal patiënten met een ernstige bloeding (WHO-graad 3 of 4
|
Redelijk GRADE |
Bij patiënten met trombocytopenie (lager dan 10*109/L) zijn er waarschijnlijk minder ernstige (WHO- graad 3 of 4) bloedingen met een profylactisch trombocyten transfusiebeleid in vergelijking met therapeutisch trombocyten transfusiebeleid
Bronnen (NICE, 2015) |
Serious adverse events en transfusie gerelateerde adverse events
|
Zeer laag GRADE |
Voor patiënten met trombocytopenie (lager dan 10*109/L) zijn er onvoldoende betrouwbare gegevens om een conclusie te trekken over het voorkomen van serious adverse events en tranfusiegerelateerde adverse events bij een profylactisch trombocyten transfusiebeleid in vergelijking met een therapeutisch trombocyten transfusiebeleid.
Bronnen (NICE, 2015) |
Aantal patiënten die een trombocytentransfusie nodig hebben
|
Redelijk GRADE |
Bij patiënten met trombocytopenie (lager dan 10*109/L) is het waarschijnlijk dat meer patiënten een trombocytentransfusie nodig hebben bij profylactisch trombocyten transfusiebeleid in vergelijking met een therapeutisch trombocyten transfusiebeleid.
Bronnen (NICE, 2015) |
Aantal units getransfundeerd per patiënt
|
Redelijk GRADE |
Bij patiënten met trombocytopenie (lager dan 10*109/L) is het waarschijnlijk dat het aantal eenheden trombocyten per patiënt hoger is bij profylactisch trombocyten transfusiebeleid in vergelijking met een therapeutisch trombocyten transfusiebeleid.
Bronnen (NICE, 2015) |
Bloedingsgerelateerde mortaliteit
|
Laag GRADE |
Voor patiënten met trombocytopenie (lager dan 10*109/L) zijn er te weinig gegevens om een conclusie te kunnen trekken over bloedingsgerelateerde mortaliteit bij een profylactisch trombocyten transfusie beleid in vergelijking met een therapeutisch trombocyten transfusiebeleid. NICE, 2015 |
Infecties, kwaliteit van leven en ziekenhuisopnameduur
|
- GRADE |
Voor patiënten met trombocytopenie (lager dan 10*109/L) werden er geen studies van voldoende kwaliteit gevonden die de uitkomstmaten infecties, kwaliteit van leven en ziekenhuisopnameduur rapporteren bij een profylactisch trombocytentransfusiebeleid in vergelijking met een therapeutisch trombocytentransfusiebeleid. |
Profylactisch trombocytentransfusiebeleid versus therapeutisch trombocytentransfusiebeleid bij kinderen
Aantal patiënten met een ernstige bloeding
|
Laag GRADE |
Het is mogelijk dat het aantal patiënten met een bloeding lager is bij een profylactisch trombocytentransfusiebeleid in vergelijking met therapeutisch trombocytentransfusiebeleid bij kinderen met acute leukemie en een trombocytopenie (lager dan 10*109/L).
Bronnen (NICE, 2015) |
Mortaliteit (alle oorzaken)
|
Zeer laag GRADE |
Er zijn onvoldoende gegevens beschikbaar om een conclusie te trekken over de mortaliteit (alle oorzaken) bij een profylactisch trombocytentransfusiebeleid in vergelijking met therapeutisch trombocytentransfusiebeleid bij kinderen met acute leukemie en een trombocytopenie (lager dan 10*109/L).
Bronnen (NICE, 2015) |
Mortaliteit door bloeding
|
Zeer laag GRADE |
Er zijn onvoldoende gegevens beschikbaar om een conclusie te trekken over de mortaliteit (door bloeding) bij een profylactisch trombocytentransfusiebeleid in vergelijking met therapeutisch trombocytentransfusiebeleid bij kinderen met acute leukemie en een trombocytopenie (lager dan 10*109/L). Bronnen (NICE, 2015) |
Mortaliteit
|
Laag GRADE |
Er lijkt geen verschil te zijn in de mortaliteit bij patiënten die bij een lage (lager dan 10*109/L) versus een hoge (lager dan 20*109/L) trigger een trombocytentransfusie ontvingen.
Binnen een subgroepanalyse bij patiënten die chemotherapie krijgen lijkt er ook geen verschil te zijn in de mortaliteit. Hetzelfde geldt voor een subgroepanalyse voor patiënten met stamceltransplantatie.
Bronnen (NICE, 2015) |
Bloeding (WHO-graad 2 of hoger)
|
Laag GRADE |
Het aantal patiënten met een bloeding (WHO-graad 2 of hoger) lijkt gelijk te zijn bij trombocytentransfusie bij een lage (lager dan 10*109/L) versus een hoge trigger (lager dan 20*109/L).
Bronnen (NICE, 2015) |
Ernstige bloeding (WHO-graad 3 of 4)
|
Zeer laag GRADE |
Het is onduidelijk of er een klinisch relevant verschil is in het optreden van ernstige bloedingen bij een trombocytentransfusie bij een lage trigger (lager dan 10*109/L) in vergelijking met een hoge trigger (lager dan 20*109/L).
Binnen de subgroepanalyse voor patiënten met chemotherapie is het ook onzeker of er een verschil bestaat in het optreden van ernstige bloedingen. Hetzelfde geldt voor de subgroepanalyse voor patiënten met stamceltransplantatie.
Bronnen (NICE, 2015) |
Infecties
|
Laag GRADE |
Er lijkt geen verschil te zijn in het aantal infecties bij patiënten die bij een lage (lager dan 10*109/L) of hoge (lager dan20*109/L) trigger een trombocytentransfusie ontvingen.
Bronnen (NICE, 2015) |
Adverse events
|
Laag GRADE |
Adverse events lijken minder vaak voor te komen bij patiënten die trombocytentransfusie krijgen bij een lage trigger (lager dan 10*109/L) in vergelijking met een hoge trigger (lager dan 20*109/L).
Bronnen (NICE, 2015) |
Aantal eenheden (trombocyten) getransfundeerd per patiënt
|
Redelijk GRADE |
Het is waarschijnlijk dat het aantal eenheden (trombocyten) getransfundeerd lager is bij een lage trigger (lager dan 10*109/L) dan bij een hoge trigger (lager dan 20*109/L).
Voor de subgroep patiënten met chemotherapie geldt dezelfde conclusie.
Voor de subgroep patiënten met stamceltransplantatie lijkt het aantal eenheden (trombocyten) getransfundeerd niet te verschillen bij een lage (lager dan 10*109/L) of hoge trigger (lager dan 20*109/L).
Bronnen (NICE, 2015) |
|
- GRADE |
Er werden geen studies gevonden waarin alleen kinderen werden geïncludeerd of waarin de data voor volwassenen en kinderen separaat werd gerapporteerd. |
Samenvatting literatuur
De NICE-richtlijn (hoofdstuk 12.2) werd voor de uitwerking van deze uitgangsvraag als uitgangspunt genomen. Er zijn ook andere recente systematische reviews (Estcourt; Kumar) die deze uitgangsvraag beantwoorden (en dezelfde studies includeren). De uitkomstmaten die in de NICE-richtlijn werden meegenomen sluiten echter beter aan bij de door de werkgroep gedefinieerde relevante uitkomstmaten en is daarom als uitgangspunt genomen. In aanvulling op de NICE-richtlijn is tot maart 2017 gezocht naar de meest recente literatuur, er werden echter geen aanvullende studies gevonden. Er werden in de NICE-review zeven RCT’s geïncludeerd (Diedrich, 2005; Heckman, 1997; Rebulla, 1997; Stanworth, 2013; Zumberg, 2002; Wandt, 2012; Murphy, 1982). In alle studies werd een lage transfusie trigger vergeleken met een hoge trigger (Diedrich, 2005; Heckman, 1997; Rebulla, 1997; Zumberg, 2002) of profylactisch met therapeutisch trombocytentransfusie beleid (Stanworth, 2013; Wandt, 2012; Murphy, 1982) (zie tabel 1). Voor de evidence-tabellen wordt verwezen naar appendix H, tabel H.4.1 (pagina 366); GRADE-tabellen naar appendix J, tabel J.4 (pagina 543); en Forest plots naar appendix K, sectie 5.4, tabellen 99 van de NICE-richtlijn.
Tabel 1 Geïncludeerde studies
|
Studie |
Populatie |
Interventie |
Controle |
Uitkomstmaten |
|
Lage versus hoge treshold |
||||
|
Diedrich, 2005 |
Volwassenen en kinderen <18 jaar die een allogene hematopoietische stamceltransplantatie ondergaan |
Profylactische trombocytentransfusie bij ≤10*109 trombocyten per liter |
Profylactische trombocytentransfusie bij ≤30*109 trombocyten per liter |
• Mortaliteit (all-cause) (3 jaar) • Aantal patiënten met bloeding • Transfusie gerelateerde mortaliteit • Bacteriemie |
|
Heckman, 1997 |
Patiënten >17 jaar met inductietherapie voor acute leukemie |
Profylactische trombocytentransfusie bij ≤10*109 trombocyten per liter |
Profylactische trombocytentransfusie bij ≤20*109 trombocyten per liter |
• Ziekenhuis-opnameduur (mediane waarden) • Aantal patiënten dat TT nodig heeft • Aantal patiënten met bloeding • All-cause mortaliteit • Aantal units getransfundeerd per patiënt • Adverse events |
|
Rebulla, 1997 |
Adolescenten en volwassenen (16 tot 70 jaar) met acute myeloide leukemie (AML, exclusief APL) opgenomen in het ziekenhuis voor eerste remissie inductie chemotherapie |
Profylactische trombocytentransfusie bij: ≤109 trombocyten per liter Of 10 tot 20*109 trombocyten per liter bij temperatuur ≥38 graden, bij bloedingen of bij invasieve procedures |
Profylactische trombocytentransfusie ≤20*109 trombocyten per liter |
• Mortaliteit (all-cause) • Aantal patiënten met majeure bloedingsepisode • Aantal trombocyten per patiënt |
|
Zumberg, 2002 |
Patiënten >2 jaar met allogene, matched unrelated donor (MUD), syngene of autologe beenmergtransplantatie (BMT) |
Profylactische trombocytentransfusie bij ochtend platelet count <10*109 trombocyten per liter |
Profylactische trombocytentransfusie bij ochtend platelet count <20*109 trombocyten per liter |
• All-cause mortaliteit • Bloeding • Aantal units rode bloedcellen getransfundeerd • Ziekenhuis-opnameduur • Aantal trombocytentransfusies |
|
Geen profylactische versus profylactische trombocytentransfusie |
||||
|
Stanworth, 2013 |
Patiënten ≥16 jaar met chemotherapie of stamceltransplantatie en die een trombocytopenie hadden of naar verwachting zouden krijgen |
Geen profylactische trombocytentrans-fusie bij <10*109 trombocyten per liter = therapeutisch trombocyten transfusie beleid |
Profylactische trombocytentrans-fusie bij <10*109 trombocyten per liter |
• Aantal patiënten met bloeding • Aantal patiënten met majeure bloeding • Aantal patiënten dat trombocytentransfusie nodig had • Aantal units trombocyten getransfundeerd /patiënt • Ziekenhuis-opnameduur • Ernstige adverse events • Transfusie gerelateerde adverse events |
|
Wandt, 2012 |
Patiënten 16 tot 80 jaar met intensieve chemotherapie voor acute myeloide leukemie of autologe stamcel transplantatie voor hematologische maligniteiten |
Therapeutische trombocytentrans-fusie (bij bloeding) |
Profylactische trombocytentrans-fusie bij ≤10*109 trombocyten per liter |
• Mortaliteit • Aantal bloedingsepisodes (who graad 2 of hoger) • Ziekenhuis-opnameduur • Bijwerkingen van transfusie |
|
Murphy, 1982 |
Kinderen met eerder onbehandelde acute leukemie |
Therapeutische trombocytentrans-fusie (bij significante bloeding) |
Profylactische trombocytentrans-fusie <20*109 trombocyten per liter onafhankelijk van klinische events |
• Aantal patiënten met bloeding • Mortaliteit (all-cause) • Mortaliteit door bloeding |
In de studies verschilden de schalen voor het beoordelen van bloedingen. De meeste studies gebruiken het WHO-scoringssysteem, echter de studie van Murphy (1982) gebruikte de aangepaste GIMEMA-criteria en Heckman (1997) gebruikte een gestandaardiseerde toxiciteitsschaal (geen details gerapporteerd). In de NICE-review is geprobeerd om de bloedingscriteria van de andere schalen te relateren aan de WHO-criteria.
In de NICE-richtlijn werden volwassen patiënten gedefinieerd als patiënten ouder dan 18 jaar; jongvolwassenen als 16 tot 18 jaar en kinderen jonger dan 16 jaar. In een aantal studies werden zowel volwassenen als adolescenten en kinderen geïncludeerd, maar werden de resultaten voor deze groepen niet apart beschreven (Diedrich, 2005; Zumberg 2002) en in één studie werden alleen kinderen geïncludeerd (Murphy, 1982). De data voor kinderen en volwassenen wordt in deze studies niet apart gerapporteerd, daarom is er in de NICE-richtlijn gekozen om deze data in de analyses voor volwassen patiënten te includeren. De studie van Stanworth (2013) includeerde adolescenten en volwassenen boven de 16 jaar; ook deze studieresultaten werden niet apart gerapporteerd voor de leeftijdsgroepen en werden in de analyses meegenomen bij de volwassen populatie.
Profylactische versus therapeutisch trombocytentransfusie beleid bij volwassen patiënten
Aantal patiënten met een bloeding (WHO-graad 2 of hoger)
De uitkomstmaat “aantal patiënten met een bloeding” werd in twee studies (totaal 991 patiënten: 391 in Wandt, 600 in Stanworth) gerapporteerd (Wandt, 2012; Stanworth, 2013). In de groep die profylactische trombocytentransfusies kreeg hadden 193 van 493 patiënten een bloeding (39,1%). In de groep die geen profylactische transfusies kregen waren dit 278 van de 498 (55,8%) patiënten (RR 0,7 (95%-CI: 0,61 tot 0,9)).
Aantal patiënten met een ernstige bloeding (WHO 3 of 4)
De uitkomstmaat aantal patiënten met een ernstige bloeding werd in twee studies (totaal 991 patiënten) gerapporteerd (Wandt, 2012; Stanworth, 2013). In de groep die profylactische trombocytentransfusie kreeg hadden 8 van 493 patiënten een bloeding (1,6%) in vergelijking met 27 van 498 (5,4%) in de groep waar patiënten geen profylactische transfusie kregen (RR 0,3 (95%-CI: 0,14 tot 0,65)).
Subgroepanalyse
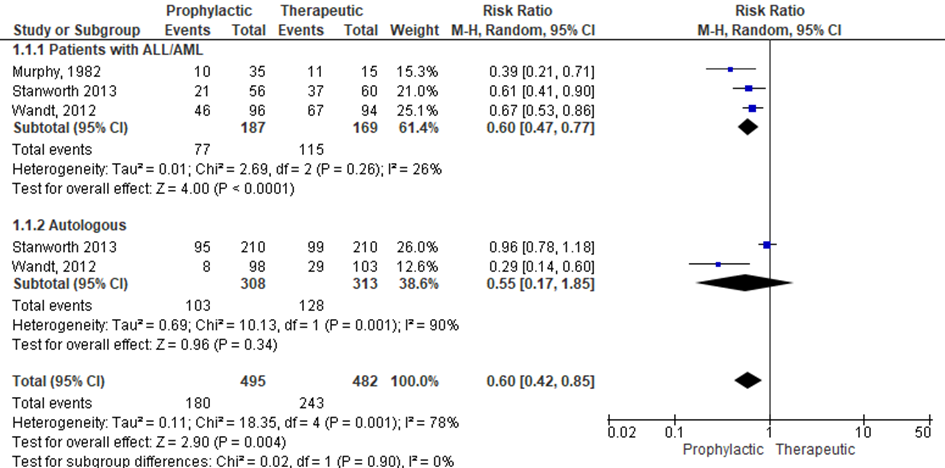
In de NICE-richtlijn zijn geen subgroepanalyses gedaan. In de review van Kumar (waar dezelfde studies zijn geïncludeerd) zijn echter wel subgroepanalyses gedaan voor patiënten met ALL/AML en autologe stamceltransplantatie. De data voor deze analyses zijn overgenomen en de analyse is opnieuw uitgevoerd om het relatief risico te berekenen (zie figuur 1). Ten aanzien van bloedingen graad 2 en hoger bestaat er een significant voordeel voor het profylactische transfusiebeleid (RR 0.60, CI95 0.42 tot 0.85). Voor patiënten met een acute leukemie lijkt er een significant voordeel te bestaan voor een profylactisch trombocyten transfusie beleid. Voor patiënten met een autologe stamceltransplantatie lijkt er geen significant verschil te zijn tussen beide strategieën.
Figuur 1 Subgroepanalyse patiënten met ALL/AML en autologe stamceltransplantatie
Serious adverse events (SAE)
De uitkomstmaat “SAE” werd in één studie (598 patiënten) gerapporteerd (Stanworth, 2013). In de groep die profylactische trombocytentransfusie kreeg hadden 20 van 298 patiënten een SAE (6,7%) in vergelijking met 18 van 300 (6%) in de groep waar patiënten geen profylactische transfusie kregen (RR 1,12 (95%-CI: 0,6 tot 2,07)).
Transfusie gerelateerde adverse events
De uitkomstmaat “transfusie gerelateerde adverse events” werd in één studie (600 patiënten) gerapporteerd (Stanworth, 2013). In de groep die profylactische trombocytentransfusie kreeg, had 1 van 299 patiënten een transfusie gerelateerd adverse event (0,33%) in vergelijking met 0 van 301 (0%) in de groep waar patiënten geen profylactische transfusie kregen (RR 3,02 (95%-CI: 0,12 tot 73,84)). Hoewel geëxcludeerd in de NICE vanwege het ontbreken van definities laat ook de studie van Wandt geen verschil zien in het optreden van transfusie gerelateerde adverse events (Wandt, 2012).
Aantal patiënten die trombocyten transfusie nodig heeft
De uitkomstmaat “aantal patiënten die trombocytentransfusie nodig heeft” werd gerapporteerd in één studie (600 patiënten) (Stanworth, 2013). In de groep die profylactische trombocytentransfusie kreeg had 266 van 299 patiënten een transfusie (89%) in vergelijking met 176 van 301 (58,5%) in de groep waar patiënten geen profylactische transfusie kregen (RR 1,52 (95%-CI: 1,37 tot 1,69)).
Aantal eenheden trombocyten per patiënt
De uitkomstmaat aantal eenheden trombocyten per patiënt werd gerapporteerd in één studie (600 patiënten) (Stanworth, 2013). Het gemiddelde aantal units per patiënt was 3,2 (sd 3,6) in de groep die profylactische trombocytentransfusie kreeg in vergelijking met 1,9 (sd 3,3) in de groep die geen profylactische trombocytentransfusie kreeg (1,3 eenheid hoger (95%-CI 0,75 tot 1,85 hoger)). De Cochrane meta-analyse, waarbij de studie van Wandt (2012) wel werd meegenomen, liet een reductie van trombocyten transfusies per patiënt zien in het voordeel van patiënten die een therapeutische trombocyten transfusie ondergingen (gestandaardiseerd gemiddeld verschil (SMD) = -0,50 95%-CI -0,63 tot -0,37).
Bloedingsgerelateerde mortaliteit
De bloedingsgerelateerde mortaliteit wordt in de review onduidelijk gerapporteerd. Tevens valt op dat tussen verschillende reviews over dit onderwerp bij dezelfde studies andere getallen worden gerapporteerd. De getallen hier gerapporteerd zijn daarom afkomstig uit de originele publicaties. De studie van Wandt (2012) rapporteert een bloedingsgerelateerde mortaliteit van 2 op 194 (1,0%) patiënten in de therapeutische groep in vergelijking met 0 op 194 patiënten in de controlegroep. In de studie van Stanworth (2013) was er geen bloedingsgerelateerde mortaliteit.
Bijwerkingen van transfusie (niet nader gespecificeerd)
De uitkomstmaat “bijwerkingen van transfusie” werd gerapporteerd in één studie (391 patiënten) (Wandt, 2012). In de groep die profylactische trombocytentransfusie kreeg hadden 25 van 194 patiënten een bijwerking (12,9%) in vergelijking met 27 van 197 (13,7%) in de groep waar patiënten geen profylactische transfusie kregen (RR 0,94 (95%-CI: 0,57 tot 1,56)).
Infecties
Er werden geen studies van voldoende kwaliteit gevonden die de uitkomstmaat infecties rapporteren.
Kwaliteit van leven
Er werden geen studies van voldoende kwaliteit gevonden die de uitkomstmaat kwaliteit van leven rapporteren.
Ziekenhuisopnameduur
Er werden geen studies van voldoende kwaliteit gevonden die de uitkomstmaat ziekenhuisopnameduur rapporteren.
De bewijskracht voor de uitkomstmaat bloedingsevent is met twee niveaus verlaagd naar zeer laag gezien beperkingen in de studieopzet, ernstige inconsistentie (I2=92) en imprecisie (betrouwbaarheidsinterval omvat de grens voor minimale klinische relevantie). De bewijskracht voor de uitkomstmaat aantal patiënten met een ernstige bloeding is met een niveau verlaagd naar matig gezien beperkingen in de studieopzet. De bewijskracht voor de uitkomstmaat ernstige adverse events is met twee niveaus verlaagd naar laag, gezien beperkingen in de studieopzet en imprecisie. De bewijskracht voor de uitkomstmaat transfusiegerelateerde adverse events is met drie niveaus verlaagd naar zeer laag gezien beperkingen in de studieopzet en imprecisie. De bewijskracht voor de uitkomstmaten aantal patiënten die een trombocytentransfusie nodig hebben en aantal units getransfundeerd per patiënt is met één niveau verlaagd naar matig gezien beperkingen in de studieopzet. De bewijskracht voor de uitkomstmaat mortaliteit is met twee niveaus verlaagd naar laag in verband met onduidelijke rapportage en imprecisie. De bewijskracht voor de uitkomstmaat bijwerkingen van transfusie is met drie niveaus verlaagd naar zeer laag in verband met beperkingen in de studie opzet (passive reporting, wat de betrouwbaarheid van aantal meldingen verlaagt) indirectheid (geen vooraf gespecificeerde definitie van bijwerkingen) en imprecisie.
Profylactisch trombocytentransfusiebeleid versus therapeutisch trombocytentransfusiebeleid bij kinderen
Aantal patiënten met een ernstige bloeding
De uitkomstmaat aantal patiënten met een ernstige bloeding werd gerapporteerd in één studie (56 patiënten met acute leukemie) (Murphy, 1982). In de groep die profylactische trombocytentransfusie kreeg hadden 10 van 35 patiënten een bloeding (28,6%) in vergelijking met 11 van 21 (52,4%) in de groep waar patiënten geen profylactische transfusie kregen (RR 0,55 (95%-CI: 0,28 tot 1,06)).
Mortaliteit (all-cause)
De uitkomstmaat mortaliteit werd gerapporteerd in één studie (56 patiënten) (Murphy, 1982). In de groep die profylactische trombocytentransfusie kreeg overleed 12 van 35 patiënten (34,3%) in vergelijking met 7 van 21 (33,3%) in de groep waar patiënten geen profylactische transfusie kregen (RR 1,03 (95%-CI: 0,48 tot 2,2)).
Mortaliteit door bloeding
De uitkomstmaat mortaliteit werd gerapporteerd in een één studie (56 patiënten) (Murphy, 1982). In de groep die profylactische trombocytentransfusie kreeg overleed 1 van 35 patiënten (2,9%) in vergelijking met 2 van de 21 (9,5%) in de groep waar patiënten geen profylactische transfusie kregen (RR 0,3 (95%-CI: 0,03 tot 3,11)).
Overige uitkomstmaten
Er werden geen studies van voldoende kwaliteit gevonden die de uitkomstmaten infecties, kwaliteit van leven, ernstige adverse events, aantal patiënten die een transfusie nodig hadden, aantal units getransfundeerd en lengte van ziekenhuisopname rapporteren.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aantal patiënten met ernstige bloedingen is met twee niveaus verlaagd naar laag gezien beperkingen in de studieopzet en imprecisie (betrouwbaarheidsinterval omvat de grens voor klinische relevantie of geen effect). De bewijskracht voor de uitkomstmaat mortaliteit (all-cause) en mortaliteit door bloeding is met drie niveaus verlaagd naar zeer laag gezien beperkingen in de studie opzet,
indirectheid (mortaliteit beoordeeld na 3 jaar, in het protocol werd de uitkomstmaat mortaliteit gedefinieerd na 30 dagen) en ernstige imprecisie.
Lage versus hoge trigger
Er werden vier studies gevonden waarin een lage trigger (profylactische trombocytentransfusie bij 10*109/L of lager) werd vergeleken met een hoge trigger (Diedrich: 30*109/L of lager; Heckman, Rebulla, Zumberg: 20*109/L of lager).
Er werden geen studies gevonden waarin alleen kinderen werden geïncludeerd. In de studie van Zumberg worden patiënten vanaf 2 jaar geïncludeerd (Zumberg, 2002). De resultaten worden echter niet voor kinderen en volwassenen apart beschreven.
Mortaliteit
De uitkomstmaat mortaliteit werd gerapporteerd in vier studies (658 patiënten). In de groep die bij een lage trigger transfusie kregen overleden 83 van 329 (25,2%) in vergelijking met 77 van 329 (23,4%) in de groep met hoge trigger (RR 1,14 (0,9 tot 1,45)).
De bewijskracht voor de uitkomstmaat mortaliteit werd met twee niveaus verlaagd naar laag door beperkingen in de studie-opzet en imprecisie.
Subgroep chemotherapie
De mortaliteit in de subgroep patiënten die chemotherapie ondergingen werd gerapporteerd in 2 studies (333 patiënten). Met lage versus hoge trigger overleden respectievelijk 25% (43 van 172) versus 23,6% (38 van 161) van de patiënten (RR 1,17 (0,85 tot 1,6)). De bewijskracht is laag gezien beperkingen in de studieopzet en inconsistentie.
Subgroep stamceltransplantaties
In de subgroep patiënten met een stamceltransplantatie (2 studies, 325 patiënten) was de mortaliteit met lage versus hoge trigger respectievelijk 25,5% (40 van 157) versus 23,2% (39 van 168) (RR 1,12 (0,78 tot 1,6)). De bewijskracht is laag gezien beperkingen in de studieopzet en inconsistentie.
Bloeding (WHO-graad 2 of hoger)
Het aantal patiënten met een bloedingsevent (WHO-graad 2 of hoger) werd gerapporteerd in twee studies (325 patiënten). In de analyse van de NICE-richtlijn lijkt een fout te zitten: daar wordt in de analyses meegenomen dat in de lage trigger groep 14 van 79 patiënten een bloeding kregen (correct) versus 13 van 0 patiënten in de hoge trigger groep (incorrect: moet 13 van 87 zijn). Met deze gegevens wordt de analyse: 88 van 157 (56,1%) patiënten in de lage thresholdgroep kregen een bloeding in vergelijking met 92 van 168 (54,8%) patiënten in de hoge triggergroep (RR 1,00 (0,89 tot 1,13)). De bewijskracht is laag in verband met beperkingen in studieopzet en indirectheid.
Ernstige bloeding (WHO-graad 3 of 4)
Het aantal patiënten met een ernstige bloeding (WHO-graad 3 of 4) werd gerapporteerd in vier studies (652 patiënten). In de groep die bij een lage trigger transfusie kregen kreeg 18,2% (60 van 329 patiënten) een bloeding in vergelijking met 50 van 323 (15,5%) in de groep met hoge trigger (RR 1,17 (0,84 tot 1,64)). De bewijskracht is zeer laag in verband met beperkingen in studieopzet en inconsistentie, indirectheid en imprecisie
Subgroep patiënten met chemotherapie
De mortaliteit in de subgroep patiënten die chemotherapie ondergingen, werd gerapporteerd in twee studies (333 patiënten). In de groep die bij een lage trigger transfusie kregen kreeg 26,7% (46 van 172 patiënten) een bloeding in vergelijking met 19,3 (31 van 161) de groep met hoge trigger (RR 1,41 (0,95 tot 2,1)). De bewijskracht is zeer laag gezien beperkingen in de studieopzet, inconsistentie, indirectheid en imprecisie.
Subgroep patiënten met stamceltransplantatie
In de subgroep patiënten met een stamceltransplantatie (2 studies, 319 patiënten) kreeg in de groep die bij een lage trigger transfusie kregen 8,9% (14 van 157 patiënten) een bloeding in vergelijking met 11,7% (19 van 162) in de groep met hoge trigger (RR 0,76 (0,4 tot 1,45)). De bewijskracht is zeer laag gezien beperkingen in de studieopzet, inconsistentie, indirectheid en imprecisie.
Infecties (bacteriëmie)
De uitkomstmaat infecties werd gerapporteerd in één studie (166 patiënten). In de groep die bij een lage trigger transfusie kregen kreeg 39,2% (31 van 79 patiënten) een infectie in vergelijking met 34,5% (30 van 87) in de groep met hoge trigger (RR 1,14 (0,76 tot 1,7)). De bewijskracht is laag in verband met beperkingen in de studieopzet en imprecisie.
Adverse events
De uitkomstmaat adverse events werd gerapporteerd in één studie (78 patiënten). In de groep die bij een lage trigger transfusie kregen had 0% (0 van 37 patiënten) een adverse event in vergelijking met 19,5% (8 van 41) in de groep met hoge trigger (RR 0,07 (0 tot 1,09)). De bewijskracht is laag gezien beperkingen in de studieopzet en imprecisie.
Aantal units (trombocyten) getransfundeerd per patiënt
De uitkomstmaat aantal units (trombocyten) getransfundeerd per patiënt werd gerapporteerd in drie studies (492 patiënten). Het gemiddeld aantal units per patiënt was 1,96 lager in de low-trigger groep (3,03 tot 0,89 lager)). De bewijskracht is redelijk gezien beperkingen in de studieopzet.
Subgroep patiënten met chemotherapie
In de subgroep patiënten met chemotherapie (2 studies, 333 patiënten) was het gemiddeld aantal units getransfundeerd per patiënt 2,09 (3,2 tot 0,99 lager) lager in de lage trigger groep. De bewijskracht is matig gezien beperkingen in de studieopzet.
Subgroep patiënten met stamceltransplantatie
In de subgroep patiënten met stamceltransplantatie (1 studie, 78 patiënten) was het gemiddeld aantal units getransfundeerd per patiënt 0,2 (4,27 lager tot 4,67 hoger) hoger in de lage trigger groep. De bewijskracht is redelijk gezien beperkingen in de studieopzet.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Is een profylactische trombocytentransfusie geïndiceerd bij volwassenen en kinderen met een trombocytopenie (trombocytenaantal lager dan 10*109/L) door een tijdelijke aanmaakstoornis?
Definities
- De standaarddosis trombocytenconcentraat bij trombocytentransfusie (TT) wordt gedefinieerd als 1 volledige eenheid TROMBOCYTEN, samengevoegd in PAS-E/plasma (kinderen 15-20ml/kg trombocyten tot maximaal 1 volledige samengevoegde eenheid) of een equivalent gedoseerd single donor aferese product. Voor aanvullende specificaties wordt verwezen naar de bloedwijzer van de stichting Sanquin Bloedvoorziening:
P: volwassenen en kinderen met een trombocytopenie (aantal lager dan 10*109/L) door een tijdelijke aanmaakstoornis (bijvoorbeeld chemotherapie geïnduceerd);
I: geen profylactisch trombocytentransfusie beleid (therapeutische TT);
C: profylactisch trombocytentransfusie beleid;
O: mortaliteit, infecties, bloedingen (kritisch: WHO-bloeding graad ≥ 2 en bloeding graad 3 tot 4), kwaliteit van leven, adverse events, duur ziekenhuisopname, aantal patiënten dat een TT nodig had, aantal units getransfundeerd.
De NICE-richtlijn van 2015 (paragraaf 12.2) is als uitgangspunt gebruikt (NICE, 2015). In een aanvullende search is naar de meest recente literatuur gezocht.
Relevante uitkomstmaten
In de NICE-richtlijn werden de volgende uitkomstmaten benoemd als kritische uitkomstmaten: all-cause mortaliteit na 30 dagen, infecties, het optreden van bloedingen , kwaliteit van leven en ernstige adverse events zoals gedefinieerd in de studies. Duur van ziekenhuisopname, aantal patiënten dat een trombocytentransfusie nodig had en aantal units getransfundeerd werden benoemd als belangrijke uitkomstmaten. De werkgroep sluit zich aan bij deze benoemde uitkomstmaten.
Zoeken en selecteren (Methode)
De NICE-richtlijn van 2015 (paragraaf 12.2) is als uitgangspunt gebruikt (NICE, 2015). In een aanvullende search is naar de meest recente (vanaf de zoekdatum van de NICE-richtlijn: januari 2015) literatuur gezocht.
In de databases Medline (OVID), Embase en de Cochrane Library is met relevante zoektermen gezocht naar reviews en gerandomiseerde studies (RCT) waarin een profylactisch trombocytentransfusie beleid wordt vergeleken met een therapeutisch trombocytentransfusie beleid in het Engels of Nederlands. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 343 treffers op.
Studies werden geselecteerd op grond van de volgende selectiecriteria: vergelijkende studie (profylactisch versus therapeutisch trombocytentransfusiebeleid) bij volwassen (>18 jaar) en pediatrische patiënten met trombocytopenie, gepubliceerd in Engels of Nederlands, met rapportage van minimaal één van de benoemde uitkomstmaten. Op basis van titel en abstract werden in eerste instantie 14 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 14 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en geen studies definitief geselecteerd. De literatuuranalyse uitgevoerd voor de NICE-richtlijn zal daarom worden overgenomen voor deze richtlijn.
Referenties
- Crighton GL, Estcourt LJ, Wood EM, et al. A therapeutic-only versus prophylactic platelet transfusion strategy for preventing bleeding in patients with haematological disorders after myelosuppressive chemotherapy or stem cell transplantation. Cochrane Database Syst Rev. 2015;(9):CD010981.NICE, 2015.
- Diedrich B, Remberger M, Shanwell A, et al. A prospective randomized trial of a prophylactic platelet transfusion trigger of 10 x 10 (9) per L versus 30 x 10(9) per L in allogeneic hematopoietic progenitor cell transplant recipients. Transfusion. 2005;45(7):1064-72.
- Heckman KD, Weiner GJ, Davis CS, et al. Randomized study of prophylactic platelet transfusion threshold during induction therapy for adult acute leukemia: 10,000/microL versus 20,000/microL. J Clin Oncol. 1997 Mar;15(3):1143-9. PubMed PMID: 9060557.
- Josephson CD, Granger S, Assmann SF, et al. Bleeding risks are higher in children versus adults given prophylactic platelet transfusions for treatment-induced hypoproliferative thrombocytopenia. Blood. 2012;26:120(4):748-60. doi: 10.1182/blood-2011-11-389569. Epub 2012 Apr 26. PubMed PMID: 22538854.
- Kumar A, Mhaskar R, Grossman BJ, et al. Platelet transfusion: a systematic review of the clinical evidence. Transfusion. 2015;55(5):1116-27.
- Murphy S, Litwin S, Herring LM, et al. Indications for platelet transfusion in children with acute leukemia. Am J Hematol. 1982;12(4):347-56. PubMed PMID: 6981349.
- NICE. Guideline Transfusion - Blood transfusion. 2015.
- Rebulla P, Finazzi G, Marangoni F, et al. The threshold for prophylactic platelet transfusions in adults with acute myeloid leukemia. Gruppo Italiano Malattie Ematologiche Maligne dell'Adulto. N Engl J Med. 1997;25:337(26):1870-5. PubMed PMID: 9407153.
- Stanworth SJ, Estcourt LJ, Powter G, et al. TOPPS Investigators. A no-prophylaxis platelet-transfusion strategy for hematologic cancers. N Engl J Med. 2013;9:368(19):1771-80. doi: 10.1056/NEJMoa1212772. PubMed PMID: 23656642.
- Wandt H, Schaefer-Eckart K, Wendelin K, et al. Study Alliance Leukemia. Therapeutic platelet transfusion versus routine prophylactic transfusion in patients with haematological malignancies: an open-label, multicentre, randomised study. Lancet. 2012;13:380(9850):1309-16. doi: 10.1016/S0140-6736(12)60689-8. Epub 2012 Aug 8. PubMed PMID: 22877506.
- Zumberg MS, del Rosario ML, Nejame CF, et al. A prospective randomized trial of prophylactic platelet transfusion and bleeding incidence in hematopoietic stem cell transplant recipients: 10,000/L versus 20,000/microL trigger. Biol Blood Marrow Transplant. 2002;8(10):569-76. PubMed PMID: 12434952.
Evidence tabellen
Voor de evidence-tabellen wordt verwezen naar appendix H, tabel H.4.1 (pagina 366); GRADE-tabellen naar appendix J, tabel J.4 (pagina 543); en Forest plots naar appendix K, sectie 5.4, tabellen 99 van de NICE-richtlijn.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur(s) |
Reden |
|
Estcourt LJ, Stanworth SJ, Murphy MF. Different Platelet Count Thresholds to Guide Use of Prophylactic Platelet Transfusions for Patients With Hematological Disorders After Myelosuppressive Chemotherapy or Stem Cell Transplantation. JAMA Oncol. 2016;2(8):1091-2.CLINICAL QUESTION: What is the optimal platelet count threshold for prophylactic platelet transfusions to minimize bleeding, platelet use, and adverse clinical outcomes in thrombocytopenic patients with hematological malignant neoplasms? |
Is een samenvatting/reflectie op de Cochrane review |
|
Ashraf A, Hadjinicolaou AV, Doree C, Hopewell S, Trivella M, Estcourt LJ. Comparison of a therapeutic-only versus prophylactic platelet transfusion policy for people with congenital or acquired bone marrow failure disorders. Cochrane Database Syst Rev. 2016;9:01 |
Is study protocol, geen volledige studie |
|
Stanworth SJ, Wood E, Wandt H. Do all patients with haematological malignancies need prophylactic platelets? Vox Sang. 2015;109:33 |
Beschrijving van 2 gepubliceerde RCTs (Wandt 2012 en Stanworth) die beiden al in de NICE zitten |
|
Kumar A, Mhaskar R, Grossman BJ, Kaufman RM, Tobian AA, Kleinman S, et al. Platelet transfusion: a systematic review of the clinical evidence. Transfusion. 2015;55(5):1116-27 |
Goede review, maar voor de vraag die wij stellen (profylactisch versus niet profylactisch bij hematologie patiënten) includeren ze dezelfde studies als in de NICE. Beschrijven ook andere patiëntpopulaties |
|
Kaufman RM, Djulbegovic B, Gernsheimer T, Kleinman S, Tinmouth AT, Capocelli KE, et al. Platelet transfusion: a clinical practice guideline from the AABB. Ann Intern Med. 2015;162(3):205-13.BACKGROUND: |
Overlap NICE. |
|
Fasano RM, Josephson CD. Platelet transfusion goals in oncology patients. Hematol. 2015;2015:462-70 |
Overlap NICE. Is een niet systematische review van richtlijnen en RCT’s |
|
Estcourt LJ, Stanworth SJ, Doree C, Hopewell S, Trivella M, Murphy MF. Comparison of different platelet count thresholds to guide administration of prophylactic platelet transfusion for preventing bleeding in people with haematological disorders after myelosuppressive chemotherapy or stem cell transplantation. Cochrane Database Syst Rev. 2015(11):CD010983 |
Overlap NICE |
|
Crighton GL, Estcourt LJ, Wood EM, Trivella M, Doree C, Stanworth S. A therapeutic-only versus prophylactic platelet transfusion strategy for preventing bleeding in patients with haematological disorders after myelosuppressive chemotherapy or stem cell transplantation. Cochrane Database Syst Rev. 2015(9):CD010981 |
Overlap NICE |
|
Pine AB, Lee EJ, Sekeres M, Steensma DP, Zelterman D, Prebet T, et al. Wide variations in blood product transfusion practices among providers who care for patients with acute leukemia in the United States. Transfusion. 2017;57(2):289-95 |
Geen klinische vergelijkende studie maar beschrijving van praktijkvariatie |
|
Schäfer-Eckart K. Choose wisely - Individualized and economic indications for platelet transfusions. Oncology Research and Treatment. 2016;39:101 |
Is een poster, geen volledig artikel |
|
Stanworth SJ, Hudson CL, Estcourt LJ, Johnson RJ, Wood EM, investigators Ts. Risk of bleeding and use of platelet transfusions in patients with hematologic malignancies: recurrent event analysis. Haematologica. 2015;100(6):740-7 |
Secundaire analyse data Stanworth, 2013 (deze studie is reeds in de NICE guideline geïncludeerd). Relevant voor overwegingen (welke patientkarakteristieken voorspellen bloedingen/ baat bij Trombocytentransfusies) maar beantwoord niet de uitgangsvraag |
|
Annen K, Olson JE. Optimizing platelet transfusions. Curr Opin Hematol. 2015;22(6):559-64 |
Niet systematische review/opiniestuk |
|
Schäfer-Eckart K. Choose wisely - Individualized and economic indications for platelet transfusions. Oncology Research and Treatment. 2016;39:101 |
Is een poster, geen volledig artikel |
|
Zeller MP, Al-Habsi KS, Heddle NM. Prophylactic platelet transfusions: should they be a treatment of the past? Curr Opin Hematol. 2014;21(6):521-7 |
Overlap NICE |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-06-2019
Beoordeeld op geldigheid : 15-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn wordt een deel van de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn zal de werkgroep per module een inschatting maken over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging (NIV), Nederlandse Vereniging van Anesthesiologie (NVA) en Nederlandse Vereniging van Klinische Chemie (NVKC) zijn regiehouders van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De transfusierichtlijn geeft ten eerste antwoorden op grote uitgangsvragen over wie, wanneer, hoe, hoeveel en met welke producten getransfundeerd wordt en wat daarvan volgens wetenschappelijk onderzoek aan voordelig/nadelig resultaat verwacht mag worden. Na het bepalen van de wetenschappelijke waarde van dit onderzoek, worden uiteindelijk aanbevelingen opgesteld, gebaseerd op de conclusies van het wetenschappelijke onderzoek en na het beschouwen van een additionele context van bijvoorbeeld kosten- ethische, maatschappelijke of wettelijke overwegingen. Deze aanbevelingen zijn bedoeld om verantwoord en wenselijk handelen voor leden van de beroepsgroep te definieren in de voorkomende dagelijkse klinische praktijk. Echter, er kan beargumenteerd altijd afgeweken worden van de algemene aanbevelingen en gekozen worden voor een meer op de individuele patient afgestemde ondersteuning.
Doelgroep
Naast de genoemde beoogde gebruikers van de richtlijn is de richtlijn ook bedoeld en van waarde voor de collega’s van de nationale bloedvoorzieningsorganisatie Sanquin.
Samenstelling werkgroep
Voor de herziening van de richtlijn zijn er in 2016 zes multidisciplinaire werkgroepen ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij patiënten die een bloedtransfusie nodig hebben. Een stuurgroep, bestaande uit de voorzitters van de deelprojecten, coördineerde de werkgroepen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep Laboratoriumaspecten
- Dr. J (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, voorzitter, NVKC
- Dr. C. (Claudia) Folman, manager laboratorium erytrocytenserologie, NVKC
- Prof. dr. M (Masja) de Haas, clustermanager immunohematologie diagnostiek, NVKC
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. H. (Henk) Russcher, Laboratoriumspecialist Klinische Chemie en Hematologie, NVKC
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, NIV
- N. (Nel) Som, senior hoofdanaliste bloedtransfusiedienst, NVML
- Dr. K.M.K. (Karen) de Vooght, laboratoriumsepcialist klinische chemie en transfusie, NVKC
- Dr. H. (Harry) de Wit, Laboratoriumspecialist Klinische Chemie en Hematologie, NVKC
Werkgroep Anemie
- Prof. dr. J.J. (Jaap Jan) Zwaginga, internist-hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde, voorzitter, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- dr. J.M. (Jurriën) ten Berg, Cardioloog, NVVC
- Dr. B.J. (Bart) Biemond, internist-hematoloog, NIV
- Dr. P.A.W. (Peter) te Boekhorst, internist-hematoloog/ transfusiespecialist, NIV
- Prof. dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- Dr. A.J. (Adriaan) van Gammeren, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. N.P. (Nicole) Juffermans, Intensivist, NVIC
- Dr. A.W.M.M. (Ankie) Koopman-van Gemert, anesthesioloog, NVA
- Dr. L.E.M. (Liesbeth) Oosten, internist-hematoloog, NIV
Werkgroep Trombocytentransfusies
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, hematoloog, voorzitter, NIV
- Dr. M. (Michiel) Coppens, internist-vasculaire geneeskunde, NIV
- Dr. A.J.G. (Gerard) Jansen, internist-hematoloog, NIV
- Dr. J.L.H. (Jean-Louis) Kerkhoffs, internist-hematoloog, NIV
- Dr. E. (Enrico) Lopriore, sectiehoofd neonatologie, NVK
- Dr. C. (Heleen) van Ommen, kinderarts hematoloog, NVK
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog-transfusiespecialist, NIV
- Dr. R.E.G. (Roger) Schutgens, internist-hematoloog, NIV
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, NVKC
- Dr. A.P.J. (Alexander) Vlaar, internist-intensivist, NVIC
Werkgroep Bloedingen en bloedbesparende technieken
- Dr. A. (Ankie) Koopman – van Gemert, anesthesioloog, voorzitter, NVA
- Dr. J.J. (Hans) Duvekot, gynaecoloog-perinatoloog, NVOG
- Dr. L.M.G. (Leo) Geeraedts, traumachirurg, NVvH
- Dr. ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Drs. E.J. (Elise) Huijssen-Huisman, kinderarts, kinderhematoloog, transfusiespecialist, NVK
- Dr. N.P. (Nicole) Juffermans, intensivist, NVIC
- Prof. dr. F.W.G. (Frank) Leebeek, internist hematoloog en internist vasculair geneeskundige, NIV
- P.M.J. (Peter) Rosseel, anesthesioloog–intensivist, NVA
- Dr. E.C.T.H. (Edward) Tan, traumachirurg, NVvH
- Drs. V.A. (Victor) Viersen, anesthesioloog, NVA
- Dr. A.B.A. (Alexander) Vonk, cardiothoracaal chirurg, NVT
- Prof. dr. J.J. (Jaap Jan) Zwaginga, hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde, NIV
Werkgroep Plasmatransfusies
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, voorzitter, NVKC
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- Dr. M. (René) van Hulst, ziekenhuisapotheker, NVZA
- Prof. dr. K. (Karina) Meijer, internist-hematoloog, NIV
- Dr. M.C.A. (Marcella) Müller, internist-intensivist, NVIC
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog/transfusiespecialist, NIV
- Dr. Marjolein Peters, kinderarts-hematoloog, NVK
- Drs. K.N.M.E.M. (Koen) Reyntjens, anesthesioloog, NVA
Werkgroep Transfusiereacties en gerelateerde aandoeningen
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, voorzitter, NIV
- Dr. J.L.P. (Hans) van Duynhoven, laboratoriumspecialist klinische chemie, NVKC
- Drs. C.T. (Christian) Favoccia, anesthesioloog, NVA
- Prof dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. T. (Tanja) Netelenbos, internist-hematoloog, NIV
- Dr. J. (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. Dik Versteeg, arts-microbioloog, NVMM
- Dr. A.P.J. (Alexander) Vlaar, internist-Intensivist, NVIC
- Dr. J.C. (Jo) Wiersum-Osselton, TRIP hemo- en biovigilantie, landelijk coördinator, sociale geneeskunde
- C. (Clary) Wijenberg, verpleegkundig specialist palliatieve zorg, V&VN
Met ondersteuning van:
- Dr. M.M. (Marja) Molag, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S.M. (Sabrina) Muller-Ploeger, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Marleen) Ploegmakers, senior-adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E. (Ester) Rake, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E.E. (Eva) Volmeijer, adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider
- Drs. T. (Tessa) Geltink, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S. (Sanne) Snoeijs, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Voorzitters (kerngroep) |
||||
|
M. Schipperus |
Internist-hematoloog (100%) |
Voorzitter Bestuur Stichting TRIP (Transfusie in patiënten), onbetaald |
ITP-onderzoek gefinancierd door AMGeN Advisory board Novartis |
Lid participeert niet in besluitvorming omtrent producten van AMGEN of Novartis. |
|
A. Koopman- van Gemert |
Anesthesioloog |
Diverse functies bij nationale en internationale commissies bv Concilium, Stuurgroep antistolling, examencommissie et cetera Internationaal lid van de Europese examencommissie |
-Participatie in de PETS-studie van het EMC, geen financiële relatie. -Participatie in verschillende onderzoeken (geen financiële relatie en geen direct verband bloedtransfusie) -Organisatie symposia met sponsoring (geen directe financiële relatie en direct verband bloedtransfusie) |
Geen restricties |
|
J.J. Zwaginga |
Hematoloog LUMC (Leiden), Transfusiespecialist, Hoogleraar transfusiegeneeskunde |
-Penningmeester VHL=Vereniging Hematologische laboratoria -Voorzitter van de benigne hematologische werkgroep van NVvH |
-Sprekershonoraria Viforpharma (ijzer: medicatie kan transfusies uitsparen) -Wetenschappelijke adviesraad: Novantis (ijzerchelatie kan transfusie gemedieerde ijzerstapeling opheffen) - Gilead: CLL medicatie webcast geen relatie met transfusiebeleid PI van meerdere Sanquin onderzoeken ogv - allumminisatie door RBC transfusies - ijzertoxiciteit door bloedtransfusies - bloedings IRM (voldoende) plaatjestransfusies et cetera |
Lid participeert niet in besluitvorming omtrent Novartis en wanneer SANQUIN-studies worden geïncludeerd waarbij lid een van de auteurs is |
|
E. Beckers |
Internist-hematoloog/transfusiespecialist MUMC + Maastricht |
Bestuurslid Ned. Ver. Bloedtransfusie, onbetaald - Bestuurslid Ned. Ver. Hematologie, onbetaald - Lid adviesraad TRIP (Transfusie Reacties in Patiënten), onbetaald - Lid Landelijke Gebruikers Raad Sanquin, onbetaald - Lid Stuurgroep TiN studie (Trombocytopathie in Nederland) |
Project 'Predictors of Bleeding' externe financiering door Bayer
Transparantieregister.nl: sprekers vergoeding van Roche; gastvrijheidsbijdrage van: Roche, Pfizer, Sanquin en Bayer |
Lid participeert niet in besluitvorming omtrent producten van Bayer en Roche en wanneer specifiek de studie "predictors of bleeding" (gefinancierd door Bayer) worden geïncludeerd |
|
J. Slomp |
Laboratorium specialist Klinische Chemie en hematologie MST/Medlon |
-Bestuurslid VHL - onbetaald -Bestuurslid NVvH - onbetaald -Werkgroep Bloedtransfusie VHL (vz.) onbetaald -Lid LGR onbetaald - - Lid Expert committee TRIP (onbetaald) |
-Medical Advisory Board Janssen: advies omtrent bloedtransfusie bij patiënten die daratumumab gebruiken, betaald - In samenwerking met UMCU en VU bezig om een landelijk protocol op te stellen voor bloedtransfusie en daratumumab |
Lid participeert niet in besluitvorming omtrent productn van Janssen (daratumumab) |
|
H. Soons |
Laboratoriumspecialist Klinische Chemie, St. Anna Ziekenhuis (1 fte) en Kempenhaeghe (detachering vanuit St. Anna Ziekenhuis)
|
-Bestuur Nederlandse Vereniging voor Bloedtransfusie (NVB), voorzitter, onbetaald -Bestuur Transfusie Reacties in Patiënten (TRIP), secretaris, vacatiegeld - Medisch Advies Raad Sanquin (MAR), lid, vacatiegeld -Lid Landelijke Gebruikersraad Sanquin (LGR), onbetaald |
|
Geen restricties |
|
Werkgroep laboratoriumaspecten |
||||
|
H. de Wit |
Laboratoriumspecialist Klinische Chemie en Hematologie, Certe |
-Bestuurslid/ penningmeester Nederlandse Vereniging voor Bloedtransfusue (onbetaald) - Bestuurslid/ penningmeester Stichting Vrienden van de NVB (onbet aald) |
|
Geen restricties |
|
K. de Vooght |
Laboratoriumspecialist Klinische Chemie, Hoofd Patiëntenzorg LKCH ad interim |
Bestuurslid/ penningmeester Stichting TRIP (onbetaald) - Bestuurslid/voorzitter Stichting vrienden van de Utrechtse bloedbank (onbetaald) - Lid Werkgroep Consortium Transfusiegeneeskundig Onderzoek (onbetaald) - Lid PROTON II Adviesraad (onbetaald) - Lidmaatschap NVB - Lidmaatschap NVvH - Docent OKU (Onderwijs Kring Utrecht) (betaald) -Docent PAO Farmacie (betaald) -Lid Wetenschappelijke commissie NVB/TRIP symposium (onbetaald) |
|
Geen restricties |
|
C. Folman |
Manager Laboratorium Erytrocytenserologie (Sanquin) |
- Docent Hogeschool Arnhem en Nijmegen, betaald - Lid TRIX-werkgroep, onbetaald - Secretaris werkgroep Bloedtransfusie van de VHL (Vereniging Hematologische Laboratoriumdiagnostiek), onbetaald - Lid Expert Committee TRIP (Transfusie Reacties In Patiënten), onbetaald -Lid wetenschappelijke commissie NVB (Nederlandse Vereniging voor Bloedtransfusie), onbetaald" |
- Dienstverband Sanquin - werkzaam in expertiselaboratorium waar onderzoek wordt gericht voor derden op het gebied van bloedtransfusie |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
M. de Haas |
-Bijzonder hoogleraar Translationele Immunohematologie (bezoldiging Sanquin, onbezoldigd aangesteld bij LUMC -Clustermanager Immunohematologie Diagnostiek |
- Secretaris NVB (tot mei 2017) |
-Dienstverband Sanquin -Hoofd van een expertiselaboratorium dat ingezet zou kunnen worden door derden voor het uitvoeren van (uit de richtlijn voortkomende) laboratoriumdiagnostiek |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
H. Russcher |
Laboratoriumspecialist Klinisch Chemie en Hematologie, in het Erasmus MC en Havenziekenhuis |
- Auditor RvA i.h.k.v. ISO 15189:2012 voor medische laboratoria - Betaald |
|
restricties t.a.v. producten van Roche diagnostiek.Gebruikersraad geen belangen tav Sanquin, geen restriicties |
|
N. Som |
Senior hoofdanaliste bloedtransfusiedienst VUmc |
- Hemovigilantiecoördinator Vumc |
|
Geen restricties |
|
J. Lie |
-Stafadviseur hemovigilantie 24,8 uur -Weefselvigil antiecoördinator 7,2 uur" |
-Contactpersoon voor landelijk Bureau TRIP: meldingen transfusiereacties en bijwerkingen - Voorzitter landelijk Hemovigilantoe Platform Nederland (vanaf 2016, eerder lid, mede oprichter HPN), onbetaald - Voorzitter en oprichter Regionaal Hemovigilantie Platform Zuidoost - BestuursLid NVB |
|
Geen restricties |
|
Werkgroep Anemie |
||||
|
A. Van Gammeren |
Laboratoriumspecialist Klinische Chemie
|
|
|
Geen restricties
|
|
N. Juffermans |
Intensivist |
Chief editor Netherlands Journal of Critical Care, vergoeding |
|
Geen restricties
|
|
K. Bergman |
Kinderarts-neonatologie, Beatrix kinderziekenhuis, UMCG ten Groningen (0,9fte). Als kinderarts-neonatologie voorzitter van het Regioteam Perinatale Audit Noord Nederland (Perined). Deze functie (0,1fte) wordt uitgeoefend binnen de UMCG aanstelling. |
-Lid programmacommissie Prenatale screening infectieziekten en erytrocyten-immunisatie RIVM namens NVK (vacatiegeld) -Lid werkgroep neonatale infectieziekten sectie neonatologie NVK (onbetaald) -Projectcommissielid ZonMw project: Introduction of Audit generated Changes in perinatal care using ""Tailored"" implementation strategies. (ACTion-project) (onbetaald) =Projectcommissielid 5 genes per minute, afdeling Medische genetica, UMCG, Groningen (onbetaald) |
|
Geen restricties
|
|
P. te Boekhorst |
Internist-Hematoloog / Transfusiespecialist
|
Medisch Adviesraad Sanquin, Lid, Vacatiegeld
|
In verleden: - Gastvrijheid Firma Alexion - Adviesraad Firma AmgeN (ITP) |
Lid participeert niet bij besluitvorming omtrent ITP |
|
B. Biemond |
Internist-hematoloog |
|
|
Geen restricties |
|
L. Oosten |
Hematoloog, Afdeling Immunohematologie & Bloedtransfusie bij het Leids Universitair Medisch Centum |
|
|
Geen restricties |
|
K. Fijn van Draat |
-Hoogleraar kinderhematologie AMC - Senior onderzoeker Sanquin Research |
VIDI selectiecommissie ZONMW, onbetaald (wel vacatievergoeding) |
Lid van de stuurgroep van de PLANET-2 studie die onderzoek doet naar triggers van trombocytentransfusie bij neonatenop de Neonatale Intensive Care Unit. PLANET-2 ontvangt geen sponsoring van de farmaceutische industrie |
Geen restricties |
|
Werkgroep trombocytentransfusies |
||||
|
A. Vlaar |
- Internist-Intensivist, Academisch Medisch Centrum, Amsterdam - Principal investigator Infusion related morbidity and mortality in the critically ill |
- Klinisch brug figuur Sanquin, onbetaald
|
Onderzoek gefinancierd door NWO, ZonMW, Sanquin: PI van de PACER studie (onder andere): hierbij worden trombotriggers voor invasieve ingrepen aangehouden. |
Geen restricties (ten aanzien van PACER studie: geen tegengesteld belang. Studie wordt niet gepubliceerd binnen termijn afronding richtlijn). |
|
l. van Pampus |
Internist-hematoloog-transfusiespecialist Radboudumc |
- Vice voorzitter hemovigilantiekamer TRIP (onbezoldigd)
|
Tegemoetkoming verblijfkosten Dublin (Ierland) het 17th Annual NATA Symposium on Patient Blood Management, Haemostasis and Thrombosis (NATA 2016) cf de CGR-rgels. |
Geen restricties |
|
G. Jansen |
Internist-hematoloog, afdeling Hematologie, Erasmus MC |
Post doctoraal onderzoeker bij afdeling Plasmaeiwitten, Sanquin Bloedvoorziening. Gastvrijheidovereenkomst, onbetaald |
"1) Naam project: ""Surface sialic acid is critical for platelet survival"" Financier: Sanquin Product and Process development (PPOC nr. 13-019). Bedrag: 499.000 euro. Rol: AIO project 2013-2018. Principal investigator en co-promotor
Toelichting: van dit geld is een OIO aangesteld (Mw M. Rijkers) die in dienst van Sanquin (1,0 fte) dit onderzoek verricht" |
Bij onderwerp sialic acid en trombocytenoverleving geen trekker /betrokkenheid opstellen aanbevelingen |
|
J.L. Kerkhoffs |
Internist - Hematoloog (0,8 FTE)
|
Transfusie-specialist / transfusie research (0,2 FTE) via Sanquin
|
Op Sanquin verricht ik klinisch transfusie onderzoek wat deels gefinancieerd wordt door de industrie TerumoBCT: PI van de PREPAReS studie, een RCT naar de klinische effectiviteit van trombocyten concentraten behandeld met een pathogeen-reductie proces (Mirasol, TERUMO BCT).
|
Restricties t.a.v. producten behandeld met pathogeen reductie proces en biomarkers. Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig.
|
|
R. Schutgens |
Internist-hematoloog
|
Lid van Medische Adviesraad patiëntenvereniging ITP |
-Speakersfee (voor instituut) en/of unrestricted research grant en/of lid advisory board van: Bayer, Baxalta, CSL Behring, NovoNordisk, Sanquin, Pfizer, Bristol-Meyers Squibb -Principal Investigator van de Trombocytopathie in Nederland (TiN) studie, mede gefinancierd door een unrestricted grant van Sanquin - deelname (in UMCU) ontwikkeling PACT en U-PACT (geen financieel belang) |
Geen betrokkenheid vragen bij bloedplaatjesfunctietest (PACT). Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig. |
|
M. Coppens |
Internist-vasculaire geneeskunde
|
- Diverse naschollingen en adviesraden (allen incidenteel) aangaande directe orale anticoagulantie georganiseerd door de fabrikanten van deze middelen, te weten Boehringer Ingelheim, Bayer, Pfizer, Bristol-Meyers Squibb, Daiichi Sankyo. Deze diensten zijn betaald, waarbij het geld naar mijn instituut gaat - Adviesraad aangaande 'The future of hemophilia treatment' georganiseerd door CSL Behring. Twee maal een advisory board; in 2015 en 2016. Deze diensten zijn betaald waarbij geld naar instituut gaat. CSL Behring produceert o.a. Haemocomplettan P (fibrinogeenconcentraat) en Beriplex (vierfactorenconcentraat). De huidige richtlijn zal mogelijk off-label gebruik van deze 2 middelen gaan bespreken. De genoemde adviesraad richtte zich op hemofilie A en B en de producten Haemocomplettan P en Beriplex zijn hier niet aan de orde geweest." |
Lid van de Stuurgroep van de Trombopathie in Nederland studie (geen financiele belangen). -Sanquin Blood Supply: Prothrombin Complex Concentrate (PCC) for the immediate reversal of the anticoagulant effects if new oral anticoagulants in emergency situations. Sanquin Blood Supply is producent van Cofact, een PCC, - CSL Behring: Biomarkers to detect subclinical arthropathy and predict long-term clinical arthropathy in patients with hemophilia. This project was awarded a 2016 Heimburger Award. CSL Behring produceert zowel Haemocomplettan P (fibrinogeenconcentraat) als Beriplex (een PCC), Dit project is gecofinancierd door CSL Behring, maar hebben geen betrekking op Haemocomplettan P noch Beriplex. |
Geen betrokkenheid opstellen aanbevelingen t.a.v. fibrinogeenconcrentraat en vierfactoren concentraat |
|
E. Lopriore |
Sectiehoofd Neonatologie WAKZ/LUMC |
Lid bloedtransfusiecommissie LUMC |
Onderzoek gefinancieerd door Sanquin: 1. PROC 12-012-027: Matisse studie: RCT in neonaten naar twee verschillende triggers voor trombocyten transfusies 50 vs 25; Promovenda: Suzanne Gunnink 2. PROC 16-33: Promotie onderzoek naar Rhesus hemolytische ziekt: Promovenda: Isabelle Ree |
Geen restricties |
|
H. van Ommen (meelezer) |
Kinderhematoloog |
|
'- PI Einstein junior (Bayer) Behandeling trombose bij kinderen - PI Hokusai kinderen (Daiichi Sankyo) Behandeling trombose bij kinderen - Nationaal coördinator BMS studie Apixaban ter preventie van trombose bij kinderen met een hartafwijking |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afstemming met de Patiëntenfederatie, Stichting Zeldzame Bloedziekten en Oscar Nederland. Deze verenigingen zijn uitgenodigd voor de invitational conference (knelpuntenanalyse) voorafgaand aan deze herziening en hebben input geleverd voor de te prioriteren vragen. De verenigingen hebben aangegeven graag in de commentaarfase de conceptrichtlijn te ontvangen voor commentaar. Tevens zal in de eindfase van deze richtlijn nog worden overlegd over de communicatie aan patiënten en of er nog aanvullende teksten voor patiënten kunnen worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij afronding van de richtlijn te vinden zijn bij de aanverwante producten. De werkgroep zal tevens de interne kwaliteitsindicatoren die bij de Richtlijn bloedtransfusie 2011 zijn opgesteld beoordelen en indien nodig door ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroepen en de adviseurs de knelpunten. De werkgroepen beoordeelden de aanbevelingen uit de eerdere richtlijn Bloedtransfusiebeleid (2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en andere aanwezigen tijdens de Invitational conference. De werkgroepen stelden vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn in de werkgroepen besproken waarna de werkgroepleden de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroepen tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews (Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje “Overwegingen”.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en de weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn word aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroepen. Naar aanleiding van de commentaren word de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroepen. De definitieve richtlijn word aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2012.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) Datum: 1 juli 2015 - maart 2017 Engels |
1 (BLOOD PLATELETS/ or (platelet* or thrombocyte*).ti.) and (exp BLOOD TRANSFUSION/ or transfus*.ti.) (5799) 2 PLATELET TRANSFUSION/ or PLATELETPHERESIS/ or ((platelet* or thrombocyte*) adj5 (prophyla* or transfus* or infus* or administ* or requir* or need* or product* or component* or concentrate* or apheres* or pooled or single donor or random donor)).tw. or (thrombocytopheres* or plateletpheres*).tw. or ((platelet* or thrombocyte*) adj5 (protocol* or trigger* or threshold* or schedul* or dose* or dosing or usage or utili?ation)).tw. (28714) 3 1 or 2 (30196) 4 exp Hematologic Neoplasms/ or Hematologic Diseases/ or exp Leukemia/ or exp Lymphoma/ or exp Neoplasms, Plasma Cell/ or exp Anemia, Aplastic/ or exp Bone Marrow Diseases/ or exp Thrombocytopenia/ or (thrombocytopeni* or thrombocytopaeni* or leukemi* or leukaemi* or lymphom* or aplast* anemi* or aplast* anaemi* or myelodysplas* or myeloproliferat* or myelom* or plasm??ytom*).tw,kf,ot. or (lymphogranulomato* or histiocy* or granulom* or thrombocythemi* or thrombocythaemi* or polycythemi* or polycythaemi* or myelofibros* or AML or CLL or CML or Hodgkin* or nonhodgkin* or reticulosis or reticulosarcom*).tw,kf,ot. or ((burkitt* adj (lymph* or tumo?r)) or lymphosarcom* or brill-symmer* or sezary).tw,kf,ot. or ((haematolog* or hematolog* or blood or red cell* or white cell* or lymph* or marrow or platelet*) adj3 (malignan* or oncolog* or cancer* or neoplasm* or carcinoma*)).tw,kf,ot. or exp Antineoplastic Agents/ or exp Remission Induction/ or exp Antineoplastic Protocols/ or exp Stem Cell Transplantation/ or Bone Marrow Transplantation/ or exp Radiotherapy/ or Lymphatic Irradiation/ or (chemotherap* or antineoplast* or anti-neoplast* or radiotherap* or radio-therap* or chemoradiotherap* or chemo-radiotherap* or stem cell* or progenitor cell* or (bone marrow adj2 (transplant* or graft* or engraft* or rescu*))).tw,kf,ot. or ((haematolog* or hematolog* or haemato-oncolog* or hemato-oncolog*) adj2 patients).tw,kf,ot. or (ASCT or ABMT or PBPC or PBSCT or PSCT or BMT or SCT or HSCT).tw,kf,ot. or (malignan* or oncolog* or cancer*).ti. (2771536) 5 3 and 4 (10132) 6 limit 5 to yr="2015 -Current" (925) 7 limit 5 to ed=20150701-20151231 (192) 8 6 or 7 (989) 9 limit 8 to english language (936) 10 ((randomized controlled trial or controlled clinical trial).pt. or randomi*.tw. or placebo.ab. or clinical trials as topic.sh. or randomly.ab. or groups.ab. or trial.ti.) not (exp animals/ not humans/) (2152306) 11 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (317197) 12 9 and 10 (153) 13 9 and 11 (53) 14 remove duplicates from 13 (44) 15 12 not 13 (125) 16 remove duplicates from 15 (118) |
343 |
|
Embase.com Datum: 1 juli 2015 - maart 2017 Engels |
|
|
