Transfusiebeleid voor IC-patiënten
Uitgangsvraag
Is een liberaal of restrictief beleid geïndiceerd voor correctie van anemie bij (niet-bloedende) IC-patiënten?
Aanbeveling
- Transfundeer 1 unit rode bloedcellen bij IC patiënten bij Hb van 4,3 mmol/L of lager.
- Overweeg transfusie van 1 unit rode bloedcellen bij IC patiënten met een acuut coronair syndroom bij Hb 5,0 mmol/L of lager.
- Monitor de Hb-waarde voor een volgende transfusieorder.
- Stem bij overplaatsing naar de afdeling af of bij de patiënt hetzelfde restrictief beleid gehandhaafd kan worden.
Overwegingen
De transfusietrigger in de onderzochte studies op de intensive care unit verschilt tussen de studies. De restrictieve arm betreft in het algemeen een Hb trigger van 7g/dL (4,3 mmol/L). Met een liberale trigger wordt meestal een Hb trigger van 9g/dl (5,6 mmol/L) en incidenteel een Hb trigger van 10g/dl (6,2 mmol/L) bedoeld.
Voor patiënten met een cardiovasculaire belasting wordt meestal bij een restrictief transfusiebeleid een Hb trigger van 8 g/dl (5,0 mmol/L) en bij liberaal transfusie beleid een trigger van 9-10 g/dl (5,6 – 6,2 mmol/L) gehanteerd.
De studies verricht na de landmark trial Hebert (1999) bevestigen consistent dat een restrictieve trigger van Hb 4,3 mmol/L bij patiënten op IC niet gepaard gaat met slechtere uitkomsten. Het blijkt dat anemie goed wordt verdragen met als voordeel dat er minder bloedtransfusie gegeven hoeft te worden. Een restrictieve trigger verhoogt niet de mortaliteit en infectierisico, en verlengt niet de ligduur in de studies geselecteerd voor deze zoekvraag. Gezien dat een restrictieve trigger geen nadelen of extra risico’s met zich meebrengt, maar daarnaast wel leidt tot een kosteneffectief en zinnig bloedverbruik, lijkt het hanteren van een restrictieve trigger van 7 g/dl (4,3 mmol/L) voor de algemene IC-populatie zonder ernstig coronair lijden zinvol. Opgemerkt dient te worden dat infectie vaak niet werd gerapporteerd. Een voorkeur voor restrictief beleid vanwege niet aantoonbare nadelen, komt overeen met andere richtlijnen alsook met expert opinion (Hebert, 2014). Echter, een belangrijke limitatie is dat patiënten met coronarialijden geëxcludeerd werden van de meeste studies; zie subgroepen.
Met betrekking tot de transfusiedosis (aantal units per keer), hebben de meer recente studies de effecten onderzocht van één unit per keer. Dit beleid leidt tot een reductie van de hoeveelheid benodigd bloed vergeleken met de praktijk van transfusie van meerdere units (Berger, 2012). In het kader van een restrictief beleid onderschrijft deze richtlijn het geven van één unit per transfusie en de opbrengst daarvan te meten.
De indicatie tot transfusie stellen alsook het monitoren van de effectiviteit van transfusie op grond van symptomen acht de werkgroep in zijn algemeenheid onwerkbaar, omdat 1) patiënten symptomen niet goed kunnen aangeven vanwege kritisch ziek zijn of sedatie, en 2) het moeizaam is om symptomen van anemie (tachycardie, dyspnoe/hypoxie) toe te schrijven aan de anemie dan wel aan tal van andere oorzaken zoals deze vaak voorkomen op IC.
Subgroepen
Sepsis: Een lage Hb waarde blijkt goed te worden verdragen in IC-patiënten met sepsis. Opvallend is dat in de sepsis groep, een liberaal beleid minder risico lijkt te geven op een nieuw cardiaal event. Dit resultaat met een wijd betrouwbaarheidsinterval komt van 1 studie, waarin een nieuw cardiaal event werd gedefinieerd als een acuut myocard infarct of instabiele angina pectoris. Wanneer andere ernstige ischemische complicaties werden meegenomen (acuut CVA of ischemie van ledematen of darm), was er geen verschil tussen de transfusie armen. Ook waren er niet meer ischemische complicaties in de subgroep van patiënten met een chronisch cardiovasculair lijden. Ook is deze bevinding niet congruent met de bevinding dat ten aanzien van nieuwe cardiale complicaties, er een verschuiving is ten faveure van een restrictieve trigger in de algemene IC populatie, waarin andere studies zijn opgenomen die ook septische patiënten hebben geïncludeerd. Alles bij elkaar genomen is de overweging dat een lage Hb waarde goed wordt verdragen in sepsis.
In de sepsis groep, waarbij sprake is van hoog verbruik van zuurstof, zou de tot op heden beschreven 4-5-6 regel een liberaal beleid adviseren. Deze regel kan daarom beter vervangen worden door de beslisregel om alleen te transfunderen bij een Hb van <4,3 mmol/L, mits geen coronarialijden.
Cardiovasculair: In veel van de aangehaalde studies die geen slechtere uitkomsten bij restrictief beleid aantonen, werden patiënten met een acuut coronair syndroom geëxcludeerd. Studies in de subpopulatie van cardiovasculair gecompromitteerde patiënten, inclusief een acuut coronair syndroom, zijn beperkt in aantal, en hebben vaak een laag aantal geïncludeerde patiënten, wat interpretatie van data bemoeilijkt. In deze context valt op dat het risico op slechtere uitkomst bij cardiovasculaire patiënten op de IC bij een restrictieve trigger enigszins verschuift naar een hoger risico, wat suggereert dat een Hb trigger van 7 g/dl (4,3 mmol/L) minder goed verdragen wordt. Voor patiënten met acuut en chronisch coronair lijden, stelt ook de NICE-richtlijn vast dat er fysiologische redenen zijn waardoor anemie minder goed getolereerd zou kunnen worden. De NICE-richtlijn heeft gekozen voor een iets liberalere transfusietrigger ten opzichte van patiënten met cardiale compensatie mogelijkheden, met een arbitraire trigger van 8 g/L (5,0 mmol/L). Deze aanbeveling is gebaseerd op zeer lage tot lage bewijskracht.
Op grond hiervan kan bij patiënten met een acuut coronair syndroom op de IC, een meer liberale Hb trigger (5,0 mmol/l) worden overwogen. Of een liberale trigger ook moet worden overwogen bij patiënten op de IC met hartfalen maar zonder coronarialijden, kan niet worden beantwoord. NB: postoperatieve cardiochirurgische patiënten die volledig zijn gerevasculariseerd, vallen niet onder de noemer ‘coronarialijden’.
Hersenletsel: Hoewel observationele studies suggereren dat een beschadigd brein een verminder vermogen heeft om een anemie te tolereren, werd er maar één studie (Robertson, 2014) gevonden die een restrictieve trigger met een liberale trigger heeft vergeleken in patiënten met traumatisch hersenletsel. In deze studie werd geen verschil gevonden. Op grond hiervan kan de werkgroep geen reden vinden om een andere trigger dan 7 g/dL (4,3 mmol/L) aan te bevelen.
Overwegingen bij ontslag van IC naar de afdeling.
De werkgroep adviseert om transfusieprotocollen af te stemmen met de ontvangende afdelingen. De werkgroep merkt op dat het hanteren van een restrictieve trigger in de IC-populatie altijd gepaard gaat met intensieve monitoring, inclusief meerdere Hb metingen per dag. Als een patiënt naar de afdeling wordt overgeplaatst, is een dergelijke intensieve monitoring mogelijk niet langer haalbaar. Ook zal een patiënt bij overplaatsing waarschijnlijk meer gaan mobiliseren, waarbij een restrictieve trigger mogelijk niet goed wordt verdragen. De werkgroep adviseert om bij ontslag van anemische patiënten van IC naar de verpleegafdeling naar intensieve monitoring te blijven streven.
Onderbouwing
Achtergrond
Met een incidentie van 90% is anemie een kenmerk van kritisch ziek zijn. Daardoor ontvangt ongeveer 40% van de kritische zieke patiënten een rode bloedcel transfusie gedurende zijn/haar verblijf op de Intensive Care. Het hanteren van een optimale transfusietrigger is van groot belang, omdat zowel anemie als transfusie geassocieerd zijn met een slechte uitkomst van IC-patiënten.
Wat wordt behandeld in deze sectie?
De landmark trial van Hebert in 1999 heeft wereldwijd geresulteerd in een restrictief transfusiebeleid op de IC. Er bleven echter vragen over specifieke groepen patiënten die op fysiologische veronderstellingen een restrictieve trigger mogelijk niet goed verdragen, door ofwel een verminderd vermogen tot compenseren door een cardiovasculaire aandoening, ofwel door een hoog zuurstofverbruik zoals bij sepsis. Deze fysiologische veronderstelling is jarenlang in Nederland de grondslag geweest van de 4-5-6 regel. Daarnaast zijn er veronderstelde specifieke condities die gepaard gaan met een verminderd vermogen om een anemie te tolereren, zoals hersenletsel. De afgelopen jaren zijn verschillende trials op de IC uitgevoerd die het mogelijk maken om uitspraken te doen met betrekking tot indicaties voor transfusie bij deze specifieke patiëntgroepen gebaseerd op onderzoeksdata.
Wat wordt niet behandeld in deze sectie?
Het transfusiebeleid bij bloedende patiënten op de IC wordt in een ander deel van de transfusierichtlijn behandeld. Voor het transfusiebeleid bij ECMO zijn onvoldoende data beschikbaar. Dit is daarom niet opgenomen in deze richtlijn. In vrijwel geen van de geïncludeerde artikelen is een leeftijdsgerelateerde trigger bestudeerd.
Conclusies / Summary of Findings
Mortaliteit
|
Hoog GRADE |
Er werd geen verschil gevonden in mortaliteit tussen een restrictief en een liberaal beleid voor IC-patiënten.
Analyse van subgroepen laat een verschuiving van het risico op mortaliteit zien richting de voorkeur voor een liberaler transfusiebeleid bij patiënten met een cardiovasculaire aandoening vergeleken met de overige groepen (Figuur 1).
Bronnen (Carson, 2013; Cholette, 2011; Cooper, 2011; Hebert, 1995; Hebert, 1999; Holst, 2014; Lacroix, 2007; Murphy, 2015; Robertson, 2014; Walsh, 2013) |
Nieuw cardiaal event
|
Hoog GRADE |
Er werd geen verschil gevonden in nieuwe cardiale events tussen een restrictief en een liberaal beleid.
Bronnen (Carson, 2013; Cooper, 2011; Hebert, 1999; Holst, 2014; Murphy, 2015) |
Ligduur in het ziekenhuis
|
Hoog GRADE |
Er werd geen verschil in ziekenhuisligduur gevonden tussen een restrictief en een liberaal beleid.
Bronnen (Cooper, 2011; Hebert, 1999 en 2001) |
Infecties zoals pneumonie
|
Hoog GRADE |
Er werd geen verschil gevonden in infectierisico tussen een restrictief en een liberaal beleid.
Bronnen (Carson, 2013; Hebert, 1999; Lacroix, 2007; Murphy, 2015; Robertson, 2014) |
Aantal units getransfundeerd
|
Hoog GRADE |
Er werd gemiddeld 1,4 units minder bloed getransfundeerd bij het volgen van een restrictief beleid dan bij het volgen van een liberaal beleid.
Bronnen (Carson, 2013; Cholette, 2011; Cooper, 2011; Hebert, 1999; Holst, 2014; Lacroix, 2007) |
Samenvatting literatuur
Beschrijving studies
De geselecteerde tien studies betroffen acht studies uit de NICE-richtlijn (Hebert, 1995; Hebert, 1999; Holst, 2014; Walsh, 2013; Carson, 2013; Cooper, 2011; Lacroix, 2007; Cholette, 2011) en twee studies gevonden in het aanvullende literatuuronderzoek (Robertson, 2014; Naidech, 2010). De belangrijkste studiekarakteristieken en literatuurresultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen beoordelingstabellen.
Hebert (1995) includeerde 96 normovolemische kritisch zieke patiënten met een Hb <9 g/dL (=5,6 mmol/l) binnen 72 uur na IC opname. Deze patiënten werden gerandomiseerd naar een liberale transfusiestrategie waarbij bij een trigger tussen 10 en 12 g/dL (6 tot 7,5 mmol/L) werd getransfundeerd of naar een restrictieve transfusiestrategie waarbij bij een trigger tussen 7 en 9 g/dL (4,3-5,6 mmol/L) werd getransfundeerd. De belangrijkste uitkomsten van deze studie waren mortaliteit, ligduur in het ziekenhuis en aantal units getransfundeerd.
De landmark trial van Hebert (1999) includeerde 838 euvolemische kritisch zieke patiënten met een Hb < 9 g/dL (<5,6 mmol/l) binnen 72 uur na IC opname. Deze patiënten werden gerandomiseerd naar een liberale transfusiestrategie waarbij bij een trigger < 9 g/dL (5,6 mmol/L) werd getransfundeerd of naar een restrictieve transfusiestrategie waarbij bij een trigger < 7 g/dL (4,3 mmol/L) werd getransfundeerd. De belangrijkste uitkomsten van deze studie waren mortaliteit, ontstaan van een nieuw myocardinfarct, andere cardiale complicaties, infecties, longaandoeningen, ligduur in het ziekenhuis en aantal patiënten en aantal units getransfundeerd. Hebert (2001) beschreef specifiek de resultaten en uitkomsten van deze studie voor de subgroep van patiënten met coronaire insufficiëntie.
Holst (2014) includeerde 998 patiënten met een septische shock en een Hb van 9 g/dL (5,6 mmol/L) of minder. Deze patiënten kregen één unit leukocyten-gereduceerd bloed bij een liberale trigger van < 9 g/dL (5,6 mmol/L) of bij een restrictieve trigger van < 7 g/dL (4,3 mmol/L) tijdens hun ic-verblijf. De belangrijkste uitkomst was mortaliteit na 90 dagen. Daarnaast werden ook de uitkomsten nieuw myocardinfarct, ischemisch event en aantal units en aantal getransfundeerde patiënten gerapporteerd.
Walsh (2013) includeerde 100 anemische (Hb 9 g/dL of 5,6 mmol/L) oudere (≥55 jaar) kritisch zieke patiënten die mechanische ventilatie nodig hadden. Deze patiënten werden gerandomiseerd naar een liberale transfusiestrategie waarbij bij een trigger < 9 g/dL (5,6 mmol/L) werd getransfundeerd of naar een restrictieve transfusiestrategie waarbij bij een trigger < 7 g/dL (4,3 mmol/L) werd getransfundeerd. De belangrijkste uitkomsten van deze studie waren mortaliteit, ligduur in het ziekenhuis en aantal getransfundeerde units.
Carson (2013) includeerde 110 patiënten met acuut coronair syndroom of stabiele angina pectoris die cardiale katheterisatie ondergingen en een Hb < 10 g/dL (6,2 mmol/L) hadden. Deze patiënten werden gerandomiseerd over een liberale transfusiegroep waarbij één of meer units bloed werden gegeven om het Hb > 10 g/dL (6,2 mmol/L) te krijgen en een restrictieve transfusiegroep die bloed kreeg bij symptomen van anemie of een Hb < 8 g/dL (5,0 mmol/L). De belangrijkste uitkomsten van deze studie waren mortaliteit, nieuwe myocardinfarcten en andere cardiale events, pneumonie of sepsis en aantal getransfundeerde units.
Cholette (2011) includeerde 60 kinderen met single ventrikel fysiologie die voor een cavopulmonale verbinding waren opgenomen. De kinderen werden gerandomiseerd in een liberale transfusiegroep (transfusie bij ≤ 13 g/dL 8,1 mmol/L) of een restrictieve transfusiegroep (transfusie bij < 9 g/dL, 5,6 mmol/L). De belangrijkste uitkomsten van deze studie waren mortaliteit, ligduur in het ziekenhuis en aantal units en aantal getransfundeerde patiënten.
Cooper (2011) includeerde 45 patiënten met een acuut myocardinfarct en een hematocriet waarde < 30%. Deze patiënten werden gerandomiseerd over een liberale transfusiestrategie (transfusie bij een hematocriet van < 30%, om een hematocriet van 30% tot 33% te handhaven) of restrictieve transfusiestrategie (transfusie bij een hematocriet van < 24%, om een hematocriet van om 24% tot 27% te handhaven). De belangrijkste uitkomsten van deze studie waren mortaliteit, nieuw myocardinfact, ligduur in het ziekenhuis en aantal getransfundeerd units en patiënten.
Lacroix (2007) includeerde 637 kritisch zieke kinderen die een Hb < 9,5 g/dL (5,9 mmol/L) hadden binnen 7 dagen na IC-opname. Ze werden gerandomiseerd over een liberale transfusiestrategie (transfusie bij < 9,5 g/dL, 5,9 mmol/L) of een restrictieve transfusiestrategie (transfusie bij < 7 g/dL, 4,3 mmol/L). De belangrijkste uitkomsten van deze studie waren mortaliteit, nadelige effecten, infecties en aantal getransfundeerd units en patiënten.
Naidech (2010) includeerde 44 patiënten met een subarachnoïdale bloeding (SAB) en een hoog risico op vasospasme of een herseninfarct. Deze patiënten werden gerandomiseerd over een liberale transfusiestrategie (transfusie bij < 11,5 g/dL, 7,1 mmol/L) of restrictieve transfusiestrategie (transfusie bij < 10 g/dL, 6,2 mmol/L). De belangrijkste uitkomsten waren: longaandoeningen, infecties en aantal units en aantal getransfundeerd units en patiënten.
Robertson (2014) includeerde 200 patiënten met traumatisch hersenletsel met een gedaald bewustzijn. 102 patiënten kregen erythropoetine en 98 placebo gedurende drie dagen en daarna gedurende meer dan twee weken. 99 en 101 patiënten werden gerandomiseerd naar een liberale transfusiestrategie (transfusie bij <10 g/dL, 6,2 mmol/L) of een restrictieve transfusiestrategie (transfusie bij < 7 g/dL, 4,3 mmol/L). De belangrijkste uitkomsten van deze studie waren mortaliteit, trombo-embolische events, infecties en aantal getransfundeerde units en patiënten.
Resultaten
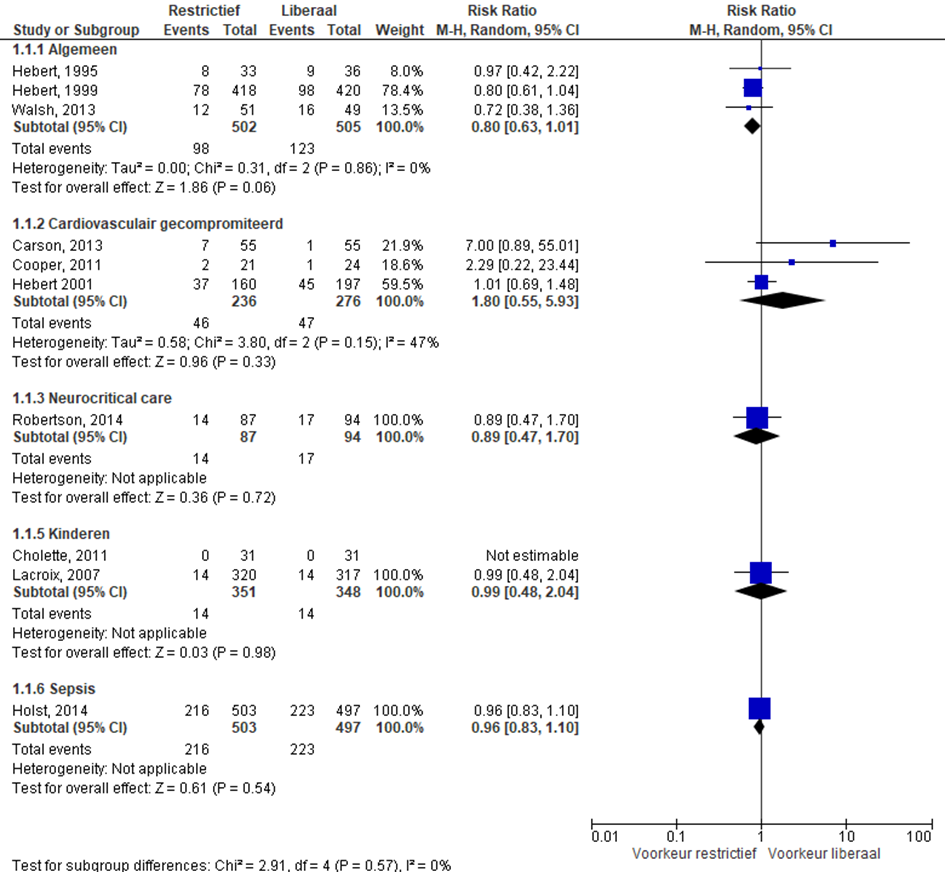
Mortaliteit na 30 dagen volwassenen
Negen studies beschreven de 30-dagen mortaliteit op de IC bij volwassenen (figuur 1). Er werd geen verschil gevonden tussen restrictief en liberaal beleid. De meta-analyse van 9 studies leverde een relatief risico op van 0.96 (0.85; 1.09).
Analyse van subgroepen laat een verschuiving van het risico op mortaliteit zien richting de voorkeur voor een liberaler transfusiebeleid bij patiënten met een cardiovasculaire aandoening vergeleken met de overige groepen.
Figuur 1 Mortaliteit uitgesplitst naar subgroepen: Sepsis, cardiovasculair, kinderen en neurocritical care
Kwaliteit van leven
De uitkomst kwaliteit van leven is niet voor de categorie IC-patiënten beschreven.
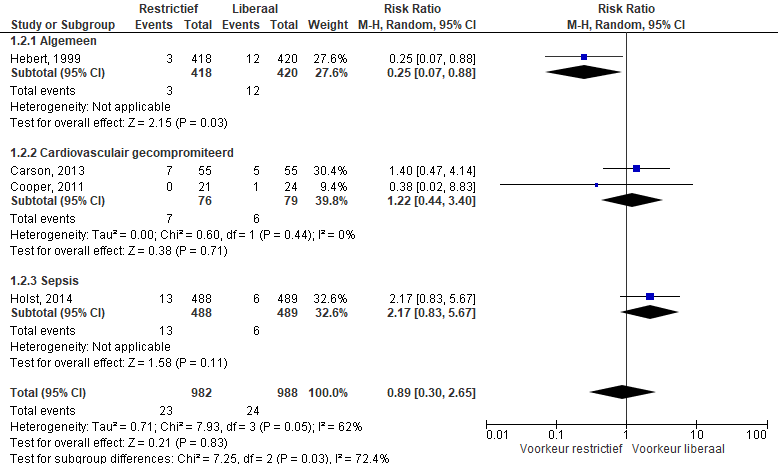
Nieuw cardiaal event
Vier studies beschreven een nieuw cardiaal event als uitkomstmaat bij volwassenen op de IC (Figuur 2). Er werd geen verschil gevonden tussen liberaal en restrictief beleid. Meta-analyse leverde een relatief risico op van 0,89 (95-%CI: 0,30; 2,65).
Analyse van subgroepen laat verschil zien tussen subgroepen. Een restrictieve transfusie trigger geeft in de algemene groep een verlaagd risico op een nieuw cardiaal event. In de sepsis groep is er een niet-significant verhoogd risico op een nieuw cardiaal event. In de studie van Hebert werden patiënten met coronairlijden geëxcludeerd.
Figuur 2 Nieuw cardiaal event opgesplitst naar subgroepen: Algemeen, cardiovasculair en sepsis
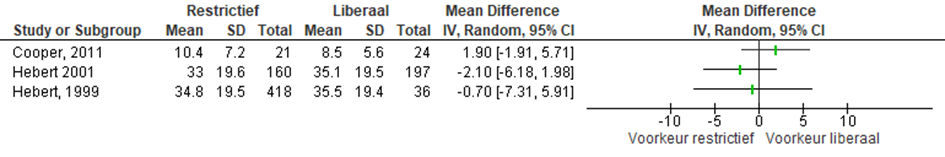
Ligduur in het ziekenhuis
Acht studies rapporteerden de uitkomst ligduur in het ziekenhuis. Drie daarvan rapporteerden de standaarddeviaties. Alleen deze werden opgenomen in onderstaande figuur (Figuur 3). Aangezien de populaties van Hebert (1999) en Hebert (2001) overlappen werd geen totaalscore gepresenteerd. Er werd geen verschil gevonden tussen beide groepen.
Figuur 3 Ligduur in het ziekenhuis
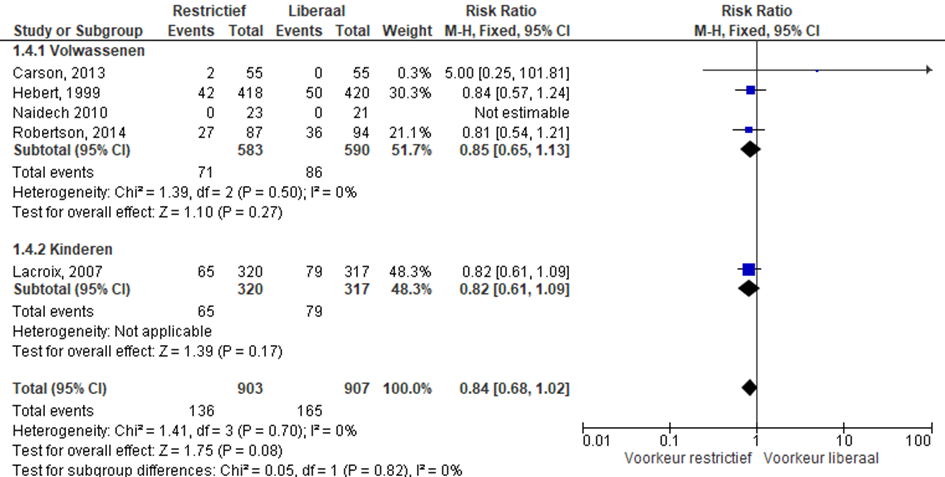
Infecties zoals pneumonie
Vier studies beschreven de uitkomstmaat infecties (zoals pneumonie) op de IC bij volwassenen en één bij kinderen (Lacroix, 2007) (figuur 4); er werd geen verschil gevonden tussen restrictief en liberaal transfusiebeleid. Meta-analyse van vijf studies leverde een relatief risico op van 0,84 (95%-CI: 0,68; 1,02).
Figuur 4 Infecties zoals pneumonie
Aantal units getransfundeerd
Zeven studies beschreven deze vergelijking op de IC (Figuur 5). Vijf studies bij volwassenen en twee studies bij kinderen. Er werd minder bloed getransfundeerd als een restrictief beleid gevolgd werd met een gemiddeld verschil van -1,34 (-2,73; 0,05).
Figuur 5 aantal units getransfundeerd na een restrictief dan wel liberaal transfusiebeleid
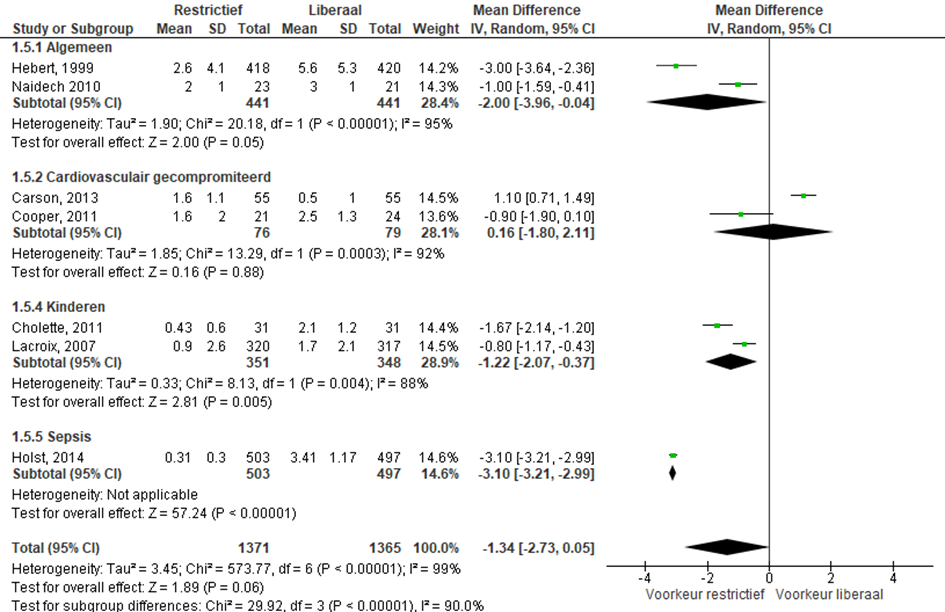
Bewijskracht van de literatuur
De bewijskracht van de geïncludeerde RCT’s is hoog. Er werd niet gedowngraded voor beperkingen in de studie-opzet (geen blindering) omdat blindering niet mogelijk was en omdat het risico op bias (gezien met name objectieve uitkomstmaten zijn meegenomen) klein is.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: Wat is de klinische effectiviteit van rode bloedcel transfusies bij lage en hoge hemoglobineconcentraties als transfusie trigger?
P: IC patiënten met anemie zonder bloeding (volwassenen, kinderen, jongeren)
I: lage (restrictieve) hemoglobine trigger voor erytrocytentransfusie;
C: hoge (liberale) hemoglobine trigger voor erytrocytentransfusie
O mortaliteit na 30 dagen, kwaliteit van leven, nieuw cardiaal event, ligduur in het ziekenhuis, (wond)infecties, aantal patiënten dat een transfusie nodig heeft, aantal units getransfundeerd.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit, nieuwe cardiale events, ligduur in het ziekenhuis, infecties zoals pneumonie, en kwaliteit van leven voor de besluitvorming kritieke uitkomstmaten.
Zoeken en selecteren (Methode)
Voor de uitgangsvraag werd de NICE-richtlijn ‘blood transfusion’ hoofdstuk 10 geadapteerd (NICE, 2015). Naast de NICE-richtlijn werd in de databases Medline (OVID), Embase en de Cochrane Library met relevante zoektermen gezocht naar studies die een liberaal bloedtransfusiebeleid vergeleken met een restrictief of conservatief beleid bij zowel IC-patiënten als patiënten die cardiochirurgie ondergingen en op de IC verbleven. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1354 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: origineel onderzoek, betrof (gedeeltelijk) patiënten die op de IC waren opgenomen, vergelijking van een restrictief met een liberaal of conventioneel beleid. Studies die betrekking hadden op acute myeloïde leukemie op de IC werden uitgesloten aangezien dit zeer specifieke patiënten betrof. Op basis van titel en abstract werden 62 studies voorgeselecteerd. Na raadpleging van de volledige tekst vielen 52 studies af (zie exclusietabel), vervolgens werden tien studies definitief geselecteerd.
10 studies zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Berger MD, Gerber B, Arn K, et al. Significant reduction of red blood cell transfusion requirements by changing from a double-unit to a single-unit transfusion policy in patiënts receiving intensive chemotherapy or stem cell transplantation. Haematologica. 2012;97(1):116-22.
- Carson JL, Brooks MM, Abbott JD, et al. Liberal versus restrictive transfusion thresholds for patiënts with symptomatic coronary artery disease. Am Heart J. 2013;165(6):964-971. PubMed PMID: 23708168.
- Cholette JM, Rubenstein JS, Alfieris GM, et al. Children with single-ventricle physiology do not benefit from higher haemoglobin levels post cavopulmonary connection: results of a prospective, randomized, controlled trial of a restrictive versus liberal red-cell transfusion strategy. Pediatr Crit Care Med. 2011;12(1):39-45. PubMed PMID: 20495502.
- Cooper HA, Rao SV, Greenberg MD, et al. Conservative versus liberal red cell transfusion in acute myocardial infarction (the CRIT Randomized Pilot Study). Am J Cardiol. 2011;15;108(8):1108-11. PubMed PMID: 21791325.
- Hébert PC, Wells G, Marshall J, et al. Transfusion requirements in critical care. A pilot study. Canadian Critical Care Trials Group. JAMA. 1995;273(18):1439-44. PubMed PMID: 7723158.
- Hébert PC, Wells G, Blajchman MA, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trials Group. N Engl J Med. 1999;11;340(6):409-17. PubMed PMID: 9971864.
- Hebert, Carson New England Journal of Medicine 371(15). 2014.
- Holst LB, Haase N, Wetterslev J, et al. Lower versus higher hemoglobin threshold for transfusion in septic shock. N Engl J Med. 2014;371(15):1381-91. PubMed PMID: 25270275.
- Lacroix J, Hébert PC, Hutchison JS, et al. Network. Transfusion strategies for patiënts in pediatric intensive care units. N Engl J Med. 2007;356(16):1609-19. PubMed PMID: 17442904.
- Naidech AM, Shaibani A, Garg RK, et al. Prospective, randomized trial of higher goal hemoglobin after subarachnoid hemorrhage. Neurocrit Care. 2010;13(3):313-20. PubMed PMID: 20717750.
- Robertson CS, Hannay HJ, Yamal JM, et al. Effect of erythropoietin and transfusion threshold on neurological recovery after traumatic brain injury: a randomized clinical trial. JAMA. 2014;312(1):36-47. PubMed PMID: 25058216.
- Rygård SL, Holst LB, Wetterslev J, et al. Higher versus lower haemoglobin threshold for transfusion in septic shock: subgroup analyses of the TRISS trial. Acta Anaesthesiol Scand. 2017;61(2):166-175. PubMed PMID: 27910086.
- Walsh TS, Boyd JA, Watson D, et al. Restrictive versus liberal transfusion strategies for older mechanically ventilated critically ill patiënts: a randomized pilot trial. Crit Care Med. 2013;41(10):2354-63. PubMed PMID: 23939351.
Evidence tabellen
|
Study reference |
Study characteristics |
Patiënt characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Carson, 2013
|
Type of study: RCT
Setting:
Country: USA
Source of funding: Funded by National Heart Lung and Blood Institute Grant Number: 1RC2HL101458-01. |
Inclusion criteria: (1) greater than 18 years of age; (2) had either (a) ST segment elevation myocardial infarction, (b) Non ST segment elevation myocardial infarction, (c) unstable angina, or (d) stable coronary artery disease undergoing a cardiac catheterization; and (3) had a hemoglobin concentration less than 10 g/dL at the time of random allocation.
Exclusion criteria: active bleeding from cardiac catheterization puncture site, including retroperitoneal, judged to be uncontrolled or needing surgical repair or resulting in hemodynamic instability at any time during the index admission; symptoms of anemia at the time of randomization; or other health concerns
N total at baseline: Intervention: 55 Control: 55
Important prognostic factors2: age ± SD: I: 74.3 ± 11.3 C: 67.3 ± 13.6
Sex: I: 49% M C: 51% M
Groups comparable at baseline? Yes, except for age |
Describe intervention (treatment/procedure/test):
restrictive transfusion strategy were permitted to receive a transfusion if they developed symptoms related to anaemia. A blood transfusion was also permitted, but not required, in the absence of symptoms if the haemoglobin concentration fell below 8 g/dL. There was no lower threshold for which blood was required in the restrictive group. Blood was to be administered one unit at a time and the presence of symptoms reassessed. Only enough blood was given to relieve symptoms or to increase the haemoglobin concentration above 8 g/dL. Symptoms of anaemia that were indications for transfusion included definite angina requiring treatment with sublingual nitro-glycerine or equivalent therapy, and unexplained tachycardia or hypotension. Leukoreduction was not required. |
Describe control (treatment/procedure/test):
liberal transfusion strategy received one unit of packed red blood cells following randomization and then received enough blood to raise the haemoglobin concentration to 10 g/dL or above any time the haemoglobin concentration was detected to be below 10 g/dL during the hospitalization for up to 30 days. |
Length of follow-up: We recorded daily haemoglobin concentrations for the first 3 days following randomization. We did not mandate daily measurements thereafter but recorded all other haemoglobin concentrations during the hospitalization (up to 30 days). All surviving patiënts discharged from the hospital by telephone at 30 days and 6 months after randomization to learn of their vital status and repeated hospital admissions
Loss-to-follow-up: Intervention: 1 Reasons (describe): Unable to contact patiënt Control: 0
Patiënt did not receive allocated intervention: I: 1 Reasons: Transfusion w/o symptoms and Hgb>=8 C: 6 Reasons: Withdrawal transfusion protocol, discharged before transfusion, discharged with Hgb<10
Incomplete outcome data: - |
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): I: 7 (13.0%) C: 1 (1.8%%)
Length of hospital stay: Not reported
Blood usage (units): I: 1.6 (SD 1.1) C: 0.5 (SD 1.0)
Pneumonia or blood stream infection: I: 2 (3.7%) C: 0
Cardiac events: Myocardial infarction: I: 7 (13%) C: 5 (9.1%)
Unscheduled coronary revascularization: I: 2 (3.7%) C: 0
Congestive heart failure: I: 7 (13%) C: 2 (3.6%)
DVT or pulmonary embolism: I: 0 C: 1 (1.8%)
|
acute coronary syndrome or stable angina undergoing cardiac catheterization |
|
Cholette, 2011 |
Type of study: RCT
Setting: PICU
Country: USA
Source of funding: unknown |
Inclusion criteria: infants and children presenting to the university of Rochester Medical Center for elective partial or total cavopulmonary connection (BDG or fontan procedures)
Exclusion criteria: no informed consent
N total at baseline: Intervention: 31 Control: 31
Important prognostic factors2: age ± SD: I: 27 ± 23 C: 32.5 ± 27
Sex: I: 56.6% M C: 56.6% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
Restrictive Restrictive transfusion group required 10 mL/kg of RBCs for any haemoglobin of 9.0 g/dL accompanied by clinical findings suggestive of symptomatic anemia (i.e. tachycardia and/or hypotension unresponsive to crystalloid or colloid infusion
|
Describe control (treatment/procedure/test):
Liberal Liberal transfusion group required 10mL/kg of RBCs for any haemoglobin of 13.0 g/dL regardless of whether there was a clinical indication for a transfusion |
Length of follow-up:
Excluded from study: Intervention: 1 Control: 1 Reasons (describe): Unable to have surgery performed and therefore excluded
Loss-to-follow-up or incomplete outcome data: none
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): Restrictive: 0 Liberal: 0
Myocardinfarct: Not reported
Ischemic event: Not reported
Infectious event: Not reported
Clinically significant pulmonary complications: Not reported
Patiënts transfused: Restrictive: 11 Liberal: 29
Units transfused: Restrictive: 0.43 ± 0.6 Liberal: 2.1 ± 1.2
No. of days in hospital (median): Restrictive: 11 (4-78) Liberal: 9.5 (5-62) |
Children with single ventricle physiology
Bij restrictive uitgaan van Hb in combinatie met symptomatic anaemia: is dat vergelijkbaar met de andere studies? |
|
Cooper, 2011 |
Type of study: RCT
Setting:
Country: USA
Source of funding: supported by the Cardiovascular Research Institute of the Washington Hospital Center and received no external funding |
Inclusion criteria: Patiënts admitted with acute myocardinfract (defined as ischemic-type chest discomfort lasting >=30 minutes and associated with a creatine kinase-MB (CK-MB) or cardiac troponin level above the upper limit of normal (determined locally); in whom the hematocrit was <=30% within 72 hours of symptom onset
Exclusion criteria: (1) noncoronary cause for clinical syndrome; (2) active bleeding, defined as overt blood loss accompanied by a decrease in hematocrit of >=5% in the preceding 12 hours; (3) inability or unwillingness to receive RBC transfusion; (4) RBC transfusion within 7 days of enrollment; (5) previous severe transfusion reaction; (6) imminent death; (7) decision to provide limited or comfort care; (8) age <21 years; (9) pregnancy; (10) participation in another clinical trial in which RBC transfusion was a requirement or a component of a primary or secondary end point; and (11) previous participation in the present study.
N total at baseline: Intervention: 21 Control: 24
Important prognostic factors2: For example age ± SD: I: 70.3 ± 14.3 C: 76.4 ± 13.5
Sex: I: 54% M C: 48% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
conservative transfusion strategy underwent RBC transfusion when their haematocrit decreased <24% with the goal of maintaining a hematocrit from 24% to 27%
Patiënts could receive RBC transfusion for any of the following reasons at the discretion of the treating physician: (1) active bleeding as defined earlier; (2) persistent hypotension related to hypovolemia; (3) active ischemia; and (4) at any time it was determined that it was in a patiënt’s best interest to receive a transfusion. Once the active issue was resolved, transfusion was again administered according to the study protocol |
Describe control (treatment/procedure/test):
liberal transfusion strategy underwent RBC transfusion when their hematocrit decreased <30% with the goal of maintaining a hematocrit from 30% to 33%
Patiënts could receive RBC transfusion for any of the following reasons at the discretion of the treating physician: (1) active bleeding as defined earlier; (2) persistent hypotension related to hypovolemia; (3) active ischemia; and (4) at any time it was determined that it was in a patiënt’s best interest to receive a transfusion. Once the active issue was resolved, transfusion was again administered according to the study protocol |
Length of follow-up: 30 days
Loss-to-follow-up: Intervention: 1 Control: 2 Reasons (describe): lost after hospital discharge
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): Restrictive: 2 Liberal: 1
Myocardinfarct: Restrictive: 0% Liberal: 5%
Ischemic event: Not reported
Infectious event: Not reported
Clinically significant pulmonary complications: Restrictive: Liberal:
Patiënts transfused: Restrictive: 54% Liberal: 100%
Units transfused: Restrictive: 1.6 ± 2.0 Liberal: 2.5 ± 1.3
No. of days in hospital (median): Restrictive: 10.4 ± 7.2 Liberal: 8.5 ± 5.6 |
Acute myocardial infarction |
|
Hebert, 1995 |
Type of study: multicentre, prospective, randomized clinical trial
Setting: tertiary level intensive care unit
Country: Canada
Source of funding: Canadian Red Cross Society, Blood Services, Ottawa, Ontario and the Physician’s Services Incorporated, North York, Ontario |
Inclusion criteria: all patiënts admitted to one of five tertiary-level intensive care units between March 1993 and January 1994 were considered elegible; patiënts were expected to stay more than 24 hours, had a haemoglobin value less than or equal to 90 g/L within 72 hours of ICU admission and were considered volume resuscitated or normovolemic by the attending staf
Exclusion criteria: less than 16 years of age, pregnant, unable to receive blood products, active blood loss at the time of enrolment, defined as a 30-gL decrease in haemoglobin in the preceding 12 hours or at least 3 U of packed RBCs during the same period; brain dead or not expected to survive for more than 24 hours, or admitted following routine cardiac surgical interventions
N total at baseline: Intervention: 33 Control: 36
Important prognostic factors2: Age ± SD: I: 58.6 ± 15 C: 59 ± 21
Sex: I: 42% M C: 53% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Restrictive transfusion strategy: Haemoglobin levels maintained between 70 and 90 g/L, with a transfusion trigger at 70 to 75 g/L
|
Describe control (treatment/procedure/test):
Liberal transfusion strategy: Hemoglobin level maintinaed between 100 and 120 g/L, with a transfusion trigger at 100 to 105 g/L |
Length of follow-up: 30 days
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): Restrictive: 24% Liberal: 25%
Units transfused: Restrictive: 2.5 Liberal: 4.8
No. of days in ICU (median): Restrictive: 6 (3-12) Liberal: 9 (5-12)
No. of days in hospital (median): Restrictive: 38 (25-62) Liberal: 31 (13-64) |
|
|
Hebert, 1999 |
Type of study: multicentre, prospective, randomized clinical trial
Setting: intensive care unit
Country: Canada
Source of funding: Supported by the Medical Research Council of Canada and by an unrestricted grant from Bayer.
|
Inclusion criteria: admitted to 1 of 22 tertiary-level and 3 community intensive care units in Canada between November 1994 and November 1997; patiënts who were expected to stay in the intensive care unit more than 24 hours, had a hemoglobin concentration of 9.0 g per deciliter or less within 72 hours after admission to the intensive care unit, and were considered to have euvolemia after initial treatment by attending physicians.
Exclusion criteria: an age of less than 16 years; inability to receive blood products; active blood loss at the time of enrollment; chronic anemia; pregnancy; brain death or imminent death (within 24 hours); a question on the part of attending physicians whether to withhold or withdraw ongoing treatment; and admission after a routine cardiac surgical procedure.
N total at baseline: Restrictive: 418 Liberal: 420
Important prognostic factors2: age ± SD: I: 57.1 ± 18.1 C: 58.1 ± 18.3
Sex: I: 64% M C: 61% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
restrictive strategy: maintained in the range of 7.0 to 9.0 g per deciliter, with a transfusion given when the hemoglobin concentration fell below 7.0 g per deciliter.
|
Describe control (treatment/procedure/test):
liberal strategy: hemoglobin concentrations were maintained in the range of 10.0 to 12.0 g per deciliter, with a threshold for transfusion of 10.0 g per deciliter.
|
Length of follow-up: 60 days
Loss-to-follow-up: Intervention: 5 Control: 4 3 additional patiënts were lost at 60 days follow-up
Cross-over: Intervention: 1% Control: 2.6%
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): Restrictive: 18.7% Liberal: 23.3%
Mortality (60 days): Restrictive: 22.7% Liberal: 26.5%
Myocardinfarct: Restrictive: 3 (0.7%) Liberal: 12 (2.9%)
Cardiac complication: Restrictive: 55 (13.2%) Liberal: 88 (21%)
Infectious event: Restrictive: 42 (10%) Liberal: 50 (11.9%)
Pulmonary complications: Restrictive: 106 (25.4%) Liberal: 122 (29.0%)
Patiënts transfused: Restrictive: 280 Liberal: 420
Units transfused: Restrictive: 2.6 ± 4.1 Liberal: 5.6 ± 5.3
No. of days in ICU (median): Restrictive: 11.0 ± 10.7 Liberal: 11.5 ± 11.3
No. of days in hospital (median): Restrictive: 34.8 ± 19.5 Liberal: 35.5 ± 19.4 |
Executive committee , without foreknowledge of treatment-specific outcomes, decided to terminate the study prematurely because of a decrease in enrolment to below 20% of predicted levels over a period of several months
Most common reasons for enrolment were respiratory and cardiac diseases
Cardiac complication included myocardial infarction, pulmonary edema, angina and cardiac arrest |
|
Holst, 2014 |
Type of study: RCT
Setting: ICU
Country: Denmark, Sweden and Finland
Source of funding: Supported by a grant (09-066938) from the Danish Strategic Research Council and by Copenhagen University Hospital, Rigshospitalet, the Scandinavian Society of Anaesthesiology and Intensive Care Medicine (ACTA Foundation), and Ehrenreich’s Foundation. Dr. Johansson reports receiving grant support from Pharmacosmos; and Dr. Perner, receiving grant support from CSL Behring, Fresenius Kabi, Cosmed, and Bioporto Diagnostics, and lecture fees from LFB. |
Inclusion criteria: patiënts 18 years of age or older who were in the ICU, fulfilled the criteria for septic shock,18 and had a blood concentration of haemoglobin of 9 g per deciliter or less as measured by means of valid point-of-care testing
Exclusion criteria: declined transfusion, previous adverse reaction to transfusion, received blood transfusion in ICU, had acute coronary syndrome, had life-threatening bleeding, had acute burn injury, withdrew from active therapy, or were excluded because consent could not be obtained
N total at baseline: Intervention: 503 Control: 497
Important prognostic factors2: Age (median): I: 67 C: 67
Sex: I: 54% M C: 52% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
Lower treshold
Patiënts were given single units of cross-mateched , prestorage leukoreduced red cells suspended in a saline-adenine-glucose-mannitol solution when the blood haemoglobin had decreased to <= 7 g/dL
In the event that a life-threatening bleeding or ischaemia developed while a patiënt was in ICU or patiënt required the use of extracorporal membrane oxygenation, the patiënt could receive a transfusion at a haemoglobin threshold decided by the attending doctor. |
Describe control (treatment/procedure/test):
Higher threshold: Patiënts were given single units of cross-mateched , prestorage leukoreduced red cells suspended in a saline-adenine-glucose-mannitol solution when the blood haemoglobin had decreased to <= 9 g/dL
In the event that a life-threatening bleeding or ischaemia developed while a patiënt was in ICU or patiënt required the use of extracorporal membrane oxygenation, the patiënt could receive a transfusion at a haemoglobin threshold decided by the attending doctor. |
Length of follow-up: entire ICU stay with a maximum of 90 days
Discontinued the study: Intervention: 38 Control: 24 Reasons: withdrawn at patiënt’s or surrogate’s request; withdrawn at a phyisican’s request; withdrew consent for use of data
Protocol temporarily suspended: Intervention: 29 (5.9%) Control: 11 (2.2%)
Incomplete outcome data: Intervention: 14 Control: 7 Reasons (describe): did not wish to be included in follow-up
Protocol violations: (one or more transfusions given despite being above the assisgned Hb threshold) Intervention: 45 Control: 16
(transfusion not given despite being below the assisgned Hb threshold on at least one Hb measurement) Intervention: 42 Control: 104 |
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (90 days): Restrictive: 216 (43%) Liberal: 223 (45%)
Myocardinfarct: Restrictive: 13 Liberal: 6
Ischemic event: Restrictive: 35 (7%) Liberal: 39 (8%)
Infectious event: Not reported
Pulmonary complications: Not reported
TRALI or TACO: Restrictive: 0 Liberal: 1
Patiënts transfused: Restrictive: 503-176=327 (65%) Liberal: 497-6=491 (99%)
Units transfused (median: Restrictive: 1 Liberal: 4
No. of days in hospital (median): Not reported |
Patiënts in the ICU with septic shock
Ischemic events included: cerebral ischaemia, acute myocardial ischemia, intestinal ischemia, or limb ischemia |
|
Lacroix, 2007 |
Type of study: RCT
Setting: PICU
Country: Canada
Source of funding: Supported by grants (84300 and 130770) from the Canadian Institutes of Health Research and by grants (3348 and 3568) from the Fonds de la Recherche en Santé du Québec. |
Inclusion criteria: Stable, critically ill children between 3 days and 14 years of age who had at least one hemoglobin concentration of 9.5 g per deciliter or less within the first 7 days after admission to the pediatric ICU were eligible for enrollment.
Exclusion criteria: expected to stay <24 hr in ICU, no approval from physician, <3 days or >14 yr of age, unstable hemodynamically,had acute blood loss, weighed <3.0 kg, had cardiovascular problems, were never discharged from neonatal ICU, had hemolytic anemia, enrolled in another study
N total at baseline: Intervention: 320 Control:317
Important prognostic factors2: age ± SD: I: 35.8 ± 46.2 C: 39.6 ± 51.9
Sex: I: 59% M C: 60% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
restrictive restrictive-strategy group, the haemoglobin threshold for transfusion was set at 7 g per deciliter, with a target range after transfusion of 8.5 to 9.5 g per deciliter.
|
Describe control (treatment/procedure/test):
Liberal liberal-strategy group, the threshold was 9.5 g per deciliter, with a target range of 11 to 12 g per deciliter. In both groups, red cells were transfused within 12 hours after the threshold value had been reached. |
Length of follow-up: 28 days
Loss-to-follow-up: 11 (2%) Reason unknown
Protocol violation: Restrictive: 1 Liberal: 10
Incomplete outcome data: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): Restrictive: 14/320 Liberal: 14/317
Adverse events: Restrictive: 221 Liberal: 203
Infectious event: Restrictive: 65/320 Liberal: 79/317
Patiënts transfused: Restrictive: 146 (46%) Liberal: 310 (98%)
Units transfused: Restrictive: 0.9 ± 2.6 Liberal: 1.7 ± 2.1
No. of days in hospital (median): Restrictive: Liberal: |
|
|
Naidech, 2010 |
Type of study: randomized trial
Setting: intensive care
Country: USA
Source of funding: grants to AMN from the Neurocritical Care Society, supported by Novo-Nordisk (for partial salary support) and from the Northwestern Memorial Foundation for MRI scans and additional PRBC transfusions above usual care.
|
Inclusion criteria: were SAH within three calendar days of enrollment (before vasospasm and cerebral infarction usually occur), World Federation of Neurologic Surgeons grades two through four at enrollment (patiënts with grade five on admission could be enrolled if they improved to grade four or better) or grade one with thick subarachnoid clot (Columbia CT grading scale 3–4) (13), and aneurysm obliteration imminent or completed.
Exclusion criteria: cerebral infarction on CT before enrollment
N total at baseline: Restrictive: 23 Liberal: 21
Important prognostic factors2: Age (median) ± SD: Restrictive: 59.2 ± 11.9 Liberal: 54.1 ± 14.9 Sex: Restrictive: 22% M Liberal: 21%M Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Restrictive strategy Transfusion at <10 g/dl
If the HGB was 0.1–1 g/dl below goal, then one unit PRBC was given; if >1 g/dl below goal, then two units were given with follow-up after the transfusion. All the PRBC units are leukoreduced at our institution. |
Describe control (treatment/procedure/test):
Liberal strategy Transfusion at <11.5g/dl
If the HGB was 0.1–1 g/dl below goal, then one unit PRBC was given; if >1 g/dl below goal, then two units were given with follow-up after the transfusion. All the PRBC units are leukoreduced at our institution. |
Length of follow-up: 3 months
Loss-to-follow-up: unclear
Incomplete outcome data: unclear
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): -
Myocardinfarct: -
Thromboembolic events: -
Infectious event: Restrictive: 0 Liberal: 0
Pulmonary complications: Restrictive: 1 Liberal: 1
Patiënts transfused: Restrictive: 19/23 (83%) Liberal: 20/21 (95%)
Units transfused: Restrictive: 2 (1-3) Liberal: 3 (2-4)
|
. |
|
Robertson, 2014 |
Type of study: randomized trial using a factorial (2 × 2) design
Setting: Neurosurgical intensive care units of two Houston level 1 trauma centers
Country: USA
Source of funding: supported by National Institute of Neurological Disorders and Stroke (grant #P01-NS38660) |
Inclusion criteria: patiënts admitted to the two level 1 trauma centers in Houston with a closed head injury who were not able to follow commands after resuscitation and could be enrolled within 6 hours of injury
Exclusion criteria: Glasgow Coma Score (GCS) of 3 with fixed and dilated pupils, penetrating trauma, pregnancy, lifethreatening systemic injuries, and severe pre-existing disease
N total at baseline: Intervention: 87 Control: 94
Important prognostic factors2: age (median): I:30 (22-40) C: 28 (21-48)
Sex: I: 85.7% M C: 85.9% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
7 g/dL
|
Describe control (treatment/procedure/test):
10 g/dL |
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): Restrictive: 14 Liberal: 17
Myocardinfarct: Not reported
Thromboembolic events: Restrictive: 8 Liberal: 22
Infectious event: Restrictive: 27 Liberal: 36
Pulmonary complications: Not reported
Patiënts transfused: Restrictive: 52 (52.5%) Liberal: 73 (72.3%)
Units transfused: Restrictive: 4.1 (1-22) Liberal: 7.1 (1-21)
No. of days in hospital (median): Not reported |
Traumatic brain injury
Patiënts received Epo (Epogen, Amgen, Inc., Thousand Oaks, CA) 500 IU/kg or an equal volume of saline intravenous bolus infusion over two minutes for each dose of the study drug. During the acute post-injury recovery period (until intracranial pressure monitoring and ventilatory support were no longer required), the assigned hemoglobin threshold was maintained with transfusion of leukoreduced PRBCs
|
|
Walsh, 2013 |
Type of study: RCT
Setting: Intensive care: critically ill requiring prolonged ventilation
Country: Scotland
Source of funding: Supported, in part, by the Chief Scientists Office, Scotland (CZB/4/698); the Scottish National Blood Transfusion Service, the NHS Lothian Academic Health Science Centre; and the Transfusion Medicine Education and Research Foundation. |
Inclusion criteria: (1): had already required mechanical ventilation via an endotracheal tube or tracheostomy tube for ≥ 96 hours (2); were expected to require ≥ 24 hours of further mechanical ventilation when assessed (3); were aged ≥ 55 years old(4); and had a Hb value of ≤ 90g/L at the time of assessment
Exclusion criteria: patiënts with active bleeding at the time of screening, traumatic brain injury and/or intracranial hemorrhage, not expected to survive for 48 hours when assessed, objection to receiving RBC transfusions, concurrent treatment with erythropoietin or similar agents, follow-up that was not feasible, and enrolment in another trial with similar endpoints
N total at baseline: Intervention: 51 Control: 49
Important prognostic factors2: Mean age: I: 67 (56-80) C: 69 (55-83)
Sex: I: 71% M C: 49% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
“restrictive transfusion strategy group” received single unit RBC transfusions with a transfusion trigger of less than or equal to 70 g/L and a target Hb concentration of 71–90 g/L during the intervention period. |
Describe control (treatment/procedure/test):
“liberal RBC transfusion group” received single-unit RBC transfusions with a transfusion trigger of less than or equal to 90 g/L and a target of 91– 110 g/L during intervention. |
Length of follow-up: up to 60 days
Loss-to-follow-up: -
Incomplete outcome data: Data were complete
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): Restrictive: 12/51 Liberal: 16/49
Mortality (60 days): Restrictive: 14/51 Liberal: 22/49
Myocardinfarct: Not reported
Ischemic event: Not reported
Infectious event: Not reported
Clinically significant pulmonary complications: Restrictive: Liberal:
Patiënts transfused: Restrictive: 78% Liberal: 100%
Units transfused: Restrictive: 3 Liberal: 4
No. of days in hospital (median): Restrictive: 34 (3-159) Liberal: 31 (1-120)
|
anaemic older critically ill patiënts requiring prolonged mechanical ventilation
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patiënts between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Carson, 2013 |
Using an automated telephone system, we implemented a permuted block randomization process stratified by clinical site and clinical diagnosis (acute coronary syndrome or stable coronary artery disease). |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Cholette, 2011 |
Block randomization was used (block size 8) was used to randomize subjects to either the restrictive or liberal transfusion strategy |
likely |
unclear |
unclear |
unclear |
unlikely |
unlikely |
unlikely |
|
Cooper, 2011 |
Patiënts were randomly assigned in a 1:1 ratio to 1 of 2 treatment groups by the coordinating center using consecutively numbered opaque envelopes |
unlikely |
unclear |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Hebert, 1995 |
Patiënts were assigned to one of two treatment groups by consecutive allocation from a random listing stratified by center and disease severity. |
unlikely |
unclear |
unclear |
unclear |
unlikely |
unlikely |
unlikely |
|
Hebert, 1999 |
Sealed, opaque envelopes arranged in a computer-generated random order were prepared by the data-coordinating center and distributed to each participating institution, where they were opened sequentially to determine the patiënts’ treatment assignments. |
unlikely |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Holst, 2014 |
with the use of a centralized computergenerated assignment sequence, with stratification according to study site and the presence or absence of active hematologic cancer |
unlikely |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Lacroix, 2007 |
Randomization was centralized, with assignment data posted on the Internet. Patiënts were assigned to the study groups in blocks of 2 or 4 that were randomly distributed and stratified according to center and three age groups |
unlikely |
unclear |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
|
Naidech, 2010 |
Opaque envelopes were randomly prepared in blocks of ten, and the next envelope in sequence was opened upon obtaining written consent. |
unlikely |
unlikely |
not possible |
unlikley |
unlikely |
unlikely |
unlikely |
|
Robertson, 2014 |
A randomization list, stratified by site and using one randomization event to both factors in blocks of 4, was prepared by the study statisticians and kept in each hospital’s research pharmacy. When a new patiënt was enrolled, the research pharmacist prepared the study drug based on the patiënt’s weight and treatment assignment from the randomization list and informed the investigators of the transfusion threshold assignment. |
unlikely |
unclear |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
|
Walsh, 2013 |
Patiënts were randomized 1:1 to each group. Minimization by center and the presence of IHD, including a random element, was used. Telephone randomization by research staff was undertaken within the ICUs using the Aberdeen Health Services Research Unit service to ensure allocation concealment prior to randomization. |
unlikely |
unlikely |
unclear |
unclear |
unlikely |
unlikely |
unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patiënts and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patiënt nor the care provider (attending physician) knows which patiënt is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patiënt assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patiënts lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patiënts lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Adams, 2009 |
Critical appraisal van Lacroix et al., 2007, geen origineel onderzoek |
|
British Journal Haematology guideline, 2013 |
Geen formeel systematisch literatuuronderzoek uitgevoerd |
|
Bergamin, 2014 |
Congres abstract |
|
Blair, 1986 |
Severe upper gastrointestinal haemorrhage, wordt uitgewerkt bij acute bloedingen (main outcome rebleeding) |
|
Carless, 2010 |
Review met bredere doelgroep dan alleen IC, search t/m augustus 2009 |
|
Carson, 2016 |
AABB guideline. Geïncludeerde studies op IC hebben vooral betrekking op gebruik van ‘fresh blood’ |
|
Carson, 2016b |
Cochrane, 31 trials, bredere doelgroep, search t/m mei 2016 |
|
Carson, 2013b |
Review met search t/m feb 2011, summary van Cochrane (Carson, 2012) en JAMA (Carson, 2013) |
|
Carson 2012, b |
AABB guideline, search t/m feb 2011 |
|
Carson, 2012 |
Cochrane, 19 trials, search t/m feb 2011 |
|
Carson, 2002 |
Systematic review, search t/m 2000 |
|
DeAlmeida |
IC in tertiary care oncology center |
|
Desjardins, 2012 |
Systematic review neurocritically ill patiënts, search t/m januari 2011 en neemt ook retrospectieve cohort studies mee |
|
Duana, 2008 |
Retrospective review of patiënts with isolated head trauma |
|
Dupuis, 2017 |
Patiënts with sepsis in ICU systematic review: 1 RCT (Holst) en 12 cohort studies, search t/m maart 2015, smallere doelgroep dan PICO |
|
English, 2016 |
Protocol |
|
Fominsky, 2015 |
Meta-analyse, search t/m maart 2015 |
|
George, 2008 |
Retrospective study in isolated traumatic brain injury |
|
Goodnough, 2014 |
Retrospective comparison of clinical decision support |
|
Gu, 2015 |
Alleen abstract congres |
|
Hardy, 2004 |
Comprehensive review |
|
Hayek, 2016 |
Alleen abstract congres |
|
Hebert, 2001 |
Uitkomst mechanical ventilation, niet conform PICO |
|
Hill, 2002 |
Systematic review, search t/m 2004 |
|
Hogshire, 2013 |
Narrative review |
|
Holst, 2016 |
PhD thesis, verwijst naar publicatie van trial resultaten uit 2014, geen origineel onderzoek |
|
Hovaguimian, 2016 |
Syst review en meta-analyse, search t/m nov 2015, 31 trials: 3 groepen: cardiac/vascular procedures; elderly orthopaedic patiënts; critically ill |
|
Karam, 2010 |
Critcally ill IC kinderen met sepsis, subgroup Lacroix et al., 2007 |
|
Leal-Noval, 2008 |
Narrative review |
|
Manchal, 2007 |
Cohort study |
|
McIntyre, 1999 |
Subgroup analyses of RCT, TRICC trial |
|
McIntyre, 2004 |
Subgroup analyses of RCT, TRICC trial, nu voor resuscitated critically ill |
|
Melchor, 2016 |
Syst review IC en acute coronary syndrome, search t/m December 2014, 6 RCTs: |
|
Mirski, 2015 |
Narrative review |
|
Murphy, 2015 |
Uitgewerkt bij cardiac surgery patiënten |
|
Napolitano, 2009 |
Clinical practice guideline, search t/m juli 2008. Doelgroep trauma en ICU |
|
Napolitano, 2004 |
Narrative review |
|
Parker, 2014 |
Narrative review critically ill children |
|
Pinheiroalmeida, 2015 |
patiënten met maagkanker opgenomen in een tertiary care oncology unit die een grote abdominale operatie ondergingen en daarna IC opname nodig hadden |
|
Pleyer, 2015 |
Acute myeloid leukemia, erg specifieke subgroep patiënten |
|
Rohde, 2014 |
Syst review search t/m januari 2014, doelgroep hospitalized patiënts, niet specifiek IC |
|
Roubinian, 2014 |
Cohort study |
|
Roubinian, 2015 |
Commentaar |
|
Rouette, 2010 |
PICU, postsurgical |
|
Rygard, 2016 |
Excluderen want subgroup Holst |
|
Salpeter, 2014 |
Syst review en meta-analyse, search t/m april 2013 3 trials |
|
Spahn, 2015 |
Narrative review |
|
Spiess, 1998 |
Niet de juiste uitkomsten gerapporteerd |
|
Stanworth, 2016 |
Powerpoint |
|
Szpila, 2015 |
Retrospective historical control analysis |
|
Villanueva, 2013 |
Acute upper gastrointestinal bleeding |
|
Willems, 2010 |
Subgroep analyse van Tripicu study, Lacroix et al., 2007 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-06-2019
Beoordeeld op geldigheid : 15-10-2020
T.a.v. hersenletsel, twee lopende studies: The TRAIN trial (ClinicalTrials.gov NCT02968654), en The HEMOTION trial (NCT03260478). Wanneer gegevens van deze studies beschikbaar zijn is update van deze module (specifiek aanbevelingen omtrent hersenletsel) aan de orde.
Tevens zijn na uitvoeren van de search voor deze module een aantal studies verschenen die waarschijnlijk relevant zijn en in een update moeten worden beoordeeld/meegenomen:
- Bergamin2017_Liberal Versus Restrictive Transfusion Strategy in Critically Ill Oncologic Patiënts- The Transfusion Requirements in Critically Ill Oncologic Patiënts Randomized Controlled Trial- verschil bij 90 dagen: liberaal beter
- Palmieri2017_Transfusion Requirement in Burn Care Evaluation (TRIBE) A Multicenter Randomized Prospective Trial of Blood Transfusion in Major Burn Injury.
- Akyildiz 2017_Comprehensive Analysis of Liberal and Restrictive Transfusion Strategies in Pediatric Intensive Care Unit
Voor het beoordelen van de actualiteit van deze richtlijn wordt een deel van de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn zal de werkgroep per module een inschatting maken over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging (NIV), Nederlandse Vereniging van Anesthesiologie (NVA) en Nederlandse Vereniging van Klinische Chemie (NVKC) zijn regiehouders van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De transfusierichtlijn geeft ten eerste antwoorden op grote uitgangsvragen over wie, wanneer, hoe, hoeveel en met welke producten getransfundeerd wordt en wat daarvan volgens wetenschappelijk onderzoek aan voordelig/nadelig resultaat verwacht mag worden. Na het bepalen van de wetenschappelijke waarde van dit onderzoek, worden uiteindelijk aanbevelingen opgesteld, gebaseerd op de conclusies van het wetenschappelijke onderzoek en na het beschouwen van een additionele context van bijvoorbeeld kosten- ethische, maatschappelijke of wettelijke overwegingen. Deze aanbevelingen zijn bedoeld om verantwoord en wenselijk handelen voor leden van de beroepsgroep te definieren in de voorkomende dagelijkse klinische praktijk. Echter, er kan beargumenteerd altijd afgeweken worden van de algemene aanbevelingen en gekozen worden voor een meer op de individuele patient afgestemde ondersteuning.
Doelgroep
Naast de genoemde beoogde gebruikers van de richtlijn is de richtlijn ook bedoeld en van waarde voor de collega’s van de nationale bloedvoorzieningsorganisatie Sanquin.
Samenstelling werkgroep
Voor de herziening van de richtlijn zijn er in 2016 zes multidisciplinaire werkgroepen ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij patiënten die een bloedtransfusie nodig hebben. Een stuurgroep, bestaande uit de voorzitters van de deelprojecten, coördineerde de werkgroepen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep Laboratoriumaspecten
- Dr. J (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, voorzitter, NVKC
- Dr. C. (Claudia) Folman, manager laboratorium erytrocytenserologie, NVKC
- Prof. dr. M (Masja) de Haas, clustermanager immunohematologie diagnostiek, NVKC
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. H. (Henk) Russcher, Laboratoriumspecialist Klinische Chemie en Hematologie, NVKC
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, NIV
- N. (Nel) Som, senior hoofdanaliste bloedtransfusiedienst, NVML
- Dr. K.M.K. (Karen) de Vooght, laboratoriumsepcialist klinische chemie en transfusie, NVKC
- Dr. H. (Harry) de Wit, Laboratoriumspecialist Klinische Chemie en Hematologie, NVKC
Werkgroep Anemie
- Prof. dr. J.J. (Jaap Jan) Zwaginga, internist-hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde, voorzitter, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- dr. J.M. (Jurriën) ten Berg, Cardioloog, NVVC
- Dr. B.J. (Bart) Biemond, internist-hematoloog, NIV
- Dr. P.A.W. (Peter) te Boekhorst, internist-hematoloog/ transfusiespecialist, NIV
- Prof. dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- Dr. A.J. (Adriaan) van Gammeren, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. N.P. (Nicole) Juffermans, Intensivist, NVIC
- Dr. A.W.M.M. (Ankie) Koopman-van Gemert, anesthesioloog, NVA
- Dr. L.E.M. (Liesbeth) Oosten, internist-hematoloog, NIV
Werkgroep Trombocytentransfusies
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, hematoloog, voorzitter, NIV
- Dr. M. (Michiel) Coppens, internist-vasculaire geneeskunde, NIV
- Dr. A.J.G. (Gerard) Jansen, internist-hematoloog, NIV
- Dr. J.L.H. (Jean-Louis) Kerkhoffs, internist-hematoloog, NIV
- Dr. E. (Enrico) Lopriore, sectiehoofd neonatologie, NVK
- Dr. C. (Heleen) van Ommen, kinderarts hematoloog, NVK
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog-transfusiespecialist, NIV
- Dr. R.E.G. (Roger) Schutgens, internist-hematoloog, NIV
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, NVKC
- Dr. A.P.J. (Alexander) Vlaar, internist-intensivist, NVIC
Werkgroep Bloedingen en bloedbesparende technieken
- Dr. A. (Ankie) Koopman – van Gemert, anesthesioloog, voorzitter, NVA
- Dr. J.J. (Hans) Duvekot, gynaecoloog-perinatoloog, NVOG
- Dr. L.M.G. (Leo) Geeraedts, traumachirurg, NVvH
- Dr. ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Drs. E.J. (Elise) Huijssen-Huisman, kinderarts, kinderhematoloog, transfusiespecialist, NVK
- Dr. N.P. (Nicole) Juffermans, intensivist, NVIC
- Prof. dr. F.W.G. (Frank) Leebeek, internist hematoloog en internist vasculair geneeskundige, NIV
- P.M.J. (Peter) Rosseel, anesthesioloog–intensivist, NVA
- Dr. E.C.T.H. (Edward) Tan, traumachirurg, NVvH
- Drs. V.A. (Victor) Viersen, anesthesioloog, NVA
- Dr. A.B.A. (Alexander) Vonk, cardiothoracaal chirurg, NVT
- Prof. dr. J.J. (Jaap Jan) Zwaginga, hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde, NIV
Werkgroep Plasmatransfusies
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, voorzitter, NVKC
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- Dr. M. (René) van Hulst, ziekenhuisapotheker, NVZA
- Prof. dr. K. (Karina) Meijer, internist-hematoloog, NIV
- Dr. M.C.A. (Marcella) Müller, internist-intensivist, NVIC
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog/transfusiespecialist, NIV
- Dr. Marjolein Peters, kinderarts-hematoloog, NVK
- Drs. K.N.M.E.M. (Koen) Reyntjens, anesthesioloog, NVA
Werkgroep Transfusiereacties en gerelateerde aandoeningen
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, voorzitter, NIV
- Dr. J.L.P. (Hans) van Duynhoven, laboratoriumspecialist klinische chemie, NVKC
- Drs. C.T. (Christian) Favoccia, anesthesioloog, NVA
- Prof dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. T. (Tanja) Netelenbos, internist-hematoloog, NIV
- Dr. J. (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. Dik Versteeg, arts-microbioloog, NVMM
- Dr. A.P.J. (Alexander) Vlaar, internist-Intensivist, NVIC
- Dr. J.C. (Jo) Wiersum-Osselton, TRIP hemo- en biovigilantie, landelijk coördinator, sociale geneeskunde
- C. (Clary) Wijenberg, verpleegkundig specialist palliatieve zorg, V&VN
Met ondersteuning van:
- Dr. M.M. (Marja) Molag, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S.M. (Sabrina) Muller-Ploeger, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Marleen) Ploegmakers, senior-adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E. (Ester) Rake, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E.E. (Eva) Volmeijer, adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider
- Drs. T. (Tessa) Geltink, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S. (Sanne) Snoeijs, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Voorzitters (kerngroep) |
||||
|
M. Schipperus |
Internist-hematoloog (100%) |
Voorzitter Bestuur Stichting TRIP (Transfusie in patiënten), onbetaald |
ITP-onderzoek gefinancierd door AMGeN Advisory board Novartis |
Lid participeert niet in besluitvorming omtrent producten van AMGEN of Novartis. |
|
A. Koopman- van Gemert |
Anesthesioloog |
Diverse functies bij nationale en internationale commissies bv Concilium, Stuurgroep antistolling, examencommissie et cetera Internationaal lid van de Europese examencommissie |
-Participatie in de PETS-studie van het EMC, geen financiële relatie. -Participatie in verschillende onderzoeken (geen financiële relatie en geen direct verband bloedtransfusie) -Organisatie symposia met sponsoring (geen directe financiële relatie en direct verband bloedtransfusie) |
Geen restricties |
|
J.J. Zwaginga |
Hematoloog LUMC (Leiden), Transfusiespecialist, Hoogleraar transfusiegeneeskunde |
-Penningmeester VHL=Vereniging Hematologische laboratoria -Voorzitter van de benigne hematologische werkgroep van NVvH |
-Sprekershonoraria Viforpharma (ijzer: medicatie kan transfusies uitsparen) -Wetenschappelijke adviesraad: Novantis (ijzerchelatie kan transfusie gemedieerde ijzerstapeling opheffen) - Gilead: CLL medicatie webcast geen relatie met transfusiebeleid PI van meerdere Sanquin onderzoeken ogv - allumminisatie door RBC transfusies - ijzertoxiciteit door bloedtransfusies - bloedings IRM (voldoende) plaatjestransfusies et cetera |
Lid participeert niet in besluitvorming omtrent Novartis en wanneer SANQUIN-studies worden geïncludeerd waarbij lid een van de auteurs is |
|
E. Beckers |
Internist-hematoloog/transfusiespecialist MUMC + Maastricht |
Bestuurslid Ned. Ver. Bloedtransfusie, onbetaald - Bestuurslid Ned. Ver. Hematologie, onbetaald - Lid adviesraad TRIP (Transfusie Reacties in Patiënten), onbetaald - Lid Landelijke Gebruikers Raad Sanquin, onbetaald - Lid Stuurgroep TiN studie (Trombocytopathie in Nederland) |
Project 'Predictors of Bleeding' externe financiering door Bayer
Transparantieregister.nl: sprekers vergoeding van Roche; gastvrijheidsbijdrage van: Roche, Pfizer, Sanquin en Bayer |
Lid participeert niet in besluitvorming omtrent producten van Bayer en Roche en wanneer specifiek de studie "predictors of bleeding" (gefinancierd door Bayer) worden geïncludeerd |
|
J. Slomp |
Laboratorium specialist Klinische Chemie en hematologie MST/Medlon |
-Bestuurslid VHL - onbetaald -Bestuurslid NVvH - onbetaald -Werkgroep Bloedtransfusie VHL (vz.) onbetaald -Lid LGR onbetaald - - Lid Expert committee TRIP (onbetaald) |
-Medical Advisory Board Janssen: advies omtrent bloedtransfusie bij patiënten die daratumumab gebruiken, betaald - In samenwerking met UMCU en VU bezig om een landelijk protocol op te stellen voor bloedtransfusie en daratumumab |
Lid participeert niet in besluitvorming omtrent productn van Janssen (daratumumab) |
|
H. Soons |
Laboratoriumspecialist Klinische Chemie, St. Anna Ziekenhuis (1 fte) en Kempenhaeghe (detachering vanuit St. Anna Ziekenhuis)
|
-Bestuur Nederlandse Vereniging voor Bloedtransfusie (NVB), voorzitter, onbetaald -Bestuur Transfusie Reacties in Patiënten (TRIP), secretaris, vacatiegeld - Medisch Advies Raad Sanquin (MAR), lid, vacatiegeld -Lid Landelijke Gebruikersraad Sanquin (LGR), onbetaald |
|
Geen restricties |
|
Werkgroep laboratoriumaspecten |
||||
|
H. de Wit |
Laboratoriumspecialist Klinische Chemie en Hematologie, Certe |
-Bestuurslid/ penningmeester Nederlandse Vereniging voor Bloedtransfusue (onbetaald) - Bestuurslid/ penningmeester Stichting Vrienden van de NVB (onbet aald) |
|
Geen restricties |
|
K. de Vooght |
Laboratoriumspecialist Klinische Chemie, Hoofd Patiëntenzorg LKCH ad interim |
Bestuurslid/ penningmeester Stichting TRIP (onbetaald) - Bestuurslid/voorzitter Stichting vrienden van de Utrechtse bloedbank (onbetaald) - Lid Werkgroep Consortium Transfusiegeneeskundig Onderzoek (onbetaald) - Lid PROTON II Adviesraad (onbetaald) - Lidmaatschap NVB - Lidmaatschap NVvH - Docent OKU (Onderwijs Kring Utrecht) (betaald) -Docent PAO Farmacie (betaald) -Lid Wetenschappelijke commissie NVB/TRIP symposium (onbetaald) |
|
Geen restricties |
|
C. Folman |
Manager Laboratorium Erytrocytenserologie (Sanquin) |
- Docent Hogeschool Arnhem en Nijmegen, betaald - Lid TRIX-werkgroep, onbetaald - Secretaris werkgroep Bloedtransfusie van de VHL (Vereniging Hematologische Laboratoriumdiagnostiek), onbetaald - Lid Expert Committee TRIP (Transfusie Reacties In Patiënten), onbetaald -Lid wetenschappelijke commissie NVB (Nederlandse Vereniging voor Bloedtransfusie), onbetaald" |
- Dienstverband Sanquin - werkzaam in expertiselaboratorium waar onderzoek wordt gericht voor derden op het gebied van bloedtransfusie |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
M. de Haas |
-Bijzonder hoogleraar Translationele Immunohematologie (bezoldiging Sanquin, onbezoldigd aangesteld bij LUMC -Clustermanager Immunohematologie Diagnostiek |
- Secretaris NVB (tot mei 2017) |
-Dienstverband Sanquin -Hoofd van een expertiselaboratorium dat ingezet zou kunnen worden door derden voor het uitvoeren van (uit de richtlijn voortkomende) laboratoriumdiagnostiek |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
H. Russcher |
Laboratoriumspecialist Klinisch Chemie en Hematologie, in het Erasmus MC en Havenziekenhuis |
- Auditor RvA i.h.k.v. ISO 15189:2012 voor medische laboratoria - Betaald |
|
restricties t.a.v. producten van Roche diagnostiek.Gebruikersraad geen belangen tav Sanquin, geen restriicties |
|
N. Som |
Senior hoofdanaliste bloedtransfusiedienst VUmc |
- Hemovigilantiecoördinator Vumc |
|
Geen restricties |
|
J. Lie |
-Stafadviseur hemovigilantie 24,8 uur -Weefselvigil antiecoördinator 7,2 uur" |
-Contactpersoon voor landelijk Bureau TRIP: meldingen transfusiereacties en bijwerkingen - Voorzitter landelijk Hemovigilantoe Platform Nederland (vanaf 2016, eerder lid, mede oprichter HPN), onbetaald - Voorzitter en oprichter Regionaal Hemovigilantie Platform Zuidoost - BestuursLid NVB |
|
Geen restricties |
|
Werkgroep Anemie |
||||
|
A. Van Gammeren |
Laboratoriumspecialist Klinische Chemie
|
|
|
Geen restricties
|
|
N. Juffermans |
Intensivist |
Chief editor Netherlands Journal of Critical Care, vergoeding |
|
Geen restricties
|
|
K. Bergman |
Kinderarts-neonatologie, Beatrix kinderziekenhuis, UMCG ten Groningen (0,9fte). Als kinderarts-neonatologie voorzitter van het Regioteam Perinatale Audit Noord Nederland (Perined). Deze functie (0,1fte) wordt uitgeoefend binnen de UMCG aanstelling. |
-Lid programmacommissie Prenatale screening infectieziekten en erytrocyten-immunisatie RIVM namens NVK (vacatiegeld) -Lid werkgroep neonatale infectieziekten sectie neonatologie NVK (onbetaald) -Projectcommissielid ZonMw project: Introduction of Audit generated Changes in perinatal care using ""Tailored"" implementation strategies. (ACTion-project) (onbetaald) =Projectcommissielid 5 genes per minute, afdeling Medische genetica, UMCG, Groningen (onbetaald) |
|
Geen restricties
|
|
P. te Boekhorst |
Internist-Hematoloog / Transfusiespecialist
|
Medisch Adviesraad Sanquin, Lid, Vacatiegeld
|
In verleden: - Gastvrijheid Firma Alexion - Adviesraad Firma AmgeN (ITP) |
Lid participeert niet bij besluitvorming omtrent ITP |
|
B. Biemond |
Internist-hematoloog |
|
|
Geen restricties |
|
L. Oosten |
Hematoloog, Afdeling Immunohematologie & Bloedtransfusie bij het Leids Universitair Medisch Centum |
|
|
Geen restricties |
|
K. Fijn van Draat |
-Hoogleraar kinderhematologie AMC - Senior onderzoeker Sanquin Research |
VIDI selectiecommissie ZONMW, onbetaald (wel vacatievergoeding) |
Lid van de stuurgroep van de PLANET-2 studie die onderzoek doet naar triggers van trombocytentransfusie bij neonatenop de Neonatale Intensive Care Unit. PLANET-2 ontvangt geen sponsoring van de farmaceutische industrie |
Geen restricties |
|
Werkgroep trombocytentransfusies |
||||
|
A. Vlaar |
- Internist-Intensivist, Academisch Medisch Centrum, Amsterdam - Principal investigator Infusion related morbidity and mortality in the critically ill |
- Klinisch brug figuur Sanquin, onbetaald
|
Onderzoek gefinancierd door NWO, ZonMW, Sanquin: PI van de PACER studie (onder andere): hierbij worden trombotriggers voor invasieve ingrepen aangehouden. |
Geen restricties (ten aanzien van PACER studie: geen tegengesteld belang. Studie wordt niet gepubliceerd binnen termijn afronding richtlijn). |
|
l. van Pampus |
Internist-hematoloog-transfusiespecialist Radboudumc |
- Vice voorzitter hemovigilantiekamer TRIP (onbezoldigd)
|
Tegemoetkoming verblijfkosten Dublin (Ierland) het 17th Annual NATA Symposium on Patient Blood Management, Haemostasis and Thrombosis (NATA 2016) cf de CGR-rgels. |
Geen restricties |
|
G. Jansen |
Internist-hematoloog, afdeling Hematologie, Erasmus MC |
Post doctoraal onderzoeker bij afdeling Plasmaeiwitten, Sanquin Bloedvoorziening. Gastvrijheidovereenkomst, onbetaald |
"1) Naam project: ""Surface sialic acid is critical for platelet survival"" Financier: Sanquin Product and Process development (PPOC nr. 13-019). Bedrag: 499.000 euro. Rol: AIO project 2013-2018. Principal investigator en co-promotor
Toelichting: van dit geld is een OIO aangesteld (Mw M. Rijkers) die in dienst van Sanquin (1,0 fte) dit onderzoek verricht" |
Bij onderwerp sialic acid en trombocytenoverleving geen trekker /betrokkenheid opstellen aanbevelingen |
|
J.L. Kerkhoffs |
Internist - Hematoloog (0,8 FTE)
|
Transfusie-specialist / transfusie research (0,2 FTE) via Sanquin
|
Op Sanquin verricht ik klinisch transfusie onderzoek wat deels gefinancieerd wordt door de industrie TerumoBCT: PI van de PREPAReS studie, een RCT naar de klinische effectiviteit van trombocyten concentraten behandeld met een pathogeen-reductie proces (Mirasol, TERUMO BCT).
|
Restricties t.a.v. producten behandeld met pathogeen reductie proces en biomarkers. Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig.
|
|
R. Schutgens |
Internist-hematoloog
|
Lid van Medische Adviesraad patiëntenvereniging ITP |
-Speakersfee (voor instituut) en/of unrestricted research grant en/of lid advisory board van: Bayer, Baxalta, CSL Behring, NovoNordisk, Sanquin, Pfizer, Bristol-Meyers Squibb -Principal Investigator van de Trombocytopathie in Nederland (TiN) studie, mede gefinancierd door een unrestricted grant van Sanquin - deelname (in UMCU) ontwikkeling PACT en U-PACT (geen financieel belang) |
Geen betrokkenheid vragen bij bloedplaatjesfunctietest (PACT). Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig. |
|
M. Coppens |
Internist-vasculaire geneeskunde
|
- Diverse naschollingen en adviesraden (allen incidenteel) aangaande directe orale anticoagulantie georganiseerd door de fabrikanten van deze middelen, te weten Boehringer Ingelheim, Bayer, Pfizer, Bristol-Meyers Squibb, Daiichi Sankyo. Deze diensten zijn betaald, waarbij het geld naar mijn instituut gaat - Adviesraad aangaande 'The future of hemophilia treatment' georganiseerd door CSL Behring. Twee maal een advisory board; in 2015 en 2016. Deze diensten zijn betaald waarbij geld naar instituut gaat. CSL Behring produceert o.a. Haemocomplettan P (fibrinogeenconcentraat) en Beriplex (vierfactorenconcentraat). De huidige richtlijn zal mogelijk off-label gebruik van deze 2 middelen gaan bespreken. De genoemde adviesraad richtte zich op hemofilie A en B en de producten Haemocomplettan P en Beriplex zijn hier niet aan de orde geweest." |
Lid van de Stuurgroep van de Trombopathie in Nederland studie (geen financiele belangen). -Sanquin Blood Supply: Prothrombin Complex Concentrate (PCC) for the immediate reversal of the anticoagulant effects if new oral anticoagulants in emergency situations. Sanquin Blood Supply is producent van Cofact, een PCC, - CSL Behring: Biomarkers to detect subclinical arthropathy and predict long-term clinical arthropathy in patients with hemophilia. This project was awarded a 2016 Heimburger Award. CSL Behring produceert zowel Haemocomplettan P (fibrinogeenconcentraat) als Beriplex (een PCC), Dit project is gecofinancierd door CSL Behring, maar hebben geen betrekking op Haemocomplettan P noch Beriplex. |
Geen betrokkenheid opstellen aanbevelingen t.a.v. fibrinogeenconcrentraat en vierfactoren concentraat |
|
E. Lopriore |
Sectiehoofd Neonatologie WAKZ/LUMC |
Lid bloedtransfusiecommissie LUMC |
Onderzoek gefinancieerd door Sanquin: 1. PROC 12-012-027: Matisse studie: RCT in neonaten naar twee verschillende triggers voor trombocyten transfusies 50 vs 25; Promovenda: Suzanne Gunnink 2. PROC 16-33: Promotie onderzoek naar Rhesus hemolytische ziekt: Promovenda: Isabelle Ree |
Geen restricties |
|
H. van Ommen (meelezer) |
Kinderhematoloog |
|
'- PI Einstein junior (Bayer) Behandeling trombose bij kinderen - PI Hokusai kinderen (Daiichi Sankyo) Behandeling trombose bij kinderen - Nationaal coördinator BMS studie Apixaban ter preventie van trombose bij kinderen met een hartafwijking |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afstemming met de Patiëntenfederatie, Stichting Zeldzame Bloedziekten en Oscar Nederland. Deze verenigingen zijn uitgenodigd voor de invitational conference (knelpuntenanalyse) voorafgaand aan deze herziening en hebben input geleverd voor de te prioriteren vragen. De verenigingen hebben aangegeven graag in de commentaarfase de conceptrichtlijn te ontvangen voor commentaar. Tevens zal in de eindfase van deze richtlijn nog worden overlegd over de communicatie aan patiënten en of er nog aanvullende teksten voor patiënten kunnen worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij afronding van de richtlijn te vinden zijn bij de aanverwante producten. De werkgroep zal tevens de interne kwaliteitsindicatoren die bij de Richtlijn bloedtransfusie 2011 zijn opgesteld beoordelen en indien nodig door ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroepen en de adviseurs de knelpunten. De werkgroepen beoordeelden de aanbevelingen uit de eerdere richtlijn Bloedtransfusiebeleid (2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en andere aanwezigen tijdens de Invitational conference. De werkgroepen stelden vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn in de werkgroepen besproken waarna de werkgroepleden de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroepen tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews (Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje “Overwegingen”.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en de weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn word aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroepen. Naar aanleiding van de commentaren word de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroepen. De definitieve richtlijn word aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2012.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
Deel 1
|
Database |
Zoektermen |
Totaal |
|
Medline OVID 01-01-2014 tot 18-05-2017 |
1 *Blood Transfusion/ or 'blood transfusion*'.ab,ti. or exp *Erythrocyte Transfusion/ or (Erythrocytes/ and transfusion*.ti,ab.) or ((erythrocyte* or red blood cell* or rbc or prbc) adj2 transfus*).ti,ab. (68136) 2 (Restrictive or liberal or conservative or (threshold* or trigger* or indicator*) or (transfusion adj (Regimen* or strateg* or practice* or policy or protocol* or criteri* or standard*))).ti,ab. (778544) 3 1 and 2 (4521) 4 limit 3 to (english language and yr="2014 -Current") (1116) 5 remove duplicates from 4 (1039) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (326312) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1720899) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (2857374) 9 5 and 6 (89) waarvan 83 uniek 10 5 and 7 (259) 11 5 and 8 (515) 12 10 not 9 (195) waarvan 189 uniek 13 11 not (10 or 9) (381) waarvan 378 uniek |
783 |
|
Embase .com |
#1 'blood transfusion'/mj OR 'erythrocyte transfusion'/mj OR 'blood transfusion*':ti,ab OR ('erythrocyte'/exp/mj AND transfusion*:ti,ab) OR ((erythrocyte* OR 'red blood cell*' OR rbc OR prbc) NEAR/2 transfus*):ti,ab 96271 #2 restrictive:ti,ab OR liberal:ti,ab OR conservative:ti,ab OR threshold*:ti,ab OR trigger*:ti,ab OR indicator*:ti,ab OR (transfusion NEXT/1 (regimen* OR strateg* OR practice* OR polic* OR protocol* OR criteri* OR standard*)):ti,ab 947589 #3 #1 AND #2 AND (english)/lim AND (embase)/lim AND (2014-2017)/py 2047 #4 #3 AND ('article'/it OR 'article in press'/it OR 'review'/it) 843 #5 'meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) 318170 #6 #4 AND #5 70 waarvan 11 uniek #7 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it 1976578 #8 #4 AND #7 231 #9 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR (cohort NEAR/1 (study OR studies)):ab,ti OR (case:ab,ti AND (control NEAR/1 (study OR studies)):ab,ti) OR (follow:ab,ti AND (up NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)):ab,ti OR (epidemiologic NEAR/1 (study OR studies)):ab,ti OR ('cross sectional' NEAR/1 (study OR studies)):ab,ti 1689496 #10 #4 AND #9 309 #11 #8 NOT #6 181 waarvan 69 uniek #12 #10 NOT (#6 OR #8) 201 waarvan 89 uniek
|
Deel 2
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1995 – maart 2017
|
1 exp *Blood Transfusion/ or 'blood transfusion'.ab,ti. or exp Erythrocyte Transfusion/ (72946) 2 exp *Anemia/ or anemia.ab,ti. or anaemia.ab,ti. (179595) 3 1 and (liberal or restrictive).ab,ti. (645) 4 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (316382) 5 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1693260) 6 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (2798625) 7 limit 3 to (english language and yr="1995-Current") (551) 8 4 and 7 (65) 9 5 and 7 (255) 10 6 and 7 (261) 11 8 or 9 or 10 (407)
= 407 (378 uniek) |
571 |
|
Embase (Elsevier) |
('blood transfusion'/exp/mj OR 'blood transfusion*':ab,ti OR 'erythrocyte transfusion'/exp) AND (liberal:ab,ti OR restrictive:ab,ti) AND (english)/lim AND (1995-2017)/py
Gebruikte filters: Systematische reviews: 'meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)
RCT’s: 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it
Observationeel onderzoek: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR (cohort NEAR/1 (study OR studies)):ab,ti OR (case:ab,ti AND (control NEAR/1 (study OR studies)):ab,ti) OR (follow:ab,ti AND (up NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)):ab,ti OR (epidemiologic NEAR/1 (study OR studies)):ab,ti OR ('cross sectional' NEAR/1 (study OR studies)):ab,ti
= 472 (459 uniek) |
