Preoperatieve behandeling van anemie als bloedbesparende interventie
Uitgangsvraag
Wat is de beste manier om chirurgische patiënten met anemie preoperatief te behandelen met het doel om een bloedtransfusie te beperken?
Aanbeveling
Analyseer de oorzaak van anemie bij patiënten die een operatie moeten ondergaan met hoog risico op bloedverlies.
Geef IV of oraal ijzertherapie aan anemische patiënten die een operatie moeten ondergaan, met hoog risico op bloedingen of groot bloedverlies. Kies voor intraveneuze ijzersuppletie indien de operatie binnen 7-10 dagen is gepland en/of er sprake is van een inflammatoire toestand of malabsorptie. Kies in overige gevallen voor orale ijzersuppletie.
Overweeg de toevoeging van EPO naast ijzertherapie bij anemische patiënten die een operatie moeten ondergaan, met hoog risico op bloedingen of groot bloedverlies. Noteer de overwegingen in het medisch dossier.
Maak een afweging van de voor- en nadelen van ijzersuppletie bij patiënten met darmtumoren met een ijzerafhankelijke groei, welke een operatie moeten ondergaan.
Overwegingen
Beperkingen
De werkgroep is van mening dat ook patiënten met een occult ijzergebrek (met een laag ferritine maar nog normaal Hb-gehalte) welke een operatie moeten ondergaan mogelijk baat zouden kunnen hebben bij preoperatief ijzertoediening. Dit omdat behandeling van occult ijzergebrek in patiënten met hartfalen en tijdens cardiochirurgie, positieve effecten heeft laten zien ten faveure van de interventie groep (Anker, 2018; Spahn, 2019). Echter, vanwege de vele vergelijkingen is het niet haalbaar geweest om deze zoekvragen te bestuderen. De werkgroep laat het derhalve aan behandelaren over om preoperatief onderzoek te doen naar het vóórkomen van occult ijzergebrek (middels bepaling van ferritine en ijzersaturatie) en daarop eventuele therapie in te stellen, rekening houdend met het risico op bloedverlies.
Een andere beperking is dat in de zoekvraag uitgegaan is van anemie, welke verder niet nader was gespecificeerd. Het is dus mogelijk dat een deel van de geïncludeerde patiënten in de studies, patiënten betrof die een andere oorzaak van de anemie hadden. Dit kan de uitkomsten vertekenen, omdat de oorzaak van de anemie waarschijnlijk van groot belang is voor de effectiviteit van eventuele therapie.
Mogelijk dient de afweging van baten en risico’s van perioperatieve ijzer en/of EPO, apart te worden afgewogen voor oncologie en niet-oncologie patiënten. In oncologische patiënten is ijzerdeficiëntie meest waarschijnlijk op grond van een hepcidine gestuurd functioneel ijzergebrek door slechte opname uit de darm. Heden loopt een RCT naar de effectiviteit van oraal versus IV-ijzer in oncologische patiënten die colorectale chirurgie ondergaan (Borstlap, 2015). Naast effectiviteit is er mogelijk ook een verschil in ongewenste bijwerking tussen patiëntencategorieën. In oncologiepatiënten is het niet uitgesloten dat ijzersuppletie een groeifactor voor diverse tumoren kan zijn (onder andere bij sommige typen darmtumoren). In de ESMO-richtlijn over anemie en ijzergebrek in kankerpatiënten wordt gewaarschuwd dat langetermijngevolgen van ijzer op tumorgroei niet bekend zijn. Deze huidige richtlijn voorziet niet in een onderscheid tussen patiëntcategorieën en laat de risico-inschatting van perioperatieve behandeling van oncologische patiënten aan de behandelaar over.
IV versus oraal ijzer
De werkgroep achtte het van belang om onderscheid te maken tussen het effect van preoperatieve toediening van IV-ijzer en oraal ijzer, omdat een IV-ijzerinjectie veelal zal leiden tot een extra poliklinisch bezoek dan wel een dagopname. Vanwege de meerdere vergelijkingen tussen zoekvragen die dit met zich meebrengt, zijn er voor de deelvragen weinig studies en was pooling lang niet altijd mogelijk. Een directe vergelijking tussen IV- en oraal ijzer is dan ook moeizaam. Overwegingen om te kiezen voor een IV of oraal preparaat zijn de volgende:
- in het geval dat een operatie binnen afzienbare tijd is gepland (< 7 tot 10 dagen), kan voor IV-ijzer worden gekozen;
- in het geval van een inflammatoire toestand van de patiënt, kan voor IV-ijzer worden gekozen, omdat inflammatie ijzeropname uit de darm verhindert.
Er zijn meer studies over IV-ijzer versus placebo voorhanden dan over oraal ijzer versus placebo. Uit de IV-ijzerstudies blijkt een trend naar zowel minder aantal patiënten dat getransfundeerd moest worden alsook een trend naar minder eenheden bloedtransfusie. Het risico op toegenomen infecties lijkt klein bij ijzertherapie. Tromboses zijn niet gezien. Thans loopt een RCT waarin anemische patiënten, die abdominale chirurgie moeten ondergaan, gerandomiseerd worden naar iv ijzer of placebo (Richards, 2015).
EPO
Uit de studies met EPO al dan niet in combinatie met ijzersuppletie versus placebo blijkt een voordeel in het reduceren van het aantal bloedtransfusies. Ten tijde van de uitwerking van de data van de zoekvraag verscheen een grote trial in 500 cardiochirurgische patiënten met een anemie of een occult ijzergebrek, die gerandomiseerd werden naar therapie met een combinatie van iv-ijzer, EPO, foliumzuur en vitamine B12 of naar een placebo-arm. De patiënten in de interventie-arm ontvingen minder transfusies dan in de controle-arm (Spahn, 2019). Derhalve onderschrijft deze trial de bevinding in deze richtlijn dat EPO het aantal perioperatieve transfusies kan verminderen. Indien voor EPO wordt gekozen, lijkt het de werkgroep zinvol om deze te combineren met ijzer, om ijzerhoudende erytropoëse te waarborgen.
Kinderen
Er zijn geen studies gevonden die voldoen aan de door de werkgroep opgestelde kwaliteitseisen en gehouden zijn in patiënten jonger dan 18 jaar. Er zijn ook geen data van (retrospectief of prospectief) cohortonderzoek gevonden waarin incidentie en behandeling van preoperatief ijzergebrek bij kinderen is beschreven, zodat een inschatting gemaakt kan worden of preventief toedienen van preoperatief ijzer zinvol kan zijn. Derhalve kan de werkgroep geen advies geven over het nut van het preoperatief toedienen van ijzersuppletie, noch oraal noch intraveneus, aan kinderen.
Het wel of niet toedienen van ijzersupplementen blijft daarmee een beslissing die elke behandelaar per situatie moet maken. De behandelaar zal de voor-en nadelen moeten afwegen. In het algemeen geldt, dat wanneer er sprake is van een dusdanige mate van ijzergebrek, dat intraveneuze ijzersuppletie nodig is, de meeste ervaring bij neonaten, zuigelingen en kinderen met ferrioxidesaccharaat. Deze preparaten zijn geregistreerd vanaf premature leeftijd, mits langzaam toegediend. Het alternatief is ferricarboxymaltose wat vanaf de leeftijd van 1 jaar geregistreerd is (https://www.kinderformularium.nl/).
Dosering en preparaten
Er zijn aanzienlijke verschillen tussen de gebruikte doseringen voor oraal en IV ijzer en EPO in de gepoolde studies. Als handreiking zijn de volgende doseringen te overwegen:
- Oraal ijzer: 2 tot 3 x 200 mg.
- IV ijzer: 1000 tot 1500 mg afhankelijk van lichaamsoppervlakte.
- EPO: 150 tot 300 IU/kg lichaamsgewicht.
De werkgroep spreekt geen voorkeur uit voor een bepaald EPO-regime.
Conclusies
Diagnostiek naar de oorzaak is een essentieel deel van de behandeling van patiënten met een anemie en/of onverklaard ijzer tekort. Een ijzertekort dient behandeld te worden met ijzer. Bij het gebruik van EPO dient eveneens ijzer te worden gegeven om een functioneel ijzer tekort ten gevolge van de toegenomen erytropoëse te voorkomen.
Onderbouwing
Achtergrond
De prevalentie van anemie varieert van 10 tot 40% in chirurgische patiënten en is geassocieerd met langere ziekenhuisopname en postoperatieve complicaties (Muñoz, 2015). Deze anemie is vaak multifactorieel van aard. Naar schatting echter, draagt ijzergebrek in 20 tot 30% bij aan de anemie, veroorzaakt door onvoldoende intake of door bloedverlies. Daarnaast kan occult ijzergebrek (dus zonder dat anemie heeft kunnen ontwikkelen) ook bijdragen aan morbiditeit.
In patiënten met een ijzergebrek, resulteert ijzersuppletie in een verhoogde erytropoïese met daarmee correctie van de anemie en een verbeterd welbevinden. Het toedienen van erytropoëtine (EPO) stimuleert de erytropoëse en verhoogt daarmee het Hb. Bij het gebruik van EPO dient eveneens ijzer te worden gegeven om een functioneel ijzer tekort ten gevolge van de toegenomen erytropoëse te voorkomen. Het is daarmee aannemelijk dat preoperatief toedienen van ijzer en/of EPO aan patiënten met een (ijzergebreks)anemie, de uitkomst zou kunnen verbeteren. Intraveneuze toediening van ijzer zou theoretisch gezien kunnen leiden tot een hoger risico op perioperatieve infecties. Ook is er mogelijk een verhoogd risico op trombose gevonden na EPO-behandeling van traumapatiënten met een anemie.
De huidige klinische praktijk is dat screening van ijzerstatus en behandelen van een ijzerdeficiëntie in beperkte mate plaatsvindt in operatieve patiënten. Daarnaast is de optimale toedieningsroute niet duidelijk. Intraveneus ijzer is mogelijk meer effectief dan oraal ijzer omdat inflammatie ijzeropname uit de darm blokkeert.
Conclusies / Summary of Findings
A: Oraal ijzer versus intraveneus ijzer
|
Laag GRADE |
Er is mogelijk geen verschil op het aantal patiënten dat een bloedtransfusie heeft ontvangen, tussen preoperatieve toediening van oraal ijzer en intraveneus ijzer bij patiënten met een anemie .
Bronnen: (Keeler, 2017; Padmanabhan, 2018) |
|
Laag GRADE |
Er is mogelijk geen verschil in het aantal eenheden getransfundeerd bloed tussen preoperatieve toediening van oraal ijzer en intraveneus ijzer bij patiënten met een anemie.
Bronnen: (Keeler, 2017) |
|
Geen GRADE |
Vanwege de beperkte beschikbare data is het niet mogelijk om een uitspraak te doen of preoperatieve toediening van IV-ijzer of oraal ijzer invloed heeft op de mortaliteit of kwaliteit van leven bij patiënten met anemie. |
B: Oraal versus placebo/standaardzorg
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van preoperatieve toediening van oraal ijzer ten opzichte van placebo op het aantal patiënten dat bloedtransfusie heeft ondergaan en het aantal eenheden getransfundeerd bloed bij patiënten met colorectaal kanker.
Bronnen: (Lidder, 2007) |
|
- GRADE |
De overige uitkomstmaten (kwaliteit van leven, mortaliteit) werden niet gerapporteerd. |
C: IV-ijzer versus placebo/standaardzorg
|
Laag GRADE |
Het is mogelijk dat preoperatieve toediening van IV-ijzer het aantal patiënten dat bloedtransfusie heeft ondergaan verlaagt ten opzichte van placebo bij patiënten met anemie.
Bronnen: (Bernabeu-Wittel, 2016; Froessler, 2016; Serrano-Trenas, 2011) |
|
Laag GRADE |
Het is mogelijk dat preoperatieve toediening van IV-ijzer het aantal eenheden getransfundeerd bloed verlaagt ten opzichte van placebo bij patiënten met anemie.
Bronnen: (Froessler, 2016) |
|
- GRADE |
Er werd geen conclusie geformuleerd voor de uitkomstmaat kwaliteit van leven omdat er verschillende onderdelen van de SF-36-schaal werden gerapporteerd.
Bronnen: (Bernabeu-Wittel, 2016; Froessler, 2016) |
|
Laag GRADE |
Het is mogelijk dat er geen verschil in preoperatieve toediening van IV-ijzer ten opzichte van placebo is op de mortaliteit (all cause 30 days) bij patiënten met anemie.
Bronnen: (Froessler, 2016; Serrano-Trenas, 2011) |
D: Oraal en IV ijzer versus placebo/standaardzorg
|
- GRADE |
Er waren geen studies van voldoende kwaliteit beschikbaar waarin oraal en IV-ijzer werden vergeleken met standaardzorg. |
E: EPO (+ ijzer) versus placebo/geen medicatie (al dan niet met ijzer)
|
Redelijk GRADE |
Het is waarschijnlijk dat het aantal patiënten dat een bloedtransfusie heeft ondergaan bij patiënten met anemie lager is na preoperatieve toediening van EPO+ ijzer in vergelijking met placebo .
Bronnen: (Dousias 2003, Feagan, 2000;, Heiss, 1996; Hettelhack, 1998; Kosmadakis, 2003; Larson, 2001; Podesta, 2000; Qvist, 1999; Scott, 2002; Sowade, 1997; Wurnig, 2001; Bernabeu-Wittel, 2016; Urena, 2017; Yoo, 2011) |
|
Redelijk GRADE |
Het is waarschijnlijk dat het aantal eenheden getransfundeerd bloed bij patiënten met anemie lager is na preoperatieve toediening van EPO+ ijzer ten opzichte van placebo op het bij patiënten met anemie.
Bronnen: (De Andrade, 1996; Feagan, 2000; Heiss, 1996; Qvist, 1999; Scott, 2002; Bernabeu-Wittel, 2016; Urena, 2017; Yoo, 2011) |
|
- GRADE |
Er werd geen conclusie geformuleerd voor de uitkomstmaat kwaliteit van leven (vanwege beperkte beschikbaarheid van data) en omdat er verschillende onderdelen van de SF-36-schaal werden gerapporteerd.
Bronnen: (Bernabeu-Wittel, 2016) |
|
Redelijk GRADE |
Het is waarschijnlijk dat de mortaliteit (all cause 30 dagen) niet verschillend is bij preoperatieve toediening van EPO + ijzer in vergelijking met placebo bij patiënten met anemie.
Bronnen: (De Andrade, 1996; Heiss, 1996; Kellelhack, 1998; Olijkhoek, 2001; Podesta, 2000; Sowade, 1997; Stowell, 2009; Wurnig, 2001; Urena, 2017; Yoo, 2011) |
|
Laag GRADE |
Het is mogelijk dat preoperatieve toediening van EPO + ijzer ten opzichte van placebo de ziekenhuisopnameduur verlaagt bij patiënten met anemie.
Bronnen: (Dousias, 2003; Kosmadakis, 2003; Larson, 2001; Yoo, 2011) |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van preoperatieve toediening van EPO+ ijzer ten opzichte van placebo op infecties is bij patiënten met anemie.
Bronnen: (Bernabeu-Wittel, 2016; Larson, 2001) |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van preoperatieve toediening van EPO+ ijzer ten opzichte van placebo op het optreden van diepe veneuze trombose bij patiënten met anemie.
Bronnen: (Feagan, 2000; Kosmadakis, 2003; Olijkhoek, 2001; Stowell, 2009; Wurnig, 2001 ) |
Kinderen
|
- GRADE |
Er werden geen studies van voldoende kwaliteit gevonden naar toediening van oraal ijzer, IV-ijzer en/of EPO bij kinderen met preoperatieve anemie. |
Samenvatting literatuur
A. Oraal ijzer versus intraveneus ijzer
Beschrijving studies
De RCT van Padmanabhan uit 2016 onderzocht het effect van intraveneus ijzer (maximum dosis 100mg) versus oraal ijzer (200mg ijzersulfaat twee keer per dag) 3 tot 8 weken voorafgaand aan geplande cardiochirurgische ingreep bij patiënten met anemie (volgens de WHO-criteria) (Padmanabhan, 2018). Primaire uitkomstmaat van deze studie was het hemoglobinegehalte. Indien nodig ontvingen patiënten in de interventiegroep een tweede ijzerinjectie, maar dit mocht de patiënt ook weigeren. Het is onduidelijk hoeveel patiënten in de interventiegroep één dan wel twee injecties hebben ontvangen. In de interventiegroep (intraveneus ijzer) werden 26 patiënten (gemiddelde leeftijd 72 jaar (SD 12)) geïncludeerd en uiteindelijk 24 patiënten meegenomen in de analyse; in de controlegroep (oraal ijzer) werden 24 patiënten (gemiddelde leeftijd 75 jaar (SD 10)) geïncludeerd en 22 in de analyse meegenomen. De patiënten en zorgverleners waren niet geblindeerd voor de toegepaste behandeling. De patiëntkarakteristieken verschilden niet tussen de groepen. De uitgangswaarde van de hemoglobine was 118,8 g/L (SD: 8,9) in de interventiegroep en 113,9 (SD: 11,1) in de controlegroep (p-waarde van 0,11).
De RCT van Keeler betreft een multicenter opzet (7 centra in het Verenigd Koninkrijk) van anemische preoperatieve patiënten gediagnosticeerd met colorectaal kanker (Keeler, 2017). Patiënten in de interventiegroep ontvingen 1 à 2 doses intraveneus ijzerpreparaat (dosering was gebaseerd op lichaamsgewicht en inclusie hemoglobine waarde (zie evidencetabel) met een maximum dosis van 1000 mg per week en 2000 mg gedurende de trial, tenminste 14 dagen voorafgaand aan de operatie. Patiënten in de controlegroep ontvingen twee keer per dag een oraal ijzertablet, 200 mg ijzersulfaat tot aan de operatie. De mediane leeftijd in de interventiegroep betrof 73 jaar (IQR 67 tot 79) en in de controlegroep 74 jaar (IQR 68 tot 81).
Resultaten
1. Aantal patiënten die een bloedtransfusie heeft ontvangen
In de studie van Keeler gaat het om het totaal aantal patiënten dat gedurende de hele studie een bloedtransfusie heeft ontvangen (recruitment tot aan follow-up). In de groep die intraveneus ijzer kreeg ontvingen 10 van 55 patiënten (18,2%) een transfusie in vergelijking met 14 van 61 patiënten die oraal ijzer ontvingen (23%) (RR: 0,79 (95%CI: 0,38 tot 1,64)) (Keeler, 2017).
In de studie van Padmanabhan was het aantal patiënten dat een postoperatieve bloedtransfusie ontving 16 van 20 (80%) in de intraveneuze groep in vergelijking met 12 van de 20 (60%) in de groep die oraal ijzer ontving (RR 1,33 (95%CI 0,88 tot 2,03)) (Padmanabhan, 2018).
Omdat de studies een andere definitie en tijdduur van bloedtransfusie hanteren werden resultaten niet gepoold.
Figuur 1 Forest plot van het aantal patiënten dat bloedtransfusie heeft ondergaan

Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘aantal patiënten dat transfusie heeft ontvangen’ (vergelijking A) start op hoog vanwege de gerandomiseerde studie-opzet en is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: geen blindering van zorgverleners/patiënten/outcome assessors) en het geringe aantal patiënten (imprecisie).
2. Aantal (eenheden) bloedtransfusie
Padmanabhan rapporteerde het aantal postoperatief gebruikte rode bloedceleenheden. In de intraveneuze ijzergroep was het mediane gebruik 2 eenheden (IQR: 1 tot 4,8) en in de orale ijzergroep was dit 1,5 eenheden (IQR: 0 tot 2) (p = 0,16). Er werd niet gerapporteerd hoeveel milliliter bloed er in een unit zat (Padmanabhan, 2018).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘aantal eenheden bloedtransfusie’ (vergelijking A) start op hoog vanwege de gerandomiseerde studie-opzet en is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: geen blindering van zorgverleners/patiënten/outcome assessors) en het geringe aantal patiënten (imprecisie).
3. Kwaliteit van leven
De studie van Padmanabhan beschreef de kwaliteit van leven door middel van de EQ-5D- en de SF-36-vragenlijst. Patiënten hebben de vragenlijsten drie keer ingevuld tijdens drie bezoeken gedurende het onderzoek. De EQ-5D vragenlijst werd door 27 patiënten (61%) ingevuld en de SF-36 door 34 patiënten (77%).
Er werd geen significant verschil gevonden in één van de domeinen van de vragenlijsten, details werden niet gerapporteerd.
Op basis van de beschikbare data kan geen conclusie getrokken worden over deze uitkomstmaat.
4. Mortaliteit (30-dagen all cause)
Keeler rapporteerde de 90-dagen mortaliteit en valt daarom buiten de genoemde uitkomstmaat. In de intraveneuze ijzergroep waren 3 patiënten die overleden en in de orale ijzergroep waren 2 doden, p-waarde: 0,906 (niet significant) (Keeler, 2017).
5. Opnameduur ziekenhuis
Keeler, 2017 rapporteerde de mediane opnameduur in het ziekenhuis. In de groep die intraveneuze ijzertoediening ontving, was de mediane opnameduur 6 dagen (IQR: 5 tot 10) en in de orale ijzergroep: 6 dagen (IQR: 4 tot 9) (p = 0,95).
Padmanabhan (2018) rapporteerde de mediane opnameduur in het ziekenhuis. In de groep die intraveneuze ijzertoediening ontving, was de mediane opnameduur 7 dagen (IQR: 3 tot 49) en in de orale ijzergroep: 9 dagen (IQR: 3 tot 30) (p=0,71).
6. Infecties
De studie van Keeler (2017) rapporteerde geen getallen over infecties, maar gaf alleen aan dat er geen verschil zat tussen de groepen voor de infectieratio (p=0,091).
Padmanabhan (2018) rapporteerde postoperatieve infecties (gedefinieerd als infecties zoals borstinfecties, chirurgische infecties en sepsis): in de intraveneuze ijzergroep was er sprake van infecties bij 20% van de patiënten; in de orale ijzergroep bij 26% van de patiënten (p=0,15).
7. Overige uitkomstmaten
De 6-minuten looptest en cardiovasculaire events werden niet gemeten in beide studies.
B. Oraal ijzer versus placebo/niets
Beschrijving studies
Voor de RCT van Lidder werden patiënten geïncludeerd met colorectaal kanker die een operatie moesten ondergaan (Lidder, 2007). De patiënten in de ijzergroep ontvingen 200mg oraal ijzer driemaal daags gedurende 14 dagen (tot operatie). De placebogroep ontving standaardbehandeling en geen ijzertherapie. Verder werd het standaard transfusieprotocol gevolgd zoals bekend in de UK (zie evidencetabel voor details). De gemiddelde leeftijd in de ijzergroep was 69 (range 47 tot 89) en in de non-ijzergroep 72 (range: 57 tot 80). De verhouding m/v was in de ijzergroep 14:8 en in de non-ijzergroep 14:9. Er was een groter gedeelte patiënten met anemie in de ijzergroep (6/24) dan in de non-ijzergroep (14/25). Er was een verschil in uitgangshemoglobine-waarde: in de ijzergroep was dit 13,1 g/dl (8,13 mmol/l) en in de niet-ijzergroep 11,8 g/dl (7,3 mmol/l) (p=0,04).
Resultaten
1. Aantal patiënten dat transfusie heeft ontvangen
De studie van Lidder (2007) rapporteerde in de orale ijzergroep bij 6 van 24 patiënten (25%) een bloedtransfusie en bij de placebogroep bij 13 van 25 patiënten (52%) ((RR 0,48 (95%CI: 0,22 tot 1,06). Dus minder transfusies in de “ijzergroep”).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aantal patiënten dat transfusie nodig heeft (vergelijking B) start op hoog vanwege de gerandomiseerde studie-opzet en is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: randomisatie is onduidelijk); extrapoleerbaarheid (bias ten gevolge van indirectheid: gedeelte van de patiënten heeft geen anemie) en het geringe aantal patiënten (imprecisie);
2. Aantal eenheden getransfundeerd bloed
In de ijzergroep werden in totaal 15 eenheden bloed getransfundeerd (mediaan 0, range 0 tot 4) en in de niet-ijzergroep 47 eenheden (mediaan 2, range 0 tot 11) (p=0,31).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aantal patiënten dat transfusie nodig heeft (vergelijking B) start op hoog vanwege de gerandomiseerde studie-opzet en is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: randomisatie is onduidelijk); extrapoleerbaarheid (bias ten gevolge van indirectheid: gedeelte van de patiënten heeft geen anemie) en het geringe aantal patiënten (imprecisie);
3. Overige uitkomstmaten
Overige genoemde uitkomstmaten werden in de studie van Lidder niet gerapporteerd.
C. Intraveneus ijzer versus placebo/niets
Beschrijving studies
In de studie van Serrano-Trenas (2011) werden patiënten met anemie die werden geopereerd vanwege een heupfractuur, geïncludeerd . Het gemiddelde Hb gehalte in de interventiegroep was 11,9 g/dl (7,4 mmol/l) en in de controlegroep 12,1 g/dl (7,5 mmol/l). In beide groepen was 80% van de deelnemers vrouw.
In de interventiegroep kregen patiënten intraveneuze toediening van ijzersucrose (600mg) in 3 doses van 200 mg in een interval van 48 uur. Dit werd gestart op de dag van de opname. De controlegroep ontving geen preoperatieve ijzertoediening en volgde het standaardprotocol.
De multicenter RCT van Bernabeu-Wittel vergeleek een groep die EPO met ijzer ontving (zie vergelijking F) met intraveneus ijzer (1000 mg) en een placebogroep (Bernabeu-Wittel, 2016). Het intraveneuze ijzer werd subcutaan toegediend. Patiënten werden geïncludeerd als ze 65 jaar of ouder waren met een heupfractuur door osteoporose die in aanmerking kwamen voor een operatie. De hemoglobinewaarde moest tussen de 90 tot 120 g/L liggen. In de IV-ijzergroep werden 103 patiënten geïncludeerd, in de placebogroep 100 patiënten.
De RCT van Froessler onderzocht IV ijzer versus standaard zorg bij anemische (volgens WHO norm) patiënten die een operatie ondergaan (Froessler, 2016). In de IV-ijzergroep (n=40) ontvingen de patiënten 15mg/kg lichaamsgewicht ijzer, (maximaal 1000mg) voorafgaand aan de operatie. Postoperatief (gedefinieerd als < 2 dagen na de operatie) ontvingen de patiënten met tenminste 100mL bloedverlies nog 0,5mg ijzercarboxymaltose (Ferinject®) per ml verloren bloed. De groep die standaard zorg ontving (n=32), ontving geen verdere behandeling tenzij er al oraal ijzer werd geslikt. IV ijzer was geen standaard zorg, maar het was wel toegestaan dit toe te dienen in de standaardgroep.
De studie werd veel eerder gestopt vanwege veel negatieve uitkomsten in de standaard zorg groep ten opzichte van de IV-ijzergroep dan vooraf verwacht. Dit zorgde ervoor dat er veel minder patiënten werden geïncludeerd dan beoogd en het kan een vertekening van de resultaten geven.
Resultaten
1. Aantal patiënten dat bloedtransfusie heeft ontvangen
Figuur 2 Forest plot van het aantal patiënten dat een bloedtransfusie heeft ontvangen
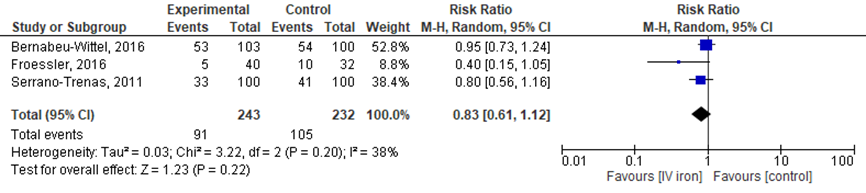
Alle drie de studies rapporteerden het aantal patiënten dat een bloedtransfusie ontving gedurende de periode dat de patiënten waren opgenomen. In totaal ontvingen in de IV-ijzergroep 91 van 243 patiënten (37,4%) in vergelijking met 105 van 232 (45,3%) in de controlegroep een bloedtransfusie (RR 0,83 (95%CI van 0,61 tot 1,12), dus minder transfusies in de IV-ijzergroep).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘aantal patiënten dat bloedtransfusie heeft ondergaan’ (vergelijking C) start op hoog vanwege de gerandomiseerde studie-opzet en is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: vroegtijdig stoppen van één van de studies) en imprecisie (gepoolde effect overschrijdt grens voor klinische besluitvorming).
2. Aantal eenheden getransfundeerd bloed
Froessler (2016) rapporteerde dat in de IV-ijzergroep 8 eenheden bloed waren getransfundeerd en in de controlegroep 32 eenheden (p=0,079, niet significant). Er werd niet gerapporteerd hoeveel milliliter bloed er in een unit bloed zat. In de studie van Bernabeu-Wittel was het aantal transfusies per patiënt in de ijzergroep gemiddeld 1,26 (± 1,3) eenheden in vergelijking met 1,28 (± 1,4) met de placebogroep. Deze uitkomstmaat werd niet gerapporteerd door Serrano-Trenas, 2011.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘aantal eenheden getransfundeerd bloed’ (vergelijking C) start op hoog vanwege de gerandomiseerde studie-opzet en is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: vroegtijdig stoppen van één van de studies); geringe aantal patiënten (imprecisie).
3. Kwaliteit van leven
Bernabeu-Wittel (2016) rapporteerde de kwaliteit van leven op de subschalen over fysieke gezondheid en mentale gezondheid. De score op de fysieke schaal was gemiddeld 31,9 (± 9,2) punten in de IV-ijzergroep en 35 (± 9,7) punten in de placebogroep. De score op de mentale schaal was gemiddeld 46,1 (± 16) punten in de IV-ijzergroep en 46,8 (± 12) in de placebogroep (p-waarde niet gerapporteerd; niet significant verschil).
Froessler (2016) rapporteerde de kwaliteit van leven 4 weken na de operatie op basis van de SF-36 vragenlijst (een hogere score geeft een betere kwaliteit van leven weer). In de IV-ijzergroep was de gemiddelde score 96 (± 14) en in de controlegroep 90 (± 26) (p=0,24).
De resultaten van deze twee studies kunnen niet worden gepooled omdat er verschillende subschalen van de SF-36 worden beschreven.
4. Mortaliteit binnen 30 dagen
Figuur 3 Forest plot van de mortaliteit binnen 30 dagen
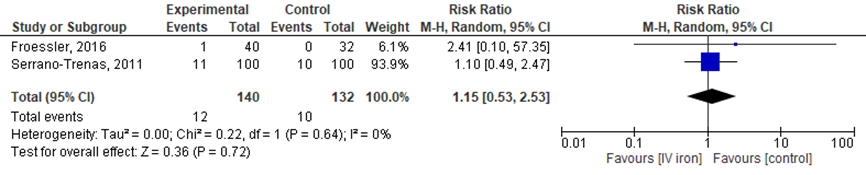
Froessier en Serrano-Trenas rapporteren de mortaliteit binnen 30 dagen. In totaal overleden er 12 van de 140 patiënten (8,6%) in de IV-ijzergroep in vergelijking met 10 van de 132 (7,6%) in de controlegroep (RR 1,15 (0,53 tot 2,53).
Bernabeu-Wittel (2016) rapporteerde overlevingsaantallen op het moment van ontslag uit het ziekenhuis, deze resultaten kunnen niet worden toegevoegd aan de bovenstaande analyse en forest plot. Omgerekend overleden er (tot tijd van ontslag) in de IV-ijzergroep 4 van 103 patiënten (3,5%) in vergelijking met 4 van 100 patiënten (4%) in de controlegroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘mortaliteit’ (vergelijking C) start op hoog vanwege de gerandomiseerde studie-opzet en is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: vroegtijdig stoppen van één van de studies); geringe aantal patiënten (imprecisie: gepoolde effect overschrijdt grens voor klinische besluitvorming).
5. Opnameduur
De opnameduur in het ziekenhuis werd door alle drie de studies op een andere manier gerapporteerd.
Serrano-Trenas (2011) rapporteerde de gemiddelde opnameduur. In de interventiegroep was dit 13,5 (± 7,1) dagen en in de controlegroep 12,9 (± 6,9) dagen (gemiddeld verschil= 0,6 dagen (95%CI: -1,34 tot 2,54)).
Bernabeu-Wittel (2016) rapporteerde de mediane opnameduur met als range het eerste en derde kwartiel. In de IV-ijzergroep betrof dit gemiddeld 7 dagen (5 tot 10) en in de controlegroep 8 dagen (6 tot 10).
Froessler (2016) rapporteerde de mediane opnameduur (met een minimum-maximum range). In de interventiegroep was dit 6 dagen (1 tot 9) en in de controlegroep was dit 9 dagen (1 tot 23) (p=0,05).
6. Infecties
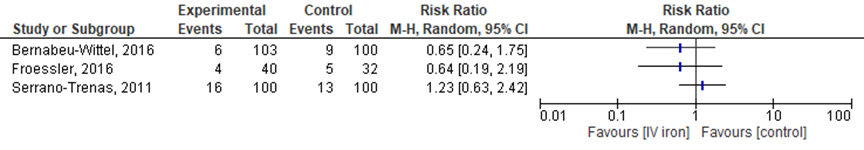
De uitkomstmaat infecties werd niet nader gespecificeerd in de studies en zodoende is er geen gepoold resultaat gepresenteerd. In totaal traden er in de IV-ijzergroep bij 16 van 100 patiënten (16%) infecties op in vergelijking met 13 van 100 (13%) in de controlegroep.
Figuur 4 Forest plot van het aantal infecties
7. Overige uitkomstmaten
De volgende uitkomstmaten werden in geen van de studies beschreven:
- De 6-minuten looptest.
- cardiovasculaire events.
D. Oraal en intraveneus ijzer versus placebo/niets
Er werden geen studies van voldoende kwaliteit gevonden die oraal en intraveneus ijzer vergeleken met placebo/gebruikelijke zorg.
E. EPO (al dan niet in combinatie met ijzer) in vergelijking met geen EPO
Beschrijving studies
In de praktijk zal EPO vaak gecombineerd worden met ijzer om ijzerhoudende erytropoëse te waarborgen. Een PICO strikt afbakenen op EPO versus placebo is daarom geen zinnige vraag. Daarom is besloten om EPO in combinatie met ijzer te vergelijken met géén EPO (placebo/niets (al dan niet met ijzer). In de analyse is tevens onderscheid gemaakt tussen studies die in de controlegroep al dan niet ijzer toedienden (subgroepanalyse met/zonder ijzer).
De RCT van Urena (2017) onderzocht de effecten van het toedienen van EPO + IV ijzer versus placebo in een groep patiënten met aortastenose, in aanmerking komend voor operatie.
De EPO (subcutane toediening) met ijzer (IV-toediening) werd toegediend op dag 10 en 1 voor de operatie. Evenals de Placebo (zoutoplossing). De geïncludeerde patiënten hadden een gemiddelde leeftijd van 81 jaar met een hemoglobine waarde van 10,7 g/dl (6,6 mmol/l).
in de EPO groep en 11,3 g/dl (7,0 mmol/l) in de controle groep. In de EPO-groep werden in totaal 48 patiënten geïncludeerd en in de placebogroep 52 patiënten.
De multicenter RCT van Bernabeu-Wittel, 2016 vergeleek een groep die EPO met ijzer ontving met intraveneus ijzer en een placebogroep. De EPO werd subcutaan toegediend in één dosis (40,000 IU EPO) en het intraveneuze ijzer werd subcutaan toegediend in twee doses van 500 mg opgelost in 250 mL saline in een ondoorzichtige plastic zak gedurende 20 minuten. Patiënten werden geïncludeerd als ze 65 jaar of ouder waren met een heupfractuur door osteoporose die in aanmerking kwamen voor een operatie. Het hemoglobinelevel moest tussen de 90 tot 120 g/L liggen. In de EPO-ijzergroep werden 100 patiënten geïncludeerd, in de placebogroep 100 patiënten.
Resultaten
1. Aantal patiënten dat een bloedtransfusie heeft ontvangen
Figuur 5 Forest plot van patiënten die een bloedtransfusie hebben ondergaan
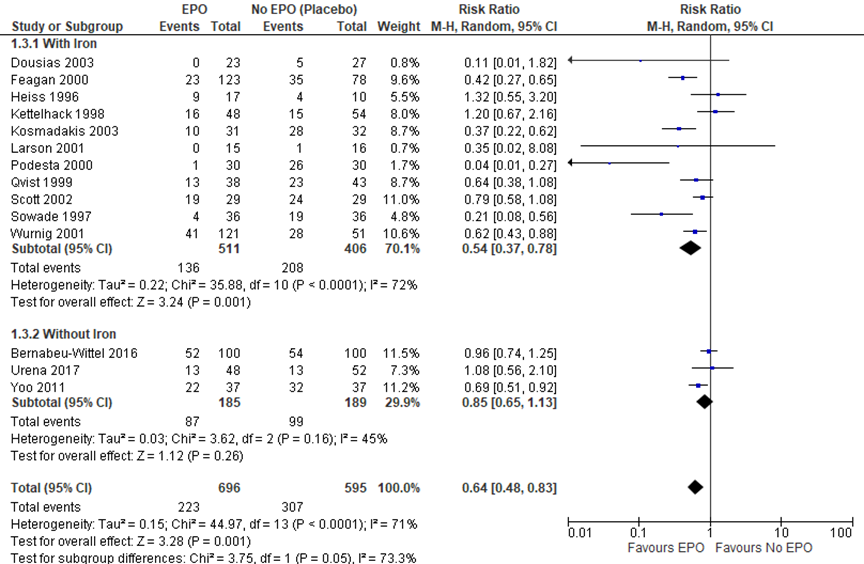
De studies genoemd in figuur 5 rapporteerden het aantal patiënten dat een transfusie heeft ondergaan. In totaal hadden 223 van de 696 (32,0%) patiënten een transfusie nodig in de EPO-groep en 307 van de 595 (51,6%) patiënten in de controlegroep (RR 0,64 (CI: 0,48-0,83)). De heterogeniteit is hoog, 71%. Er is waarschijnlijk sprake van klinische heterogeniteit door de verschillende toegepaste ingrepen, verschillende dosering strategieën per studie, de timing van de medicatie en de manier van toediening.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘patiënten met transfusie’ (vergelijking E) start op hoog vanwege de gerandomiseerde studie-opzet en is met een niveau verlaagd naar redelijk gezien heterogeniteit.
2. Aantal eenheden getransfundeerd bloed
Figuur 6 forest plot het aantal eenheden getransfundeerd bloed per patient
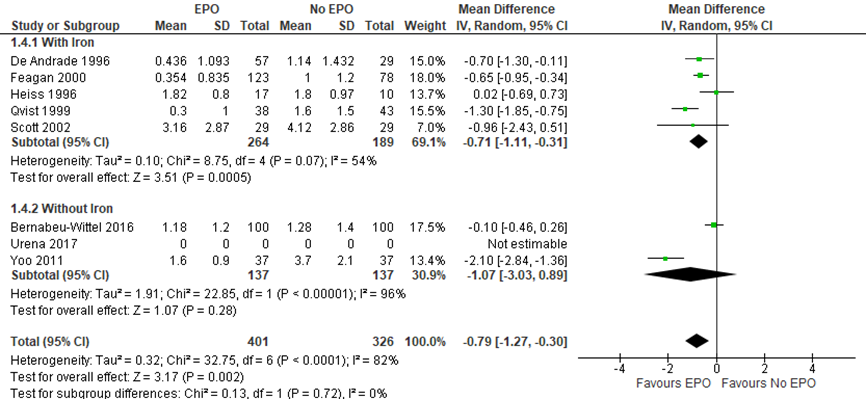
De studies genoemd in de forest plot van figuur 6 beschrijven de aantallen eenheden getransfundeerd bloed per patiënt. Het toedienen van EPO + ijzer pre-operatief resulteert in een afname van 0,79 eenheden (mean difference 95%BI -1,27 tot -0,30) getransfundeerd bloed per patiënt. Het effect in de subgroep zonder ijzer lijkt sterker, echter de verschillen tussen de subgroepen zijn niet significant.
De heterogeniteit is hoog (82%). Er is waarschijnlijk sprake van klinische heterogeniteit door de verschillende toegepaste ingrepen, verschillende dosering strategieën per studie, verschillen in patiëntenpopulaties (ernst van anemie), de timing van de medicatie en de manier van toediening.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘aantal eenheden getransfundeerd bloed’ (vergelijking E) start op hoog vanwege de gerandomiseerde studie-opzet en is met een niveau verlaagd naar redelijk gezien het geringe aantal patiënten
3. Kwaliteit van leven
Bernabeu-Wittel (2016) rapporteerde de kwaliteit van leven gemeten middels SF-36v2 op de sub schalen over fysieke- en mentale gezondheid (n=200). De score op de fysieke schaal was gemiddeld 33,4 (± 9,7) punten in de EPO-groep en 35 (± 9,7) punten in de placebogroep. De score op de mentale schaal was gemiddeld 45,1 (± 13) punten in de EPO-groep en 46,8 (± 12) in de placebogroep (p-waarde niet gerapporteerd; niet significant verschil).
De overige studies rapporteren kwaliteit van leven niet.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘kwaliteit van leven’ (vergelijking E) is niet gegradeerd. Kwaliteit van leven werd met verschillende onderdelen van de SF-36-schaal gerapporteerd als ook beperkte beschikbaarheid van data.
4. Mortaliteit (all cause 30 dagen)
Figuur 7 Forest plot Mortaliteit (all cause 30 dagen)
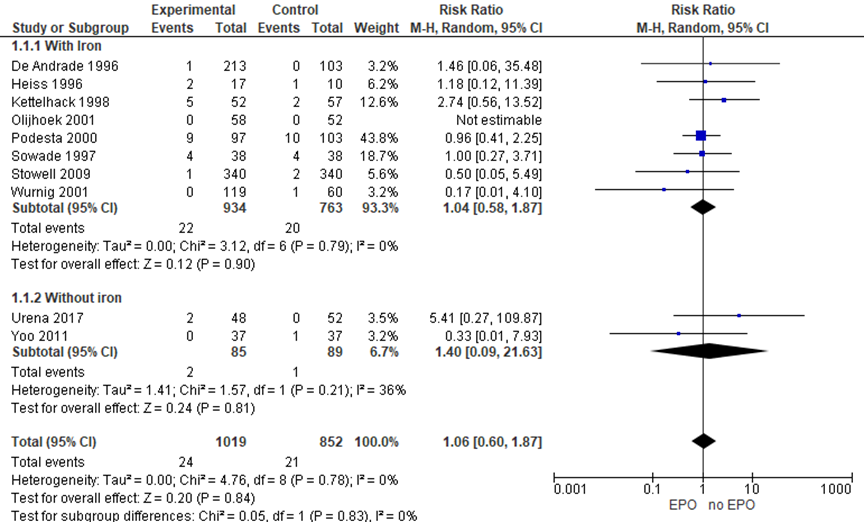
De studies genoemd in figuur 7 beschrijven de mortaliteit op 30 dagen postoperatief. In totaal overleden er 24 van de 1019 (2,4%) mensen in de EPO-groep en 21 van de 851 (2,5%) in de controle groep (RR 1,06 (CI: 0,60-1,87)).
Bernabeu-Wittel (2016) rapporteerde overlevingsaantallen op het moment van ontslag uit het ziekenhuis en na 60 dagen. Deze resultaten kunnen daardoor niet worden toegevoegd aan de bovenstaande analyse en forest plot waar mortaliteit tot 30 dagen wordt gerapporteerd. Na 60 dagen waren 12 (12%) mensen overleden uit de EPO-groep en 10 (10%) uit de placebogroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘mortaliteit’ (vergelijking E) start op hoog vanwege de gerandomiseerde studie-opzet en is met een niveau verlaagd naar redelijk gezien beperkingen in de onderzoeksopzet (risk of bias in verband met lage aantal patiënten (imprecisie)).
5. Ziekenhuisopnameduur
Figuur 8 Forest plot van ziekenhuisopnameduur
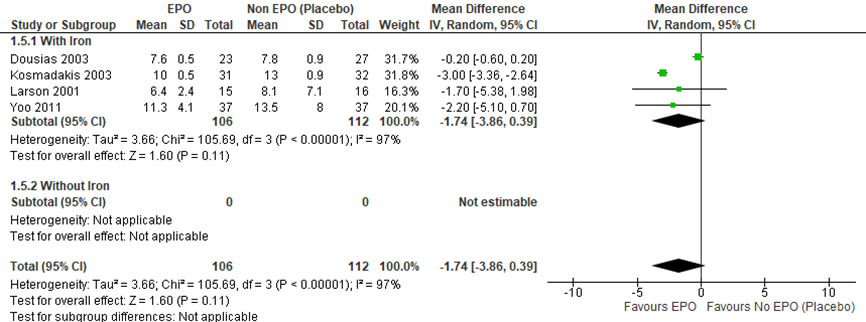
Figuur 8 laat de forest plot zien met de ziekenhuisopnameduur. Het toedienen van EPO + ijzer zorgt voor een afname in ziekenhuisopnameduur van 1,74 dagen (mean difference (CI: -3,86-0,39)). Echter, de heterogeniteit is hoog, 97%. Er is waarschijnlijk sprake van klinische heterogeniteit door de verschillende toegepaste ingrepen, verschillende dosering strategieën per studie, de timing van de medicatie en de manier van toediening.
Bernabeu-Wittel (2016) rapporteert de ziekenhuisopname duur als mediaan (eerste-derde quartiel). Deze data kunnen om deze reden niet toegevoegd worden aan de forest plot. De mediane ziekenhuisopnameduur in de EPO-groep was 8 (6 tot 11) en die in de placebogroep 8 (6 tot 10).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘ziekenhuisopnameduur’ (vergelijking E) start op hoog vanwege de gerandomiseerde studie-opzet en is met twee niveaus verlaagd naar laag gezien beperkingen in de onderzoeksopzet (gering aantal patiënten, imprecisie en heterogeniteit (verschillende ingrepen)).
6. Infecties
Figuur 9 Forest plot van het aantal infecties.
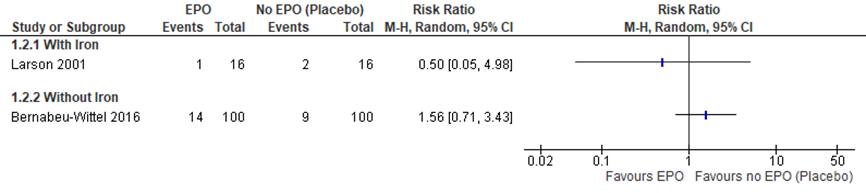
De uitkomstmaat infecties werd niet nader gespecificeerd in de studies en zodoende is er geen gepoold resultaat gepresenteerd. In totaal traden er in de EPO+ijzer groep bij 14 van 116 patiënten (13%) infecties op in vergelijking met 11 van 116 (9%) in de controlegroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘infecties’ (vergelijking E) start op hoog vanwege de gerandomiseerde studie-opzet en is met drie niveaus verlaagd naar zeer laag gezien beperkingen in de onderzoeksopzet en het zeer geringe aantal patiënten (ernstige heterogeniteit).
7. Diepe veneuze trombose
Figuur 10 Forest plot van (diep veneuze) trombose
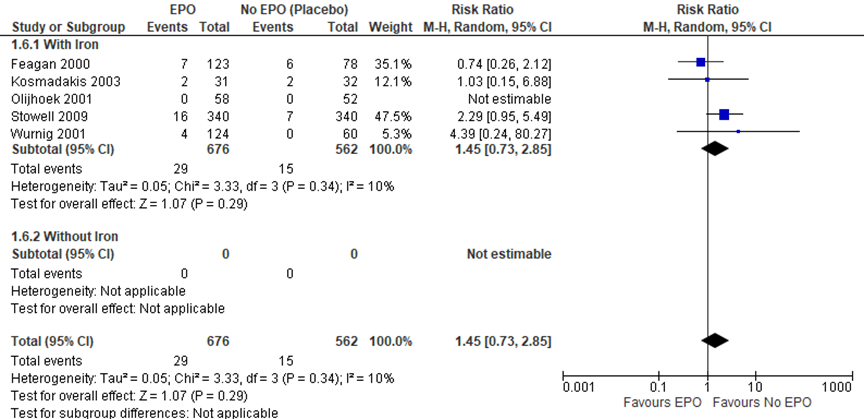
Feagan (2000); Kosmadakis (2003); Olijkhoek (2001); Stowell (2009) en Wurnig (2001) rapporteerden de uitkomstmaat diep veneuze trombose (DVT). In totaal zijn er 29 van de 679 (4,3%) gevallen van trombose beschreven in de EPO-groep en 15 van de 562 (2,7%) in de controle groep (RR 1.45 (95%CI van 0,73 tot 2,85), in het voordeel van de controlegroep).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘diep veneuze trombose’ (vergelijking E) start op hoog vanwege de gerandomiseerde studie-opzet en is met drie niveaus verlaagd naar zeer laag gezien beperkingen in de onderzoeksopzet (Risk of bias, geringe aantal patiënten (imprecisie: gepoolde effect overschrijdt grens voor klinische besluitvorming)).
1. Overige uitkomstmaten
De volgende uitkomstmaten werden in geen van de studies gerapporteerd:
- Cardiovasculaire events (myocardinfarct, CVA) en;
- 6 minuten-looptest.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is het effect van het preoperatief toedienen van EPO, intraveneus ijzer of oraal ijzer (zie opsomming) bij chirurgische patiënten (volwassenen en kinderen) met een anemie
P: chirurgische patiënten (volwassenen en kinderen) met een anemie;
Anemie volwassenen (WHO definitie):
- Vrouwen = Hb < 12 g/dl; 7,5 mmol/l.
- Mannen = Hb < 13 g/dl; 8,13 mmol/l.
Anemie kinderen (WHO definitie):
- 0,5 tot 5 jaar = Hb < 11 g/dl; 6,88 mmol/l.
- 5 tot 12 jaar = Hb < 11,5 g/dl; 7,19 mmol/l.
- 12-15 jaar = Hb < 12 g/dl; 7,5 mmol/l.
I/C: het preoperatief toedienen van:
- oraal ijzer in vergelijking met intraveneus ijzer;
- oraal ijzer in vergelijking met niets/ placebo;
- iv ijzer in vergelijking met niets/placebo;
- oraal en iv ijzer in vergelijking met niets/placebo;
- EPO plus ijzer in vergelijking met alleen ijzer (subgroepanalyse: met niets/placebo).
O: Kwaliteit van leven; 6 min looptest; aantal eenheden getransfundeerd bloed; ziekenhuisopnameduur; mortaliteit (all cause 30 dagen); infectie; aantal patiënten dat transfusie nodig heeft; cardiovasculaire events (myocardinfarct, CVA, trombo-embolisch event).
Relevante uitkomstmaten
De werkgroep achtte kwaliteit van leven, aantal eenheden getransfundeerd bloed, mortaliteit (all cause 30 dagen) en aantal patiënten dat getransfundeerd werd, cruciale uitkomstmaten voor de besluitvorming; en 6 minuten looptest, ziekenhuis opnameduur, infectie en cardiovasculaire events werden als belangrijke uitkomstmaten voor de besluitvorming gekenmerkt.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Elsevier) is op 30 januari 2019 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd onderzoek over het effect van oraal ijzer, intraveneus ijzer of EPO bij chirurgische patiënten. Er werd gezocht vanaf 2015 omdat de NICE Guideline Blood Transfusion (hoofdstuk 5) als uitgangspunt werd gebruikt en aangevuld met de zoekresultaten uit deze search. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 233 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerd onderzoek of een systematische review met een kwalitatief goede search, risk of bias en studieselectie in het Engels of Nederlands die aan de PICO voldoen: preoperatieve toediening van ijzer en/of EPO (studies over een combinatie van pre- en postoperatieve toediening werden geïncludeerd, alleen postoperatieve toediening van ijzer viel buiten de PICO). Op basis van titel en abstract werden in eerste instantie 35 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 30 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 5 studies definitief geselecteerd.
Selectie vanuit de NICE-Guideline Blood Transfusion, 2015:
Vanuit de NICE-Guideline werden de geïncludeerde studies uit hoofdstuk 5 doorgelopen en beoordeeld aan de hand van de PICO in deze module.
Van de 39 geïncludeerde artikelen uit de NICE-guideline werden er
- 8 geëxcludeerd omdat zij geen relevante uitkomstmaat rapporteren.
- 4 geëxcludeerd omdat zij enkel postoperatieve toediening beschrijven (Bisbe, 2014;, Karkouti, 2016; Madi, 2004; Na, 2011).
- 6 studies geëxcludeerd omdat het expliciet om niet anemische patiënten gaat (Edwards: Hb > 13,5g/dl in mannen en 12,5g/dl in vrouwen; Garrido-Martin, 2012; Anon, 1993; Laupacis, 1996 Hb level >11 g/dl D'Ambria,1997; Faris, 1996).
- Een studie geëxcludeerd omdat EPO zonder ijzer werd vergeleken met placebo. Dit valt buiten de afbakening van de huidige vraagstelling (Weltert, 2010).
Na de zoekdatum van de NICE-richtlijn (januari 2015) zijn er vijf additionele studies opgenomen en aan de analyses toegevoegd.
Resultaten
De belangrijkste studiekarakteristieken en resultaten van de geïncludeerde studies zijn opgenomen in de evidencetabellen (en tabel 1). De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Tabel 1 overzicht van geïncludeerde studies per vergelijking (preoperatieve toediening van ijzer bij chirurgische patiënten met anemie)
|
Vergelijking: |
Inclusie vanuit de NICE-guideline Blood transfusion: |
Inclusie vanuit de literatuursearch van deze module: |
|
- |
Keeler, 2017 Padmanabhan, 2018 |
|
Lidder, 2007 (helft patiënten heeft geen anemie) |
|
|
Serrano-Trenas, 2011 |
Bernabeu-Wittel, 2016 Froessler, 2016 |
|
- |
- |
|
Andrade 1996 Devon 2009 (Cochrane review- includes 4 papers: Christodoulakis 2005 Heiss 1996 Qvist 1999 Kettlehack 1998) Feagan 2000 Kosmadakis 2003 Scott 2002 Sowade 1997 Wurnig 2001 Olijhoek 2001 Stowell 2009 Kateros 2010 Yoo 2011 Dousias 2003 Larson 2001 Podesta 2000 |
Urena, 2017 Bernabeu-Wittel, 2016
|
Referenties
- Anker SD, Kirwan BA, van Veldhuisen DJ, et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis. Eur J Heart Fail. 2018;20(1):125-133. doi:10.1002/ejhf.823.
- Bernabeu-Wittel M, Romero M, Ollero-Baturone M, et al. Ferric carboxymaltose with or without erytropoietin in anemic patients with hip fracture: a randomized clinical trial. Transfusion. 2016;56(9):2199–2211. doi:10.1111/trf.13624.
- Froessler B, Palm P, Weber I, Hodyl NA, Singh R, Murphy EM. The Important Role for Intravenous Iron in Perioperative Patient Blood Management in Major Abdominal Surgery: A Randomized Controlled Trial. Ann Surg. 2016;264(1):41–46. doi:10.1097/SLA.0000000000001646.
- Keeler BD, Simpson JA, Ng O, et al. Randomized clinical trial of preoperative oral versus intravenous iron in anaemic patients with colorectal cancer. Br J Surg. 2017;104(3):214–221. doi:10.1002/bjs.10328.
- Muñoz M, Gómez-Ramírez S, Campos A, Ruiz J, Liumbruno GM. Pre-operative anaemia: prevalence, consequences and approaches to management. Blood Transfus. 2015;13(3):370–379. doi:10.2450/2015.0014-15.
- National Clinical Guideline Centre (UK). Blood Transfusion. London: National Institute for Health and Care Excellence (UK); 2015.
- Padmanabhan H, Siau K, Nevill AM, et al. Intravenous iron does not effectively correct preoperative anaemia in cardiac surgery: a pilot randomized controlled trial. Interact Cardiovasc Thorac Surg. 2019;28(3):447–454. doi:10.1093/icvts/ivy226.
- Richards T, Clevenger B, Keidan J, et al. PREVENTT: preoperative intravenous iron to treat anaemia in major surgery: study protocol for a randomised controlled trial (published correction appears in Trials. 2015;16:312). Trials. 2015;16:254. Published 2015 Jun 4. doi:10.1186/s13063-015-0774-2.
- Spahn DR, Schoenrath F, Spahn GH, et al. Effect of ultra-short-term treatment of patients with iron deficiency or anaemia undergoing cardiac surgery: a prospective randomised trial. Lancet. 2019;393(10187):2201-2212. doi:10.1016/S0140-6736(18)32555-8.
- Urena M, Del Trigo M, Altisent OA, et al. Combined erytropoietin and iron therapy for anaemic patients undergoing transcatheter aortic valve implantation: the EPICURE randomised clinical trial. EuroIntervention. 2017;13(1):44–52. doi:10.4244/EIJ-D-16-00591.
Evidence tabellen
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: what is the effect of EPO/IViron/oral iron compared to placebo/control/standard care for preoperative patients with anaemia or iron deficiency ?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Padmanabhan, 2018 |
Patients were randomly allocated to receive either intravenous FCM (Ferinject) (Group A) or oral iron (Group B). Treatment allocation was decided by random numbers that were concealed in opaque envelopes. This process was performed independently from the study research group. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Likely |
Likely, not all randomized patients were analysed in the ITTcohort
|
|
Bernabeu-Wittel, 2016 |
The randomization assignment list was stratified by centers and performed by unequal blocks technique. |
Unlikely |
Unlikely, IV/placebo was administered using a opaque plastic bag |
Unlikely, IV/placebo was administered using a opaque plastic bag |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Keeler, 2017 |
Recruited patients were randomized in a 1 : 1 fashion via a web-based system using variable block allocation, stratified by patient sex and age. The system was designed, set up and run by a unit independent of the study (Clinical Trials Unit,University of Nottingham).Treatment allocation was open-label as it was not possible to conceal the darkening of stool when ingesting oral iron. |
Unlikely |
Likely, not possible to conceal the darkening of stool when ingesting oral iron |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Froessler, 2016 |
Randomization followed a computer-generated number sequence and allocation was conducted by telephone. |
Unlikely |
Likely |
Unlikely, the surgeon was concealed for treatment allocation |
Unclear |
Unlikely |
Likely, study was terminated early due to higher than expected rates of poor outcome in the usual care group |
Unlikely |
|
Urena, 2017 |
Randomization followed a computer-generated randomnization scheme in a 1:1 ratio, stratified by planned route (transfemoral versus transapical). |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Lidder, 2007 |
Patients were randomised (by telephone to a distant centre) |
Likely, no concealment of allocation |
Likely, blinding was not possible as oral iron alters stool colour |
Unlikely, blinding of care providers |
Unclear (research fellow not involved in the direct care of the patient performed collection of data) |
Unlikely |
Unlikely |
Likely, ITT not followed |
|
Serrano-Trenas, 2011 |
Zie NICE |
|
|
|
|
|
|
|
|
Haljan, 2009 |
Zie NICE |
|
|
|
|
|
|
|
|
Weltert, 2010 |
Zie NICE |
|
|
|
|
|
|
|
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Shah, 2018 |
Includeert ook post-operatieve studies; de twee studies die geïncludeerd zijn in deze meta-analyse zijn los beschreven in de literatuuranalyse van deze module |
|
Peters, 2018 |
Narrative review, geen systematische review |
|
Lu, 2018 |
Geen systematische search beschikbaar en geen risk of bias assessment uitgevoerd |
|
LI, 2018 |
Review van Cho, 2019 is recenter |
|
Gomez-Ramirez, 2018 |
Geen risk of bias assessment beschikbaar |
|
Weigl, 2017 |
Geen chirurgische patiënten; voldoet niet aan PICO |
|
Kei, 2017 |
Conference abstract |
|
Derman, 2017 |
Patiëntengroep voldoet niet, geen chirurgische patiënten |
|
Zhao, 2016 |
Review van Cho, 2019 is recenter |
|
Voorn, 2016 |
Review van Cho, 2019 is recenter |
|
Steuber, 2016 |
Geen systematische search en studieselectie |
|
Shah, 2016 |
Ook non-chirurgische patiënten, geen gestratificeerde data beschikbaar |
|
Lancee, 2016 |
Abstract, geen volledig artikel |
|
Tai, 2015 |
Patiëntengroep voldoet niet, geen chirurgische patiënten |
|
Ng, 2015 |
Includeert alleen anemische patiënten; geen studies met patiënten met ijzerdeficiente; de drie geïncludeerde studies zijn opgenomen in deze literatuuranalyse of geëxcludeerd (zie NICE-exclusietabel hieronder) |
|
NG, 2015b |
Protocol van systematische review van Ng, 2015a |
|
Kotze, 2015 |
Geen risk of bias assessment uitgevoerd |
|
Hogan, 2015 |
Searchperiode van 4 maanden in totaal |
|
Elhanawy, 2015 |
Protocol |
|
Borstlap, 2015 |
Includeert alleen patiënten met colorectaal carcinoom; de drie geïncludeerde rct’s uit deze review zijn opgenomen in deze literatuuranalyse of geëxcludeerd (zie ook NICE-exclusietabel hieronder). |
|
Chaturvedi, 2019 |
Geen gerandomiseerde studie |
|
Froessler, 2018 |
Brief aan de editor, geen primaire studie |
|
Biboulet, 2018 |
Interventie voldoet niet aan PICO: EPO plus intraveneus ijzer versus EPO plus oraal ijzer |
|
Pujol-Nicolas, 2017 |
Geen gerandomiseerde studie |
|
Miles, 2017 |
Opinion statement, geen primair onderzoek |
|
Munoz, 2016 |
Editorial, geen primair onderzoek |
|
Calleja, 2016 |
Geen gerandomiseerde studie |
|
Weltert, 2015 |
Geïncludeerd in NICE richtlijn. Studie meegenomen in analyses vanuit NICE richtlijn. |
|
Johansson, 2015 |
Niet-anemische patiënten, valt niet binnen PICO |
|
Cho, 2018 |
Over de toediening van EPO, al dan niet in combinatie met IV of oraal ijzer in vergelijking met geen EPO is een systematische review uit 2018 beschikbaar. In deze review wordt echter geen duidelijk onderscheid gemaakt tussen studies waar wel of geen ijzer is toegediend (in interventie of controlegroep) en worden geen subgroepanalyses gedaan. Daarom zijn de in deze studie geïncludeerde artikelen nagelopen op relevantie en separaat geïncludeerd (uiteindelijk waren er geen relevante studies die recenter waren dan de NICE-richtlijn). |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 15-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn wordt een deel van de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn zal de werkgroep per module een inschatting maken over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging (NIV), Nederlandse Vereniging van Anesthesiologie (NVA) en Nederlandse Vereniging van Klinische Chemie (NVKC) zijn regiehouders van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De transfusierichtlijn geeft ten eerste antwoorden op grote uitgangsvragen over wie, wanneer, hoe, hoeveel en met welke producten getransfundeerd wordt en wat daarvan volgens wetenschappelijk onderzoek aan voordelig/nadelig resultaat verwacht mag worden. Na het bepalen van de wetenschappelijke waarde van dit onderzoek, worden uiteindelijk aanbevelingen opgesteld, gebaseerd op de conclusies van het wetenschappelijke onderzoek en na het beschouwen van een additionele context van bijvoorbeeld kosten- ethische, maatschappelijke of wettelijke overwegingen. Deze aanbevelingen zijn bedoeld om verantwoord en wenselijk handelen voor leden van de beroepsgroep te definieren in de voorkomende dagelijkse klinische praktijk. Echter, er kan beargumenteerd altijd afgeweken worden van de algemene aanbevelingen en gekozen worden voor een meer op de individuele patient afgestemde ondersteuning.
Doelgroep
Naast de genoemde beoogde gebruikers van de richtlijn is de richtlijn ook bedoeld en van waarde voor de collega’s van de nationale bloedvoorzieningsorganisatie Sanquin.
Samenstelling werkgroep
Voor de herziening van de richtlijn zijn er in 2016 zes multidisciplinaire werkgroepen ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij patiënten die een bloedtransfusie nodig hebben. Een stuurgroep, bestaande uit de voorzitters van de deelprojecten, coördineerde de werkgroepen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep bloedingen en bloedbesparende technieken:
- Dr. A.W .M.M. (Ankie) Koopman- van Gemert, Anesthesioloog, voorzitter, NVA
- Dr. P.M.J. (Peter) Rosseel, anesthesioloog-intensivist, NVA
- Prof. dr. J.J. (Jaap Jan) Zwaginga, Hematoloog / Transfusiespecialist / Hoogleraar transfusiegeneeskunde, NIV
- Prof. dr. F.W.G. (Frank) Leebeek, Internist hematoloog en internist vasculair geneeskundige, NIV
- Dr. ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie/ clusterhoofd Hemostase en Transfusie, NVKC
- Dr. E.C.T.H. (Edward) Tan, Traumachirurg / Afdelingshoofd SEH / Heli-MMT arts, NVVH
- Dr. L.M.G. (Leo) Geeraedts, Traumachirurg, NVVH
- Dr. A.B.A. (Alexander) Vonk, Cardiothoracaal chirurg, NVT
- Drs. E.J. (Elise) Huijssen-Huisman, Kinderarts, kinderhematoloog, Transfusiespecialist, NVK
- Dr. N.P. (Nicole) Juffermans, Intensivist, NVIC
- Dr. J.J. (Hans) Duvekot, Gynaecoloog-Perinatoloog, NVOG
Meelezer:
- Drs. V.A. (Victor) Viersen, Anesthesioloog, NVA
Werkgroep Transfusiereacties en gerelateerde aandoeningen:
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, voorzitter, NIV
- Dr. J.L.P. (Hans) van Duijnhoven, laboratoriumspecialist klinische chemie, NVKC
- Drs. C.T. (Christian) Favoccia, anesthesioloog, NVA
- Prof dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. T. (Tanja) Netelenbos, internist-hematoloog, NIV
- M.R. (Michaela) van Bohemen, verpleegkundige n.p., hemovigilantieconsulent V&VN (vanaf juli 2018)
- Dr. J. (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. D. (Dik) Versteeg, arts-microbioloog, NVMM (tot juli 2018)
- Dr. J. H. (Jan) Marcelis arts-microbioloog, NVMM (vanaf juli 2018)
- Dr. A.P.J. (Alexander) Vlaar, internist-Intensivist, NVIC
- Dr. J.C. (Jo) Wiersum-Osselton, TRIP hemo- en biovigilantie, landelijk coördinator, arts M&G, NVDG
Voor de module “Indicatie voor bestralen van bloedproducten” heeft een expertmeeting plaatsgevonden. Bijzondere dank aan de experts die tijdens en na deze meeting hebben bijgedragen aan de tekst:
- Prof. dr. J.H.F. (Fred) Falkenburg, hoogleraar hematologie
- Dr. P.A.W. (Peter) te Boekhorst, internist-hematoloog/ transfusiespecialist
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatoloog
- Prof. dr. J.J. (Jaap Jan) Zwaginga, internist-hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde
- Dr. M.D. (Mette) Hazenberg, internist-hematoloog
Met ondersteuning van:
- Drs. E.E. (Eva) Volmeijer, adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider (tot februari 2020)
- Dr. B.H. (Bernardine) Stegeman, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider (vanaf februari 2020)
- Drs. T. (Tessa) Geltink, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. (Roy) Elbers, adviseur Kennisinstituut van de Federatie Medisch Specialisten (tot juli 2019)
- Dr. E. (Ellen) Paap, adviseur Kennisinstituut van de Federatie Medisch Specialisten (vanaf juli 2019)
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Voorzitters (kerngroep) |
||||
|
M. Schipperus |
Internist-hematoloog (100%) |
Voorzitter Bestuur Stichting TRIP (Transfusie in patiënten), onbetaald |
ITP-onderzoek gefinancierd door AMGeN Advisory board Novartis |
Lid participeert niet in besluitvorming omtrent producten van AMGEN of Novartis. |
|
A. Koopman- van Gemert |
Anesthesioloog |
Diverse functies bij nationale en internationale commissies bv Concilium, Stuurgroep antistolling, examencommissie et cetera Internationaal lid van de Europese examencommissie |
-Participatie in de PETS-studie van het EMC, geen financiële relatie. -Participatie in verschillende onderzoeken (geen financiële relatie en geen direct verband bloedtransfusie) -Organisatie symposia met sponsoring (geen directe financiële relatie en direct verband bloedtransfusie) |
Geen restricties |
|
J.J. Zwaginga |
Hematoloog LUMC (Leiden), Transfusiespecialist, Hoogleraar transfusiegeneeskunde |
-Penningmeester VHL=Vereniging Hematologische laboratoria -Voorzitter van de benigne hematologische werkgroep van NVvH |
-Sprekershonoraria Viforpharma (ijzer: medicatie kan transfusies uitsparen) -Wetenschappelijke adviesraad: Novantis (ijzerchelatie kan transfusie gemedieerde ijzerstapeling opheffen) - Gilead: CLL medicatie webcast geen relatie met transfusiebeleid PI van meerdere Sanquin onderzoeken ogv - allumminisatie door RBC transfusies - ijzertoxiciteit door bloedtransfusies - bloedings IRM (voldoende) plaatjestransfusies et cetera |
Lid participeert niet in besluitvorming omtrent Novartis en wanneer SANQUIN-studies worden geïncludeerd waarbij lid een van de auteurs is |
|
E. Beckers |
Internist-hematoloog/transfusiespecialist MUMC + Maastricht |
Bestuurslid Ned. Ver. Bloedtransfusie, onbetaald - Bestuurslid Ned. Ver. Hematologie, onbetaald - Lid adviesraad TRIP (Transfusie Reacties in Patiënten), onbetaald - Lid Landelijke Gebruikers Raad Sanquin, onbetaald - Lid Stuurgroep TiN studie (Trombocytopathie in Nederland) |
Project 'Predictors of Bleeding' externe financiering door Bayer
Transparantieregister.nl: sprekers vergoeding van Roche; gastvrijheidsbijdrage van: Roche, Pfizer, Sanquin en Bayer |
Lid participeert niet in besluitvorming omtrent producten van Bayer en Roche en wanneer specifiek de studie "predictors of bleeding" (gefinancierd door Bayer) worden geïncludeerd |
|
J. Slomp |
Laboratorium specialist Klinische Chemie en hematologie MST/Medlon |
-Bestuurslid VHL - onbetaald -Bestuurslid NVvH - onbetaald -Werkgroep Bloedtransfusie VHL (vz.) onbetaald -Lid LGR onbetaald - - Lid Expert committee TRIP (onbetaald) |
-Medical Advisory Board Janssen: advies omtrent bloedtransfusie bij patiënten die daratumumab gebruiken, betaald - In samenwerking met UMCU en VU bezig om een landelijk protocol op te stellen voor bloedtransfusie en daratumumab |
Lid participeert niet in besluitvorming omtrent productn van Janssen (daratumumab) |
|
H. Soons |
Laboratoriumspecialist Klinische Chemie, St. Anna Ziekenhuis (1 fte) en Kempenhaeghe (detachering vanuit St. Anna Ziekenhuis)
|
-Bestuur Nederlandse Vereniging voor Bloedtransfusie (NVB), voorzitter, onbetaald -Bestuur Transfusie Reacties in Patiënten (TRIP), secretaris, vacatiegeld - Medisch Advies Raad Sanquin (MAR), lid, vacatiegeld -Lid Landelijke Gebruikersraad Sanquin (LGR), onbetaald |
|
Geen restricties |
|
Werkgroep laboratoriumaspecten |
||||
|
H. de Wit |
Laboratoriumspecialist Klinische Chemie en Hematologie, Certe |
-Bestuurslid/ penningmeester Nederlandse Vereniging voor Bloedtransfusue (onbetaald) - Bestuurslid/ penningmeester Stichting Vrienden van de NVB (onbet aald) |
|
Geen restricties |
|
K. de Vooght |
Laboratoriumspecialist Klinische Chemie, Hoofd Patiëntenzorg LKCH ad interim |
Bestuurslid/ penningmeester Stichting TRIP (onbetaald) - Bestuurslid/voorzitter Stichting vrienden van de Utrechtse bloedbank (onbetaald) - Lid Werkgroep Consortium Transfusiegeneeskundig Onderzoek (onbetaald) - Lid PROTON II Adviesraad (onbetaald) - Lidmaatschap NVB - Lidmaatschap NVvH - Docent OKU (Onderwijs Kring Utrecht) (betaald) -Docent PAO Farmacie (betaald) -Lid Wetenschappelijke commissie NVB/TRIP symposium (onbetaald) |
|
Geen restricties |
|
C. Folman |
Manager Laboratorium Erytrocytenserologie (Sanquin) |
- Docent Hogeschool Arnhem en Nijmegen, betaald - Lid TRIX-werkgroep, onbetaald - Secretaris werkgroep Bloedtransfusie van de VHL (Vereniging Hematologische Laboratoriumdiagnostiek), onbetaald - Lid Expert Committee TRIP (Transfusie Reacties In Patiënten), onbetaald -Lid wetenschappelijke commissie NVB (Nederlandse Vereniging voor Bloedtransfusie), onbetaald" |
- Dienstverband Sanquin - werkzaam in expertiselaboratorium waar onderzoek wordt gericht voor derden op het gebied van bloedtransfusie |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
M. de Haas |
-Bijzonder hoogleraar Translationele Immunohematologie (bezoldiging Sanquin, onbezoldigd aangesteld bij LUMC -Clustermanager Immunohematologie Diagnostiek |
- Secretaris NVB (tot mei 2017) |
-Dienstverband Sanquin -Hoofd van een expertiselaboratorium dat ingezet zou kunnen worden door derden voor het uitvoeren van (uit de richtlijn voortkomende) laboratoriumdiagnostiek |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
H. Russcher |
Laboratoriumspecialist Klinisch Chemie en Hematologie, in het Erasmus MC en Havenziekenhuis |
- Auditor RvA i.h.k.v. ISO 15189:2012 voor medische laboratoria - Betaald |
|
restricties t.a.v. producten van Roche diagnostiek.Gebruikersraad geen belangen tav Sanquin, geen restriicties |
|
N. Som |
Senior hoofdanaliste bloedtransfusiedienst VUmc |
- Hemovigilantiecoördinator Vumc |
|
Geen restricties |
|
J. Lie |
-Stafadviseur hemovigilantie 24,8 uur -Weefselvigil antiecoördinator 7,2 uur" |
-Contactpersoon voor landelijk Bureau TRIP: meldingen transfusiereacties en bijwerkingen - Voorzitter landelijk Hemovigilantoe Platform Nederland (vanaf 2016, eerder lid, mede oprichter HPN), onbetaald - Voorzitter en oprichter Regionaal Hemovigilantie Platform Zuidoost - BestuursLid NVB |
|
Geen restricties |
|
Werkgroep Anemie |
||||
|
A. Van Gammeren |
Laboratoriumspecialist Klinische Chemie
|
|
|
Geen restricties
|
|
N. Juffermans |
Intensivist |
Chief editor Netherlands Journal of Critical Care, vergoeding |
|
Geen restricties
|
|
K. Bergman |
Kinderarts-neonatologie, Beatrix kinderziekenhuis, UMCG ten Groningen (0,9fte). Als kinderarts-neonatologie voorzitter van het Regioteam Perinatale Audit Noord Nederland (Perined). Deze functie (0,1fte) wordt uitgeoefend binnen de UMCG aanstelling. |
-Lid programmacommissie Prenatale screening infectieziekten en erytrocyten-immunisatie RIVM namens NVK (vacatiegeld) -Lid werkgroep neonatale infectieziekten sectie neonatologie NVK (onbetaald) -Projectcommissielid ZonMw project: Introduction of Audit generated Changes in perinatal care using ""Tailored"" implementation strategies. (ACTion-project) (onbetaald) =Projectcommissielid 5 genes per minute, afdeling Medische genetica, UMCG, Groningen (onbetaald) |
|
Geen restricties
|
|
P. te Boekhorst |
Internist-Hematoloog / Transfusiespecialist
|
Medisch Adviesraad Sanquin, Lid, Vacatiegeld
|
In verleden: - Gastvrijheid Firma Alexion - Adviesraad Firma AmgeN (ITP) |
Lid participeert niet bij besluitvorming omtrent ITP |
|
B. Biemond |
Internist-hematoloog |
|
|
Geen restricties |
|
L. Oosten |
Hematoloog, Afdeling Immunohematologie & Bloedtransfusie bij het Leids Universitair Medisch Centum |
|
|
Geen restricties |
|
K. Fijn van Draat |
-Hoogleraar kinderhematologie AMC - Senior onderzoeker Sanquin Research |
VIDI selectiecommissie ZONMW, onbetaald (wel vacatievergoeding) |
Lid van de stuurgroep van de PLANET-2 studie die onderzoek doet naar triggers van trombocytentransfusie bij neonatenop de Neonatale Intensive Care Unit. PLANET-2 ontvangt geen sponsoring van de farmaceutische industrie |
Geen restricties |
|
Werkgroep trombocytentransfusies |
||||
|
A. Vlaar |
- Internist-Intensivist, Academisch Medisch Centrum, Amsterdam - Principal investigator Infusion related morbidity and mortality in the critically ill |
- Klinisch brug figuur Sanquin, onbetaald
|
Onderzoek gefinancierd door NWO, ZonMW, Sanquin: PI van de PACER studie (onder andere): hierbij worden trombotriggers voor invasieve ingrepen aangehouden. |
Geen restricties (ten aanzien van PACER studie: geen tegengesteld belang. Studie wordt niet gepubliceerd binnen termijn afronding richtlijn). |
|
l. van Pampus |
Internist-hematoloog-transfusiespecialist Radboudumc |
- Vice voorzitter hemovigilantiekamer TRIP (onbezoldigd)
|
Tegemoetkoming verblijfkosten Dublin (Ierland) het 17th Annual NATA Symposium on Patient Blood Management, Haemostasis and Thrombosis (NATA 2016) cf de CGR-rgels. |
Geen restricties |
|
G. Jansen |
Internist-hematoloog, afdeling Hematologie, Erasmus MC |
Post doctoraal onderzoeker bij afdeling Plasmaeiwitten, Sanquin Bloedvoorziening. Gastvrijheidovereenkomst, onbetaald |
"1) Naam project: ""Surface sialic acid is critical for platelet survival"" Financier: Sanquin Product and Process development (PPOC nr. 13-019). Bedrag: 499.000 euro. Rol: AIO project 2013-2018. Principal investigator en co-promotor
Toelichting: van dit geld is een OIO aangesteld (Mw M. Rijkers) die in dienst van Sanquin (1,0 fte) dit onderzoek verricht" |
Bij onderwerp sialic acid en trombocytenoverleving geen trekker /betrokkenheid opstellen aanbevelingen |
|
J.L. Kerkhoffs |
Internist - Hematoloog (0,8 FTE)
|
Transfusie-specialist / transfusie research (0,2 FTE) via Sanquin
|
Op Sanquin verricht ik klinisch transfusie onderzoek wat deels gefinancieerd wordt door de industrie TerumoBCT: PI van de PREPAReS studie, een RCT naar de klinische effectiviteit van trombocyten concentraten behandeld met een pathogeen-reductie proces (Mirasol, TERUMO BCT).
|
Restricties t.a.v. producten behandeld met pathogeen reductie proces en biomarkers. Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig.
|
|
R. Schutgens |
Internist-hematoloog
|
Lid van Medische Adviesraad patiëntenvereniging ITP |
-Speakersfee (voor instituut) en/of unrestricted research grant en/of lid advisory board van: Bayer, Baxalta, CSL Behring, NovoNordisk, Sanquin, Pfizer, Bristol-Meyers Squibb -Principal Investigator van de Trombocytopathie in Nederland (TiN) studie, mede gefinancierd door een unrestricted grant van Sanquin - deelname (in UMCU) ontwikkeling PACT en U-PACT (geen financieel belang) |
Geen betrokkenheid vragen bij bloedplaatjesfunctietest (PACT). Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig. |
|
M. Coppens |
Internist-vasculaire geneeskunde
|
- Diverse naschollingen en adviesraden (allen incidenteel) aangaande directe orale anticoagulantie georganiseerd door de fabrikanten van deze middelen, te weten Boehringer Ingelheim, Bayer, Pfizer, Bristol-Meyers Squibb, Daiichi Sankyo. Deze diensten zijn betaald, waarbij het geld naar mijn instituut gaat - Adviesraad aangaande 'The future of hemophilia treatment' georganiseerd door CSL Behring. Twee maal een advisory board; in 2015 en 2016. Deze diensten zijn betaald waarbij geld naar instituut gaat. CSL Behring produceert o.a. Haemocomplettan P (fibrinogeenconcentraat) en Beriplex (vierfactorenconcentraat). De huidige richtlijn zal mogelijk off-label gebruik van deze 2 middelen gaan bespreken. De genoemde adviesraad richtte zich op hemofilie A en B en de producten Haemocomplettan P en Beriplex zijn hier niet aan de orde geweest." |
Lid van de Stuurgroep van de Trombopathie in Nederland studie (geen financiele belangen). -Sanquin Blood Supply: Prothrombin Complex Concentrate (PCC) for the immediate reversal of the anticoagulant effects if new oral anticoagulants in emergency situations. Sanquin Blood Supply is producent van Cofact, een PCC, - CSL Behring: Biomarkers to detect subclinical arthropathy and predict long-term clinical arthropathy in patients with hemophilia. This project was awarded a 2016 Heimburger Award. CSL Behring produceert zowel Haemocomplettan P (fibrinogeenconcentraat) als Beriplex (een PCC), Dit project is gecofinancierd door CSL Behring, maar hebben geen betrekking op Haemocomplettan P noch Beriplex. |
Geen betrokkenheid opstellen aanbevelingen t.a.v. fibrinogeenconcrentraat en vierfactoren concentraat |
|
E. Lopriore |
Sectiehoofd Neonatologie WAKZ/LUMC |
Lid bloedtransfusiecommissie LUMC |
Onderzoek gefinancieerd door Sanquin: 1. PROC 12-012-027: Matisse studie: RCT in neonaten naar twee verschillende triggers voor trombocyten transfusies 50 vs 25; Promovenda: Suzanne Gunnink 2. PROC 16-33: Promotie onderzoek naar Rhesus hemolytische ziekt: Promovenda: Isabelle Ree |
Geen restricties |
|
H. van Ommen (meelezer) |
Kinderhematoloog |
|
'- PI Einstein junior (Bayer) Behandeling trombose bij kinderen - PI Hokusai kinderen (Daiichi Sankyo) Behandeling trombose bij kinderen - Nationaal coördinator BMS studie Apixaban ter preventie van trombose bij kinderen met een hartafwijking |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afstemming met de Patiëntenfederatie, Stichting Zeldzame Bloedziekten en Oscar Nederland. Deze verenigingen zijn uitgenodigd voor de invitational conference (knelpuntenanalyse) voorafgaand aan deze herziening en hebben input geleverd voor de te prioriteren vragen. De verenigingen hebben aangegeven graag in de commentaarfase de conceptrichtlijn te ontvangen voor commentaar. Tevens zal in de eindfase van deze richtlijn nog worden overlegd over de communicatie aan patiënten en of er nog aanvullende teksten voor patiënten kunnen worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij afronding van de richtlijn te vinden zijn bij de aanverwante producten. De werkgroep zal tevens de interne kwaliteitsindicatoren die bij de Richtlijn bloedtransfusie 2011 zijn opgesteld beoordelen en indien nodig door ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroepen en de adviseurs de knelpunten. De werkgroepen beoordeelden de aanbevelingen uit de eerdere richtlijn Bloedtransfusiebeleid (2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en andere aanwezigen tijdens de Invitational conference. De werkgroepen stelden vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn in de werkgroepen besproken waarna de werkgroepleden de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroepen tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews (Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje “Overwegingen”.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en de weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn word aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroepen. Naar aanleiding van de commentaren word de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroepen. De definitieve richtlijn word aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2012.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Uitgangsvraag: In chirurgische patiënten (volwassenen en kinderen) met een anemie of met een occult ijzergebrek, Wat is het effect op uitkomst van het preoperatief toedienen van: 1. oraal ijzer in vergelijking met intraveneus ijzer 2. oraal ijzer in vergelijking met niets/ placebo 3. iv ijzer in vergelijking met niets/placebo 4. oraal en iv ijzer in vergelijking met niets/placebo 5. EPO in vergelijking met niets/placebo 6. EPO plus ijzer in vergelijking met niets/placebo |
|
|
Database(s): Medline, Embase |
Datum: 30 januari 2019 |
|
Periode: > 2015 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2015 – januari 2019
|
1 exp Anemia/ or exp Hemoglobinometry/ or (an?emi* or ((h?emoglobin or hb) adj2 (level* or volume* or measure*))).ti,ab,kw. (240311) 2 exp Perioperative Period/ or exp Perioperative Care/ or (surg* or presurg* or operat* or preoperat* or pre-operat* or perioperat* or peri-operat* or intraoperat*or intra-operat* or postoperat* or post-operat*).ti,ab,kw. (2687766) 3 exp Hematinics/ or exp Iron Compounds/ or Iron/ or Erytropoietin/ or ((iron or ferrous or ferric or ferumoxytol or magnetite or "ferriferous oxide") adj5 (supplement*or therap* or treat* or oral or iv or intravenous or diet*)).ti,ab,kw. or (h?ematinic* or h?ematopoieti*).ti,ab,kw. or (erytropoie* or epoetin* or epoietin* or epo or epogen or eporatio or procrit or binocrit or eprex or mircera or neorecormon or recormon or retacrit or darbopoetin or darbepoetin or darbepoietin or aranesp or r-huepo or huepo or r-hepo or rhepo or glycol-epoetin).ti,ab,kw. or (anti-an?emi* or antian?emi*).ti,ab,kw. (312195) 4 1 and 2 and 3 (1965) 5 limit 4 to (english language and yr="2015 -Current") (337) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (387645) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1834583) 8 5 and 6 (29) 9 5 and 7 (82) 10 9 or 10 (94)
= 94 (93 uniek) |
233 |
|
Embase (Elsevier) |
('anemia'/exp/mj OR anemi*:ab,ti OR anaemi*:ab,ti OR 'hemoglobin determination'/exp OR (((hemoglobin OR haemoglobin OR hb) NEAR/2 (level* OR volume* OR measure*)):ab,ti) OR 'iron deficiency'/exp OR ((iron NEAR/2 deficien*):ab,ti))
AND ('surgery'/exp/mj OR surg*:ab,ti OR presurg*:ab,ti OR operat*:ab,ti OR preoperat*:ab,ti OR 'pre-operat*':ab,ti OR perioperat*:ab,ti OR 'peri-operat*':ab,ti OR intraoperat*:ab,ti OR 'intra-operat*':ab,ti OR postoperat*:ab,ti OR 'post operat*':ab,ti)
AND ('antianemic agent'/exp OR 'iron'/exp OR 'iron intake'/exp OR 'iron derivative'/exp OR 'anti-an?emi*':ab,ti OR antian?emi*:ab,ti OR h?ematinic*:ab,ti OR h?ematopoieti*:ab,ti OR (((iron OR ferrous OR ferric OR ferumoxytol OR magnetite OR 'ferriferous oxide') NEAR/5 (supplement* OR therap* OR treat* OR oral OR iv OR intravenous OR diet*)):ab,ti) OR erytropoieti*:ab,ti OR epoetin*:ab,ti OR epoietin*:ab,ti OR epo:ab,ti OR epogen:ab,ti OR eporatio:ab,ti OR procrit:ab,ti OR binocrit:ab,ti OR eprex:ab,ti OR mircera:ab,ti OR neorecormon:ab,ti OR recormon:ab,ti OR retacrit:ab,ti OR darbopoetin:ab,ti OR darbepoetin:ab,ti OR darbepoietin:ab,ti OR aranesp:ab,ti OR huepo:ab,ti OR 'r hepo':ab,ti OR rhepo:ab,ti OR 'glycol epoetin':ab,ti)
AND (english)/lim AND (2015-2019)/py NOT 'conference abstract':it
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
= 201 (196 uniek) |
