Peri-operatief gebruik tranexaminezuur bij kinderen
Uitgangsvraag
Is het effectief om preventief tranexaminezuur te geven aan kinderen die een operatie met hoog bloedingsrisico ondergaan?
Aanbeveling
Geef peri-operatief tranexaminezuur:
- aan kinderen die een ingreep ondergaan ter correctie van een congenitale craniosynostose;
- aan adolescenten die een ingreep ondergaan ter correctie van een scoliose.
Overweeg peri-operatief tranexaminezuur te geven aan:
- kinderen die een andere operatie met hoog bloedingsrisico ondergaan;
- kinderen die een cardiochirurgische ingreep moeten ondergaan met hoog bloedingsrisico, maar houdt hierbij rekening met een mogelijk verhoogd risico op epilepsie bij complexe cardiochirurgische situaties en mogelijk verminderde klaring door tijdelijke nierfunctiestoornis.
Geef niet standaard peri-operatief tranexaminezuur aan:
- kinderen die een operatie met een laag bloedingsrisico ondergaan. Overweeg om bij kinderen waar wel een grote bloeding optreedt, diagnostiek te verrichten naar een onderliggende stollingsstoornis.
Geef een oplaad tranexaminezuur van 10 tot 15 mg/kg bij aanvang van de operatie en continueer met een continu infusie van 3 tot 5 mg/kg/uur.
Overwegingen
Introductie
Tranexaminezuur is een antifibrinolyticum. Het bindt aan plasminogeen waardoor plasminogeen niet omgezet kan worden in plasmine. Hierdoor wordt de interactie tussen plasminogeen en fibrine tegen gegaan en fibrine niet afgebroken. Tranexaminezuur kan zowel lokaal, als oraal en intraveneus worden toegediend. Tranexaminezuur passeert de bloed-hersenbarrière (McCormack, Drugs 2012).
Naast tranexaminezuur zijn er andere middelen die als antifibrinolyticum werken, zoals aprotinine, maar deze middelen zijn in Nederland niet of nauwelijks in gebruik en zijn daarom niet meegenomen in deze richtlijn.
Profylactisch gebruik van tranexaminezuur tijdens operaties met standaard groot bloedverlies leidt tot minder bloedverlies
In de meta-analyse die verricht is voor deze richtlijn tonen de geïncludeerde studies dat er minder bloedverlies optreedt bij de kinderen die tranexaminezuur hebben ontvangen. Dit effect is vooral overtuigend te zien tijdens chirurgische correcties van craniosynostosis bij jonge kinderen en scoliose-correcties in adolescenten. Bij beide ingrepen kan het bloedverlies tot > 500mL of > 1x het volledige bloedvolume oplopen. Bij beide operatietechnieken betreft het een ingreep met een belangrijk component botmodulatie. De conclusie van de meta-analyse dat tranexaminezuur tijdens craniosynostosis of scoliose-correcties bloedverlies vermindert, is ook redelijk toepasbaar in Nederland. De geïncludeerde studies (Neilipovitza, Duran, Kim) gebruiken vergelijkbare doseringen tranexaminezuur, een enkele gebruikt hogere doseringen (Sethna, Goobie). Daarnaast leidt het verminderde bloedverlies ook daadwerkelijk tot een afname van bloedtransfusies.
De conclusie dat profylactisch gebruik van tranexaminezuur bij operaties met groot bloedverlies leidt tot minder bloedverlies en minder toediening van bloedtransfusies, wordt ook bevestigd in een RCT bij kinderen met een craniosynostose correctie, welke is gepubliceerd buiten de onderzoeksperiode van deze review om (Fenger-Eriksen, 2019). De resultaten van Fenger-Eriksen et al sluiten aan bij de in deze review gevonden conclusies.
Profylactisch gebruik van tranexaminezuur tijdens operaties met accidenteel groot bloedverlies leidt niet evident tot minder bloedverlies
In de studies naar het effect van tranexaminezuur op bloedverlies bij operaties waar gemiddeld gezien maar weinig bloedverlies optreedt, wordt geen sterk effect van tranexaminezuur gevonden. In deze review zijn de studies opgenomen die tranexaminezuur toepasten tijdens een KNO-ingreep of palatoplastiek (Bruhm, Solimon, Arantes). In deze studies werd gemiddeld 46.56 tot 158,21 mL bloed verloren. Hierbij moet worden genoteerd dat het meeste bloed werd verloren in de studie van Santosh (2016), waar een tonsillectomie werd uitgevoerd bij relatief oudere kinderen van gemiddeld 13-14 jaar in plaats van gemiddeld 7 jaar zoals bij Bruhm en Solimon. Het statistisch significante verschil in de studie van Santosh (2016) bleek niet significant in de meta-analyse (MD -1,08 (95%-CI -4,41 tot 2,25)), zie figuur 7. Het lijkt dan ook relevanter om bij de individuele patiënt waar wel incidenteel groot bloedverlies optreedt tijdens een ingreep, stollingsanalyse in te zetten en zo nodig gerichte therapie te geven voorafgaande aan een nieuwe ingreep (Gitomer, 2019).
Profylactisch gebruik van tranexaminezuur tijdens cardiochirurgische ingrepen vermindert misschien het totaal bloedverlies
De conclusie dat tranexaminezuur bloedverlies tijdens cardiochirurgische ingrepen bij kinderen vermindert, is op basis van de huidige studies niet goed te stellen. Het ontbreekt toch aan voldoende, kwalitatief goed opgezette studies in deze groep patiënten. Er moet zelfs worden aangetekend dat een disproportioneel deel van de studies in hetzelfde centrum zijn uitgevoerd (zie Chauhan 2003, 2004, 2004b). Met inclusie van deze studies is er geen significant bloedverlies; de mean difference is 3,6ml/kg minder bloedverlies voor de groep die tranexaminezuur kreeg. Het 95% betrouwbaarheidsinterval gaat hier echter over de nul (-8,08 tot 0,85). Omdat er methodologisch vraagtekens geplaatst worden bij de uitvoering van de Chauhan studies, is er aanvullend een meta-analyse verricht zonder deze studies. Er is dan wel significant minder bloedverlies in de tranexaminezuur arm, maar dit betreft een klinisch weinig-relevant volume van gemiddeld 1/3e transfusie (mean difference -5,22 ml/kg, met 95% CI -8,16 tot -2,28) (Faraoni, 2012).
Meer onderzoek middels een goed RCT over tranexaminezuur bij cardiochirurgische ingrepen bij kinderen is aangeraden. Opvallend is dat in dezelfde meta-analyse van Faraoni (2012) er wel een afname was van met name de rode bloedtransfusies in de groep die tranexaminezuur kreeg. Dit effect hield ook aan als de studies van Chauhan werden geëxcludeerd (afname transfusie RBC’s van mean 6,4 ml/kg naar -9,08 ml/kg (95%CI -15,04 tot -3,12).
De toepasbaarheid van de bevindingen voor de Nederlandse situatie zijn niet eenduidig. In het algemeen wordt vaak alleen tranexaminezuur gegeven bij hoog-risico ingrepen in een dosering die varieert van 10 tot 15 mg/kg als oplaadt en een onderhoudsdosering van 2 tot 5mg/kg/uur. De doseringen in de gevonden studies variëren sterk en de oplaaddosis is soms vele malen hoger dan de Nederlandse praktijk.
Profylactisch gebruik van tranexaminezuur vermindert mogelijk het aantal bloedtransfusies bij operaties met een hoog risico op groot bloedverlies
In de studies bij kinderen met een chirurgische correctie van een craniosynostose, scoliose of een cor vitium, is een afname gevonden van het aantal transfusies. Dit geldt met name voor de toediening van erytrocyten transfusies en mogelijk ook voor plasma. Deze conclusie wordt bevestigd in een recent gepubliceerde RCT door Fenger-Eriksen (Fenger-Eriksen, 2019). De gemiddelde afname is niet groot, gemiddeld 6 tot 8 ml/kg transfusie. Mogelijk komt dit doordat de beslissing om een bloedtransfusie te geven gebaseerd wordt op het zichtbare bloedverlies en op peri-operatief afgenomen hemoglobine waarden, welke beïnvloed worden door de kwaliteit van het bloedgas en de peri-operatief optredende dilutie als gevolg van kristalloïden of colloïden
Profylactisch tranexaminezuur en het ontstaan van trombose
Door de werking van tranexaminezuur op de fibrinolyse, bestaat er een theoretisch risico op het ontstaan van trombose. Dit is niet gevonden in de RCT’s (incl. cardiochirurgische ingrepen) die in deze richtlijn zijn opgenomen. Bij cardiothoracale ingrepen wordt in de praktijk en retrospectief onderzoek cohort onderzoek wel een trombotisch event gerapporteerd. Er is maar één melding van een postoperatieve trombose in de ulnaire arterie waar een arterielijn was geplaatst bij een kind dat tranexaminezuur kreeg tijdens een craniosynostose correctie (Chung , 2019).
Profylactisch tranexaminezuur en optreden van epileptische consulten
Er is in de RCT’s die geïncludeerd zijn voor deze richtlijn geen melding gemaakt van een verhoogde incidentie op epilepsie door het additioneel gebruik van tranexaminezuur.
In prospectieve of retrospectieve cohortstudies in kinderen dietranexaminezuur toegediend krijgen tijdens een cardiochirurgische ingreep, wordt wel melding gemaakt van epilepsie (Lecker, 2016; Lin, 2012). In de analyses komt daarbij het geven van tranexaminezuur als één van de mogelijke risicofactoren naar voren. Omdat het in deze studies gaat om zeer complexe ingrepen is een causaal verband moeilijk aantoonbaar in een cohortstudie. Er wordt naast tranexaminezuur als risicofactor vaak ook melding gemaakt van andere bijdragende factoren, zoals een lange klemtijd of (peri-operatief ontstane) nierinsufficiëntie (Sharma, 2014; Katznelson: The association between TXA and convulsive sezures after cardiac surgery: a multivariate analysis in 11.529 patients, Anesthesia 2014;69:124-30).
Mogelijk is er ook een relatie met de dosering, bij hogere piekconcentraties (Gertler, 2017; onderhoudsinfuus) en hogere totaal doseringen treedt vaker epilepsie op (Kalavrouziotis, 2012; Lecker, 2016; Lin, 2012). Meer informatie kan er in de toekomst komen uit de geregistreerde RCT (ChiCTR1900024131) (Zhang, 2019).
Los van intraveneuze toediening is er ook gekeken naar intrapericardiale toediening tijdens de cardiochirurgische ingreep (Habbab, 2019). Habbab concluderen dat topicaal aanbrengen van tranexaminezuur tijdens de ingreep kan leiden tot minder postoperatief bloedverlies. Tevens zou er minder epilepsie als bijwerking worden gezien.
Dat neemt niet weg dat er melding wordt gemaakt van epilepsie bij kinderen die cardiochirugische ingreep ondergaan met ondersteuning middels hart-longmachine. Om de risico’s goed in te schatten is er geprotocolleerd onderzoek nodig waar tranexaminezuur de interventie is en epilepsie de uitkomstmaat. Het is mogelijk dat het vaker voorkomen van epilepsie door tranexaminezuur als add-on in risicogroepen optreedt. Daarom wordt geadviseerd om bij risicopatiënten hoge doseringen te vermijden. Dit advies komt overeen met een recent gepubliceerd opinieartikel van Faraoni (Faraoni, 2019).
Dosering en toediening tranexaminezuur tijdens operaties
Uit de gerapporteerde studies blijkt dat er meestal gekozen wordt voor intraveneuze toediening van tranexaminezuur. Er bestaat echter een grote variabiliteit in de dosering van tranexaminezuur. Zowel oplaaddosis als onderhoud verschilt in dosering en in vorm. Met de huidige data is geen definitieve uitspraak te doen over de optimale toedieningsvorm van peroperatief intraveneus toegediend tranexaminezuur.
In het algemeen kan gesteld worden dat relatief laag-gemiddelde doseringen tranexaminezuur reeds effectief lijken. In een aantal studies wordt gestreefd naar een tranexaminezuur-concentratie van 20 µg/ml. Het lijkt er op dat dit het beste bereikt wordt met een oplaaddosis van 10 tot 15 mg/kg en een onderhoudsdosis van 3 tot 5 mg/kg/uur (Goobie, 2013 en Gertler, 2017). Deze doseringen sluiten goed aan bij de Nederlandse praktijk.
Onderbouwing
Achtergrond
Sommige operatieve ingrepen bij kinderen kunnen gepaard gaan met een groot bloedverlies. Aangezien kinderen weinig circulerend bloedvolume hebben, kunnen ze minder goed compenseren voor dit perioperatieve bloedverlies, waardoor er sneller perioperatieve complicaties als een verworven coagulopathie, acidose vorming, of hypotensie kunnen optreden, welke het bloedverlies op hun beurt weer negatief beïnvloeden. Om dit bloedverlies tegen te gaan, kan tranexaminezuur worden gegeven tijdens de operatie. Tranexaminezuur is een antifybrinoliticum en werkt daarmee stollingsbevorderend. Om de toegevoegde waarde van de juiste dosering tranexaminezuur bij operaties in kinderen vast te stellen werd met behulp van een systematisch literatuur 'search' gezocht naar een wetenschappelijke onderbouwing van het preventief toedienen van tranexaminezuur aan kinderen die een operatie met een hoog bloedingsrisico ondergaan.
Conclusies / Summary of Findings
Scoliose
|
Laag GRADE |
Perioperatief bloedverlies Profylactische toediening van tranexaminezuur kan het perioperatieve bloedverlies bij adolescenten die een chirurgische scoliosecorrectie ondergaan verminderen.
Bronnen: (McNicol, 2016; Neilipovitz, 2001; Sethna, 2005) |
|
Laag GRADE |
Aantal bloedtransfusies/zakjes Toediening van tranexaminezuur kan het aantal bloedtransfusies/zakjes bij adolescenten die een chirurgische scoliosecorrectie ondergaan verminderen.
Bronnen: (McNicol, 2016; Neilipovitz, 2001; Sethna, 2005) |
|
- GRADE |
Aantal patiënten dat een bloedtransfusie moet ontvangen Vanwege de beperkte beschikbare data is het niet mogelijk om een uitspraak te doen of tranexaminezuur invloed heeft op het aantal patiënten dat een bloedtransfusie moet ontvangen na een chirurgische scoliosecorrectie.
Bronnen: (McNicol, 2016; Sethna, 2005) |
|
- GRADE |
Stollingscorrecties door middel van stollingsbevorderende medicatie Er zijn geen studies gevonden die het effect van tranexaminezuur op stollingscorrecties door middel van stollingsbevorderende medicatie bij adolescenten die een chirurgische scoliosecorrectie moeten ondergaan hebben onderzocht. |
|
- GRADE |
Optreden trombose Vanwege de beperkte beschikbare data is het niet mogelijk om een uitspraak te doen wat het effect van tranexaminezuur is op het optreden van trombose bij adolescenten die een chirurgische scoliosecorrectie moeten ondergaan.
Bronnen: (McNicol, 2016; Sethna, 2005) |
|
- GRADE |
Epilepsie Er zijn geen studies gevonden die het risico-verhogende effect van tranexaminezuur op het optreden van epilepsie bij adolescenten die een chirurgische scoliosecorrectie moeten ondergaan hebben onderzocht. |
|
- GRADE |
Opnameduur Er zijn geen studies gevonden die het effect van tranexaminezuur op de opnameduur bij adolescenten die een chirurgische scoliosecorrectie moeten ondergaan hebben onderzocht. |
Hartoperatie
|
Laag GRADE |
Aantal bloedtransfusies/zakjes Toediening van tranexaminezuur zou het aantal bloedtransfusies/zakjes bij kinderen die een hartoperatie ondergaan kunnen verminderen.
Bronnen: (Faraoni, 2012) |
|
Laag GRADE |
Postoperatieve bloedverlies Toediening van tranexaminezuur zou het postoperatieve bloedverlies bij kinderen die een hartoperatie ondergaan kunnen verminderen.
Bronnen: (Faraoni, 2012) |
|
- GRADE |
Overige uitkomstmaten Er zijn geen cardiochirurgische studies gevonden die onderzocht hebben bij kinderen of het geven van tranexaminezuur effect heeft op:
|
Tonsillectomie
|
Laag GRADE |
Intra-operatieve bloedverlies Toediening van tranexaminezuur lijkt het intra-operatieve bloedverlies bij kinderen die een adeno- of tonsillectomie ondergaan niet te verminderen.
Bronnen: (Brum, 2012; Santosh, 2016, Soliman, 2015) |
|
- GRADE |
Aantal patiënten dat een bloedtransfusie moet ontvangen Vanwege de beperkte beschikbare data is het niet mogelijk om een uitspraak te doen of tranexaminezuur invloed heeft op het aantal patiënten dat een bloedtransfusie moet ontvangen na een adeno- of tonsillectomie.
Bronnen: (Brum, 2012) |
|
- GRADE |
Overige uitkomstmaten Er zijn geen studies gevonden die het effect van tranexaminezuur hebben onderzocht bij kinderen die een adeno- of tonsillectomie moeten ondergaan, op:
|
Craniosynostose
|
Redelijk GRADE |
Intra-operatief bloedverlies Toediening van tranexaminezuur vermindert waarschijnlijk het intra-operatieve bloedverlies bij kinderen die een operatie voor craniosynostose ondergaan.
Bronnen: (Kim, 2018) |
|
Laag GRADE |
Totaal aantal transfusies/zakjes Toediening van tranexaminezuur kan het totaal aantal transfusies/zakjes bij kinderen die een operatie voor craniosynostose ondergaan verminderen.
Bronnen: (White, 2015; Duran, 2003; Dadure, 2011; Goobie, 2011) |
|
Redelijk GRADE |
Hoeveelheid intra-operatief toegediende erytrocyten Toediening van tranexaminezuur vermindert waarschijnlijk de hoeveelheid intra-operatief toegediende erytrocyten bij kinderen die een operatie voor craniosynostose ondergaan.
Bronnen: (Kim, 2018) |
|
Redelijk GRADE |
Hoeveelheid intra-operatief toegediende plasma Toediening van tranexaminezuur vermindert waarschijnlijk de hoeveelheid intra-operatief toegediende plasma bij kinderen die een operatie voor craniosynostose ondergaan.
Bronnen: (Kim, 2018) |
|
Redelijk GRADE |
Hoeveelheid intra-operatief toegediende trombocyten Toediening van tranexaminezuur vermindert misschien de hoeveelheid intra-operatief toegediende trombocyten bij kinderen die een operatie voor craniosynostose ondergaan.
Bronnen: (Kim, 2018) |
|
- GRADE |
Aantal patiënten dat een bloedtransfusie moet ondergaan Vanwege de beperkingen van beschikbare data is het niet mogelijk om een uitspraak te doen of tranexaminezuur invloed heeft op het aantal patiënten dat een bloedtransfusie moet ontvangen na een operatie voor craniosynostose.
Bronnen: (Kim, 2018) |
|
- GRADE |
Stollingscorrecties door middel van stollingsbevorderende medicatie Er zijn geen studies gevonden die het effect van tranexaminezuur op stollingscorrecties door middel van stollingsbevorderende medicatie bij kinderen die een operatie voor craniosynostose moeten ondergaan hebben onderzocht. |
|
- GRADE |
Optreden van trombose Vanwege de beperkte beschikbare data is het niet mogelijk om een uitspraak te doen wat het effect van tranexaminezuur is op het optreden van trombose bij kinderen die een operatie voor craniosynostose moeten ondergaan.
Bronnen: (Kim, 2018) |
|
- GRADE |
Optreden van epilepsie Er zijn geen studies gevonden die onderzocht hebben dat bij kinderen er een risico-verhogend effect is van tranexaminezuur op het optreden van epilepsie. |
|
Zeer laag GRADE |
Opnameduur Het is onduidelijk wat het effect van tranexaminezuur is op de opnameduur van kinderen die een operatie voor craniosynostose moeten ondergaan.
Bronnen: (White, 2015; Goobie, 2011; Kim, 2018) |
Palatoplastiek
|
Redelijk GRADE |
Intra-operatief bloedverlies Toediening van tranexaminezuur vermindert het intra-operatieve bloedverlies bij kinderen die een palatoplastiek ondergaan waarschijnlijk niet.
Bronnen: (Arantes, 2017) |
|
- GRADE |
Totaal aantal transfusies/zakjes Vanwege de beperkt beschikbare data is het niet mogelijk om een uitspraak te doen of tranexaminezuur invloed heeft op het totaal aantal transfusies/zakjes of het aantal patiënten dat een bloedtransfusie moet ontvangen na een palatoplastiek.
Bronnen: (Arantes, 2017) |
|
- GRADE |
Stollingscorrecties door middel van stollingsbevorderende medicatie Vanwege de beperkte beschikbare data is het niet mogelijk om een uitspraak te doen of tranexaminezuur invloed heeft op stollingscorrecties door middel van stollingsbevorderende medicatie na een palatoplastiek.
Bronnen: (Arantes, 2017) |
|
- GRADE |
Overige uitkomstmaten Er zijn geen studies gevonden die het effect van tranexaminezuur hebben onderzocht bij kinderen die een palatoplastiek moeten ondergaan op:
|
Samenvatting literatuur
Scoliose
Beschrijving studies
In de Cochrane review van McNicol (2016) is gekeken naar het effect van aprotonine, tranexaminezuur en aminocapronzuur op het ontstaan van peri-operatief bloedverlies en de transfusiebehoefte bij kinderen die een chirurgische correctie van een scoliose ondergaan. De search van McNicol (2016) is niet beperkt op datum en taal. Er is gezocht tot 8 oktober 2015. Artikelen zijn alleen geïncludeerd wanneer het een RCT betrof. Gedetailleerde inclusiecriteria zijn opgenomen in de evidencetabel. De Cochrane review includeerde negen studies, waarvan drie studies (En, 2014; Neilipovitz 2001; Sethna, 2005) wél preventief toedienen van tranexaminezuur vergelijken met níet toedienen van tranexaminezuur en daarmee relevant zijn voor de beantwoording van onze uitgangsvraag. Echter, bij opvragen van de bronstudies, bleek dat één van de drie studies een abstract betrof (En, 2014), waarin details over study design en patiëntkarakteristieken ontbraken. Om deze reden wordt dit abstract niet meegenomen in deze systematische literatuuranalyse.
De studie van Neilipovitz (2001) werd gesponsord door een farmaceutisch bedrijf en Sethna (2005) rapporteerde geen financieringsbron.
Neilipovitz (2001) en Sethna (2005) includeerden beiden kinderen met scoliose. Neilipovitz (2001) includeerde 40 patiënten, 22 in de tranexaminezuurgroep (interventie) versus 18 in de placebogroep. De gemiddelde leeftijd van de interventiegroep was 14,1 (± 2,1) jaar en van de placebogroep 13,7 (± 2,5) jaar (controle). De oplaaddosis werd gegeven nadat de patiënt gepositioneerd was. Er werd 10 mg/kg tranexaminezuur iv toegediend, gevolgd door een continue infusie van 1mg/kg/uur, totdat de huid weer gesloten was. Gehanteerde transfusie trigger was een hemoglobine niveau lager dan 4,3 mmol/l (7 g/dL) of klinische symptomen van hypovolemie. De studie rapporteert niet welk placebo de controlegroep ontving. Voor de Nederlandse praktijk, ligt de gebruikte dosering lager dan gemiddeld gebruikt wordt.
Sethna (2005) includeerde 44 patiënten, waarvan 23 in de tranexaminezuurgroep versus 21 in de placebogroep. De gemiddelde leeftijd van de interventiegroep was 13,6 (± 1,8) jaar en van de placebogroep 14,0 (± 2,0) jaar. Er werd in 15 minuten 100 mg/kg tranexaminezuur toegediend, gevolgd door een continue infusie van 10 mg/kg/uur totdat de huid gesloten was. De oplaaddosis werd gegeven na inductie van de anesthesie en voor incisie van de huid. Gehanteerde transfusiedrempel was een hematocrietwaarde lager dan 25%, of voor sommige patiënten met secundaire scoliose een hematocriet lager dan 27%. De controlegroep ontving een zoutoplossing (0,9%). Voor de Nederlandse praktijk, ligt de gebruikte dosering hoger dan gemiddeld gebruikt wordt.
Resultaten
Gemiddelde totale Bloedverlies (mL)
McNicol (2016) voerde een meta-analyse uit voor het gemiddelde totale bloedverlies in mL. Hierbij is het intra- en postoperatieve bloedverlies samen genomen. Tranexaminezuur verlaagde het gemiddelde totale bloedverlies met 681,81 mL (Mean Difference: -681,81 (95% betrouwbaarheidsinterval (CI) -1149,12 tot -214,49), zie analyse 1.1.3 in figuur 1).
Figuur 1 Meta-analyse: het gemiddelde totale bloedverlies (mL) bij antifibrinolytica ten opzichte van placebo uitgesplitst naar subgroepen aminocapronzuur, aprotonine en tranexaminezuur (Bron: McNicol, 2016)
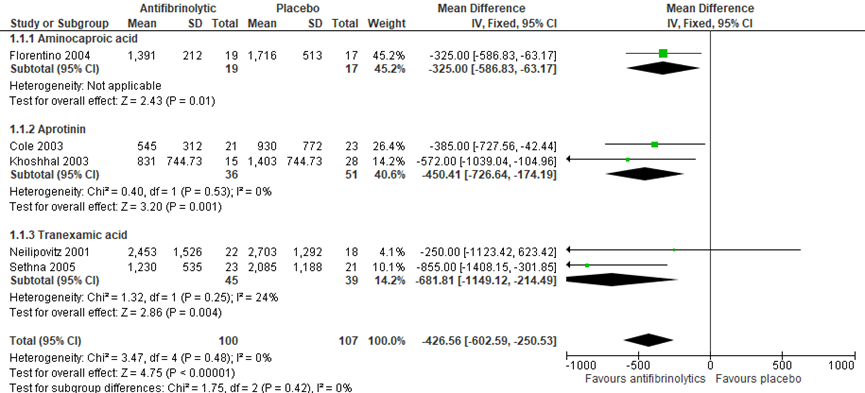
Aantal transfusies/zakjes (gemiddelde getransfundeerd bloed in mL)
McNicol (2016) voerde een meta-analyse uit voor de gemiddelde hoeveelheid getransfundeerd bloed in mL (intra-operatief en postoperatief samen). Dit betrof zowel allogeen als autoloog getransfundeerd bloed. Er waren geen studies die tranexaminezuur onderzochten en exclusief allogene transfusies onderzochten.
Tranexaminezuur verminderde het gemiddelde totale getransfundeerde bloed met 395,14 mL (Mean Difference (95%-CI -687,55 tot -102,73), p<0.05 zie analyse 4.1.3 in figuur 2).
Figuur 2 Meta-analyse: gemiddelde hoeveelheid getransfundeerd bloed (mL) bij antifibrinolytica ten opzichte van placebo uitgesplitst naar subgroepen aminocapronzuur, aprotonine en tranexaminezuur (Bron: McNicol, 2016)
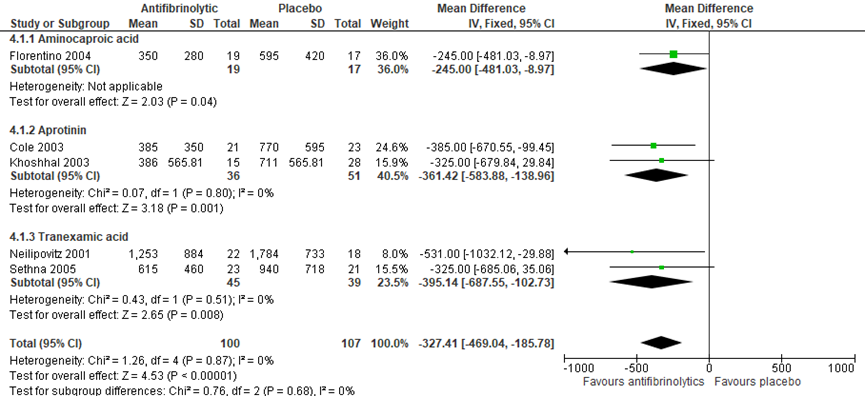
Aantal patiënten die een bloedtransfusie ontvingen
McNicol (2016) voerde een meta-analyse uit voor het aantal kinderen dat tijdens een scioliosecorrectie zowel allogeen als autoloog getransfundeerd bloed als transfusie heeft ontvangen. In deze meta-analyse rapporteerde alleen de studie van Sethna (2005) het aantal patiënten dat een transfusie ontving in beide studiearmen. Deze studie rapporteerde geen significant verschil tussen patiënten in de tranexaminezuurgroep in vergelijking met de placebogroep als gekeken wordt naar aantal bloedtransfusies. In totaal ontvingen 14 van de 23 patiënten (60,1%) in de tranexaminezuur groep een bloedtransfusie in vergelijking met 15 van de 21 patiënten (71,4%) in de placebogroep (RR 0,85 (95% CI 0,56 tot 1,30) zie analyse 2.1.3 in figuur 3).
Figuur 3: Meta-analyse: aantal patiënten die een bloedtransfusie ontvingen bij antifibrinolytica ten opzichte van placebo uitgesplitst naar subgroepen aminocapronzuur, aprotonine en tranexaminezuur (Bron: McNicol, 2016)
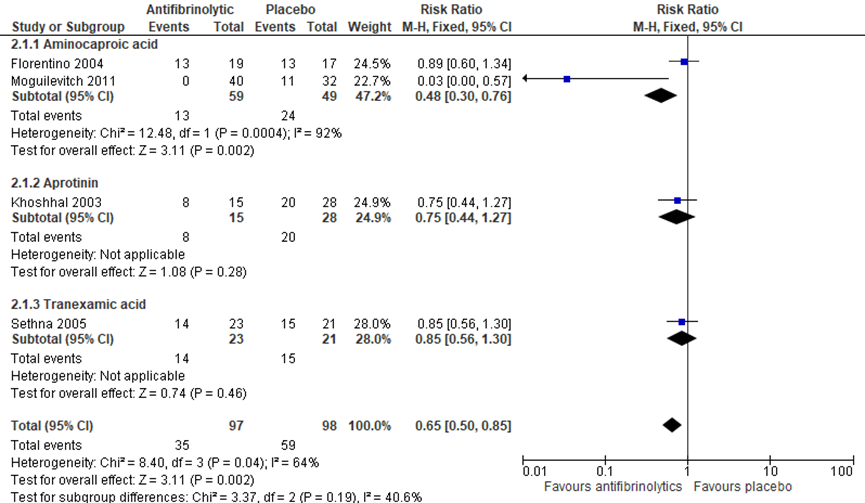
Stollingscorrecties
Deze uitkomstmaat werd niet gerapporteerd.
Trombose
Alleen de studie van Sethna (2005) rapporteerde de uitkomstmaat trombose voor de vergelijking tranexaminezuur versus placebo. In de review werden geen gegevens beschreven over het gebruik van tromboseprofylaxe. Zowel in de tranexaminezuur groep (n=23) als in de placebogroep (n=21) trad geen trombose op. Op basis van de beschikbare data en aantallen kan daarom ook geen conclusie getrokken worden over deze uitkomstmaat.
Epilepsie
Deze uitkomstmaat werd niet gerapporteerd.
Opnameduur
Deze uitkomstmaat werd niet gerapporteerd
Hartoperatie
Beschrijving studies
In de review van Faraoni (2012) is gekeken naar het effect van tranexaminezuur op bloedverlies en allogene bloedtransfusies bij kinderen die een hartoperatie ondergaan. De searchdatum is niet gerapporteerd, maar alle geïncludeerde studies werden teruggevonden door onze eigen search, die werd uitgevoerd op 05-12-2018 en die geen beperking in publicatiedatum had.
Faraoni (2012) includeerde alleen Engelstalige RCT’s. Gedetailleerde inclusiecriteria zijn opgenomen in de evidence-tabel. De review includeerde acht studies (Bulutcu, 2005; Chauhan, 2004; Chauhan, 2003; Chauhan, 2004b; Reid, 1997; Zonis, 1996; Levin, 2000; Shimizu, 2011). De auteurs vermelden dat de resultaten kunnen zijn beïnvloed door het feit dat drie geïncludeerde studies door hetzelfde onderzoeksteam zijn gepubliceerd (Chauhan, 2003 tot 2004). Eén van de studies (Chauhan, 2004) bevat vier verschillende interventiegroepen met elk een andere toedieningsvorm en dosering van tranexaminezuur, maar gebruikt hierbij steeds dezelfde controlegroep. Er is überhaupt grote variabiliteit in de doserings- en infusieschema’s van het tranexaminezuur tussen de verschillende studies (zie figuur 4). Tevens is het belangrijk om te noteren dat niet alle studies het gehanteerde transfusiebeleid rapporteerden.
De doseringen en infusieschema’s die in de drie studies van Chauhan werden gehanteerd komen het meest overeen met de doseringen die in de Nederlandse praktijk worden gebruikt voor cardiochirurgische ingrepen, te weten oplaad 10 tot 15mg/kg, onderhoud 5 mg/kg/uur. Echter, in alle drie de studies werden patiënten in hetzelfde centrum, en in dezelfde periode geïncludeerd. Daarnaast hebben de artikelen veel tekstuele overlap. De auteurs melden hier zelf niks over, waardoor voor het analyseren van de resultaten in deze review de kwaliteit van deze studies in twijfel wordt getrokken. Het is onduidelijk of het om verschillende patiëntenpopulaties gaat en ook lijkt er steeds naar dezelfde placebo groep van n=30 verwezen te worden. Dit suggereert dat er niet voor elke interventie een nieuwe placebo groep parallel heeft meegelopen. Ook wordt het door de werkgroepleden van de richtlijnencommissie zeer onwaarschijnlijk geacht dat er in één centrum, gedurende dezelfde periode, drie separate RCT’s liepen, met 7 verschillende doseringsschema’s, en zonder overlap tussen patiënten. Om bovenstaande redenen worden ook de resultaten uit de sensitiviteitsanalyse beschreven die is uitgevoerd door Faraoni (2012) waarin de studies van Chauhan zijn geëxcludeerd.
Figuur 4 gehanteerde doserings- en infusieschema per studie; ID = Induction-dosage, ECC = Extra corporal circuit, CI = continuous infusion
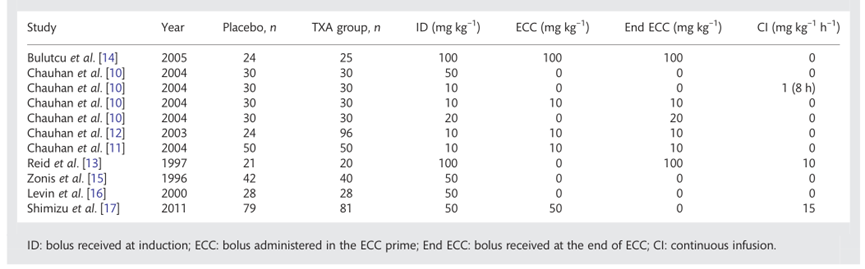
Resultaten
Hieronder volgen de resultaten per uitkomst-parameter.
Gemiddelde totale Bloedverlies (mL/kg)
Faraoni (2012) voerde een meta-analyse uit voor het gemiddelde totale bloedverlies in mL (van starten OK tot 24 uur postoperatief) per kilo. De groep met tranexaminezuur behandeling verloor gemiddeld 3,61 mL/kg minder bloed dan de controlegroep (MD -3,61 (95%-CI -8,08 tot 0,85)). Zie figuur 5.
Figuur 5 verschil in bloedverlies (ml/kg) 24 uur postoperatief voor tranexaminezuur versus placebo
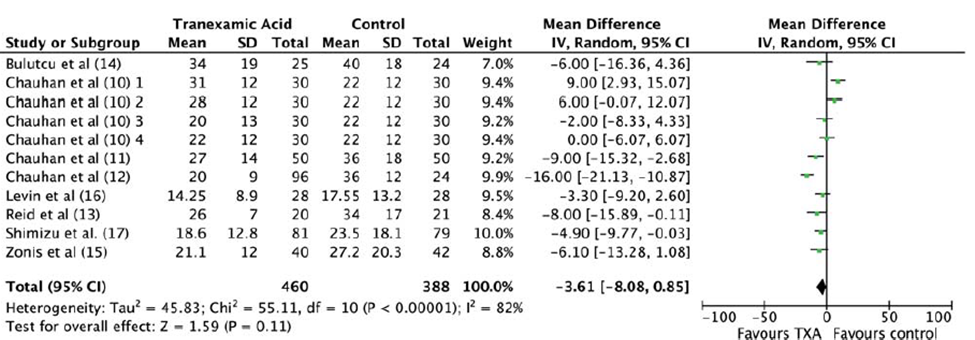
Faraoni (2012) voerde voor deze uitkomstmaat nog een sensitiviteitsanalyse uit zonder de studies van Chauhan. De groep in de tranexaminezuur groep verloor dan gemiddeld 5,22 mL/kg minder bloed dan de controlegroep (MD -5,22 (95%-CI -8,16 tot -2,28)) (Figuur 6).
Figuur 6 Sensitiviteitsanalyse voor de uitkomstmaten bloedverlies, transfusie van erytrocyten (RBC), plasma (FFP) en trombocyten (PLT) (mg/kg) zonder de studies van Chauhan
Aantal transfusies/zakjes (mL/kg)
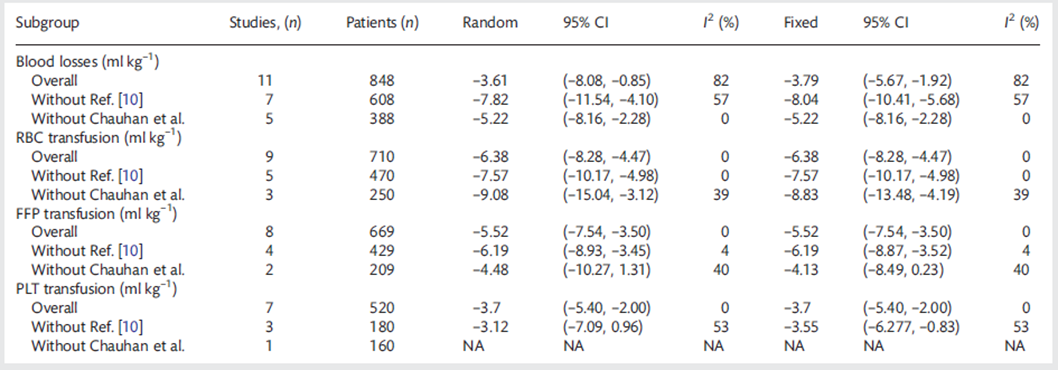
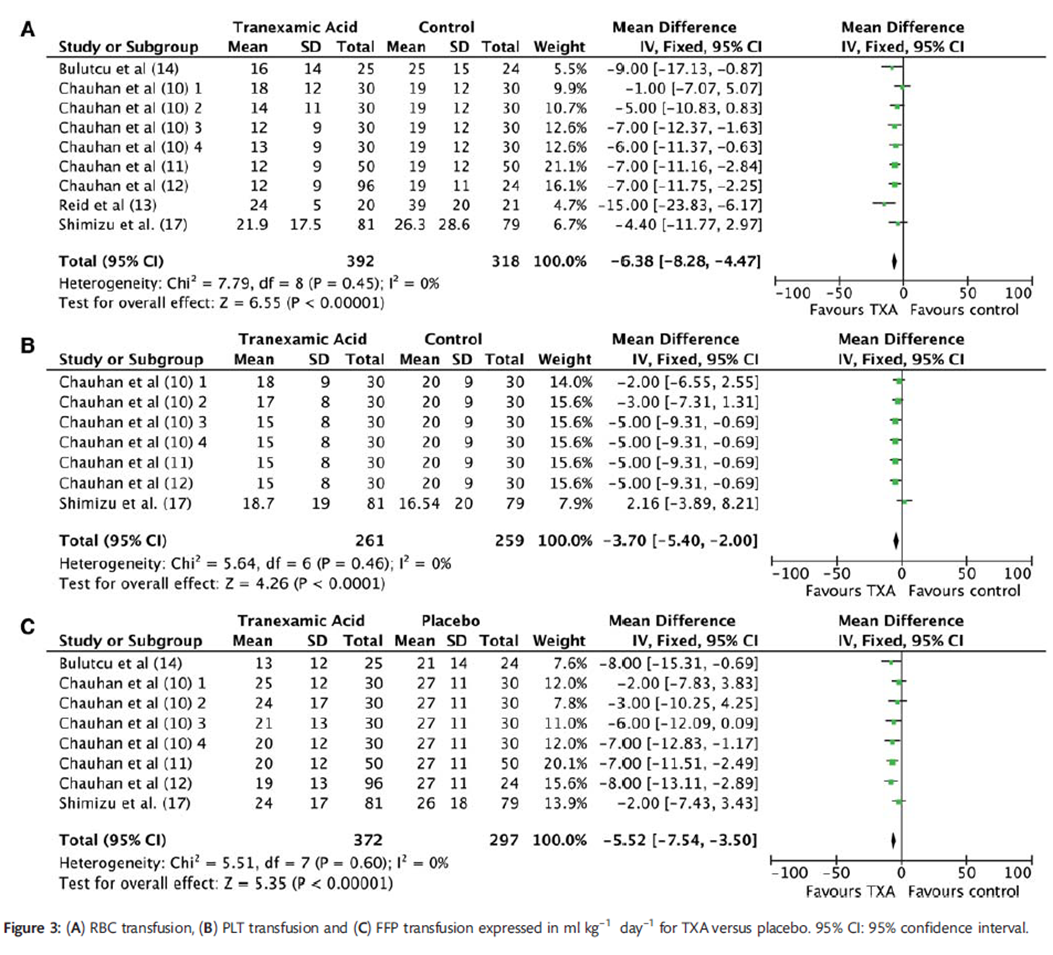
Faraoni (2012) voerde een meta-analyse uit voor de gemiddelde hoeveelheid allogeen getransfundeerd bloed in mL/kg (24 uur postoperatief). Patiënten in de tranexaminezuur groep ontvingen gemiddeld 6,38 mL/kg minder RBC-transfusies (MD -6,38 (95%-CI -8,28 tot -4,47) zie analyse A, figuur 7). Patiënten in de tranexaminezuur groep ontvingen gemiddeld 5,52 mL/kg minder Plasma-transfusies (MD -5,52 (95%-CI -7,54 tot -3,50) zie analyse B, figuur 7). Patiënten in de tranexaminezuur groep ontvingen gemiddeld 3,7 mL/kg minder PLT-transfusies (MD -3,7 (95%-CI -5,40 tot -2,00) zie analyse C, figuur 7).
Ondanks de kleine volumina verschil, is dit vertaald naar de kliniek een derde tot een halve transfusie minder, aangezien transfusies bij kinderen worden berekend op 15 mL/kg of 1 eenheid per keer.
Faraoni (2012) voerde voor deze uitkomstmaat een sensitiviteitsanalyse uit zonder de studies van Chauhan (zie tabel 1). Patiënten in de tranexaminezuur groep ontvingen gemiddeld 9,08 mL/kg minder erytrocyten (RBC)-transfusies (MD -9,08 (95%-CI -15,04 tot -3,12). Patiënten in de tranexaminezuur groep ontvingen gemiddeld 4,48 mL/kg minder Plasma-transfusies (FFP) (MD -4,48 (95%-CI -10,27 tot 1,31). Voor de trombocyten (PLT)-transfusies bleef maar één studie over, dus is hier geen meta-analyse voor uitgevoerd.
Figuur 7 RBC transfusie (A), PLT (B) en plasma (FFP - C) in ml/kg, 24 uur postoperatief voor tranexaminezuur versus placebo.
Aantal patiënten die geen bloedtransfusies ontvingen
Deze uitkomstmaat werd niet in de review van Faraoni (2012) gerapporteerd.
Stollingscorrecties
Deze uitkomstmaat werd niet gerapporteerd.
Trombose
Deze uitkomstmaat werd niet gerapporteerd.
Epilepsie
Deze uitkomstmaat werd niet gerapporteerd.
Opnameduur
Deze uitkomstmaat werd niet gerapporteerd.
Tonsillectomie
Beschrijving studies
In de dubbel-geblindeerde RCT van Brum (2012) is gekeken naar het effect van tranexaminezuur op het intra-operatieve bloedverlies en het optreden van postoperatieve (na)bloedingen bij kinderen die een adenotonsillectomie ondergingen. Brum (2012) includeerde 95 patiënten, waarvan 47 in de tranexaminezuurgroep versus 48 in de placebogroep. De gemiddelde leeftijd van de interventiegroep was 6,43 (± 2,23) jaar en van de controlegroep 7,33 (± 2,66) jaar. Er was geen verschil in geslacht tussen de groepen, maar ondanks randomisatie was gewicht en leeftijd van de tranexaminezuur groep lager dan de controlegroep (respectievelijk p = 0,07 en p = 0,04). In de voorbereidingsruimte/holding werd een oplaad van 10 mg/kg tranexaminezuur intraveneus gegeven in 1 uur gevolgd door 8 en 16 uur na de eerste toediening een nieuwe dosis van 10 mg/kg. De controlegroep ontving een zoutoplossing (0,9%) met identiek volume, kleur en textuur als tranexaminezuur, toedieningen werden bereid in de ziekenhuisapotheek. Pijnmedicatie middels NSAIDs werd vermeden.
In de RCT van Soliman (2015) is gekeken naar zowel het effect van tranexaminezuur als het effect van 2 verschillende doseringen tranexaminezuur op het intra-operatieve bloedverlies bij kinderen die een tonsillectomie ondergingen. Er werden 225 patiënten geïncludeerd verdeeld over drie groepen. Interventiegroep A (n=75) ontving na inductie in 10 minuten 10 mg/kg intraveneus tranexaminezuur, interventiegroep B (n=75) ontving na inductie in 10 minuten 15 mg/kg intraveneus tranexaminezuur plus een continue infusie van 5 mg/kg/uur gedurende de operatie. Er werden tevens 75 kinderen geïncludeerd in de controlegroep. Zij ontvingen geen tranexaminezuur. De studie rapporteerde niet welk placebo de controlegroep ontving.
De gemiddelde leeftijd van de kinderen in interventiegroep A was 7,14 (± 2,35) jaar, van interventiegroep B, 7,0 (± 2,32) en van de controlegroep 7,10 (± 2,45) jaar. Anesthetica werd toegediend volgens een vastgelegd protocol.
In de RCT van Santosh (2016) is ook gekeken naar het effect van tranexaminezuur op intra-operatief bloedverlies bij kinderen die een tonsillectomie ondergingen. Santosh (2016) includeerde 50 patiënten, waarvan 25 in de tranexaminezuur groep versus 25 in de controlegroep. De gemiddelde leeftijd lag tussen 13,5 en 14,5 jaar. Patiënten in de interventiegroep ontvingen drie tot vier uur pre-operatief eenmalig 10 mg/kg tranexaminezuur intraveneus. De controlegroep ontving geen tranexaminezuur, maar de studie rapporteerde niet welk placebo wel gegeven werd.
Resultaten
Hieronder volgen de resultaten per uitkomst-parameter.
Gemiddelde totale Bloedverlies (mL)
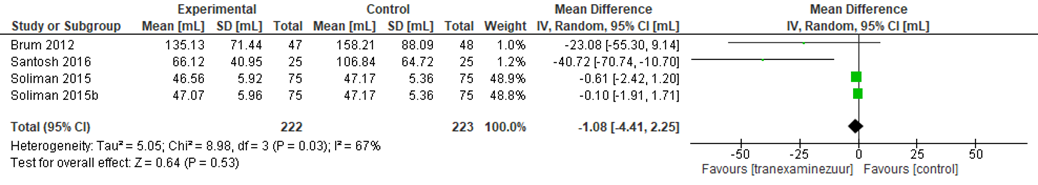
Drie studies rapporteerden het gemiddelde totale bloedverlies (mL). In de studie van Brum werd geen significant verschil (p = 0,195) gevonden in bloedverlies tussen de tranexaminezuurgroep (135,13 ± 71,44 mL) versus placebogroep (158,21 ± 88,09). In de studie van Soliman (2015) werd ook geen significant verschil (p = 0,691) gevonden in bloedverlies tussen patiënten die tranexaminezuur ontvingen als eenmalige bolus of met onderhoudsinfuus erna (groep A: 46,56 ± 5,92 mL, groep B: 47,07 ± 5,96 mL) ten opzichte van patiënten die dit niet kregen (47,17 ± 5,36 mL). Santosh (2016) rapporteerde wel een significant verschil in bloedverlies (p < 0,01) tussen de tranexaminezuur groep (66,12 ± 40,95 mL) en de controlegroep (106,84 ± 64,72 mL). Wat hierin opvalt is, dat de patiënten hier tieners zijn in plaats van kinderen en dat de oplaad tranexaminezuur ruim pre-operatief gegeven werd.
Een meta-analyse die werd uitgevoerd voor deze uitkomstmaat vond echter geen klinisch relevant verschil voor bloedverlies in mL ten voordele van tranexaminezuur of placebo (MD -1,08 (95%-CI -4,41 tot 2,25) (Figuur 8).
Figuur 8 Meta-analyse van het gemiddelde totale bloedverlies (mL) bij tranexaminezuur ten opzichte van de controlegroep
Aantal transfusies/zakjes
Deze uitkomstmaat werd niet gerapporteerd.
Aantal patiënten die geen bloedtransfusies ontvingen tijdens of na de ingreep als gevolg van nabloeding
Er was geen sprake van intra-operatieve noch postoperatieve bloedingen met klinisch significantie, gedefinieerd als ziekenhuis heropname, bloedtransfusie of chirurgische re-interventie. Derhalve zijn er geen bloedtransfusies toegediend aan kinderen in beide studiearmen. Vanwege de beperkte beschikbare data kan geen conclusie getrokken worden over deze uitkomstmaat.
Stollingscorrecties
Deze uitkomstmaat werd niet gerapporteerd.
Trombose
Deze uitkomstmaat werd niet gerapporteerd.
Epilepsie
Deze uitkomstmaat werd niet gerapporteerd.
Opnameduur
Deze uitkomstmaat werd niet gerapporteerd
Craniosynostose
Beschrijving studies
In de review van White (2015) is gekeken naar de effectiviteit van verschillende interventies om allogene bloedtransfusiebehoefte te verminderen bij kinderen die een operatieve correctie van een craniosynostose ondergaan. Er is gezocht tot juni 2012. Gedetailleerde inclusiecriteria zijn opgenomen in de evidencetabel. De review includeert 18 studies, waarvan drie studies (Duran, 2003; Dadure, 2011; Goobie, 2011) prospectief gerandomiseerde studies zijn die het effect van tranexaminezuur onderzochten. In de studie van Goobie (2011) ontving de interventiegroep (n=23) een oplaaddosis van 50 mg/kg tranexaminezuur gevolgd door een continue infusie van 5 mg/kg/uur gedurende de operatie. In de studie van Duran (2003) werd in de voorbereidingsruimte 15 mg/kg tranexaminezuur intraveneus toegediend. Dit werd gedurende de operatie iedere 4 uur herhaald, en tot 48uur postoperatief iedere 8 uur. In de studie van Dadure (2011) ontving de interventiegroep 15 mg/kg tranexaminezuur in 15 minuten (= 1,5 mL/kg) tegenover geen tranexaminezuur voor de controle groep. De controlegroep kreeg 1,5 mL/kg zout (0,9%) in 15 minuten. Daarnaast kregen patiënten in beide studiearmen eenmaal per week 600 U/kg erytropoëtine (EPO) gedurende twee weken en evt. nog een 3e keer bij persisterende anemie. Tevens ontvingen alle patiënten orale ijzersuppletie (6 mg/kg/dg). Anesthetica werd toegediend volgens een vastgelegd protocol.
De studies (Duran, 2003; Dadure, 2011; Goobie, 2011) rapporteren het gehanteerde transfusiebeleid niet allemaal of niet op identieke wijze. Daarnaast is er aanzienlijke variatie in het volume van getransfundeerd bloed. Sommige studies presenteren data voor perioperatieve transfusies en sommige presenteren postoperatieve transfusiedata. Zover als mogelijk heeft White (2015) deze data geconformeerd tot een “totaal getransfundeerd bloedvolume” als identieke parameter.
In de dubbel geblindeerde RCT van Kim (2018) is gekeken naar het effect van tranexaminezuur op het bloedverlies bij kinderen die een chirurgische craniosynostose-correctie ondergingen. De studie rapporteert niet of het allogene of autologe bloedtransfusies betrof. Kim (2018) includeerde 48 patiënten, waarvan 23 in de tranexaminezuur groep versus 25 in de placebogroep. De mediane leeftijd van de interventiegroep was 12 (interkwartiel range 7 tot 22) maanden en van de controlegroep 14 (Interkwartiel range 8 - 30) maanden. Er werd gedurende 15 minuten een oplaaddosis van 10 mg/kg tranexaminezuur intraveneus toegediend gevolgd door een continue infusie van 5 mg/kg/u vanaf het begin van de operatie totdat de huid gesloten was. De controlegroep ontving een zoutoplossing (0.9%). Anesthetica werd toegediend volgens een vastgelegd protocol.
Resultaten
Hieronder volgen de resultaten per uitkomst-parameter.
Intra-operatief gemiddeld totaal bloedverlies (mL/kg)
Bloedverlies werd in de studie van Kim (2018) beschreven als het bloedverlies in milliliter per kilogram lichaamsgewicht. Patiënten in de tranexaminezuurgroep (gemiddeld bloedverlies80,6 ± 33,3 mL/kg) verloren minder bloed in vergelijking met patiënten in de controlegroep (115,6 ± 43,6 mL/kg) intra-operatieve (p = 0,03).
Aantal transfusies/zakjes (gemiddelde volume allogeen getransfundeerd bloed in mL)
De review van White (2015) rapporteerde het gemiddelde (totaal aantal milliliters) allogeen getransfundeerd bloed (zie tabel 1).
Tabel 1 Totaal volume allogeen getransfundeerd bloed tranexaminezuurgroep versus controlegroep
|
Studie |
Tranexaminzuurgroep Gemiddelde (SD) volume allogeen getransfundeerd bloed in mL |
Controlegroep Gemiddelde (SD) volume allogeen getransfundeerd bloed in mL |
Mean Difference (95% CI) |
|
Duran, 2003 |
185 (132) |
258 (144) |
-73 (-194,07 tot 48,07) |
|
Dadure, 2011 |
58 (94) |
133 (108) |
-75 (-138,46 tot -11,54) |
|
Goobie, 2011 |
376 (148) |
655 (409) |
-279 (-468,18 tot -89,82) |
Aangezien het volume allogeen getransfundeerd bloed aanzienlijke varieerde tussen de drie studies (Duran, 2003; Dadure, 2011; Goobie, 2011) worden de resultaten geconformeerd naar “totaal getransfundeerd bloedvolume” waarvan de resultaten gepresenteerd worden als de Standardized Mean Difference (eenheidsloos). De meta-analyse laat dan een matig verschil zien in het gemiddelde volume allogeen getransfundeerd bloed in het voordeel van het gebruik van tranexaminezuur ten opzichte van de controlegroep (SMD -0,76; 95% CI: -1,16 tot -0,35) (zie figuur 9).
Figuur 9 Meta-analyse van het effect van tranexaminezuur versus placebo op het “totaal getransfundeerd bloedvolume” van allogeen getransfundeerd bloed gepresenteerd als standardized mean difference (White, 2015)
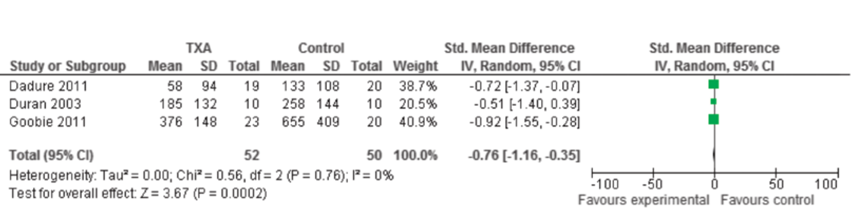
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Aantal transfusies/zakjes (intra-operatief gemiddelde volume getransfundeerd bloed in mL/kg)
Patiënten in de tranexaminezuurgroep ontvingen gemiddeld minder rode bloedcellen (RBC) tijdens de operatie (48,8 ± 16,8 mL/kg) in vergelijking met patiënten in de controlegroep (65,2 ± 24,2 mL/kg) (p = 0,010). Dit komt klinisch overeen met 2 tot 3 transfusies à 15 mL/kg RBC’s minder in de groep kinderen die tranexaminezuur kreeg.
Patiënten in de tranexaminezuurgroep ontvingen gemiddeld minder plasma tijdens de operatie (19,4 ± 13,0 mL/kg) in vergelijking met patiënten in de controlegroep (28,1 ± 15,1 mL/kg) (p = 0,038). Dit komt klinisch overeen met ~1 transfusie minder in de groep die tranexaminezuur kreeg.
Er was geen significant verschil in het mediane intra-operatief ontvangen trombocyten (PLT) tussen de tranexaminezuurgroep (5,9 (interkwartiel range 0 tot 12,9) mL/kg) in vergelijking met de controlegroep (10 (interkwartiel range 2,1 tot 16,9) mL/kg) (p = 0,217).
Aantal patiënten die geen bloedtransfusies ontvingen
De studie van Kim (2018) rapporteerde het aantal patiënten die een bloedtransfusie ontvingen. Zowel in de tranexaminezuur groep als in de placebogroep hadden alle patiënten tenminste één bloedtransfusie nodig.
Stollingscorrecties
Deze uitkomstmaat werd niet gerapporteerd.
Trombose
Eén studie (Kim, 2018) rapporteerde de uitkomstmaat trombose. In deze studie werden geen gegevens beschreven over het gebruik van tromboseprofylaxe, maar gezien de jonge leeftijd waarop de correctie van de craniosynostose plaats vindt (gemiddeld 9 maanden) is dit ook niet geïndiceerd. Zowel in de tranexaminezuur-groep als in de placebogroep trad geen trombose op.
Epilepsie
Deze uitkomstmaat werd niet gerapporteerd.
Opnameduur
Twee studies (Kim, 2018; Goobie, 2011) rapporteerden de opnameduur. Kim (2018) rapporteerde een gemiddelde opnameduur in de controlegroep van 10,9 ± 5,1 dagen versus 10,1 ± 3,6 dagen in de tranexaminezuurgroep (Mean Difference 0,8 (95%-CI -3,4 tot 1,8). Goobie (2011) rapporteerde een gemiddelde opnameduur in de controlegroep van 72 ± 96 uur versus 72 ± 264 uur in de tranexaminezuurgroep.
Palatoplastiek
Beschrijving studies
In de dubbel-geblindeerde RCT van Arantes (2017) is gekeken naar het effect van intraveneus tranexaminezuur op het verminderen van intra-operatieve bloedingen en het optreden van oronasale fistels bij kinderen die een palatoplastiek ondergingen. De studie includeerde 70 patiënten, waarvan 35 in de tranexaminezuurgroep versus 35 in de placebogroep. De gemiddelde leeftijd van de interventiegroep was 6,43 (± 2,23) jaar en van de controlegroep 7,33 (± 2,66) jaar. In de voorbereidingsruimte/holding werd 10 mg/kg tranexaminezuur intraveneus toegediend in 15 minuten plus aansluitend een continue infusie gegeven van 1 mg/kg/uur gedurende de operatie. De controlegroep ontving een zoutoplossing (0,9%) bolus en infusie. Beiden infusies zijn kleurloos en daarmee werd blindering gewaarborgd voor de chirurgen . Anesthetica werd toegediend volgens een vastgelegd protocol.
Resultaten
Bloedverlies (mL/geschat totale bloedvolume)
Bloedverlies werd in deze studie beschreven als het percentage bloedverlies in mL ten opzichte van het totale geschatte bloedvolume van de patiënt. Het gemiddelde intra-operatieve bloedverlies in de controlegroep was 28,92mL (2,75% ± 1,92% van het totale bloedvolume) versus 28,36mL (2,42% ± 1,77% van het totale bloedvolume) in de tranexaminezuurgroep (p = 0,459).
Aantal patiënten die een bloedtransfusies ontvingen en aantal transfusies/zakjes
Zowel in de tranexaminezuur groep als in de placebogroep werden geen bloedtransfusies gegeven.
Stollingscorrecties
Eén van de 33 patiënten (3%) in de controlegroep ontving alsnog een antifibrinolyticum in de postoperatieve periode om een bloeding te behandelen. In de profylactisch toegediende tranexaminezuur groep ontvingen geen patiënten additionele antifibrinolytische behandeling voor late nabloedingen.
Trombose
Deze uitkomstmaat werd niet gerapporteerd.
Epilepsie
Deze uitkomstmaat werd niet gerapporteerd.
Opnameduur
Deze uitkomstmaat werd niet gerapporteerd.
Bewijskracht van de literatuur
Scoliose
De bewijskracht voor de uitkomstmaat bloedverlies en aantal transfusies/zakjes is met 2 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (mogelijke risk of bias door: inadequate concealment of allocation oftewel toewijzing aan randomisatie-arm, blindering en selectief rapporteren) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat trombose en aantal patiënten die een bloedtransfusie ontvingen kan niet met GRADE beoordeeld worden gezien de beperkt beschikbare data bij kinderen.
Hartoperatie
De bewijskracht voor de uitkomstmaten bloedverlies en aantal transfusies/zakjes (allogeen getransfundeerd bloed) is met 2 niveaus verlaagd van ‘hoog’ naar ‘laag’, gezien het geringe aantal patiënten (imprecisie), en heterogeniteit (doseringen van tranexaminezuur wijken af van de Nederlandse situatie)
Tonsillectomie
De bewijskracht voor de uitkomstmaat bloedverlies is met 2 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (mogelijke risk of bias door inadequate randomisatie en blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat aantal patiënten die een bloedtransfusie ontvingen kan niet met GRADE beoordeeld worden gezien de beperkte beschikbare data bij kinderen.
Craniosynostose
De bewijskracht voor de uitkomstmaat bloedverlies is met 1 niveau verlaagd naar ‘redelijk’ gezien het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat aantal transfusies/zakjes (allogeen getransfundeerd bloed) is met 2 niveaus verlaagd naar ‘laag’ gezien beperkingen in de onderzoeksopzet (mogelijke risk of bias door inadequate concealment of allocation en blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaten aantal transfusies/zakjes (erytrocyten, plasma en trombocyten) is met 1 niveau verlaagd gezien het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat opnameduur is met 3 niveaus verlaagd naar ‘laag’ gezien beperkingen in de onderzoeksopzet (mogelijke risk of bias door inadequate concealment of allocation en blindering) en het geringe aantal patiënten (imprecisie (2x)).
De bewijskracht voor de uitkomstmaten aantal patiënten die een bloedtransfusie ontvingen en trombose kan niet met GRADE beoordeeld worden gezien de beperkte beschikbare data.
Palatoplastiek
De bewijskracht voor de uitkomstmaat bloedverlies is met 1 niveau verlaagd gezien het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat aantal patiënten die een bloedtransfusie ontvingen, het aantal transfusies/zakjes en stollingscorrecties kan niet met GRADE beoordeeld worden gezien de beperkte beschikbare data.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende vragen:
Wat is het effect van het preventief toedienen van tranexaminezuur in vergelijking met het niet preventief toedienen van tranexaminezuur aan kinderen van 0-18 jaar, die een operatie ondergaan waarbij een reëel risico bestaat op het optreden van groot bloedverlies.
Dit effect wordt gemeten als vermindering van peri-operatief bloedverlies, verminderd gebruik van stollingscorrigerende medicatie of bloedproducten, en verminderd optreden van complicaties.
P: kinderen van 0 tot 18 jaar die een ingreep met hoog bloedingsrisico ondergaan;
I: tranexaminezuur;
C: geen tranexaminezuur of placebo;
O: bloedverlies peri-operatief en postoperatief;
aantal transfusies in milliliters of eenheden;
noodzaak tot stollingscorrecties door middel van stollingsbevorderende medicatie zoals DDAVP, Novoseven;
optreden van trombose (diepe veneuze trombose (DVT); veneuze trombo-embolie (VTE)); pPulmonaire embolie (PE);
optreden van epilepsie;
opnameduur.
De werkgroep achtte bloedverlies peri-operatief, bloedverlies postoperatief, het aantal transfusies/zakjes en stollingscorrecties door middel van andere stollingsbevorderende medicatie (zoals DDAVP/Novoseven) voor de besluitvorming cruciale uitkomstmaten; en trombose (diepe veneuze trombose (DVT); veneuze trombo-embolie (VTE); pulmonaire embolie (PE)), en opnameduur voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de genoemde uitkomstmaten niet a priori, maar hanteerde de in de studies gebruikte definities.
De werkgroep sloot aan bij de door GRADE aangegeven default grenzen van 0,5 SD voor continue uitkomstmaten, RR < 0,75 of > 1,25) (GRADE recommendation) of Standardized Mean Difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot), als uitkomstmaat voor een klinisch relevant verschil.
Omdat in Nederland alleen tranexaminezuur wordt gebruikt, zijn andere antifibrinolytica buiten beschouwing gelaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 5 december 2018 met zoektermen gezocht naar studies over gebruik van tranexaminezuur bij kinderen die een ingreep met hoog bloedingsrisico ondergaan. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 181 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: prospectief gerandomiseerde studies naar 1/ bloedverlies, aantal transfusies (milliliter of eenheden), stollingscorrectie als gevolg van peri-operatief verworven coagulopathie, optreden van trombose of epilepsie, en de opnameduur, bij 2/ kinderen die een ingreep met hoog bloedingsrisico ondergaan en 3/ die tranexaminezuur ontvingen in vergelijking met 4/ kinderen die dezelfde ingreep ondergaan, maar aan wie geen tranexaminezuur of een placebo is gegeven.
Studies werden geëxcludeerd wanneer de patiëntenpopulatie kinderen met preëxistente coagulopathie of stollingsstoornis betrof of wanneer meer dan 10% patiënten ouder was dan 18 jaar. Op basis van titel en abstract werden in eerste instantie 69 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 61 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 8 studies definitief geselecteerd:
- 1 review scoliose;
- 1 review en 1 additionele studie craniosynostose;
- 1 review cardiochirurgie;
- 3 studies tonsillectomie;
- 1 studie palatoplastiek.
Acht onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Arantes GC, Pereira RMR, de Melo DB, Alonso N, Duarte MDCMB. Effectiveness of tranexamic acid for reducing intraoperative bleeding in palatoplasties: A randomized clinical trial. J Craniomaxillofac Surg. 2017 May;45(5):642-648. doi: 10.1016/j.jcms.2016.12.021. Epub 2016 Dec 30. PubMed PMID: 28318926.
- Brum MR, Miura MS, Castro SF, Machado GM, Lima LH, Lubianca Neto JF. Tranexamic acid in adenotonsillectomy in children: a double-blind randomized clinical trial. Int J Pediatr Otorhinolaryngol. 2012 Oct;76(10):1401-5. doi: 10.1016/j.ijporl.2012.04.028. Epub 2012 Jun 16. PubMed PMID: 22704676.
- Chung E, Karlberg HI. Ulnar Artery Thrombosis Following Tranexamic Acid Administration for Craniosynostosis Repair. J Craniofac Surg. 2019;30(1):186–187. doi:10.1097/SCS.0000000000004905.
- Faraoni D, Rahe C, Cybulski KA. Use of antifibrinolytics in pediatric cardiac surgery: Where are we now?. Paediatr Anaesth. 2019;29(5):435–440. doi:10.1111/pan.13533.
- Faraoni D, Rahe C, Cybulski KA. Use of antifibrinolytics in pediatric cardiac surgery: Where are we now?. Paediatr Anaesth. 2019;29(5):435–440. doi:10.1111/pan.13533.
- Faraoni D, Willems A, Melot C, De Hert S, Van der Linden P. Efficacy of tranexamic acid in paediatric cardiac surgery: a systematic review and meta-analysis. Eur J Cardiothorac Surg. 2012 Nov;42(5):781-6. doi: 10.1093/ejcts/ezs127. Epub 2012 Apr 24. Review. PubMed PMID: 22531271.
- Fenger-Eriksen C, D'Amore Lindholm A, Nørholt SE, et al. Reduced perioperative blood loss in children undergoing craniosynostosis surgery using prolonged tranexamic acid infusion: a randomised trial. Br J Anaesth. 2019;122(6):760–766. doi:10.1016/j.bja.2019.02.017.
- Gertler R, Gruber M, Grassin-Delyle S, et al. Pharmacokinetics of tranexamic acid in neonates and infants undergoing cardiac surgery. Br J Clin Pharmacol. 2017;83(8):1745–1757. doi:10.1111/bcp.13274.
- Gitomer SA, Shebna Anand G, Bradley HE, Kumar M, Ouellete L, Musso MF: Screening for undiagnosed bleeding disorders in post-tonillectomy bleed patients: retrospective review and systematic review of literature. Int J Pediatr Otorhinolaryngol 2019;124:210-214.
- Goobie SM, Meier PM, Sethna NF, et al. Population pharmacokinetics of tranexamic acid in paediatric patients undergoing craniosynostosis surgery. Clin Pharmacokinet. 2013;52(4):267–276. doi:10.1007/s40262-013-0033-1.
- Habbab LM, Semelhago L, Lamy A: topical use of tranexaminic acid in cardiac surgery: a meta-analysis, Thor Cardiov Surg 2019.
- Kalavrouziotis D, Voisine P, Mohammadi S, Dionne S, Dagenais F. High-dose tranexamic acid is an independent predictor of early seizure after cardiopulmonary bypass. Ann Thorac Surg. 2012;93(1):148–154. doi:10.1016/j.athoracsur.2011.07.085.
- Kim EJ, Kim YO, Shim KW, Ko BW, Lee JW, Koo BN. Effects of Tranexamic Acid Based on its Population Pharmacokinetics in Pediatric Patients Undergoing Distraction Osteogenesis for Craniosynostosis: Rotational Thromboelastometry (ROTEM(TM)) Analysis. Int J Med Sci. 2018 May 22;15(8):788-795. doi:10.7150/ijms.25008. eCollection 2018. PubMed PMID: 30008588; PubMed Central PMCID: PMC6036088.
- Lecker I, Wang D-S, Whissell PD etal: Tranexamic acid–associated seizures: causes and treatment. Ann neurol 2016;79:18–26 .
- Lin Z, Xiaoyi Z: Tranexamic acid-associated seizures: A meta-analysis. Seizure 2016; 36:70–73
- McNicol ED, Tzortzopoulou A, Schumann R, et al. Antifibrinolytic agents for reducing blood loss in scoliosis surgery in children. Cochrane Database Syst Rev. 2016 19;9:CD006883. Review. PubMed PMID: 27643712.
- Neilipovitz DT, Murto K, Hall L, et al. A randomized trial of tranexamic acid to reduce blood transfusion for scoliosis surgery. Anesth Analg. 2001;93(1):82-7. PubMed PMID: 11429344.
- Santosh, Uttarkar. (2016). A Comparative Study to verify the Efficacy of Preoperative Intravenous Tranexamic Acid in Control of Tonsillectomy Bleeding A Comparative Study to verify the Efficacy of Preoperative Intravenous Tranexamic Acid in Control of Tonsillectomy Bleeding. Otorhinolaryngology Clinics. 8. 1-4. 10.5005/jp-journals-10003-1219.
- Sethna NF, Zurakowski D, Brustowicz RM, et al. Tranexamic acid reduces intraoperative blood loss in pediatric patients undergoing scoliosis surgery. Anesthesiology. 2005;102(4):727-32. PubMed PMID: 15791100.
- Sharma, 2014 V, Katznelson R et al: The association between TXA and convulsive sezures after cardiac surgery: a multivariate analysis in 11.529 patients, Anesthesia 2014;69:124-30.
- Soliman, R., & Alshehri, A. (2015). Assessment of the effect of tranexamic acid on perioperative bleeding in pediatric patients undergoing tonsillectomy. Egyptian Journal of Anaesthesia, 31(4), 297-301.
- van Zhang Y et al (Zhang Y, Jia Y et al: Safety and efficacy of tranexaminic acid in paediatric cardiac surgery: study protocol for a double-blind randomised controlled trial, BMJ Open 2019, (ChiCTR1900024131).
- White N, Bayliss S, Moore D. Systematic review of interventions for minimizing perioperative blood transfusion for surgery for craniosynostosis. J Craniofac Surg. 2015 Jan;26(1):26-36. doi: 10.1097/SCS.0000000000001108. Review. PubMed PMID: 25569385.
Evidence tabellen
Research question: Wat is het effect van het toedienen van tranexaminezuur (peri-operatief) in vergelijking met geen tranexaminezuur (peri-operatief) bij kinderen die een operatie ondergaan met een risico op veel bloedverlies?
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
McNicol, 2016 |
Yes, objectives: To assess the efficacy and safety of aprotinin, tranexamic acid and aminocaproic acid in reducing blood loss and transfusion requirements in children undergoing surgery for correction of idiopathic or secondary scoliosis. |
Yes |
yes |
yes |
Not applicable |
Yes, GRADE approach to assess the overall quality of the evidence |
yes |
Yes, publication bias could not be assessed because there were fewer than 10 included studies |
Not reported for the systematic review |
|
Faraoni, 2012 |
Yes, we therefore performed a systematic review with meta-analysis to evaluate the available literature on the efficacy of TXA compared with placebo in reducing blood loss and allogeneic blood transfusion exposure in children undergoing cardiac surgery. |
Yes, however, date of search was not reported |
Yes |
Yes, however, patient characteristics for different intervention and control group were not reported |
Not applicable |
Yes, the systematic review quality checklist was used. For each study included, it reports the level of evidence and grades of recommendations. |
Yes, furthermore a sensitivity analysis was performed to take into account the following aspects: four included studies were published by the same team. Second, one of the studies evolved different TXA schemes compared with a same control group and each TXA scheme was considered as a single study in the meta-analysis. We therefore performed a sensitivity analysis to take into account these possible biases. In addition to this, these studies applied low TXA doses compared to the other included studies. |
Yes, publication bias could not be assessed because there were fewer than 10 included studies |
Not reported for the individual studies |
|
White, 2015 |
Yes, aim: to systematically review the clinical effectiveness and the cost-effectiveness of interventions to reduce blood transfusions in children undergoing surgery for craniosynostosis. |
Yes |
Yes |
Yes, however, information is very scarce |
Not applicable |
Yes, risk of bias table |
Yes |
Yes, publication bias could not be assessed because there were fewer than 10 included studies |
Not reported for the individual studies |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Brum, 2012 |
Study used randomized blocks. Prior to the beginning of the study, an independent investigator established randomized blocks of four patients: 2 of the placebo group and 2 of the intervention group. These were distributed randomly within the block. Positions within the blocks were given increasing numbers, and this number identified a sealed opaque envelope containing treatment group. Each surgeon received his/her randomized blocks. The 4 patients of the same block were operated by the same surgeon. At the time of surgery, the team contacted the pharmacy of the hospital, providing the patient’s information and the name of the surgeon. The pharmacist in charge opened the corresponding envelope, which contained the type of treatment (saline or tranexamic acid) and of sent the recipients for the study. Treatment was kept blind, revealed only after the completion of the study. Blinding was kept in a manner in which the surgeon, the main investigator, and patient/family had no knowledge of who was receiving the intervention or placebo. Placebo was normal saline maintaining the identical volume, coloration, texture and vial as tranexamic acid, and it was prepared in the hospital pharmacy. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely, authors reported all outcomes that were reported at https://clinicaltrials.gov/ were described |
Unlikely, loss to follow up doesn’t differ between groups. Reasons are also reported |
Unlikely, ITT analysis performed |
|
Santosh, 2016 |
Not described |
Unclear, method of randomization is not described |
Unclear if patients, care providers or outcome assessors were blinded |
Unclear if patients, care providers or outcome assessors were blinded |
Unclear if patients, care providers or outcome assessors were blinded |
Unlikely, trial not registered at clinicaltrial.gov. However, all outcomes listed in the methods section were reported in the results section |
Unlikely, no losses to follow-up |
Unlikely, participants included in the analysis are exactly those who were randomized into the trial. |
|
Soliman, 2015 |
Not described |
Unclear, method of randomization is not described |
Unclear if patients, care providers or outcome assessors were blinded |
Unclear if patients, care providers or outcome assessors were blinded |
Unclear if patients, care providers or outcome assessors were blinded |
Unlikely, trial not registered at clinicaltrial.gov. However, all outcomes listed in the methods section were reported in the results section |
Unlikely, no losses to follow-up |
Unlikely, participants included in the analysis are exactly those who were randomized into the trial. |
|
Arantes, 2017 |
Randomization was performed after inclusion of the patients in the study by an independent physician, and numbered packages were distributed to the two groups by an author using RAS ® (RandomAllocation Software 1.0, Mahmood Saghaei, Isfahan University of Medical Sciences, Isfahan, Iran). Packages were used sequentially, and each patient had the same probability of being allocated to the control group as to the intervention group. During surgery, the anesthesia care team received a package that could contain drug or placebo. Palatoplasties were performed by one of the six plastic surgeons working at the department. The authors did not participate in the surgical procedures. |
Unlikely |
Unlikely |
Unlikely, the surgical team received a previously diluted solution for infusion, which could contain saline (240 mL) with 10 mL Transamin ® (50 mg/mL tranexamic acid, Zydus Nikkho Farmaceutica Ltda, RJ, Brazil) or 10 mL saline. Because the drug is colorless, whether the package had the drug or not was not possible to determine by observation |
Unlikely |
Unlikely, authors reported all outcomes that were reported at clinicaltrials.gov were described |
Unlikely, loss to follow up doesn’t differ between groups. Reasons are also reported |
Unlikely, ITT analysis performed |
|
Kim, 2018 |
Patients were evenly assigned to two groups (TXA or control) using computer-generated randomized tables. The group allocations were noted in sequentially numbered, sealed, and opaque envelopes. |
Unlikely |
Unlikely, a research assistant who was not a study investigator opened the envelopes and prepared the infusions according to the group allocations. Besides the designated research assistant who prepared the study drugs, all study participants and care providers were blinded to the randomization. |
Unlikely |
Unlikely |
Unlikely, authors reported all outcomes that were reported at clinicaltrials.gov were described. More outcomes were reported than were described at clinicaltrials.gov, however these were both statistically and not statistically significant outcomes. |
Unlikely, 2/25 patients of the intervention group were lost to follow up because of an error in the ROTEMTM analysis. |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Reden van exclusie |
|
Tengborn 2015 |
Niet juiste studiedesign (niet systematische review) |
|
Hsu 2016 |
Niet juiste interventie en vergelijking (Aminocaproic) |
|
Sankar 2012 |
Leeftijd 17-30 jaar waarbij grootste deel >18 jaar oud is. Andere P. |
|
Schouten 2009 |
Ouder dan andere reviews en zelfde primaire studies. T.o.v. meer recente studies geen additionele data. (hebben ook studies tranexaminezuur versus. niks). 23 studies cardiac, 5 scoliose |
|
Verma 2014 |
Geen separate evaluatie van kinderen en volwassenen |
|
Durga 2015 |
Voldoet niet aan PICO: studie rapporteert niet de geformuleerde uitkomstmaten |
|
Basta 2012 |
Ouder dan andere systematische reviews en ten opzichte van deze reviews geen additionele primaire data. |
|
Song 2013 |
Overlap met geïncludeerde review en geen additionele primaire data t.o.v. deze review (includeren Goobie, Dadure en een niet RCT) |
|
Hanna 2010 |
Niet juiste interventie en controle (tranexaminezuur versus. recombinant factor VII) |
|
Xie 2015 |
Niet juiste studiedesign (retrospectief) |
|
Faraoni 2014 |
Oudere review. Ten opzichte van nieuwere reviews die geïncludeerd zijn geen additionele primaire studies. |
|
Ohashi 2017. |
Retrospectieve studieopzet |
|
Badeaux 2014 |
Rapporteren niet specifiek over kinderen (data niet te extraheren). |
|
Yang 2013 |
Geen specifieke data kinderen of adolescenten gepresenteerd. |
|
Badeaux 2013 |
Niet juiste studiedesign (is protocol) |
|
Prutsky 2012 |
Niet juiste studie populaite: heamoptoë |
|
Tzortzopoulou 2008 |
Oudere versie van Cochrane review |
|
Desborough 2017 |
Niet juiste interventie (desmopressine) |
|
Mogensen 2017 |
Niet juiste interventie (bepaalde mix) |
|
Gertler 2017. |
Niet juiste studiedesign (modelstudie, farmacokinetica) |
|
Wesley 2015 |
Niet juiste studiedesign (farmacokinetica) |
|
Verma 2015 |
Niet juiste studiepopulatie (pat >18) |
|
Rozen 2015 |
Niet juiste studiedesign (ex vivo) |
|
Muthialu 2015 |
Niet juiste interventie en controle (tranexaminezuur versus. aprotonine) |
|
McLeod 2015 |
Niet juiste studiedesign (cohort) |
|
Robb 2014 |
Niet juiste studiedesign (retrospectief) |
|
Halanski 2014 |
Niet juiste interventie en controle (tranexaminezuur versus. andere middelen) |
|
McLeod 2013 |
Niet juiste studiedesign (retrospectieve cohort) |
|
Yagi 2012 |
Niet juiste studiedesign (retrospectieve cohort) |
|
Xu 2012. |
Niet juiste interventie en controle (tranexaminezuur versus. Batroxoban) |
|
Pasquali 2012 |
Niet juiste interventie en controle (Tranexaminezuur versus. aprotonin) |
|
Faraoni 2012 |
Niet juiste studiedesign (niet systematische review) |
|
Aggarwal 2012 |
Niet juiste uitkomstmaten gerapporteerd ) |
|
Shimizu 2011 |
Zit in review Faraonia |
|
Goobie 2011. |
Zit in review White |
|
Dadure 2011. |
Zit in review White |
|
Verma 2010 |
Niet juiste studiedesign (aankondiging studie die gaat komen). |
|
Niet juiste vergelijking (tranexaminezuur versus. aprotonine) |
|
|
Elwatidy 2008 |
Niet juiste patiëntpopulatie (compound results – geen specifieke data kinderen) |
|
Sethna 2005 |
ZIT IN REVIEW McNicol |
|
Bulutcu 2005 |
Zit in review Faraonia |
|
Chauhan 2004 |
Zit in review Faraonia |
|
Chauhan 2004 |
Zit in review Faraonia |
|
Chauhan 2003 |
Referentie meerdere keren gevonden, dubbel. Studie wel geïncludeerd maar deze referentie niet. |
|
Vacharaksa 2002 |
Zit in review Faraonia |
|
Neilipovitz 2001 |
ZIT in review McNICOL |
|
Dalmau 2000. |
Niet juiste patiëntpopulatie (volwassen populatie (22-67 jaar)) |
|
Reid 1997 |
Zit in review Faraonia |
|
Zonis, 1996 |
Zit in review Faraonia |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-08-2020
Beoordeeld op geldigheid : 15-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn wordt een deel van de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn zal de werkgroep per module een inschatting maken over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging (NIV), Nederlandse Vereniging van Anesthesiologie (NVA) en Nederlandse Vereniging van Klinische Chemie (NVKC) zijn regiehouders van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De transfusierichtlijn geeft ten eerste antwoorden op grote uitgangsvragen over wie, wanneer, hoe, hoeveel en met welke producten getransfundeerd wordt en wat daarvan volgens wetenschappelijk onderzoek aan voordelig/nadelig resultaat verwacht mag worden. Na het bepalen van de wetenschappelijke waarde van dit onderzoek, worden uiteindelijk aanbevelingen opgesteld, gebaseerd op de conclusies van het wetenschappelijke onderzoek en na het beschouwen van een additionele context van bijvoorbeeld kosten- ethische, maatschappelijke of wettelijke overwegingen. Deze aanbevelingen zijn bedoeld om verantwoord en wenselijk handelen voor leden van de beroepsgroep te definieren in de voorkomende dagelijkse klinische praktijk. Echter, er kan beargumenteerd altijd afgeweken worden van de algemene aanbevelingen en gekozen worden voor een meer op de individuele patient afgestemde ondersteuning.
Doelgroep
Naast de genoemde beoogde gebruikers van de richtlijn is de richtlijn ook bedoeld en van waarde voor de collega’s van de nationale bloedvoorzieningsorganisatie Sanquin.
Samenstelling werkgroep
Voor de herziening van de richtlijn zijn er in 2016 zes multidisciplinaire werkgroepen ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij patiënten die een bloedtransfusie nodig hebben. Een stuurgroep, bestaande uit de voorzitters van de deelprojecten, coördineerde de werkgroepen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep bloedingen en bloedbesparende technieken:
- Dr. A.W .M.M. (Ankie) Koopman- van Gemert, Anesthesioloog, voorzitter, NVA
- Dr. P.M.J. (Peter) Rosseel, anesthesioloog-intensivist, NVA
- Prof. dr. J.J. (Jaap Jan) Zwaginga, Hematoloog / Transfusiespecialist / Hoogleraar transfusiegeneeskunde, NIV
- Prof. dr. F.W.G. (Frank) Leebeek, Internist hematoloog en internist vasculair geneeskundige, NIV
- Dr. ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie/ clusterhoofd Hemostase en Transfusie, NVKC
- Dr. E.C.T.H. (Edward) Tan, Traumachirurg / Afdelingshoofd SEH / Heli-MMT arts, NVVH
- Dr. L.M.G. (Leo) Geeraedts, Traumachirurg, NVVH
- Dr. A.B.A. (Alexander) Vonk, Cardiothoracaal chirurg, NVT
- Drs. E.J. (Elise) Huijssen-Huisman, Kinderarts, kinderhematoloog, Transfusiespecialist, NVK
- Dr. N.P. (Nicole) Juffermans, Intensivist, NVIC
- Dr. J.J. (Hans) Duvekot, Gynaecoloog-Perinatoloog, NVOG
Meelezer:
- Drs. V.A. (Victor) Viersen, Anesthesioloog, NVA
Werkgroep Transfusiereacties en gerelateerde aandoeningen:
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, voorzitter, NIV
- Dr. J.L.P. (Hans) van Duijnhoven, laboratoriumspecialist klinische chemie, NVKC
- Drs. C.T. (Christian) Favoccia, anesthesioloog, NVA
- Prof dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. T. (Tanja) Netelenbos, internist-hematoloog, NIV
- M.R. (Michaela) van Bohemen, verpleegkundige n.p., hemovigilantieconsulent V&VN (vanaf juli 2018)
- Dr. J. (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. D. (Dik) Versteeg, arts-microbioloog, NVMM (tot juli 2018)
- Dr. J. H. (Jan) Marcelis arts-microbioloog, NVMM (vanaf juli 2018)
- Dr. A.P.J. (Alexander) Vlaar, internist-Intensivist, NVIC
- Dr. J.C. (Jo) Wiersum-Osselton, TRIP hemo- en biovigilantie, landelijk coördinator, arts M&G, NVDG
Voor de module “Indicatie voor bestralen van bloedproducten” heeft een expertmeeting plaatsgevonden. Bijzondere dank aan de experts die tijdens en na deze meeting hebben bijgedragen aan de tekst:
- Prof. dr. J.H.F. (Fred) Falkenburg, hoogleraar hematologie
- Dr. P.A.W. (Peter) te Boekhorst, internist-hematoloog/ transfusiespecialist
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatoloog
- Prof. dr. J.J. (Jaap Jan) Zwaginga, internist-hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde
- Dr. M.D. (Mette) Hazenberg, internist-hematoloog
Met ondersteuning van:
- Drs. E.E. (Eva) Volmeijer, adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider (tot februari 2020)
- Dr. B.H. (Bernardine) Stegeman, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider (vanaf februari 2020)
- Drs. T. (Tessa) Geltink, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. (Roy) Elbers, adviseur Kennisinstituut van de Federatie Medisch Specialisten (tot juli 2019)
- Dr. E. (Ellen) Paap, adviseur Kennisinstituut van de Federatie Medisch Specialisten (vanaf juli 2019)
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Voorzitters (kerngroep) |
||||
|
M. Schipperus |
Internist-hematoloog (100%) |
Voorzitter Bestuur Stichting TRIP (Transfusie in patiënten), onbetaald |
ITP-onderzoek gefinancierd door AMGeN Advisory board Novartis |
Lid participeert niet in besluitvorming omtrent producten van AMGEN of Novartis. |
|
A. Koopman- van Gemert |
Anesthesioloog |
Diverse functies bij nationale en internationale commissies bv Concilium, Stuurgroep antistolling, examencommissie et cetera Internationaal lid van de Europese examencommissie |
-Participatie in de PETS-studie van het EMC, geen financiële relatie. -Participatie in verschillende onderzoeken (geen financiële relatie en geen direct verband bloedtransfusie) -Organisatie symposia met sponsoring (geen directe financiële relatie en direct verband bloedtransfusie) |
Geen restricties |
|
J.J. Zwaginga |
Hematoloog LUMC (Leiden), Transfusiespecialist, Hoogleraar transfusiegeneeskunde |
-Penningmeester VHL=Vereniging Hematologische laboratoria -Voorzitter van de benigne hematologische werkgroep van NVvH |
-Sprekershonoraria Viforpharma (ijzer: medicatie kan transfusies uitsparen) -Wetenschappelijke adviesraad: Novantis (ijzerchelatie kan transfusie gemedieerde ijzerstapeling opheffen) - Gilead: CLL medicatie webcast geen relatie met transfusiebeleid PI van meerdere Sanquin onderzoeken ogv - allumminisatie door RBC transfusies - ijzertoxiciteit door bloedtransfusies - bloedings IRM (voldoende) plaatjestransfusies et cetera |
Lid participeert niet in besluitvorming omtrent Novartis en wanneer SANQUIN-studies worden geïncludeerd waarbij lid een van de auteurs is |
|
E. Beckers |
Internist-hematoloog/transfusiespecialist MUMC + Maastricht |
Bestuurslid Ned. Ver. Bloedtransfusie, onbetaald - Bestuurslid Ned. Ver. Hematologie, onbetaald - Lid adviesraad TRIP (Transfusie Reacties in Patiënten), onbetaald - Lid Landelijke Gebruikers Raad Sanquin, onbetaald - Lid Stuurgroep TiN studie (Trombocytopathie in Nederland) |
Project 'Predictors of Bleeding' externe financiering door Bayer
Transparantieregister.nl: sprekers vergoeding van Roche; gastvrijheidsbijdrage van: Roche, Pfizer, Sanquin en Bayer |
Lid participeert niet in besluitvorming omtrent producten van Bayer en Roche en wanneer specifiek de studie "predictors of bleeding" (gefinancierd door Bayer) worden geïncludeerd |
|
J. Slomp |
Laboratorium specialist Klinische Chemie en hematologie MST/Medlon |
-Bestuurslid VHL - onbetaald -Bestuurslid NVvH - onbetaald -Werkgroep Bloedtransfusie VHL (vz.) onbetaald -Lid LGR onbetaald - - Lid Expert committee TRIP (onbetaald) |
-Medical Advisory Board Janssen: advies omtrent bloedtransfusie bij patiënten die daratumumab gebruiken, betaald - In samenwerking met UMCU en VU bezig om een landelijk protocol op te stellen voor bloedtransfusie en daratumumab |
Lid participeert niet in besluitvorming omtrent productn van Janssen (daratumumab) |
|
H. Soons |
Laboratoriumspecialist Klinische Chemie, St. Anna Ziekenhuis (1 fte) en Kempenhaeghe (detachering vanuit St. Anna Ziekenhuis)
|
-Bestuur Nederlandse Vereniging voor Bloedtransfusie (NVB), voorzitter, onbetaald -Bestuur Transfusie Reacties in Patiënten (TRIP), secretaris, vacatiegeld - Medisch Advies Raad Sanquin (MAR), lid, vacatiegeld -Lid Landelijke Gebruikersraad Sanquin (LGR), onbetaald |
|
Geen restricties |
|
Werkgroep laboratoriumaspecten |
||||
|
H. de Wit |
Laboratoriumspecialist Klinische Chemie en Hematologie, Certe |
-Bestuurslid/ penningmeester Nederlandse Vereniging voor Bloedtransfusue (onbetaald) - Bestuurslid/ penningmeester Stichting Vrienden van de NVB (onbet aald) |
|
Geen restricties |
|
K. de Vooght |
Laboratoriumspecialist Klinische Chemie, Hoofd Patiëntenzorg LKCH ad interim |
Bestuurslid/ penningmeester Stichting TRIP (onbetaald) - Bestuurslid/voorzitter Stichting vrienden van de Utrechtse bloedbank (onbetaald) - Lid Werkgroep Consortium Transfusiegeneeskundig Onderzoek (onbetaald) - Lid PROTON II Adviesraad (onbetaald) - Lidmaatschap NVB - Lidmaatschap NVvH - Docent OKU (Onderwijs Kring Utrecht) (betaald) -Docent PAO Farmacie (betaald) -Lid Wetenschappelijke commissie NVB/TRIP symposium (onbetaald) |
|
Geen restricties |
|
C. Folman |
Manager Laboratorium Erytrocytenserologie (Sanquin) |
- Docent Hogeschool Arnhem en Nijmegen, betaald - Lid TRIX-werkgroep, onbetaald - Secretaris werkgroep Bloedtransfusie van de VHL (Vereniging Hematologische Laboratoriumdiagnostiek), onbetaald - Lid Expert Committee TRIP (Transfusie Reacties In Patiënten), onbetaald -Lid wetenschappelijke commissie NVB (Nederlandse Vereniging voor Bloedtransfusie), onbetaald" |
- Dienstverband Sanquin - werkzaam in expertiselaboratorium waar onderzoek wordt gericht voor derden op het gebied van bloedtransfusie |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
M. de Haas |
-Bijzonder hoogleraar Translationele Immunohematologie (bezoldiging Sanquin, onbezoldigd aangesteld bij LUMC -Clustermanager Immunohematologie Diagnostiek |
- Secretaris NVB (tot mei 2017) |
-Dienstverband Sanquin -Hoofd van een expertiselaboratorium dat ingezet zou kunnen worden door derden voor het uitvoeren van (uit de richtlijn voortkomende) laboratoriumdiagnostiek |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
H. Russcher |
Laboratoriumspecialist Klinisch Chemie en Hematologie, in het Erasmus MC en Havenziekenhuis |
- Auditor RvA i.h.k.v. ISO 15189:2012 voor medische laboratoria - Betaald |
|
restricties t.a.v. producten van Roche diagnostiek.Gebruikersraad geen belangen tav Sanquin, geen restriicties |
|
N. Som |
Senior hoofdanaliste bloedtransfusiedienst VUmc |
- Hemovigilantiecoördinator Vumc |
|
Geen restricties |
|
J. Lie |
-Stafadviseur hemovigilantie 24,8 uur -Weefselvigil antiecoördinator 7,2 uur" |
-Contactpersoon voor landelijk Bureau TRIP: meldingen transfusiereacties en bijwerkingen - Voorzitter landelijk Hemovigilantoe Platform Nederland (vanaf 2016, eerder lid, mede oprichter HPN), onbetaald - Voorzitter en oprichter Regionaal Hemovigilantie Platform Zuidoost - BestuursLid NVB |
|
Geen restricties |
|
Werkgroep Anemie |
||||
|
A. Van Gammeren |
Laboratoriumspecialist Klinische Chemie
|
|
|
Geen restricties
|
|
N. Juffermans |
Intensivist |
Chief editor Netherlands Journal of Critical Care, vergoeding |
|
Geen restricties
|
|
K. Bergman |
Kinderarts-neonatologie, Beatrix kinderziekenhuis, UMCG ten Groningen (0,9fte). Als kinderarts-neonatologie voorzitter van het Regioteam Perinatale Audit Noord Nederland (Perined). Deze functie (0,1fte) wordt uitgeoefend binnen de UMCG aanstelling. |
-Lid programmacommissie Prenatale screening infectieziekten en erytrocyten-immunisatie RIVM namens NVK (vacatiegeld) -Lid werkgroep neonatale infectieziekten sectie neonatologie NVK (onbetaald) -Projectcommissielid ZonMw project: Introduction of Audit generated Changes in perinatal care using ""Tailored"" implementation strategies. (ACTion-project) (onbetaald) =Projectcommissielid 5 genes per minute, afdeling Medische genetica, UMCG, Groningen (onbetaald) |
|
Geen restricties
|
|
P. te Boekhorst |
Internist-Hematoloog / Transfusiespecialist
|
Medisch Adviesraad Sanquin, Lid, Vacatiegeld
|
In verleden: - Gastvrijheid Firma Alexion - Adviesraad Firma AmgeN (ITP) |
Lid participeert niet bij besluitvorming omtrent ITP |
|
B. Biemond |
Internist-hematoloog |
|
|
Geen restricties |
|
L. Oosten |
Hematoloog, Afdeling Immunohematologie & Bloedtransfusie bij het Leids Universitair Medisch Centum |
|
|
Geen restricties |
|
K. Fijn van Draat |
-Hoogleraar kinderhematologie AMC - Senior onderzoeker Sanquin Research |
VIDI selectiecommissie ZONMW, onbetaald (wel vacatievergoeding) |
Lid van de stuurgroep van de PLANET-2 studie die onderzoek doet naar triggers van trombocytentransfusie bij neonatenop de Neonatale Intensive Care Unit. PLANET-2 ontvangt geen sponsoring van de farmaceutische industrie |
Geen restricties |
|
Werkgroep trombocytentransfusies |
||||
|
A. Vlaar |
- Internist-Intensivist, Academisch Medisch Centrum, Amsterdam - Principal investigator Infusion related morbidity and mortality in the critically ill |
- Klinisch brug figuur Sanquin, onbetaald
|
Onderzoek gefinancierd door NWO, ZonMW, Sanquin: PI van de PACER studie (onder andere): hierbij worden trombotriggers voor invasieve ingrepen aangehouden. |
Geen restricties (ten aanzien van PACER studie: geen tegengesteld belang. Studie wordt niet gepubliceerd binnen termijn afronding richtlijn). |
|
l. van Pampus |
Internist-hematoloog-transfusiespecialist Radboudumc |
- Vice voorzitter hemovigilantiekamer TRIP (onbezoldigd)
|
Tegemoetkoming verblijfkosten Dublin (Ierland) het 17th Annual NATA Symposium on Patient Blood Management, Haemostasis and Thrombosis (NATA 2016) cf de CGR-rgels. |
Geen restricties |
|
G. Jansen |
Internist-hematoloog, afdeling Hematologie, Erasmus MC |
Post doctoraal onderzoeker bij afdeling Plasmaeiwitten, Sanquin Bloedvoorziening. Gastvrijheidovereenkomst, onbetaald |
"1) Naam project: ""Surface sialic acid is critical for platelet survival"" Financier: Sanquin Product and Process development (PPOC nr. 13-019). Bedrag: 499.000 euro. Rol: AIO project 2013-2018. Principal investigator en co-promotor
Toelichting: van dit geld is een OIO aangesteld (Mw M. Rijkers) die in dienst van Sanquin (1,0 fte) dit onderzoek verricht" |
Bij onderwerp sialic acid en trombocytenoverleving geen trekker /betrokkenheid opstellen aanbevelingen |
|
J.L. Kerkhoffs |
Internist - Hematoloog (0,8 FTE)
|
Transfusie-specialist / transfusie research (0,2 FTE) via Sanquin
|
Op Sanquin verricht ik klinisch transfusie onderzoek wat deels gefinancieerd wordt door de industrie TerumoBCT: PI van de PREPAReS studie, een RCT naar de klinische effectiviteit van trombocyten concentraten behandeld met een pathogeen-reductie proces (Mirasol, TERUMO BCT).
|
Restricties t.a.v. producten behandeld met pathogeen reductie proces en biomarkers. Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig.
|
|
R. Schutgens |
Internist-hematoloog
|
Lid van Medische Adviesraad patiëntenvereniging ITP |
-Speakersfee (voor instituut) en/of unrestricted research grant en/of lid advisory board van: Bayer, Baxalta, CSL Behring, NovoNordisk, Sanquin, Pfizer, Bristol-Meyers Squibb -Principal Investigator van de Trombocytopathie in Nederland (TiN) studie, mede gefinancierd door een unrestricted grant van Sanquin - deelname (in UMCU) ontwikkeling PACT en U-PACT (geen financieel belang) |
Geen betrokkenheid vragen bij bloedplaatjesfunctietest (PACT). Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig. |
|
M. Coppens |
Internist-vasculaire geneeskunde
|
- Diverse naschollingen en adviesraden (allen incidenteel) aangaande directe orale anticoagulantie georganiseerd door de fabrikanten van deze middelen, te weten Boehringer Ingelheim, Bayer, Pfizer, Bristol-Meyers Squibb, Daiichi Sankyo. Deze diensten zijn betaald, waarbij het geld naar mijn instituut gaat - Adviesraad aangaande 'The future of hemophilia treatment' georganiseerd door CSL Behring. Twee maal een advisory board; in 2015 en 2016. Deze diensten zijn betaald waarbij geld naar instituut gaat. CSL Behring produceert o.a. Haemocomplettan P (fibrinogeenconcentraat) en Beriplex (vierfactorenconcentraat). De huidige richtlijn zal mogelijk off-label gebruik van deze 2 middelen gaan bespreken. De genoemde adviesraad richtte zich op hemofilie A en B en de producten Haemocomplettan P en Beriplex zijn hier niet aan de orde geweest." |
Lid van de Stuurgroep van de Trombopathie in Nederland studie (geen financiele belangen). -Sanquin Blood Supply: Prothrombin Complex Concentrate (PCC) for the immediate reversal of the anticoagulant effects if new oral anticoagulants in emergency situations. Sanquin Blood Supply is producent van Cofact, een PCC, - CSL Behring: Biomarkers to detect subclinical arthropathy and predict long-term clinical arthropathy in patients with hemophilia. This project was awarded a 2016 Heimburger Award. CSL Behring produceert zowel Haemocomplettan P (fibrinogeenconcentraat) als Beriplex (een PCC), Dit project is gecofinancierd door CSL Behring, maar hebben geen betrekking op Haemocomplettan P noch Beriplex. |
Geen betrokkenheid opstellen aanbevelingen t.a.v. fibrinogeenconcrentraat en vierfactoren concentraat |
|
E. Lopriore |
Sectiehoofd Neonatologie WAKZ/LUMC |
Lid bloedtransfusiecommissie LUMC |
Onderzoek gefinancieerd door Sanquin: 1. PROC 12-012-027: Matisse studie: RCT in neonaten naar twee verschillende triggers voor trombocyten transfusies 50 vs 25; Promovenda: Suzanne Gunnink 2. PROC 16-33: Promotie onderzoek naar Rhesus hemolytische ziekt: Promovenda: Isabelle Ree |
Geen restricties |
|
H. van Ommen (meelezer) |
Kinderhematoloog |
|
'- PI Einstein junior (Bayer) Behandeling trombose bij kinderen - PI Hokusai kinderen (Daiichi Sankyo) Behandeling trombose bij kinderen - Nationaal coördinator BMS studie Apixaban ter preventie van trombose bij kinderen met een hartafwijking |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afstemming met de Patiëntenfederatie, Stichting Zeldzame Bloedziekten en Oscar Nederland. Deze verenigingen zijn uitgenodigd voor de invitational conference (knelpuntenanalyse) voorafgaand aan deze herziening en hebben input geleverd voor de te prioriteren vragen. De verenigingen hebben aangegeven graag in de commentaarfase de conceptrichtlijn te ontvangen voor commentaar. Tevens zal in de eindfase van deze richtlijn nog worden overlegd over de communicatie aan patiënten en of er nog aanvullende teksten voor patiënten kunnen worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij afronding van de richtlijn te vinden zijn bij de aanverwante producten. De werkgroep zal tevens de interne kwaliteitsindicatoren die bij de Richtlijn bloedtransfusie 2011 zijn opgesteld beoordelen en indien nodig door ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroepen en de adviseurs de knelpunten. De werkgroepen beoordeelden de aanbevelingen uit de eerdere richtlijn Bloedtransfusiebeleid (2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en andere aanwezigen tijdens de Invitational conference. De werkgroepen stelden vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn in de werkgroepen besproken waarna de werkgroepleden de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroepen tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews (Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje “Overwegingen”.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en de weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn word aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroepen. Naar aanleiding van de commentaren word de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroepen. De definitieve richtlijn word aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2012.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Uitgangsvraag: UV5: Wat is het effect van het toedienen van tranexaminezuur (peri-operatief) in vergelijking met geen tranexaminezuur (peri-operatief) bij kinderen die een operatie ondergaan met een risico op veel bloedverlies op (UITKOMST)? Wat is het effect van een lage toedieningssnelheid van tranexaminezuur (peri-operatief) in vergelijking met hoge toedieningssnelheid van tranexaminezuur (peri-operatief) bij kinderen die een operatie ondergaan met een risico op veel bloedverlies op (UITKOMST)? Wat is het effect van een lage dosis tranexaminezuur (peri-operatief) in vergelijking met een hoge dosis tranexaminezuur (peri-operatief) bij kinderen die een operatie ondergaan met een risico op veel bloedverlies op (UITKOMST)? |
|
|
Database(s): Medline, Embase |
Datum: 05 december 2018 |
|
Periode: Geen beperking |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1946 – december 2018
|
1 exp TRANEXAMIC ACID/ or (tranexam* or tranexaminezuur).ti,ab,kw. (5174) 2 exp General Surgery/ or (surger* or surgic* or operat* or preoperat* or peroperat* or perioperat*).ti,ab,kw. (2440197) 3 (child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. (2288813) 4 1 and 2 and 3 (207) 5 limit 4 to english language (187) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (376480) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1809029) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3081840) 9 5 and 6 (27) 10 5 and 7 (76) 11 5 and 8 (86) 12 9 or 10 or 11 (129)
= 129 (127 uniek) |
181 |
|
Embase (Elsevier) |
('tranexamic acid'/exp/mj OR tranexam*:ab,ti OR tranexaminezuur:ab,ti)
AND ('surgery'/exp OR surger*:ab,ti OR surgic*:ab,ti OR operat*:ab,ti OR preoperat*:ab,ti OR peroperat*:ab,ti OR perioperat*:ab,ti)
AND (infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR 'baby'/exp OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR 'minors'/exp/mj OR minors*:ti,ab OR 'boy'/exp OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR 'child'/exp OR child:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR 'schoolchild'/exp OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab OR 'pediatrics'/exp)
AND (english)/lim NOT 'conference abstract':it
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
Observationeel onderzoek: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 154 (150 uniek) |
