Moment van toedienen van tranexaminezuur bij acute bloedingen
Uitgangsvraag
Wanneer dient tranexaminezuur gegeven te worden (vroegtijdig versus later) bij acute bloedingen?
Aanbeveling
Vroegtijdig toedienen tranexaminezuur bij volwassenen met een acute bloeding als gevolg van een trauma
Geef patiënten met een acute traumatische bloeding zo snel mogelijk en in ieder geval binnen 3 uur na het trauma tranexaminezuur in een dosering van 1 gram (100 mg/minuut) intraveneus gevolgd door een continue infusie van 1 gram in 8 uur.
Vroegtijdig toedienen van tranexaminezuur bij kinderen met een groot bloedverlies als gevolg van een trauma
Overweeg pediatrische traumapatiënten met groot bloedverlies zo vroeg mogelijk en bij voorkeur binnen 3 uur tranexaminezuur in een dosis van 10 tot 20 mg/kg (maximaal 1 gram) in 10 minuten intraveneus gevolgd door een continu infusie van 2mg/kg (maximaal 1 gram) gedurende tenminste 8 uur of tot de bloeding stopt.
Vroegtijdig toedienen van tranexaminezuur bij volwassenen met een acute gastro-intestinale bloeding
Voor beleid omtrent gastro-intestinale bloedingen bij volwassenen wordt verwezen naar de MDL richtlijn “bloedingen tractus digestivus” (2018): https://www.mdl.nl/sites/www.mdl.nl/files/richlijnen/Richtlijnbloedingen-definitief-mei2018.pdf.
Vroegtijdig toedienen van tranexaminezuur bij kinderen met een acute gastro-intestinale bloeding
De werkgroep is van mening dat zij op basis van deze gegevens geen onderbouwd advies kan geven voor het al dan niet toedienen van tranexaminezuur bij kinderen met een gastro-intestinale bloeding.
Vroegtijdig toedienen van tranexaminezuur bij patiënten met een acute obstetrische bloeding
Zie NVOG module “wat is de rol van tranexaminezuur” voor de aanbevelingen omtrent het toedienen van tranexaminezuur bij postpartum bloedingen.
Overwegingen
Vroegtijdig toedienen tranexaminezuur bij volwassenen met een acute bloeding als gevolg van een trauma
Bewijs toediening tranexaminezuur versus placebo
De CRASH-2 studie heeft aangetoond dat het vroegtijdig geven van tranexaminezuur bij de bloedende patiënt een verlaging geeft van mortaliteit en morbiditeit. Dit wordt bevestigd door de meta-analyse van El-Menyar (2018) waarin vergelijkende en niet vergelijkende studies over het geven van prehospitale tranexaminezuur in vergelijking met placebo in traumapatiënten worden beschreven. In deze review wordt een retrospectief onderzoek (Wafaisade, 2016) en een prospectief (Neeki, 2017) (niet gerandomiseerd) onderzoek beschreven. De reviewers concluderen dat de 24-uurs mortaliteit in de tranexaminezuur groep lager was dan in de placebogroep (2 studies, n= 769, OR 0,49; 95% CI, 0,27 tot 0,84, GRADE Moderate). De 30-dagen mortaliteit toonde een trend naar een lagere mortaliteit in de interventiegroep (2 studies, n=769; OR 0,86; 95% CI, 0,559 tot 1.32, GRADE moderate). In deze twee studies kregen 18 patiënten een trombo-embolisch event: 6 in tranexaminezuur groep en 12 in de placebogroep (2 studies, n=769; OR 0,74 95%-CI 0,27 tot 2,06; GRADE moderate).
Vroege toediening (< 3 uur) versus late toediening
De huidige module gaat over de vraag of het tijdstip van toedienen van belang is. Er is voor een tijdsinterval van 3 uur na het trauma gekozen, omdat de remmende werking van tranexaminezuur op de fibrinolyse reeds binnen 30 minuten effectief moet zijn. Tranexaminezuur remt competitief de omzetting van plasminogeen in plasmine en daarmee de fibrine en fibrinogeen afbraak en vorming van D-dimeren.
Deze fibrinolyse wordt direct na weefselschade geactiveerd door tissue Plasminogeen Activator welk na circa 30 minuten post trauma piekt. Tegelijk piekt plasminogeen circa 1 uur posttrauma (Stansfield, 2019).
Er is tot heden geen gerandomiseerd onderzoek gepubliceerd dat het effect van vroegtijdig toedienen van tranexaminezuur vergelijkt met het later toedienen van tranexaminezuur. Secundaire analyse van de CRASH-2 studie toont dat er wel een tijdsafhankelijke factor is, waarbij uit de studie naar voren komt dat indien tranexaminezuur binnen 3 uur wordt gegeven dit de overleving vergroot, onafhankelijk van type letsel, GCS of bloeddruk (Roberts, 2017).
Bewijs over bijwerkingen
Er is geen bewijs dat toediening van tranexaminezuur in vergelijking met een placebo meer risico geeft op vasculaire occlusieve events (diepe veneuze trombose, longembolie, myocardinfarct en cerebrovasculair accident) (Ker, 2015). Mogelijk is de kans op epilepsie groter bij hogere dosis en nierfalen (Lecker, 2016; Lin, 2016). Convulsie door snelheid van toediening is nog niet bewezen.
Hoewel in deze uitgangsvraag geen systematische analyse is gedaan naar de optimale dosering adviseert de werkgroep op basis van de gebruikte dosering in de CRASH-studie en andere studies (Stansfield, 2019; Spahn, 2019) en aansluitend op de huidige praktijk tranexaminezuur te geven als bolus van 1 gram intraveneus (maximale injectiesnelheid van 100mg/min) en standaard hierop een herhalingsdosis na 8 uur van 1 gram intraveneus of continue infuus van 2 tot 5mg/kg/uur (Prasad, 2018; Guo, 2019). In Nederland heeft het professionele prehospitale werkzame personeel van de ambulance en het mobiel medisch team sinds 2016 de beschikking over tranexaminezuur. De kosten van tranexaminezuur zijn niet hoog. De werkgroep is daarom van mening dat het haalbaar is om vroegtijdig (indien mogelijk ook al prehospitaal) tranexaminezuur te geven.
Het geven van tranexaminezuur bij een acute bloeding na 3 uur is geassocieerd met een groter risico op overlijden, gebaseerd op extrapolatie van de data van de CRASH-2 studie. De werkgroep heeft geen andere studies gevonden die de mogelijk schadelijke werking van tranexaminezuur na 3 uur bij een acute bloeding onderschrijven. Derhalve kan op theoretische gronden het geven van tranexaminezuur na 3 uur bij een acute bloeding overwogen worden, om de verdere ongoing fibrinolyse te remmen.
Vroegtijdig toedienen van tranexaminezuur bij kinderen met een groot bloedverlies als gevolg van een trauma
Bewijs toediening tranexaminezuur versus placebo
Er is weinig bewijs voor de toediening van tranexaminezuur bij kinderen met groot bloedverlies ten gevolge van trauma. Internationale consensus is echter dat op basis van extrapolatie van de CRASH-2 studie en diverse andere studies naar het perioperatieve gebruik van tranexaminezuur bij grotere chirurgie bij kinderen, tranexaminezuur gebruikt kan worden bij kinderen (Nishijima, 2018; Eckert, 2014; Beno, 2014; RCPCH and NPPG medicines committee, 2012).
Bewijs tijdstip van toediening
Er is geen gerandomiseerde studie gevonden naar vroegtijdig versus late toediening van tranexaminezuur bij kinderen met een groot bloedverlies ten gevolge van trauma. De resultaten van de lopende TIC-TOQ trial zullen meer informatie geven over het gebruik en de hoogte van de dosis van tranexaminezuur bij kinderen bij een traumatische bloeding. Hoewel er geen bewijs is over het effect van vroege versus late toediening is de werkgroep van mening dat het voordeel van vroege toediening (binnen 3 uur na trauma) waarschijnlijk ook voor kinderen van toepassing zal zijn.
Dosering
De gegeven dosis als tranexaminezuur-bolus bij traumapatiënten varieert in de literatuur van 15 tot 30 mg/kg tranexaminezuur (Beno, 2014; Nishijima 2018). Er is nog geen duidelijkheid over de hoogte van de geadviseerde dosis tranexaminezuur. De werkgroep adviseert derhalve bij kinderen met groot bloedverlies door trauma vroegtijdig een dosis van tranexaminezuur te geven van 10 tot 20 mg/kg (maximaal 1 gram) intraveneus in 10 minuten gevolgd door een continu infusie van 2mg/kg (maximaal 1 gram) gedurende tenminste 8 uur of tot de bloeding stopt. Dit advies is in overeenstemming met internationale consensus over dit onderwerp (The RCPCH and NPPG Medicines Committee, 2012).
Vroegtijdig toedienen van tranexaminezuur bij volwassenen met een acute gastro-intestinale bloeding
We hebben geen literatuur gevonden die het effect van vroegtijdige toediening van tranexaminezuur vergelijkt met het later toedienen van tranexaminezuur bij patiënten met een gastro-intestinale bloeding. Wellicht kan de verwachte trial van Brenner en collega’s in de toekomst meer inzicht verschaffen (Brenner, 2019).
Voor aanbevelingen omtrent het beleid bij gastro-intestinale bloedingen bij volwassenen is een richtlijn uit 2018 beschikbaar:
https://www.mdl.nl/sites/www.mdl.nl/files/richlijnen/Richtlijnbloedingen-definitief-mei2018.pdf.
Voor adviezen omtrent het beleid rondom gastro-intestinale bloedingen bij volwassenen verwijst de werkgroep naar deze richtlijn.
Vroegtijdig toedienen van tranexaminezuur bij kinderen met een acute gastro-intestinale bloeding
Er is geen wetenschappelijke onderbouwing beschikbaar die het doen van een uitspraak over vroeg of later toedienen van tranexaminezuur bij kinderen met een gastro-intestinale bloeding ondersteunt. Ook internationaal zijn er geen richtlijnen of position papers die hier aanbevelingen over doen.
Voor gastro-intestinale bloedingen bij kinderen staat een algemeen advies in tabel 10.2 van het werkboek kindermaag-darm en leverziekte. Deze is terug te vinden op de NVK site (NVK.nl, onder werkboeken). Deze richtlijn is opgesteld in 2014 op basis van consensus van kinder-MDL-artsen. Hierin is tranexaminezuur niet als optie opgenomen.
De werkgroep is van mening dat zij op basis van deze gegevens geen onderbouwd advies kan geven voor het al dan niet toedienen van tranexaminezuur bij kinderen met een gastro-intestinale bloeding. Wel kan op theoretische gronden het geven van tranexaminezuur overwogen worden.
Onderbouwing
Achtergrond
Acute bloedingen dienen zo snel mogelijk gestelpt te worden. Indien dit niet direct mogelijk is vanwege de locatie van de bloeding levert het geven van tranexaminezuur een grote bijdrage aan het optimaliseren van het eigen stollingssysteem. Sinds de publicatie van de CRASH-2 studies (Shakur, 2010; Roberts, 2011) is men ervan overtuigd dat vroegtijdig toedienen van tranexaminezuur een verbetering geeft van mortaliteit en morbiditeit bij de bloedende traumapatiënt en bij post partum bloedingen. Er is echter nog geen duidelijkheid over het optimale tijdstip van het geven van tranexaminezuur. Ook is nog niet duidelijk of tranexaminezuur aan alle leeftijdsgroepen kan worden gegeven zonder bijwerkingen.
Conclusies / Summary of Findings
Vroegtijdig toedienen tranexaminezuur bij volwassenen met een acute bloeding als gevolg van een trauma
|
Redelijk GRADE |
Mortaliteit binnen 30 dagen Het is waarschijnlijk dat bij volwassenen met een ernstige bloeding na een trauma het starten met tranexaminezuur binnen drie uur na het trauma, in vergelijking met het starten van tranexaminezuur meer dan drie uur na het trauma, de kans op overlijden (door verbloeding) vermindert.
Bronnen: (Roberts, 2011) |
|
- GRADE |
Overige uitkomstmaten Er is geen onderzoek van voldoende kwaliteit beschikbaar over het effect van het toedienen van tranexaminezuur binnen 3 uur na trauma in vergelijking met het toedienen meer dan 3 uur na trauma op:
|
Vroegtijdig toedienen van tranexaminezuur bij kinderen met een groot bloedverlies als gevolg van een trauma
|
- GRADE |
Er is geen gerandomiseerd onderzoek of vergelijkende cohortonderzoeken beschikbaar waarin het effect van vroege (binnen 3 uur na trauma) versus late toediening van tranexaminezuur bij groot bloedverlies bij kinderen is onderzocht. |
Vroegtijdig toedienen van tranexaminezuur bij volwassenen met een acute gastro-intestinale bloeding
|
- GRADE |
Er is geen gerandomiseerd onderzoek of vergelijkend cohortonderzoek beschikbaar waarin het effect van vroege (binnen 3 uur na trauma) versus late toediening van tranexaminezuur bij gastro-intestinale bloedingen is onderzocht. |
Vroegtijdig toedienen van tranexaminezuur bij kinderen met een acute gastro-intestinale bloeding
|
- GRADE |
Er is geen gerandomiseerd onderzoek of vergelijkend cohort onderzoek beschikbaar waarin het effect van vroege (binnen 3 uur na trauma) versus late toediening van tranexaminezuur gastro-intestinale bloedingen bij kinderen is onderzocht. |
Samenvatting literatuur
De literatuurzoekactie leverde 185 treffers op. Op basis van titel en abstract werden er 44 artikelen geselecteerd. Na raadpleging van de volledige tekst, werden er 41 artikelen uitgesloten. Twee Cochrane systematische reviews die het gebruik van tranexaminezuur na een traumatische bloeding (Ker, 2015) of obstetrische bloeding (Shakur, 2018) in vergelijking met placebo onderzochten werden uitgesloten omdat er geen onderscheid werd gemaakt tussen vroegtijdig toedienen van tranexaminezuur versus het later toedienen van tranexaminezuur. De redenen voor uitsluiting van de overige artikelen zijn samengevat in de exclusietabel onder het tabblad Verantwoording.
De belangrijkste studiekarakteristieken en resultaten zijn samengevat in de evidencetabellen. De beoordeling van de individuele studieopzet is samengevat in de risk of bias tabellen.
Vroegtijdig toedienen tranexaminezuur bij volwassenen met een acute bloeding als gevolg van een trauma
Beschrijving van studies
We hebben geen gerandomiseerde studies gevonden die de effectiviteit onderzochten van het vroegtijdig toedienen versus het later toedienen van tranexaminezuur bij volwassenen met een acute bloeding. We hebben wel één gerandomiseerde studie (de CRASH-2 trial) ingesloten die subgroep-resultaten presenteert voor volwassenen die binnen één uur, binnen drie uur, of meer dan drie uur na het trauma (Roberts, 2011) tranexaminezuur of placebo kregen toegediend.
Deelnemers werden gerandomiseerd naar een groep met een oplaaddosis van 1g tranexaminezuur intraveneus gedurende 10 minuten, gevolgd door een intraveneus infuus met 1g tranexaminezuur gedurende 8 uur, of in vergelijking met placebo. In totaal includeerden de onderzoekers N = 20.211 deelnemers uit 274 ziekenhuizen in 40 landen. We zullen in deze literatuuranalyse alleen de resultaten van subgroep-analyses van patiënten die binnen drie uur, of meer dan drie uur na het tijdstip van het trauma tranexaminezuur of placebo kregen toegediend beschrijven. Deze resultaten geven indirect antwoord op de uitgangsvraag. De onderzoekers van de CRASH-2 trial presenteren subgroep-analyses naar de invloed van het tijdstip van toediening van tranexaminezuur of placebo op mortaliteit en mortaliteit door bloeding (Roberts, 2011). Er werden geen subgroep-resultaten gepresenteerd voor de overige uitkomstmaten.
Resultaten
Mortaliteit
Het gebruik van tranexaminezuur binnen één uur na het trauma, in vergelijking met placebo, verminderde het risico op overlijden (RR= 0,87, 95% CI (0,76 tot 0,97)). Het gebruik van tranexaminezuur tussen één uur- en drie uur na het trauma, in vergelijking met placebo, verminderde het risico op overlijden (RR= 0,87 , 95% CI (0,77 tot 0,97)) (Roberts, 2011). Het gebruik van tranexaminezuur meer dan drie uur na het trauma, in vergelijking met placebo, laat geen effect zien op het risico op overlijden (RR= 1,00, 95% CI (0,90 tot 1,13)) (Roberts, 2011).
Mortaliteit door bloeding
Figuur 1 presenteert het risico op overlijden als gevolg van een bloeding gestratificeerd naar het moment van toedienen (binnen drie uur of later dan drie uur na het trauma):
- Het gebruik van tranexaminezuur binnen drie uur na het trauma, in vergelijking met placebo, vermindert het risico op overlijden door een bloeding (gepoolde RR, 95% CI = 0,73 (0,63 tot 0,83)).
- Het gebruik van tranexaminezuur meer dan drie uur na het trauma, in vergelijking met placebo, vergroot het risico op overlijden door een bloeding (RR, 95% CI = 1,44 (1,12 tot 1,84)).
Figuur 1 Verschil in risico op overlijden door bloeding op basis van tijdstip na trauma toedienen tranexaminezuur of placebo
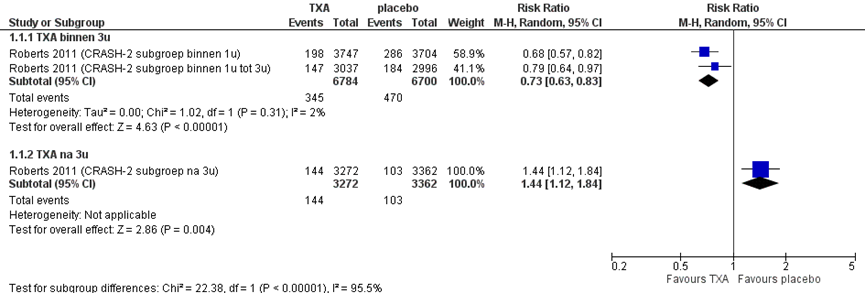
De effecten van tranexaminezuur in vergelijking met placebo op het overlijden door een bloeding verschillen statistisch significant tussen patiënten die binnen drie uur-, of meer dan drie uur na het trauma behandeld zijn (test voor subgroep verschillen p < 0,00001; Figuur 1).
Patiëntkarakteristieken van patiënten die binnen 1, 1 tot 3 en meer dan 3 uur na het trauma werden behandeld verschilden in deze studie niet significant wat betreft leeftijd en capillary refill (seconden). Wel verschilden de patiëntengroepen in bloeddruk en aanwezigheid van een trauma capitis (lager in groep < 3 uur), patiënten met stomp letsel (lager in groep < 3 uur) en gemiddelde Glasgow coma score (GCS) (hoger in < 3 groep). Ondanks deze verschillen tussen de groepen, blijft het effect van kortere tijdsduur bestaan, blijkens de uitgevoerde sensitiviteitsanalyses.
Overige uitkomstmaten
We hebben in de literatuur geen resultaten gevonden voor de uitkomsten bloedverlies, hemoglobinegehalte, ‘multiple organ dysfunction’, infectie, myocardinfarct, over de bijwerkingen misselijkheid, braken, diarree, allergische huidreacties, trombocytopenie, blindheid, kleurenblindheid en andere visuele stoornissen, convulsies, duizeligheid en hypotensie, overgevoeligheidsreacties.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomst overlijden door bloeding start op niveau redelijk, omdat er voor de vergelijking die in deze analyse wordt beschreven geen RCT is uitgevoerd (de studie onderzocht tranexaminezuur versus placebo). De in deze literatuuranalyse beschreven gegevens zijn het resultaat van een secundaire analyse van de data waarin verschillende tijdsduren werden vergeleken met placebo. Voor de tijdsduur werd niet gerandomiseerd.
Vroegtijdig toedienen van tranexaminezuur bij kinderen met een groot bloedverlies als gevolg van een trauma
We hebben geen gerandomiseerde of vergelijkende cohortstudies gevonden die het effect van vroegtijdige toediening van tranexaminezuur bij kinderen met een ernstige bloeding als gevolg van een trauma onderzochten.
Vroegtijdig toedienen van tranexaminezuur bij volwassenen met een acute gastro-intestinale bloeding
We hebben geen gerandomiseerde of vergelijkende cohortstudies gevonden die het effect van vroegtijdige toediening van tranexaminezuur bij volwassenen of kinderen met een acute gastro-intestinale bloeding heeft onderzocht.
Vroegtijdig toedienen van tranexaminezuur bij patiënten met een acute obstetrische bloeding
Er is een recente richtlijn van de NVOG gepubliceerd over de rol van tranexaminezuur in de preventieve en therapeutische setting van een postpartum bloeding (https://richtlijnendatabase.nl/richtlijn/hemorrhagia_postpartum_hpp/tranexaminezuur_in_preventieve_en_therapeutische_setting_hpp.html).
Zoeken en selecteren
Om de uitgangsvragen te kunnen beantwoorden is er een systematische literatuuranalyse verricht met de volgende PICO:
P:
- volwassenen en kinderen met een acute bloeding als gevolg van een trauma;
- volwassenen en kinderen met een acute gastro-intestinale bloeding;
- patiënten met een acute obstetrische bloeding.
I: Vroegtijdig toedienen van tranexaminezuur (binnen drie uur na het ontstaan van de bloeding);
C: later toedienen van tranexaminezuur (meer dan drie uur na het ontstaan van de bloeding).
Relevante uitkomstmaten
De werkgroep achtte mortaliteit binnen 30 dagen, mortaliteit ná 30 dagen, bloedverlies, bloedverbruik, hemoglobinegehalte, ‘multiple organ dysfunction syndrome’ (MODS), infectie, diep veneuze trombose, longembolie, myocard infarct en cerebrovasculair accident voor de besluitvorming cruciale uitkomstmaten.
Verdere voor de besluitvorming belangrijke uitkomstmaten waren: aantal dagen beademing, opnameduur in ziekenhuis, en bijwerkingen. Mogelijke bijwerkingen van tranexaminezuur zoals beschreven in het farmacotherapeutisch kompas zijn: misselijkheid, braken, diarree, allergische huidreacties, trombocytopenie, trombo-embolische aandoeningen, blindheid, kleurenblindheid en andere visuele stoornissen, convulsies, duizeligheid en hypotensie, overgevoeligheidsreacties (anafylaxie).
Zoeken en selecteren
In de databases Medline (via OVID) en Embase (via Elsevier) is op 2 oktober 2018 gezocht naar studies die het effect van vroegtijdig toedienen van tranexaminezuur (binnen drie uur na het ontstaan van de bloeding) vergeleken met het toedienen van tranexaminezuur meer dan drie uur na het ontstaan van de bloeding. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. We includeerden systematische literatuurstudies van vergelijkend onderzoek, gerandomiseerde studies en vergelijkend cohortonderzoek.
Referenties
- Ausset S, Glassberg E, Nadler R, Sunde G, Cap AP, Hoffmann C, Plang S, Sailliol A. Tranexamic acid as part of remote damage-control resuscitation in the prehospital setting: A critical appraisal of the medical literature and available alternatives. J Trauma Acute Care Surg. 2015 Jun;78(6 Suppl 1):S70-5. doi: 10.1097/TA.0000000000000640. Review. PubMed PMID: 26002268.
- Bennett C, Klingenberg SL, Langholz E, Gluud LL. Tranexamic acid for upper gastrointestinal bleeding. Cochrane Database Syst Rev. 2014 Nov 21;(11):CD006640.
- Brenner A, Afolabi A, Ahmad SM, Arribas M, Chaudhri R, Coats T, Cuzick J, Gilmore I, Hawkey C, Jairath V, Javaid K, Kayani A, Mutti M, Nadeem MA, Shakur-Still H, Stanworth S, Veitch A, Roberts I; HALT-IT Trial Collaborators. Tranexamic acid for acute gastrointestinal bleeding (the HALT-IT trial): statistical analysis plan for an international, randomised, double-blind, placebo-controlled trial. Trials. 2019 Jul 30;20(1):467. doi: 10.1186/s13063-019-3561-7.
- Beno S, Ackery AD, Callum J, Rizoli S. Tranexamic acid in pediatric trauma: why not? Crit Care. 2014 Jul 2;18(4):313.
- Boling B, Moore K. Tranexamic acid (TXA) use in trauma. J Emerg Nurs. 2012 Sep;38(5):496-7. doi: 10.1016/j.jen.2012.06.001. Review. PubMed PMID: 22925347.
- Boudreau RM, Deshpande KK, Day GM, Hinckley WR, Harger N, Pritts TA, Makley AT, Goodman MD. Prehospital Tranexamic Acid Administration During Aeromedical Transport After Injury. J Surg Res. 2019 Jan;233:132-138. doi:10.1016/j.jss.2018.07.074. Epub 2018 Aug 21. PubMed PMID: 30502239.
- Boutonnet M, Abback P, Le Saché F, Harrois A, Follin A, Imbert N, Cap AP, Trichereau J, Ausset S; Traumabase Group. Tranexamic acid in severe trauma patients managed in a mature trauma care system. J Trauma Acute Care Surg. 2018 Jun;84(6S Suppl 1):S54-S62. doi: 10.1097/TA.0000000000001880. PubMed PMID 29538226.
- Brown JB, Neal MD, Guyette FX, Peitzman AB, Billiar TR, Zuckerbraun BS, Sperry JL. Design of the Study of Tranexamic Acid during Air Medical Prehospital Transport (STAAMP) Trial: Addressing the Knowledge Gaps. Prehosp Emerg Care. 2015 January-March;19(1):79-86. Epub 2014 Jul 30. PubMed PMID: 25076119; PubMed Central PMCID: PMC4623322.
- Couret-Alcaraz P, Maconochie I. The role of tranexamic acid in acute paediatric trauma. Archives of Disease in Childhood. 2016 101:A120-A2.
- Dewan Y, Komolafe EO, Mejía-Mantilla JH, Perel P, Roberts I, Shakur H; CRASH-3 Collaborators. CRASH-3 - tranexamic acid for the treatment of significant traumatic brain injury: study protocol for an international randomized, double-blind, placebo-controlled trial. Trials. 2012 Jun 21;13:87. doi: 10.1186/1745-6215-13-87. PubMed PMID: 22721545; PubMed Central PMCID: PMC3481366.
- Eckert MJ, Wertin TM, Tyner SD, Nelson DW, Izenberg S, Martin MJ. Tranexamic acid administration to pediatric trauma patients in a combat setting: the pediatric trauma and tranexamic acid study (PED-TRAX). J Trauma Acute Care Surg. 2014 Dec;77(6):852-8; discussion 858. doi: 10.1097/TA.0000000000000443. PubMed PMID: 25423534.
- El-Menyar A, Sathian B, Asim M, Latifi R, Al-Thani H. Efficacy of prehospital administration of tranexamic acid in trauma patients: A meta-analysis of the randomized controlled trials. Am J Emerg Med. 2018 Jun;36(6):1079-1087. doi: 10.1016/j.ajem.2018.03.033. Epub 2018 Mar 16. Review. PubMed PMID: 29573898.
- Franchini M, Mannucci PM. Adjunct agents for bleeding. Curr Opin Hematol. 2014 Nov;21(6):503-8. doi: 10.1097/MOH.0000000000000084. Review. PubMed PMID: 25159711.
- Gillissen A, Henriquez D, Van Den Akker T, Caram-Deelder C, Wind M, Zwart J, et al. The effect of tranexamic acid on blood loss and maternal outcome in the treatment of persistent postpartum hemorrhage: A nationwide retrospective cohort study. Blood. 2017 130.
- Gillissen A, Henriquez DDCA, van den Akker T, Caram-Deelder C, Wind M, Zwart JJ, van Roosmalen J, Eikenboom J, Bloemenkamp KWM, van der Bom JG; TeMpOH-1 study group. The effect of tranexamic acid on blood loss and maternal outcome in the treatment of persistent postpartum hemorrhage: A nationwide retrospective cohort study. PLoS One. 2017 Nov 6;12(11):e0187555. doi: 10.1371/journal.pone.0187555. eCollection 2017. PubMed PMID: 29107951; PubMed Central PMCID: PMC5673178.
- Goobie SM, Zurakowski, Brustowicz R, Glotzbecker M, Hedequist D, Sethna N, et al. Tranexamic acid decreases the rate of blood loss in adolescent idiopathic scoliosis surgery. Anesthesia and Analgesia. 2017;125(3):7-8.
- Gruen RL, Mitra B. Tranexamic acid for trauma. Lancet. 2011 Mar 26;377(9771):1052-4. doi: 10.1016/S0140-6736(11)60396-6. PubMed PMID: 21439636.
- Guerriero C, Cairns J, Perel P, Shakur H, Roberts I; CRASH 2 trial collaborators. Cost-effectiveness analysis of administering tranexamic acid to bleeding trauma patients using evidence from the CRASH-2 trial. PLoS One. 2011 May 3;6(5):e18987. doi: 10.1371/journal.pone.0018987. PubMed PMID: 21559279; PubMed Central PMCID: PMC3086904.
- Gulmezoglu M, Alfirevic Z, Elbourne D, Roberts I, Ronsmans C, Shakur H. Tranexamic acid for the treatment of postpartum haemorrhage: An international, randomised, double blind, placebo controlled trial (woman trial - Protocol Number ISRCTN76912190). International Journal of Gynecology and Obstetrics. 2009;107:S500.
- The RCPCH and NPPG Medicines Committee. Evidence Statement Major trauma and the use of tranexamic acid in children November 2012.
- Harvin JA, Peirce CA, Mims MM, Hudson JA, Podbielski JM, Wade CE, Holcomb JB, Cotton BA. The impact of tranexamic acid on mortality in injured patients with hyperfibrinolysis. J Trauma Acute Care Surg. 2015 May;78(5):905-9; discussion 909-11. doi: 10.1097/TA.0000000000000612. PubMed PMID: 25909408.
- Howard D, Skeith AE, Lai J, D'Souza R, Caughey AB. Routine use of tranexamic acid in postpartum hemorrhage: A cost-effectiveness analysis. Obstetrics and Gynecology. 2018;131:171S-2S.
- Huebner BR, Dorlac WC, Cribari C. Tranexamic Acid Use in Prehospital Uncontrolled Hemorrhage. Wilderness Environ Med. 2017 Jun;28(2S):S50-S60. doi: 10.1016/j.wem.2016.12.006. Review. PubMed PMID: 28601210; PubMed Central PMCID:PMC5567779.
- ishijima DK, VanBuren J, Hewes HA, Myers SR, Stanley RM, Adelson PD, Barnhard SE, Bobinski M, Ghetti S, Holmes JF, Roberts I, Schalick WO 3rd, Tran NK, Tzimenatos LS, Michael Dean J, Kuppermann N; TIC-TOC Collaborators of the Pediatric Emergency Care Applied Research Network. Traumatic injury clinical trial evaluating tranexamic acid in children (TIC-TOC): study protocol for a pilot randomized controlled trial. Trials. 2018 Oct 30;19(1):593.
- Ker K, Roberts I, Shakur H, Coats TJ. Antifibrinolytic drugs for acute traumatic injury. Cochrane Database Syst Rev. 2015 May 9;(5):CD004896. doi:10.1002/14651858.CD004896.pub4. Review. PubMed PMID: 25956410.
- Lecker I, Wang DS, Whissell PD, Avramescu S, Mazer CD, Orser BA. Tranexamic acid-associated seizures: Causes and treatment. Ann Neurol. 2016 Jan;79(1):18-26.
- Li B, Miners A, Shakur H, Roberts I; WOMAN Trial Collaborators. Tranexamic acid for treatment of women with post-partum haemorrhage in Nigeria and Pakistan: a cost-effectiveness analysis of data from the WOMAN trial. Lancet Glob Health. 2018 Feb;6(2):e222-e228. doi: 10.1016/S2214-109X(17)30467-9. PubMed PMID: 29389542; PubMed Central PMCID: PMC5785366.
- Lin Z, Xiaoyi Z. Tranexamic acid-associated seizures: A meta-analysis. Seizure. 2016 Mar;36:70-73.
- McCaul M, Kredo T. Antifibrinolytic drugs for acute traumatic injury. S Afr Med J. 2016 Jul 13;106(8):777-8. doi: 10.7196/SAMJ.2016.v106i8.11042. PubMed PMID: 27499400.
- Mitra B, Mazur S, Cameron PA, Bernard S, Burns B, Smith A, Rashford S, Fitzgerald M, Smith K, Gruen RL; PATCH-Trauma Study Investigators. Tranexamic acid for trauma: filling the 'GAP' in evidence. Emerg Med Australas. 2014 Apr;26(2):194-7. doi: 10.1111/1742-6723.12172. PubMed PMID: 24708011.
- Mouna K, Fehmi F, Kais GO, Amal N, Noura C, Amine BM, et al. Early administration of tranexamic acid and fibrinogen concentrate reduces mortality in postpartum hemorrhage. Annals of Intensive Care. 2018; 8(1).2018;
- Mrochuk M, ÓDochartaigh D, Chang E. Rural trauma patients cannot wait: tranexamic Acid administration by helicopter emergency medical services. Air Med J. 2015 Jan-Feb;34(1):37-9. doi: 10.1016/j.amj.2014.09.004. PubMed PMID: 25542726.
- Neeki MM, Dong F, Toy J, Vaezazizi R, Powell J, Jabourian N, Jabourian A, Wong D, Vara R, Seiler K, Pennington TW, Powell J, Yoshida-McMath C, Kissel S, Schulz-Costello K, Mistry J, Surrusco MS, O'Bosky KR, Van Stralen D, Ludi D, Sporer K, Benson P, Kwong E, Pitts R, Culhane JT, Borger R. Efficacy and Safety of Tranexamic Acid in Prehospital Traumatic Hemorrhagic Shock: Outcomes of the Cal-PAT Study. West J Emerg Med. 2017 Jun;18(4):673-683. doi: 10.5811/westjem.2017.2.32044. Epub 2017 Apr 19. PubMed PMID: 28611888; PubMed Central PMCID: PMC5468073.
- Ng M, Perrott J, Burgess S. Evaluation of tranexamic acid in trauma patients: A retrospective quantitative analysis. Am J Emerg Med. 2019 Mar;37(3):444-449. doi: 10.1016/j.ajem.2018.06.010. Epub 2018 Jun 5. PubMed PMID: 29903672.
- Nishijima DK, VanBuren J, Hewes HA, Myers SR, Stanley RM, Adelson PD, Barnhard SE, Bobinski M, Ghetti S, Holmes JF, Roberts I, Schalick WO 3rd, Tran NK, Tzimenatos LS, Michael Dean J, Kuppermann N; TIC-TOC Collaborators of the Pediatric Emergency Care Applied Research Network. Traumatic injury clinical trial evaluating tranexamic acid in children (TIC-TOC): study protocol for a pilot randomized controlled trial. Trials. 2018 Oct 30;19(1):593.
- Pacheco LD, Hankins GDV, Saad AF, Costantine MM, Chiossi G, Saade GR. Tranexamic Acid for the Management of Obstetric Hemorrhage. Obstet Gynecol. 2017 Oct;130(4):765-769. doi: 10.1097/AOG.0000000000002253. PubMed PMID: 28885402.
- Pinto MA, Silva JG, Chedid AD, Chedid MF. USE OF TRANEXAMIC ACID IN TRAUMA PATIENTS: AN ANALYSIS OF COST-EFFECTIVENESS FOR USE IN BRAZIL. Arq Bras Cir Dig. 2016 Nov-Dec;29(4):282-286. doi: 10.1590/0102-6720201600040017. Review.PubMed PMID: 28076488; PubMed Central PMCID: PMC5225873.
- Roberts I, Perel P, Prieto-Merino D, Shakur H, Coats T, Hunt BJ, Lecky F, Brohi K, Willett K; CRASH-2 Collaborators. Effect of tranexamic acid on mortality in patients with traumatic bleeding: prespecified analysis of data from randomised controlled trial. BMJ. 2012 Sep 11;345:e5839. doi: 10.1136/bmj.e5839. PubMed PMID: 22968527; PubMed Central PMCID: PMC3439642.
- Roberts I, Prieto-Merino D, Manno D. Mechanism of action of tranexamic acid in bleeding trauma patients: an exploratory analysis of data from the CRASH-2 trial. Crit Care. 2014 Dec 13;18(6):685. doi: 10.1186/s13054-014-0685-8. PubMed PMID: 25498484; PubMed Central PMCID: PMC4277654.
- Roberts I, Shakur H, Afolabi A, Brohi K, Coats T, Dewan Y, Gando S, Guyatt G, Hunt BJ, Morales C, Perel P, Prieto-Merino D, Woolley T. The importance of early treatment with tranexamic acid in bleeding trauma patients: an exploratory analysis of the CRASH-2 randomised controlled trial. Lancet. 2011 Mar 26;377(9771):1096-101, 1101.e1-2. doi:10.1016/S0140-6736(11)60278-X. PubMed PMID: 21439633.
- Roberts I, Shakur H, Coats T, Hunt B, Balogun E, Barnetson L, Cook L, Kawahara T, Perel P, Prieto-Merino D, Ramos M, Cairns J, Guerriero C. The CRASH-2 trial: a randomised controlled trial and economic evaluation of the effects of tranexamic acid on death, vascular occlusive events and transfusion requirement in bleeding trauma patients. Health Technol Assess. 2013 Mar;17(10):1-79. doi: 10.3310/hta17100. PubMed PMID: 23477634; PubMed Central PMCID: PMC4780956.
- Shakur 2017, WOMAN Trial Collaborators. Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled trial. Lancet. 2017 May 27;389(10084):2105-2116. doi: 10.1016/S0140-6736(17)30638-4. Epub 2017 Apr 26.
- Shakur H, Beaumont D, Pavord S, Gayet-Ageron A, Ker K, Mousa HA. Antifibrinolytic drugs for treating primary postpartum haemorrhage. Cochrane Database Syst Rev. 2018 Feb 20;2:CD012964. doi: 10.1002/14651858.CD012964. Review. PubMed PMID: 29462500.
- Shakur H, Elbourne D, Gülmezoglu M, Alfirevic Z, Ronsmans C, Allen E, Roberts The WOMAN Trial (World Maternal Antifibrinolytic Trial): tranexamic acid for the treatment of postpartum haemorrhage: an international randomised, double blind placebo controlled trial. Trials. 2010 Apr 16;11:40. doi: 10.1186/1745-6215-11-40. PubMed PMID: 20398351; PubMed Central PMCID: PMC2864262.
- Shakur H, Roberts I, Bautista R, Caballero J, Coats T, Dewan Y, El-Sayed H, Gogichaishvili T, Gupta S, Herrera J, Hunt B, Iribhogbe P, Izurieta M, Khamis H, Komolafe E, Marrero MA, Mejía-Mantilla J, Miranda J, Morales C, Olaomi O, Olldashi F, Perel P, Peto R, Ramana PV, Ravi RR, Yutthakasemsunt S. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet. 2010 Jul 3;376(9734):23-32. doi: 10.1016/S0140-6736(10)60835-5. Epub 2010 Jun 14. PubMed PMID: 20554319.
- Shiraishi A, Kushimoto S, Otomo Y, Matsui H, Hagiwara A, Murata K; Japanese Observational Study for Coagulation and Thrombolysis in Early Trauma (J-OCTET) investigators. Effectiveness of early administration of tranexamic acid in patients with severe trauma. Br J Surg. 2017 May;104(6):710-717. doi: 10.1002/bjs.10497. Epub 2017 Feb 23. PubMed PMID: 28230248.
- Spahn DR, Bouillon B, Cerny V, Duranteau J, Filipescu D, Hunt BJ, Komadina R, Maegele M, Nardi G, Riddez L, Samama CM, Vincent JL, Rossaint R. The European guideline on management of major bleeding and coagulopathy following trauma: fifth edition. Crit Care. 2019 Mar 27;23(1):98.
- Stansfield R, Morris D, Jesulola E. The Use of Tranexamic acid (TXA) for The Management of Haemorrhage In Trauma Patients In The Prehospital Environment: Literature Review and Descriptive Analysis of Principal Themes. Shock. 2019 Jun 4.
- Stein P, Studt JD, Albrecht R, Müller S, von Ow D, Fischer S, Seifert B, Mariotti S, Spahn DR, Theusinger OM. The Impact of Prehospital Tranexamic Acid on Blood Coagulation in Trauma Patients. Anesth Analg. 2018 Feb;126(2):522-529. doi: 10.1213/ANE.0000000000002708. PubMed PMID: 29239953.
- Tourtier JP, Palmier B, Tazarourte K, Raux M, Meaudre E, Ausset S, Sailliol A, Vivien B, Domanski L, Carli P. The concept of damage control: extending the paradigm in the prehospital setting. Ann Fr Anesth Reanim. 2013 Jul-Aug;32(7-8):520-6. doi: 10.1016/j.annfar.2013.07.012. Epub 2013 Jul 31. Review. PubMed PMID: 23916519.
- Wafaisade A, Lefering R, Bouillon B, Böhmer AB, Gäßler M, Ruppert M; TraumaRegister DGU. Prehospital administration of tranexamic acid in trauma patients. Crit Care. 2016 May 12;20(1):143. doi: 10.1186/s13054-016-1322-5. PubMed PMID: 27176727; PubMed Central PMCID: PMC4866028.
- Williams-Johnson JA, McDonald AH, Strachan GG, Williams EW. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2) A randomised, placebo-controlled trial. West Indian Med J. 2010 Dec;59(6):612-24. PubMed PMID: 21702233.
- Yeguiayan JM, Rosencher N, Vivien B. Early administration of tranexamic acid in trauma patients. Lancet. 2011 Jul 2;378(9785):27-8; author reply 28. doi: 10.1016/S0140-6736(11)61015-5. PubMed PMID: 21724032.
- Prasad, R, Patki, A, Padhy, S, Ramchandran, G. Single intravenous bolus versus perioperative continuous infusion of tranexamic acid to reduce blood loss in abdominal oncosurgical procedures: a prospective randomized double‐blind clinical study. J Anaesthesiol Clin Pharmacol. 2018; 34( 4): 529‐ 534.
- Guo J, Gao X, Ma Y, Lv H, Hu W, Zhang S, Ji H, Wang G, Shi J. Different dose regimes and administration methods of tranexamic acid in cardiac surgery: a meta-analysis of randomized trials. BMC Anesthesiol. 2019 Jul 15;19(1):129. doi: 10.1186/s12871-019-0772-0.
Evidence tabellen
Research question: Wat is het effect van het toedienen van tranexaminezuur vóór aankomst in het ziekenhuis (of binnen drie uur na het ontstaan van de bloeding) in vergelijking met het toedienen van tranexaminezuur ín het ziekenhuis (of ná drie uur na het ontstaan van de bloeding) bij volwassenen met een acute bloeding als gevolg van een trauma?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Olldashi, 2010, 2011 (CRASH-2 trial collaborators) |
Type of study: RCT
Setting: Hospital
Country: Global, 40 different countries
Source of funding: UK NIHR Health Technology Assessment programme, Pfizer, BUPA Foundation, and J P Moulton Charitable Foundation. |
Inclusion criteria: Adult trauma patients with significant haemorrhage (systolic blood pressure <90 mm Hg or heart rate >110 beats per min, or both), or who were considered to be at risk of significant haemorrhage, and who were within 8h of injury.
Exclusion criteria: Patients for whom there was a clear indication, or a clear contraindication, for tranexamic acid were not randomly assigned.
Subgroup ≤1h of administering*
N total at baseline: N=7451
Age years (mean (SD): 33.4 (13.9)
Glasgow Coma Score N: Severe (3-8) = 1000 (13.4%) Moderate (9-12) = 868 (11.7%) Mild (13-15) = 5577 (74.9%)
Subgroup 1-3h of administering*
N total at baseline: N=6033
Age years (mean (SD): 35.0 (14.0)
Glasgow Coma Score N: Severe (3-8) = 1124 (18.6%) Moderate (9-12) = 915 (15.2%) Mild (13-15) = 3994 (66.2%)
Subgroup >3h of administering*
N total at baseline: N=6634
Age years (mean (SD): 35.5 (14.8)
Glasgow Coma Score N: Severe (3-8) = 1494 (22.5%) Moderate (9-12) = 909 (13.7%) Mild (13-15) = 4214 (63.5%) |
Tranexamic acid (loading dose 1 g over 10 min followed by infusion of 1 g over 8 h)
|
Matching placebo |
Length of follow-up: Maximum 4 weeks
Loss-to-follow-up: Primary outcome data were available for 20127 (99.6%) randomised patients. |
All cause mortality and bleeding death.
For detailed outcomes see ‘Figuur 1’ in main guideline text.
|
Data extracted from the Olldashi 2010 and 2011 papers (the latter presents detailed results for timing of administering tranexaminezuur).
|
*No details reported per treatment group
Research question: Wat is het effect van het toedienen van tranexaminezuur vóór aankomst in het ziekenhuis (of binnen drie uur na het ontstaan van de bloeding) in vergelijking met het toedienen van tranexaminezuur ín het ziekenhuis (of ná drie uur na het ontstaan van de bloeding) bij patiënten met een acuut obstetrische bloeding?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Shakur 2017 |
Type of study: RCT
Setting: Hospital
Country: Global, 21 different countries
Source of funding: London School of Hygiene & Tropical Medicine, Pfizer, UK Department of Health, Wellcome Trust, and Bill & Melinda Gates Foundation. |
Inclusion criteria: Women 16 years and older with a clinical diagnosis of post-partum haemorrhage after a vaginal birth (500 mL) or any blood loss sufficient to compromise haemodynamic stability. Fundamental eligibility criterion was the clinician’s uncertainty about whether to use tranexamic acid in a particular woman with post-partum haemorrhage.
Exclusion criteria: Not specified.
N total at baseline: I: N = 10051 C: N = 10009
Age years N (%) I: < 16 = 1 (<1%) 16-25 = 3445 (34%) 26-33 = 4580 (46%) ≥34 = 2022 (20%) Unknown = 3 (<1%)
Age years N (%) C: < 16 = 3 (<1%) 16-25 = 3407 (34%) 26-33 = 4608 (46%) ≥34 = 1987 (20%) Unknown = 4 (<1%)
Type of delivery N (%) I: Vaginal = 7093 (71%) Caesarean section = 2957 (29%) Unknown = 1 (<1%)
Type of delivery N (%) C: Vaginal = 7126 (71%) Caesarean section = 2879 (29%) Unknown = 4 (<1%) |
Investigators were advised to give 1 g (100 mg/mL) of tranexamic acid intravenously at an approximate rate of 1 mL per min. If bleeding continued after 30 min or stopped and restarted within 24 h of the first dose, a second dose of 1 g of tranexamic acid or placebo could be given. |
Matching placebo |
Length of follow-up: Maximum 6 weeks
Loss-to-follow-up: I: N = 11 lost to follow-up (out of N = 10051) C: N = 21 lost to follow-up (out of N = 10009) |
Bleeding death, need for laparotomy to stop bleeding.
For detailed outcomes see ‘Figuur 2’ and ‘Figuur 3’ in main guideline text.
|
|
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat is het effect van het toedienen van tranexaminezuur vóór aankomst in het ziekenhuis (of binnen drie uur na het ontstaan van de bloeding) in vergelijking met het toedienen van tranexaminezuur ín het ziekenhuis (of ná drie uur na het ontstaan van de bloeding) bij volwassenen met een acute bloeding als gevolg van een trauma?
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Olldashi 2010, 2011 (CRASH-2) |
”Randomisation was balanced by centre, with an allocation sequence based on a block size of eight, generated with a computer random number generator.“ |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Research question: Wat is het effect van het toedienen van tranexaminezuur vóór aankomst in het ziekenhuis (of binnen drie uur na het ontstaan van de bloeding) in vergelijking met het toedienen van tranexaminezuur ín het ziekenhuis (of ná drie uur na het ontstaan van de bloeding) bij patiënten met een acuut obstetrische bloeding?
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Shakur, 2017 |
Not randomised for early versus. later tranexamic acid |
Likely |
Unlikely |
Unclear (providers not blinded, outcomes are objective and not likely biased) |
Unlikely |
Unlikely |
Unlikely |
Unclear (no RCT, no ITT) |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Ausset 2015 |
Beschrijvende literatuurstudie |
|
Boling 2012 |
Beschrijvende literatuurstudie |
|
Boudreau 2019 |
Beide groepen ontvangen tranexaminezuur binnen drie uur na trauma |
|
Boutonnet 2018 |
Congres abstract |
|
Brown 2015 |
Studieprotocol (Study of tranexamic acid during air medical prehospital transport STAAMP Trial) |
|
Couret-Alcaraz 2016 |
Congres abstract |
|
Dewan 2012 |
Studieprotocol (Tranexamic acid for the treatment of significant traumatic brain injury CRASH-3) |
|
Eckert 2014 |
Congres abstract |
|
El-Menyar 2018 |
Systematische literatuurstudie van niet gerandomiseerde studies (Neeki 2017 en Wafaisade 2016), vergelijkt wel of geen tranexaminezuur voor aankomst in het ziekenhuis |
|
Franchini 2014 |
Beschrijvende literatuurstudie |
|
Gillissen 2017 |
Niet gerandomiseerde studie, vergelijkt wel of geen tranexaminezuur binnen 1u na bloeding. Controle groep bestaat uit patiënten die geen, of laat (>3u na bloeding) tranexaminezuur kregen. |
|
Gillissen 2017 |
Dubbel publicatie Gillissen 2017 |
|
Goobie 2017 |
Patiënten zonder acute bloeding (geplande wervelkolom operatie) |
|
Gruen 2011 |
Letter to the Editor |
|
Guerriero 2011 |
Kosten-effectiviteit analyse CRASH-2 trial |
|
Gulmezoglu 2009 |
Studieprotocol (The WOMAN Trial, Shakur 2017) |
|
Harvin 2015 |
Congres abstract |
|
Howard 2018 |
Congres abstract |
|
Huebner 2017 |
Beschrijvende literatuurstudie |
|
Ker 2015 |
Cochrane Systematic Review, maakt geen verschil tussen binnen- of 3u na bloeding |
|
Li 2018 |
Kosteneffectiviteit analyse (Nigeria, Pakistan) |
|
McCaul 2016 |
Samenvatting van Cochrane Review (Ker 2015) |
|
Mitra 2014 |
Beschrijvende literatuurstudie |
|
Mouna 2018 |
Congres abstract |
|
Mrochuk 2015 |
Niet vergelijkend onderzoek |
|
Neeki 2017 |
Niet gerandomiseerde studie, vergelijkt wel of geen tranexaminezuur voor aankomst in het ziekenhuis |
|
Ng 2018 |
Niet vergelijkend onderzoek |
|
Pacheco 2017 |
Beschrijvende literatuurstudie |
|
Pinto 2016 |
Beschrijvende literatuurstudie |
|
Roberts 2012a |
Oudere versie van Cochrane review (Ker 2015) |
|
Roberts 2012b |
Secundaire analyse CRASH-2 trial |
|
Roberts 2013 |
HTA rapport CRASH-2 trial |
|
Roberts 2014 |
Secundaire analyse CRASH-2 trial |
|
Shakur 2010 |
Studieprotocol (The WOMAN Trial, Shakur 2017) |
|
Shakur 2018 |
Cochrane Systematic Review, maakt geen verschil tussen binnen- of 3u na bloeding |
|
Shiraishi 2017 |
Niet gerandomiseerde studie, vergelijkt wel of geen tranexaminezuur binnen 3u na bloeding |
|
Stein 2018 |
Niet gerandomiseerde studie, vergelijkt wel of geen tranexaminezuur voor aankomst in het ziekenhuis |
|
Tourtier 2013 |
Beschrijvende literatuurstudie |
|
Wafaisade 2016 |
Niet gerandomiseerde studie, vergelijkt wel of geen tranexaminezuur voor aankomst in het ziekenhuis |
|
Williams-Johnson 2010 |
Samenvatting van CRASH-2 trial |
|
Yeguiayan 2011 |
Letter to the Editor |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 15-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn wordt een deel van de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn zal de werkgroep per module een inschatting maken over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging (NIV), Nederlandse Vereniging van Anesthesiologie (NVA) en Nederlandse Vereniging van Klinische Chemie (NVKC) zijn regiehouders van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Tijdstip toediening tranexaminezuur bij trauma |
NIV |
|
|
|
|
Let op Tic-Toc trial en https://www.ncbi.nlm.nih.gov/pubmed/31362765 |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De transfusierichtlijn geeft ten eerste antwoorden op grote uitgangsvragen over wie, wanneer, hoe, hoeveel en met welke producten getransfundeerd wordt en wat daarvan volgens wetenschappelijk onderzoek aan voordelig/nadelig resultaat verwacht mag worden. Na het bepalen van de wetenschappelijke waarde van dit onderzoek, worden uiteindelijk aanbevelingen opgesteld, gebaseerd op de conclusies van het wetenschappelijke onderzoek en na het beschouwen van een additionele context van bijvoorbeeld kosten- ethische, maatschappelijke of wettelijke overwegingen. Deze aanbevelingen zijn bedoeld om verantwoord en wenselijk handelen voor leden van de beroepsgroep te definieren in de voorkomende dagelijkse klinische praktijk. Echter, er kan beargumenteerd altijd afgeweken worden van de algemene aanbevelingen en gekozen worden voor een meer op de individuele patient afgestemde ondersteuning.
Doelgroep
Naast de genoemde beoogde gebruikers van de richtlijn is de richtlijn ook bedoeld en van waarde voor de collega’s van de nationale bloedvoorzieningsorganisatie Sanquin.
Samenstelling werkgroep
Voor de herziening van de richtlijn zijn er in 2016 zes multidisciplinaire werkgroepen ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij patiënten die een bloedtransfusie nodig hebben. Een stuurgroep, bestaande uit de voorzitters van de deelprojecten, coördineerde de werkgroepen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep bloedingen en bloedbesparende technieken:
- Dr. A.W .M.M. (Ankie) Koopman- van Gemert, Anesthesioloog, voorzitter, NVA
- Dr. P.M.J. (Peter) Rosseel, anesthesioloog-intensivist, NVA
- Prof. dr. J.J. (Jaap Jan) Zwaginga, Hematoloog / Transfusiespecialist / Hoogleraar transfusiegeneeskunde, NIV
- Prof. dr. F.W.G. (Frank) Leebeek, Internist hematoloog en internist vasculair geneeskundige, NIV
- Dr. ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie/ clusterhoofd Hemostase en Transfusie, NVKC
- Dr. E.C.T.H. (Edward) Tan, Traumachirurg / Afdelingshoofd SEH / Heli-MMT arts, NVVH
- Dr. L.M.G. (Leo) Geeraedts, Traumachirurg, NVVH
- Dr. A.B.A. (Alexander) Vonk, Cardiothoracaal chirurg, NVT
- Drs. E.J. (Elise) Huijssen-Huisman, Kinderarts, kinderhematoloog, Transfusiespecialist, NVK
- Dr. N.P. (Nicole) Juffermans, Intensivist, NVIC
- Dr. J.J. (Hans) Duvekot, Gynaecoloog-Perinatoloog, NVOG
Meelezer:
- Drs. V.A. (Victor) Viersen, Anesthesioloog, NVA
Werkgroep Transfusiereacties en gerelateerde aandoeningen:
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, voorzitter, NIV
- Dr. J.L.P. (Hans) van Duijnhoven, laboratoriumspecialist klinische chemie, NVKC
- Drs. C.T. (Christian) Favoccia, anesthesioloog, NVA
- Prof dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. T. (Tanja) Netelenbos, internist-hematoloog, NIV
- M.R. (Michaela) van Bohemen, verpleegkundige n.p., hemovigilantieconsulent V&VN (vanaf juli 2018)
- Dr. J. (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. D. (Dik) Versteeg, arts-microbioloog, NVMM (tot juli 2018)
- Dr. J. H. (Jan) Marcelis arts-microbioloog, NVMM (vanaf juli 2018)
- Dr. A.P.J. (Alexander) Vlaar, internist-Intensivist, NVIC
- Dr. J.C. (Jo) Wiersum-Osselton, TRIP hemo- en biovigilantie, landelijk coördinator, arts M&G, NVDG
Voor de module “Indicatie voor bestralen van bloedproducten” heeft een expertmeeting plaatsgevonden. Bijzondere dank aan de experts die tijdens en na deze meeting hebben bijgedragen aan de tekst:
- Prof. dr. J.H.F. (Fred) Falkenburg, hoogleraar hematologie
- Dr. P.A.W. (Peter) te Boekhorst, internist-hematoloog/ transfusiespecialist
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatoloog
- Prof. dr. J.J. (Jaap Jan) Zwaginga, internist-hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde
- Dr. M.D. (Mette) Hazenberg, internist-hematoloog
Met ondersteuning van:
- Drs. E.E. (Eva) Volmeijer, adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider (tot februari 2020)
- Dr. B.H. (Bernardine) Stegeman, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider (vanaf februari 2020)
- Drs. T. (Tessa) Geltink, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. (Roy) Elbers, adviseur Kennisinstituut van de Federatie Medisch Specialisten (tot juli 2019)
- Dr. E. (Ellen) Paap, adviseur Kennisinstituut van de Federatie Medisch Specialisten (vanaf juli 2019)
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Voorzitters (kerngroep) |
||||
|
M. Schipperus |
Internist-hematoloog (100%) |
Voorzitter Bestuur Stichting TRIP (Transfusie in patiënten), onbetaald |
ITP-onderzoek gefinancierd door AMGeN Advisory board Novartis |
Lid participeert niet in besluitvorming omtrent producten van AMGEN of Novartis. |
|
A. Koopman- van Gemert |
Anesthesioloog |
Diverse functies bij nationale en internationale commissies bv Concilium, Stuurgroep antistolling, examencommissie et cetera Internationaal lid van de Europese examencommissie |
-Participatie in de PETS-studie van het EMC, geen financiële relatie. -Participatie in verschillende onderzoeken (geen financiële relatie en geen direct verband bloedtransfusie) -Organisatie symposia met sponsoring (geen directe financiële relatie en direct verband bloedtransfusie) |
Geen restricties |
|
J.J. Zwaginga |
Hematoloog LUMC (Leiden), Transfusiespecialist, Hoogleraar transfusiegeneeskunde |
-Penningmeester VHL=Vereniging Hematologische laboratoria -Voorzitter van de benigne hematologische werkgroep van NVvH |
-Sprekershonoraria Viforpharma (ijzer: medicatie kan transfusies uitsparen) -Wetenschappelijke adviesraad: Novantis (ijzerchelatie kan transfusie gemedieerde ijzerstapeling opheffen) - Gilead: CLL medicatie webcast geen relatie met transfusiebeleid PI van meerdere Sanquin onderzoeken ogv - allumminisatie door RBC transfusies - ijzertoxiciteit door bloedtransfusies - bloedings IRM (voldoende) plaatjestransfusies et cetera |
Lid participeert niet in besluitvorming omtrent Novartis en wanneer SANQUIN-studies worden geïncludeerd waarbij lid een van de auteurs is |
|
E. Beckers |
Internist-hematoloog/transfusiespecialist MUMC + Maastricht |
Bestuurslid Ned. Ver. Bloedtransfusie, onbetaald - Bestuurslid Ned. Ver. Hematologie, onbetaald - Lid adviesraad TRIP (Transfusie Reacties in Patiënten), onbetaald - Lid Landelijke Gebruikers Raad Sanquin, onbetaald - Lid Stuurgroep TiN studie (Trombocytopathie in Nederland) |
Project 'Predictors of Bleeding' externe financiering door Bayer
Transparantieregister.nl: sprekers vergoeding van Roche; gastvrijheidsbijdrage van: Roche, Pfizer, Sanquin en Bayer |
Lid participeert niet in besluitvorming omtrent producten van Bayer en Roche en wanneer specifiek de studie "predictors of bleeding" (gefinancierd door Bayer) worden geïncludeerd |
|
J. Slomp |
Laboratorium specialist Klinische Chemie en hematologie MST/Medlon |
-Bestuurslid VHL - onbetaald -Bestuurslid NVvH - onbetaald -Werkgroep Bloedtransfusie VHL (vz.) onbetaald -Lid LGR onbetaald - - Lid Expert committee TRIP (onbetaald) |
-Medical Advisory Board Janssen: advies omtrent bloedtransfusie bij patiënten die daratumumab gebruiken, betaald - In samenwerking met UMCU en VU bezig om een landelijk protocol op te stellen voor bloedtransfusie en daratumumab |
Lid participeert niet in besluitvorming omtrent productn van Janssen (daratumumab) |
|
H. Soons |
Laboratoriumspecialist Klinische Chemie, St. Anna Ziekenhuis (1 fte) en Kempenhaeghe (detachering vanuit St. Anna Ziekenhuis)
|
-Bestuur Nederlandse Vereniging voor Bloedtransfusie (NVB), voorzitter, onbetaald -Bestuur Transfusie Reacties in Patiënten (TRIP), secretaris, vacatiegeld - Medisch Advies Raad Sanquin (MAR), lid, vacatiegeld -Lid Landelijke Gebruikersraad Sanquin (LGR), onbetaald |
|
Geen restricties |
|
Werkgroep laboratoriumaspecten |
||||
|
H. de Wit |
Laboratoriumspecialist Klinische Chemie en Hematologie, Certe |
-Bestuurslid/ penningmeester Nederlandse Vereniging voor Bloedtransfusue (onbetaald) - Bestuurslid/ penningmeester Stichting Vrienden van de NVB (onbet aald) |
|
Geen restricties |
|
K. de Vooght |
Laboratoriumspecialist Klinische Chemie, Hoofd Patiëntenzorg LKCH ad interim |
Bestuurslid/ penningmeester Stichting TRIP (onbetaald) - Bestuurslid/voorzitter Stichting vrienden van de Utrechtse bloedbank (onbetaald) - Lid Werkgroep Consortium Transfusiegeneeskundig Onderzoek (onbetaald) - Lid PROTON II Adviesraad (onbetaald) - Lidmaatschap NVB - Lidmaatschap NVvH - Docent OKU (Onderwijs Kring Utrecht) (betaald) -Docent PAO Farmacie (betaald) -Lid Wetenschappelijke commissie NVB/TRIP symposium (onbetaald) |
|
Geen restricties |
|
C. Folman |
Manager Laboratorium Erytrocytenserologie (Sanquin) |
- Docent Hogeschool Arnhem en Nijmegen, betaald - Lid TRIX-werkgroep, onbetaald - Secretaris werkgroep Bloedtransfusie van de VHL (Vereniging Hematologische Laboratoriumdiagnostiek), onbetaald - Lid Expert Committee TRIP (Transfusie Reacties In Patiënten), onbetaald -Lid wetenschappelijke commissie NVB (Nederlandse Vereniging voor Bloedtransfusie), onbetaald" |
- Dienstverband Sanquin - werkzaam in expertiselaboratorium waar onderzoek wordt gericht voor derden op het gebied van bloedtransfusie |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
M. de Haas |
-Bijzonder hoogleraar Translationele Immunohematologie (bezoldiging Sanquin, onbezoldigd aangesteld bij LUMC -Clustermanager Immunohematologie Diagnostiek |
- Secretaris NVB (tot mei 2017) |
-Dienstverband Sanquin -Hoofd van een expertiselaboratorium dat ingezet zou kunnen worden door derden voor het uitvoeren van (uit de richtlijn voortkomende) laboratoriumdiagnostiek |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
H. Russcher |
Laboratoriumspecialist Klinisch Chemie en Hematologie, in het Erasmus MC en Havenziekenhuis |
- Auditor RvA i.h.k.v. ISO 15189:2012 voor medische laboratoria - Betaald |
|
restricties t.a.v. producten van Roche diagnostiek.Gebruikersraad geen belangen tav Sanquin, geen restriicties |
|
N. Som |
Senior hoofdanaliste bloedtransfusiedienst VUmc |
- Hemovigilantiecoördinator Vumc |
|
Geen restricties |
|
J. Lie |
-Stafadviseur hemovigilantie 24,8 uur -Weefselvigil antiecoördinator 7,2 uur" |
-Contactpersoon voor landelijk Bureau TRIP: meldingen transfusiereacties en bijwerkingen - Voorzitter landelijk Hemovigilantoe Platform Nederland (vanaf 2016, eerder lid, mede oprichter HPN), onbetaald - Voorzitter en oprichter Regionaal Hemovigilantie Platform Zuidoost - BestuursLid NVB |
|
Geen restricties |
|
Werkgroep Anemie |
||||
|
A. Van Gammeren |
Laboratoriumspecialist Klinische Chemie
|
|
|
Geen restricties
|
|
N. Juffermans |
Intensivist |
Chief editor Netherlands Journal of Critical Care, vergoeding |
|
Geen restricties
|
|
K. Bergman |
Kinderarts-neonatologie, Beatrix kinderziekenhuis, UMCG ten Groningen (0,9fte). Als kinderarts-neonatologie voorzitter van het Regioteam Perinatale Audit Noord Nederland (Perined). Deze functie (0,1fte) wordt uitgeoefend binnen de UMCG aanstelling. |
-Lid programmacommissie Prenatale screening infectieziekten en erytrocyten-immunisatie RIVM namens NVK (vacatiegeld) -Lid werkgroep neonatale infectieziekten sectie neonatologie NVK (onbetaald) -Projectcommissielid ZonMw project: Introduction of Audit generated Changes in perinatal care using ""Tailored"" implementation strategies. (ACTion-project) (onbetaald) =Projectcommissielid 5 genes per minute, afdeling Medische genetica, UMCG, Groningen (onbetaald) |
|
Geen restricties
|
|
P. te Boekhorst |
Internist-Hematoloog / Transfusiespecialist
|
Medisch Adviesraad Sanquin, Lid, Vacatiegeld
|
In verleden: - Gastvrijheid Firma Alexion - Adviesraad Firma AmgeN (ITP) |
Lid participeert niet bij besluitvorming omtrent ITP |
|
B. Biemond |
Internist-hematoloog |
|
|
Geen restricties |
|
L. Oosten |
Hematoloog, Afdeling Immunohematologie & Bloedtransfusie bij het Leids Universitair Medisch Centum |
|
|
Geen restricties |
|
K. Fijn van Draat |
-Hoogleraar kinderhematologie AMC - Senior onderzoeker Sanquin Research |
VIDI selectiecommissie ZONMW, onbetaald (wel vacatievergoeding) |
Lid van de stuurgroep van de PLANET-2 studie die onderzoek doet naar triggers van trombocytentransfusie bij neonatenop de Neonatale Intensive Care Unit. PLANET-2 ontvangt geen sponsoring van de farmaceutische industrie |
Geen restricties |
|
Werkgroep trombocytentransfusies |
||||
|
A. Vlaar |
- Internist-Intensivist, Academisch Medisch Centrum, Amsterdam - Principal investigator Infusion related morbidity and mortality in the critically ill |
- Klinisch brug figuur Sanquin, onbetaald
|
Onderzoek gefinancierd door NWO, ZonMW, Sanquin: PI van de PACER studie (onder andere): hierbij worden trombotriggers voor invasieve ingrepen aangehouden. |
Geen restricties (ten aanzien van PACER studie: geen tegengesteld belang. Studie wordt niet gepubliceerd binnen termijn afronding richtlijn). |
|
l. van Pampus |
Internist-hematoloog-transfusiespecialist Radboudumc |
- Vice voorzitter hemovigilantiekamer TRIP (onbezoldigd)
|
Tegemoetkoming verblijfkosten Dublin (Ierland) het 17th Annual NATA Symposium on Patient Blood Management, Haemostasis and Thrombosis (NATA 2016) cf de CGR-rgels. |
Geen restricties |
|
G. Jansen |
Internist-hematoloog, afdeling Hematologie, Erasmus MC |
Post doctoraal onderzoeker bij afdeling Plasmaeiwitten, Sanquin Bloedvoorziening. Gastvrijheidovereenkomst, onbetaald |
"1) Naam project: ""Surface sialic acid is critical for platelet survival"" Financier: Sanquin Product and Process development (PPOC nr. 13-019). Bedrag: 499.000 euro. Rol: AIO project 2013-2018. Principal investigator en co-promotor
Toelichting: van dit geld is een OIO aangesteld (Mw M. Rijkers) die in dienst van Sanquin (1,0 fte) dit onderzoek verricht" |
Bij onderwerp sialic acid en trombocytenoverleving geen trekker /betrokkenheid opstellen aanbevelingen |
|
J.L. Kerkhoffs |
Internist - Hematoloog (0,8 FTE)
|
Transfusie-specialist / transfusie research (0,2 FTE) via Sanquin
|
Op Sanquin verricht ik klinisch transfusie onderzoek wat deels gefinancieerd wordt door de industrie TerumoBCT: PI van de PREPAReS studie, een RCT naar de klinische effectiviteit van trombocyten concentraten behandeld met een pathogeen-reductie proces (Mirasol, TERUMO BCT).
|
Restricties t.a.v. producten behandeld met pathogeen reductie proces en biomarkers. Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig.
|
|
R. Schutgens |
Internist-hematoloog
|
Lid van Medische Adviesraad patiëntenvereniging ITP |
-Speakersfee (voor instituut) en/of unrestricted research grant en/of lid advisory board van: Bayer, Baxalta, CSL Behring, NovoNordisk, Sanquin, Pfizer, Bristol-Meyers Squibb -Principal Investigator van de Trombocytopathie in Nederland (TiN) studie, mede gefinancierd door een unrestricted grant van Sanquin - deelname (in UMCU) ontwikkeling PACT en U-PACT (geen financieel belang) |
Geen betrokkenheid vragen bij bloedplaatjesfunctietest (PACT). Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig. |
|
M. Coppens |
Internist-vasculaire geneeskunde
|
- Diverse naschollingen en adviesraden (allen incidenteel) aangaande directe orale anticoagulantie georganiseerd door de fabrikanten van deze middelen, te weten Boehringer Ingelheim, Bayer, Pfizer, Bristol-Meyers Squibb, Daiichi Sankyo. Deze diensten zijn betaald, waarbij het geld naar mijn instituut gaat - Adviesraad aangaande 'The future of hemophilia treatment' georganiseerd door CSL Behring. Twee maal een advisory board; in 2015 en 2016. Deze diensten zijn betaald waarbij geld naar instituut gaat. CSL Behring produceert o.a. Haemocomplettan P (fibrinogeenconcentraat) en Beriplex (vierfactorenconcentraat). De huidige richtlijn zal mogelijk off-label gebruik van deze 2 middelen gaan bespreken. De genoemde adviesraad richtte zich op hemofilie A en B en de producten Haemocomplettan P en Beriplex zijn hier niet aan de orde geweest." |
Lid van de Stuurgroep van de Trombopathie in Nederland studie (geen financiele belangen). -Sanquin Blood Supply: Prothrombin Complex Concentrate (PCC) for the immediate reversal of the anticoagulant effects if new oral anticoagulants in emergency situations. Sanquin Blood Supply is producent van Cofact, een PCC, - CSL Behring: Biomarkers to detect subclinical arthropathy and predict long-term clinical arthropathy in patients with hemophilia. This project was awarded a 2016 Heimburger Award. CSL Behring produceert zowel Haemocomplettan P (fibrinogeenconcentraat) als Beriplex (een PCC), Dit project is gecofinancierd door CSL Behring, maar hebben geen betrekking op Haemocomplettan P noch Beriplex. |
Geen betrokkenheid opstellen aanbevelingen t.a.v. fibrinogeenconcrentraat en vierfactoren concentraat |
|
E. Lopriore |
Sectiehoofd Neonatologie WAKZ/LUMC |
Lid bloedtransfusiecommissie LUMC |
Onderzoek gefinancieerd door Sanquin: 1. PROC 12-012-027: Matisse studie: RCT in neonaten naar twee verschillende triggers voor trombocyten transfusies 50 vs 25; Promovenda: Suzanne Gunnink 2. PROC 16-33: Promotie onderzoek naar Rhesus hemolytische ziekt: Promovenda: Isabelle Ree |
Geen restricties |
|
H. van Ommen (meelezer) |
Kinderhematoloog |
|
'- PI Einstein junior (Bayer) Behandeling trombose bij kinderen - PI Hokusai kinderen (Daiichi Sankyo) Behandeling trombose bij kinderen - Nationaal coördinator BMS studie Apixaban ter preventie van trombose bij kinderen met een hartafwijking |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afstemming met de Patiëntenfederatie, Stichting Zeldzame Bloedziekten en Oscar Nederland. Deze verenigingen zijn uitgenodigd voor de invitational conference (knelpuntenanalyse) voorafgaand aan deze herziening en hebben input geleverd voor de te prioriteren vragen. De verenigingen hebben aangegeven graag in de commentaarfase de conceptrichtlijn te ontvangen voor commentaar. Tevens zal in de eindfase van deze richtlijn nog worden overlegd over de communicatie aan patiënten en of er nog aanvullende teksten voor patiënten kunnen worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij afronding van de richtlijn te vinden zijn bij de aanverwante producten. De werkgroep zal tevens de interne kwaliteitsindicatoren die bij de Richtlijn bloedtransfusie 2011 zijn opgesteld beoordelen en indien nodig door ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroepen en de adviseurs de knelpunten. De werkgroepen beoordeelden de aanbevelingen uit de eerdere richtlijn Bloedtransfusiebeleid (2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en andere aanwezigen tijdens de Invitational conference. De werkgroepen stelden vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn in de werkgroepen besproken waarna de werkgroepleden de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroepen tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews (Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje “Overwegingen”.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en de weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn word aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroepen. Naar aanleiding van de commentaren word de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroepen. De definitieve richtlijn word aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2012.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1948 – 2 oktober 2018
|
1 exp Tranexamic Acid/ or (tranexam* or tranexaminezuur).ti,ab,kw. (5093) 2 exp Hemorrhage/ or exp "Wounds and Injuries"/ or exp Postpartum Hemorrhage/ or (bleed* or haemorrhag* or hemorrhag* or trauma or injur* or wound* or ((obstetric or vaginal or partum or postpartum) adj3 (hemorrhag* or haemorrhag* or bleed*))).ti,ab,kw. (1932767) 3 exp Emergency Medical Services/ or (prehospital or pre-hospital or (early adj3 (suppletion or administration)) or (('3' or three) adj3 hour*)).ti,ab,kw. (176314) 4 1 and 2 and 3 (207) 5 limit 4 to english language (188) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (369613) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1792672) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3047767) 9 5 and 6 (16) 10 5 and 7 (83) 11 5 and 8 (57) 12 9 or 10 or 11 (116)
= 116 |
185 |
|
Embase (Elsevier)
2 oktober 2018 |
('tranexamic acid'/exp OR tranexam*:ab,ti OR tranexaminezuur:ab,ti)
AND ('bleeding'/exp OR bleed*:ab,ti OR haemorrhag*:ab,ti OR hemorrhag*:ab,ti OR 'injury'/exp OR trauma:ab,ti OR injur*:ab,ti OR 'wound'/exp OR wound*:ab,ti OR 'obstetric hemorrhage'/exp OR ((obstetric OR vaginal OR partum OR postpartum) NEAR/3 (hemorrhag* OR haemorrhag* OR bleed*)):ab,ti)
AND ('emergency care'/exp OR prehospital:ab,ti OR 'pre hospital':ab,ti OR (early NEAR/3 (suppletion OR administration)):ab,ti OR ((3 OR three) NEAR/3 hour*):ab,ti)
AND (english)/lim NOT 'conference abstracts':it))
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
Observationeel onderzoek: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 153 |
