Vaccinatie en biologicals
Uitgangsvraag
Wanneer kan een IMID patiënt met gebruik van of indicatie voor biologicals welke vaccinaties toegediend krijgen en welke informatie zal hierbij aan de patiënt verstrekt moeten worden?
Aanbeveling
Het verdient aanbeveling om alle IMID patiënten met biologicals vaccinaties tegen influenza vòòr de start toe te dienen. Indien dit niet mogelijk is, kunnen deze vaccinaties ook tijdens het gebruik van biologicals worden toegediend, waarbij effectiviteit mogelijk iets is afgenomen.
Bij behandeling met biologicals valt pneumococcenvaccinatie te overwegen.
Het verdient aanbeveling om vaccinaties tegen influenza en pneumococcen bij voorkeur 4 weken vòòr de start van Rituximab toe te dienen. Indien dit niet mogelijk is, kunnen deze vaccinaties ook tijdens het gebruik van Rituximab worden toegediend. Aanbevolen wordt dan te wachten tot tenminste 2 maanden na de laatste Ritixumab gift, waarbij rekening moet worden gehouden met een verminderde effectiviteit van de vaccinatie.
Bij IMID patiënten die worden behandeld met biologicals wordt het gebruik van levend verzwakte vaccins ontraden.
Overwegingen
Bij patiënten met IMID is er een verhoogd risico op voornamelijk bovenste luchtweginfecties (zie uitgangsvraag 3). Alhoewel data van exacte microbiële verwekkers ontbreken, mag er, als de data van grote epidemiologische studies worden geëxtrapoleerd, van uit worden gegaan dat influenza en, in mindere mate, pneumococcen een belangrijke rol in de etiologie spelen. Dit speelt des te meer voor IMID patiënten tijdens het gebruik van biologicals, aangezien deze patiënten extra zijn immuungecompromiteerd. IMID patiënten, behandeld met biologicals, komen derhalve voor jaarlijkse influenzavaccinatie in aanmerking. Hoewel de incidentie van pneumoccocceninfectie laag is, zou ook pneumococcenvaccinatie eens in de 5 jaar kunnen worden aangeboden. De werkgroep is zich bewust dat de pneumococcenvaccinatie niet voor vergoeding in aanmerking komt. De keuze een patiënt al dan niet te beschermen middels deze vaccinatie zal dan ook op een individuele basis dienen te geschieden. Aangezien het gebruik van biologicals de effectiviteit van vaccinatie mogelijk iets vermindert, wordt door de werkgroep geadviseerd de vaccinaties, indien dat therapeutisch en logistiek mogelijk is (het influenzavaccin is immers seizoensgebonden), 4 weken voor de start van de biological te geven. Deze termijn is gekozen aangezien de effectiviteit van vaccinatie in verreweg de meeste studies op deze termijn is gebaseerd. Na een dergelijke periode zal de antistofrespons optimaal zijn. Indien voorafgaande vaccinatie niet mogelijk is, kan de vaccinatie tijdens biological-therapie worden gegeven. Hierop vormt het gebruik van rituximab een uitzondering: in de eerste 2 maanden na rituximab behandeling wordt geen antistofrespons op vaccinatie gevonden. Het lijkt daarom raadzaam om bij gebruik van dit middel ten minste 2 maanden met vaccinatie te wachten.
In de 1B teksten van alle biologicals wordt vermeld dat gebruik van levend verzwakt vaccin is gecontra-indiceerd. Bij ontbreken van studies op dit terrein wordt door de werkgroep deze aanbeveling overgenomen.
Onderbouwing
Achtergrond
IMID patiënten hebben een verhoogd risico op het optreden van infecties. Enerzijds is dit het gevolg van de onderliggende aandoening zelf, anderzijds wordt dit risico veroorzaakt door het gebruik van immuunsuppressieve medicijnen die nodig zijn voor de behandeling. Door patiënten te vaccineren, kan het beloop van infecties milder zijn of kunnen deze infecties worden voorkomen. Daarnaast neemt het reizen naar (sub)tropische landen toe waar patiënten worden geëxposeerd aan infecties die met vaccinaties kunnen worden voorkomen.
Kernvraag bij IMID patiënten die behandeld worden met biologicals is of vaccinaties veilig kunnen worden toegediend en of vaccintoediening leidt tot de beoogde bescherming.
Conclusies
|
Niveau 2 |
Van TNFα-blokkers is aangetoond dat het gebruik van deze middelen de effectiviteit van influenza- en pneumococcenvaccinatie niet of slechts gering beïnvloedt. De meeste patiënten die anti-TNFα gebruiken zullen derhalve na deze vaccinaties beschermd zijn.
B Elkayam et al, 2004; Mease et al, 2004; Fomin et al, 2006; Kapetanovic et al, 2006; Kapetanovic et al, 2007; Kaine et al, 2007; Visvanathan et al, 2007; Gelinck et al, 2008 |
|
Niveau 3 |
Ervaringen met rituximab zijn beperkt maar wijzen er op dat de respons op vaccinatie, zeker in de eerste maanden na rituximabgebruik, sterk is afgenomen.
C Gelinck et al, 2007; Oren et al, 2008; van Assen et al, 2009 |
|
Niveau 4 |
Er zijn onvoldoende studies naar het effect van tocelizumab, abatacept, ustekinumab of IL-1RA op de vaccinatierespons; er kan derhalve geen gefundeerde stellingname over effectiviteit en veiligheid van vaccinaties bij gebruik van deze middelen worden geformuleerd.
D Mening van de werkgroep |
|
Niveau 4 |
Er zijn onvoldoende gegevens over vaccinaties met andere, inclusief levend verzwakte, vaccins.
D Mening van de werkgroep |
Samenvatting literatuur
TNFα-blokkers
In diverse studies is het effect van TNFα-blokkers op de effectiviteit van vaccinaties bij IMID patiënten onderzocht. Elkayam et al (2004) vaccineerden 16 patiënten (11 met RA en 5 met SpA) die behandeld werden met een TNFα-blokker (infliximab of etanercept) met het 23-valente pneumococcenvaccin. Zij vergeleken de antistofrespons met die van 17 leeftijdgematchde RA patiënten voor 7 serotypen. Alhoewel er een significante stijging van het antistofniveau tegen pneumococcen in beide groepen plaatsvond, waren er in de met anti-TNFα behandelde groep meer patiënten die onvoldoende op de vaccinatie reageerden. Kaine et al.(2007) vaccineerden RA patiënten behandeld met adalimumab (n=99) en RA patiënten zonder adalimumab (in beide groepen gebruikte ongeveer de helft van de patiënten ook MTX) en vonden geen verschil in vorming van pneumococcen antistoffen. In beide groepen had de overgrote meerderheid 4 weken na vaccinatie een beschermende titer (respectievelijk 85.9% en 81.7 %). Ook bij patiënten met arthritis psoriatica lijkt het gebruik van TNFα-blokkers geen (negatief) effect te hebben op de respons op pneumococcenvaccinatie (Mease et al, 2004).
Fomin et al (2006) vaccineerden 82 RA patiënten en 30 gezonde controlepersonen en beoordeelden de respons op influenzavaccinatie 6 weken na vaccinatie. Daarbij bleken de RA patiënten een lagere respons te vertonen ten opzichte van de gezonde controles, hetgeen echter niet was geassocieerd met gebruik van anti-TNFα (infliximab of etanercept). In een studie met soortgelijke opzet werd het effect van influenzavaccinatie onderzocht in 64 RA patiënten behandeld met anti-TNF, vergeleken met 48 RA patiënten zonder anti-TNFα en 18 gezonde controles. Hoewel de gemiddelde anti-influenzatiters lager waren in de met anti-TNFα behandelde patiënten, werd geen verschil gevonden in het percentage patiënten dat een beschermende anti-influenza titer bereikte (Gelinck et al, 2008).
Kapetanovic et al (2007) vond eendere resultaten in een studie waarin 149 RA patiënten en 18 gezonde controles werden geïncludeerd Van de RA patiënten werden 50 behandeld met anti-TNFα en MTX, 62 met anti-TNFα alleen of in combinatie met een ander DMARD, en 37 met alleen MTX. In deze studie bleek de respons op vaccinatie in alle groepen voldoende effectief te zijn, maar deze was lager in de groepen patiënten behandeld met anti-TNFα in monotherapie of gecombineerd met DMARDs. In bovenbeschreven studie van Kaine et al werden alle patiënten tegelijkertijd ook gevaccineerd voor influenza en werden in beide groepen bij bijna alle patiënten protectieve titers antistoffen tegen influenza bereikt (respectievelijk (98% en 94.5 %).
Reactivatie van een Hepatitis B (HBV) infectie is een bekende complicatie bij het gebruik van immunosuppressieve middelen. Dit risico zou, op theoretische gronden, verder toenemen tijdens het gebruik van TNFα-blokkers. Bij patiënten met IBD zijn tot op heden in de literatuur 28 casussen met een HBV reactivatie beschreven (Shale, 2009). In hoeverre dit een daadwerkelijke toename van het aantal HBV reactivaties door gebruik van TNFα-blokkers betekent, is niet duidelijk. Preventieve HBV vaccinatie wordt dan ook vooralsnog niet aanbevolen.
Rituximab
In een studie met 4 RA patiënten, behandeld met rituximab, werd nagenoeg geen respons op influenzavaccinatie gevonden, terwijl de RA patiënten behandeld met infliximab (n=19) en de gezonde controles (n=20) een adequate respons lieten zien (Gelinck, 2007). Oren et al.(2008) onderzochten het effect van rituximab op de antistofrespons 4 weken na influenzavaccinatie: bij RA patiënten die rituximab gebruikten (n=14), RA patiënten zonder rituximab (n=29) en gezonde controles (n=21). Alhoewel alle patiënten een respons vertoonden, was deze significant lager in de rituximab groep, waarbij moet worden aangetekend dat de tijd tussen behandeling met rituximab en vaccinatie sterk varieerde. Recentelijk werd aangetoond dat in de eerste 2 maanden na behandeling geen respons optreedt en dat de respons op vaccinatie 6-10 maanden na rituximab gedeeltelijk herstelt (van Assen, et al, 2009).
Tocelizumab
In een studie (tot op heden uitsluitend gepubliceerd als abstract) werden 38 patiënten (28 met RA en 10 met de ziekte van Castleman) die behandeld werden met tociluzimab gevaccineerd met influenzavaccin. De respons op vaccinatie werd vergeleken met de respons verkregen in 15 RA patiënten behandeld met TNFα-blokkers en 24 RA patiënten behandeld met conventionele DMARDs. In deze studie bleek de respons op vaccinatie adequaat, en vergelijkbaar met die in de patiënten behandeld met TNFα-blokkers of DMARDs (Tsuru et al, 2008).
Overige biologicals
Over vaccinaties bij gebruik van andere biologicals als anakinra, abatacept en ustekinumab is geen informatie beschikbaar. Ook is geen informatie beschikbaar over vaccins anders dan DTP bij het gebruik van TNFα-blokkers en ritxuximab, zodat evidence voor het opstellen van richtlijnen voor tropenbezoek ontbreekt. Gebruik van levend vaccin wordt ontraden, overigens zonder wetenschappelijke onderbouwing of melding van ongunstig beloop of vaccinia (Saag et al, 2008).
Evidence tabellen
Vaccinaties en biologicals
|
Referentie
|
Mate van bewijs
Studie type
|
Aantal patiënten
|
Patiënten kenmerken
|
Inclusie criteria
|
Interventie
|
Controle
|
Follow-up duur
|
Uitkomstmaten
|
Resultaten
|
Overige opmerkingen
|
|
(1) Elkayam el at, 2004 |
Gecontrolleerd |
16 |
11 RA +anti-TNF 5 SpA + anti-TNF 17 RA |
Infliximab (3 mg/kg) of etanercept 2 x pw 25 mg |
23-valente pneumoccen vacc |
|
1 maand |
Gemiddelde antistof respons (GMC) Ontbreken seroprotectie (antistof <1 ug/ml) |
GMC identiek, meer patiënten op antiTNF blijven onbeschermd |
|
|
(2) Mease et al, 2004 |
Gecontrolleerd |
184 |
94 PsA + etanercept 90 PsA |
Leeftijd 18-70 Active ziekte |
23-valente pneumoccen vacc |
|
4 weken |
Pneumovacc: 2-voudige en 4-voudige titer stijging in tenminste 2 van de 5 geteste serotypen
|
Geen effect anti-TNF op respons |
Etanercept |
|
(3) Fomin et al, 2006 |
Gecontrolleerd |
82 |
22 RA + inflixmab 5 RA + etanercept
|
3 maand stabiele medicatie |
Influenza vaccinatie
|
30 gezonde controles (HC) |
6 weken |
4-voudige titerstijging of seroprotectie (≥40) GMT |
Geen effect anti-TNF op respons |
|
|
(4) Kapetanovic et al, 2006 |
Gecontrolleerd |
149 |
50 RA MTX +anti-TNF 62 RA anti-TNF 37 RA MTX
|
Patiënten op anti-TNF |
23-valente pneumoccen vacc |
47 gezonde controles (HC) |
4-6 weken |
Respons: 2-voudige titer stijging (2 serotypen getest)
|
Anti-TNF alleen hogere respons dan anti-TNF+MTX en MTX alleen |
Etanercept en infliximab |
|
(5) Kapetanovic et al, 2007 |
Gecontrolleerd |
149 |
50 RA MTX +anti-TNF 62 RA anti-TNF 37 RA MTX
|
Patiënten op anti-TNF |
Influenza vaccinatie |
18 gezonde controles (HC) |
4-6 weken |
GMT seroprotectie (≥40) |
Lagere respons in patiënten met TNF alleen of met MTX + TNF |
|
|
(6) Kaine et al, 2007 |
RCT |
208 |
99 RA + adalimumab 109 RA |
> 20 jaar; laatste anti-TNF > 2 mnd voor studie Excl: < 3 mnd influenza of pneumocoocen inf, vaccinatie < 3mnd, influenza vacc. < 6 mnd, pneumococcen vacc. < 6jr |
Influenza en 23-valente pneumoccen vacc 1 week na gift adalimumab of placebo. Ada ook op dag 15 en 29 |
|
4 weken |
Respons: Pneumovacc: 2-voudige titer stijging in tenminste 3 van de 5 geteste serotypen Influenzavacc: 4 voudige titer stijging in tenminste 2 van de 3 stammen |
Geen verschil in effectiviteit voor beide vaccinaties |
|
|
(7) Visvanathan et al, 2007 |
Gecontroleerd |
70 |
RA + MTX |
ASPIRE studie Excl: actieve infectie en vaccinatie binnen 5 jr |
23 valente pneumoccenvaccin 56 patiënten met anti-TNF (20 3 mg/kg IFX, 36 5 mg/kg IFX),14 zonder |
|
4 weken |
Respons: 2-voudige titer stijging in tenminste 6 van de 12 geteste serotypen |
Geen verschil door gebruik infliximab |
|
|
(8) Gelinck et al, 2008 |
Gecontroleerd |
112 |
79 RA 4 JIA 2 Still 14 PsA 1SpA 21 Crohn 1 IBD |
> 18 jaar Anti-TNF voor reumatische of inflammatoire darmziekte |
Influenza vaccinatie 64 patiënten met anti-TNF, 48 zonder
|
18 gezonde controles (HC) |
4 weken |
GMT Seroprotectie (≥40) |
GMT verlaagd in anti-TNF tov niet-TNF en HC Seroprotectie gelijk |
|
|
(10) Gelinck et al, 2007 |
Gecontroleerd |
23 |
4 RA met RTX 19 RA met anti-TNF |
Onbekend |
Influenza vaccinatie |
20 gezonde controles (HC) |
4 weken |
GMT
|
Significant verlaagde GMT in RTX tov anti-TNF en HC Anti-TNF niet verlaagd |
Vaccinatie op dag 84 na RTX bij minimale B-cel reconstitutie |
|
(11) Oren et al, 2008 |
Gecontroleerd |
43 |
14 RA +RTX 29 RA |
RTX behandeling |
Influenza vaccinatie
|
21 gezonde controles (HC) |
4 weken |
GMT respons tegen elk van de 3 serotypes |
Verminderde respons in RTX groep |
RTX behandeling tot 18 maanden voor vaccinatie |
|
(12) (abstact) Van Assen et al, 2009 |
Gecontrolleerd |
43 |
23 RA met RTX 20 met MTX 29 HC |
Onbekend |
Influenza vaccinatie |
|
4 weken |
Seroprotectie (>40) |
Geen respons op vaccinatie in eerste 2 maanden na RTX, partieel herstel na 6-10 maanden |
|
|
(13) (abstact) Tsuru et al, 2008 |
Gecontrolleerd |
38 |
28 RA 10 Catelaman 15 RA met anti-IL6 24 RA op DMARD |
Onbekend |
Influenza vaccinatie |
|
12 weken, , HAR elke 4 weken |
Seroprotectie (>40) |
Geen verschil tussen groepen in bereiken beschermende titer |
|
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-01-2011
Laatst geautoriseerd : 01-01-2011
Geplande herbeoordeling : 01-01-2014
De Nederlandse Vereniging voor Reumatologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. Uiterlijk in 2013 bepaalt de NVR of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De andere aan deze richtlijn deelnemende beroepsverenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid ten aanzien van het bewaken van de actualiteit van de aanbevelingen in de richtlijn. Hen wordt verzocht relevante ontwikkelingen binnen hun vakgebied kenbaar te maken aan de eerstverantwoordelijke.
Algemene gegevens
Met ondersteuning van de afdeling Ondersteuning Professionele Kwaliteit van de Orde van Medisch Specialisten. De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (= SKMS).
Doel en doelgroep
Deze richtlijn geeft een leidraad voor de dagelijkse praktijk van het gebruik van Biologicals. De richtlijn heeft een algemeen karakter, kan gebruikt worden om beroepsspecifieke richtlijnen te formuleren en biedt aanknopingspunten voor bijvoorbeeld lokale (instituuts- of regiogebonden) protocollen en/of zorgafspraken.
De richtlijn is primair geschreven voor medisch specialisten die patiënten met chronische ontstekingsziekten (IMID = Immune Mediated Inflammatory Disorders) behandelen met biologicals, alsmede voor deze patiënten zelf en hun overige behandelaars.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2009 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die met biologicals te maken hebben.
Bij het samenstellen van de werkgroep is rekening gehouden met geografische spreiding en evenredige vertegenwoordiging van verschillende verenigingen, ‘scholen’ en academische achtergrond. De werkgroepleden zijn door de wetenschappelijke verenigingen gemandateerd voor deelname en de samenstelling van de werkgroep is goedgekeurd door alle deelnemende wetenschappelijke verenigingen. De werkgroepleden zijn gezamenlijk verantwoordelijk voor de tekst.
- Dr. D.L. Baeten, reumatoloog, Academisch Medisch Centrum, Amsterdam
- Dr. M. Bijl, reumatoloog, Universitair Medisch Centrum Groningen
- Prof. dr. J.W.J. Bijlsma, reumatoloog, Universitair Medisch Centrum Utrecht (voorzitter)
- Dr. A.A. van Bodegraven, maag-, darm-, leverarts, VU Medisch Centrum, Amsterdam
- Dr. P.L.A. van Daele, internist-klinisch immunoloog, Erasmus Medisch Centrum, Rotterdam
- Prof. dr. M. Drent, longarts, Academisch Ziekenhuis Maastricht
- Mevr. drs. G.J. Geven, Reumapatiëntenbond, Amersfoort
- Mevr. drs. J.W. Hagemeijer, senior adviseur, Orde van medisch Specialisten, Utrecht
- Dr. T.L.Th.A. Jansen, reumatoloog, Medisch Centrum Leeuwarden
- Prof. dr. M.A.F.J. van de Laar, reumatoloog, Medisch Spectrum Twente, Enschede
- Prof. dr. R.B.M. Landewé, reumatoloog, Academisch Ziekenhuis Maastricht
- Prof. dr. W.F. Lems, reumatoloog, VU medisch centrum, Amsterdam
- Dr. M.T. Nurmohamed, reumatoloog, Jan van Breemen Instituut, Amsterdam
- Dr. E. Prens, dermatoloog, Erasmus Medisch Centrum, Rotterdam
- Mevr. drs. M.M.J.H. Scholte-Voshaar, Reumapatiëntenbond, Amersfoort
- Mevr. drs. M. Wessels, informatiespecialist, Orde van Medisch Specialisten, Utrecht
Belangenverklaringen
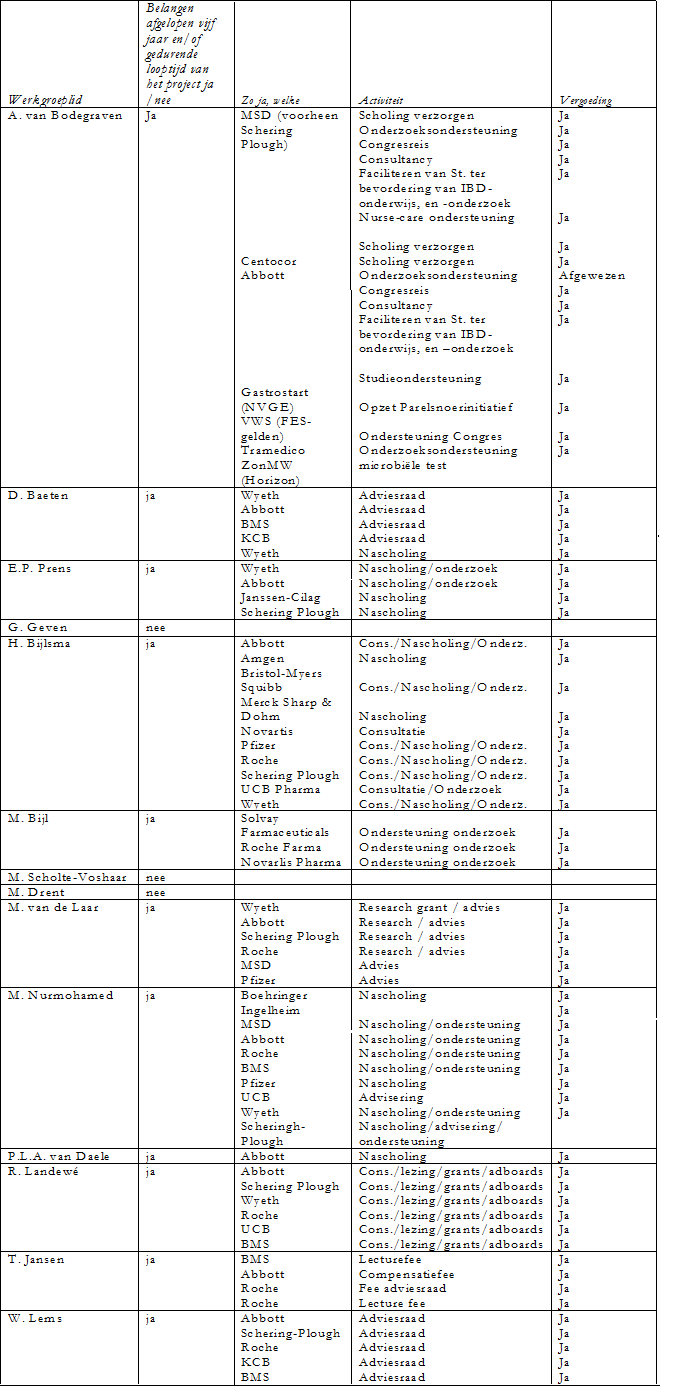
De werkgroepleden is gevraagd om aan te geven of er sprake is van een mogelijke belangenverstrengeling met commerciële bedrijven. Een overzicht hiervan is hieronder weergegeven. De verklaringen van werkgroepleden over mogelijke financiële belangenverstrengeling ligt ter inzage bij de afdeling Ondersteuning Professionele Kwaliteit van de Orde van Medisch Specialisten. Uit de ingevulde belangenverklaringen blijkt dat de werkgroepleden banden met de farmaceutische industrie hebben en dat deze banden gezien het onderwerp belangrijk zijn. Er wordt geconcludeerd dat deze banden geen invloed hebben gehad bij het totstandkomen van de richtlijn.
Inbreng patiëntenperspectief
Gedurende de ontwikkeling van de richtlijn is nadrukkelijk aandacht besteed aan het in kaart brengen van het patiëntenperspectief. In de werkgroep hebben twee patiëntenvertegenwoordigers zitting genomen en zij brachten het perspectief van de patiënten naar voren tijdens de bespreking van de teksten en de formulering van de aanbevelingen. Daarnaast is halverwege het traject een focusgroep georganiseerd waaraan 9 patiënten hebben deelgenomen. De uitgangsvragen zijn voorgelegd aan de leden van de focusgroep en hen is gevraagd naar hun ervaringen en overwegingen die zij van belang achten bij het formuleren van de aanbevelingen. Hiervan is een verslag gemaakt en aan de leden voorgelegd ter verifiëring en eventuele aanvulling. De leden van het schrijverscollectief hebben gebruikgemaakt van de inhoud van deze documentatie voor de formulering van overwegingen vanuit patiëntenperspectief. Een verslag hiervan is hieronder te vinden.
Patiëntenperspectief – verslag focusgroep
In totaal hebben 9 patiënten hun medewerking verleend aan het in kaart brengen van het patiëntenperspectief. Twee mannelijke patiënten met Sarcoidose met Remicade (via infuuskliniek (1 X p.m.) of Humira zelf injecteren (1X p.w.), één mannelijke patiënt met Psoriasis Enbrel zelf injecteren (1X p.w.), twee vrouwen met RA (Enbrel en Rituximab), één mannelijke patiënt met RA (Enbrel), twee vrouwelijke patiënten met Ziekte van Crohn (Humira en Remicade).
Drie personen waren aanwezig bij de focusgroepbijeenkomst die gehouden is op 12 november 2009. De overige 5 personen waren niet in staat om aanwezig te zijn en hebben op digitale wijze hun input geleverd door per uitgangsvraag hun ervaringen terug te koppelen.
Naast het bespreken van de ervaringen is ook gevraagd naar overwegingen die vanuit het perspectief van de patiënt van belang zijn en die naar hun idee meegewogen dienen te worden bij de formulering van de aanbevelingen.
Uit de besprekingen is naar voren gekomen dat de patiënten de geformuleerde uitgangsvragen complex vinden. De patiënten hebben aangegeven dat het maken van een patiëntenversie van de richtlijn belangrijk is omdat nog veel onduidelijk is over het gebruik van biologicals. Door het ontwikkelen van een patiëntenversie van de richtlijn ontvangen de patiënten een instrument waarmee zij ook kunnen bijdragen aan het goed en verantwoord gebruik van biologicals. Hierbij is als voorwaarde gesteld dat de patiëntenversie toegankelijk geschreven moet worden.
Alle deelnemers waren lid van een patiëntenvereniging en ervaren dit als zeer plezierig. Het geeft onder meer de mogelijkheid tot het uitwisselen van informatie met lotgenoten.
VOORAFGAANDE AAN DE BEHANDELING MET BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 1: - Patiënten geven aan dat de aanloop naar de behandeling met biologicals overwegend een langdurig proces is geweest. Er wordt overgegaan tot biologicals als alle andere behandelingsvormen niet blijken te helpen of te veel bijwerkingen veroorzaken. - Patiënten vinden het belangrijk dat alle aspecten die van belang zijn bij de behandeling van biologicals worden onderzocht, maar hebben geen zicht op welke aspecten dit dan moeten zijn. Zij geven aan dat het echter belangrijk is dat zij door de specialist of door de verpleegkundige deelgenoot worden gemaakt van het afwegingsproces door informatie te ontvangen zodat zij zelf actief kunnen meewerken aan het zorgproces. |
Overweging vanuit het patiëntenperspectief bij UV 2: - Patiënten vinden het belangrijk dat de arts door wie zij worden behandeld deskundig is, zodat zij erop kunnen vertrouwen in goede handen te zijn. - De (voorschrijvende) medisch specialist dient de regie in handen te houden en daarbij is het overleg met de andere betrokken professionals belangrijk. - Het is belangrijk dat de professionals communicatief zijn en duidelijk uitleg kunnen geven op niveau van de leek. Daarnaast is het wenselijk dat de medisch specialist toegankelijk en laagdrempelig is bij vragen; te weten via de telefoon of email. - Als het niet goed gaat met de patiёnt is het belangrijk dat de medisch specialist confronterend en direct is door aan te geven dat het helemaal niet goed gaat, dat de patiënt zich overvraagt of dat bijvoorbeeld gestopt moet worden met werken. Het is daarbij belangrijk dat de patiënt geen ruimte wordt gegeven om te marchanderen. - De partner is samen met de patiënt ziek en hiermee een essentiёle schakel die duidelijk betrokken behoort te worden in het zorgproces. |
BIJWERKINGEN VAN BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 3: - Patiënten vinden het belangrijk dat zij duidelijke en volledige (zowel schriftelijke als mondelinge) informatie ontvangen over de bijwerkingen die zich kunnen voordoen bij een behandeling met biologicals. - Patiënten vinden het belangrijk dat, als zij bijwerkingen ervaren, duidelijk is tot wie zij zich moeten richten, dus tot de huisarts of de medisch specialist. - Patiënten vinden het belangrijk dat, als zij bijwerkingen ervaren, hier serieus naar wordt gekeken en deskundig op wordt geacteerd. - Patiënten vinden het belangrijk dat zij instructies ontvangen wat zij zelf kunnen doen om bepaalde bijwerkingen te voorkomen. |
Overweging vanuit het patiëntenperspectief bij UV 4: - Patiënten vinden het belangrijk dat zij informatie ontvangen over de het risico op kanker bij biologicals. - Patiënten vinden het belangrijk dat zij actief worden gevolgd op het mogelijk ontstaan van kanker. |
ZWANGERSCHAP EN BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 5: Op basis van de focusgroep zijn geen overwegingen aan te dragen. |
BIOLOGICALS EN (OPERATIEVE) INGREPEN: |
Overweging vanuit het patiëntenperspectief bij UV 6: - Patiënten vinden het belangrijk dat de voorschrijvend specialist betrokken is bij het besluitvormingsproces van een operatie. Daarbij is het essentieel dat er direct contact is tussen de betrokken specialisten. - Patiënten vinden het belangrijk dat zij in bezit zijn van een ‘kaartje’ waarop staat dat zij biologicals gebruiken en dat met de specialist contact opgenomen moet worden in geval van tandheelkundige of operatieve ingrepen. - Patiënten vinden het belangrijk dat zij informatie ontvangen over de stappen die gezet moeten worden bij het staken of doorgaan van biologicals bij een operatie. Hierdoor zijn zij in staat zelf actief mee te werken en hebben meer het gevoel controle te hebben over hun behandeling met biologicals. |
FOLLOW-UP VAN DE BEHANDELING MET BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 7: - Patiënten vinden het belangrijk dat zij regelmatig (om de 3 tot 6 mnd) door de medisch specialist worden onderzocht waarbij de werking van de biologicals in kaart wordt gebracht. - Patiënten vinden het belangrijk dat zij worden geinformeerd over de uitslag van de periodieke controle zodat zij deelgenoot zijn van het zorgproces. - Patiënten geven aan geconfronteerd te worden met een veelheid aan informatiestromen die regelmatig tegenstrijdig zijn. Zij vinden het belangrijk dat hier meer regie over gevoerd gaat worden. - Patiënten vinden het belangrijk dat professionels aangeven wanneer men geen duidelijkheid ten aanzien van bepaalde vraagstukken kunnen geven omdat nog zoveel onbekend is bij de behandeling van biologicals. - Patiënten vinden het belangrijk regelmatig contact te hebben met de (specialistisch) verpleegkundige zodat zij eventuele vragen kan beantwoorden. |
BIOLOGICALS EN VACCINATIE: |
Overweging vanuit het patiëntenperspectief bij UV 8: - Patiënten vinden het belangrijk dat zij (tijdig) informatie ontvangen over welke vaccinaties zij toegediend kunnen krijgen. - Patiënten vinden het belangrijk dat zij informatie ontvangen bij welke verschijnselen, nadat zij een vaccinatie hebben ontvangen, zij contact op moeten nemen met de medisch speicalist. |
DE BEHANDELING MET BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 9: - Patiënten vinden het belangrijk dat de arts door wie zij worden behandeld deskundig is en over de meest recente inzichten beschikt zodat zij erop kunnen vertrouwen in goede handen te zijn. - De (voorschrijvende) medisch specialist dient de regie in handen te houden en daarbij is het overleg met de andere betrokken professionals belangrijk. - Het is belangrijk dat de professionals communicatief zijn en duidelijk uitleg kunnen geven op niveau van de leek. Daarnaast is het wenselijk dat de medisch specialist toegankelijk en laagdrempelig is bij vragen; te weten via de telefoon of email. - Als het niet goed gaat met de patiёnt is het belangrijk dat de medisch specialist confronterend en direct is door aan te geven dat het helemaal niet goed gaat, dat de patient zich overvraagt of dat bijvoorbeeld gestopt moet worden met werken. Het is daarbij belangrijk dat de patiënt geen ruimte wordt gegeven om te marchanderen. |
LANGDURIG VERBLIJF ELDERS: |
Overweging vanuit het patiëntenperspectief bij UV 10: - Patiënten vinden het belangrijk dat zij informatie ontvangen over: - hoe zij de biologicals het beste naar het buitenland kunnen vervoeren; - naar welke gebieden zij kunnen reizen; - de mogelijkheden om in het buitenland een infuus met biologicals te ontvangen.
|
Methode ontwikkeling
Evidence based
Implementatie
Tijdens de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de uitvoerbaarheid van de aanbevelingen. Daarbij is gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn is verspreid onder alle relevante beroepsgroepen en instellingen. Een samenvatting van de richtlijn is gepubliceerd in het Nederlands Tijdschrift voor Geneeskunde en in tijdschriften van de deelnemende wetenschappelijke verenigingen.
Werkwijze
De werkgroep heeft een jaar aan de totstandkoming van de richtlijn gewerkt. Binnen de werkgroep was een schrijverscollectief ingesteld. De leden van het schrijverscollectief zochten systematisch naar literatuur en beoordeelden kwaliteit en inhoud ervan. Vervolgens schreven zij een concepttekst waarin de literatuur werd verwerkt. Tijdens vergaderingen lichtten zij hun teksten toe aan de overige leden van de werkgroep. De conceptrichtlijn is in februari 2010 schriftelijk aan alle betrokken wetenschappelijke verenigingen aangeboden en gevraagd de richtlijn aan hun leden voor te leggen. Daarnaast is de richtlijn ook naar wetenschappelijke verenigingen gestuurd die niet in de werkgroep hebben geparticipeerd, te weten oogartsen, neurologen, gynaecologen en tandartsen. De ontvangen commentaren zijn, waar relevant bevonden, verwerkt in de definitieve richtlijn.
Wetenschappelijke onderbouwing
De onderbouwing van de richtlijn is mede gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht met systematische zoekacties. Er werd gezocht tussen 1998 en 2009 in Medline en Embase. Voor de oriënterende search werd ook gezocht in de Cochrane Library en werd specifiek gezocht naar al bestaande richtlijnen in online raadpleegbare (inter)nationale guideline clearinghouses.
Hierbij werd de taal gelimiteerd tot Nederlands, Engels, Duits en Frans. Daarnaast werden artikelen geëxtraheerd uit referentielijsten van opgevraagde literatuur. Dit leverde bij enkele uitgangsvragen nog aanvullende artikelen op.
Doordat de uitgangsvragen niet gericht waren op het beoordelen van de effectiviteit van de interventies maar veelal gingen over bijwerkingen, complicaties en diagnostiek bleek een beperking tot systematische reviews en RCTs vaak niet zinvol. De searches zijn verricht in mei en juni 2009. Voor alle uitgangsvragen is gebruik gemaakt van een uniforme formulering van de patiëntencategorie en de interventie.
Voor de gehanteerde zoektermen wordt verwezen naar Appendix 1. Op verzoek zijn de volledige zoekstrategieën beschikbaar. Daarnaast werden artikelen geëxtraheerd uit referentielijsten van opgevraagde literatuur en zijn enkele relevante publicaties tot 1 november 2009 meegenomen. Lopend onderzoek is buiten beschouwing gelaten. Abstracts van congressen van de afgelopen 2 jaar (november 2007 tot 1 november 2009) zijn meegenomen bij de selectie van de literatuur. Relevante informatie vanuit deze abstract wordt uitgewerkt bij de overige overwegingen. Onder samenvatting van de literatuur / conclusies worden alleen gepubliceerde onderzoeken / richtlijnen uitgewerkt.
De geselecteerde artikelen zijn beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is de standaardindeling gebruikt: zie tabel 1. Na selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De beoordeling van de verschillende artikelen is opgenomen onder het kopje ‘samenvatting van de literatuur’. Het wetenschappelijk bewijs is vervolgens kort samengevat in een ‘conclusie’. De belangrijkste literatuur waarop deze conclusie is gebaseerd staat bij de conclusie vermeld, inclusief de mate van bewijs (zie tabel 2).
Voor het formuleren van een aanbeveling zijn, naast het wetenschappelijk bewijs, vaak nog andere aspecten van belang, bijvoorbeeld patiëntenvoorkeuren, kosten, beschikbaarheid of organisatorische aspecten. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘overwegingen’. In de overige overwegingen spelen de ervaring en de mening van de werkgroepleden een belangrijke rol. De ‘aanbeveling’ is het resultaat van de combinatie van het beschikbare bewijs en de overige overwegingen.
Voor een aantal uitgangsvragen zijn evidencetabellen gemaakt en deze zijn te raadplegen in Appendix 3.
Tabel 1: Indeling van methodologische kwaliteit van individuele studies
|
|
Interventie |
Diagnostische accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohort-onderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiënt-controleonderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Tabel 2: Niveau van bewijs van de conclusie
|
Conclusie gebaseerd op |
|
|
1 |
Onderzoek van niveau A1 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
Eén onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
Eén onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Deze (concept)richtlijn is opgesteld aan de hand van het Appraisal of Guidelines for Research & Evaluation (AGREE) instrument. Dit instrument is in een Europees verband opgesteld om de procedurele kwaliteit van richtlijnen te kunnen beoordelen. Door de aspecten van AGREE te verwerken in de inleiding van de richtlijn, wordt duidelijk aan welke kwaliteitseisen is voldaan.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
