Perioperatief beleid bij behandeling met bDMARD’s
Uitgangsvraag
Welk perioperatief beleid dient gehanteerd te worden om de veiligheid te waarborgen van patiënten die met biologische (b)DMARD’s behandeld worden en een operatieve ingreep, inclusief tandheelkundige ingrepen, moeten ondergaan?
Aanbeveling
Aanbeveling-1
- Continueer bij patiënten met een laag risico op infecties en/of bij laagrisico ingrepen de bDMARD’s.
- Maak bij hoogrisico patiënten en/of bij hoogrisico ingrepen een individuele risicoschatting en besluit in overleg met de operateur of het staken van de bDMARD noodzakelijk is.
- Neem bij de besluitvorming van het al dan niet perioperatief staken van bDMARD’s voor een electieve ingreep het individuele risico op complicaties en opvlammingen van de ziekteactiviteit in acht.
- Laat spoedeisende operaties doorgaan ongeacht het gebruik en type bDMARD. Wees hierbij alert op infectieuze complicaties.
Aanbeveling-2
Let bij het perioperatief staken van bDMARD’s en het bepalen van de duur van het staken op de specifieke farmacokinetische en farmacodynamische eigenschappen (onder andere de halfwaardetijd) van de gebruikte bDMARD.
Aanbeveling-3
Neem in acht dat bij gebruik van IL-6-remmers postoperatieve complicaties gemaskeerd kunnen zijn omdat er geen CRP-stijging optreedt.
Aanbeveling-4
- Neem hierbij het individuele risico op infectie en het risico op wondinfectie bij een bepaalde ingreep in acht.
- Enkel het gebruik een bDMARD is geen reden voor het toedienen van antibioticaprofylaxe.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Om de uitgangsvraag te beantwoorden is er een systematisch literatuuronderzoek verricht naar het effect van stoppen/aanpassen van de dosering van een behandeling met een biologische (b)DMARD in vergelijkingen met het continueren van deze behandeling bij patiënten met reumatoïde artritis (RA), spondyloartritis (SpA) en artritis psoriatica (PsA) die een operatieve ingreep ondergaan. Op basis van één recente systematische review, met alleen bewijs uit retrospectieve cohortstudies, met problemen van inconsistentie en onnauwkeurigheid, kunnen geen eenduidige conclusies getrokken worden met betrekking tot voor- en nadelen van het perioperatief stoppen/aanpassen van dosering van bDMARD’s in vergelijking met doorgaan met bDMARD’s bij patiënten met RA, PsA, of SpA. Hierbij moet echter aangemerkt worden dat hoewel het bewijskracht laag is, dat dit onderzoek laat zien dat de incidentiecijfers van infecties en vertraagde wondheling zeer laag zijn, terwijl in vergelijking de incidentie van opvlammingen van de ziekteactiviteit bij stoppen van bDMARD’s hoger is; dit is meegewogen bij het formuleren van de aanbevelingen.
Informatie uit aanvullende literatuur
Aanvullende literatuur wijst op het mogelijk belang van het in acht nemen van de verschillende farmacokinetische eigenschappen van bDMARD’s, die van invloed kunnen zijn op niet alleen de besluitvorming van het al dan niet perioperatief staken van bDMARD’s, maar ook op het bepalen van de duur van het eventuele staken. Zo lijkt het op basis van farmacokinetische eigenschappen van bDMARD’s niet altijd zinvol om een bDMARD slechts voor de duur van 1 interval te staken. Uit onderzoek blijkt dat bepaalde bDMARD’s (bijv., adalimumab) tot 6 maanden na het staken in bloed te detecteren zijn (Berkhout, 2019). Hiernaast kan het farmacodynamisch effect langer voortduren terwijl het middel in bloed niet meer aantoonbaar is.
Tocilizumab (IL-6-remmer) onderdrukt CRP-stijging en koorts (Bari, 2013; Fujiwara, 2009; Kopf, 1994; Nguyen, 2013; Yanagawa, 2012). Hierdoor zijn bij gebruik van tocilizumab de conventionele indicatoren voor een infectie niet betrouwbaar en kunnen postoperatieve complicaties gemaskeerd worden in de eerste 1-2 maanden na een toediening van tocilizumab. Dit geldt ook voor andere IL-6-remmers.
Recente westerse richtlijnen adviseren in veel gevallen om bDMARD’s perioperatief te staken:
- In de richtlijnen van ‘British Society for Rheumatology’ voor veilig gebruik van bDMARD’s uit 2019 (Holroyd, 2019) wordt op basis van conflicterend, lage kwaliteit bewijs de aanbeveling gedaan om de bDMARD’s tenminste 1 doseringsinterval te staken. Rituximab wordt geadviseerd 3-6 maanden voor de electieve operatie te staken. Verder adviseren ze tocilizumab subcutaan 2 weken en tocilizumab intraveneus 4 weken voor de electieve operatie te staken. Bij operaties met hogere infectierisico wordt aanbevolen de bDMARD voor een duur van 3-5 maal de halfwaarde tijd van de specifieke bDMARD te staken.
- Vergelijkbaar met de Britse richtlijn, wordt in de richtlijn van ‘American College of Rheumatology/American Association of Hip and Knee Surgeons’ voor perioperatieve management van patiënten met inflammatoire artritis en systemische lupus erythematodus, die een electieve totale heup/knie prothese operatie ondergaan uit 2022 (Goodman, 2022), onder voorbehoud (gezien het ontbreken van vergelijkend onderzoek), aanbevolen om bij patiënten met RA, PsA, SpA en JIA alle bDMARD’s voor de duur van 1 doseringsinterval te staken. Er wordt ruimte gegeven om bijvoorbeeld bij moeilijk te behandelen patiënten de bDMARD’s perioperatief te continueren ter voorkomen van toename van de ziekteactiviteit. In deze richtlijn worden patiënten met ernstige SLE als aparte categorie beschouwd. In deze patiëntengroep kan zowel rituximab, belimumab als anifrolumab gecontinueerd worden. Wel wordt er een aanbeveling gedaan op welk moment de operatie gepland dient te worden.
- In de ‘the German Society for Rheumatology’ voor perioperatieve management van patiënten met inflammatoire artritis uit 2023 (Albrecht, 2023) wordt ook aanbevolen om operaties na het verstrijken van een doseringsinterval in te plannen. Hierbij geven ze aan dat er geen bewijs is dat het continueren van TNF-remmers leidt tot hogere postoperatieve risico’s. Bij gebruik van rituximab bevelen ze op basis van expert opinion aan de operatie 4 maanden na de laatste gift en 4 weken voor de volgende gift in te plannen. Verder geven ze bij gebruik van rituximab ter overweging aan bij hoog-risico operaties preoperatief de immunoglobuline levels te bepalen en bij immunoglobuline levels kleiner dan 4g/L profylactisch immunoglobulines toe te dienen.
Praktijkervaring
In de klinische praktijk worden bDMARD’s over het algemeen voor een duur van 2 tot 4 weken gestaakt voorafgaand aan een ingreep. Bij gebrek aan eenduidige aanbevelingen wordt er op basis van eerdere ervaringen van zowel behandelaren en patiënten en het geschatte infectierisico een beslissing genomen om al dan niet perioperatief bDMARD’s te staken en het moment van staken. Dit kan leiden tot heterogeen beleid.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Patiënten die behandeld worden met bDMARD’s zijn zich over het algemeen bewust van hun immuun-gecompromitteerde status en hebben vaak de vraag of zij wel door moeten gaan met bDMARD’s wanneer zij een operatieve ingreep moeten ondergaan. Patiënten vinden het dan ook belangrijk dat, naast de bij de operatie betrokken specialist, de voorschrijver van de bDMARD betrokken is bij het opstellen van het perioperatieve beleid. Een directe samenwerking tussen de betrokken specialisten is daarbij essentieel. Om zelf actief mee te kunnen werken en controle te hebben over hun behandeling is het voor patiënten belangrijk dat ook zij worden meegenomen in de bepaling van het perioperatieve beleid. Hierbij zullen factoren zoals thuissituatie, werksituatie, hoe lang de ziekte stabiel is en eerdere ervaringen met tijdelijk stoppen een rol spelen. Nu er geen harde bewijzen zijn voor het al dan niet preoperatieve staken van bDMARD’s, dienen het individuele risico op complicaties en opvlammingen en de mate van risico van de operatie meegewogen te worden en met de patiënt besproken te worden om tot een gedeelde besluitvorming te komen.
Kosten (middelenbeslag)
Zowel het staken als het continueren van bDMARD’s kan het kostenplaatje beïnvloeden. Indien door het perioperatief staken van bDMARD’s een hoge ziekteactiviteit ontstaat, dan gaat dat mogelijk gepaard met hogere kosten van andere soorten medicatie en/of van bDMARD’s postoperatief. De hogere ziekteactiviteit kan leiden tot uitstel van de operatie. Hogere doseringen van corticosteroïden om de ziekteactiviteit te verminderen kunnen leiden tot een slechtere uitkomst van de operatie. Daarbij kan een verhoogde ziekteactiviteit in sommige gevallen langdurig zijn. Aanhoudende ziekteactiviteit leidt tot verminderde kwaliteit van leven en verminderde arbeidsparticipatie. Om die reden kan het continueren van bDMARD’s doelmatiger zijn. Echter, hetzelfde zou kunnen gelden voor het perioperatief continueren van bDMARD’s indien dit gepaard gaat met postoperatieve complicaties. Ook postoperatieve complicaties gaan gepaard met hogere medicatiekosten, kunnen daarbij tot een langere ligduur in het ziekenhuis leiden en een verminderde arbeidsparticipatie tot gevolg hebben. Er zijn geen duidelijke aanwijzingen in de literatuur dat er een verhoogd risico is op complicaties bij continueren van bDMARD’s.
Aanvaardbaarheid, haalbaarheid en implementatie
Er heerst bij een deel van behandelaren het gevoel dat het perioperatief staken van bDMARD’s niet altijd zinvol is. Het is van belang dat behandelaren bDMARD’s niet als één groep beschouwen, maar voor iedere bDMARD een afzonderlijke afweging maken. Om dit te bewerkstelligen, zullen de behandelaren inzicht moeten krijgen in de specifieke kenmerken, farmacokinetiek en farmacodynamiek van de verschillende bDMARD’s. De perioperatieve zorg voor patiënten die een laag risico op infecties hebben en bij laagrisico ingrepen kan gestandaardiseerd worden. Prospectieve, gerandomiseerde studies waarin het al dan niet perioperatief continueren van bDMARD’s onderzocht wordt, zullen helpen bij het vergroten van de aanvaardbaarheid en bij implementatie van aanbevolen perioperatief beleid ten aanzien van bDMARD’s.
Rationale van aanbeveling-1
Patiënten met een inflammatoire reumatische ziekte hebben een verhoogd risico op peri- en postoperatieve complicaties. Het individuele risico is onder meer afhankelijk van de mate van ziekteactiviteit van de onderliggende reumatische ziekte. Hoge ziekteactiviteit en dientengevolge gebruik van corticosteroïden leiden tot een hoger risico op infecties. Om die reden is het van belang voorafgaand aan een electieve ingreep lage ziekteactiviteit te bewerkstellingen en zo nodig hierbij bDMARD’s toe te passen.
Uit literatuur is bekend dat staken van bDMARD’s kan leiden tot hoge ziekteactiviteit en ontstaan van schade. In het geval van een opvlamming kunnen doorgaans corticosteroïden toegepast worden. De behandeling is echter gericht om het gebruik van steroïden te minimaliseren en zoals eerder genoemd leidt het gebruik van steroïden tot een hoger risico op peri- en/of postoperatieve complicaties. Hiernaast zorgt hoge ziekteactiviteit voor een lagere kwaliteit van leven en verminderde arbeidsparticipatie.
Om de risico’s op peri- en postoperatieve complicaties en hoge ziekteactiviteit te voorkomen dienen de potentiële voordelen (bijv. voorkomen van postoperatieve infecties) van staken van bDMARD’s afgewogen te worden tegen het risico op optreden van hoge ziekteactiviteit. Wetenschappelijk onderzoek naar effect van al dan niet perioperatief staken van bDMARD’s is schaars en van beperkte kwaliteit. De beschreven literatuur bestaat uit retrospectieve cohorten en omvat met name het gebruikt van TNF-remmers. De meeste studies rapporteren een laag risico op postoperatieve infecties (in de orde van grootte van 3%) en van gestoorde wondgenezing (1-2%). Zelfs als de incidentie van deze complicaties zou stijgen met 15-50%, dan blijft nog steeds het absolute risico laag. Dat lage risico in combinatie met een aanzienlijk risico op opvlamming van het ziektebeeld pleit tegen het perioperatief staken van bDMARD’s.
Rationale van aanbeveling-2
Op basis van farmacokinetische eigenschappen van bDMARD’s is het niet zinvol om de bDMARD’s slechts voor de duur van 1 doseerinterval te staken, omdat de meeste geneesmiddelen doorgaans een halfwaardetijd van enkele weken hebben. Dit betekent dat na een doseringsinterval nog een aanzienlijk deel van het geneesmiddel en zijn immuunmodulerende effecten in het lichaam aanwezig is. Uit onderzoek blijkt dat bepaalde bDMARD’s tot 6 maanden na het staken in bloed te detecteren zijn, bijv. adalimumab (Berkout, 2019). Hiernaast kan het farmacodynamisch effect langer voortduren terwijl het middel in het bloed niet meer aantoonbaar is.
Rationale van aanbeveling-3
IL-6-remmers onderdrukken CRP-stijging. Hierdoor wordt de monitoring van postoperatieve complicaties in de eerste een tot twee maanden na een IL-6-remmer gift belemmerd. Patiënten die tocilizumab krijgen, dienen postoperatief nauwlettender vervolgd te worden aangezien de conventionele indicatoren voor een infectie niet betrouwbaar zijn.
Rationale van aanbeveling-4
Enkel op basis van het gebruik van DMARD’s is er geen indicatie om antibiotische profylaxe toe te dienen. De algemeen geldende preprocedurele antibiotica protocollen dienen gevolgd te worden. Op basis van het individuele risico op infectie en het risico op wondinfectie bij een specifieke ingreep zoals beschreven in de Swab Richtlijn ‘perioperatieve profylaxe’ uit 2019, kan een inschatting gemaakt worden of er een indicatie is voor antibioticaprofylaxe.
De richtlijn ‘Antibioticaprofylaxe bij gewrichtsprothese’ van de Nederlands Orthopedische Vereniging uit 2016 geeft aan dat bij patiënten met verlaagde immuniteit (en die hiervoor DMARD’s gebruiken) er geen directe indicatie is voor antibioticaprofylaxe bij tandheelkundige ingrepen.
In de richtlijn van European Society of Cardiologie over management van endocarditis (Delgado, 2023) worden patiënten met verminderde immuniteit niet als een risicogroep beschreven die antibiotische profylaxe nodig hebben ter voorkomen van endocarditis bij tandheelkundige behandelingen.
Bij overige niet steriele ingrepen zoals oculaire ingrepen, endoscopieën en dermatologische chirurgie worden geen eenduidige uitspraken gedaan over antibioticaprofylaxe bij immuungecompromitteerde patiënten.
Onderbouwing
Achtergrond
In de dagelijkse praktijk komt het regelmatig voor dat een patiënt met een reumatische aandoening zoals reumatoïde artritis (RA), Spondyloartritis (SpA) en artritis psoriatica (PsA) een operatie moet ondergaan, die al of niet gerelateerd is aan het onderliggende ziektebeeld. Als zij een (electieve) operatieve ingreep moeten ondergaan dan doet zich veelal de vraag voor of het nuttig en nodig is om de onderhoudsbehandeling met bDMARD’s tijdelijk te onderbreken. Redenen om de behandeling tijdelijk te onderbreken zijn onder meer een gestoorde wondgenezing bij gebruik van het betreffende geneesmiddel, of een verhoogd risico op infectieuze complicaties. Hier tegenover staat dat het tijdelijk onderbreken van medicatie tot exacerbatie van de ziekte kan leiden. Opereren bij exacerbatie of hoge ziekteactiviteit kan weer een verhoogd operatierisico geven. Richtlijnen over het al of niet onderbreken van deze anti-reumatische medicatie ontbreken. Dit leidt tot praktijkvariatie en verwarring.
Conclusies / Summary of Findings
Effects of perioperative discontinuation of bDMARDs versus continuation of bDMARDs
|
Very low GRADE |
The evidence is very uncertain about the effect of discontinuing biological DMARDs perioperatively on the prevalence of surgical site infections when compared with continuing biological DMARDs perioperatively in patients with rheumatoid arthritis, psoriatic arthritis, or spondylarthritis undergoing elective surgery.
Source: van Duren (2022) |
|
Very low GRADE |
The evidence is very uncertain about the effect of discontinuing biological DMARDs perioperatively on the prevalence of delayed wound healing when compared with continuing biological DMARDs perioperatively in patients with rheumatoid arthritis, psoriatic arthritis, or spondylarthritis undergoing elective surgery.
Source: van Duren (2022) |
|
Very low GRADE |
The evidence is very uncertain about the effect of discontinuing biological DMARDs perioperatively on the prevalence of disease flares when compared with continuing biological DMARDs perioperatively in patients with rheumatoid arthritis, psoriatic arthritis, or spondylarthritis undergoing elective surgery.
Source: van Duren (2022) |
|
No GRADE |
No evidence was found regarding the effect of discontinuing biological DMARDs perioperatively on the prevalence of serious adverse events when compared with continuing biological DMARDs perioperatively in patients with rheumatoid arthritis, psoriatic arthritis or spondylarthritis undergoing elective surgery.
Source: van Duren (2022) |
Effects of perioperative altered dosing of bDMARDs versus continuation of bDMARDs
|
No GRADE |
No evidence was found regarding the effect of altered dosing of biological DMARDs perioperatively on any outcome when compared with continuing biological DMARDs perioperatively in patients with rheumatoid arthritis, psoriatic arthritis or spondylarthritis undergoing elective surgery.
Source: None. |
Samenvatting literatuur
Description of study
Van Duren, 2022 is a systematic review with meta-analysis examining the benefit/harm of withholding versus continuing bDMARDs on three outcomes, all in line with our PICO, surgical site infections, delayed wound healing, and disease flares in patients who underwent orthopedic surgical procedures. Studies were selected if they were written in English and met the above-described PICO. The authors included eleven studies, all retrospective cohort studies published between 2005 and 2020, with bDMARDs withheld in 4959 patients and continued in 2385 patients (total n=7344). Most patients in the included studies had RA, but also patients with SpA, PsA, psoriasis, and inflammatory bowel disease were included. One very small study (Fabiano, 2014; n=10) only included patients with psoriasis, and another small study (Scherrer, 2013; n=171) included juvenile arthritis patients besides RA, PsA, and SpA patients possibly resulting in a younger mean population, but the population mean was not reported. Studies mostly included patients on TNF-inhibitors adalimumab, etanercept, and infliximab (Bakkour, 2016; Berthold, 2013; Bongartz, 2008; Den Broeder, 2007; Fabiano, 2014; Ruyssen-Witrand, 2007; Scherrer, 2013; Talwalkar, 2005). George (2017) only included patients on infliximab. In addition to TNF-inhibitors, Fabiano (2014) included ustekinumab, Scherrer (2013) rituximab and abatacept, and George (2019) only included patients on abatacept.
The quality of the included studies was examined with the Newcastle-Ottawa Scale. Relevant study characteristics were reported if available. The seven smallest of the included studies (Bakkour, 2016; Bongartz, 2008; Fabiano, 2014; Ruyssen-Witrand, 2007; Scherrer, 2013; Talwalkar, 2005; Wendling, 2005; 10 ≤ n ≤ 171) failed to report possible confounders such as age and sex. Van Duren considered five of these studies to have a high risk of bias (Bakkour, 2016; Fabiano, 2014; Scherrer, 2013; Talwalkar, 2005; Wendling, 2005). The four largest of the included studies (Berthold, 2013; Den Broeder, 2007; George, 2017; George, 2019; 196 ≤ n ≤ 3131) did report basic possible confounders and were considered to have a low risk of bias. However, overall, Van Duren (2022) reports variation between included studies in procedures, included bDMARDs, timing of interruption of bDMARDs, and definitions of outcomes. The included studies failed to report on comorbidity, bDMARD dosing differences, and concomitant use of csDMARDs, thus confounding by different risk profiles could not be excluded. Follow-up time and loss to follow-up were not reported by Van Duren (2022). A low risk of publication bias was confirmed by means of a funnel plot.
Results
In meta-analyses, the discontinuation of bDMARDs (intervention) was compared to the continuation of bDMARDs (control/comparison). The comparison between altered dosing and continued dosing of bDMARDs could not be examined due to a lack of data. Results were pooled per outcome and the following outcomes - as reported by Van Duren (2022) - were examined: surgical site infections, delayed wound healing, and disease flares. No data regarding serious adverse events were reported by Van Duren (2022). When possible, a subanalysis per outcome was done including only studies with a low risk of bias.
Effects of perioperative discontinuation of bDMARDs versus continuation of bDMARDs
Surgical site infections (crucial)
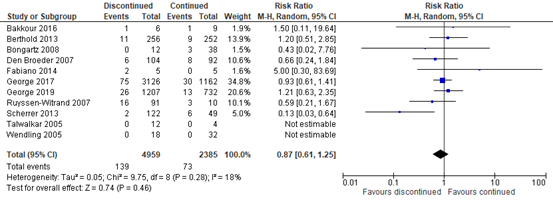
Surgical site infections were reported in all eleven studies included in Van Duren (2022; Bakkour, 2016; Berthold, 2013; Bongartz, 2008; Den Broeder, 2007; Fabiano, 2014; George, 2017; George, 2019; Ruyssen-Witrand, 2007; Scherrer, 2013; Talwalkar, 2005; Wendling, 2005; total n=7344). Meta-analysis of these studies showed that surgical site infections occurred in 2.80% (139/4959) of patients who discontinued bDMARDs perioperatively compared with 3% (73/2385) of patients who continued bDMARDs. This resulted in a Risk Ratio (RR) of 0.87 in favor of perioperative discontinuation of bDMARDs, i.e., those who discontinued bDMARDs perioperatively had a 13% reduction in risk of developing a surgical site infection compared to those who continued bDMARDs. However, the relative risk reduction was not clinically important and the true value was uncertain with a confidence interval (CI) ranging from a 39% clinically important reduction in risk to a borderline clinically important 25% increase in risk (RR 0.87, 95% CI 0.61 to 1.25; see figure 1).
Subanalysis, only including the four largest studies (196 ≤ n ≤ 3131) with a low risk of bias (Berthold, 2013; Den Broeder, 2007; George, 2017; George, 2019; total n=6931), more clearly seemed to indicate a lack of difference between groups in the risk of surgical site infections with a RR of 0.99, but again with uncertainty due to a confidence interval ranging from a RR indicating a clinically important benefit of perioperative discontinuation of bDMARDs to a RR indicating clinically important harm (RR 0.99, 95% CI 0.72 to 1.35).
Figure 1. Effect of discontinuing versus continuing bDMARDs on surgical site infections
Delayed wound healing (important)
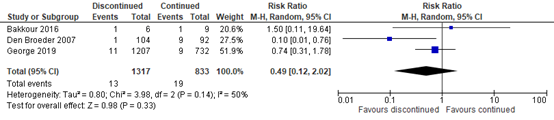
Delayed wound healing was an outcome in three studies (Bakkour, 2016; Den Broeder, 2007; George, 2019; total n=2150). Meta-analysis of these studies showed delayed wound healing in 0.99% (13/1317) of patients discontinuing bDMARDs perioperatively as compared to 2.28% of patients continuing bDMARDs. This resulted in a RR of 0.49, meaning patients who discontinued bDMARDs perioperatively had a clinically important 51% reduction in risk of delayed wound healing as compared to those who continued bDMARDs. However, the confidence interval ranged from an 88% reduction in risk to a 102% increase in risk of delayed wound healing for those who discontinued bDMARDs perioperatively as compared to those who continued bDMARDs (RR 0.49, 95% CI 0.12 to 2.02; see figure 2).
Subanalysis, only including the two studies with a low risk of bias (Den Broeder, 2007; George 2019; total n=2135) yielded a comparable result, indicating a group difference in favor of the group who discontinued bDMARDs, but with the true risk ratio remaining uncertain with a confidence interval ranging from a RR indicating a clinically important benefit of perioperative discontinuation of bDMARDs to a RR indicating clinically important harm (RR 0.33, 95% CI 0.04 to 2.47).
Figure 2. Effect of discontinuing versus continuing bDMARDs on delayed wound healing
Disease flares (important)
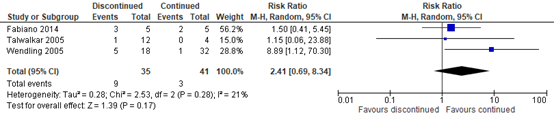
Disease flares were examined in three small studies (10 ≤ n ≤ 50), all with a high risk of bias (Fabiano, 2014; Talwalkar, 2005; Wendling, 2005; total n=76). Meta-analysis of these studies showed disease flares in 25.71% (9/35) of patients discontinuing bDMARDs perioperatively as compared to 7.32% of patients continuing bDMARDs. This resulted in a RR of 2.41, meaning that patients who discontinued bDMARDs perioperatively had an 141% increase in risk of getting a disease flare as compared to those continuing bDMARDs perioperatively (RR 2.41). However, the confidence interval trespassed both borders of clinical importance, including the possibility of a 31% decrease in risk, no group difference, as well as a 734% increase in risk of getting a disease flare when discontinuing bDMARDs as compared to those continuing bDMARDs (RR 2.41, 95% CI 0.69 to 8.34; see figure 3).
Figure 3. Effect of discontinuing versus continuing bDMARDs on disease flares
Serious adverse events (important)
There are no data available on serious adverse events.
Effects of perioperative altered dosing of bDMARDs versus continuation of bDMARDs
There are no data available.
Level of evidence of the literature
Effects of perioperative discontinuation of bDMARDs versus continuation of bDMARDs
Surgical site infections (crucial)
The level of evidence regarding the possible effect of discontinuing bDMARDs as compared to continuing bDMARDs perioperatively on the outcome ‘surgical site infections’ started low because all included studies were observational studies and was further downgraded to very low because of imprecision (-1 level), with the overall 95% CI overlapping ‘no effect’ and crossing the cut-off for a clinically important benefit of discontinuation of bDMARDs.
Delayed wound healing (important)
The level of evidence regarding the possible effect of discontinuing bDMARDs as compared to continuing bDMARDs perioperatively on the outcome ‘delayed wound healing’ started low because all included studies were observational studies and was further downgraded to very low because of inconsistency in results (-1) and because of imprecision (-2), with the overall 95% CI overlapping ‘no effect’ and crossing the cut-offs for both clinically important benefit and clinically important harm of discontinuation of bDMARDs.
Disease flares (important)
The level of evidence regarding the possible effect of discontinuing bDMARDs as compared to continuing bDMARDs perioperatively on the outcome ‘disease flares’ started low because all included studies were observational studies and was further downgraded to very low because of serious imprecision (-2) due to small sample size and the overall 95% CI overlapping ‘no effect’ and crossing the cut-offs for both clinically important benefit and clinically important harm of discontinuation of bDMARDs.
Serious adverse events (important)
No evidence was found regarding the possible effect of discontinuing bDMARDs as compared to continuing bDMARDs perioperatively on the outcome ‘serious adverse events.’ The level of evidence was not assessed due to a lack of data.
Effects of perioperative altered dosing of bDMARDs versus continuation of bDMARDs
No evidence was found regarding the possible effect of altered dosing of bDMARDs as compared to continuing bDMARDs perioperatively on any outcome. The level of evidence was not assessed due to lack of data.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the benefits/harms of perioperative discontinuation or altered dosing of biological DMARDs (bDMARDs) compared to perioperative continuation of bDMARDs in patients with rheumatoid arthritis (RA), psoriatic arthritis (PsA) or spondylarthritis (SpA) undergoing elective surgery?
| P: | patients with RA, PsA, or SpA treated with bDMARDs and undergoing elective surgery |
| I: | perioperative discontinuation or altered dosing of bDMARDs |
| C: | perioperative continuation of bDMARDs |
| O: |
adverse events/postoperative complications, i.e. (surgical site) infections, delayed wound healing, disease activity (flares), serious adverse events |
Relevant outcome measures
- A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
- The working group predefined ‘(surgical site) infections’ as a critical outcome and both ‘delayed wound healing’ and ‘disease activity (flares)’ as important outcome measures for decision-making.
- The working group defined values for minimal clinically (patient) important differences per outcome measure; they were equal to standard cut-offs. All reported outcomes were dichotomous variables; for all outcomes, a Risk Ratio (RR) above 1.25 or below 0.8 was considered to indicate a clinically important difference between groups.
Search and select (Methods)
On the 2nd of May 2023, a systematic search was performed in the databases Embase.com and Ovid/Medline for systematic reviews and RCTs on surgery in patients with rheumatoid arthritis, psoriatic arthritis or spondylarthritis treated with biological DMARDs. The search resulted in 286 unique hits. Studies were selected based on the following criteria:
- They should be a systematic review (SR) or a randomized controlled trial (RCT);
- published since 2010;
- be in line with our PICO.
Initially, seven systematic reviews (SR) were selected based on title and abstract screening. After reading the full text, one SR was selected. Six papers were excluded (see the table with reasons for exclusion under the tab ’Evidence tabellen’).
Results
One paper, a SR (Van Duren, 2022) was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The quality assessment is summarized in the table of quality assessment for systematic reviews of RCTs and observational studies.
Referenties
- Albrecht K, Poddubnyy D, Leipe J, Sewerin P, Iking-Konert C, Scholz R, Krüger K. Perioperative management of patients with inflammatory rheumatic diseases : Updated recommendations of the German Society for Rheumatology. Z Rheumatol. 2023 Jan;82(Suppl 1):1-11. English. doi: 10.1007/s00393-021-01150-9. Epub 2022 Mar 2. PMID: 35235025.
- Bari SF, Khan A, Lawson T. C reactive protein may not be reliable as a marker of severe bacterial infection in patients receiving tocilizumab. BMJ Case Rep. 2013 Oct 31;2013:bcr2013010423. doi: 10.1136/bcr-2013-010423. PMID: 24177456; PMCID: PMC3822052.
- Berkhout LC, l'Ami MJ, Ruwaard J, Hart MH, Heer PO, Bloem K, Nurmohamed MT, van Vollenhoven RF, Boers M, Alvarez DF, Smith CH, Wolbink GJ, Rispens T. Dynamics of circulating TNF during adalimumab treatment using a drug-tolerant TNF assay. Sci Transl Med. 2019 Jan 30;11(477):eaat3356. doi: 10.1126/scitranslmed.aat3356. PMID: 30700574.
- Delgado V, Ajmone Marsan N, de Waha S, Bonaros N, Brida M, Burri H, Caselli S, Doenst T, Ederhy S, Erba PA, Foldager D, Fosbøl EL, Kovac J, Mestres CA, Miller OI, Miro JM, Pazdernik M, Pizzi MN, Quintana E, Rasmussen TB, Risti? AD, Rodés-Cabau J, Sionis A, Zühlke LJ, Borger MA; ESC Scientific Document Group. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J. 2023 Oct 14;44(39):3948-4042. doi: 10.1093/eurheartj/ehad193. Erratum in: Eur Heart J. 2023 Sep 20;: Erratum in: Eur Heart J. 2024 Jan 1;45(1):56. PMID: 37622656.
- Fujiwara H, Nishimoto N, Hamano Y, Asanuma N, Miki S, Kasayama S, Suemura M. Masked early symptoms of pneumonia in patients with rheumatoid arthritis during tocilizumab treatment: a report of two cases. Mod Rheumatol. 2009;19(1):64-8. doi: 10.1007/s10165-008-0111-7. Epub 2008 Aug 30. PMID: 18758893.
- Goodman SM, Springer BD, Chen AF, Davis M, Fernandez DR, Figgie M, Finlayson H, George MD, Giles JT, Gilliland J, Klatt B, MacKenzie R, Michaud K, Miller A, Russell L, Sah A, Abdel MP, Johnson B, Mandl LA, Sculco P, Turgunbaev M, Turner AS, Yates A Jr, Singh JA. 2022 American College of Rheumatology/American Association of Hip and Knee Surgeons Guideline for the Perioperative Management of Antirheumatic Medication in Patients With Rheumatic Diseases Undergoing Elective Total Hip or Total Knee Arthroplasty. J Arthroplasty. 2022 Sep;37(9):1676-1683. doi: 10.1016/j.arth.2022.05.043. Epub 2022 Jun 19. PMID: 35732511.
- Holroyd CR, Seth R, Bukhari M, Malaviya A, Holmes C, Curtis E, Chan C, Yusuf MA, Litwic A, Smolen S, Topliffe J, Bennett S, Humphreys J, Green M, Ledingham J. The British Society for Rheumatology biologic DMARD safety guidelines in inflammatory arthritis. Rheumatology (Oxford). 2019 Feb 1;58(2):e3-e42. doi: 10.1093/rheumatology/key208. Erratum in: Rheumatology (Oxford). 2019 Feb 1;58(2):372. PMID: 30137552.Kopf M, Baumann H, Freer G, Freudenberg M, Lamers M, Kishimoto T, Zinkernagel R, Bluethmann H, Köhler G. Impaired immune and acute-phase responses in interleukin-6-deficient mice. Nature. 1994 Mar 24;368(6469):339-42. doi: 10.1038/368339a0. PMID: 8127368.
- Nguyen MT, Pødenphant J, Ravn P. Three cases of severely disseminated Staphylococcus aureus infection in patients treated with tocilizumab. BMJ Case Rep. 2013 Jan 2;2013:bcr2012007413. doi: 10.1136/bcr-2012-007413. PMID: 23283607; PMCID: PMC3603831.
- van Duren BH, Wignall A, Goodman S, Hewitt C, Mankia K, Pandit H. The Effect of Perioperative Biologic Disease-Modifying Anti-Rheumatic Drugs on the Risk of Postoperative Complications: Surgical Site Infection, Delayed Wound Healing, and Disease Flares Following Orthopaedic Surgical Procedures. J Bone Joint Surg Am. 2022 Jun 15;104(12):1116-1126. doi: 10.2106/JBJS.21.00811. Epub 2022 Feb 17. PMID: 35175994.
- Yanagawa Y, Hirano Y, Kato H, Iba T. The absence of typical pneumonia symptoms in a patient with rheumatoid arthritis during tocilizumab and steroid treatment. BMJ Case Rep. 2012 May 23;2012:bcr0220125835. doi: 10.1136/bcr.02.2012.5835. PMID: 22669023; PMCID: PMC3369370.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What are the benefits/harms of perioperative discontinuation or altered dosing of biological DMARD’s (bDMARD’s) compared to perioperative continuation of bDMARD’s in patients with with rheumatoid arthritis (RA), psoriatic arthritis (PsA) or spondylarthritis (SpA) undergoing elective surgery?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison/ control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Van Duren, 2022
|
SR and meta-analysis of RCTs and cohort studies
MEDLINE,Embase, and PubMed Central databases were searched up to April 2021.
11 included studies: A: George, 2019 B: George, 2017 C: Bakkour, 2016 D: Fabiano, 2014 E: Berthold, 2013 F: Scherrer, 2013 G: Bongartz, 2008 H: Den Broeder, 2007 I: Ruyssen-Witrand, 2007 J: Talwalkar, 2005 K: Wendling, 2005
Study design: Only retrospective cohort studies were found /included.
Setting and Country: Not reported.
Source of funding and conflicts of interest: All authors filled out a disclosure form. Two had received consultancy fees, but not in relation to this study. No external funding was received for this study. |
Inclusion criteria SR: Inclusion criteria were established that adhered to the PICO approach. Population = patients who underwent orthopaedic surgical procedures and who were taking bDMARD’s. Intervention = withholding bDMARD use during the perioperative period. Comparator = continuing bDMARD use during the perioperative period. Outcomes = SSI (both deep and superficial), delayed wound healing, and disease flares. Only articles published in English were included.
Exclusion criteria SR: None reported.
Important patient characteristics at baseline:
BDMARD’s continued N, diagnosis, mean (SD/range) age, sex, bDMARD’s A: 732, RA, 67.5 ± 10, 104 M, 628 F, Abatacept B: 1162, RA, PsA, Ps, AS, IBD, 70 (66-75), 238 M, 924 F, Infliximab C: 9, PsA, Ps, N/R, N/R, Etanercept, adalimumab, infliximab D: 5, Ps, N/R, N/R, Infliximab, adalimumab, ustekinumab, etanercept E: 252, RA, 59 ± 15, 55% F, Infliximab, etanercept, adalimumab F: 49, RA, PsA, JA, SA, N/R, N/R, Etanercept, adalimumab, infliximab, rituximab, abatacept G: 38, RA, N/R, N/R, Etanercept, adalimumab H: 92, RA, 57 ± 13, 17M, 75F, Etanercept, adalimumab, infliximab I: 10, RA, SA, N/R, N/R, etanercept, adalimumab, infliximab J: 4, RA, PsA, N/R, N/R, etanercept, adalimumab, infliximab K: 32, RA, N/R, N/R, N/R
BDMARD’s discontinued time of interruption subgroups, N, diagnosis, mean (SD/range) age, sex, bDMARD’s A:
B:
C: No subgroups, 6, PsA, Ps, N/R, N/R, Etanercept, adalimumab, infliximab D: No subgroups, 5, Ps, N/R, N/R, Infliximab, adalimumab, ustekinumab, etanercept E: No subgroups, 256, RA, 55 ± 18, 75% F, Infliximab, etanercept, adalimumab F: No subgroups, 122, RA, PsA, JA, SA, N/R, N/R, Etanercept, adalimumab, infliximab, rituximab, abatacept G: No subgroups, 12, RA, N/R, N/R, TNFi H: No subgroups, 104, RA, 54 ± 16, 26 M, 78 F, Etanercept, adalimumab, infliximab I:
J: No subgroups, 12, RA, PsA, N/R, N/R, Etanercept, adalimumab, infliximab K: No subgroups, 18, RA, N/R, N/R, N/R
Groups comparable at baseline? Unclear. |
Describe intervention: Withholding bDMARD’s peri-operatively.
Time of interruption variable.
|
Describe control: Coninuing bDMARD’s peri-operatively
|
End-point of follow-up:
Follow-up time per included study not reported in the SR.
For how many participants were no complete outcome data available? (intervention/control)
Not reported in the SR.
|
Surgical Site Infection (SSI) Effect measure: OR [95% CI]: A: 0.82 (0.42, 1.61) B: 1.08 (0.70, 1.66) C: 0.63 (0.03, 12.41) D: 0.13 (0.00, 3.52) E: 8.37 (1.63, 43.06) F: 0.82 (0.34, 2.03) G: 2.46 (0.12, 51.14) H: 1.56 (0.52, 4.66) I: 2.01 (0.47, 8.62) K: N/R, not estimable
Pooled effect (fixed effects model): 1.11 [95% CI 0.82 to 1.49] indicating similar odds for SSI for group continuing and group discontinuing bDMARD’s perioperatively. Heterogeneity (I2): 21%
Delayed wound healing Effect measure: OR [95% CI]: A: 1.35 (0.56, 3.28) C: 0.63 (0.03, 12.41) H: 11.17 (1.39, 89.95)
Pooled effect (random effects model): 2.16 [95% CI 0.48 to 9.85] indicating that it is unclear if odds for delayed wound healing are higher for group continuing bDMARD’s as compared to group discontinuing bDMARD’s perioperatively. Heterogeneity (I2): 50%
Disease flares Effect measure: OR [95% CI]: D: 0.44 (0.04, 5.58) J: 0.85 (0.03, 25.05) K: 0.08 (0.01, 0.79)
Pooled effect (fixed effects model): 0.22 [95% CI 0.05 to 0.95] favoring continuing with bDMARD’s perioperatively as compared to discontinuing bDMARD’s perioperatively. Heterogeneity (I2): 0%
|
Risk of bias (high, some concerns or low): Tool used by authors: Newcastle-Ottawa Scale for non-randomized studies A: Low risk B: Low risk C: High risk D: High risk E: Low risk F: High risk G: High risk* H: Low risk I: High risk* J: High risk K: High risk
*NB: Studies G and I received points for compatibility although they did not report possible confounders such as age and sex. According to the tool/authors, they would nevertheless be considered good/low risk studies. I downgraded them to poor quality/high risk studies.
Brief description of author’s conclusion: Findings suggest that patients may not be at an increased risk for developing infection or wound complications if bDMARD’s are continued but are at an increased risk for disease flare if bDMARD’s are withheld. However, conclusions are limited by the retrospective and heterogenous nature of the data, and possibly by a lack of study power.
Personal remarks on study quality, conclusions, and other issues:
GRADE (per comparison and outcome measure) including reasons for down/upgrading: Not specified per outcome. Authors only report: GRADE analysis found the quality of evidence to be very low or low for all analyses, indicating a possibility that the true effect may differ substantially from the estimates presented. |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Van Duren, 2022 |
Yes |
Yes |
Yes |
Yes |
Unclear Authors report that three of 11 included studies reported the use of concomitant cDMARD’s and adjusted results for the confounding effect. Seven of 11 included studies did not report population age or gender. Included studies also failed to report on comorbidity and bDMARD dosing differences. If analyses were adjusted for potential confounders is unclear. |
Yes |
Unclear Seven of 11 included studies did not report population age or gender. Authors report variation between included studies in procedures, included bDMARD’s timing of interruption, and definitions of outcomes. Authors do not systematically report on other confounders such as comorbidity and additional medications, bDMARD dosing differences. They do say that the included studies often did not provide this information. |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Albrecht, K., Poddubnyy, D., Leipe, J., Sewerin, P., Iking-Konert, C., Scholz, R., & Krüger, K. (2023). Perioperative management of patients with inflammatory rheumatic diseases: Updated recommendations of the German Society for Rheumatology. Zeitschrift für Rheumatologie, 82(Suppl 1), 1-11. |
Recommendation article with narrative review. |
|
Berber, O., et al. "Do Biologic Agents Increase the Risk of Infection in Patients Undergoing Lower Limb Arthroplasty Surgery?." Current Rheumatology Reviews 14.1 (2018): 46-52. |
Not in line with PICO. Included studies examine wrong comparison. When bDMARD’s are used, they are always discontinued and comparison is no recent bDMARD’s vs no DMARD’s/csDMARD’s. |
|
Choi, Y. M., Debbaneh, M., Weinberg, J. M., Yamauchi, P. S., Van Voorhees, A. S., Armstrong, A. W., ... & Wu, J. J. (2016). From the Medical Board of the National Psoriasis Foundation: Perioperative management of systemic immunomodulatory agents in patients with psoriasis and psoriatic arthritis. Journal of the American Academy of Dermatology, 75(4), 798-805. |
In line with PICO, but all included studies are covered by newer SR and MA by Van Duren, 2022. |
|
Goodman, S. M., Springer, B. D., Chen, A. F., Davis, M., Fernandez, D. R., Figgie, M., ... & Singh, J. A. (2022). 2022 American College of Rheumatology/American Association of Hip and Knee Surgeons guideline for the perioperative management of antirheumatic medication in patients with rheumatic diseases undergoing elective total hip or total knee arthroplasty. The Journal of Arthroplasty, 37(9), 1676-1683. |
Not in line with PICO. Included studies examine wrong comparison. When bDMARD’s are used, they are always discontinued and comparison is no recent bDMARD’s vs no DMARD’s/csDMARD’s. |
|
Mabille, C., Degboe, Y., Constantin, A., Barnetche, T., Cantagrel, A., & Ruyssen-Witrand, A. (2017). Infectious risk associated to orthopaedic surgery for rheumatoid arthritis patients treated by anti-TNFalpha. Joint Bone Spine, 84(4), 441-445. |
In line with PICO, but all included studies are covered by newer SR and MA by Van Duren, 2022. |
|
Mamaril-Davis, J. C., Aguilar-Salinas, P., Avila, M. J., Villatoro-Villar, M., & Dumont, T. M. (2022). Perioperative management of disease-modifying antirheumatic drugs for patients undergoing elective spine surgery: a systematic review. European Spine Journal, 31(4), 815-829. |
Not in line with PICO. Included studies examine wrong medication (stop/continuing of csDMARD’s only) and/or wrong comparison csDMARD’s vs bDMARD’s. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-03-2025
Beoordeeld op geldigheid : 28-02-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de behandeling van patiënten met biological DMARD’s of targeted synthetic DMARD’s die worden ingezet bij inflammatoire reumatische aandoeningen (o.a. reumatoïde artritis (RA), spondylitis ankylopoietica (SpA), artritis psoriatica (PsA)). De werkgroep realiseert zich dat de middelen ook voor andere indicaties worden ingezet, zoals bij overige auto-immuunziekten, en gaat ervan uit dat in essentie hiervoor de regels van verantwoord gebruik niet anders zullen zijn.
Werkgroep
- Dr. D. (David) ten Cate (voorzitter), reumatoloog, werkzaam in Sint Maartenskliniek, NVR.
- Dr. M. (Marlies) van der Goes, reumatoloog, werkzaam in Meander Medisch Centrum, NVR.
- Dr. P. (Pascal) de Jong, reumatoloog, werkzaam in Erasmus Medisch Centrum, NVR.
- Dr. G.J. (Gerrit Jan) Wolbink, reumatoloog, werkzaam in Reade, NVR.
- Drs. S. (Sadaf) Atiqi, AIOS reumatologie, werkzaam in Reade, NVR.
- R. (René) van der Knaap, patiëntvertegenwoordiger, ReumaZorg Nederland.
- MSc. M.J. (Marieke) van Leijden, patiëntvertegenwoordiger, ReumaNederland.
- S.P. (Silvia) van der Windt, reumaverpleegkundige, werkzaam in Reinier de Graaf ziekenhuis, V&VN.
- Dr. J.C.E.M. (Josianne) ten Berge, oogarts, werkzaam in Erasmus Medisch Centrum, NOG.
- Dr. T. (Thijs) Giezen, ziekenhuisapotheker, werkzaam in Apotheek Spaarne Gasthuis, NVZA.
- Dr. T (Teun) van Gelder, internist – klinisch farmacoloog, werkzaam in Leids Universitair Medisch Centrum, NIV/NVKFB.
Klankbordgroep
- Dr. A.E. (Andrea) van der Meulen – de Jong, maag-darm-leverarts, werkzaam in Leids Universitair Medisch Centrum, NVMDL.
- Drs. B.J.M. (Barbara) Bergmans, arts-microbioloog, werkzaam in Labmicta, NVMM.
Met ondersteuning van
- Dr. T. Hoekstra, senior adviseur (vanaf juni 2024), Kennisinstituut van Federatie Medisch Specialisten.
- Dr. C.L. Overman, adviseur (tot december 2023), Kennisinstituut van de Federatie Medisch Specialisten.
- Dr. B.H. Stegeman, senior adviseur, Kennisinstituut van Federatie Medisch Specialisten.
- Dr. M.M.A. Verhoeven, adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
- Mw. A. van der Wal, medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. D. (David) ten Cate (voorzitter) |
reumatoloog, werkzaam in Sint Maartenskliniek |
Geen |
Geen |
Geen |
|
Dr. M. (Marlies) van der Goes |
reumatoloog, werkzaam in Meander Medisch Centrum |
Geen |
Geen |
Geen |
|
Dr. P. (Pascal) de Jong |
reumatoloog, werkzaam in Erasmus Medisch Centrum |
Geen |
Deelgenomen aan diverse adviesraden voor: Abbvie, Lilly; Bristol-Myers Squibb; Pfizer; Sanofi Genzyme; Galapagos; AstraZeneca & UCB. Verzorgen van onderwijs uit naam van de industrie: Galapagos; Pfizer; Novartis; Lilly & Abbvie |
Deelname aan adviesraad neerleggen gedurende richtlijnontwikkeling. Restrictie ten aanzien van besluitvorming van een module follow-up (Deze module gaat over de effectiviteit van de middelen, de andere modules meer over het 'veilig gebruik') |
|
Dr. G.J. (Gerrit Jan) Wolbink |
reumatoloog, werkzaam in Reade |
Werkzaam bij Sanquin. lid Covid werkgroep NVR Werkgroep Immuungecompromiteerden Covid vaccinatie RIVM. |
Extern gefinancierd onderzoek: ADORA Todora COVIDARC ZonMW |
Restrictie m.b.t. besluitvorming module 'follow up' |
|
Drs. S. (Sadaf) Atiqi |
AIOS reumatologie, werkzaam in Reade |
Geen |
Extern gefinancierd onderzoek: Therapeutic drug monitoring to optimise treatment with adalimumab in rheumatoid arthritis patients. |
Geen |
|
R. (René) van der Knaap |
patiëntvertegenwoordiger, ReumaZorg Nederland |
Geen |
Geen |
Geen |
|
MSc. M.J. (Marieke) van Leijden |
patiëntvertegenwoordiger, ReumaNederland |
Geen |
Geen |
Geen |
|
S.P. (Silvia) van der Windt |
reumaverpleegkundige, werkzaam in Reinier de Graaf ziekenhuis |
Geen |
Geen |
Geen |
|
Dr. J.C.E.M. (Josianne) ten Berge |
oogarts, werkzaam in Erasmus Medisch Centrum |
Geen |
Geen |
Geen |
|
Dr. T. (Thijs) Giezen |
ziekenhuisapotheker, werkzaam in Apotheek Spaarne Gasthuis |
Lid, Biosimilar Working Party, EMA, Amsterdam (onbetaald) t/m 2023 Extern expert CBG, Utrecht (onbetaald) t/m 2023 0-uren aanstelling, Division of Pharmacoepidemiology and Clinical Pharmacology, UIPS, Utrecht (onbetaald)
Vanaf 2024: Lid van de Medische AdviesRaad van Sanquin. De werkzaamheden voor Sanquin betreffen het non-profit gedeelte (de Bloedbank). |
Als co-promotor betrokken geweest bij 2 promotietrajecten welke gefinancierd zijn door het CBG en de Saudi FDA. |
Geen |
|
Dr. T (Teun) van Gelder |
internist – klinisch farmacoloog, werkzaam in Leids Universitair Medisch Centrum |
Klinisch Farmacoloog bij CCMO. Spreker en consulting vergoedingen ontvangen van Roche Diagnostics, Thermo Fisher, Vitaeris, CSL Behring, Astellas and Aurinia Pharma. In alle gevallen is de donatie aan de ziekenhuis rekening gedaan, dus geen persoonlijke betalingen. Geen aandelen of werkzaamheden voor deze bedrijven. |
Extern gefinancierd onderzoek: Ministerie van VWS, geneesmiddel-ontwikkeling ZonMW, IMProving symptomatic treatment with Amifampridine; a randomized double-blinded, placebo controlled AntiCancer Fund, Adaptive therapy in metastatic castration resistant prostate cancer Medical Delta Talent Acceleration Call 2021 A Biofilm-dissolving Gel to Eradicate Cardiac Bacterial Infections during Surgery KNMP, Klinisch redeneren door de apotheker |
Deelname aan adviesraad neerleggen gedurende richtlijnontwikkeling. Geen aanvullende restricties. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van patiëntenorganisatiesin de werkgroep. De opzet van de module Organisatie van Zorg is in samenspraak met de patiëntenorganisaties opgezet. De conceptrichtlijn is tevens voor commentaar voorgelegd aan verschillende patiëntenverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wet kwaliteit, klachten en geschillen zorg (Wkkgz).
Bij de richtlijn is conform de Wkkgz een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële negatieve financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Perioperatief bDMARD’s |
Geen substantiële financiële gevolgen. |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de huidige zorg middels een schriftelijke knelpuntenanalyse. Tijdens deze knelpuntenanalyse werd aan vertegenwoordigers vanuit verschillende organisaties gevraagd hun input te leveren met als doel te inventariseren welke knelpunten men ervaarde rondom de te ontwikkelen richtlijn. De resultaten hiervan zijn opgenomen onder aanverwante producten (zie Bijlage Reacties schriftelijke knelpunteninventarisatie). Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch en/of patiëntrelevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Search and select’. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet een-op-een vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert-opinie. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Embase.com
|
No. |
Query |
Results |
|
#10 |
#6 AND #8 NOT #9 = RCT |
109 |
|
#9 |
#6 AND #7 = SR |
93 |
|
#8 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3775360 |
|
#7 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
921505 |
|
#6 |
#5 AND [2010-2023]/py |
1068 |
|
#5 |
#4 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
1508 |
|
#4 |
#1 AND #2 AND #3 |
3136 |
|
#3 |
'surgery'/exp/mj OR 'surgical patient'/exp/mj OR 'surgical risk'/exp/mj OR 'postoperative complication'/exp/mj OR 'perioperative period'/exp/mj OR 'perioperative medicine'/exp/mj OR surgic*:ti,ab,kw OR surger*:ti,ab,kw OR operation*:ti,ab,kw OR operative:ti,ab,kw OR presurg*:ti,ab,kw OR 'pre surg*':ti,ab,kw OR preoperati*:ti,ab,kw OR 'pre operati*':ti,ab,kw OR perisurg*:ti,ab,kw OR 'peri surg*':ti,ab,kw OR perioperati*:ti,ab,kw OR 'peri operati*':ti,ab,kw OR postsurg*:ti,ab,kw OR 'post surg*':ti,ab,kw OR postoperati*:ti,ab,kw OR 'post operati*':ti,ab,kw OR laparoscop*:ti,ab,kw OR intraoperati*:ti,ab,kw |
5510767 |
|
#2 |
'rheumatoid arthritis'/exp/mj OR 'rheumatic disease'/de OR 'arthritis deformans':ti,ab,kw OR 'arthrosis deformans':ti,ab,kw OR 'beauvais disease*':ti,ab,kw OR 'chronic articular rheumatism':ti,ab,kw OR 'chronic polyarthriti*':ti,ab,kw OR 'chronic rheumatoid arthriti*':ti,ab,kw OR 'inflammatory arthriti*':ti,ab,kw OR 'polyarthritis rheumatica':ti,ab,kw OR 'rheumarthriti*':ti,ab,kw OR 'rheumatic arthriti*':ti,ab,kw OR 'rheumatic polyarthriti*':ti,ab,kw OR 'rheumatoid arthriti*':ti,ab,kw OR 'rheumatoid polyarthriti*':ti,ab,kw OR rheumatic:ti OR 'antirheumatic':ti OR 'psoriatic arthritis'/exp/mj OR 'alibert bazin disease':ti,ab,kw OR (((arthrit* OR arthropath* OR polyarthrit* OR rheumat*) NEAR/2 (psoriatic* OR psoriasis)):ti,ab,kw) OR 'spondylarthritis'/exp/mj OR 'spine arthriti*':ti,ab,kw OR 'spondylarthr*':ti,ab,kw OR 'spondyloarthr*':ti,ab,kw OR 'vertebral arthriti*':ti,ab,kw OR 'vertebral osteo arthriti*':ti,ab,kw OR 'vertebral osteoarthriti*':ti,ab,kw OR 'ankylosing spondyl*':ti,ab,kw OR bechterew*:ti,ab,kw OR 'marie struempell':ti,ab,kw OR 'marie strumpell':ti,ab,kw OR 'rheumatoid spondyliti*':ti,ab,kw OR 'spondylitis ankylopoietica*':ti,ab,kw OR 'spinal arthriti*':ti,ab,kw |
334274 |
|
#1 |
'disease modifying antirheumatic drug'/exp AND biologic*:ti,ab,kw OR bdmard*:ti,ab,kw OR (((dmard* OR 'disease modifying antirheumatic' OR 'disease modifying anti rheumatic') NEAR/4 biologic*):ti,ab,kw) OR 'biological therapy'/de OR 'biologic* therap*':ti,ab,kw OR biotherap*:ti,ab,kw OR 'cell and tissue based therap*':ti,ab,kw OR 'tissue therap*':ti,ab,kw OR ((biologic* NEAR/2 (agent* OR therap* OR treatment* OR medic* OR drug* OR pharmaceutic*)):ti,ab,kw) OR 'biologicals':ti,ab,kw OR biologics:ti,ab,kw OR biopharmaceutical*:ti,ab,kw OR ((('immun* suppress*' OR immunosuppress* OR 'immune depress*') NEAR/3 (therap* OR treatment* OR medication* OR drug* OR agent*)):ti,ab,kw) OR 'tumor necrosis factor inhibitor'/exp OR 'tumor necrosis factor'/exp OR 'tnf alfa':ti,ab,kw OR 'tnf alpha':ti,ab,kw OR tnfα:ti,ab,kw OR 'tnf α':ti,ab,kw OR 'cachectin':ti,ab,kw OR 'cachetin':ti,ab,kw OR cachexin:ti,ab,kw OR ((('tissue necros*' OR 'tumor necros*' OR 'tumour necros*') NEAR/2 (factor* OR serum)):ti,ab,kw) OR (((tnf* OR 'tissue necros*' OR 'tumor necros*' OR 'tumour necros*') NEAR/3 (inhibit* OR block* OR anti OR antagonist)):ti,ab,kw) OR 'adalimumab'/exp OR 'adalimumab':ti,ab,kw OR 'adaly':ti,ab,kw OR 'amgevita':ti,ab,kw OR 'amjevita':ti,ab,kw OR 'amsparity':ti,ab,kw OR 'cinnora':ti,ab,kw OR 'cyltezo':ti,ab,kw OR 'exemptia':ti,ab,kw OR 'fyzoclad':ti,ab,kw OR 'hadlima':ti,ab,kw OR 'halimatoz':ti,ab,kw OR 'hefiya':ti,ab,kw OR 'hukyndra':ti,ab,kw OR 'hulio':ti,ab,kw OR 'humira':ti,ab,kw OR 'hyrimoz':ti,ab,kw OR 'idacio':ti,ab,kw OR 'imraldi':ti,ab,kw OR 'kromeya':ti,ab,kw OR 'libmyris':ti,ab,kw OR 'mabura':ti,ab,kw OR 'qletli':ti,ab,kw OR 'raheara':ti,ab,kw OR 'solymbic':ti,ab,kw OR 'sulinno':ti,ab,kw OR 'trudexa':ti,ab,kw OR 'yuflyma':ti,ab,kw OR 'yusimry':ti,ab,kw OR 'etanercept'/exp OR 'altebrel':ti,ab,kw OR 'avent':ti,ab,kw OR 'benepali':ti,ab,kw OR 'brenzys':ti,ab,kw OR 'davictrel':ti,ab,kw OR 'embrel':ti,ab,kw OR 'enbrel':ti,ab,kw OR 'enerceptan':ti,ab,kw OR 'erelzi':ti,ab,kw OR 'etacept':ti,ab,kw OR 'etanar':ti,ab,kw OR 'etanercept':ti,ab,kw OR 'eticovo':ti,ab,kw OR 'infinitam':ti,ab,kw OR 'lifmior':ti,ab,kw OR 'nepexto':ti,ab,kw OR 'opinercept':ti,ab,kw OR 'reumatocept':ti,ab,kw OR 'tunex':ti,ab,kw OR 'yisaipu':ti,ab,kw OR 'infliximab'/exp OR 'avakine':ti,ab,kw OR 'avsola':ti,ab,kw OR 'flixabi':ti,ab,kw OR 'inflectra':ti,ab,kw OR 'infliximab':ti,ab,kw OR 'ixifi':ti,ab,kw OR 'remicade':ti,ab,kw OR 'remsima':ti,ab,kw OR 'renflexis':ti,ab,kw OR 'revellex':ti,ab,kw OR 'zessly':ti,ab,kw OR 'certolizumab'/exp OR 'certolizumab':ti,ab,kw OR 'certolizumab pegol'/exp OR 'cimzia':ti,ab,kw OR 'simziya':ti,ab,kw OR 'xcimzane':ti,ab,kw OR 'tocilizumab'/exp OR 'actemra':ti,ab,kw OR 'atlizumab':ti,ab,kw OR 'lusinex':ti,ab,kw OR 'roactemra':ti,ab,kw OR 'tocilizumab':ti,ab,kw OR 'sarilumab'/exp OR 'kevzara':ti,ab,kw OR 'sarilumab':ti,ab,kw OR 'anakinra'/exp OR 'anakinra':ti,ab,kw OR 'antril':ti,ab,kw OR 'kineret':ti,ab,kw OR 'raleukin':ti,ab,kw OR 'interleukin 1 receptor antagonist protein':ti,ab,kw OR 'canakinumab'/exp OR 'canakinumab':ti,ab,kw OR 'ilaris':ti,ab,kw OR 'secukinumab'/exp OR 'cosentyx':ti,ab,kw OR 'scapho':ti,ab,kw OR 'secukinumab':ti,ab,kw OR 'ixekizumab'/exp OR 'ixekizumab':ti,ab,kw OR 'taltz':ti,ab,kw OR 'ustekinumab'/exp OR 'stelara':ti,ab,kw OR 'stellara':ti,ab,kw OR 'ustekinumab':ti,ab,kw OR 'guselkumab'/exp OR 'guselkumab':ti,ab,kw OR 'tremfya':ti,ab,kw OR 'rituximab'/exp OR 'acellbia':ti,ab,kw OR 'blitzima':ti,ab,kw OR 'cimabior':ti,ab,kw OR 'halpryza':ti,ab,kw OR 'kikuzubam':ti,ab,kw OR 'mabthera':ti,ab,kw OR 'redditux':ti,ab,kw OR 'reditux':ti,ab,kw OR 'retuxira':ti,ab,kw OR 'riabni':ti,ab,kw OR 'ristova':ti,ab,kw OR 'ritemvia':ti,ab,kw OR 'ritucad':ti,ab,kw OR 'ritumax':ti,ab,kw OR 'rituxan':ti,ab,kw OR 'rituximab':ti,ab,kw OR 'rituxin':ti,ab,kw OR 'rituzena':ti,ab,kw OR 'rixathon':ti,ab,kw OR 'riximyo':ti,ab,kw OR 'ruxience':ti,ab,kw OR 'tidecron':ti,ab,kw OR 'truxima':ti,ab,kw OR 'tuxella':ti,ab,kw OR 'zytux':ti,ab,kw OR 'belimumab'/exp OR 'belimumab':ti,ab,kw OR 'benlysta':ti,ab,kw OR 'abatacept'/exp OR 'abatacept':ti,ab,kw OR 'orencia':ti,ab,kw OR belatacept:ti,ab,kw OR nulojix:ti,ab,kw OR 'golimumab'/exp OR 'golimumab':ti,ab,kw OR 'shinponi':ti,ab,kw OR 'simponi':ti,ab,kw |
899076 |
Ovid/Medline
|
# |
Searches |
Results |
|
10 |
(6 and 8) not 9 = RCT |
102 |
|
9 |
6 and 7 = SR |
77 |
|
8 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2583277 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
665386 |
|
6 |
limit 5 to yr="2010 -Current" |
1094 |
|
5 |
4 not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
1650 |
|
4 |
1 and 2 and 3 |
1866 |
|
3 |
exp Surgical Procedures, Operative/ or exp Specialties, Surgical/ or exp Postoperative Complications/ or exp Perioperative Period/ or exp Perioperative Medicine/ or surgic*.ti,ab,kf. or surger*.ti,ab,kf. or operation*.ti,ab,kf. or operative.ti,ab,kf. or presurg*.ti,ab,kf. or 'pre surg*'.ti,ab,kf. or preoperati*.ti,ab,kf. or 'pre operati*'.ti,ab,kf. or perisurg*.ti,ab,kf. or 'peri surg*'.ti,ab,kf. or perioperati*.ti,ab,kf. or 'peri operati*'.ti,ab,kf. or postsurg*.ti,ab,kf. or 'post surg*'.ti,ab,kf. or postoperati*.ti,ab,kf. or 'post operati*'.ti,ab,kf. or laparoscop*.ti,ab,kf. or intraoperati*.ti,ab,kf. |
5299332 |
|
2 |
exp Arthritis, Rheumatoid/ or 'arthritis deformans'.ti,ab,kf. or 'arthrosis deformans'.ti,ab,kf. or 'beauvais disease*'.ti,ab,kf. or 'chronic articular rheumatism'.ti,ab,kf. or 'chronic polyarthriti*'.ti,ab,kf. or 'chronic rheumatoid arthriti*'.ti,ab,kf. or 'inflammatory arthriti*'.ti,ab,kf. or 'polyarthritis rheumatica'.ti,ab,kf. or 'rheumarthriti*'.ti,ab,kf. or 'rheumatic arthriti*'.ti,ab,kf. or 'rheumatic polyarthriti*'.ti,ab,kf. or 'rheumatoid arthriti*'.ti,ab,kf. or 'rheumatoid polyarthriti*'.ti,ab,kf. or 'rheumatic'.ti. or 'antirheumatic'.ti. or exp Arthritis, Psoriatic/ or 'alibert bazin disease'.ti,ab,kf. or ((arthrit* or arthropath* or polyarthrit* or rheumat*) adj2 (psoriatic* or psoriasis)).ti,ab,kf. or exp Spondylarthritis/ or 'spine arthriti*'.ti,ab,kf. or 'spondylarthr*'.ti,ab,kf. or 'spondyloarthr*'.ti,ab,kf. or 'vertebral arthriti*'.ti,ab,kf. or 'vertebral osteo arthriti*'.ti,ab,kf. or 'vertebral osteoarthriti*'.ti,ab,kf. or 'ankylosing spondyl*'.ti,ab,kf. or bechterew*.ti,ab,kf. or 'marie struempell'.ti,ab,kf. or 'marie strumpell'.ti,ab,kf. or 'rheumatoid spondyliti*'.ti,ab,kf. or 'spondylitis ankylopoietica*'.ti,ab,kf. or 'spinal arthriti*'.ti,ab,kf. |
220974 |
|
1 |
(bdmard* or ((dmard* or 'disease modifying antirheumatic' or 'disease modifying anti rheumatic') adj4 biologic*)).ti,ab,kf. or Biological Therapy/ or 'biologic* therap*'.ti,ab,kf. or biotherap*.ti,ab,kf. or 'cell-and-tissue based therap*'.ti,ab,kf. or 'tissue therap*'.ti,ab,kf. or (biologic* adj2 (agent* or therap* or treatment* or medic* or drug* or pharmaceutic*)).ti,ab,kf. or 'biologicals'.ti,ab,kf. or biologics.ti,ab,kf. or biopharmaceutical*.ti,ab,kf. or (('immun* suppress*' or immunosuppress* or 'immune depress*') adj3 (therap* or treatment* or medication* or drug* or agent*)).ti,ab,kf. or exp Tumor Necrosis Factor Inhibitors/ or exp Tumor Necrosis Factor-alpha/ or 'tnf alfa'.ti,ab,kf. or 'tnf alpha'.ti,ab,kf. or 'cachectin'.ti,ab,kf. or 'cachetin'.ti,ab,kf. or cachexin.ti,ab,kf. or (('tissue necros*' or 'tumor necros*' or 'tumour necros*') adj2 (factor* or serum)).ti,ab,kf. or ((tnf* or 'tissue necros*' or 'tumor necros*' or 'tumour necros*') adj3 (inhibit* or block* or anti or antagonist)).ti,ab,kf. or Adalimumab/ or 'adalimumab'.ti,ab,kf. or 'adaly'.ti,ab,kf. or 'amgevita'.ti,ab,kf. or 'amjevita'.ti,ab,kf. or 'amsparity'.ti,ab,kf. or 'cinnora'.ti,ab,kf. or 'cyltezo'.ti,ab,kf. or 'exemptia'.ti,ab,kf. or 'fyzoclad'.ti,ab,kf. or 'hadlima'.ti,ab,kf. or 'halimatoz'.ti,ab,kf. or 'hefiya'.ti,ab,kf. or 'hukyndra'.ti,ab,kf. or 'hulio'.ti,ab,kf. or 'humira'.ti,ab,kf. or 'hyrimoz'.ti,ab,kf. or 'idacio'.ti,ab,kf. or 'imraldi'.ti,ab,kf. or 'kromeya'.ti,ab,kf. or 'libmyris'.ti,ab,kf. or 'mabura'.ti,ab,kf. or 'qletli'.ti,ab,kf. or 'raheara'.ti,ab,kf. or 'solymbic'.ti,ab,kf. or 'sulinno'.ti,ab,kf. or 'trudexa'.ti,ab,kf. or 'yuflyma'.ti,ab,kf. or 'yusimry'.ti,ab,kf. or Etanercept/ or 'altebrel'.ti,ab,kf. or 'avent'.ti,ab,kf. or 'benepali'.ti,ab,kf. or 'brenzys'.ti,ab,kf. or 'davictrel'.ti,ab,kf. or 'embrel'.ti,ab,kf. or 'enbrel'.ti,ab,kf. or 'enerceptan'.ti,ab,kf. or 'erelzi'.ti,ab,kf. or 'etacept'.ti,ab,kf. or 'etanar'.ti,ab,kf. or 'etanercept'.ti,ab,kf. or 'eticovo'.ti,ab,kf. or 'infinitam'.ti,ab,kf. or 'lifmior'.ti,ab,kf. or 'nepexto'.ti,ab,kf. or 'opinercept'.ti,ab,kf. or 'reumatocept'.ti,ab,kf. or 'tunex'.ti,ab,kf. or 'yisaipu'.ti,ab,kf. or Infliximab/ or 'avakine'.ti,ab,kf. or 'avsola'.ti,ab,kf. or 'flixabi'.ti,ab,kf. or 'inflectra'.ti,ab,kf. or 'infliximab'.ti,ab,kf. or 'ixifi'.ti,ab,kf. or 'remicade'.ti,ab,kf. or 'remsima'.ti,ab,kf. or 'renflexis'.ti,ab,kf. or 'revellex'.ti,ab,kf. or 'zessly'.ti,ab,kf. or Certolizumab Pegol/ or 'certolizumab'.ti,ab,kf. or 'golimumab'.ti,ab,kf. or 'shinponi'.ti,ab,kf. or 'simponi'.ti,ab,kf. or 'cimzia'.ti,ab,kf. or 'simziya'.ti,ab,kf. or 'xcimzane'.ti,ab,kf. or 'actemra'.ti,ab,kf. or 'atlizumab'.ti,ab,kf. or 'lusinex'.ti,ab,kf. or 'roactemra'.ti,ab,kf. or 'tocilizumab'.ti,ab,kf. or 'kevzara'.ti,ab,kf. or 'sarilumab'.ti,ab,kf. or Interleukin 1 Receptor Antagonist Protein/ or 'anakinra'.ti,ab,kf. or 'antril'.ti,ab,kf. or 'kineret'.ti,ab,kf. or 'raleukin'.ti,ab,kf. or 'canakinumab'.ti,ab,kf. or 'ilaris'.ti,ab,kf. or 'cosentyx'.ti,ab,kf. or 'scapho'.ti,ab,kf. or 'secukinumab'.ti,ab,kf. or 'ixekizumab'.ti,ab,kf. or 'taltz'.ti,ab,kf. or Ustekinumab/ or 'stelara'.ti,ab,kf. or 'stellara'.ti,ab,kf. or 'ustekinumab'.ti,ab,kf. or 'guselkumab'.ti,ab,kf. or 'tremfya'.ti,ab,kf. or Rituximab/ or 'acellbia'.ti,ab,kf. or 'blitzima'.ti,ab,kf. or 'cimabior'.ti,ab,kf. or 'halpryza'.ti,ab,kf. or 'kikuzubam'.ti,ab,kf. or 'mabthera'.ti,ab,kf. or 'redditux'.ti,ab,kf. or 'reditux'.ti,ab,kf. or 'retuxira'.ti,ab,kf. or 'riabni'.ti,ab,kf. or 'ristova'.ti,ab,kf. or 'ritemvia'.ti,ab,kf. or 'ritucad'.ti,ab,kf. or 'ritumax'.ti,ab,kf. or 'rituxan'.ti,ab,kf. or 'rituximab'.ti,ab,kf. or 'rituxin'.ti,ab,kf. or 'rituzena'.ti,ab,kf. or 'rixathon'.ti,ab,kf. or 'riximyo'.ti,ab,kf. or 'ruxience'.ti,ab,kf. or 'tidecron'.ti,ab,kf. or 'truxima'.ti,ab,kf. or 'tuxella'.ti,ab,kf. or 'zytux'.ti,ab,kf. or 'belimumab'.ti,ab,kf. or 'benlysta'.ti,ab,kf. or Abatacept/ or 'abatacept'.ti,ab,kf. or 'orencia'.ti,ab,kf. or belatacept.ti,ab,kf. or nulojix.ti,ab,kf. or 'golimumab'.ti,ab,kf. or 'shinponi'.ti,ab,kf. or 'simponi'.ti,ab,kf. |
468999 |