Cardiovasculaire complicaties bij bDMARD’s
Uitgangsvraag
Welke cardiovasculaire complicaties kunnen optreden als gevolg van een behandeling met bDMARD’s?
Aanbeveling
Maak geen onderscheid in bDMARD’s vanwege vergelijkbare frequenties van cardiovasculaire ziekten tussen bDMARD’s.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Gegevens over bijwerkingen bij gebruik van bDMARD’s komt uit een grote systematische review die verschillende observationele studies heeft geïncludeerd. Helaas waren de resultaten te heterogeen om te meta-analyseren. De bewijskracht kan daardoor niet worden geëvalueerd en als gevolg hiervan kon ook geen conclusie worden geformuleerd. Ondanks deze beperking is het mogelijk de resultaten te beschrijven en een mogelijke richting aan te geven. Dit was mede mogelijk doordat veel resultaten van de studies dezelfde richting suggereren. In onderstaande tabel is een overzicht weergegeven van de associaties met verschillende cardiovasculaire bijwerkingen tussen de bDMARD’s, op basis van de literatuur van Sepriano (2023). Over het algemeen lijkt het risico op MACE en myocardinfarct hetzelfde te zijn tussen de verschillende bestudeerde bDMARD’s. Voor hartfalen kan geen conclusie worden getrokken gezien de beperkte aantallen. De werkgroep adviseert om voorzichtig te zijn met het voorschrijven van TNF-remmers bij patiënten met zeer ernstig hartfalen, in lijn met het advies van het Farmacotherapeutisch Kompas.
Tabel Overzicht van de mogelijke associaties tussen bDMARD’s en type cardiovasculaire complicatie.
|
Type |
verschil tussen verschillende bDMARD’s |
|
Major adverse cardiovascular events (MACE) |
mogelijk hetzelfde |
|
Hartfalen |
niet bekend |
|
Myocardinfarct |
mogelijk hetzelfde |
Informatie uit aanvullende literatuur
Bij het uitwerken van de PICO heeft de werkgroep zich gefocust op het knelpunt wat zijn de verschillen tussen de verschillende bDMARD’s. Het verschil in veiligheid tussen bDMARD’s en csDMARD’s is een ander relevant punt. Door de jaren heen zijn er veel studies gepubliceerd die dit hebben beschreven. Data uit onder andere de gepubliceerde review van EULAR uit 2023, maar ook uit 2020 en 2017, laten zien dat het gebruik van een bDMARD niet gepaard gaat met een hoger risico op het optreden cardiovasculaire complicaties in vergelijking met csDMARD’s (Sepriano, 2023; 2020; Ramiro, 2017). Het is bekend dat patiënten met auto-immuunziektes een verhoogd risico hebben op het ontwikkelen van cardiovasculaire ziekten. Het lijkt aannemelijk dat verlaging van de ziekteactiviteit door effectieve behandeling met, onder andere bDMARD’s, het risico op cardiovasculaire ziekten bij deze patiëntenpopulatie verlaagt (Asenjo-Lobos, 2024).
Praktijkervaring
Op basis van het genoemde onder het kopje ‘informatie uit aanvullende literatuur’ is het aan te raden effectief te behandelen om het bestaande risico op cardiovasculaire ziekten in de populatie met auto-immuunziekten te verlagen. Er lijkt geen voorkeur te bestaan voor een specifiek bDMARD ten aanzien van een mogelijk risico op cardiovasculaire problemen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Bij de keuze van een behandeling dient er rekening te worden gehouden met de wensen van de patiënt. De voor- en nadelen van de behandeling dienen uitgebreid besproken te worden waarbij de behandelaar eveneens rekening houdt met het lokale beleid, welke per ziekenhuis kan verschillen. Redenen voor het kiezen van een bepaald medicijn zijn o.a. effectiviteit, bijwerkingenprofiel, toedieningsvorm (o.a. oraal vs. subcutaan vs. intraveneus) en comorbiditeit (bijvoorbeeld aanwezigheid van een inflammatoire darmziekte of psoriasis of uveitis). Specifiek met betrekking tot infecties lijkt er op basis van de uitgevoerde analyse geen verschil te bestaan tussen de verschillende bDMARD’s.
Kosten (middelenbeslag)
Bij de keuze van een bDMARD (originator of biosimilar) dient de voorschrijver naast het risico op het optreden van complicaties, ook de mogelijk kosten die gepaard gaan met een complicatie (en de behandeling hiervan) in acht te nemen. Denk hierbij aan ziekenhuisopname, monitoring, etc.
Aanvaardbaarheid, haalbaarheid en implementatie
Na het falen van ≥1 csDMARD komen patiënten in aanmerking voor een bDMARD bij RA waarbij in de meeste gevallen gestart zal worden met een TNF-remmer. In veel ziekenhuizen geldt een lokaal beleid, wat tot op zekere hoogte de volgorde van de voor te schrijven b- en tsDMARD’s bepaalt. Bij de keuze van een bDMARD (originator of biosimilar) dienen de kosten eveneens meegenomen te worden.
Rationale van de aanbeveling
De systematische review van Sepriano (2023) laat zien dat er geen evident verschil bestaat tussen de bestudeerde bDMARD’s onderling ten aanzien van cardiovasculaire ziekten. Praktijkervaring en kosten dienen eveneens meegenomen te worden. De literatuur suggereert dat effectieve behandeling middels DMARD’s het achtergrondrisico op cardiovasculaire ziekten bij patiënten met een auto-immuunziekte mogelijk verlaagt. Onze aanbevelingen zijn congruent hieraan. Hierbij dient wel opgemerkt te worden dat niet alle bDMARD’s zijn bestudeerd in vergelijking tot andere bDMARD’s.
Onderbouwing
Achtergrond
Op basis van de literatuur blijkt dat bDMARD’s een bewezen effect hebben op de ziekteactiviteit en patiëntgerapporteerde uitkomstmaten bij volwassen patiënten met een inflammatoire aandoening (Kerschbaumer, 2023). Studies naar langetermijneffecten van deze medicamenten laten tevens een blijvend en positief effect zien (Kerschbaumer, 2023).
De verdere ontrafeling van de pathofysiologische mechanismen van inflammatoire reumatische aandoeningen heeft ertoe geleid dat het therapeutisch arsenaal in de laatste decennia sterk is uitgebreid. De grote diversiteit in therapeutische opties heeft ertoe geleid dat we de behandeling meer kunnen afstemmen op de individuele patiënt. Tegelijkertijd heeft het ervoor gezorgd dat het maken van een keuze voor een specifieke behandeling lastiger is geworden, met name bij comorbiditeit. Daarnaast wordt het steeds meer van belang dat we de risk-benefit ratio van elk geneesmiddel goed kennen, zodat er voor de individuele patiënt een goede afweging gemaakt kan worden. Immers, de eventuele complicaties kunnen samenhangen met het werkingsmechanisme van een specifieke DMARD. Om een goede indicatie te krijgen van de huidige plaatsbepaling van bDMARD’s in de dagelijkse praktijk is het van belang dat we weten welke verschillende (ernstige) complicaties kunnen optreden, inzicht hebben in de frequentie waarmee complicaties kunnen voorkomen, welke patiënten een verhoogd risico hebben op het oplopen van complicaties, en kennis hebben op welke manier bijwerkingen voorkomen kunnen worden/ risico’s beperkt kunnen worden. In dit onderdeel wordt gekeken wat de verschillen zijn in het ontstaan van (ernstige) complicaties tussen verschillende bDMARD’s.
Conclusies / Summary of Findings
|
No GRADE |
As the results were too heterogenous to perform a meta-analysis, it was not possible to evaluate the level of evidence or to draw a conclusion on the risk of complications with use of bDMARDs in patients with rheumatoid arthritis.
Source: Sepriano, 2023 |
Samenvatting literatuur
Description of EULAR publication
Sepriano (2023) was a systematic literature review informing the 2022 update of the EULAR recommendations for the management of rheumatoid arthritis (RA). Databases were searched from 1 January 2019 to 14 January 2022 for publications addressing the safety of DMARD use (csDMARD, bDMARD—including biosimilars—or tsDMARD) in adult (≥18 years old) patients with RA, updating a previous systematic literature review. Studies were only eligible if they included a comparator group (either another DMARD, combination therapy, or the general population). Studies on glucocorticoids were excluded, as they were dealt with in a separate literature review (Dure, 2013). The following safety outcomes were considered: infections, including serious infections, opportunistic infections such as tuberculosis (TB) and herpes zoster (HZ), malignancies, mortality, major adverse cardiovascular events (MACEs), venous thromboembolism (VTE), including pulmonary embolism (PE) and deep venous thrombosis (DVT), changes in lipid levels, elevations of creatine phosphokinase, impairments in renal function, elevations of liver enzymes, haematological abnormalities, gastrointestinal side effects, demyelinating disease, induction of autoimmune disease, teratogenicity, fertility, and pregnancy outcomes. From a total of 2,961 references, the authors included 59 observational studies. Studies in the EULAR SR were heterogeneous, precluding data pooling. Therefore, results were presented descriptively.
Results
1. Infections
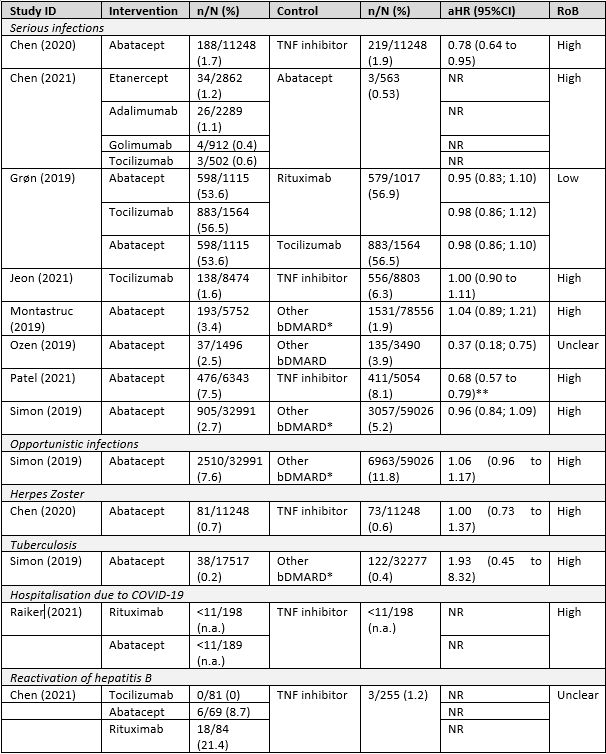
Sepriano (2023) focused on serious infections, opportunistic infections, Herpes Zoster, Tuberculosis, hospitalization due to COVID-19 and reactivation of hepatitis B. Table 1 shows the results. For several studies and outcomes, the number of events were too low to interpret the effect estimate. Therefore, the effect estimates were not reported.
Table 1 Risk of infections with use of bDMARDs (observational studies, source Sepriano (2023))
RoB, Risk of Bias. NR, not reported (numbers were too few to interpret the effect estimate) *included a tsDMARD (tofacitinib) ** Reciprocal of results originally reported.
Regarding the risk of serious infections, the results showed no increased risk for serious infections among the bDMARDs studied. The results indicated that this risk was, in general, similar. Based on one large study, the risk of opportunistic infections and Herpes Zoster may also be similar among the bDMARDs studied. The results for tuberculosis potentially suggested an increased risk, although not statistically significant, for abatacept as compared to a reference group including other bDMARDs. However, the confidence interval is very broad. More research would be needed.
2. Allergies
Sepriano (2023) does not report on allergies.
3. Cardiovascular diseases
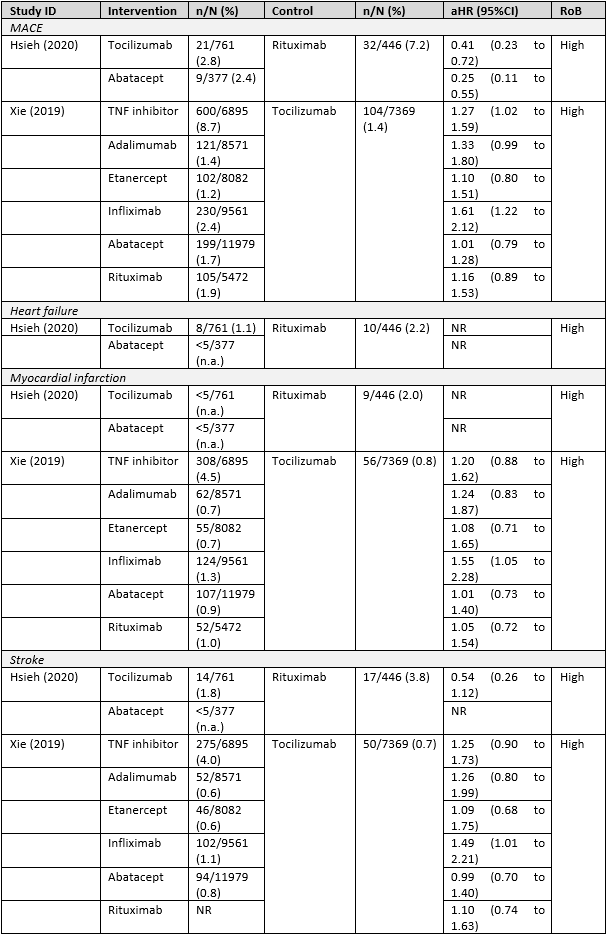
Sepriano (2023) focused on major adverse cardiovascular events (MACE), heart failure, myocardial infarction, and stroke. Table 2 shows the results.
Table 2 Risk of cardiovascular diseases with use of bDMARDs (observational studies, source Sepriano (2023))
RoB, Risk of Bias. NR, not reported (numbers were too few to interpret the effect estimate).
The results on the risk of MACE, myocardial infarction and stroke were heterogenous. Although the results are difficult to infer, there is a tendency that the risk of MACE, myocardial infarction, and stroke is not increased and seems to be similar between the bDMARDs studied. The number of events on the risk of heart failure were too small to infer any conclusions.
4. Malignancies
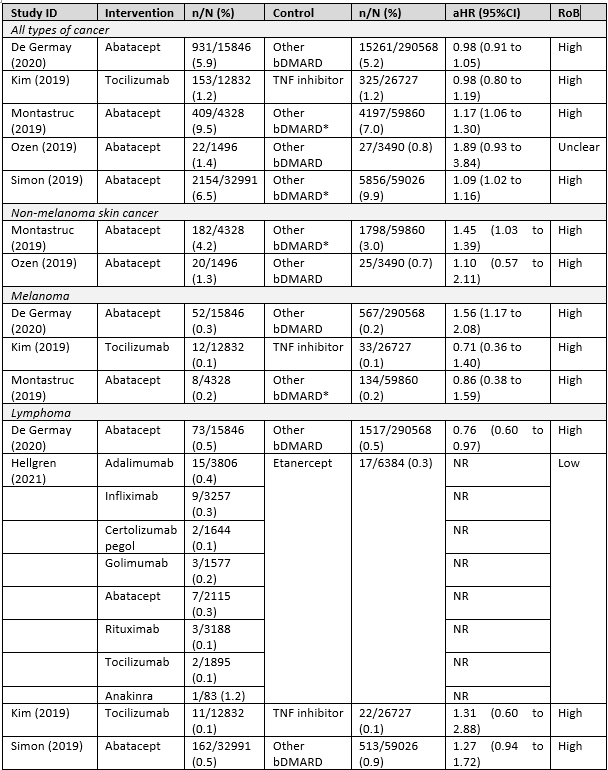
Sepriano (2023) focused on any type of cancer, non-melanoma skin cancer, melanoma and lymphoma. Table 3 shows the results.
Table 3 Risk of malignancies with use of bDMARDs (observational studies, source Sepriano (2023))
RoB, Risk of Bias. NR, not reported (numbers were too few to interpret the effect estimate) *included a tsDMARD (tofacitinib)
Table 3 showed that for all types of cancer, the risk may not be different among the bDMARDs studied. The findings on abatacept are conflicting but may suggest a potential increased risk for malignancies. However, the evidence is limited and based on studies with a potential high risk of bias. Therefore, more research is needed.
Level of evidence of the literature
As no meta-analysis was performed, the level of evidence was not assessed.
Zoeken en selecteren
To answer the clinical question, an update of the literature for the EULAR recommendations for the management of rheumatoid arthritis (Sepriano, 2023) was used. Sepriano (2023) performed a systematic search in line with our research question until 14 January 2022. We used the results of this systematic review (SR) to answer our research question. As the literature was searched recently, no update of the literature was performed.
For this clinical question, only results of comparisons between bDMARDS were described. For adverse effects regarding tsDMARDs, please refer to module Complicaties – tsDMARD’s.
Referenties
- Asenjo-Lobos C, González L, Bulnes JF, Roque M, Muñoz Venturelli P, Rodríguez GM. Cardiovascular events risk in patients with systemic autoimmune diseases: a prognostic systematic review and meta-analysis. Clin Res Cardiol. 2024 Feb;113(2):246-259. doi: 10.1007/s00392-023-02291-4. Epub 2023 Aug 31. PMID: 37650912.
- Duru N, van der Goes MC, Jacobs JW, Andrews T, Boers M, Buttgereit F, Caeyers N, Cutolo M, Halliday S, Da Silva JA, Kirwan JR, Ray D, Rovensky J, Severijns G, Westhovens R, Bijlsma JW. EULAR evidence-based and consensus-based recommendations on the management of medium to high-dose glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis. 2013 Dec;72(12):1905-13. doi: 10.1136/annrheumdis-2013-203249. Epub 2013 Jul 19. PMID: 23873876.
- Kerschbaumer A, Sepriano A, Bergstra SA, Smolen JS, van der Heijde D, Caporali R, Edwards CJ, Verschueren P, de Souza S, Pope JE, Takeuchi T, Hyrich KL, Winthrop KL, Aletaha D, Stamm TA, Schoones JW, Landewé RBM. Efficacy of synthetic and biological DMARDs: a systematic literature review informing the 2022 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis. 2023 Jan;82(1):95-106. doi: 10.1136/ard-2022-223365. Epub 2022 Nov 11. PMID: 36368906.
- Ramiro S, Sepriano A, Chatzidionysiou K, Nam JL, Smolen JS, van der Heijde D, Dougados M, van Vollenhoven R, Bijlsma JW, Burmester GR, Scholte-Voshaar M, Falzon L, Landewé RBM. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2016 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis. 2017 Jun;76(6):1101-1136. doi: 10.1136/annrheumdis-2016-210708. Epub 2017 Mar 15. PMID: 28298374.
- Riley TR, George MD. Risk for infections with glucocorticoids and DMARDs in patients with rheumatoid arthritis. RMD Open. 2021 Feb;7(1):e001235. doi: 10.1136/rmdopen-2020-001235. PMID: 33597206; PMCID: PMC7893655.
- Sepriano A, Kerschbaumer A, Bergstra SA, Smolen JS, van der Heijde D, Caporali R, Edwards CJ, Verschueren P, de Souza S, Pope J, Takeuchi T, Hyrich K, Winthrop KL, Aletaha D, Stamm T, Schoones JW, Landewé RBM. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2022 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis. 2023 Jan;82(1):107-118.
- Sepriano A, Kerschbaumer A, Smolen JS, van der Heijde D, Dougados M, van Vollenhoven R, McInnes IB, Bijlsma JW, Burmester GR, de Wit M, Falzon L, Landewé R. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2019 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis. 2020 Jun;79(6):760-770. doi: 10.1136/annrheumdis-2019-216653. Epub 2020 Feb 7. PMID: 32033941.
- Seror R, Lafourcade A, De Rycke Y, Pinto S, Castaneda J, Fautrel B, Mariette X, Tubach F. Risk of malignancy in rheumatoid arthritis patients initiating biologics: an historical propensity score matched cohort study within the French nationwide healthcare database. RMD Open. 2022 Jun;8(2):e002139. doi: 10.1136/rmdopen-2021-002139. PMID: 35738803; PMCID: PMC9226991.
- Singh JA, Cameron C, Noorbaloochi S, Cullis T, Tucker M, Christensen R, Ghogomu ET, Coyle D, Clifford T, Tugwell P, Wells GA. Risk of serious infection in biological treatment of patients with rheumatoid arthritis: a systematic review and meta-analysis. Lancet. 2015 Jul 18;386(9990):258-65. doi: 10.1016/S0140-6736(14)61704-9. Epub 2015 May 11. PMID: 25975452; PMCID: PMC4580232
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 28-02-2025
Laatst geautoriseerd : 28-02-2025
Geplande herbeoordeling : 28-02-2026
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de behandeling van patiënten met biological DMARD’s of targeted synthetic DMARD’s die worden ingezet bij inflammatoire reumatische aandoeningen (o.a. reumatoïde artritis (RA), spondylitis ankylopoietica (SpA), artritis psoriatica (PsA)). De werkgroep realiseert zich dat de middelen ook voor andere indicaties worden ingezet, zoals bij overige auto-immuunziekten, en gaat ervan uit dat in essentie hiervoor de regels van verantwoord gebruik niet anders zullen zijn.
Werkgroep
- Dr. D. (David) ten Cate (voorzitter), reumatoloog, werkzaam in Sint Maartenskliniek, NVR.
- Dr. M. (Marlies) van der Goes, reumatoloog, werkzaam in Meander Medisch Centrum, NVR.
- Dr. P. (Pascal) de Jong, reumatoloog, werkzaam in Erasmus Medisch Centrum, NVR.
- Dr. G.J. (Gerrit Jan) Wolbink, reumatoloog, werkzaam in Reade, NVR.
- Drs. S. (Sadaf) Atiqi, AIOS reumatologie, werkzaam in Reade, NVR.
- R. (René) van der Knaap, patiëntvertegenwoordiger, ReumaZorg Nederland.
- MSc. M.J. (Marieke) van Leijden, patiëntvertegenwoordiger, ReumaNederland.
- S.P. (Silvia) van der Windt, reumaverpleegkundige, werkzaam in Reinier de Graaf ziekenhuis, V&VN.
- Dr. J.C.E.M. (Josianne) ten Berge, oogarts, werkzaam in Erasmus Medisch Centrum, NOG.
- Dr. T. (Thijs) Giezen, ziekenhuisapotheker, werkzaam in Apotheek Spaarne Gasthuis, NVZA.
- Dr. T (Teun) van Gelder, internist – klinisch farmacoloog, werkzaam in Leids Universitair Medisch Centrum, NIV/NVKFB.
Klankbordgroep
- Dr. A.E. (Andrea) van der Meulen – de Jong, maag-darm-leverarts, werkzaam in Leids Universitair Medisch Centrum, NVMDL.
- Drs. B.J.M. (Barbara) Bergmans, arts-microbioloog, werkzaam in Labmicta, NVMM.
Met ondersteuning van
- Dr. T. Hoekstra, senior adviseur (vanaf juni 2024), Kennisinstituut van Federatie Medisch Specialisten.
- Dr. C.L. Overman, adviseur (tot december 2023), Kennisinstituut van de Federatie Medisch Specialisten.
- Dr. B.H. Stegeman, senior adviseur, Kennisinstituut van Federatie Medisch Specialisten.
- Dr. M.M.A. Verhoeven, adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
- Mw. A. van der Wal, medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. D. (David) ten Cate (voorzitter) |
reumatoloog, werkzaam in Sint Maartenskliniek |
Geen |
Geen |
Geen |
|
Dr. M. (Marlies) van der Goes |
reumatoloog, werkzaam in Meander Medisch Centrum |
Geen |
Geen |
Geen |
|
Dr. P. (Pascal) de Jong |
reumatoloog, werkzaam in Erasmus Medisch Centrum |
Geen |
Deelgenomen aan diverse adviesraden voor: Abbvie, Lilly; Bristol-Myers Squibb; Pfizer; Sanofi Genzyme; Galapagos; AstraZeneca & UCB. Verzorgen van onderwijs uit naam van de industrie: Galapagos; Pfizer; Novartis; Lilly & Abbvie |
Deelname aan adviesraad neerleggen gedurende richtlijnontwikkeling. Restrictie ten aanzien van besluitvorming van een module follow-up (Deze module gaat over de effectiviteit van de middelen, de andere modules meer over het 'veilig gebruik') |
|
Dr. G.J. (Gerrit Jan) Wolbink |
reumatoloog, werkzaam in Reade |
Werkzaam bij Sanquin. lid Covid werkgroep NVR Werkgroep Immuungecompromiteerden Covid vaccinatie RIVM. |
Extern gefinancierd onderzoek: ADORA Todora COVIDARC ZonMW |
Restrictie m.b.t. besluitvorming module 'follow up' |
|
Drs. S. (Sadaf) Atiqi |
AIOS reumatologie, werkzaam in Reade |
Geen |
Extern gefinancierd onderzoek: Therapeutic drug monitoring to optimise treatment with adalimumab in rheumatoid arthritis patients. |
Geen |
|
R. (René) van der Knaap |
patiëntvertegenwoordiger, ReumaZorg Nederland |
Geen |
Geen |
Geen |
|
MSc. M.J. (Marieke) van Leijden |
patiëntvertegenwoordiger, ReumaNederland |
Geen |
Geen |
Geen |
|
S.P. (Silvia) van der Windt |
reumaverpleegkundige, werkzaam in Reinier de Graaf ziekenhuis |
Geen |
Geen |
Geen |
|
Dr. J.C.E.M. (Josianne) ten Berge |
oogarts, werkzaam in Erasmus Medisch Centrum |
Geen |
Geen |
Geen |
|
Dr. T. (Thijs) Giezen |
ziekenhuisapotheker, werkzaam in Apotheek Spaarne Gasthuis |
Lid, Biosimilar Working Party, EMA, Amsterdam (onbetaald) t/m 2023 Extern expert CBG, Utrecht (onbetaald) t/m 2023 0-uren aanstelling, Division of Pharmacoepidemiology and Clinical Pharmacology, UIPS, Utrecht (onbetaald)
Vanaf 2024: Lid van de Medische AdviesRaad van Sanquin. De werkzaamheden voor Sanquin betreffen het non-profit gedeelte (de Bloedbank). |
Als co-promotor betrokken geweest bij 2 promotietrajecten welke gefinancierd zijn door het CBG en de Saudi FDA. |
Geen |
|
Dr. T (Teun) van Gelder |
internist – klinisch farmacoloog, werkzaam in Leids Universitair Medisch Centrum |
Klinisch Farmacoloog bij CCMO. Spreker en consulting vergoedingen ontvangen van Roche Diagnostics, Thermo Fisher, Vitaeris, CSL Behring, Astellas and Aurinia Pharma. In alle gevallen is de donatie aan de ziekenhuis rekening gedaan, dus geen persoonlijke betalingen. Geen aandelen of werkzaamheden voor deze bedrijven. |
Extern gefinancierd onderzoek: Ministerie van VWS, geneesmiddel-ontwikkeling ZonMW, IMProving symptomatic treatment with Amifampridine; a randomized double-blinded, placebo controlled AntiCancer Fund, Adaptive therapy in metastatic castration resistant prostate cancer Medical Delta Talent Acceleration Call 2021 A Biofilm-dissolving Gel to Eradicate Cardiac Bacterial Infections during Surgery KNMP, Klinisch redeneren door de apotheker |
Deelname aan adviesraad neerleggen gedurende richtlijnontwikkeling. Geen aanvullende restricties. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van patiëntenorganisatiesin de werkgroep. De opzet van de module Organisatie van Zorg is in samenspraak met de patiëntenorganisaties opgezet. De conceptrichtlijn is tevens voor commentaar voorgelegd aan verschillende patiëntenverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wet kwaliteit, klachten en geschillen zorg (Wkkgz).
Bij de richtlijn is conform de Wkkgz een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële negatieve financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Complicaties bDMARD’s – cardiovasculair |
Geen substantiële financiële gevolgen. |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de huidige zorg middels een schriftelijke knelpuntenanalyse. Tijdens deze knelpuntenanalyse werd aan vertegenwoordigers vanuit verschillende organisaties gevraagd hun input te leveren met als doel te inventariseren welke knelpunten men ervaarde rondom de te ontwikkelen richtlijn. De resultaten hiervan zijn opgenomen onder aanverwante producten (zie Bijlage Reacties schriftelijke knelpunteninventarisatie). Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch en/of patiëntrelevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Search and select’. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet een-op-een vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert-opinie. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.