Risico maligniteit bij biologicals
Uitgangsvraag
Op welke wijze dient bij IMID patiënten die worden behandeld met biologicals te worden omgegaan met het risico op maligniteiten?
Aanbeveling
Het is niet geïndiceerd om IMID patiënten, bij wie men een behandeling met biologicals wil starten, vooraf te screenen op maligniteiten. Wel dient men zich op de hoogte te stellen van voorafgaande maligniteiten.
Maligniteit in de voorgeschiedenis vormt bij IMID patiënten geen absolute contra-indicatie om behandeld te worden met biologicals.
Het is gewenst om bij IMID patiënten die bekend zijn met een maligniteit in de voorgeschiedenis alert te zijn op de ontwikkeling van tumoren.
Het wordt geadviseerd om IMID patiënten die behandeld worden met biologicals te informeren over het mogelijk risico op de ontwikkeling van huidtumoren en het belang van zelfinspectie van de huid van armen/benen/hoofd/hals te benadrukken.
Wanneer bij een IMID patiënt een plaveiselcelcarcinoom van de huid wordt vastgesteld, dient in overleg met de dermatoloog risicoanalyse plaats te vinden naar de kans op nieuwe tumoren. Indien verhoogd, dan dient overwogen te worden de behandeling met biologicals te staken.
Overwegingen
In de meeste trials zijn patiënten met maligniteiten in de voorgeschiedenis uitgesloten wat kan leiden tot een vertekend beeld inzake het optreden van nieuwe maligniteiten. Voor de ‘gouden’ regel in de dagelijkse praktijk om patiënten met een maligniteit in de afgelopen 5 jaar uit te sluiten van behandeling met biologicals is geen goede onderbouwing.
Op grond van de huidige gegevens kan een licht verhoogd risico niet worden uitgesloten dan wel worden aangetoond. Gezien de zeer lage incidenties is de impact voor de behandeling van de individuele patiënt zeer beperkt. Al met al moet in geval met een maligniteit in de voorgeschiedenis alertheid geboden zijn, maar is dit geen absolute contra-indicatie.
Op grond van de huidige gegevens is vooraf screening op maligniteiten niet geïndiceerd. Wel is meer aandacht voor de huid aangewezen omdat TNFα-blokkers vaker leiden tot non-melanoma huidtumoren. Het basaalcelcarcinoom is goed te behandelen maar het plaveiselcarcinoom kan metastaseren, derhalve is actief monitoren gewenst. Personen met bovengemiddelde zonblootstelling in het verleden, hetzij beroepsmatig (vissers of agrariërs), therapeutisch (bijv. ultraviolet lichttherapie), of recreatief, die daarnaast behandeld worden met ciclosporine of azathioprine behoren tot een extra risicogroep.
Onderbouwing
Achtergrond
Het immuunsysteem speelt ook een belangrijke rol bij de afweer in de zin van tumorsurveillance. Het gebruik van biologicals werpt dan ook de vraag op of deze medicatie niet tot een verhoogde incidentie van maligniteiten leidt.
Naast de systematische literatuursearch is ook gezocht op de website van de Europese en Amerikaanse registratieautoriteiten (EMEA en FDA) naar aanvullende, post-marketing, informatie.
Voordat de uitgangsvraag beantwoord kan worden is natuurlijk van belang geïnformeerd te zijn over de achtergrondincidenties van maligniteiten in de algemene bevolking en bij patiënten met inflammatoire aandoeningen.
Achtergrondincidenties
Reumatoïde artritis; In een recente meta-analyse van observationele studies bij RA is gekeken naar het relatieve risico ten opzichte van de algemene populatie. Daaruit komt naar voren dat het overall risico vergelijkbaar is ten opzichte van de algemene populatie (Standardized Incidence Ratio (SIR): 1,05; 1,01 – 1,09) (Smitten et al, 2008). Echter lymfomen en longtumoren komen vaker voor, terwijl colorectale- en mammatumoren minder vaak voorkomen. De respectievelijke SIRs zijn 2,08 (1,80 – 2,39), 1,63 (1,43 – 1,87), 0,77 (0,65 – 0,90) en 0,84 (0,79-0,90). Het verdubbelde risico op lymfomen lijkt gerelateerd te zijn aan de ziekteactiviteit en is ook al aanwezig bij new onset inflammatory polyarthritis (Askling et al, 2005).
Spondylitis ankylopoetica; Voor spondylitis ankylopoetica zijn er onvoldoende literatuurgegevens voorhanden om tot een betrouwbare uitspraak te komen over het maligniteitsrisico.
Artritis psoriatica; Uit de slechts beperkte literatuur komen geen aanwijzingen dat artritis psoriatica gepaard gaan met een overall verhoogde kans op maligniteiten (Rohekar et al, 2008).
Psoriasis; Bij psoriasis is er, ten opzichte van de algemene populatie, een hoger achtergrondrisico voor lymfomen (Hannuksela-Svahn et al, 2000), waarbij het relatief risico, net als bij RA, afhangt van de ziekteactiviteit. Zo hebben patiënten met milde psoriasis een relatief risico tussen de 1,4 – 3,2, terwijl ernstige psoriasis gepaard gaat met relatieve risico’s variërend tussen 4,1 en 10,8 (Gelfand et al, 2003; 2006). Daarnaast is er een verhoogd risico voor huidtumoren bij eerdere UV therapie (met name PUVA) of door het gebruik van immunosuppresiva zoals ciclosporine (Marcil, en Stern, 2001; Paul et al, 2003).
Inflammatoire darmziekten; Patiënten met inflammatoire darmziekten hebben een verhoogd risico op het ontwikkelen van darmkanker. In een meta-analyse van 116 studies werd een prevalentie van 3,7% gerapporteerd voor een willekeurige patiënt met colitis ulcerosa en 5,4% voor patiënten met pancolitis, terwijl het cumulatieve risico voor het ontstaan van een carcinoom 2, 8 en 18% na respectievelijk 10, 20 en 30 jaar bleek (Eaden et al, 2001). Recentere studies laten echter een veel minder hoog risico (Rutter et al, 2006) of zelfs een vergelijkbare incidentie zien in vergelijking met de achtergrondpopulatie (Jess et al, 2006).
Bij de ziekte van Crohn is het relatieve risico voor het ontstaan van dikkedarmkanker ongeveer 2,5 voor de totale patiëntengroep en 5,6 voor degenen, waarbij de ziekte alleen gelokaliseerd is in het colon (Ekbom et al, 1990; Bernstein et al, 2001). De gemiddelde duur van de ziekte voorafgaande aan het carcinoom is vergelijkbaar voor de ziekte van Crohn en colitis ulcerosa, respectievelijk 15 en 18 jaar (Bernstein et al, 2001). Ook is het risico op tumoren van de dunne darm verhoogd bij de ziekte van Crohn met een relatief risico ver boven de 20, leidend tot een absoluut risico van 2,2% na 25 jaar ziekte (Palascak-Juif et al, 2005).
Er is discussie of het achtergrondrisico op het krijgen van een lymfoom bij patiënten met de ziekte van Crohn verhoogd is (Loftus et al, 2000; Lewis et al, 2001, Bernstein et al, 2001). Het risico is hoogstens licht verhoogd. Onmiskenbaar draagt gebruik van thiopurine-antagonisten wel bij aan lymfoomrisico (Kandiel et al, 2005; Beaugerie et al, 2009).
Non-melanoma huidtumoren lijken vaker aanwezig bij IBD-patiënten met een incidentie rate ratio van 1,64 (95% B.I. 1,51-1,78), waarbij er associatie is gemeld met thiopurinegebruik (Long et al, 2009).
JIA; Gegevens over de achtergrond incidentie van maligniteiten bij JIA zijn niet aanwezig.
Conclusies
|
Niveau 2
|
Het is aannemelijk dat, ondanks een verdubbeling van het risico op lymfomen, het overall risico op maligniteiten bij RA niet verhoogd is ten opzichte van de algemene bevolking.
B Smitten et al, 2008 |
|
Niveau 3
|
Het lijkt waarschijnlijk dat, ondanks een verhoogd risico op lymfomen, het overall risico op maligniteiten bij artritis psoriatica niet verhoogd is ten opzichte van de algemene bevolking.
C Rohekar et al, 2008 C Hannuksela-Svahn et al, 2000 |
|
Niveau 4
|
Voor spondylitis ankylopoetica en JIA zijn onvoldoende of geen gegevens beschikbaar om tot een uitspraak te komen over een verhoogde kans op het ontwikkelen van maligniteiten.
D Mening van de werkgroep |
|
Niveau 3
|
Het lijkt waarschijnlijk dat het risico op darmkanker verhoogd is bij inflammatoire darmziekten ten opzichte van de algemene bevolking, maar over de grootte hiervan is de literatuur niet eenduidig.
C Eaden et al, 2001; Rutter et al, 2006; Jess et al, 2006 |
|
Niveau 2 |
Gepoolde gegevens van individuele trials met TNFα-blokkers bij RA, SA en artritis psoriatica geven geen uitsluitsel c.q. spreken elkaar tegen als het gaat om de vraag of deze middelen gepaard gaan met een verhoogd risico op ontwikkeling van maligniteiten.
B Bongartz et al, 2006; Nannini et al, 2009 |
|
Niveau 2 |
Het is aannemelijk dat het gebruik van TNFα-blokkers bij RA, met name in combinatie met methotrexaat, leidt tot toename van non-melanoma maligne huidtumoren.
B Chakravarty et al, 2005 |
|
Niveau 3
|
Ook is het aannemelijk dat het gebruik van TNFα-blokkers bij psoriasis, alsmede bij de ziekte van Crohn, leidt tot een toename van non-melanoma huidtumoren (plaveiselcelcarcinoom).
C Gottlieb et al, 2008 C Long, 2009 |
|
Niveau 3
|
Het lijkt waarschijnlijk dat TNFα-blokkers bij RA geen additioneel verhoogde kans geven op lymfomen.
C Askling et al, 2009; Wolfe et al, 2007 |
|
Niveau 3
|
Bij de ziekte van Crohn is bij het gebruik van TNFα-blokkers mogelijk wel een verhoogd risico op lymfomen ten opzichte van placebo, maar de literatuur is hier niet eenduidig over.
C Siegel et al, 2009 |
|
Niveau 4
|
Van de andere biologicals zijn te weinig data om gefundeerde uitspraken te doen over een al dan niet verhoogd risico op maligniteiten.
D Mening van de werkgroep |
Samenvatting literatuur
Bij het beoordelen van de literatuur is uitgegaan van registers van cohortstudies, al dan niet grootschalige, (gecombineerde) trial gegevens en extensies hiervan, meta-analyses en systematische reviews. De (aanvullende) informatie van de EMEA en FDA wordt apart besproken.
Reumatoïde artritis
Uit een geïntegreerde database van 22 trials met etanercept (n = 4.322, 6.798 ptjr) was de SIR voor maligniteiten bij patiënten < 65 jr 0,9 (0,6 – 1,3) en voor patiënten > 65 jr 1,3 (0,7 – 1,9) met andere woorden vergelijkbaar met de algemene populatie (Fleischmann et al, 2006). Een eerdere studie met een kleiner aantal patiëntjaren hadden dit ook al laten zien (Moreland et al, 2006. In een Zweeds biologicals register (ARTIS, n = 6.604) en een nationaal RA register (n = 67.743) zijn de incidenties van lymfomen onderzocht en vergeleken met de algemene populatie (Askling et al, 2009). Het relatieve risico (RR) bij met anti-TNFα behandelde RA patiënten vs algemene populatie was 2,7 (1,8-4,1), terwijl dat binnen de RA-populatie tussen wel TNFα en geen TNFα behandeling niet significant verschilde (RR: 1,4 (0,8 – 2,1). Wat andere hematologische maligniteiten betreft bleek bij leukemieën een vergelijkbaar patroon, i.e. verhoogde SIRs bij RA onafhankelijk van de therapie (SIR anti-TNFα: 2,0, 0,2 – 7,3) (Askling et al, 2005). Thans worden de gegevens van 8 Europese registers gezamenlijk geanalyseerd en uit een eerste rapport blijkt dat het gebruik van TNFα-blokkers niet leidt tot toename van het aantal lymfomen (Zink et al, 2009).
De bevindingen m.b.t. lymfomen zijn overigens ook in overeenstemming met de observaties van de National Data Bank for Rheumatic diseases (NBD) waar 908 reumatologische praktijken aan deelnemen en halfjaarlijks vragenlijsten aan de patiënten worden verstuurd (Wolfe&Michaud, 2007). Voor deze vraagstelling is gebruikgemaakt van de gegevens van 19.562 patiënten (89.710 ptjr) waarvan 55,3% werd behandeld met anti-TNF-α en 68,0% met MTX. De OR anti-TNFα vs geen anti-TNFα was 1,0 (0,6-1,8) en de OR TNF-α/MTX vs MTX was 1,1 (0,6-2,0). De SIR (ten opzichte van de algemene bevolking) was 1,8 (1,5-2,2).
Bij een ander grootschalig gecombineerd Amerikaans/Canadees cohortonderzoek bij RA met 1.152 biologicals-gebruikers (2.940 ptjr) en 7.306 MTX gebruikers (30.300 ptjr) was er geen significant verschil tussen anti-TNFα en MTX voor wat betreft hematologische maligniteiten en solide tumoren (Setoguchi et al, 2006). Ten opzichte van de algemene bevolking waren er overigens wel meer lymfomen, myelomen, melanomen, longtumoren en tumoren van de urinewegen.
Inzake non-melanoma maligne huidtumoren (i.e. basaalcelcarcinoom en plaveiselcelcarcinoom) werden 15.789 RA patiënten (40.125 ptjr) vergeleken met 3.639 artrosepatiënten (9.988 ptjr). RA bleek geassocieerd te zijn met verhoogd risico t.o.v artrose (HR 1,19). Anti-TNFα gebruik zonder methotrexaat liet een verhoging zien (HR: 1,24, p= 0,089), zij het niet statistisch significant, terwijl anti-TNFα /methotrexaat een verdubbeling van het risico gaf (HR: 1,97, p = 0.001) (Chakravarty et al, 2005). In de veel bekritiseerde meta-analyse van Bongartz et al. zijn in totaal 9 trials met in totaal 3.493 anti-TNFα en 1.512 placebo behandelde patiënten geanalyseerd waarbij de gepoolde odds ratio (anti-TNFα vs placebo) 3,3 (1,2-9,1) was (Bongartz et al, 2006). Echter methodologisch zijn diverse kanttekeningen te plaatsen (Costenbader et al, 2006; Okada en Siegel, 2006; Callegari et al, 2006). Op grond van deze meta-analyse kan niet de conclusie worden getrokken dat TNFα-blokkers tot verhoogde kans op maligniteiten leiden. Overigens blijkt dat bij RA geen essentiële verschillen zijn met betrekking tot het maligniteitsrisico tussen infliximab, etanercept en adalimumab (Askling et al, 2009).
In een jaar durende placebogecontroleerde trial met abatacept, bij in totaal 1.441 patiënten, was het percentage tumoren, zowel benigne als maligne, in beide groepen gelijk (3,5%) (Weinblatt et al, 2006).
Uit cumulatieve analyses van respectievelijk 5 en 7 registratiestudies blijkt dat abatacept niet gepaard gaat met meer maligniteiten ten opzichte van niet met abatacept behandelde RA-patiënten (Sibilia en Westhovens, 2007; Simon et al, 2009).
Uit beperkte data kan opgemaakt worden dat anakinra niet gepaard lijkt te gaan met een verhoogd risico op maligniteiten (Sibilia en Westhovens, 2007; Fleischmann et al, 2006).
Psoriasis
Een review van de klinische studies met etanercept liet een verhoogde kans zien op plaveiselcelcarcinoom bij psoriasis met OR’s variërend tussen de 2,1 en 5,0 afhankelijk van de mate van zonlichtexpositie (Gottlieb et al, 2008). De gecombineerde informatie uit de Europese registratiedossiers is als volgt:
- infliximab; In de twee registratiestudies (EXPRESS en SPIRIT) met 564 patiënten werden 9 maligniteiten van de huid (plaveiselcelcarcinoom (in situ): n = 5, basaalcelcarcinoom n = 3, spinocellulair carcinoom n = 1) gemeld, en geen in de (te kleine) placebogroep.
- adalimumab; Bij de placebogecontroleerde studies waren bij adalimumab vaker maligniteiten (m.n. huidtumoren) dan bij de met placebo behandelde patiënten. Bij de met adalimumab behandelde patiënten (n = 1.696; 1.684 ptjr) waren er bij 12 patiënten 15 non-melanoma huidcarcinomen.
- etanercept; Het EMEA rapport uit 2004 vermeldt 13 huidtumoren bij 12 patiënten (1.039 ptjr) en stelt dat dit lager dan verwacht zou zijn in een vergelijkbare matige tot ernstige, niet met etanercept behandelde, psoriasis populatie.
Inflammatoire darmziekten
Sinds enkele jaren zijn twee grootschalige PMS studies bij patiënten met de Ziekte van Crohn die met infliximab worden behandeld. Uit beide registers blijkt tot nu toe geen verhoogd risico op lymfomen of andere maligniteiten bij het gebruik van infliximab (Colombel et al, 2008; Lichtenstein etal, 2008). Een review uit 2007 van 6 trials en 4 retrospectieve en case-control studies met in totaal 2.109 met infliximab behandelde patiënten met de ziekte van Crohn liet eveneens geen verhoogde kans op maligniteiten zijn. Dit gold eveneens voor 9 trials en 2 retrospectieve studies met in totaal 629 met infliximab behandelde patiënten met een colitis ulcerosa (Biancone et al, 2007).
Daarentegen toont een recente meta-analyse van 9 RCT’s, 3 cohorten en 14 case series met in totaal 8.109 patiënten met de ziekte van Crohn, een verdubbeling van de kans op lymfomen ten opzichte van de algemene bevolking (6,1 per 10.000 ptjr) (Siegel et al, 2009). Anti-TNF gebruikende patiënten hadden een SIR van 3,2 (95% CI: 1,5-6,9), vergelijkbaar met patiënten die alleen immuunsuppressiva hadden gebruikt. Hier moet echter opgemerkt worden dat het merendeel van de anti-TNFα populatie eerder met thiopurinederivaten werd behandeld, een medicamentengroep die inmiddels onweersproken geassocieerd is met verhoogd lymfoomrisico.
Uit een grote case-control studie bleek dat het gebruik van biologicals gepaard ging met een verdubbeling van het risico op non-melanoma huidtumoren bij de ziekte van Crohn (OR 2,2 ; 1,1 – 4,5. Voldoende data voor colitis ulcerosa zijn nog niet beschikbaar (Long et al, 2009).
Overige informatie
Recent heeft de FDA een waarschuwing doen uitgaan over een verhoogd risico op maligniteiten bij het gebruik van TNFα-blokkers bij kinderen en adolescenten. Dit is gebaseerd op 48 maligniteiten bij kinderen en adolescenten, waarvan de helft bestond uit lymfomen (FDA Questions and Answers – TNFα Blockers, 2009). Voor infliximab was het verwachte aantal lymfomen en andere maligniteiten hoger dan verwacht. Voor etanercept (voornamelijk gegeven bij JIA) gold dit alleen voor lymfomen. Over de sterkte van deze associatie is geen uitspraak te doen omdat in 90% van de gevallen ook andere immunosuppressiva werden gegeven.
Daarnaast heeft de FDA 147 post-marketing rapporten (inclusief 4 pediatrische) rapporten) van leukemie beoordeeld waarbij een mogelijke associatie naar voren komt, wat de reden voor de FDA vormt om dit nu expliciet te laten vermelden in de bijsluiterteksten (FDA. Information for Healthcare Professionals: TNFα- Blockers, 2009).
Recentelijk is ustekinumab beschikbaar gekomen voor de behandeling van psoriasis. Uit het Europese registratiedossier komen weliswaar meer maligniteiten in de ustekinumab behandelde patiënten naar voren ten opzichte van placebo, maar de overall gestandardiseerde incidenties laten geen significant verschil zien tussen ustekinumab en placebobehandelde patiënten. Eind september is dit middel ook in Amerika voor de behandeling van psoriasis beschikbaar gekomen, waarbij aan de fabrikant een strikte post-marketing surveillance is opgelegd door de FDA. De EMEA gaat overigens minder ver en stelt alleen dat er nog meer data moet komen.
In 2009 zijn 15 casussen met hepatosplenisch T-cel lymfoom beschreven, een bijzonder kwaadaardig en therapieresistent type van lymfoom, in associatie met infliximabgebruik bij IBD (Mackey et al, 2009). Dit betrof veelal jonge patiënten die infliximab gebruikten in combinatie met een thiopurinederivaat of glucocorticoïden. Ook bij adalimumabgebruikers zijn inmiddels 3 casussen beschreven (Richtlijn CBO-IBD, 2008).
Evidence tabellen
Maligniteiten en biologicals
|
Referentie
|
Mate van bewijs
Studie type
|
Aantal patiënten
|
Patiënten kenmerken
|
Inclusie criteria
|
Interventie
|
Controle
|
Follow-up duur
|
Uitkomstmaten
|
Resultaten
|
Overige opmerkingen
|
|
|
Carmona ARD 2007 |
Vergelijking van 2 Spaanse Cohorten 1) BIOBASER 2000 –drug safety register – 100 centra - RA 2) EMECAR 1999– cohort random sample van 34 praktijken – RA Mate van bewijs: III |
1) 789 2) 789 |
1) RA 2) RA 3) Algemene populatie gegevens uit 2002 |
1) Start met 1e aTNF
|
1) aTNF
|
2) Geen aTNF |
1) 2879 ptjr (n = 789) 2) 2265 ptjr (n = 789) |
Maligniteit - mortaliteit |
1) 11 - Incidentie ratio/100.000: 382 2) 23 - Incidentie ratio/100.000: 1103
1) SMR: 0,28 (0,059 – 0,83) 2) SMR: 0,988(0,53- 1,69) Mortality rate ratio (1 vs 2): 0,36 (o,10- 1,30) |
- Patiënten 1) significant jonger (59 vs 61) en vaker vrouw (79 vs 72%) Overall Mortaliteit rate ratio: 0,32 (0,20 – 0,53) - welk anti-TNF wordt iet duidelijk |
|
|
Bongartz JAMA 2006 |
Meta-analyse van placebo-gecontroleerde Mate van Bewijs: II |
|
Zie tabel 1 en 2 |
|
|
|
|
Maligniteiten |
|
Opmerkelijke belangen-verstrengeling |
|
|
Askling ARD209 |
Zweeds Nationaal RA cohort register |
|
1) RA 2) RA 3) algemene populatie
|
|
1) a-TNF 2) geen a-TNF |
2) 3) |
1) 26.981 ptjr 2) 365026 ptjr 3) 3355849 prjr
|
Lymfomen |
1) 26 – Incidentie ratio : 96 2) 336- Incidentie ratio: 92 3)1568 – Incidentie ratio: 47
RR 1 vs 3: 2,71 (1,82 – 4,08) 1 vs 2: 1,35 (0,82 – 2,11) |
- geen uitsplitsing naar welk aTNF |
|
|
O’Dell J rheum 2006 |
Openlabel studie
III |
119 |
Etanercept in combinatie met Sulfa/HCQ/of goud |
|
|
|
|
|
1 mammaca (eta + HCQ) 1 tongca (ETA + HCQ) |
|
|
|
Moreland J Rheum |
Follow up (extenis) etanercept trials – 7 jr
III |
581 (vd 714 ptn) |
RA |
|
|
|
3139 ptjr |
Maligniteiten
|
N= 29(excl non-melanoma huidca/in-situ ca)): 1,0/100 pt yjr Algemene populatie gegevens: 28 verwachte malginiteiten (SEER database)- 12 lymfomen vs 1 verwacht SIR (versus RA): 3.2- 3.7
- 15 niet melanoma huid tumoren (basaal (11) en plaveiselcel(4)),verwacht 8/34 en 4 |
|
|
|
Genovese ARD 2008 |
Opel label extensie – 2 jr III |
317 |
RA |
|
|
|
|
Maligniteiten |
N= 11 3 basaalcel ca 2 plaveselcel ca Rest: gemengd è Geschatte incidentrie 6/600 pt jrè 1/100 pt jr |
|
|
|
Askling ARD 2005 |
1) prevalent RA cohort 2) Incident RA cohort 3) aTNF cohort Gekoppeld met Zweeds oncologie register |
1) 53067
2) 3703
3) 4160 |
RA |
|
|
|
|
Hematologiusche maligniteiten |
500 maligiteiten, bij RA toegenomen risico op lyfoom of leukemie, maar iet op myeloom 1) 481 SIR (algm populatie): 1,7 (1,5-1,8) 2) 15, SIR (alg) 1,6 (0,9-2,6) 3) 11: SIR (alg) 2,1 (1,1-3,8) |
|
|
|
Bombardieri Rheumatology |
III Open-label (React) prospectief Multi-center internationaal |
6610 |
RA 1) voorafgaand a TNF n = 899 2) voorafgaand DMARD n = 5711 |
|
Adalimumab |
|
1) 30 weken 2) 34 weken |
Maligniteiten |
1)1,4 /100 pt jr 2) 1,2 / 100 pt/jr |
|
|
|
FDA 2009 |
III, post-marketing surveillance |
|
Kinderen en adoloscenten met IBD (IFX) 0 – 16 jr en JIA (eta) 0 – 17 jaar |
|
|
|
IFX: 22.645 pt jr ETA: 26.800 pt jr |
|
|
|
|
|
Ho 2009 Al Pharm Ther |
III, PMS |
|
CD |
|
ada |
|
101 pt jr |
|
Colortectaal ca: n = 1 |
|
|
|
Gottlieb ARD 2008 (Abstr) |
III,review van clinical trials (44 RA, JIA, AS PsA an PsO) |
|
PsO |
? |
eta |
|
|
|
SIR plaveiselca(laag zonlicht): 2,1 (1,3 – 3,2) SIR plaveiselca (hoogzonlicht): 5, (3,0 – 7,7)
|
|
|
|
Siegel 2009, Clin Gastr Hep |
II Meta-analyse(9 RCT, 3 case control, 14 case series |
|
Ziekte van Crohn |
|
22 studies:IFX 3 ada 1 certolizumab |
|
21.178 pt jr (n = 8905) |
NHL |
N = 13 Algemene populatie gegevens: (SEER database): 1,9 per 10.000 ptjr SIR: 3,2 ( 1,5 – 6,9)
|
Merendeel eerder behandeld met immunosuppressiva |
|
|
Hannauer, Lancet 2002 |
II RCT |
573: Placebo: 188 (groep I) IFX: 385 (groepen II en III) |
Ziekte van Crohn |
|
IFX 8 wekelijks
|
placebo |
110 weken |
|
Groep I: 2 maligniteiten Groepen II en III: 4 maliniteiten |
At baseline kregen alle 573 ptn IFX |
|
|
Orlando Dig Liv Dis 2005 |
III Multicenter Italiaans |
573 |
Ziekte van Crohn |
|
IFX, maximaal driemaal een infuus |
|
6 mnd |
|
8 maligniteiten |
|
|
|
Fidder Gut 2008 |
III Vergelijking van 2 cohorten |
a)743 IFX b) 666 not-IFX |
IBD |
|
|
|
a) 58 mnd b)144 mnd |
|
Geen verschil in maligniteiten |
|
|
|
Papp, Lancet 2008 |
II RCT |
1230
|
psoriasis |
|
Ustekinumab: Week 0 – 12 Echt plac-gecontroleerd, daarna alleen actieve behandeling (2 dosis) tot week 52 |
|
|
|
IN de 1e 12 weken nauwelijk (cutane) maligniteiten
|
Niet conclusief vanwege studie design |
|
|
EMEA Registratiedossier, adalimumab bij psoriasis |
II |
Placebo:503 Ada: 966 |
psoriasis |
|
adalimumab |
|
Placebo: 148 pt jr Ada: 294 pt jaar |
|
Plac: 2 maligniteiten – 1,4 /100 ptjr Ada: 7 maligniteiten – 2,4 /100 ptjr |
O |
|
|
EMEA Registratie-dossier, etanercept bij psoriasis |
II |
Placebo: 414 Eta:933 |
psoriasis |
|
|
|
|
|
Placebo: 2 maligniteiten Eta 23 maligniteiten (waarvan 10 niet-cutaan) |
Uiteindelijk hebben 1204 ptn teminste 1 dosis etanercept gehad! Placebo incidentie niet goed te bepalen. |
|
|
De Vries Drugs Safety 2008 |
III Cohort |
147 |
IBD |
|
IFX |
|
Mediaan: 59 mnd |
|
9 maligniteiten |
|
|
|
Biancone GUT 2006 |
II |
IFX Geen IFX |
Z v Crohn |
|
|
|
Mediaan: 25 mnd |
|
9 maligniteiten 7 maligniteiten (OR: 1,33 95% B.I:0,46-3,84 |
|
|
|
Colombel JCC 2008 (abstract) ENCORE |
III |
IFX: 1166 Geen IFX: 842 |
Z v Crohn |
|
IFX Geen IFX |
|
13,2 mnd (1506 pt jr) 12,7 mnd ( 1016ptjr) |
|
In beide groepen < 1% hartfalen/ maligniteiten/ sterfte |
IFX gebruik geen voorspeller |
|
|
Lichtenstein DDW 2008 (abstract) TREAT |
III |
IFX:3396 Geen IFX: 2877 |
Z v Crohn |
|
|
|
14184 ptjr 10391 ptjr |
|
Incidentie van maligniteiten: IFX: 0, 43 per 100 ptjr vs geen IFX: 0.56/ 100 ptjr (RR = 0,76,95% B.I. = 0,54–,.07); Lymfomen: IFX 0,04 per 100 ptjr geen IFX 0,05 ( RR = 0,74,95% B.I. 0,24–2,29). |
|
|
http://www.fda.gov/cder/foi/label/2008/125057s114lbl.pdf.


Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-01-2011
Laatst geautoriseerd : 01-01-2011
Geplande herbeoordeling : 01-01-2014
De Nederlandse Vereniging voor Reumatologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. Uiterlijk in 2013 bepaalt de NVR of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De andere aan deze richtlijn deelnemende beroepsverenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid ten aanzien van het bewaken van de actualiteit van de aanbevelingen in de richtlijn. Hen wordt verzocht relevante ontwikkelingen binnen hun vakgebied kenbaar te maken aan de eerstverantwoordelijke.
Algemene gegevens
Met ondersteuning van de afdeling Ondersteuning Professionele Kwaliteit van de Orde van Medisch Specialisten. De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (= SKMS).
Doel en doelgroep
Deze richtlijn geeft een leidraad voor de dagelijkse praktijk van het gebruik van Biologicals. De richtlijn heeft een algemeen karakter, kan gebruikt worden om beroepsspecifieke richtlijnen te formuleren en biedt aanknopingspunten voor bijvoorbeeld lokale (instituuts- of regiogebonden) protocollen en/of zorgafspraken.
De richtlijn is primair geschreven voor medisch specialisten die patiënten met chronische ontstekingsziekten (IMID = Immune Mediated Inflammatory Disorders) behandelen met biologicals, alsmede voor deze patiënten zelf en hun overige behandelaars.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2009 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die met biologicals te maken hebben.
Bij het samenstellen van de werkgroep is rekening gehouden met geografische spreiding en evenredige vertegenwoordiging van verschillende verenigingen, ‘scholen’ en academische achtergrond. De werkgroepleden zijn door de wetenschappelijke verenigingen gemandateerd voor deelname en de samenstelling van de werkgroep is goedgekeurd door alle deelnemende wetenschappelijke verenigingen. De werkgroepleden zijn gezamenlijk verantwoordelijk voor de tekst.
- Dr. D.L. Baeten, reumatoloog, Academisch Medisch Centrum, Amsterdam
- Dr. M. Bijl, reumatoloog, Universitair Medisch Centrum Groningen
- Prof. dr. J.W.J. Bijlsma, reumatoloog, Universitair Medisch Centrum Utrecht (voorzitter)
- Dr. A.A. van Bodegraven, maag-, darm-, leverarts, VU Medisch Centrum, Amsterdam
- Dr. P.L.A. van Daele, internist-klinisch immunoloog, Erasmus Medisch Centrum, Rotterdam
- Prof. dr. M. Drent, longarts, Academisch Ziekenhuis Maastricht
- Mevr. drs. G.J. Geven, Reumapatiëntenbond, Amersfoort
- Mevr. drs. J.W. Hagemeijer, senior adviseur, Orde van medisch Specialisten, Utrecht
- Dr. T.L.Th.A. Jansen, reumatoloog, Medisch Centrum Leeuwarden
- Prof. dr. M.A.F.J. van de Laar, reumatoloog, Medisch Spectrum Twente, Enschede
- Prof. dr. R.B.M. Landewé, reumatoloog, Academisch Ziekenhuis Maastricht
- Prof. dr. W.F. Lems, reumatoloog, VU medisch centrum, Amsterdam
- Dr. M.T. Nurmohamed, reumatoloog, Jan van Breemen Instituut, Amsterdam
- Dr. E. Prens, dermatoloog, Erasmus Medisch Centrum, Rotterdam
- Mevr. drs. M.M.J.H. Scholte-Voshaar, Reumapatiëntenbond, Amersfoort
- Mevr. drs. M. Wessels, informatiespecialist, Orde van Medisch Specialisten, Utrecht
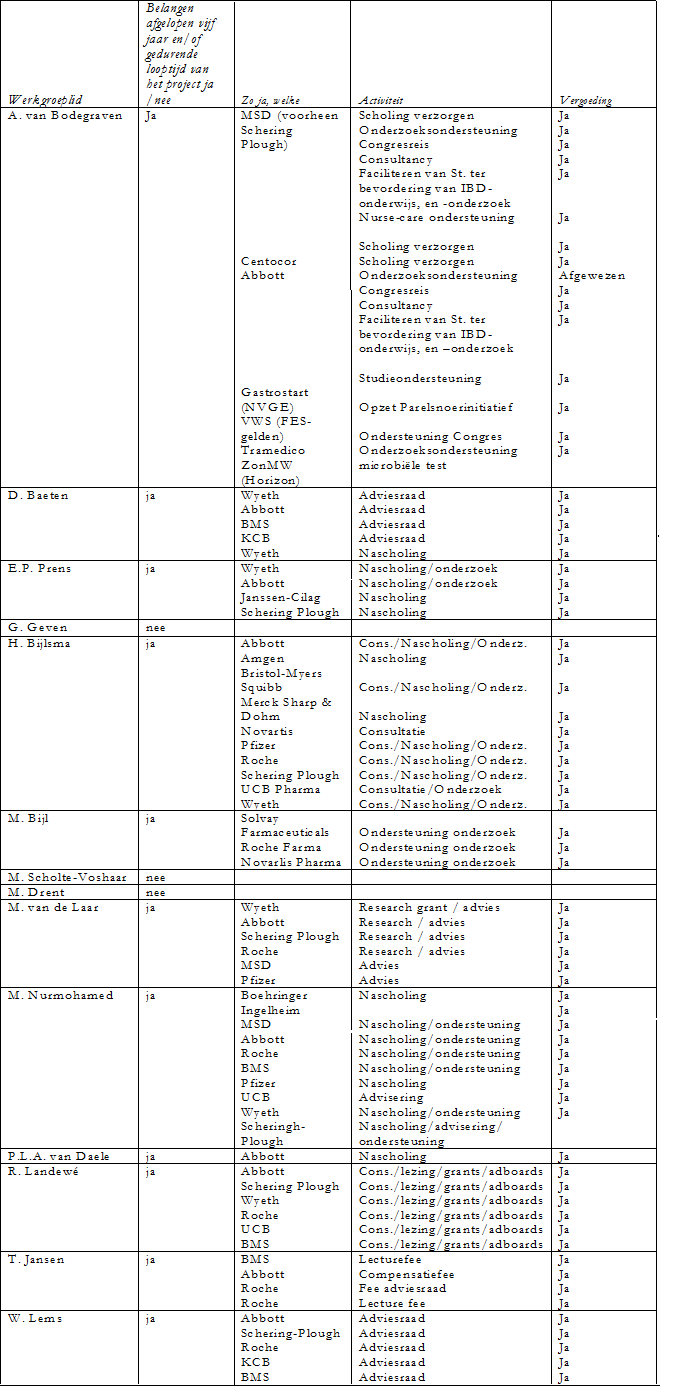
Belangenverklaringen
De werkgroepleden is gevraagd om aan te geven of er sprake is van een mogelijke belangenverstrengeling met commerciële bedrijven. Een overzicht hiervan is hieronder weergegeven. De verklaringen van werkgroepleden over mogelijke financiële belangenverstrengeling ligt ter inzage bij de afdeling Ondersteuning Professionele Kwaliteit van de Orde van Medisch Specialisten. Uit de ingevulde belangenverklaringen blijkt dat de werkgroepleden banden met de farmaceutische industrie hebben en dat deze banden gezien het onderwerp belangrijk zijn. Er wordt geconcludeerd dat deze banden geen invloed hebben gehad bij het totstandkomen van de richtlijn.
Inbreng patiëntenperspectief
Gedurende de ontwikkeling van de richtlijn is nadrukkelijk aandacht besteed aan het in kaart brengen van het patiëntenperspectief. In de werkgroep hebben twee patiëntenvertegenwoordigers zitting genomen en zij brachten het perspectief van de patiënten naar voren tijdens de bespreking van de teksten en de formulering van de aanbevelingen. Daarnaast is halverwege het traject een focusgroep georganiseerd waaraan 9 patiënten hebben deelgenomen. De uitgangsvragen zijn voorgelegd aan de leden van de focusgroep en hen is gevraagd naar hun ervaringen en overwegingen die zij van belang achten bij het formuleren van de aanbevelingen. Hiervan is een verslag gemaakt en aan de leden voorgelegd ter verifiëring en eventuele aanvulling. De leden van het schrijverscollectief hebben gebruikgemaakt van de inhoud van deze documentatie voor de formulering van overwegingen vanuit patiëntenperspectief. Een verslag hiervan is hieronder te vinden.
Patiëntenperspectief – verslag focusgroep
In totaal hebben 9 patiënten hun medewerking verleend aan het in kaart brengen van het patiëntenperspectief. Twee mannelijke patiënten met Sarcoidose met Remicade (via infuuskliniek (1 X p.m.) of Humira zelf injecteren (1X p.w.), één mannelijke patiënt met Psoriasis Enbrel zelf injecteren (1X p.w.), twee vrouwen met RA (Enbrel en Rituximab), één mannelijke patiënt met RA (Enbrel), twee vrouwelijke patiënten met Ziekte van Crohn (Humira en Remicade).
Drie personen waren aanwezig bij de focusgroepbijeenkomst die gehouden is op 12 november 2009. De overige 5 personen waren niet in staat om aanwezig te zijn en hebben op digitale wijze hun input geleverd door per uitgangsvraag hun ervaringen terug te koppelen.
Naast het bespreken van de ervaringen is ook gevraagd naar overwegingen die vanuit het perspectief van de patiënt van belang zijn en die naar hun idee meegewogen dienen te worden bij de formulering van de aanbevelingen.
Uit de besprekingen is naar voren gekomen dat de patiënten de geformuleerde uitgangsvragen complex vinden. De patiënten hebben aangegeven dat het maken van een patiëntenversie van de richtlijn belangrijk is omdat nog veel onduidelijk is over het gebruik van biologicals. Door het ontwikkelen van een patiëntenversie van de richtlijn ontvangen de patiënten een instrument waarmee zij ook kunnen bijdragen aan het goed en verantwoord gebruik van biologicals. Hierbij is als voorwaarde gesteld dat de patiëntenversie toegankelijk geschreven moet worden.
Alle deelnemers waren lid van een patiëntenvereniging en ervaren dit als zeer plezierig. Het geeft onder meer de mogelijkheid tot het uitwisselen van informatie met lotgenoten.
VOORAFGAANDE AAN DE BEHANDELING MET BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 1: - Patiënten geven aan dat de aanloop naar de behandeling met biologicals overwegend een langdurig proces is geweest. Er wordt overgegaan tot biologicals als alle andere behandelingsvormen niet blijken te helpen of te veel bijwerkingen veroorzaken. - Patiënten vinden het belangrijk dat alle aspecten die van belang zijn bij de behandeling van biologicals worden onderzocht, maar hebben geen zicht op welke aspecten dit dan moeten zijn. Zij geven aan dat het echter belangrijk is dat zij door de specialist of door de verpleegkundige deelgenoot worden gemaakt van het afwegingsproces door informatie te ontvangen zodat zij zelf actief kunnen meewerken aan het zorgproces. |
Overweging vanuit het patiëntenperspectief bij UV 2: - Patiënten vinden het belangrijk dat de arts door wie zij worden behandeld deskundig is, zodat zij erop kunnen vertrouwen in goede handen te zijn. - De (voorschrijvende) medisch specialist dient de regie in handen te houden en daarbij is het overleg met de andere betrokken professionals belangrijk. - Het is belangrijk dat de professionals communicatief zijn en duidelijk uitleg kunnen geven op niveau van de leek. Daarnaast is het wenselijk dat de medisch specialist toegankelijk en laagdrempelig is bij vragen; te weten via de telefoon of email. - Als het niet goed gaat met de patiёnt is het belangrijk dat de medisch specialist confronterend en direct is door aan te geven dat het helemaal niet goed gaat, dat de patiënt zich overvraagt of dat bijvoorbeeld gestopt moet worden met werken. Het is daarbij belangrijk dat de patiënt geen ruimte wordt gegeven om te marchanderen. - De partner is samen met de patiënt ziek en hiermee een essentiёle schakel die duidelijk betrokken behoort te worden in het zorgproces. |
BIJWERKINGEN VAN BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 3: - Patiënten vinden het belangrijk dat zij duidelijke en volledige (zowel schriftelijke als mondelinge) informatie ontvangen over de bijwerkingen die zich kunnen voordoen bij een behandeling met biologicals. - Patiënten vinden het belangrijk dat, als zij bijwerkingen ervaren, duidelijk is tot wie zij zich moeten richten, dus tot de huisarts of de medisch specialist. - Patiënten vinden het belangrijk dat, als zij bijwerkingen ervaren, hier serieus naar wordt gekeken en deskundig op wordt geacteerd. - Patiënten vinden het belangrijk dat zij instructies ontvangen wat zij zelf kunnen doen om bepaalde bijwerkingen te voorkomen. |
Overweging vanuit het patiëntenperspectief bij UV 4: - Patiënten vinden het belangrijk dat zij informatie ontvangen over de het risico op kanker bij biologicals. - Patiënten vinden het belangrijk dat zij actief worden gevolgd op het mogelijk ontstaan van kanker. |
ZWANGERSCHAP EN BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 5: Op basis van de focusgroep zijn geen overwegingen aan te dragen. |
BIOLOGICALS EN (OPERATIEVE) INGREPEN: |
Overweging vanuit het patiëntenperspectief bij UV 6: - Patiënten vinden het belangrijk dat de voorschrijvend specialist betrokken is bij het besluitvormingsproces van een operatie. Daarbij is het essentieel dat er direct contact is tussen de betrokken specialisten. - Patiënten vinden het belangrijk dat zij in bezit zijn van een ‘kaartje’ waarop staat dat zij biologicals gebruiken en dat met de specialist contact opgenomen moet worden in geval van tandheelkundige of operatieve ingrepen. - Patiënten vinden het belangrijk dat zij informatie ontvangen over de stappen die gezet moeten worden bij het staken of doorgaan van biologicals bij een operatie. Hierdoor zijn zij in staat zelf actief mee te werken en hebben meer het gevoel controle te hebben over hun behandeling met biologicals. |
FOLLOW-UP VAN DE BEHANDELING MET BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 7: - Patiënten vinden het belangrijk dat zij regelmatig (om de 3 tot 6 mnd) door de medisch specialist worden onderzocht waarbij de werking van de biologicals in kaart wordt gebracht. - Patiënten vinden het belangrijk dat zij worden geinformeerd over de uitslag van de periodieke controle zodat zij deelgenoot zijn van het zorgproces. - Patiënten geven aan geconfronteerd te worden met een veelheid aan informatiestromen die regelmatig tegenstrijdig zijn. Zij vinden het belangrijk dat hier meer regie over gevoerd gaat worden. - Patiënten vinden het belangrijk dat professionels aangeven wanneer men geen duidelijkheid ten aanzien van bepaalde vraagstukken kunnen geven omdat nog zoveel onbekend is bij de behandeling van biologicals. - Patiënten vinden het belangrijk regelmatig contact te hebben met de (specialistisch) verpleegkundige zodat zij eventuele vragen kan beantwoorden. |
BIOLOGICALS EN VACCINATIE: |
Overweging vanuit het patiëntenperspectief bij UV 8: - Patiënten vinden het belangrijk dat zij (tijdig) informatie ontvangen over welke vaccinaties zij toegediend kunnen krijgen. - Patiënten vinden het belangrijk dat zij informatie ontvangen bij welke verschijnselen, nadat zij een vaccinatie hebben ontvangen, zij contact op moeten nemen met de medisch speicalist. |
DE BEHANDELING MET BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 9: - Patiënten vinden het belangrijk dat de arts door wie zij worden behandeld deskundig is en over de meest recente inzichten beschikt zodat zij erop kunnen vertrouwen in goede handen te zijn. - De (voorschrijvende) medisch specialist dient de regie in handen te houden en daarbij is het overleg met de andere betrokken professionals belangrijk. - Het is belangrijk dat de professionals communicatief zijn en duidelijk uitleg kunnen geven op niveau van de leek. Daarnaast is het wenselijk dat de medisch specialist toegankelijk en laagdrempelig is bij vragen; te weten via de telefoon of email. - Als het niet goed gaat met de patiёnt is het belangrijk dat de medisch specialist confronterend en direct is door aan te geven dat het helemaal niet goed gaat, dat de patient zich overvraagt of dat bijvoorbeeld gestopt moet worden met werken. Het is daarbij belangrijk dat de patiënt geen ruimte wordt gegeven om te marchanderen. |
LANGDURIG VERBLIJF ELDERS: |
Overweging vanuit het patiëntenperspectief bij UV 10: - Patiënten vinden het belangrijk dat zij informatie ontvangen over: - hoe zij de biologicals het beste naar het buitenland kunnen vervoeren; - naar welke gebieden zij kunnen reizen; - de mogelijkheden om in het buitenland een infuus met biologicals te ontvangen.
|
Methode ontwikkeling
Evidence based
Implementatie
Tijdens de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de uitvoerbaarheid van de aanbevelingen. Daarbij is gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn is verspreid onder alle relevante beroepsgroepen en instellingen. Een samenvatting van de richtlijn is gepubliceerd in het Nederlands Tijdschrift voor Geneeskunde en in tijdschriften van de deelnemende wetenschappelijke verenigingen.
Werkwijze
De werkgroep heeft een jaar aan de totstandkoming van de richtlijn gewerkt. Binnen de werkgroep was een schrijverscollectief ingesteld. De leden van het schrijverscollectief zochten systematisch naar literatuur en beoordeelden kwaliteit en inhoud ervan. Vervolgens schreven zij een concepttekst waarin de literatuur werd verwerkt. Tijdens vergaderingen lichtten zij hun teksten toe aan de overige leden van de werkgroep. De conceptrichtlijn is in februari 2010 schriftelijk aan alle betrokken wetenschappelijke verenigingen aangeboden en gevraagd de richtlijn aan hun leden voor te leggen. Daarnaast is de richtlijn ook naar wetenschappelijke verenigingen gestuurd die niet in de werkgroep hebben geparticipeerd, te weten oogartsen, neurologen, gynaecologen en tandartsen. De ontvangen commentaren zijn, waar relevant bevonden, verwerkt in de definitieve richtlijn.
Wetenschappelijke onderbouwing
De onderbouwing van de richtlijn is mede gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht met systematische zoekacties. Er werd gezocht tussen 1998 en 2009 in Medline en Embase. Voor de oriënterende search werd ook gezocht in de Cochrane Library en werd specifiek gezocht naar al bestaande richtlijnen in online raadpleegbare (inter)nationale guideline clearinghouses.
Hierbij werd de taal gelimiteerd tot Nederlands, Engels, Duits en Frans. Daarnaast werden artikelen geëxtraheerd uit referentielijsten van opgevraagde literatuur. Dit leverde bij enkele uitgangsvragen nog aanvullende artikelen op.
Doordat de uitgangsvragen niet gericht waren op het beoordelen van de effectiviteit van de interventies maar veelal gingen over bijwerkingen, complicaties en diagnostiek bleek een beperking tot systematische reviews en RCTs vaak niet zinvol. De searches zijn verricht in mei en juni 2009. Voor alle uitgangsvragen is gebruik gemaakt van een uniforme formulering van de patiëntencategorie en de interventie.
Voor de gehanteerde zoektermen wordt verwezen naar Appendix 1. Op verzoek zijn de volledige zoekstrategieën beschikbaar. Daarnaast werden artikelen geëxtraheerd uit referentielijsten van opgevraagde literatuur en zijn enkele relevante publicaties tot 1 november 2009 meegenomen. Lopend onderzoek is buiten beschouwing gelaten. Abstracts van congressen van de afgelopen 2 jaar (november 2007 tot 1 november 2009) zijn meegenomen bij de selectie van de literatuur. Relevante informatie vanuit deze abstract wordt uitgewerkt bij de overige overwegingen. Onder samenvatting van de literatuur / conclusies worden alleen gepubliceerde onderzoeken / richtlijnen uitgewerkt.
De geselecteerde artikelen zijn beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is de standaardindeling gebruikt: zie tabel 1. Na selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De beoordeling van de verschillende artikelen is opgenomen onder het kopje ‘samenvatting van de literatuur’. Het wetenschappelijk bewijs is vervolgens kort samengevat in een ‘conclusie’. De belangrijkste literatuur waarop deze conclusie is gebaseerd staat bij de conclusie vermeld, inclusief de mate van bewijs (zie tabel 2).
Voor het formuleren van een aanbeveling zijn, naast het wetenschappelijk bewijs, vaak nog andere aspecten van belang, bijvoorbeeld patiëntenvoorkeuren, kosten, beschikbaarheid of organisatorische aspecten. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘overwegingen’. In de overige overwegingen spelen de ervaring en de mening van de werkgroepleden een belangrijke rol. De ‘aanbeveling’ is het resultaat van de combinatie van het beschikbare bewijs en de overige overwegingen.
Voor een aantal uitgangsvragen zijn evidencetabellen gemaakt en deze zijn te raadplegen in Appendix 3.
Tabel 1: Indeling van methodologische kwaliteit van individuele studies
|
|
Interventie |
Diagnostische accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohort-onderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiënt-controleonderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Tabel 2: Niveau van bewijs van de conclusie
|
Conclusie gebaseerd op |
|
|
1 |
Onderzoek van niveau A1 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
Eén onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
Eén onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Deze (concept)richtlijn is opgesteld aan de hand van het Appraisal of Guidelines for Research & Evaluation (AGREE) instrument. Dit instrument is in een Europees verband opgesteld om de procedurele kwaliteit van richtlijnen te kunnen beoordelen. Door de aspecten van AGREE te verwerken in de inleiding van de richtlijn, wordt duidelijk aan welke kwaliteitseisen is voldaan.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
