Vroege effecten bij kind door benzodiazepinen
Uitgangsvraag
-
Is er een verband tussen benzodiazepinegebruik in de zwangerschap en vroege, neonatale effecten (geboortegewicht; dysmaturiteit/ Small for Gestational Age (SGA) en macrosomie; Apgar score; navelstreng pH; opname kinderafdeling; opname NICU; intoxicatie verschijnselen (‘floppy infant’ syndroom; tonusproblemen, ademhalingsdepressie en hypotensie); onttrekkingsverschijnselen (tonusproblemen; voedingsproblemen; tremoren; prikkelbaarheid en convulsies)?
-
Welke specifieke factoren dragen bij aan het optreden van deze vroege effecten bij de pasgeborene (dosering en duur, tijdstip in de zwangerschap)?
-
Hoe lang blijven deze symptomen aanwezig per middel?
-
Welke benzodiazepinen hebben de voorkeur voor gebruik in de zwangerschap gezien het risico op vroege effecten?
Aanbeveling
Zorgverleners moeten bedacht zijn op het mogelijk optreden van neonatale adaptatieproblemen met name bij hoge dosering, chronisch gebruik, comedicatie en/of vroeggeboorte. Het is aan te bevelen ouders hierover voor te lichten.
De werkgroep is van mening dat bij incidenteel gebruik van een benzodiazepine tijdens de zwangerschap de bevalling niet expliciet in een eerstelijns geboortecentrum of ziekenhuis hoeft plaats te vinden.
Bij intermitterend benzodiazepinegebruik in het 3e trimester wordt, vanwege het toegenomen risico op een lage Apgarscore en respiratoire problemen, aangeraden om minimaal met een plaatsindicatie (B-D indicatie: klinische bevalling onder verantwoordelijkheid van de eerstelijns verloskundige of verloskundig huisarts) te bevallen. Klinische observatie van de pasgeborene na de eerste opvang is niet geïndiceerd, mits het kind in goede klinische conditie is en ouders en kraamzorg goed geïnstrueerd worden over het mogelijk optreden van neonatale adaptatiestoornissen.
De werkgroep adviseert in gevallen van hoge dosering, chronisch gebruik en/of comedicatie in het laatste trimester of bij vroeggeboorte in combinatie met benzodiazepinegebruik een medische partus (C indicatie) en klinische observatie van de pasgeborene. De duur van de klinische observatie van de pasgeborene dient individueel en door de kinderarts bepaald te worden.
Overwegingen
Er is erg weinig onderzoek beschikbaar waarin de effecten van het gebruik van alleen benzodiazepinen, zonder comedicatie, in de zwangerschap zijn beschreven. Meestal gebruiken zwangeren die benzodiazepinen gebruiken, ook andere geneesmiddelen.
De belangrijkste vroege effecten na intra-uteriene blootstelling aan benzodiazepinen zijn SGA, lage Apgarscore en respiratoire problemen. Tevens worden neurologische verschijnselen als hypotonie en thermoregulatieproblemen beschreven (Owen, 1972; Kanjilal, 1993). Ook meldt de literatuur neonatale hyperbilirubinemie (Drew, 1976).
In het onderzoek van Calderon (2009) waarbij perinatale uitkomsten na psychofarmacagebruik tijdens de zwangerschap werden onderzocht, was in de benzodiazepinegroep het risico op een Apgarscore <5 bij 5 minuten verhoogd, OR 3.87 (95% BI 1.53-9.76) en kwam vaker respiratory distress syndrome voor, OR 3.74 (95% BI 1.86-7.54). Wikner beschreef een significant verhoogd risico op een lage Apgarscore (<7 bij 5 minuten), OR 2.02 (95% BI 1.13-3.65) en op respiratoire problemen, OR 2.21 (95% BI 1.62-3.02) na late intra-uteriene blootstelling aan benzodiazepinen. Er is in beide onderzoeken echter niet gecorrigeerd voor comedicatie.
Factoren die mogelijk van invloed zijn op het optreden en de ernst van deze effecten zijn dosis, farmacokinetische eigenschappen, tijdstip voor de bevalling en duur van het gebruik. Tevens kan comedicatie zoals antidepressiva de effecten versterken (Kallen 2012, Calderon, 2009; Wikner, 2007; Kanjilal, 1993). Dit is voor deze groep patiënten van belang, omdat benzodiazepinen vaak in combinatie met andere middelen gebruikt worden. Het is mogelijk dat de invloed van intraveneuze of intramusculaire toediening van benzodiazepinen anders is dan de invloed van orale toediening die vaak voor slaap- en angststoornissen wordt gebruikt – het onderwerp van deze richtlijn. De voor deze richtlijn onderzochte literatuur betreft daarom voornamelijk oraal gebruik.
Enkele onderzoeken laten zien dat de halfwaardetijd van benzodiazepinen bij pasgeborenen langer is dan bij volwassenen (Cree, 1973; Tomson, 1976). Dit is waarschijnlijke het gevolg van een nog onrijpe leverfunctie van de pasgeborene. Hierdoor kunnen soms hogere concentraties in het bloed van de baby aanwezig zijn dan bij de moeder (Gamble, 1977). Een duidelijke relatie met symptomen is echter niet aangetoond, hoewel Kanjilal, 1993 heeft beschreven dat hypotonie en een abnormale ademhaling vaker voorkomen na een hogere maternale dosering.
Er zijn geen onderzoeken gevonden waarbij gekeken is naar effecten specifiek bij prematuren of zieke pasgeborenen na benzodiazepinegebruik, maar het is aannemelijk dat adaptatieproblemen duidelijker aanwezig kunnen zijn in deze groep.
Daar een hoger risico op lage Apgarscore en respiratoire problemen beschreven zijn, wordt een (poli)klinische partus geadviseerd om optimale omstandigheden voor de opvang te waarborgen. Dit geldt vooral bij hoge dosering, chronisch gebruik of comedicatie.
In het algemeen zijn de beschreven vroege effecten van voorbijgaande aard. Afhankelijk van de ernst van de symptomen kan opname geïndiceerd zijn. De oorzaak van de neonatale effecten kunnen het gevolg zijn van zowel intoxicatie als onttrekking. Er is één studie (Kanjilal, 1993) die heeft beschreven dat de effecten als hypotonie en hypoactiviteit na 24 uur verdwenen zijn. Langdurige observatie van de pasgeborene lijkt dan ook niet noodzakelijk. Na hoge dosering, chronisch gebruik of comedicatie wordt klinische observatie wel geadviseerd. De duur van de observatie wordt individueel en door de kinderarts bepaald. Factoren als zwangerschapsduur, duur en dosering van het gebruik of het gebruik van comedicatie worden hierin meegenomen.
Onderbouwing
Achtergrond
Benzodiazepinen passeren de placenta. Neonatale effecten zijn na zowel chronisch als incidenteel gebruik beschreven. In deze module wordt ingegaan op de vroege, neonatale effecten na maternaal benzodiazepinegebruik. Omdat de verschijnselen van adaptatie, intoxicatie en onttrekking niet altijd goed onderscheiden kunnen worden, wordt gesproken over ‘neonatale adaptatieverschijnselen’ als overkoepelend begrip.
Conclusies / Summary of Findings
Niet nader gespecificeerde benzodiazepinen
|
Kwaliteit van bewijs ZEER LAAG |
In één onderzoek was de incidentie van het optreden van een lager geboortegewicht hoger na benzodiazepinegebruik. Laegreid, 1992 |
|
Kwaliteit van bewijs ZEER LAAG |
In twee onderzoeken die benzodiazepinen als groep hebben onderzocht, worden lagere Apgarscores en vaker opname van de pasgeborene beschreven. Laegreid, 1992, Kallen 2012 |
|
Kwaliteit van bewijs ZEER LAAG |
In twee onderzoeken werden bij aan benzodiazepinen blootgestelde pasgeborenen meer neurologische verschijnselen, een hoger risico op respiratoire problemen of vaker verdenking op infectie gezien. Laegreid, 1992, Kallen 2012 |
|
Kwaliteit van bewijs ZEER LAAG |
Hogere doseringen benzodiazepinen leiden tot ernstigere neurologische verschijnselen bij de pasgeborene in één onderzoek. Laegreid, 1992 |
Afzonderlijke benzodiazepinen
|
Kwaliteit van bewijs ZEER LAAG |
In één onderzoek werd geconcludeerd dat zolpidemgebruik in de zwangerschap mogelijk tot meer SGA leidt. Wang, 2010 |
|
Kwaliteit van bewijs ZEER LAAG |
Zopiclongebruik in de zwangerschap had geen invloed op SGA in één onderzoek. Diav-Citrin, 1999 |
|
Kwaliteit van bewijs ZEER LAAG |
Intraveneus of oraal diazepam- of lorazepamgebruik durante partu lijkt geen effect te hebben op de Apgarscores. Gamble, 1977; McBride, 1979; Yeh, 1974 |
|
Kwaliteit van bewijs ZEER LAAG |
Intraveneus diazepamgebruik durante partu had geen effect op de navelstreng pH’s of op het neurologisch functioneren van de pasgeborene 72 uur postpartum in één onderzoek. Yeh, 1974 |
|
Kwaliteit van bewijs ZEER LAAG |
Gebruik van lorazepam voorafgaande aan inleiding, had geen effect op het voedingsgedrag van de pasgeborene in één onderzoek. Johnstone, 1982 |
|
Geen bewijs |
Er is geen adequaat onderzoek beschikbaar over de duur van vroege neonatale effecten na gebruik van benzodiazepinen. |
|
Geen bewijs |
Er is geen adequaat onderzoek beschikbaar om te bepalen welke benzodiazepinen de voorkeur hebben in de zwangerschap met het oog op het risico op vroege neonatale effecten. |
Samenvatting literatuur
Uitgangsvraag 1: Is er een verband tussen benzodiazepinegebruik in de zwangerschap en vroege, neonatale effecten?
Na beschouwing van artikelen over benzodiazepinegebruik in het algemeen worden de effecten van specifieke benzodiazepinen beschreven.
Geboortegewicht en SGA
Benzodiazepinegebruik in het algemeen
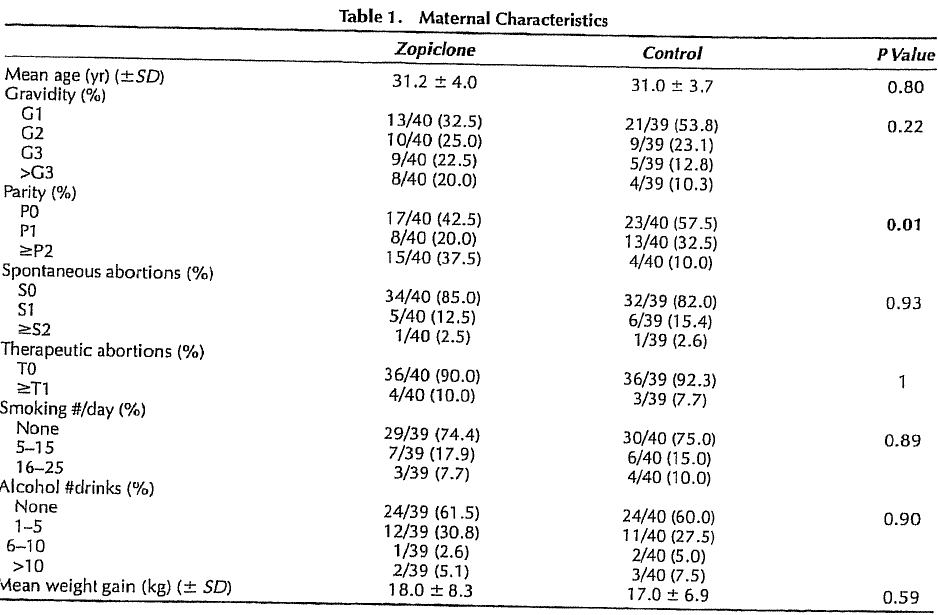
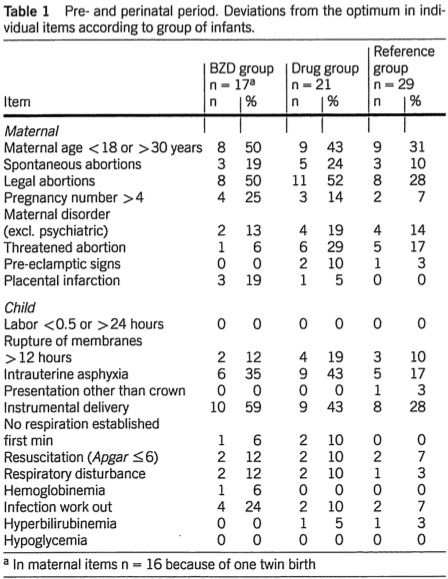
In het onderzoek van Laegreid werden 16 vrouwen (17 kinderen) met benzodiazepinegebruik vergeleken met 21 vrouwen met ander psychofarmacagebruik en met 29 vrouwen zonder psychofarmacagebruik tijdens de zwangerschap. Er was een significant verschil in het geboortegewicht, gecorrigeerd voor zwangerschapsduur in de benzodiazepinengroep (gemiddelde standaarddeviatie; -0.5 SD ±0.7 SD) vergeleken met de andere psychofarmacagroep (gemiddelde standaarddeviatie 0.3 SD ±1.2 SD) en een nagenoeg significant verschil vergeleken met de referentiegroep (gemiddelde standaarddeviatie 0.1 SD ±1.2 SD).
Afzonderlijke middelen
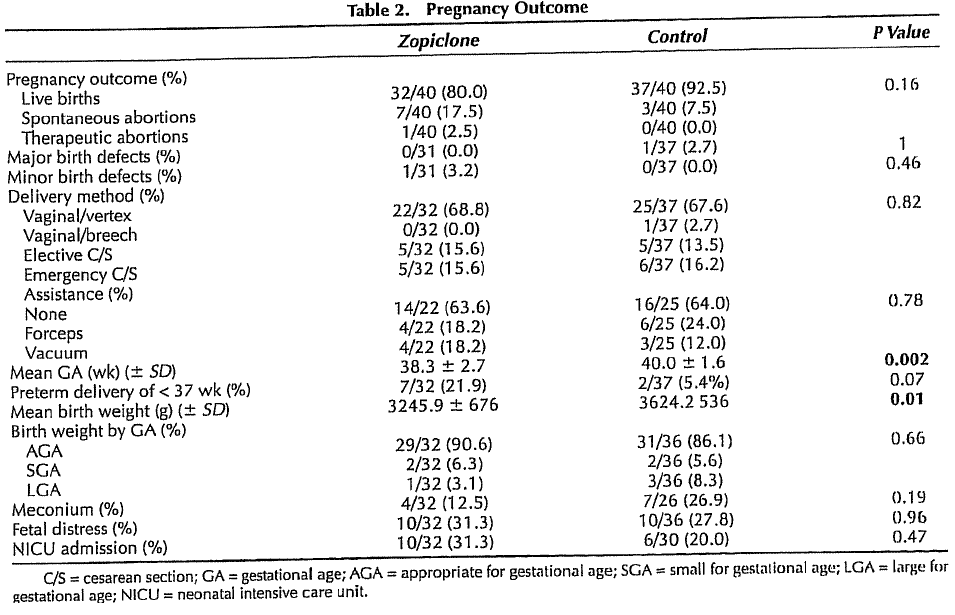
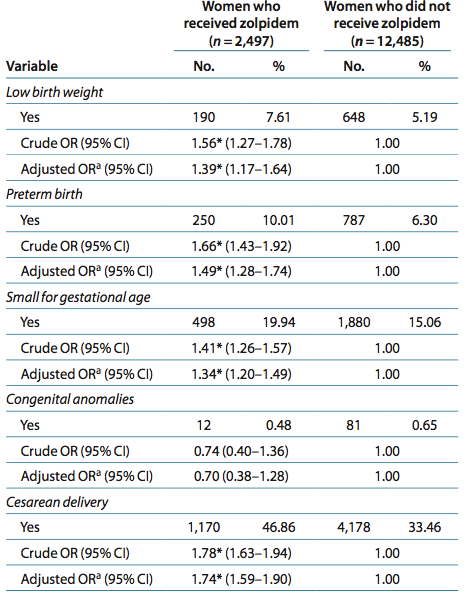
Wang gebruikte een Taiwanees cohort van 2497 zwangeren die zolpidem gebruikten en vergeleek met vrouwen die dit middel niet gebruikten. In de zolpidemgroep was er meer SGA (OR 1.34, 95% BI 1.28-1.74).
Diav-Citrin heeft 40 vrouwen die zoplicon gebruikten onderzocht. In de zoplicongroep was het geboortegewicht significant lager, echter na correctie voor zwangerschapsduur was er geen significant verschil tussen beide groepen.
Apgarscore en navelstreng pH
Benzodiazepinegebruik in het algemeen
In het onderzoek van Laegreid was het percentage kinderen met een lage Apgarscore iets hoger ten opzichte van de groep met andere psychofarmaca en de groep zonder psychofarmaca.
In de studie van Kallen werden vaker neonatale complicaties, zoals een Apgarscore <7 gezien na het gebruik van benzodiazepinen en benzodiazepine agonisten. Dit effect was sterker in combinatie met SSRI’s.
Afzonderlijke middelen
Yeh onderzocht 31 vrouwen die diazepam intraveneus (IV) kregen tijdens de partus. Drie kinderen hadden een lage Apgarscore na 1 minuut, echter er werd geen verband met diazepam gelegd (één stuitextractie, één schouderdystocie en één cardiaal arrest na vagale stimulatie door uitzuigen). Er werd geen effect op de navelstreng pH gevonden.
Gamble heeft bij 11 patiënten diazepamconcentraties gemeten in navelstrengbloed nadat minder dan vier uur voor de geboorte intraveneus diazepam werd toegediend. Er was geen correlatie tussen de diazepamconcentratie en de Apgarscores.
In het onderzoek van McBride werd intraveneus lorazepam toegediend voor de inleiding (n=10) of voor de uitdrijving (n=12). In geen van beide groepen werd een relatie gevonden tussen neonatale lorazepamconcentraties en Apgarscores.
Opname kinderafdeling of NICU
Benzodiazepinegebruik in het algemeen
In het onderzoek van Laegreid werd een verschil gezien in opname van de pasgeborene op de kinderafdeling; 41% in de benzodiazepine-, 19% in de andere psychofarmacagroep en 14% in de referentiegroep. Dit verschil was niet significant.
Afzonderlijke middelen
Er is geen adequaat onderzoek beschikbaar voor het beantwoorden van de vraag of er een verband is tussen het gebruik van afzonderlijke benzodiazepinen in de zwangerschap en het risico op een opname op de kinderafdeling of NICU.
Adaptatieverschijnselen
In de literatuur wordt geen duidelijk onderscheid gemaakt tussen intoxicatieverschijnselen en onttrekkingsverschijnselen.
Benzodiazepinegebruik in het algemeen
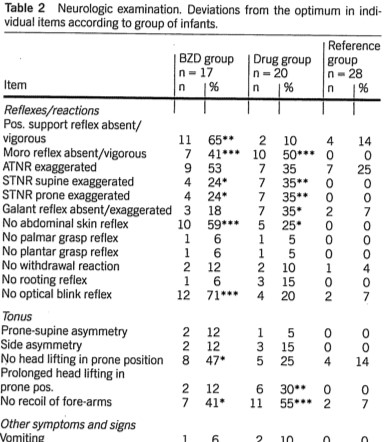
In het onderzoek van Laegreid, waarin vrouwen met benzodiazepine-, ander psychofarmaca- of geen middelengebruik in de zwangerschap werden vergeleken, werd bij iedere pasgeborene uitgebreid lichamelijk neurologisch onderzoek gedaan. Pasgeborenen in de benzodiazepine- en andere psychofarmacagroep, hadden meer neurologische verschijnselen (verminderde reflexen, regurgitatie en slaperigheid) dan de niet-blootgestelde pasgeborenen. Tevens kwamen in de benzodiazepinegroep meer respiratoire problemen en verdenking op infectie voor.
In het onderzoek van Kallen werden vaker neonatale complicaties, zoals respiratoire verschijnselen en hypoglycemie, gezien na het gebruik van benzodiazepinen en benzodiazepine agonisten. Dit effect was sterker in combinatie met SSRI’s.
Afzonderlijke middelen
Johnstone diende vrouwen 1 uur voor de start van inleiding van de baring 5 mg lorazepam toe. In dit onderzoek werd geen verschil in drinkgedrag van de pasgeborenen na lorazepamgebruik (n=18) gevonden vergeleken met niet-blootgestelde pasgeborenen.
Yeh (1974) onderzocht het effect van intraveneus diazepam durante partu. Na 72 uur werd bij alle pasgeborenene een lichamelijk neurologisch onderzoek uitgevoerd door de kinderarts; hierbij werden geen afwijkingen gezien.
Uitgangsvraag 2: Welke specifieke factoren dragen bij aan het optreden van deze vroege effecten bij de pasgeborene? (dosering en duur, tijdstip in de zwangerschap)?
In het onderzoek van Laegreid werden vrouwen met benzodiazepinegebruik vergeleken met vrouwen met ander psychofarmacagebruik en vrouwen zonder psychofarmacagebruik in de zwangerschap. De pasgeborenen van de moeders met de hoogste dosering benzodiazepinen in de zwangerschap (dagelijks 60 mg oxazepam in combinatie met 30 mg diazepam of dagelijks 5-15 mg lorazepam) vertoonden ernstiger symptomen (sufheid, agitatie en hypotonie), dan de lager gedoseerde moeders.
Uitgangsvraag 3: Hoe lang blijven deze symptomen aanwezig per middel?
Er is geen adequaat onderzoek beschikbaar voor het beantwoorden van de vraag hoe lang vroeg neonatale effecten aanwezig blijven na benzodiazepinegebruik door de moeder.
Uitgangsvraag 4: Welke benzodiazepinen hebben de voorkeur voor gebruik in de zwangerschap gezien het risico op vroege neonatale effecten?
Er is geen adequaat onderzoek beschikbaar voor het beantwoorden van de vraag welke benzodiazepinen de voorkeur hebben voor gebruik in de zwangerschap, gezien het risico op vroeg neonatale effecten.
Zoeken en selecteren
Van de 559 gevonden onderzoeken bleken er acht (Diav-Citrin, 1999; Gamble, 1977; Johnstone, 1982; Laegreid, 1992; McBride, 1979; Wang, 2010; Yeh, 1974, Kallen, 2012) bruikbaar voor het beantwoorden van de uitgangsvragen. Zie tabblad 'Verantwoording' voor de zoekverantwoording en kopje 'Evidence tabellen' voor de evidencetabel. Het artikel van Kallen 2012 is geincludeerd, ondanks dat deze na de sluitingsdatum van de zoekopdrachten (november 2011) is gepubliceerd, omdat het een relevant artikel is voor het beantwoorden van de uitgangsvragen.
Grade tabel
|
Beoordeling van kwaliteit |
Kwaliteit |
||||||
|
Aantal studies |
Studie ontwerp |
Studie beperkingen |
Inconsistentie |
Indirectheid |
Imprecisie |
Andere opmerkingen |
|
|
Vroege neonatale effecten (benzodiazepinen in het algemeen) |
|||||||
|
7 |
Observationele studies |
Zeer ernstige beperkingen1- 8 |
Ernstige inconsistentie6-7 |
Geen ernstige indirectheid |
Geen ernstige imprecisie |
Geen |
ZEER LAAG |
|
Verband dosering, duur en tijdstip expositie benzodiazepinen |
|||||||
|
1 |
Observationele studie |
Ernstige beperkingen 1 |
Geen ernstige inconsistentie |
Geen ernstige indirectheid |
Ernstige imprecisie 1 |
Geen |
ZEER LAAG |
1 Laegreid; 67 inclusies, wv ernstige imprecisie. Onbekend of moeders ook andere geneesmiddelen gebruiken, wat een studie beperking is.
2 Wang; geen correctie voor roken, alcohol of gebruik van andere medicatie. De dosis van de medicatie is onbekend en zo ook de duur van het gebruik. Echter wel informatie over duur en tijdstip van expositie. Mogelijke bias, zijn allemaal levende kinderen, echter niet zeker.
3 Diav-Citrin; Het is onzeker of zwangeren de voorgeschreven medicatie daadwerkelijk hebben genomen. Er is geen zekerheid over de dosering en duur van gebruik en het risico op complicaties. De studie kan ongemeten waarden, als ander medicatiegebruik niet uitsluiten.
4 Johnstone; Alleen flesgevoede kinderen en geen correctie voor confounders
5 Gamble; Geen correctie voor confounders, ander medicatiegebruik is onbekend en de modus partus wordt niet genoemd.
6 McBride; Geen correctie voor confounders, ander medicatiegebruik wordt niet genoemd. Inconsistentie wegens IV gebruik
7 Yeh; Selectiecreteria niet omschreven, verder 2 PE patienten, 1 diabeet en 1 SSRI gebruikster (ongelijk verdeeld over de groepen). Inconsistentie wegens IV gebruik. Ander medicatiegebruik is onbekend.
8 Kallen; Niet goed omschreven uitkomsten voor deze module, wegens heretogeniteit met andere geincludeerde studies; gedowngrade
Referenties
- Calderon-Margalit R, Qiu C, Ornoy A, Siscovick DS, Williams MA. Risk of preterm delivery and other adverse perinatal outcomes in relation to maternal use of psychotropic medications during pregnancy. Am J Obstet Gynecol 2009;201:579-88.
- Cree JE, Meyer J, Hailey DM. Diazepam in labour: its metabolism and effect on the clinical condition and thermogenesis of the newborn. BMJ 1973; 4(5887):251-5.
- Diav-Citrin O, Okotore B, Lucarelli K, Koren G. Pregnancy outcome following first-trimester exposure to zopiclone: a prospective controlled cohort study. Am J Perinatol 1999;16(4):157-60.
- Drew JH, Barrie J, Horacek I, Kitchen WH. Factors influencing jaundice in immigrant Greek infants. Arch Dis Child 1978; 53:49-52.
- Gamble J, Moore J, Lamki H, Howard P. A study of plasma diaepam levels in mother and infant. Brit J Ob Gyn 1977;84:588-91.
- Johnstone M. The effect of lorazepam on neonatal feeding behaviour at term. Pharmatherapeutica 1982;3:259.
- Källén B, Reis M. Neonatal complications after maternal concomitant use of SSRI and other central nervous system active drugs during the second or third trimester of pregnancy. J Clin Psychopharmacol 2012;32:608-14.
- Kanjilal S, Pan N, Chakraborty D, Mukherjee N. Cord bllod diazepam: Clinical effects in neonates of eclamptic morthers. Indian J Pediatr 1993;60:257-63.
- Laegreid L, Hagberg G, Lundberg A. The effect of benzodiazepines on the fetus and the newborn. Neuropediatrics 1992;23:18-23.
- Owen JR, Irani SF, Blair AW. Effect of diazepam administered to mothers during labour on temperature regulation of neonate. Arch Dis Child 1972; 47(251):107-10.
- McBride R, Dundee J, Moore J, Toner W, Howard P. Study of plasma concentrations of lorazepam in mother and neonate. Br J Anaesth 1979;51:971.
- Tomson G, Lunell NO, Sundwall A, Rane A. Placental passage of oxazepam and its metabolism in mother and newborn. Clin Pharmacol Ther 1979; 25:74-81.
- Wang LH, Lin HC, Lin CC, Chen YH, Lin .C. Increased risk of adverse pregnancy outcomes in women receiving zolpidem during pregnancy. Clin Pharmacol Ther 2010;88:369-74.
- Wikner BN, Stiller CO, Bergman U, Asker C, Kallen B. Use of benzodiazepines and benzodiazepine receptor agonists during pregnancy: neonatal outcome and congenital malformations. Pharmacoepidemiol Drug Saf 2007;16:1203-10.
- Yeh S, Paul R., Cordero L., Hon E. A study of diazepam during labor. Obstet Gynecol 1974;43:363-73.
Evidence tabellen
|
Reference |
Study type |
Characteristics |
Intervention (I)
Controls (C)
|
Outcome measures and follow-up time |
Results |
Quality assessment study |
|
Diav-Citrin, 1999 |
Prospective cohort
N total = 79, with 40 zopiclon users |
Inclusion criteria: -1993-1997 -Motherisk program -Zopiclon use
Exclusion criteria:- |
Aim of the study: To investigate the potential teratogenic effect of zopiclon.
Intervention: 1st trimester exposure to zopiclon
Controls: A matched control group counselled for non-teratogenic exposure
-After expected dat a questionnaire was taken by phone. -Medical file from pediatrics |
Primary outcomes: Rate of birth defects in first trimester exposure
Secundary outcomes: -Delivery method -Preterm delivery -Birth weight by GA -Fetal distress -NICU admission
Follow up:- |
Outcomes:
|
-Clearly defined groups: Yes
-Selection bias: No
-Method of assessing the outcome appropriately: -
-Identification confounders and correction in analysis: Yes Groups were matched for age, cigarette smoking and alcohol consumption. And obstetric history.
Limitations: - It cannot be certain that women who received prescriptions during pregnancy actually took the medications as prescribed, nor can we estimate risk of preterm delivery and other adverse outcomes in relation to dosages and the exact duration of the use of the medications during pregnancy - Relatively small sample size. - It cannot exclude the possibility of some residual from unmeasured factors, such as maternal illicit drug use.
-Funding:- |
|
Gamble, 1977 |
Prospective cohort
N total = 11 |
Aim of the study: To assess the levels of diazepam and the influence on Apgar scores
Inclusion criteria: -No diazepam in month before labor -Women in labor at term
Exclusion criteria:- |
Intervention: -10 mg diazepam IV during labor -After birth maternal blood and bloodcord samples were taken -After 24 hours a maternal and neonatal blood sample was taken
Controls: None |
Primary outcomes: -Diazepam levels in mother and infant
Secundary outcomes: -Apgar scores
Follow up: 24 hours |
Primary outcomes: -Significant higher drug levels in babies than mothers (p<0.01)
Secondary outcomes: There was no correlation between cord plasma diazepam concentrations and Apgar scores at birth |
Clearly defined groups: Yes
Selection bias: Possible
Method of assessing the outcome appropriately: Yes
Impact assessor blinded Not possible
Selective loss to follow up: No
Identification confounders and correction in analysis: No, other medication was unknown and mode of delivery was not mentioned
Funding: Not mentioned |
|
Johnstone, 1982 |
Prospective cohort
N total = 38 |
Aim of the study: To assess the effect of maternal administration of 5 mg lorazepam orally 1 hour before induction of labour.
Inclusion criteria: -Primiparous -38-42weeks GA -Induction because of post date, uncomplicated PIH or social reasons -NO or epidural -Scotland ->2500g -singleton, spontaneous babies - bottlefed babies
Exclusion criteria: -Pethidine -SC -General anesthesia -Kielland forceps
|
Intervention: 18 neonates whos mother received 5 mg lorazepam 1 hour before induction
Controls: 20 age group matched women without medication |
Outcomes: -Apgar scores -Low tempature -Feeding
Follow up: - |
Outcomes: -There were no neonates with Apgar scores<7 -No neonate had a tempature under 36 celcius -There was no difference in volume or duration of feeding in the 2 groups |
Clearly defined groups: Yes
Selection bias: Bottlefed babies were only used for analysis.
Method of assessing the outcome appropriately: Yes
Selective loss to follow up: No
Identification confounders and correction in analysis: No
Funding: Not mentioned
Limitations: Only bottle fed children, Small sample size |
|
Kallen, 2012
|
Retrospective cohort (national database)
N total = 701 benzodiazepinen (716 infants) and 648 HBRA (667 infants) |
Inclusion criteria: Women who had given birth the years 2006Y2008 and had redeemed prescriptions of an SSRI drug or other drugs identified from PDR in Sweden. During 2nd or 3rt trimester.
Exclusion criteria: Not mentioned |
Aim of the study: To evaluate the risk of neonatal morbidity and preterm delivery after maternal use of SSRI’s with or without other CNS-active drugs. |
Outcomes: Diagnoses of respiratory problems, Low 5-minute Apgar score if such score was recorded. If no 5-minute score was recorded but 1-minute score was higher than 8, the 5-minute score was regarded as higher than 7. Diagnoses of intraventricular hemorrhage Diagnoses of hypoglycemia Diagnoses of neonatal convulsions and other cerebral distur- bances floppy baby syndrome
Follow up: - |
Outcomes Not specified! Benzodiazepines neonatal complications 24/204 OR 1.63 (95%CI 1.05-2.53) HBRA preterm 20/234 OR 1.29 (95%CI 0.82-2.05) |
-Clearly defined groups: Yes -Selection bias: No -Method of assessing the outcome appropriately: Risk estimates were determined as odds ratios (ORs) using Mantel-Haenszel analyses and approximate 95% confidence intervals (95% CIs) were estimated with Miettinen method. -Selective loss to follow up: No -Identification confounders and correction in analysis: Adjustments were made for year of birth, maternal age (<20, 20-24, 25-29, 30-34, 35-39, 40-44, and >45, or >40 in some tables), parity (1, 2, 3, and >4), smoking (unknown, none, <10 cigarettes per day, >10 cigarettes per day), number of previous miscarriages (0, 1, 2, and >3), and body mass index (BMI; unknown, <19.8, 19.8-24.9, 25-29.9, >30). Maternal smoking in early pregnancy and prepregnancy weight and height were recorded at midwife interviews, usually in weeks 10 to 12. Probably underreportation of benzo use in national database No information about iliat drug use and if the prescibed drugs were taken indeed. -Funding: Not mentioned |
|
Laegreid, 1992 |
Prospective cohort
N total = 67 17 (16 mothers) BDZ |
Aim of the study: The evaluate the effect of maternal benzodia-zepines use on the fetus and the newborn infant.
NB This is part one of the study
Inclusion criteria: -1984-1986 -2 hospitals Gothenberg -Informed consent
Exclusion criteria: -Use of street drugs -Alcohol abuse -Comedicatie BDP and other psychotropisc -Fetus with Zellweger syndrome |
Intervention: -Maternal interview prior to delivery -Record investigation
Controls: -21 neonates exposed to other psychotropics -29 neonates without expose to psychotropics |
Outcomes: -Birthweight -Apgar<6 -Respitory disbalance -Tonus -Regurgitation -Convulsions -Care on neonatal ward
Follow up: 2 days |
Outcomes: The use of BZD during pregnancy is associated with impaired intrauterine growth and an increased frequency of pre- and perinatal events. It effects the infant with intoxication and withdrawel syndromes.
The infants of the 2 mothers with the highest dosage of benzodiazepines, demonstrated intoxication or withdrawal syndromes. |
Clearly defined groups: Yes
Selection bias: Fetus with Zellweger syndrome excluded.
Method of assessing the outcome appropriately: Yes
Selective loss to follow up: No
Identification confounders and correction in analysis: Most proberbly.
Funding: Non mentioned
Limitations: Althoughthe study adjusted for multiple confounding factors, as with all observational studies, the study cannot exclude the possibility of some residual confounding from unmeasured factors, such as maternal illicit drug use. |
|
McBride, 1979 |
Prospective cohort
N total = 32 |
Aim of the study: To examine the use of lorazepam in obstetric prectice
Inclusion criteria: -Expacted sponateous vaginal delivery -Uncomplicated antenatal history -No other benzodiazepinen use
Exclusion criteria:- |
Intervention: -10 women a term prior to surgical induction of labor (SC) -10 women in labor in start of second phase of labor -2.5 mg lorazepam IV
Controls: -10 non pregnant women undergoing minor gynecological procedures |
Primary outcomes: -Maternal and neonatal lorazepam levels
Secundary outcomes: Apgar scores
Follow up: |
Primary outcomes: The neonatal level was not significant different from the mother (p>0.1) in the surgical group In the second stage group the levels of neonates were signficantly lower (p<0.01)
Secundary outcomes: All apgar scores were good exept two, but no relation to lorazepam was suspected |
Clearly defined groups: Yes
Selection bias: No
Method of assessing the outcome appropriately: Yes
Impact assessor blinded: Not possible
Selective loss to follow up: No
Identification confounders and correction in analysis: No, other medication was unknown
Funding: None |
|
Wang, 2010 |
Prospective cohort
N total = 14955 (2497 zolpidem users, 12485 in the control group)
|
Aim of the study: Comparing the risk of adverse pregnancy outcomes in women who received zol-pidem treat-ment for in-somnia during pregnancy with that in women who did not.
Inclusion criteria: - Taiwan national health insurance research Dataset
Exclusion criteria: Not mentioned
|
Intervention: Analysed from the dataset.
Controls: Adjusted for infant’s gender, parity, maternal educational level, gestational hypertension, gestational diabetes, pre-eclampsia/eclampsia, and anemia |
Primary outcomes: -delivery of low-birth-weight (lBW) infants, -preterm deliveries, -delivery of small-for-gestational-age (sga) infants, -delivery of infants with congenital anomalies, -cesarean delivery
Secundary outcomes: Exposure to zolpidem during 1st trimester vs 2nd or 3rd trimester of pregnancy. Duration of use.
Follow up: - |
Primary outcomes: LBW infants, preterm, SGA and cesarean delivery—were all higher in mothers who received zolpidem treatment during pregnancy.
Secundary outcomes: First- trimester exposure did not result in higher odds of adverse pregnancy outcomes. In general, after adjusting for potential confounders, the adjusted ORs for mothers who received zolpidem were further increased in the group of women who received the drug for >90 days. |
Clearly defined groups: Yes
Selection bias: No, although they all seem to be live births
Method of assessing the outcome appropriately: Yes
Selective loss to follow up: No
Identification confounders and correction in analysis: Yes and no; they adjusted for infant’s gender, parity, maternal educational level, gestational hypertension, gestational diabetes, pre-eclampsia/ eclampsia, and anemia. But did not idntify or correct for smoking, other medication of alcohol use. It is unknown what doses they used and if it was regulary or once.
Funding: Non mentioned |
|
Yeh, 1974 |
Prospective cohort
N total = 31
Aim of the study: The neonatal effect of diazepam during labor.
|
Inclusion criteria: -1967-1969 -Yale Hospital
Exclusion criteria: Not mentioned |
Intervention: -5 to 10 mg diazepam for tranquillation -Possible second injection after min 3 h
Controls: None |
Outcomes: -Neonatal pH and BE -Neurologic evaluation at 24 and 72 h after delivery -Apgar
Follow up: 72 hours |
Outcomes: -3 infants had low Apgar scores at 1 min, but thought to be due to other factors than diazepam -No adverse effects were seen in umbilical cord pH and BE due to diazepam -No abnormal neurologic signs were found |
Clearly defined groups: Yes
Selection bias: Possible, not explained how women were recruited
Method of assessing the outcome appropriately: Yes
Impact assessor blinded: No
Selective loss to follow up: No
Identification confounders and correction in analysis: -Co-medication? -Reason for tranquillisers? Funding: Not mentioned |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-03-2014
Beoordeeld op geldigheid : 01-01-2013
Binnen 5 jaar bepaalt het bestuur van de Nederlandse Vereniging voor Obstetrie en Gynaecologie in samenspraak met de NVVP en de NVK of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Obstetrie en Gynaecologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Gezien de opzet van de richtlijn, kan bij bekend worden van relevant onderzoek waarbij (een deel van) de richtlijn zou moeten worden aangepast, dit tussentijds per uitgangsvraag plaatsvinden.
Algemene gegevens
Deze richtlijn is tot stand gekomen in met ondersteuning van de Orde van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doelstelling
Het doel van deze richtlijn is de onduidelijkheid en onzekerheid over het al dan niet continueren of aanpassen van de dosis van (specifieke) benzodiazepinen tijdens zwangerschap en/of lactatie te verminderen door het geven van informatie en aanbevelingen voor het gebruik van benzodiazepinen in deze periode en voor het beleid met betrekking tot de pasgeborene. Tevens wordt door het ontwikkelen van deze richtlijn multidisciplinaire samenwerking gestimuleerd, zodat zwangere vrouwen met psychische problemen en medicijngebruik gezamenlijk geëvalueerd en behandeld worden.
Patiëntencategorie
In principe geldt de richtlijn voor alle vrouwen met kinderwens, zwangere vrouwen en/of vrouwen die borstvoeding (willen) geven bij wie er een indicatie bestaat voor behandeling met benzodiazepinen of bij wie er reeds sprake is van benzodiazepinegebruik ongeacht de indicatie voor het benzodiazepinegebruik.
Richtlijngebruikers
De richtlijn kan worden gebruikt door alle zorgverleners die betrokken zijn bij de zorg voor vrouwen die een benzodiazepine gebruiken tijdens zwangerschap en/of lactatie maar is primair geschreven voor leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen: de Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Nederlandse Vereniging voor Kindergeneeskunde en de Nederlandse Vereniging voor Psychiatrie.
Samenstelling werkgroep
Voor het ontwikkelen van deze richtlijn is in 2012 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van de Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Nederlandse Vereniging voor Kindergeneeskunde en de Nederlandse Vereniging voor Psychiatrie. Deze drie wetenschappelijke verenigingen zijn betrokken bij het zorgproces in de tweede lijn van vrouwen die benzodiazepinen gebruiken in de zwangerschap, het kraambed of tijdens de lactatie.
De werkgroepleden werden door de wetenschappelijke verenigingen gemandateerd voor deelname aan deze werkgroep. De werkgroepleden zijn gezamenlijk verantwoordelijk voor de integrale tekst van deze conceptrichtlijn.
De werkgroep werd ondersteund door een klinisch epidemioloog en twee richtlijnondersteuners.
Partijen die geen zitting hadden in de werkgroep maar wel voor advies geraadpleegd werden vanwege hun betrokkenheid bij het onderwerp zijn het Nederlandse Huisartsen Genootschap (NHG), de Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) en de Angst, Dwang en Fobie (ADF) stichting.
Samenstelling van de werkgroep
- Dhr. dr. J.J. Duvekot, gynaecoloog-perinatoloog, Erasmus MC, Rotterdam (voorzitter)
- Mw. M.E. van Hoorn, gynaecoloog-perinatoloog, VU Medisch Centrum, Amsterdam
- Mw. dr. I.L. van Kamp, gynaecoloog-perinatoloog, Leids Universitair Medisch Centrum, Leiden
- Dhr. dr. M.J.K. de Kleine, kinderarts-neonatoloog, Máxima Medisch Centrum, Veldhoven
- Mw. S.D. Sie, kinderarts-neonatoloog, VU Medisch Centrum, Amsterdam
- Mw. dr. M.M. van Weissenbruch, kinderarts-neonatoloog, VU Medisch Centrum, Amsterdam
- Dhr. dr. K.P. Grootens, psychiater, Canisius Wilhelmina Ziekenhuis, Nijmegen
- Mw. dr. I.M. van Vliet, psychiater, Leids Universitair Medisch Centrum, Leiden
- Dhr. Ir. T.A. van Barneveld, klinisch epidemioloog, Orde van Medisch Specialisten, Utrecht
- Mw. C.A.L. van Rijn, arts, richtlijnondersteuner Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
- Mw. M.E.P.F. Rückert, arts, richtlijnondersteuner Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
Extern advies:
Mw. drs. M. Wessels, informatiespecialist, Orde van Medisch Specialisten, Utrecht
Belangenverklaringen
De werkgroepleden hebben geen strijdige belangen aangegeven. De originele belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG. Zie hieronder voor een voorbeeldformulier belangenverklaring.
De inhoud van de conclusies en aanbevelingen uit deze richtlijn werd onafhankelijk opgesteld van en niet beoordeeld door de financier van deze richtlijn, de Stichting Kwaliteitsgelden Medisch Specialisten.
Belangenverklaring formulier
Verklaring omtrent mogelijke belangenverstrengeling en embargo met betrekking tot de richtlijn ‘gebruik van benzodiazepinen en zwangerschap’ op initiatief van ‘NVOG’
Utrecht, ………………………. 2011
Betreft: Richtlijn ‘Gebruik van Benzodiazepinen en zwangerschap’
Geachte heer, mevrouw,
In verband met uw deelname aan de ontwikkeling van de richtlijn ‘gebruik van Benzodiazepinen en zwangerschap’ vragen wij u bijgevoegde verklaring in te vullen.
Mogelijke belangenverstrengeling:
Mogelijke belangenverstrengeling valt niet steeds te vermijden, maar de Orde van Medisch Specialisten en NVOG vinden het wel van belang dat hierover openheid bestaat. U wordt daarom gevraagd op bijgaand formulier te vermelden of u in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhield met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn ‘Benzodiazepine gebruik in de zwangerschap en tijdens de lactatie’.
Hetgeen u in uw verklaring vermeldt, zal bij het secretariaat van de NVOG opvraagbaar zijn.
Embargo
Gedurende de richtlijnontwikkeling rust een embargo op de teksten van de conceptrichtlijn.
Dit betekent dat het zonder schriftelijke toestemming van de opdrachtgever niet is toegestaan om passages uit de conceptrichtlijn, of de gehele conceptrichtlijn inclusief bijlagen zoals evidence-tabellen te verstrekken aan derden.
Ondergetekende verklaart zich door ondertekening akkoord met het bovenstaande.
.......................................................................................................................................
(naam)
........................................................... ...............................................................
(plaats, datum) (handtekening)
Formulier belangenverklaring
Heeft u naar uw mening in de afgelopen vijf jaar en/of gedurende de looptijd van het project belangen die mogelijk kunnen interfereren met de besluitvorming in de werkgroep ten aanzien van de interpretatie van het wetenschappelijk bewijs en het opstellen van aanbevelingen?
Ja / Neen i
Zo ja, wilt u aangeven uit welke activiteiten deze belangen voortvloeien en welke organisaties/bedrijven het betreft? Voorbeelden van activiteiten kunnen gevonden worden in consultatie/advisering, (na)scholing / cursus en ondersteuning van wetenschappelijk onderzoek.
1. ..................................................................................................................................
2. ..................................................................................................................................
3. ..................................................................................................................................
Bij meer dan deze drie vermeldingen graag een extra blad bijvoegen.
Ondergetekende verklaart bovenstaande informatie naar waarheid te hebben ingevuld en mutaties t.a.v. bovenstaande te vermelden aan de voorzitter en secretaris van de werkgroep:
Betreft: richtlijn ‘gebruik van Benzodiazepinen en zwangerschap’
Naam: ............................................................................................................................
Afgevaardigde namens: ....................................................................................................
........................................................... ...............................................................
(plaats, datum) (handtekening)
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is geprobeerd rekening te houden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn wordt verspreid onder alle relevante beroepsgroepen. Daarnaast is een patiëntenfolder opgesteld. Ook is de richtlijn te downloaden vanaf de websites van de Nederlandse Vereniging voor Obstetrie en Gynaecologie (www.nvog.nl), de Nederlandse Vereniging voor Psychiatrie (www.nvvp.net) en de Nederlandse Vereniging voor Kindergeneeskunde (www.nvk.nl).
In module 'Organisatie van zorg benzodiazepinegebruik' worden de consequenties voor zwangere vrouwen die benzodiazepinen gebruiken tijdens zwangerschap en/of lactatie nader besproken.
Werkwijze
Methode richtlijnontwikkeling
Deze richtlijn is opgesteld aan de hand van het ‘Appraisal of Guidelines for Research & Evaluation’ (AGREE-II) instrument (www.agreetrust.org). Dit is een breed (internationaal) geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen. Bovendien werd gekozen om -volgens de meest recente ontwikkelingen op het gebied van richtlijnen - de methode toe te passen van The Grading of Recommendations Assessment, Development and Evaluation (GRADE) voor het graderen van de kwaliteit van bewijs en de sterkte van de aanbevelingen. Voor deze methode werd gekozen omdat naast de grootte van studies hierbij ook de kwaliteit van het onderzoek in de beoordeling wordt meegenomen. Formeel is de GRADE methode ontworpen voor het beoordelen van onderzoek naar interventies. Daarom werd afgezien van het aangeven van de sterkte van de aanbevelingen en is alleen de kwaliteit van bewijs in de richtlijn vermeld.
Literatuur zoekstrategieën
Er werd eerst oriënterend gezocht naar bestaande richtlijnen (https://www.ahrq.gov, www.nice.org.uk, het cbo en www.sign.ac.uk en naar systematische reviews in de Cochrane Library. Vervolgens werd er voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke onderzoeken in de elektronische databases PubMed, Embase en PsychINFO van 1940 tot november 2011 in de Engelse of Nederlandse taal. De gebruikte zoekverantwoording staat vermeld in onder kopje 'zoekverantwoording'.
Uitkomstmaten
Bij de beoordeling van de literatuur heeft de werkgroep vooral gekeken naar onderzoeken waarbij, naar inzicht van de werkgroepleden, klinisch relevante uitkomstmaten gebruikt werden. Deze werden voorafgaand aan de literatuurselectie door de werkgroep bepaald en gedefinieerd. Ook de meetinstrumenten die volgens de werkgroep relevant en acceptabel (valide) waren voor het meten van de uitkomstmaten werden vooraf vastgesteld.
Tabel 1 is een overzicht van door de werkgroep opgestelde klinisch relevante uitkomstmaten en daarbij opgestelde geaccepteerde meetinstrumenten met klinisch relevante afkappunten.
Tabel 1: Uitkomstmaten
|
Uitkomstmaten |
Operationalisatie |
|
Zwangerschapscomplicaties |
|
|
spontane miskraam |
frequentie voorkomen |
|
hypertensieve complicaties |
frequentie voorkomen |
|
diabetes gravidarum |
frequentie voorkomen |
|
Intrauteriene vruchtdood (IUVD) |
frequentie voorkomen |
|
Intrauteriene groeivertraging (IUGR) |
< P2.3, < P10 |
|
Zwangerschapsduur |
< 37 weken (< 32 weken) en > 42 weken, continue uitkomsten |
|
Complicaties tijdens de baring |
|
|
kunstverlossingen |
frequentie voorkomen |
|
sectio’s |
frequentie voorkomen |
|
inleiding van de baring (vordering?) |
ja/nee |
|
Complicaties bij het kind |
|
|
congenitale afwijkingen |
ja/nee (mild,ernstig) |
|
vroege effecten |
|
|
Geboortegewicht |
SGA (< -2 SD, < P10) of > P90 en continue uitkomsten |
|
Apgar score |
< 7 na 5 minuten |
|
pH navelstrengarterie |
< 7.00 (geen continue uitkomst) |
|
opname op de NICU |
ja/nee |
|
opname op kinderafdeling (niet NICU indicatie) |
ja/nee |
|
Onttrekkingsverschijnselen |
ja/nee -> tonusproblemen, voedingsproblemen, tremoren, prikkelbaarheid en convulsies |
|
Intoxicatie verschijnselen |
ja/nee -> ‘floppy infant’ syndroom, tonusproblemen, ademhalingsdepressie, hypotensie |
|
lange-termijn effecten |
definitie: vanaf 2 jaar tot volwassen (gevalideerde/gestandaardiseerde meetinstrumenten) |
|
motorische effecten |
vb. BSID (Bayley), Aims |
|
emotionele, sociale en gedragseffecten |
vb. CBCL (child behavior checklist), BSID, SST (strange situation procedure) |
|
cognitieve effecten |
vb. IQ als continue maat, BSID |
|
psychiatrische aandoeningen |
ja/nee -> slaapstoornissen, angst en stress |
Literatuurselectie
Per uitgangsvraag werden twee werkgroepleden aangesteld om onafhankelijk van elkaar de literatuur te beoordelen op relevantie. Bij de eerste selectie op titel en abstract werden de volgende exclusiecriteria gehanteerd:
- niet van toepassing op de vraagstelling
- niet vergelijkbaar met de Nederlandse populatie
- niet-gedefinieerde uitkomstmaat
- minder dan tien vrouwen in de onderzoekspopulatie (wegens imprecisie)
- meer dan 5% van de vrouwen gebruikten andere psychofarmaca of andere comedicatie, waarvoor niet was gecorrigeerd (minimaal een subgroepanalyse of multivariate analyse)
- andere indicatie voor benzodiazepinegebruik dan slaap-, stress- en angststoornissen (zoals epilepsie, anesthesiologische sedatie, preëclampsie en hyperemesis gravidarum)
Een exacte definitie voor chronisch of incidenteel gebruik ontbreekt. De Stichting Farmaceutische Kengetallen definieert een periode van meer dan drie maanden als chronisch gebruik. In principe zou bij chronisch gebruik continu een spiegel van het medicament in het bloed aanwezig moeten zijn. Uiteraard is dit laatste dan afhankelijk van de inname frequentie en de halfwaardetijd van het medicament.
Voor het opstellen van antwoorden op de uitgangsvragen van deze richtlijn werden de volgende specifieke definities gebruikt:
1. Mate van gebruik
- Niet-chronisch gebruik: maximaal 2 weken onafgebroken gebruik (in één trimester) of in totaal tijdens de zwangerschap maximaal 2 weken gebruik. Onder deze categorie valt dus zowel het incidenteel als het intermitterend gebruik van de medicatie.
- Chronisch gebruik: meer dan 2 weken onafgebroken gebruik tijdens de zwangerschap.
2. Hoge en lage dosering
- Hoog:
- Oxazepam > 30 mg/dag
- Temazepam > 20 mg/dag
- Zolpidem >10 mg/dag
- Laag:
- Oxazepam ≤ 30 mg/dag
- Temazepam ≤ 20 mg/dag
- Zolpidem ≤ 10 mg/dag
Comedicatie
Een deel van de patiënten die benzodiazepinen gebruiken, gebruiken hiernaast andere medicatie, zoals antidepressiva, antipsychotica, stemmingsstabilisatoren, of somatische medicatie. Deze richtlijn probeert om zoveel mogelijk alleen de effecten van benzodiazepinen te beschrijven. Bij de literatuurselectie is hier rekening mee gehouden en worden alleen onderzoeken met comedicatie gebruikt als er een adequate subanalyse is gemaakt.
Diverse vormen van comedicatie, ondermeer antipsychotica en antidepressiva maar ook vele andere somatische medicamenten, alsook alcohol en drugs, kunnen de werking van benzodiazepinen beïnvloeden. Mogelijk geldt dit ook voor de effecten op het (ongeboren) kind. Deze invloed op de werking van benzodiazepinen kan worden veroorzaakt door remming of juist stimulatie van bepaalde leverenzymen (cytochroom P450-systeem). Ook kan er sprake zijn van directe effecten op neurotransmittersystemen in de hersenen. De effecten van comedicatie dienen daarom bij de diverse afwegingen meegenomen te worden (zie ook bijlage 'Achtergrondinformatie').
Antipsychotica, antidepressiva, opioïden, anti-epileptica, anaesthetica en sedatieve antihistaminica kunnen de werking en de bijwerkingen van benzodiazepinen versterken. Stoffen die bepaalde leverenzymen (met name CYP3A4) remmen (zoals grapefruitsap, cimetidine, erytromycine en azoolantimycotica zoals ketoconazol en itraconazol), kunnen de werking van alprazolam, diazepam, midazolam, zolpidem en zopiclon versterken. Klinisch relevante interacties zijn gemeld met midazolam. Deze interactie zal zich niet voordoen bij temazepam, lormetazepam, lorazepam en oxazepam, die vooral worden geglucuronideerd. (bron: Farmacotherapeutisch Kompas, 2013)
Beoordeling van de kwaliteit van onderzoeken
Na selectie door de werkgroepleden bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De geselecteerde artikelen werden vervolgens door de werkgroepleden beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is de indeling gebruikt, zoals weergegeven in tabel 2.
De beoordeling van de verschillende artikelen vindt u in de verschillende teksten terug onder ‘Samenvatting literatuur’. De richtlijnondersteuners maakten in samenspraak met de subgroepen per vraag evidence tabellen van de geselecteerde individuele onderzoeken als hulpmiddel bij het beoordelen en samenvatten van deze onderzoeken. Vervolgens werd de kwaliteit van het bewijs van het totaal aan gevonden onderzoeken van de betreffende vraag en uitkomstmaat (‘body of evidence’) beoordeeld. Met de kwaliteit van het bewijs wordt bedoeld in hoeverre er vertrouwen is dat de aanbevelingen gebaseerd kunnen worden op de (effectschatting van de) evidence en de GRADE tabellen. Het wetenschappelijk bewijs werd vervolgens kort samengevat in een ‘conclusie’. De belangrijkste literatuur waarop deze conclusie is gebaseerd staat bij de conclusie vermeld inclusief de GRADE gradering van bewijs.
Bij GRADE wordt de evidence per uitkomstmaat beoordeeld. De beoordeling wordt gedaan door het invullen van een evidenceprofiel. Alleen voor kritieke en/of belangrijke uitkomstmaten is een evidenceprofiel gemaakt. Er zijn in totaal vijf factoren die de kwaliteit van het bewijs per uitkomstmaat kunnen verlagen en drie factoren die de kwaliteit kunnen verhogen. Per factor kan de kwaliteit met een of twee niveaus omlaag gaan. Als het om een ernstige beperking gaat, gaat de kwaliteit met een niveau omlaag; als het om een zeer ernstige beperking gaat, gaat de kwaliteit met twee niveaus omlaag.
De verschillende typen onderzoek kunnen worden ingedeeld naar mate van bewijs. Randomized controlled trials (RCT’s) zijn in beginsel van hogere methodologische kwaliteit dan observationele onderzoeken, omdat RCT’s minder kans op vertekening (bias) geven. In het GRADE systeem beginnen daarom RCT’s met hoge kwaliteit (4) en observationele onderzoeken met lage kwaliteit (2). Niet-vergelijkende, niet-systematische onderzoeken (zoals ‘case series’ en ‘case reports’) worden altijd gekwalificeerd als zeer lage kwaliteit. Een overzicht van de GRADE indeling van kwaliteit van de onderzoeken per uitkomstmaat is weergegeven in tabel 2.
Aangezien de GRADE systematiek niet geschikt is voor de beoordeling van case reports en case series werden deze onderzoeken niet geselecteerd. Review artikelen waarin een overzicht van dit soort onderzoeken worden vermeld, werden alleen geselecteerd als geen andere onderzoeken voorhanden waren.
Tabel 2. GRADE-indeling van de kwaliteit van de onderzoeken per uitkomstmaat.
|
Kwaliteit |
Studiedesign |
Kwaliteit verlagen |
Kwaliteit verhogen |
|
Hoog (4) |
RCT |
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 waarschijnlijk -2 zeer waarschijnlijk |
+1 groot +2 zeer groot
+1 bewijs voor relatie
+1 zou het effect onderschatten +2 zou het effect overschatten als er geen effect was aangetoond
|
|
Matig (3) |
|
||
|
Laag (2) |
Observationele vergelijkend onderzoek (bijv. patiënt-controle onderzoek, cohort onderzoek) |
||
|
Zeer laag (1) |
Niet-systematische klinische observaties (bijv. ‘case studies’, ‘case reports’) |
RCT’s beginnen ‘hoog’ (4), observationele onderzoeken ‘laag’ (2).
Bij RCT’s: bijvoorbeeld 1 punt downgraden: dan van hoog (4) naar matig (3), 2 punten downgraden: dan van hoog (4) naar laag (2), 3 punten downgraden: dan van hoog (4) naar zeer laag (1).
Bij observationele onderzoeken: bijvoorbeeld 1 punt upgraden: dan van laag (2) naar matig (3).
Formuleren van aanbevelingen
Nadat de gegevens uit de GRADE tabellen waren samengevat als tekst werden hieruit conclusies getrokken. Om vervolgens tot een gewogen aanbeveling te komen werden de overige overwegingen besproken en geformuleerd. Dit is van belang omdat voor een aanbeveling naast het wetenschappelijke bewijs ook nog andere aspecten meegewogen horen te worden, zoals patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen en organisatorische aspecten. Bij de overwegingen spelen ook de ervaring en opvattingen van de werkgroepleden een rol (‘authority-based’). De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en op de belangrijkste overwegingen. De gebruikte methodiek voor richtlijnontwikkeling verhoogt de transparantie van de totstandkoming van de aanbevelingen in deze richtlijn.
Bij het beoordelen van de literatuur werd de volgende tekortkoming vastgesteld. Ondanks het feit dat benzodiazepinen al lang en veel worden gebruikt en er veel over is geschreven, werd weinig literatuur aangetroffen die voldeed aan de vooraf vastgestelde inclusiecriteria. In wetenschappelijk onderzoek naar dit onderwerp wordt vaak gebruik gemaakt van door patiënten zelf ingevulde vragenlijsten waarbij symptomen uitgevraagd worden zonder deze in de bredere context van duur, beperkingen en bijkomende relevante factoren te plaatsen. Meer in het bijzonder zijn er weinig vragenlijsten die specifiek rekening houden met de zwangerschap als lichamelijke bron van angst- en slaapstoornissen.
Alle conclusies en aanbevelingen werden plenair in de vergaderingen van de werkgroep besproken, waarbij door consensus tot een concepttekst werd gekomen. Indien dit niet mogelijk bleek werd door meerderheid van stemmen de uiteindelijke concepttekst bepaald. Uiteindelijk waren alle werkgroepleden akkoord met de voorliggende conceptteksten.
Zoekverantwoording
|
Onderwerp: Vroege neonatale effecten |
Database |
Zoekstrategie |
Aantal ref. |
|
1. Is er een verband tussen benzodiazepinegebruik in de zwangerschap en vroege neonatale effecten (geboortegewicht (dysmaturiteit, macrosomie), APGAR-score, navelstreng PH, opname kinderafdeling, opname NICU, intoxicatie verschijnselen: ‘floppy infant’ syndroom, tonusproblemen, ademhalingsdepressie, hypotensie, onttrekkingsverschijnselen: tonusproblemen, voedingsproblemen, tremoren, prikkelbaarheid en convulsies)?
2. Is er een verschil in vroege neonatale effecten bij gebruik van verschillende benzodiazepinen in de zwangerschap?
3. Welke specifieke factoren dragen bij tot het optreden van deze vroege effecten bij de neonaat? (dosering en duur, tijdstip in de zwangerschap)
4. Hoe lang blijven deze symptomen aanwezig per middel?
5. Welke benzodiazepinen hebben de voorkeur voor gebruik in de zwangerschap gezien het risico op vroege neonatale effecten?
|
Medline (OVID) 1980- april/mei 2011 Engels, Nederlands
Aanvullende search 1940-1979
Psycinfo (OVID)
Embase (Elsevier)
|
1 exp Anti-Anxiety Agents/ (54746) 2 exp Benzodiazepines/ (55777) 3 exp Anxiety Disorders/dt [Drug Therapy] (8287) 4 (alprazolam or Xanax or bromazepam or chlordiazepoxide or Librium or clobazam or Frisium or chlorazepate or Tranxene or diazepam or Stesolid or lorazepam or Temesta or oxazepam or Seresta or prazepam or Reapam or midazolam or Dormicum or brotizolam or lendormin or flunitrazepam or flurazepam or Dalmadorm or loprazolam or Noctamid or lormetazepam or Noctamid or nitrazepam or Mogadon or temazepam or Normison or zolpidem or Stilnoct or zopiclon or Imovane).af. (46720) 5 "anxiolytic drug*".ti,ab. (954) 6 1 or 2 or 3 or 4 or 5 (87251) 7 pregnancy/ or gravidity/ or exp labor, obstetric/ or exp parturition/ or exp pregnancy in adolescence/ or exp pregnancy, high-risk/ or exp pregnancy maintenance/ or exp pregnancy outcome/ or exp pregnancy, unplanned/ or exp pregnancy, unwanted/ (656993) 8 Prenatal Exposure Delayed Effects/ (17167) 9 pregnan*.ti,ab. (330104) 10 7 or 8 or 9 (724588) 12 exp infant, low birth weight/ or infant, very low birth weight/ or infant, postmature/ or infant, premature/ or (preterm or premature).ti,ab. (133802) 13 exp infant, newborn, diseases/ or neonatal abstinence syndrome/ (129293) 14 pregnancy/ or gravidity/ or exp labor, obstetric/ or exp parturition/ or exp pregnancy in adolescence/ or exp pregnancy, high-risk/ or exp pregnancy maintenance/ or exp pregnancy outcome/ or exp pregnancy, unplanned/ or exp pregnancy, unwanted/ (656993) 15 pregnan*.ti. (160951) 16 14 or 15 (674909) 17 exp infant, low birth weight/ or infant, very low birth weight/ or infant, postmature/ or infant, premature/ or (preterm or premature).ti,ab. (133802) 18 convulsions.ti,ab. or Seizures/ or Startle Reaction.ti,ab. or Startle Reaction/ or Tremor/ or (tremor* or seizure*).ti,ab. (116433) 19 exp Sleep Disorders/ (53121) 20 Crying/ (1868) 21 "excessive crying".ti,ab. (127) 22 "neonatal tremor*".ti,ab. (2) 23 Hypothermia/ (7980) 24 Muscle Hypotonia/ (2389) 25 Vomiting/ (17888) 26 Body Temperature/de [Drug Effects] (9780) 27 "Feeding and Eating Disorders of Childhood"/ (230) 28 exp Respiratory Distress Syndrome, Newborn/ (12781) 29 exp Hypertension, Pulmonary/ (22664) 30 exp infant, newborn, diseases/ (129293) 31 ("neonatal symptoms" or "neonatal adaptation").ti,ab. (185) 32 exp Infant, Newborn/ (463438) 33 (infant* or neonat*).ti,ab. (401429) 34 32 or 33 (674124) 35 "small for gestational age".ti,ab. (4920) 36 (dysmaturity or macrosomia).ti,ab. (2006) 37 "large for gestational age".ti,ab. (840) 38 Intensive Care Units, Neonatal/ (8095) 39 ("neonatal ICU" or "neonatal intensive care").ti,ab. (9610) 40 Apgar score/ (6174) 41 Apgar.ti,ab. (7276) 42 "umbilical cord blood samples".ti,ab. or Fetal Blood/an [Analysis] (4304) 43 "floppy infant*".ti,ab. (109) 44 neonatal abstinence syndrome/ or (neonatal adj2 withdrawal).ti,ab. (855) 45 19 or 20 or 21 or 23 or 24 or 25 or 26 or 29 (114569) 46 34 and 45 (8759) 47 12 or 13 or 18 or 22 or 27 or 28 or 30 or 35 or 36 or 37 or 38 or 39 or 40 or 41 or 42 or 43 or 44 (372538) 48 46 or 47 (378489) 49 6 and 48 (6565) 50 10 and 49 (462) 51 (cat or cats or dog or dogs or rat or rats or mouse or mice or pig or pigs or horse or horses or foal or foals or sheep).ti. (1323757) 52 50 not 51 (417) 53 limit 52 to (yr="1980 -Current" and (dutch or english)) (228), 227 uniek Aanvullende search:– 88 referenties
1 "Anxiolytic drugs".ti,ab. (335) 2 exp Benzodiazepines/ (8767) 3 exp Minor Tranquilizers/ (5815) 4 (alprazolam or Xanax or bromazepam or chlordiazepoxide or Librium or clobazam or Frisium or chlorazepate or Tranxene or diazepam or Stesolid or lorazepam or Temesta or oxazepam or Seresta or prazepam or Reapam or midazolam or Dormicum or brotizolam or lendormin or flunitrazepam or flurazepam or Dalmadorm or loprazolam or Noctamid or lormetazepam or Noctamid or nitrazepam or Mogadon or temazepam or Normison or zolpidem or Stilnoct or zopiclon or Imovane).af. (24402) 5 1 or 2 or 3 or 4 (27286) 6 pregnancy/ or gravidity/ or exp labor, obstetric/ or exp parturition/ or exp pregnancy in adolescence/ or exp pregnancy, high-risk/ or exp pregnancy maintenance/ or exp pregnancy outcome/ or exp pregnancy, unplanned/ or exp pregnancy, unwanted/ (20988) 7 exp Prenatal Exposure/ (4386) 8 pregnan*.ti. (8207) 9 6 or 7 or 8 (26150) 10 5 and 9 (351) 11 convulsion*.ti,ab. or Seizures/ or Startle Reaction/ or "startle reaction".ti,ab. or Tremor/ or (tremor* or seizure*).ti,ab. (21403) 12 exp Sleep Disorders/ (8628) 13 Crying/ (929) 14 "excessive crying".ti,ab. (70) 15 "neonatal tremor*".ti,ab. (0) 16 Hypothermia/ (796) 17 Vomiting/ (784) 18 birth weight/ or premature birth/ (4668) 19 exp fetus/ (1416) 20 exp neonatal disorders/ (5924) 21 neonatal development/ (1454) 22 hypotonia.ti,ab. (392) 23 exp Feeding Disorders/ (104) 24 exp Bottle Feeding/ or exp Breast Feeding/ (1867) 25 disorder*.mp. (432967) 26 24 and 25 (141) 27 exp respiratory distress/ (5636) 28 exp neonatal period/ (949) 29 (pulmonary adj hypertension).ti,ab. (81) 30 (infant* or neonat*).ti,ab. (57030) 31 28 or 30 (57095) 32 11 or 12 or 13 or 14 or 16 or 17 or 22 or 27 or 29 (37746) 33 31 and 32 (2072) 34 18 or 19 or 20 or 21 (13058) 35 ("small for gestational age" or (dysmaturity or macrosomia) or "large for gestational age").ti,ab. (323) 36 Intensive Care Units, Neonatal/ (0) 37 neonatal intensive care/ (419) 38 ("neonatal ICU" or "neonatal intensive care").ti,ab. (956) 39 Apgar.ti,ab. (395) 40 "umbilical cord blood samples".ti,ab. (6) 41 ("poor neonatal adaptation" or "floppy infant*").ti,ab.. (17) 42 or/35-41 (1739) 43 33 or 34 or 42 (15851) 44 5 and 43 (163) 45 10 and 44 (29) 46 44 not 45 (134) 47 limit 45 to ((dutch or english) and yr="1980 -Current") (29) – 28 uniek
alprazolam:ab,ti OR xanax:ab,ti OR bromazepam:ab,ti OR chlordiazepoxide:ab,ti OR librium:ab,ti OR clobazam:ab,ti OR frisium:ab,ti OR chlorazepate:ab,ti OR tranxene:ab,ti OR diazepam:ab,ti OR stesolid:ab,ti OR lorazepam:ab,ti OR temesta:ab,ti OR oxazepam:ab,ti OR seresta:ab,ti OR prazepam:ab,ti OR reapam:ab,ti OR midazolam:ab,ti OR dormicum:ab,ti OR brotizolam:ab,ti OR lendormin:ab,ti OR flunitrazepam:ab,ti OR flurazepam:ab,ti OR dalmadorm:ab,ti OR loprazolam:ab,ti OR lormetazepam:ab,ti OR noctamid:ab,ti OR nitrazepam:ab,ti OR mogadon:ab,ti OR temazepam:ab,ti OR normison:ab,ti OR zolpidem:ab,ti OR stilnoct:ab,ti OR zopiclon:ab,ti OR imovane:ab,ti OR (anxiolytic NEAR/1 drug*):ab,ti OR 'anxiolytic agent'/exp/mj OR 'benzodiazepine derivative'/exp/mj OR 'anxiety disorder'/exp/mj/dm_dt AND ('newborn disease'/exp/dm OR 'neonatal symptoms':ab,ti OR 'neonatal adaptation':ab,ti OR 'newborn vomiting'/exp OR 'neonatal stress'/exp OR 'neonatal weight loss'/exp OR (convulsion*:ab,ti OR tremor*:ab,ti OR seizure*:ab,ti OR vomiting:ab,ti OR 'excessive crying':ab,ti OR hypothermia:ab,ti OR hypotonia:ab,ti OR 'respiratory distress syndrome':ab,ti OR 'pulmonary hypertension':ab,ti AND ('newborn'/exp OR infant*:ab,ti OR neonat*:ab,ti)) OR 'neonatal ic admission':ab,ti OR 'neonatal intensive care admission':ab,ti OR 'neonatal ic admissions':ab,ti OR 'neonatal intensive care admissions':ab,ti OR 'premature labor'/exp/mj OR 'prematurity'/exp/mj OR 'low birth weight'/exp/mj OR preterm:ab,ti OR prematur*:ab,ti OR 'newborn intensive care'/exp/mj OR 'Apgar score'/exp OR Apgar.ti,ab OR 'umbilical cord blood samples':ab,ti AND ('pregnancy'/exp/mj OR pregnan*:ti) OR 'floppy infant':ab,ti OR (neonatal:ab,ti AND adj2:ab,ti AND withdrawal:ab,ti) OR (neonatal NEAR/2 withdrawal):ab,ti) AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [1980-2012]/py 166, 160 uniek Aanvullende search– 62 referenties, 56 uniek |
415
Plus aanvullende search: 144 |