Lactatie en benzodiazepinegebruik
Uitgangsvraag
- In hoeverre worden benzodiazepinen uitgescheiden in de borstvoeding? (per middel, dosering en tijdstip)
- Wat zijn de directe effecten van benzodiazepine bevattende borstvoeding op het kind?
- Wat zijn de lange-termijn effecten van benzodiazepinen bevattende borstvoeding op het kind?
- Is er een verschil in associatie tussen gebruik van verschillende benzodiazepinen tijdens de lactatie en effecten op het kind?
- Welke benzodiazepinen hebben de voorkeur voor gebruik tijdens de lactatieperiode?
Aanbeveling
Bij eenmalig of incidenteel gebruik van een benzodiazepine is het niet noodzakelijk de borstvoeding te onderbreken.
Bij intermitterend of chronisch gebruik is terughoudendheid geboden bij het starten of continueren van borstvoeding. Aan de hand van de dosering, halfwaardetijd, uitscheiding in borstvoeding en mogelijke risicofactoren bij het kind dient overwogen te worden of borstvoeding gegeven kan worden.
Bij comedicatie en/of hoge doseringen wordt borstvoeding ontraden.
Indien in het kraambed gestart wordt met een benzodiazepine hebben middelen met een korte halfwaardetijd, een lage M/P ratio en zonder actieve metabolieten de voorkeur.
Overwegingen
Er is weinig literatuur beschikbaar over de kortetermijneffecten van benzodiazepinegebruik tijdens de lactatie. Uit de gevonden onderzoeken kan slechts worden geconcludeerd dat benzodiazepinen na eenmalig of kortdurend gebruik in geringe mate overgaan in de borstvoeding. Er zijn onvoldoende betrouwbare onderzoeken die de effecten tijdens chronisch gebruik hebben bestudeerd.
Of er effecten bij het kind optreden is afhankelijk van meer factoren (zie inleiding, artikel Nordeng 2012). In het algemeen worden benzodiazepinen door kinderen langzamer geklaard en is de halfwaardetijd bij pasgeborenen langer. Het is aannemelijk, dat bij een lange halfwaardetijd van het middel zelf of van de actieve metabolieten, buiten een eenmalig gebruik, accumulatie van het middel (of de actieve metabolieten hiervan) kan optreden bij de pasgeborene. Tevens kunnen andere factoren als prematuriteit, ziekte van de pasgeborene en stofwisselingsziekten hieraan bijdragen.
Om een zorgvuldig advies te geven voor het al dan niet geven van borstvoeding tijdens benzodiazepinegebruik van moeder, moet een aantal factoren meegenomen worden. Naast de dosering en duur van het benzodiazepinegebruik, spelen halfwaardetijd van het middel en de actieve metabolieten een rol. Ook leeftijd en klinische conditie van het kind moeten meegenomen worden in het advies.
Op grond van de beschikbare literatuur lijkt het niet nodig om de borstvoeding te staken bij eenmalig of incidenteel gebruik van een benzodiazepine. Ook kan overwogen worden om bij kortdurend gebruik de borstvoeding tijdelijk te staken. Indien de benzodiazepine alleen voor de nacht wordt ingenomen als slaapmiddel, kan bij een korte halfwaardetijd, de nachtvoeding vervangen worden door kunstvoeding.
Bij chronisch gebruik van benzodiazepinen is terughoudendheid geboden in het geven van borstvoeding. Indien borstvoeding gecontinueerd wordt, is het goed te letten op symptomen als sufheid bij het kind. Gezien de sederende eigenschappen van benzodiazepinen, wordt borstvoeding ontraden indien er sprake is van hoge dosering en/of comedicatie.
De ouders moeten op de hoogte worden gebracht van het feit dat over langetermijneffecten van benzodiazepinegebruik tijdens de lactatie geen gegevens bekend zijn.
Onderbouwing
Achtergrond
Bij de behandeling met benzodiazepinen tijdens de lactatieperiode zal een afweging gemaakt moeten worden tussen de positieve effecten van het geven van borstvoeding en de mogelijk negatieve korte en langetermijneffecten van benzodiazepinen op de pasgeborene. Of de pasgeborene effecten ondervindt van benzodiazepinen tijdens de lactatie is naast de frequentie van aanleggen afhankelijk van meer factoren (Nordeng, 2012):
- De farmacokinetische en farmacodynamische aspecten van het geneesmiddel. Daarmee samenhangend de dosis, frequentie en duur (eenmalig of chronisch) van inname van benzodiazepinen door de moeder.
- De hoeveelheid van het geneesmiddel dat wordt uitgescheiden in de borstvoeding en door opname daadwerkelijk bij het kind terecht komt.
- Factoren die de farmacokinetiek en -dynamiek van het geneesmiddel in het kind beïnvloeden (zwangerschapsduur, postnatale leeftijd, nier- en leverfunctie).
- Comedicatie
Voor de interpretatie van de literatuur is het belangrijk dat het meten van medicatiespiegels bij het kind en in de borstvoeding, onder meer afhankelijk is van tijdstip van inname, tijdstip van voeden en tijdstip van de bepaling. Deze gegevens waren niet altijd voorhanden.
In deze module wordt op grond van bovenstaande getracht antwoord te geven op de vraag of vrouwen met benzodiazepinegebruik borstvoeding kunnen geven.
Conclusies / Summary of Findings
Uitgangsvraag 1:
|
Kwaliteit van bewijs ZEER LAAG |
Benzodiazepinen gaan over in de borstvoeding. Brandt 1976, Brodie 1981, Cole 1975, Matheson 1990a, Matheson 1990b |
|
Kwaliteit van bewijs ZEER LAAG |
De M/P ratio van benzodiazepinen is in het algemeen laag. Dit heeft in het beschikbaar onderzoek niet altijd geleid tot meetbare serumconcentraties bij het kind. Birnbaum 1999, Brandt 1976, Brodie 1981, Cole 1975, Hümpel 1982, Matheson 1990a, Matheson 1990b, Oo 1995, Pons 1989 |
Uitgangsvraag 2:
|
Kwaliteit van bewijs ZEER LAAG |
De bijwerkingen bij het kind in de beschreven onderzoeken zijn mild van aard. Birnbaum 1999, Cole 1975, Matheson 1990b |
|
Geen bewijs |
Er zijn onvoldoende betrouwbare onderzoeken die de effecten tijdens chronisch gebruik hebben bestudeerd. |
Uitgangsvraag 3, 4 en 5:
|
Geen bewijs |
Er zijn geen onderzoeken gevonden die de langetermijneffecten van benzodiazepinegebruik tijdens de lactatie hebben onderzocht. |
Samenvatting literatuur
Uitgangsvraag 1: In hoeverre worden benzodiazepinen uitgescheiden in de borstvoeding? (per middel, dosering en tijdstip)
Negen onderzoeken beantwoordden deze uitgangsvraag (Birnbaum, 1999; Brandt, 1976; Brodie, 1981; Cole, 1975; Hümpel, 1982; Matheson, 1990a; Matheson, 1990b; Oo, 1995; Pons, 1989).
Birnbaum heeft elf moeder-kindparen onderzocht. De leeftijd van de kinderen varieerde van 1-44 weken postpartum. Zes moeders gebruikten alleen clonazepam (0.75-1.5 mg/dag), vijf moeders gebruikten ook andere medicatie. Bij de elf à terme kinderen werden op een willekeurig tijdstip clonazepam spiegels bepaald. Bij tien neonaten werd geen clonazepam in het bloed gemeten. Bij het kind waar wel clonazepam (22 ng/ml) in het bloed werd gemeten was sprake van hyperbilirubinemie, volgens de auteurs duidend op een onrijpe leverfunctie. Er werden geen spiegels in de borstvoeding gemeten.
Brandt onderzocht bij vier moeders die gedurende zes opeenvolgende dagen (dag 3-9 postpartum) 10 mg diazepam gebruikten de diazepamconcentratie in maternaal plasma en borstvoeding op vaste tijdstippen. De melk plasma (M/P)-ratio varieerde van 0.13-0.18 (gemiddeld 0.16). De auteurs concludeerden dat diazepam in geringe mate overgaat in de borstvoeding.
Cole heeft bij negen moeder - kindparen de diazepamconcentratie en de actieve metaboliet desmethyldiazepam in maternaal plasma, in borstvoeding en bij het kind gemeten. Moeder en kind werden 10 dagen na de geboorte vervolgd en onderzocht. De M/P ratio varieerde van 0.21-2.7 met een gemiddelde van 0.5. Bij één kind werd tien dagen na inname nog een noemenswaardige concentratie van actieve metabolieten gemeten, wat aangeeft dat de halfwaardetijd bij kinderen langer kan zijn met het risico op accumulatie bij chronisch gebruik.
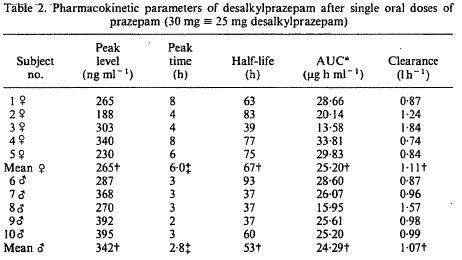
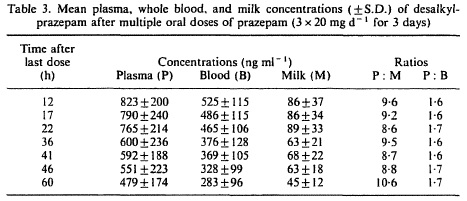
Brodie beschreef vijf patiënten die drie keer per dag 20 mg prazepam gedurende drie dagen kregen in een periode dat zij geen borstvoeding gaven. Vanaf twaalf uur na de laatste gift werd de prazepam concentratie in het bloed van de moeder en in de borstvoeding gemeten. De gemiddelde (M/P) ratio van desalkylprazepam (actieve metaboliet) bleef gedurende de drie meetdagen stabiel (0.09-0.11). Dit suggereert dat desalkylprazepam even snel wordt geëlimineerd uit bloed als uit melk. De auteurs beredeneren dat bij neonaten met een gemiddelde intake van 600 ml per dag, de prazepam dosering ongeveer 4% is van die van de moeder.
Hümpel beschrijft lormetazepam concentraties bij moeder, kind en in borstvoeding. Vijf vrouwen gebruikten vanaf 2-3 dagen na de bevalling gedurende tien dagen 1 dd 2 mg lormetazepam. Er kon geen exacte M/P ratio bepaald worden omdat de concentratie lormetazepam in de borstvoeding in meer monsters onder de detectiegrens was. Bij de onderzochte neonaten werd geen lormetazepam in het bloed gemeten.
In een patiëntengroep van Oo kregen acht vrouwen, 6-28 weken postpartum, eenmalig 0.50 mg alprazolam. De gemiddelde M/P ratio was 0.36 (±0.11) en bleef gedurende 36 uur constant. De halfwaardetijd berekend in deze studie was in bloed 12 uur (± 3.53) en in borstvoeding 14 uur (± 6.27).
In een dubbelblind gerandomiseerd onderzoek van Matheson (1990b) kregen twaalf vrouwen (0-5 dagen postpartum) 15 mg midazolam (n=12) en tien vrouwen 5 mg nitrazepam gedurende enkele dagen. Bloed en borstvoeding werden op vaste tijdstippen afgenomen. De gemiddelde M/P ratio voor nitrazepam was 0.27 en voor midazolam 0.15.
In een ander onderzoek van Matheson (1990a) kregen twaalf vrouwen eenmalig, 2-6 dagen postpartum, 7.5 mg zopiclon, waarna op vaste tijdstippen zoplicon concentraties werden gemeten in plasma en borstvoeding. De gemiddelde M/P ratio was 0.51, met een range van 0.41 tot 0.70.
In het onderzoek van Pons kregen vijf vrouwen, drie dagen postpartum, eenmalig 20 mg zolpidem. Bloed en borstvoeding werden op vaste tijdstippen na inname afgenomen. De M/P ratio drie uur na inname was gemiddeld 0.13 (0.11 –0.18). In de monsters afgenomen ≥ 3 uur na inname, werd noch in bloed noch in borstvoeding een meetbare zolpidemconcentratie gevonden.
Uitgangsvraag 2: Wat zijn de directe effecten van benzodiazepine bevattende borstvoeding op het kind?
Drie onderzoeken beantwoordden deze vraag (Birnbaum, 1999; Cole, 1975; Matheson, 1990b). Mogelijke directe effecten van benzodiazepinen op de pasgeborene zijn bijvoorbeeld hypotonie, verminderd bewustzijn en ademhalingsproblemen.
In het onderzoek van Birnbaum werden door de moeders zelf geen bijwerkingen van chronische blootstelling aan clonazepam bij hun kind tijdens de lactatie gerapporteerd.
In het onderzoek van Cole werd bij drie van de negen neonaten een milde icterus gerapporteerd. In het onderzoek wordt echter niet beschreven of voor de icterus therapie nodig was en hoe lang na de geboorte de icterus optrad. In het onderzoek van Matheson bleken kinderen na nitrazepam (n=10) minder vaak wakker vergeleken met de midazolamgroep (n=12).
Uitgangsvraag 3: Wat zijn de lange-termijn effecten van benzodiazepinen bevattende borstvoeding op het kind?
Er werden geen onderzoeken gevonden die antwoord gaven op deze uitgangsvraag.
Uitgangsvraag 4: Is er een verschil in associatie tussen gebruik van verschillende benzodiazepinen tijdens de lactatie en effecten op het kind?
Eén onderzoek (Matheson, 1990b) vergeleek nitrazepam met midazolam. Uit dit onderzoek bleek dat de M/P ratio lager is van midazolam dan van nitrazepam en dus minder overgaat in de borstvoeding. Tevens waren kinderen na nitrazepam minder vaak wakker dan na midazolam.
Uitgangsvraag 5: Welke benzodiazepinen hebben de voorkeur voor gebruik tijdens de lactatieperiode?
Er werden geen onderzoeken gevonden die antwoord gaven op deze uitgangsvraag.
Tabel 5.3.1: M/P ratio’s bij verschillende benzodiazepinen
|
Studie |
Middel |
Bereik M/P ratio |
Gemiddelde M/P ratio |
Bijzonderheden |
|
Birnbaum 1999 |
clonazepam |
Niet bepaald |
Niet bepaald |
|
|
Brandt 1976 |
diazepam |
0.13-0.18 |
0.16 |
|
|
Cole 1975 |
diazepam |
0.21-2.7 |
0.5 |
|
|
Brodie 1981 |
prazepam |
0.09-0.11 |
Niet bepaald |
Actieve metaboliet desmethylprazepam |
|
Humpel 1982 |
lormetazepam |
Niet bepaald |
Niet bepaald |
|
|
Matheson 1990a |
zopiclon |
0.41-0.70 |
0.51 |
|
|
Matheson 1990b |
nitrazepam |
Niet bepaald |
0.27 |
|
|
Matheson 1990b |
midazolam |
Niet bepaald |
0.15 |
|
|
Oo 1995 |
alprazam |
0.14-0.58 |
0.36 |
|
|
Pons 1989 |
zolpidem |
0.11-0.18 |
0.13 |
|
Zoeken en selecteren
In totaal werden er van de 370 gevonden onderzoeken negen geselecteerd voor het beantwoorden van de uitgangsvragen (Birnbaum, 1999; Brandt, 1976; Brodie, 1981; Cole 1975; Hümpel, 1982; Matheson, 1990a; Matheson 1990b; Oo, 1995; Pons, 1989). Zie tabblad 'Verantwoording' voor de zoekverantwoording en kopje 'Evidence tabellen' voor de evidence tabel.
GRADE tabel
|
Beoordeling van kwaliteit |
Kwaliteit |
||||||
|
Aantal studies |
Studie ontwerp |
Studie beperkingen |
Inconsistentie |
Indirectheid |
Imprecisie |
Andere opmerkingen |
|
|
Excretie benzodiazepinen in borstvoeding |
|||||||
|
9 |
Observationele studies |
Ernstige beperkingen 1-5 |
Geen ernstige inconsistentie |
Geen ernstige indirectheid |
Ernstige imprecisie 6 |
Geen |
ZEER LAAG |
|
Directe effecten benzodiazepine bevattende borstvoeding op kind |
|||||||
|
3 |
Observationele studies |
Ernstige beperkingen 2,5 |
Geen ernstige inconsistentie |
Geen ernstige indirectheid |
Ernstige imprecisie 6 |
Geen |
ZEER LAAG |
1 Birnbaum; 10-20% uitval door logistieke redenen of geen toestemming tot venapunctie bij de neonaat. Ziekenhuis laboratoria die verschillen in tests en hun sensitiviteit, daarbij was er geen standaard assay protocol. Er is geen informatie gegeven over het voedingsschema, de tijd en dosis inname medicatie en de tijdsspan waarin voeding werd gegeven.
2 Brodie; Inclusie van niet lacterende vrouwen. Vrouwen werden op basis van lichamelijk onderzoek geïncludeerd of geëxcludeerd, verdere gegevens over geëxludeerden werd niet gegeven. Er is geen informatie gegeven over het voedingsschema, de tijd en dosis inname medicatie en de tijdsspan waarin voeding werd gegeven.
3 Cole; Inclusiecriteria niet genoemd. Er werd geen evenwicht van het middel tussen borstvoeding en bloed bereikt. Er is niet duidelijk wanneer het middel werd gegeven en hoe snel hierop melk en bloed werden afgenomen.
4 Hümpel; Sensitiviteit van de test was erg laag (22pg/ml, terwijl het detectielimiet volgens de studie 30 pg/ml is). Er is geen informatie gegeven over het voedingsschema, de tijd en dosis inname medicatie en de tijdsspan waarin voeding werd gegeven.
5 Matheson; Comedicatie door 15 vrouwen (14 paracetamol, 1 aspirine, 1 methylergometrine).
6 Totaal N= 53 De kwaliteit van de onderzoeken werden zeer laag beoordeeld door de heterogeniteit in de methode van het meten van de uitkomsten, daarnaast betreft het studies met zeer kleine onderzoekspopulaties (n<10). (Birnbaum 11, Brodie 5, Cole 9, Hümpel 5, Matheson 12, Oo 6, Pons 5).
Referenties
- Birnbaum CS, Cohen LS, Bailey JW, Grush LR, Robertson LM, Stowe ZN. Serum concentrations of antidepressants and benzodiazepines in nursing infants: A case series. Pediatrics 1999 Jul;104(1):e11.
- Brandt R, Passage of diazepam and desmethyldiazepam into breastmilk. Arzeim.-Forsch. (Drug Res) 1976; 26.
- Brodie RR, Chasseaud LF, Taylor T. Concentrations of N-descyclopropylmethylprazepam in whole-blood, plasma, and milk after administration of prazepam to humans. Biopharm Drug Dispos 1981;2:59-68.
- Cole AP, Hailey DM. Diazepam and active metabolite in breast milk and their transfer to the neonate. Arch Dis Child. 1975;50(9):741-2
- Hümpel M, Stoppelli I, Milia S, Rainer E. Pharmacokinetics and biotransformation of the new benzodiazepine, lormetazepam, in man. Eur J Clin Pharmacol (1982) 21:421-425
- Matheson I, Sande HA, Gaillot J. The excretion of zopiclone into breast milk. Br J clin Pharmac (1990a);30, 267-271
- Matheson I, Lunde PK, Bredesen JE. Midazolam and nitrazepam in the maternity ward: milk concentrations and clinical effects. Br J Clin Pharmacol (1990b);30:787-93.
- Nordeng H, Havnen GC, Spigset O. Drug use and breastfeeding. Tidsskr Nor Laegeforen. 2012;132:1089-93.
- Oo CY, Kuhn RJ, Desai N, Wright CE, McNamara PJ. Pharmacokinetics in lactating women: prediction of alprazolam transfer into milk. Br J Clin Pharmacol 1995;40:231-6.
- Pons G, Francoual C, Guillet P, Moran C, Hermann P, Bianchetti G. Zolpidem excretion in breast milk. Eur J Clin Pharmacol 1989;37:245-8.
Evidence tabellen
|
Reference |
Study type |
Characteristics |
Exposure |
Outcome measures and follow-up time |
Results |
Quality assessment study |
|
Birnbaum, 1999 |
Case series (prospective)
N total = 35 (11 used clonazepam) |
Aim of the study to evaluate the extent that psychotropic medications were present in the serum of infants breastfed by mothers treated with antidepressants and benzodiazepines.
Inclusion criteria All patients who were seen by physicians in the program and who elected to breastfeed while taking psychotropic medications were invited to participate in the study.
Exclusion: Not mentioned. |
35 infants of mothers referred to the Perinatal Psychiatry Program who elected either 1) to continue pharmacologic therapy begun during pregnancy (n= 25)
or
2) to initiate psychopharmacologic treatment during the puerperium (n=10).
|
Primary outcomes: Presence of detectable levels of medication in infants whose mothers breastfed while taking psychotropic medications during pregnancy and/or during the puerperium and the well-being (based on maternal report) of infants who had detectable serum concentrations of medication.
|
Primary outcomes: Clonazepam was not detected in the 9 other infants whose mothers used clonazepam during pregnancy and in the postpartum period. Neither fluoxetine nor clonazepam was detected in the sera of infants whose mothers were treated with these medications exclusively during the puerperium. Clonazepam was detected in 1 infant (co-morbidity infant hyperbilirumbinemia). N=11 (clonazepam use, with n=5 in use with comedication) |
Clearly defined groups: Yes.
Selection bias: Possible. 10% to 20% declined because of logistic reasons or refusal to have the infant undergo venipuncture. No further info about this group.
Method of assessing the methods and outcome appropriately: Yes. But hospital-based laboratories with assays that differed in sensitivity, and the assay protocol was not standardized
Selective loss to follow up: No.
Identification confounders and correction in analysis: No info about feeding schedule, as well as regarding time and duration of maternal dose. No correction. Data regarding the relationship between time of medication ingestion and the time of feedings also were not available.
Funding: supported by an unrestricted grant from the van Ameringen Foundation (L.S.C.) and by the National Association for Research in Schizophrenia and Depression (L.S.C.). |
|
Brandt, 1976 |
Prospective cohort
N total = 4 |
Aim of the study: To study whether and to what extent diazepam passes into the breast milk during repeated oral administration to nursing mothers.
Inclusion criteria: Not mentioned
Exclusion criteria: Comedication |
Intervention: 10 mg diazepam once a dag 3-9th day post partum 20 mg diazepam iv prior to delivery
Controls: None |
Outcomes: Concentrations of diazepam and desmethyldiazepam in plasma and milk.
Follow up:- |
Outcomes: Plasmaconcentration range during day 3-9th: 34-188 ng/ml
Milkconcentration range during day 3-9th: 125-85 ng/ml
|
Clearly defined groups: No
Selection bias: Possibly
Method of assessing the outcome appropriately: Yes
Impact assessor blinded: No
Selective loss to follow up: No
Identification confounders and correction in analysis: No
Funding: None |
|
Brodie, 1981 |
Prospective cohort
N total = 10 5 (women) |
Aim of the study To measure the whole-blood, plasma and milk concentrations of desalkylprazelam that occurred after oral doses of prazelam to human subjects.
Inclusion criteria - 5 healthy lactating women, who were not breast feeding their babies.
Exclusion criteria: - |
Intervention Fasting 12h before and 4 h after 30 mg prazelam. For the following 3 days 3x20mg/d. Milk and bloodsamples were collected and analyzed. |
Primary outcomes: -Clearance -Plasma half-life -Peak level -Peak time
Secundary outcomes: -Blood-milk ratio (after repeated dosis for 3 days)
Follow up: none |
Primary outcomes:
Secundary outcomes:
>10% is secreted into breast milk, 4% is expected to reach the newborn |
Clearly defined groups: Yes
Selection bias: physical examination before participating. Possibly exclusion and bias.
Method of assessing the outcome appropriately: Yes. Selective loss to follow up: No
Identification confounders and correction in analysis: No info about feeding schedule, as well as regarding time and duration of maternal dose. No correction. Data regarding the relationship between time of medication ingestion and the time of feedings also were not available.
Funding: - |
|
Cole, 1975 |
Prospective cohort
N total = 9 |
Inclusion criteria: Unknown
Exclusion criteria:- |
Intervention -Nine breast feeding mothers were given diazepam for post-partum tranquilization of persistent hypertension, -Maternal milk and simultaneous blood samples -Capillary blood samples from the infants coincident with routine neonatal investigations -The infants were closely observed for the clinical features associated with diazepam toxicity. |
Primary outcomes: Blood-milk ratio of diazepam
Secundary outcomes: Adverse effects
Follow up: No |
Primary outcomes: The ratios of maternal to milk levels of these substances were variable, ranging from 4 . 75:1 to 0.36:1, with an average of 2:1.
Secundary outcomes: No adverse clinical affects were observed other than 3 cases of mild jaundice. |
Clearly defined groups: Yes, inclusion and exclusion criteria are missing
Selection bias: Possibly
Method of assessing the outcome appropriately: Variabel outcomes.... Unsure
Identification confounders and correction in analysis: Identified, but not corrected. Lack of equilibration between maternal milk and blood, and also to the variable ease with which these infants took to the breast. No information about the time the medication was taken and the moment of milk and blood collection.
Funding:- |
|
Hümpel, 1982 |
Prospective cohort
N total = 5 |
Inclusion criteria: -Post SC -Breast feeding
Exclusion criteria: Non mentioned |
Aim of the study: The ratio of lormetazepam levels in milk and plasma
Intervention: - 2-3 days after delivery medication started -10 daily doses of 2 mg lormetazepam -Plasma and milk samples just before and 12h after the medication - Plasma of the infant on day 2,6 and10 |
Primary outcomes: -M/P ratio
Follow up: - |
Primary outcomes: The ratio of the levels of lormetazepam in milk and plasma was estimated to be below 0.06, and for the glucuronide the ratio was 0.04. The quantity of free and conjugated active ingredient transferred to the children via breast milk was calculated. to be at most 100 ng/kg, corresponding to 0.35 % of the maternal dose, which is regarded as tolerable. |
Clearly defined groups: Yes
Selection bias: Unknown
Method of assessing the outcome appropriately: Mostly; The detection limit in plasma from mothers and children was calculated to be 30pg/ml and 90pg/ml, respectively. The sensitivity in milk was found to be 200pg/ml..
Identification confounders and correction in analysis: No, unknown when the infant got milk.
Funding: None mentioned |
|
Matheson, 1990 |
Randomized controlled trail
N total = 22 |
Inclusion criteria: -Lactating women who had delivered healthy babies in the Department of Obstetrics and Gynecology, Ullevaal Hospital -Initiated breast-feeding and had produced about 15-20 ml milk at one feed
Exclusion criteria: - |
Intervention Each mother was asked each night of the 5 day hospital period if she needed a sleeping pill. If so, she was then given either nitrazepam 5 mg (n = 10) or midazolam 15 mg (n = 12) in a double-blind random fashion. -Venous blood and milk samples (3-8 ml) around 06.00 h, i.e. about 7 h (range 6-8 h) after tablet intake and immediately before the morning feed. -Milk was expressed manually and the first millilitre was discarded. An interval of 6-8 h since the previous breast feed was noted.
Controls Nitrazepam vs midazolam |
Primary outcomes: -Residual concentrations of midazolam 15 mg p.o. and nitrazepam 5 mg p.o., were measured in early breast milk and plasma 7 h after intake on day 2 to day 6 postpartum
Secundary outcomes: -Milk pH, -Milk fat and -Binding to plasma proteins -Sleep variables scored on questionnaires.
Follow up: - |
Primary outcomes: -No measurable (<10 nmol -1) concentrations of drug in milk when taken midazolam at night, either after the first night or after the fifth night. -The mean (s.d.) milk to plasma ratio for midazolam was 0.15 (0.06) in six paired samples. -It may be assumed that practically no midazolam is transferred via early milk to the baby if the baby is nursed more than 4 h after tablet intake. -Milk nitrazepam concentrations increased significantly from the first (30 nmol 1-1) to the fifth morning (48 nmol 1-1) in the nitrazepam at night group. - The mean (s.d.) milk to plasma ratio of nitrazepam after 7 h was 0.27 (0.06) in 32 paired samples, and did not vary from day 1 to day 5. - The average amount of nitrazepam received by the breast-fed baby in the morning was calculated to increase from 1 to 1.5 ,ug 100 ml-' breast milk, from days 1 to 5. Secundary outcomes: In the mothers nitrazepam was associated with better hypnotic effect, but a higher incidence of complaints than midazolam.
|
Clearly defined groups: Yes
Selection bias: Not mentioned
Method of assessing the outcome appropriately: Yes
Impact assessor blinded: Yes
Selective loss to follow up: No
Identification confounders and correction in analysis: Identification, but no correction. - Pharmacokinetic comparisons in milk were not possible as nitrazepam could be measured only after 7 h, at a time when midazolam was undetectable. -Changes in total plasma drug concentrations that might result from plasma binding changes were not considered. Funding: None mentioned |
|
Matheson, 1990 |
Prospective cohort
N total = 12 |
Aim of the study: The excretion of zopiclone into breastmilk oral administration of a single zopiclone tablet
Inclusion criteria: - lactating women -2-6 days postpartum
Exclusion criteria: Not mentioned |
Intervention: -oral administration of a single zopiclone tablet (7.5mg) 21:00-23:00 -Venous blood and milk samples after 15, 30 min and 1, 2, 4, 8, 11 and 22 hours |
Primary outcomes: The milk/plasma AUC ratio of zopiclone was 0.51±0.09 (mean±s.d.). Individual mean milk/plasma concentration ratios of zopiclone showed significant interindividual variation(range0.41- 0.70).
Secundary outcomes: -Cmax, tmax, t1/2 in milk and plasma -Intake of the infant
Follow up: No |
Primary outcomes: The milk/plasma AUC ratio of zopiclone was 0.51±0.09 (mean±s.d.). Individual mean milk/plasma concentration ratios of zopiclone showed significant interindividual variation(range0.41- 0.70). Secundary outcomes: A comparison of pharmacokinetic parameters in the postpartum women with those reported previously in non-pregnant women, showed significantly higher Cmax values in the lactating mothers; tmax occurred later in milk than in maternal plasma. -Assuming a daily milkintake of 0.15l/kg-and 100% absorption the average infant dose of zopiclone in milk would be 1.4% of the weight adjusted dose ingested by the mother. |
Clearly defined groups: Yes
Selection bias: Yes, it is emphasized that only mothers with established milk production and in apparently gor physical and mental condition were selected.
Method of assessing the outcome appropriately: Yes
Identification confounders and correction in analysis: Identification, but no correction. Analgetics were accepted, but not mentioned.
Funding: Non mentioned |
|
Oo, 1995 |
Prospective cohort
N total = 8 |
Inclusion criteria: -Lactating women -6-28 weeks postpartum
Exclusion criteria: Not mentioned |
Aim of the study: To assess the pharma-cokinetics of alprazolam and its two hydroxylated metabolites: 4-hydroxy-alprazolam and alva-hydroxy-alprazolam in lactating human volunteers and to test the predictability of four recently reported models for drug transfer into milk based on physicochemical properties.
Intervention: Each subject received a single oral dose of alprazolam (2x 0.25 mg). Multiple blood (7 ml) and milk (15-60 ml) samples were obtained at 0.0, 0.25, 0.50, 1.0 2.0, 4.0 6.0, 8.0, 12.0, 24.0 and 36 h. Suckling of the infant was discontinued after drug administration.
Controls:- |
Outcomes: -Clearence -Serum and milk T1/2 -Cmax, serum&milk -tmax, serum&milk -T1/2, serum&milk -Mean residence time (The time course of alprazolam in milk roughly paralleled the respective plasma time profile) -Predictability of four recent models for drug transfer into milk.
Follow up:- |
Outcomes: 4-Hydroxy-alprazolam was found in serum, but not milk, at the detection limit of 0.5-1 ng ml-' or less; a-hydroxy alprazolam was not detected in any of the samples.
Observed milk/serum concentration ratios were determined in vivo as AUCmilk/ AUCserum (mean M/S obs = 0.36 ± 0.11). Predicted M/S ratios were calculated from the in vitro measures of the unbound fractions of alprazolam in serum and skim milk (mean fs = 0.18 ± 0.02, mean fm = 0.74 ± 0.05 respectively); the unionized fractions in serum and whole milk (both values approached unity); the skim to whole milk drug concentration ratio (mean S/W = 0.86 ± 0.09); crematocrit (mean Cr = 0.06 ± 0.02), and assuming the milk lipid:ultrafiltrate partition coefficient, Pm = 5.48. The diffusion based models using in vitro measurements adequately predicted M/S obs. |
Clearly defined groups: Yes
Selection bias: Unknown, not suspected
Method of assessing the outcome appropriately: Yes, but with a 4-hydroxy-alprazolam detection limit of 0.5-1 ng/ml
Selective loss to follow up: No
Identification confounders and correction in analysis: Yes
Funding: This work was supported by the Upjohn Company and NIH grant
|
|
Pons, 1989 |
Prospective cohort
N total = 5 |
Inclusion criteria: -Lactating women -3-4 days post partum
Exclusion criteria: -Not mentioned |
Aim of the study: To examine the excretion of zolpidem in breast milk.
Intervention: Before the study, each mother agreed to stop nursing her infant for 24 h after drug administration.
A single 20 mg tablet of zolpidem was admini-stered at 20.00 h, 30 min after dinner, and milk samples were collected before and 3, 13 and 16 h. Venous blood 5 ml was taken before and 1.5, 3, 13, 16 h after zolpidem administration
Controls: - |
Outcomes: -T1/2 -M/P ratio -Clearance milk
Follow up: |
Outcomes: The maximum plasma concentration (Cmax was observed between 1.75 and 3.75 h after drug administration (tmax) and ranged from 90 to 364ng/ml (Fig. 1). The apparent elimination half-life (t1/2) and area under the plasma concentration-time curve extrapolated to infinity (AUC) were, respectively, 2.6 (0.3) h and 1437 (307 ng.ml -t -h, Table 1). The amount of zolpidem recovered in breast milk 3 h after drug administration ranged between 0.76 and 3.88 lxg, i.e. 0.004 to 0.019% of the administered dose. No detectable (below 0.5 ng/ml) zolpidem was found in subsequent milk samples (Fig.l). The breast milk clearance of zolpidem was 1.48 (0.38) ml/h (range 0.68-2.61). The 3-h milk/plasma concentration ratio was 0.13 (0.01); range 0.11-0.18 |
Clearly defined groups: Yes
Selection bias: Unknown, not suspected
Method of assessing the outcome appropriately: Detection limit of zolpidem was 0.5 ng/ml.
Selective loss to follow up: No
Identification confounders and correction in analysis: Yes
Funding: Not mentioned
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-03-2014
Beoordeeld op geldigheid : 01-01-2013
Binnen 5 jaar bepaalt het bestuur van de Nederlandse Vereniging voor Obstetrie en Gynaecologie in samenspraak met de NVVP en de NVK of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Obstetrie en Gynaecologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Gezien de opzet van de richtlijn, kan bij bekend worden van relevant onderzoek waarbij (een deel van) de richtlijn zou moeten worden aangepast, dit tussentijds per uitgangsvraag plaatsvinden.
Algemene gegevens
Deze richtlijn is tot stand gekomen in met ondersteuning van de Orde van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doelstelling
Het doel van deze richtlijn is de onduidelijkheid en onzekerheid over het al dan niet continueren of aanpassen van de dosis van (specifieke) benzodiazepinen tijdens zwangerschap en/of lactatie te verminderen door het geven van informatie en aanbevelingen voor het gebruik van benzodiazepinen in deze periode en voor het beleid met betrekking tot de pasgeborene. Tevens wordt door het ontwikkelen van deze richtlijn multidisciplinaire samenwerking gestimuleerd, zodat zwangere vrouwen met psychische problemen en medicijngebruik gezamenlijk geëvalueerd en behandeld worden.
Patiëntencategorie
In principe geldt de richtlijn voor alle vrouwen met kinderwens, zwangere vrouwen en/of vrouwen die borstvoeding (willen) geven bij wie er een indicatie bestaat voor behandeling met benzodiazepinen of bij wie er reeds sprake is van benzodiazepinegebruik ongeacht de indicatie voor het benzodiazepinegebruik.
Richtlijngebruikers
De richtlijn kan worden gebruikt door alle zorgverleners die betrokken zijn bij de zorg voor vrouwen die een benzodiazepine gebruiken tijdens zwangerschap en/of lactatie maar is primair geschreven voor leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen: de Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Nederlandse Vereniging voor Kindergeneeskunde en de Nederlandse Vereniging voor Psychiatrie.
Samenstelling werkgroep
Voor het ontwikkelen van deze richtlijn is in 2012 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van de Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Nederlandse Vereniging voor Kindergeneeskunde en de Nederlandse Vereniging voor Psychiatrie. Deze drie wetenschappelijke verenigingen zijn betrokken bij het zorgproces in de tweede lijn van vrouwen die benzodiazepinen gebruiken in de zwangerschap, het kraambed of tijdens de lactatie.
De werkgroepleden werden door de wetenschappelijke verenigingen gemandateerd voor deelname aan deze werkgroep. De werkgroepleden zijn gezamenlijk verantwoordelijk voor de integrale tekst van deze conceptrichtlijn.
De werkgroep werd ondersteund door een klinisch epidemioloog en twee richtlijnondersteuners.
Partijen die geen zitting hadden in de werkgroep maar wel voor advies geraadpleegd werden vanwege hun betrokkenheid bij het onderwerp zijn het Nederlandse Huisartsen Genootschap (NHG), de Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) en de Angst, Dwang en Fobie (ADF) stichting.
Samenstelling van de werkgroep
- Dhr. dr. J.J. Duvekot, gynaecoloog-perinatoloog, Erasmus MC, Rotterdam (voorzitter)
- Mw. M.E. van Hoorn, gynaecoloog-perinatoloog, VU Medisch Centrum, Amsterdam
- Mw. dr. I.L. van Kamp, gynaecoloog-perinatoloog, Leids Universitair Medisch Centrum, Leiden
- Dhr. dr. M.J.K. de Kleine, kinderarts-neonatoloog, Máxima Medisch Centrum, Veldhoven
- Mw. S.D. Sie, kinderarts-neonatoloog, VU Medisch Centrum, Amsterdam
- Mw. dr. M.M. van Weissenbruch, kinderarts-neonatoloog, VU Medisch Centrum, Amsterdam
- Dhr. dr. K.P. Grootens, psychiater, Canisius Wilhelmina Ziekenhuis, Nijmegen
- Mw. dr. I.M. van Vliet, psychiater, Leids Universitair Medisch Centrum, Leiden
- Dhr. Ir. T.A. van Barneveld, klinisch epidemioloog, Orde van Medisch Specialisten, Utrecht
- Mw. C.A.L. van Rijn, arts, richtlijnondersteuner Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
- Mw. M.E.P.F. Rückert, arts, richtlijnondersteuner Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
Extern advies:
Mw. drs. M. Wessels, informatiespecialist, Orde van Medisch Specialisten, Utrecht
Belangenverklaringen
De werkgroepleden hebben geen strijdige belangen aangegeven. De originele belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG. Zie hieronder voor een voorbeeldformulier belangenverklaring.
De inhoud van de conclusies en aanbevelingen uit deze richtlijn werd onafhankelijk opgesteld van en niet beoordeeld door de financier van deze richtlijn, de Stichting Kwaliteitsgelden Medisch Specialisten.
Belangenverklaring formulier
Verklaring omtrent mogelijke belangenverstrengeling en embargo met betrekking tot de richtlijn ‘gebruik van benzodiazepinen en zwangerschap’ op initiatief van ‘NVOG’
Utrecht, ………………………. 2011
Betreft: Richtlijn ‘Gebruik van Benzodiazepinen en zwangerschap’
Geachte heer, mevrouw,
In verband met uw deelname aan de ontwikkeling van de richtlijn ‘gebruik van Benzodiazepinen en zwangerschap’ vragen wij u bijgevoegde verklaring in te vullen.
Mogelijke belangenverstrengeling:
Mogelijke belangenverstrengeling valt niet steeds te vermijden, maar de Orde van Medisch Specialisten en NVOG vinden het wel van belang dat hierover openheid bestaat. U wordt daarom gevraagd op bijgaand formulier te vermelden of u in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhield met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn ‘Benzodiazepine gebruik in de zwangerschap en tijdens de lactatie’.
Hetgeen u in uw verklaring vermeldt, zal bij het secretariaat van de NVOG opvraagbaar zijn.
Embargo
Gedurende de richtlijnontwikkeling rust een embargo op de teksten van de conceptrichtlijn.
Dit betekent dat het zonder schriftelijke toestemming van de opdrachtgever niet is toegestaan om passages uit de conceptrichtlijn, of de gehele conceptrichtlijn inclusief bijlagen zoals evidence-tabellen te verstrekken aan derden.
Ondergetekende verklaart zich door ondertekening akkoord met het bovenstaande.
.......................................................................................................................................
(naam)
........................................................... ...............................................................
(plaats, datum) (handtekening)
Formulier belangenverklaring
Heeft u naar uw mening in de afgelopen vijf jaar en/of gedurende de looptijd van het project belangen die mogelijk kunnen interfereren met de besluitvorming in de werkgroep ten aanzien van de interpretatie van het wetenschappelijk bewijs en het opstellen van aanbevelingen?
Ja / Neen i
Zo ja, wilt u aangeven uit welke activiteiten deze belangen voortvloeien en welke organisaties/bedrijven het betreft? Voorbeelden van activiteiten kunnen gevonden worden in consultatie/advisering, (na)scholing / cursus en ondersteuning van wetenschappelijk onderzoek.
1. ..................................................................................................................................
2. ..................................................................................................................................
3. ..................................................................................................................................
Bij meer dan deze drie vermeldingen graag een extra blad bijvoegen.
Ondergetekende verklaart bovenstaande informatie naar waarheid te hebben ingevuld en mutaties t.a.v. bovenstaande te vermelden aan de voorzitter en secretaris van de werkgroep:
Betreft: richtlijn ‘gebruik van Benzodiazepinen en zwangerschap’
Naam: ............................................................................................................................
Afgevaardigde namens: ....................................................................................................
........................................................... ...............................................................
(plaats, datum) (handtekening)
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is geprobeerd rekening te houden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn wordt verspreid onder alle relevante beroepsgroepen. Daarnaast is een patiëntenfolder opgesteld. Ook is de richtlijn te downloaden vanaf de websites van de Nederlandse Vereniging voor Obstetrie en Gynaecologie (www.nvog.nl), de Nederlandse Vereniging voor Psychiatrie (www.nvvp.net) en de Nederlandse Vereniging voor Kindergeneeskunde (www.nvk.nl).
In module 'Organisatie van zorg benzodiazepinegebruik' worden de consequenties voor zwangere vrouwen die benzodiazepinen gebruiken tijdens zwangerschap en/of lactatie nader besproken.
Werkwijze
Methode richtlijnontwikkeling
Deze richtlijn is opgesteld aan de hand van het ‘Appraisal of Guidelines for Research & Evaluation’ (AGREE-II) instrument (www.agreetrust.org). Dit is een breed (internationaal) geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen. Bovendien werd gekozen om -volgens de meest recente ontwikkelingen op het gebied van richtlijnen - de methode toe te passen van The Grading of Recommendations Assessment, Development and Evaluation (GRADE) voor het graderen van de kwaliteit van bewijs en de sterkte van de aanbevelingen. Voor deze methode werd gekozen omdat naast de grootte van studies hierbij ook de kwaliteit van het onderzoek in de beoordeling wordt meegenomen. Formeel is de GRADE methode ontworpen voor het beoordelen van onderzoek naar interventies. Daarom werd afgezien van het aangeven van de sterkte van de aanbevelingen en is alleen de kwaliteit van bewijs in de richtlijn vermeld.
Literatuur zoekstrategieën
Er werd eerst oriënterend gezocht naar bestaande richtlijnen (https://www.ahrq.gov, www.nice.org.uk, het cbo en www.sign.ac.uk en naar systematische reviews in de Cochrane Library. Vervolgens werd er voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke onderzoeken in de elektronische databases PubMed, Embase en PsychINFO van 1940 tot november 2011 in de Engelse of Nederlandse taal. De gebruikte zoekverantwoording staat vermeld in onder kopje 'zoekverantwoording'.
Uitkomstmaten
Bij de beoordeling van de literatuur heeft de werkgroep vooral gekeken naar onderzoeken waarbij, naar inzicht van de werkgroepleden, klinisch relevante uitkomstmaten gebruikt werden. Deze werden voorafgaand aan de literatuurselectie door de werkgroep bepaald en gedefinieerd. Ook de meetinstrumenten die volgens de werkgroep relevant en acceptabel (valide) waren voor het meten van de uitkomstmaten werden vooraf vastgesteld.
Tabel 1 is een overzicht van door de werkgroep opgestelde klinisch relevante uitkomstmaten en daarbij opgestelde geaccepteerde meetinstrumenten met klinisch relevante afkappunten.
Tabel 1: Uitkomstmaten
|
Uitkomstmaten |
Operationalisatie |
|
Zwangerschapscomplicaties |
|
|
spontane miskraam |
frequentie voorkomen |
|
hypertensieve complicaties |
frequentie voorkomen |
|
diabetes gravidarum |
frequentie voorkomen |
|
Intrauteriene vruchtdood (IUVD) |
frequentie voorkomen |
|
Intrauteriene groeivertraging (IUGR) |
< P2.3, < P10 |
|
Zwangerschapsduur |
< 37 weken (< 32 weken) en > 42 weken, continue uitkomsten |
|
Complicaties tijdens de baring |
|
|
kunstverlossingen |
frequentie voorkomen |
|
sectio’s |
frequentie voorkomen |
|
inleiding van de baring (vordering?) |
ja/nee |
|
Complicaties bij het kind |
|
|
congenitale afwijkingen |
ja/nee (mild,ernstig) |
|
vroege effecten |
|
|
Geboortegewicht |
SGA (< -2 SD, < P10) of > P90 en continue uitkomsten |
|
Apgar score |
< 7 na 5 minuten |
|
pH navelstrengarterie |
< 7.00 (geen continue uitkomst) |
|
opname op de NICU |
ja/nee |
|
opname op kinderafdeling (niet NICU indicatie) |
ja/nee |
|
Onttrekkingsverschijnselen |
ja/nee -> tonusproblemen, voedingsproblemen, tremoren, prikkelbaarheid en convulsies |
|
Intoxicatie verschijnselen |
ja/nee -> ‘floppy infant’ syndroom, tonusproblemen, ademhalingsdepressie, hypotensie |
|
lange-termijn effecten |
definitie: vanaf 2 jaar tot volwassen (gevalideerde/gestandaardiseerde meetinstrumenten) |
|
motorische effecten |
vb. BSID (Bayley), Aims |
|
emotionele, sociale en gedragseffecten |
vb. CBCL (child behavior checklist), BSID, SST (strange situation procedure) |
|
cognitieve effecten |
vb. IQ als continue maat, BSID |
|
psychiatrische aandoeningen |
ja/nee -> slaapstoornissen, angst en stress |
Literatuurselectie
Per uitgangsvraag werden twee werkgroepleden aangesteld om onafhankelijk van elkaar de literatuur te beoordelen op relevantie. Bij de eerste selectie op titel en abstract werden de volgende exclusiecriteria gehanteerd:
- niet van toepassing op de vraagstelling
- niet vergelijkbaar met de Nederlandse populatie
- niet-gedefinieerde uitkomstmaat
- minder dan tien vrouwen in de onderzoekspopulatie (wegens imprecisie)
- meer dan 5% van de vrouwen gebruikten andere psychofarmaca of andere comedicatie, waarvoor niet was gecorrigeerd (minimaal een subgroepanalyse of multivariate analyse)
- andere indicatie voor benzodiazepinegebruik dan slaap-, stress- en angststoornissen (zoals epilepsie, anesthesiologische sedatie, preëclampsie en hyperemesis gravidarum)
Een exacte definitie voor chronisch of incidenteel gebruik ontbreekt. De Stichting Farmaceutische Kengetallen definieert een periode van meer dan drie maanden als chronisch gebruik. In principe zou bij chronisch gebruik continu een spiegel van het medicament in het bloed aanwezig moeten zijn. Uiteraard is dit laatste dan afhankelijk van de inname frequentie en de halfwaardetijd van het medicament.
Voor het opstellen van antwoorden op de uitgangsvragen van deze richtlijn werden de volgende specifieke definities gebruikt:
1. Mate van gebruik
- Niet-chronisch gebruik: maximaal 2 weken onafgebroken gebruik (in één trimester) of in totaal tijdens de zwangerschap maximaal 2 weken gebruik. Onder deze categorie valt dus zowel het incidenteel als het intermitterend gebruik van de medicatie.
- Chronisch gebruik: meer dan 2 weken onafgebroken gebruik tijdens de zwangerschap.
2. Hoge en lage dosering
- Hoog:
- Oxazepam > 30 mg/dag
- Temazepam > 20 mg/dag
- Zolpidem >10 mg/dag
- Laag:
- Oxazepam ≤ 30 mg/dag
- Temazepam ≤ 20 mg/dag
- Zolpidem ≤ 10 mg/dag
Comedicatie
Een deel van de patiënten die benzodiazepinen gebruiken, gebruiken hiernaast andere medicatie, zoals antidepressiva, antipsychotica, stemmingsstabilisatoren, of somatische medicatie. Deze richtlijn probeert om zoveel mogelijk alleen de effecten van benzodiazepinen te beschrijven. Bij de literatuurselectie is hier rekening mee gehouden en worden alleen onderzoeken met comedicatie gebruikt als er een adequate subanalyse is gemaakt.
Diverse vormen van comedicatie, ondermeer antipsychotica en antidepressiva maar ook vele andere somatische medicamenten, alsook alcohol en drugs, kunnen de werking van benzodiazepinen beïnvloeden. Mogelijk geldt dit ook voor de effecten op het (ongeboren) kind. Deze invloed op de werking van benzodiazepinen kan worden veroorzaakt door remming of juist stimulatie van bepaalde leverenzymen (cytochroom P450-systeem). Ook kan er sprake zijn van directe effecten op neurotransmittersystemen in de hersenen. De effecten van comedicatie dienen daarom bij de diverse afwegingen meegenomen te worden (zie ook bijlage 'Achtergrondinformatie').
Antipsychotica, antidepressiva, opioïden, anti-epileptica, anaesthetica en sedatieve antihistaminica kunnen de werking en de bijwerkingen van benzodiazepinen versterken. Stoffen die bepaalde leverenzymen (met name CYP3A4) remmen (zoals grapefruitsap, cimetidine, erytromycine en azoolantimycotica zoals ketoconazol en itraconazol), kunnen de werking van alprazolam, diazepam, midazolam, zolpidem en zopiclon versterken. Klinisch relevante interacties zijn gemeld met midazolam. Deze interactie zal zich niet voordoen bij temazepam, lormetazepam, lorazepam en oxazepam, die vooral worden geglucuronideerd. (bron: Farmacotherapeutisch Kompas, 2013)
Beoordeling van de kwaliteit van onderzoeken
Na selectie door de werkgroepleden bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De geselecteerde artikelen werden vervolgens door de werkgroepleden beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is de indeling gebruikt, zoals weergegeven in tabel 2.
De beoordeling van de verschillende artikelen vindt u in de verschillende teksten terug onder ‘Samenvatting literatuur’. De richtlijnondersteuners maakten in samenspraak met de subgroepen per vraag evidence tabellen van de geselecteerde individuele onderzoeken als hulpmiddel bij het beoordelen en samenvatten van deze onderzoeken. Vervolgens werd de kwaliteit van het bewijs van het totaal aan gevonden onderzoeken van de betreffende vraag en uitkomstmaat (‘body of evidence’) beoordeeld. Met de kwaliteit van het bewijs wordt bedoeld in hoeverre er vertrouwen is dat de aanbevelingen gebaseerd kunnen worden op de (effectschatting van de) evidence en de GRADE tabellen. Het wetenschappelijk bewijs werd vervolgens kort samengevat in een ‘conclusie’. De belangrijkste literatuur waarop deze conclusie is gebaseerd staat bij de conclusie vermeld inclusief de GRADE gradering van bewijs.
Bij GRADE wordt de evidence per uitkomstmaat beoordeeld. De beoordeling wordt gedaan door het invullen van een evidenceprofiel. Alleen voor kritieke en/of belangrijke uitkomstmaten is een evidenceprofiel gemaakt. Er zijn in totaal vijf factoren die de kwaliteit van het bewijs per uitkomstmaat kunnen verlagen en drie factoren die de kwaliteit kunnen verhogen. Per factor kan de kwaliteit met een of twee niveaus omlaag gaan. Als het om een ernstige beperking gaat, gaat de kwaliteit met een niveau omlaag; als het om een zeer ernstige beperking gaat, gaat de kwaliteit met twee niveaus omlaag.
De verschillende typen onderzoek kunnen worden ingedeeld naar mate van bewijs. Randomized controlled trials (RCT’s) zijn in beginsel van hogere methodologische kwaliteit dan observationele onderzoeken, omdat RCT’s minder kans op vertekening (bias) geven. In het GRADE systeem beginnen daarom RCT’s met hoge kwaliteit (4) en observationele onderzoeken met lage kwaliteit (2). Niet-vergelijkende, niet-systematische onderzoeken (zoals ‘case series’ en ‘case reports’) worden altijd gekwalificeerd als zeer lage kwaliteit. Een overzicht van de GRADE indeling van kwaliteit van de onderzoeken per uitkomstmaat is weergegeven in tabel 2.
Aangezien de GRADE systematiek niet geschikt is voor de beoordeling van case reports en case series werden deze onderzoeken niet geselecteerd. Review artikelen waarin een overzicht van dit soort onderzoeken worden vermeld, werden alleen geselecteerd als geen andere onderzoeken voorhanden waren.
Tabel 2. GRADE-indeling van de kwaliteit van de onderzoeken per uitkomstmaat.
|
Kwaliteit |
Studiedesign |
Kwaliteit verlagen |
Kwaliteit verhogen |
|
Hoog (4) |
RCT |
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 waarschijnlijk -2 zeer waarschijnlijk |
+1 groot +2 zeer groot
+1 bewijs voor relatie
+1 zou het effect onderschatten +2 zou het effect overschatten als er geen effect was aangetoond
|
|
Matig (3) |
|
||
|
Laag (2) |
Observationele vergelijkend onderzoek (bijv. patiënt-controle onderzoek, cohort onderzoek) |
||
|
Zeer laag (1) |
Niet-systematische klinische observaties (bijv. ‘case studies’, ‘case reports’) |
RCT’s beginnen ‘hoog’ (4), observationele onderzoeken ‘laag’ (2).
Bij RCT’s: bijvoorbeeld 1 punt downgraden: dan van hoog (4) naar matig (3), 2 punten downgraden: dan van hoog (4) naar laag (2), 3 punten downgraden: dan van hoog (4) naar zeer laag (1).
Bij observationele onderzoeken: bijvoorbeeld 1 punt upgraden: dan van laag (2) naar matig (3).
Formuleren van aanbevelingen
Nadat de gegevens uit de GRADE tabellen waren samengevat als tekst werden hieruit conclusies getrokken. Om vervolgens tot een gewogen aanbeveling te komen werden de overige overwegingen besproken en geformuleerd. Dit is van belang omdat voor een aanbeveling naast het wetenschappelijke bewijs ook nog andere aspecten meegewogen horen te worden, zoals patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen en organisatorische aspecten. Bij de overwegingen spelen ook de ervaring en opvattingen van de werkgroepleden een rol (‘authority-based’). De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en op de belangrijkste overwegingen. De gebruikte methodiek voor richtlijnontwikkeling verhoogt de transparantie van de totstandkoming van de aanbevelingen in deze richtlijn.
Bij het beoordelen van de literatuur werd de volgende tekortkoming vastgesteld. Ondanks het feit dat benzodiazepinen al lang en veel worden gebruikt en er veel over is geschreven, werd weinig literatuur aangetroffen die voldeed aan de vooraf vastgestelde inclusiecriteria. In wetenschappelijk onderzoek naar dit onderwerp wordt vaak gebruik gemaakt van door patiënten zelf ingevulde vragenlijsten waarbij symptomen uitgevraagd worden zonder deze in de bredere context van duur, beperkingen en bijkomende relevante factoren te plaatsen. Meer in het bijzonder zijn er weinig vragenlijsten die specifiek rekening houden met de zwangerschap als lichamelijke bron van angst- en slaapstoornissen.
Alle conclusies en aanbevelingen werden plenair in de vergaderingen van de werkgroep besproken, waarbij door consensus tot een concepttekst werd gekomen. Indien dit niet mogelijk bleek werd door meerderheid van stemmen de uiteindelijke concepttekst bepaald. Uiteindelijk waren alle werkgroepleden akkoord met de voorliggende conceptteksten.
Zoekverantwoording
|
Onderwerp: Lactatie |
Database |
Zoekstrategie |
Aantal ref. |
|
1. In hoeverre worden benzodiazepinen uitgescheiden in de borstvoeding? (per middel, dosering en tijdstip)
2. Wat zijn de directe effecten van benzodiazepine bevattende borstvoeding op het kind?
3. Wat zijn de lange-termijn effecten van benzodiazepinen bevattende borstvoeding op het kind?
4. Is er een verschil in associatie tussen gebruik van verschillende benzodiazepinen tijdens de lactatie en effecten op het kind?
5. Welke benzodiazepinen hebben de voorkeur voor gebruik tijdens de lactatieperiode?
|
Medline (OVID) 1980- dec. 2011 Engels, Nederlands
Aanvullende search 1940-1979
PsycInfo (OVID)
Embase (Elsevier)
|
1 Breast Feeding/ (23180) 2 Lactation/ (30548) 3 ("breast feeding" or lactation or breastfeeding* or breast-feeding* or "breast milk" or breastmilk).ti,ab. (46527) 4 Milk, Human/ (14230) 5 1 or 2 or 3 or 4 (75244) 6 exp Anti-Anxiety Agents/ (54746) 7 exp Benzodiazepines/ (55777) 8 exp Anxiety Disorders/dt [Drug Therapy] (8287) 9 (alprazolam or Xanax or bromazepam or chlordiazepoxide or Librium or clobazam or Frisium or chlorazepate or Tranxene or diazepam or Stesolid or lorazepam or Temesta or oxazepam or Seresta or prazepam or Reapam or midazolam or Dormicum or brotizolam or lendormin or flunitrazepam or flurazepam or Dalmadorm or loprazolam or Noctamid or lormetazepam or Noctamid or nitrazepam or Mogadon or temazepam or Normison or zolpidem or Stilnoct or zopiclon or Imovane).af. (46721) 10 "anxiolytic drug*".ti,ab. (954) 11 6 or 7 or 8 or 9 or 10 (87252) 75 5 and 11 (222) 76 limit 75 to (yr="1980 -Current" and (dutch or english)) (167)
1 Breast Feeding/ (1819) 2 Lactation/ (1089) 3 ("breast feeding" or lactation or breastfeeding* or breast-feeding*).ti,ab. (3705) 4 (breastmilk or "breast milk" or "human milk").ti,ab. (407) 5 or/1-4 (4431) 6 "Anxiolytic drugs".ti,ab. (335) 7 exp Benzodiazepines/ (8773) 8 exp Minor Tranquilizers/ (5817) 9 (alprazolam or Xanax or bromazepam or chlordiazepoxide or Librium or clobazam or Frisium or chlorazepate or Tranxene or diazepam or Stesolid or lorazepam or Temesta or oxazepam or Seresta or prazepam or Reapam or midazolam or Dormicum or brotizolam or lendormin or flunitrazepam or flurazepam or Dalmadorm or loprazolam or Noctamid or lormetazepam or Noctamid or nitrazepam or Mogadon or temazepam or Normison or zolpidem or Stilnoct or zopiclon or Imovane).af. (24454) 10 6 or 7 or 8 or 9 (27339) 11 pregnancy/ or gravidity/ or exp labor, obstetric/ or exp parturition/ or exp pregnancy in adolescence/ or exp pregnancy, high-risk/ or exp pregnancy maintenance/ or exp pregnancy outcome/ or exp pregnancy, unplanned/ or exp pregnancy, unwanted/ (21020) 12 exp Prenatal Exposure/ (4398) 13 pregnan*.ti. (8220) 14 11 or 12 or 13 (26193) 15 10 and 14 (352) 16 5 and 10 (116) 17 limit 16 to ((dutch or english) and yr="1980 -Current") (114) > 16 dubbel > 98 uniek Aanvullende search: 19 referenties
alprazolam:ab,ti OR xanax:ab,ti OR bromazepam:ab,ti OR chlordiazepoxide:ab,ti OR librium:ab,ti OR clobazam:ab,ti OR frisium:ab,ti OR chlorazepate:ab,ti OR tranxene:ab,ti OR diazepam:ab,ti OR stesolid:ab,ti OR lorazepam:ab,ti OR temesta:ab,ti OR oxazepam:ab,ti OR seresta:ab,ti OR prazepam:ab,ti OR reapam:ab,ti OR midazolam:ab,ti OR dormicum:ab,ti OR brotizolam:ab,ti OR lendormin:ab,ti OR flunitrazepam:ab,ti OR flurazepam:ab,ti OR dalmadorm:ab,ti OR loprazolam:ab,ti OR ormetazepam:ab,ti OR noctamid:ab,ti OR nitrazepam:ab,ti OR mogadon:ab,ti OR temazepam:ab,ti OR normison:ab,ti OR zolpidem:ab,ti OR stilnoct:ab,ti OR zopiclon:ab,ti OR imovane:ab,ti OR (anxiolytic NEAR/1 drug*):ab,ti OR 'anxiolytic agent'/exp/mj OR 'benzodiazepine derivative'/exp/mj OR 'anxiety disorder'/exp/mj/dm_dt AND ('breast feeding':ti OR breastfeeding*:ti OR lactation:ti OR 'breast mik':ti OR breastmilk:ti OR 'breast feeding'/exp/mj OR 'lactation'/exp/mj OR 'breast milk'/exp/mj) AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [1980-2012]/py 112 refs. > 42 dubbel > 70 uniek Aanvullende search: 19 referenties, 16 uniek |
335
Plus aanvullende search: 35
|