Effect benzodiazepinegebruik op zwangerschap
Uitgangsvraag
- Is er een verband tussen benzodiazepinegebruik in de zwangerschap en het optreden van zwangerschapscomplicaties (miskraam, zwangerschapshypertensie en preeclampsie, zwangerschapsdiabetes, IUVD, groeivertraging, vroeggeboorte) en complicaties bij de baring (inleidingen, kunstverlossingen)?
- Is er een verschil in het optreden van deze complicaties bij het gebruik van verschillende benzodiazepinen in de zwangerschap?
- Dragen dosering, duur en tijdstip van de expositie aan benzodiazepinen tijdens de zwangerschap bij aan het optreden van zwangerschaps- en baringscomplicaties?
- Welke benzodiazepinen hebben de voorkeur voor gebruik tijdens de zwangerschap gezien het risico op zwangerschaps- en baringscomplicaties?
Aanbeveling
Er zijn geen redenen om gebruik van benzodiazepinen tijdens de zwangerschap te ontraden op basis van een toegenomen risico op zwangerschaps- en baringscomplicaties.
Gezien het ontbreken van duidelijke aanwijzingen voor een toename van zwangerschaps- en baringscomplicaties is er geen indicatie voor overname of extra controles in de 2e/3e lijn bij benzodiazepinegebruik tijdens de zwangerschap, tenzij er sprake is van hoge dosering, chronisch gebruik of comedicatie.
Overwegingen
Er is weinig onderzoek naar de effecten van maternaal benzodiazepinegebruik op het optreden van zwangerschaps- en baringscomplicaties. Bovendien is de kwaliteit van alle beschikbare onderzoeken zeer laag.
Het risico op een miskraam is multifactorieel bepaald. De leeftijd van de zwangere, roken, overmatig gebruik van alcohol en koffie, maternale ziekten of dragerschap van gebalanceerde chromosoomafwijkingen kunnen het risico aanzienlijk doen toenemen.
Benzodiazepinegebruik van de moeder lijkt, in slechts 1 studie, een zeer gering verhoogd risico op een miskraam te geven. De kwaliteit van de betreffende studie is echter laag vanwege de methodologie en omdat niet gecorrigeerd is voor andere factoren die het risico zouden kunnen verhogen. Daarom is het met de huidige kennis zeker nog discutabel of er werkelijk een associatie met miskramen bestaat.
Een licht verhoogd risico op vroeggeboorte bij gebruik van een benzodiazepine door de moeder werd in enkele onderzoeken beschreven. Ook hierbij is, door de kwaliteit van de onderzoeken, niet goed uit te sluiten dat andere factoren van invloed zijn geweest op de gevonden associatie. Bovendien is er ook onderzoek waarin een dergelijke associatie niet overtuigend werd aangetoond. In de meeste onderzoeken is niet bekend wat de reden is van het voorschrijven van de benzodiazepinen. Mogelijk heeft de indicatie voor het voorschrijven van de benzodiazepine bijgedragen aan de gevonden associatie met vroeggeboorte.
Over een associatie met andere maternale zwangerschapscomplicaties of de foetale groei is feitelijk geen betrouwbare informatie beschikbaar. Er is wel onderzoek naar een laag geboortegewicht (SGA) in relatie tot benzodiazepinegebruik; dit wordt besproken in module 'Vroege effecten bij het kind'.
De bevindingen in de literatuur over een mogelijk iets hogere incidentie van sectio caesarea bij zolpidemgebruiksters is ook als discutabel te beschouwen, omdat het onduidelijk is om welke redenen hiertoe werd besloten en het Aziatisch onderzoek betreft. In dit opzicht kan er een evident verschil zijn met de Nederlandse situatie. Ook bij de duur en het tijdstip van expositie van benzodiazepinen en het mogelijk verhoogde risico op een sectio caesarea en vroegeboorte in dit onderzoek kan de kanttekening geplaatst worden dat er een effect was bij gebruik in elk trimester en bij elke duur van expositie. Mogelijk spelen dus ook andere confounders hierbij een rol.
Omdat er helaas geen adequaat en kwalitatief goed onderzoek beschikbaar is naar een eventuele associatie tussen benzodiazepinen en zwangerschaps- of baringscomplicaties, zijn er wat dit aspect betreft geen specifieke maatregelen mogelijk.
Onderbouwing
Achtergrond
Deze module behandelt het verband tussen gebruik van benzodiazepinen in de zwangerschap en zwangerschaps- en baringscomplicaties. Complicaties die na de geboorte duidelijk worden, zoals: laag geboortegewicht (SGA), een lage APGAR score, een lage pH waarde en NICU opname zijn als uitkomstmaat van de zwangerschap op te vatten maar ook als neonataal effect en worden daarom in de module ‘vroege neonatale effecten’ beschreven.
Conclusies / Summary of Findings
Niet nader gespecificeerd benzodiazepinegebruik
|
Kwaliteit van bewijs: ZEERLAAG |
Miskraam Er zijn minimale aanwijzingingen gevonden dat de incidentie van miskramen hoger is bij benzodiazepinegebruik. Ornoy, 1998 |
|
Kwaliteit van bewijs: ZEERLAAG |
Vroeggeboorte Er zijn aanwijzingingen gevonden dat het risico op een vroeggeboorte hoger is bij benzodiazepinegebruik. Calderon, 2009; Kallen, 2012 |
|
Geen bewijs |
Zwangerschapscomplicaties Er is geen adequaat onderzoek beschikbaar naar het verband tussen het gebruik van benzodiazepinen en het optreden van zwangerschapshypertensie, preëclampsie, zwangerschapsdiabetes, IUVD en IUGR.
Baringscomplicaties Er zijn geen adequate onderzoeken beschikbaar naar het verband tussen het gebruik van benzodiazepinen en het ondergaan van een inleiding van de baring of een kunstverlossing. |
Afzonderlijke benzodiazepinen
|
Kwaliteit van bewijs: ZEERLAAG |
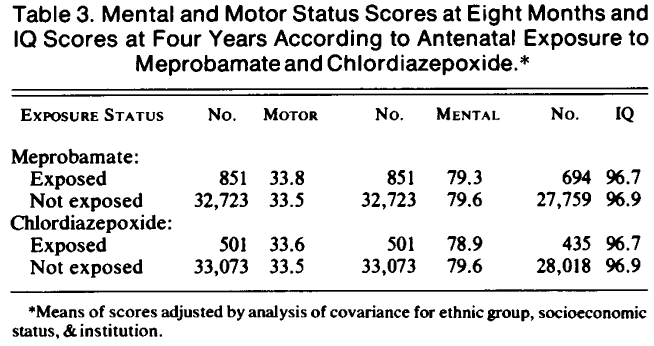
Chloordiazepoxide: Er zijn geen aanwijzingingen gevonden dat het risico op perinatale sterfte (inclusief IUVD) hoger is bij chloordiazepoxidegebruik. Hartz, 1975 |
|
Kwaliteit van bewijs: ZEERLAAG |
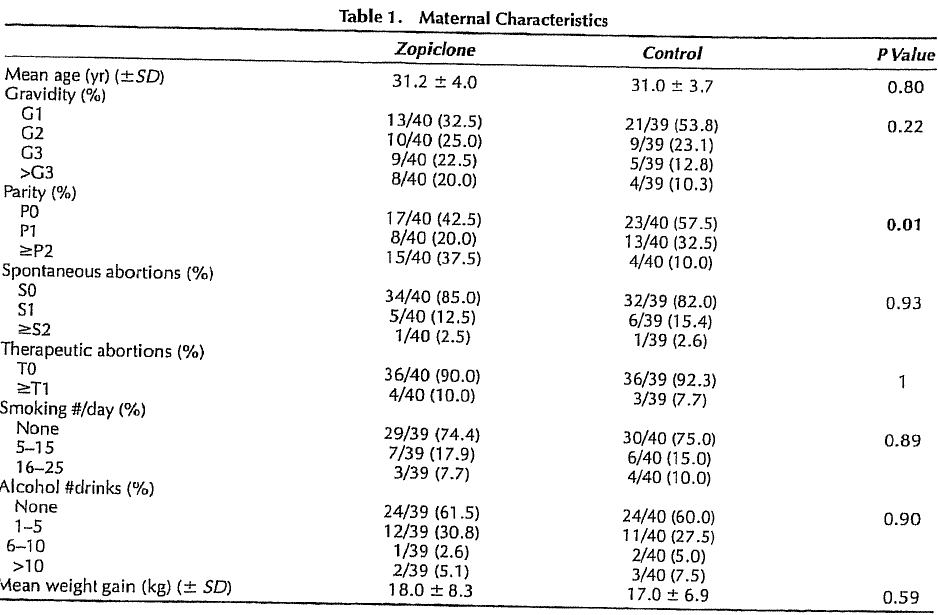
Zoplicon: Er is geen verband gevonden tussen zolpicongebruik (in het eerste trimester) en het optreden van een miskraam of vroeggeboorte en het ondergaan van een kunstverlossing. Diav-Citrin, 1999 |
|
Kwaliteit van bewijs: LAAG |
Zolpidem: Er zijn aanwijzingen gevonden dat zolpidemgebruik een gering verhoogd risico geeft op een vroeggeboorte of het ondergaan van een sectio caesarea.
De duur en het trimester van expositie lijken hier geen invloed op te hebben. Wang, 2010 |
|
Geen bewijs |
Er is geen onderzoek beschikbaar naar het verband tussen gebruik van de overige benzodiazepinen en het optreden van zwangerschaps- en baringscomplicaties. |
Samenvatting literatuur
Uitgangsvraag 1 en 2: Is er een verband tussen benzodiazepinegebruik in de zwangerschap en het optreden van zwangerschapscomplicaties (miskraam, zwangerschapshypertensie en preeclampsie, zwangerschapsdiabetes, IUVD, groeivertraging, vroeggeboorte) en complicaties bij de baring (inleidingen, kunstverlossingen)?
Is er een verschil in het optreden van deze complicaties bij het gebruik van verschillende benzodiazepinen in de zwangerschap?
Na beschouwing van artikelen over benzodiazepinegebruik in het algemeen, worden de mogelijke effecten van specifieke benzodiazepinen beschreven.
Zwangerschapscomplicaties
Miskraam
Benzodiazepinegebruik in het algemeen
Slechts één onderzoek (Ornoy, 1998) heeft het verband tussen benzodiazepinegebruik en het optreden van miskramen onderzocht. In dit prospectieve onderzoek werd een hogere incidentie miskramen gevonden bij benzodiazepinegebruikers ten opzichte van niet-gebruikers (8.7% versus 5.2%, P=0.05; OR 2.0 BI 1.1-3.4). Soms werd meer dan één benzodiazepine-preparaat gebruikt, zodat sprake kan zijn van versterking van het effect. Omdat door mensen zelf werd gebeld met de betreffende teratologie informatie service, kan het zijn dat in beide groepen de actuele abortusincidentie nog hoger ligt dan de aangetoonde percentages. Een ernstige beperking van dit onderzoek is het grote verlies aan follow-up, 139/566 in de benzodiazepinegroep en 966/1390 in de controlegroep. Verder was er weinig informatie en geen correctie voor belangrijke confounders. De kwaliteit van dit onderzoek is dan ook zeer laag.
Afzonderlijke middelen
Eén onderzoek (Diav-Citrin, 1999) heeft het effect van zoplicongebruik op het optreden van een miskraam onderzocht. Zwangeren met zopiclongebruik werden in dit onderzoek vergeleken met zwangeren met non-teratogene blootstelling. Bij 7/40 (17.5%) van de zopiclongroep en 3/40 (7.5%) van de controlegroep trad een miskraam op. Wanneer voor dit resultaat een OR wordt berekend, is het resultaat niet significant verschillend tussen beide groepen (OR 0.43 95% BI 0.12-1.5, p=0.18).
Zwangerschapshypertensie, preeclampsie en zwangerschapsdiabetes
Er is geen adequaat onderzoek beschikbaar voor het beantwoorden van de vraag of er een verband is tussen het gebruik van benzodiazepinen in de zwangerschap en het optreden van zwangerschapshypertensie, preëclampsie en zwangerschapsdiabetes.
Er werd ook geen bewijs gevonden voor een effect van afzonderlijke benzodiazepinen op het optreden van deze zwangerschapscomplicaties.
Intra-uteriene vruchtdood (IUVD)
Er is geen adequaat onderzoek beschikbaar voor het beantwoorden van de vraag of er een verband is tussen het gebruik van benzodiazepinen in de zwangerschap en het optreden van een intra-uteriene vruchtdood.
Afzonderlijke middelen
Hartz vond geen verhoogd risico op perinatale sterfte (inclusief IUVD) wanneer chloordiazepoxide werd gebruikt (4.8%) tijdens de zwangerschap in vergelijking met zowel een controlegroep (4.4%) zonder medicatiegebruik als met een controlegroep van meprobamaat gebruikers (3.7%).
Groeivertraging (IUGR)
Er konden geen onderzoeken geselecteerd worden die een verband tussen benzodiazepinegebruik en het optreden van groeivertraging hebben onderzocht. Voor de uitkomstmaat ‘small for gestational age’ (SGA) wordt verwezen naar de module 'Vroege effecten bij het kind'.
Vroeggeboorte
Benzodiazepinegebruik in het algemeen
Er zijn twee onderzoeken (Calderon, 2009; Kallen, 2012) die het verband tussen benzodiazepinegebruik tijdens de zwangerschap en het optreden van een vroeggeboorte hebben onderzocht.
In het prospectieve onderzoek van Calderon werd vroeggeboorte gedefinieerd als een geboorte na de 20ste en voor de 37ste zwangerschapsweek. In totaal waren er 85 vrouwen die een benzodiazepine gebruikten. Van deze 85 vrouwen gebruikten 43 vrouwen alleen benzodiazepinen, de overige 42 vrouwen gebruikten naast de benzodiazepine één of meerdere andere psychofarmaca. In de groep van 43 zuivere benzodiazepinegebruikers traden 20 vroeggeboortes op (OR 5.56; 95% BI 2.7-11). Deze groep werd vergeleken met 2493 vrouwen die geen medicatie gebruikte. Van de niet medicijngebruikers had 9.4% een vroeggeboorte. Bij gebruik van één of meerdere andere psychofarmaca naast de benzodiazepine werd een OR van 8.48 gevonden (BI 4.0-17.8).
In het retrospectieve onderzoek van Kallen trad bij 23 van de 200 benzodiazepinegebruikers een vroeggeboorte op; de odds ratio was 1.87 (95% BI 1.20-2.89).
Bij benzodiazepine agonisten (zolpidem en zopiclon) gebruikers was de OR 1.31 (15 van de 210, 95% BI 0.77-2.23).
Er werd in deze onderzoeken gecorrigeerd voor belangrijke confounders, er waren echter geen gegevens bekend over de redenen waarvoor benzodiazepinen of benzodiazepine agonisten werden voorgeschreven.
Afzonderlijke middelen
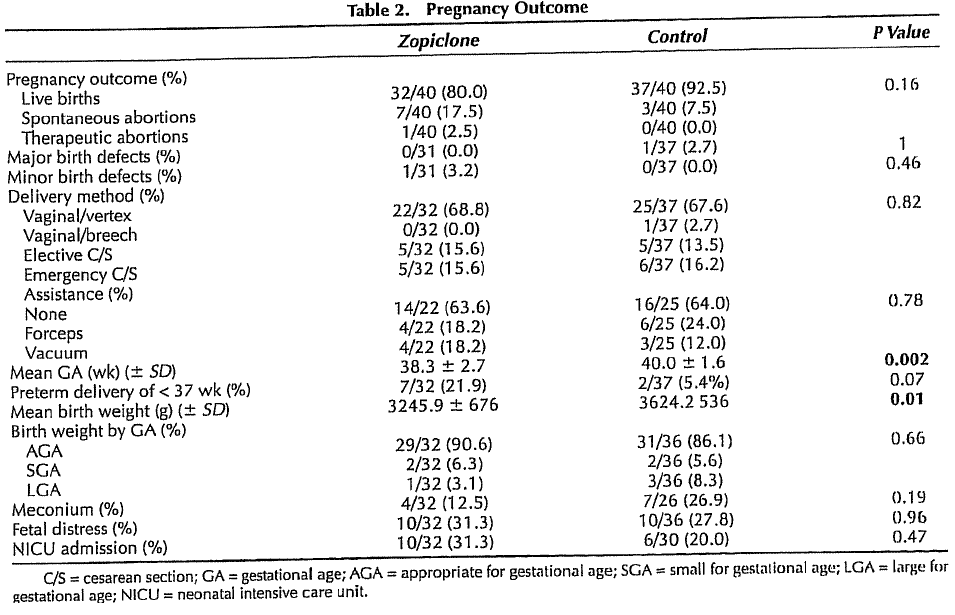
Twee onderzoeken hebben naar specifieke benzodiazepinen en het optreden van een vroeggeboorte gekeken (Diav-Citrin, 1999; Wang, 2010). In het onderzoek van Diav-Citrin werd geen significant verschil gevonden in incidentie van vroeggeboorte tussen 40 zoplicon gebruikers en de 49 vrouwen in een controlegroep met non-teratogene blootstelling, respectievelijk (7/32) 21.9% versus (2/37) 5.4% (p=0.07).
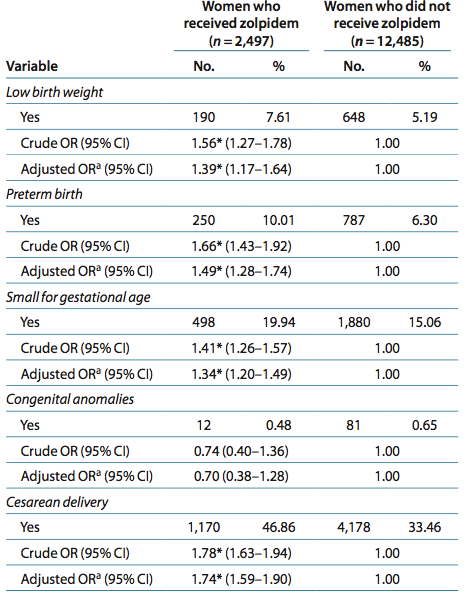
In een retrospectief Aziatisch onderzoek (Wang, 2010) werden 2497 zolpidemgebruikers vergeleken met 12.485 niet-zolpidemgebruikers. Vroeggeboorte werd vaker gezien in de zolpidemgroep met een OR van 1.49 (95% BI 1.28-1.74). Hierbij is gecorrigeerd voor zwangerschapshypertensie, maar niet voor andere belangrijke confounders zoals roken en alcoholgebruik.
Baringscomplicaties
Inleiding van de baring
Er is geen onderzoek beschikbaar voor het beantwoorden van de vraag of er een verband is tussen het gebruik van benzodiazepinen tijdens de zwangerschap en inleiding van de baring.
Er werd ook geen onderzoek gevonden over een dergelijk verband bij afzonderlijke benzodiazepinen.
Kunstverlossingen (vacuümextractie, forcipale extractie, sectio caesarea)
Benzodiazepinegebruik in het algemeen
Er is geen adequaat onderzoek beschikbaar voor het beantwoorden van de vraag of er een verband is tussen het gebruik van benzodiazepinen tijdens de zwangerschap en een kunstverlossing.
Afzonderlijke middelen
Twee onderzoeken hebben naar een specifieke benzodiazepine en de kans op een kunstverlossing gekeken (Diav-Citrin, 1999; Wang, 2010).
In het onderzoek van Diav-Citrin werden 40 zwangeren die in het 1ste trimester zoplicon gebruikten vergeleken met 40 zwangeren die geen medicatie gebruikten (controlegroep).
32 zoplicongebruikers en 37 controlepatiënten bevielen van een levend kind. Bij de overige vrouwen was een miskraam opgetreden of werd een abortus gepleegd. Er was geen significant verschil in partus modus tussen de beide groepen.
In een retrospectieve Aziatische studie van Wang werden 2497 zolpidemgebruikers vergeleken met 12.485 niet-zolpidemgebruikers en werd gekeken wat het risico op een sectio caesarea was. In dit onderzoek zijn alle indicaties voor een sectio caesarea samengevoegd (electief, niet vorderende baring en spoedindicatie). Een sectio caesarea werd significant vaker verricht bij zwangeren die zolpidem gebruikten in vergelijking met de controlegroep (OR 1.74; 95% BI 1.59-1.90). In dit onderzoek werd het risico op een forcipale- of vacuümextractie niet onderzocht.
Uitgangsvraag 3: Dragen dosering, duur en tijdstip van de expositie aan benzodiazepinen tijdens de zwangerschap bij aan het optreden van zwangerschaps- en baringscomplicaties?
Er was één onderzoek (Wang, 2010) beschikbaar dat antwoord gaf op deze uitgangsvraag bij zolpidemgebruik. In het retrospectieve onderzoek van Wang werd onderscheid gemaakt in duur en tijdstip van zolpidem-expositie en daarmee samenhangend het optreden van een vroeggeboorte of het risico op een sectio caesarea. Er is nauwelijks verschil in de kans op een vroeggeboorte en sectio caesarea vergeleken met de controlegroep, bij gebruik in het eerste, tweede of derde trimester. Wanneer zolpidem langer dan 180 dagen werd gebruikt was er een toename in de kans op een vroeggeboorte en een sectio caesarea. De OR’s staan weergegeven in tabel 4.1.
Tabel 4.1: Zolpidem en zwangerschaps- en baringscomplicaties in vergelijking met controlegroep
|
|
Gebruik in 1e trimester OR(95% BI) |
Gebruik in 2e-3e trimester OR (95% BI) |
Duur gebruik 30-90 dagen OR(95% BI) |
Duur gebruik 90-180 dagen OR(95% BI) |
Duur gebruik >180 dagen OR(95% BI) |
|
Vroeggeboorte |
1.49 (1.26-1.77) |
1.48 (1.10-1.98) |
1.46 (1.20-1.76) |
1.35 (1.00-1.84) |
1.74 (1.31-2.32) |
|
Sectio cesarea |
1.73 (1.45-2.06) |
1.75 (1.58-1.93) |
1.72 (1.52-1.92) |
1.66 (1.34-1.98) |
1.90 (1.31-2.62) |
Uitgangsvraag 4: Welke benzodiazepinen hebben de voorkeur voor gebruik in de zwangerschap m.b.t. het risico op zwangerschaps- en baringscomplicaties?
Er werden geen adequate onderzoeken gevonden voor het beantwoorden van deze uitgangsvraag.
Zoeken en selecteren
In totaal werden er zes artikelen geselecteerd (Calderon, 2009; Diav-Citrin, 1999; Hartz, 1975; Kallen, 2012; Ornoy, 1998; Wang, 2010) voor het beantwoorden van de uitgangsvragen (zie de zoekverantwoording en de evidence tabel). Er werden geen gerandomiseerde gecontroleerde onderzoeken gevonden voor het beantwoorden van deze uitgangsvragen. Alle gevonden onderzoeken hadden een zeer lage kwaliteit van bewijs.
Het artikel van Kallen 2012 is toch geincludeerd, ondanks het feit dat deze na de sluitingsdatum van de zoekopdrachten (november 2011) is gepubliceerd, omdat het een relevant artikel bleek te zijn voor het beantwoorden van de uitgangsvragen.
GRADE tabel
|
Beoordeling van kwaliteit |
Kwaliteit |
||||||
|
Aantal studies |
Studie ontwerp |
Studie beperkingen |
Inconsistentie |
Indirectheid |
Imprecisie |
Andere opmerkingen |
|
|
Zwangerschaps- en baringscomplicaties (benzodiazepinen in het algemeen) |
|||||||
|
3 |
Observationele studies 1 |
Ernstige beperkingen 1 |
Geen ernstige inconsistentie |
Geen ernstige indirectheid |
Geen ernstige imprecisie |
Geen |
ZEER LAAG |
|
Zwangerschaps- en baringscomplicaties (afzonderlijke benzodiazepinen) |
|||||||
|
3 |
Observationele studies 2 |
Ernstige beperkingen 2,3 |
Geen ernstige inconsistentie |
Geen ernstige indirectheid |
Ernstige imprecisie 2,4 |
Geen |
ZEER LAAG |
|
Verband dosering, duur en tijdstip expositie benzodiazepinen |
|||||||
|
1 |
Observationele studie |
Ernstige beperkingen 4 |
Geen ernstige inconsistentie |
Geen ernstige indirectheid |
Ernstige imprecisie 4 |
Geen |
ZEER LAAG |
1 Calderon, 2009; Kallen, 2012; Ornoy, 1998. In het artikel van Calderon was een grote groep patiënten lost to follow up, de studiepopulaties waren klein en er is geen heterogeniteit in de uitkomstmaten tussen de studies. Er werd hierdoor gedowngrade naar zeer lage kwaliteit van bewijs.
2 Wang 2010 en Diav-Citrin 1999, alleen informatie over zoplicon en zolpidem. Voor elk maar één artikel beschikbaar, daardoor ernstige imprecisie. Hartz, 1975, enige artikel dat naar perinatale sterfte (incl. IUVD) heeft gekeken.
3 Diav-Citrin; Het is onzeker of zwangeren de voorgeschreven medicatie daadwerkelijk hebben genomen. Er is geen zekerheid over de dosering en duur van gebruik en het risico op complicaties. De studie kan ongemeten waarden, als ander medicatiegebruik niet uitsluiten.
4 Wang 2010, slechts 1 studie; geen correctie voor roken, alcohol of gebruik van andere medicatie. De dosis van de medicatie is onbekend en zo ook de duur van het gebruik. Echter wel informatie over duur en tijdstip van expositie. Echter dit weegt niet op tegen de andere beperkingen van dit onderzoek. De kwaliteit van bewijs is hierdoor zeer laag.
Referenties
- Calderon-Margalit R, Qiu C, Ornoy A, Siscovick DS, Williams MA. Risk of preterm delivery and other adverse perinatal outcomes in relation to maternal use of psychotropic medications during pregnancy. Am J Obstet Gynecol 2009;201:579-8.
- Diav-Citrin O, Okotore B, Lucarelli K, Koren G. Pregnancy outcome following first-trimester exposure to zopiclone: a prospective controlled cohort study. Am J Perinatol 1999;16:157-60.
- Hartz SC, Heinonen OP, Shapiro S, Siskind V, Slone D. Antenatal exposure to meprobamate and chlordiazepoxide in relation to malformations, mental development, and childhood mortality. N Eng J Med 1975;292:726-8.
- Källén B, Reis M. Neonatal complications after maternal concomitant use of SSRI and other central nervous system active drugs during the second or third trimester of pregnancy. J Clin Psychopharmacol 2012;32:608-614.
- Ornoy A, Arnon J, Shechtman S, Moerman L, Lukashova I. Is benzodiazepine use during pregnancy really teratogenic? Reprod Toxicol 1998;12:511-5.
- Wang LH, Lin HC, Lin CC, Chen YH, Lin HC. Increased risk of adverse pregnancy outcomes in women receiving zolpidem during pregnancy. Clin Pharmacol Ther 2010;88:369-74.
Evidence tabellen
|
Reference |
Study type |
Characteristics |
Exposure (E) |
Outcome measures and follow-up time |
Results |
Quality assessment study |
|
Calderon, 2009
|
Prospective cohort
N total = 87/2793 |
Inclusion criteria: -Participants Omega study -<20 wkn pregnant ->18 yrs -Plan to deliver at term - Delivery at 2 known hospitals
Exclusion criteria: -Iatrogenic or spontaneous abortion |
Aim of the study: To determine the association of maternal psychotropic medication use during pregnancy with preterm delivery and other adverse perinatal outcomes.
Intervention: Participants were interviewed during a prenatal visit at _20 weeks of gestation by trained research personnel who used a structured questionnaire. Medical records were reviewed for pregestational and antepartum diagnoses and for the use of prescription medications. |
Primary outcomes: - Preterm delivery (gestational age of >20 weeks of gestation and before the completion of 37 weeks of gestation)
Secundary outcomes: - Low birthweight (LBW; a birthweight at <2500g)
- Small for gestational age (SGA; birthweight 2 SDs below the mean for the newborn infant’s gestational age at birth)
- Low Apgar score (5- minute Apgar score <7), - admissions to the neonatal intensive care unit (NICU)
- Diagnosis of respiratory distress syndrome (RDS) |
Primary outcomes: Preterm delivery: Maternal use of benzodiazepine during pregnancy in general was associated with AOR 6.79; 95% CI, 4.01–11.5; P< .001).
Single or multiple use: Those who used 1 medication (n=43) had an AOR 5.56; 95% CI 2.71–11.4);
Those who used (n=42) multiple benzodiazepine formulations or used benzodiazepine in combination with another psychotropic medication had an OR 8.48; 95% CI 4.03–17.8; P<.001.
Type Benzo: Lorazepam (used by 73/85 benzo users) was associated with an OR 7.94; 95% CI 4.47–14.1; P<.001.
Trimester of use: Information regarding the onset of benzodiazepine use 93% of patients (n=80). Initiations of treatment before or during the first trimester (n=11), in the second trimester (n=19), or in the third trimester (n=50) of pregnancy were associated with AORs 5.15; 95% CI 1.34 –19.8; P =.017), 7.39; 95% CI 2.35–23.2; P<.001), and 10.1; 95% CI 4.84 –21.1; P<.001).
Medically induced or nonmedically induced labor: Medically induced preterm delivery AOR 5.40; 95% CI 2.18 –13.3 and nonmedically induced preterm delivery AOR 7.32; 95% CI 4.11–13.0 -> P< .001 (either preterm premature rupture of the membranes or spontaneous preterm labor with intact membranes; data not shown).
Secundary outcomes: Benzodiazepine was associated with an increased risk of LBW AOR, 7.43; 95% CI 4.15–13.3; P<.001), but not with SGA AOR 0.83; 95% CI 0.24–2.88. Benzodiazepine was associated with low 5-minute Apgar scores OR, 3.87; 95% CI 1.53–9.76; P =.004), with admission to NICU OR 4.33; 95% CI 2.45–7.63; P< .001, and with a diagnosis of RDS OR, 3.74;95%CI 1.86–7.54; P< .001). |
Clearly defined groups: Yes
Selection bias: The high follow-up rate of enrolled participants (>95%) also served to attenuate concerns about possible selection bias.
Method of assessing the outcome appropriately: Yes.
Selective loss to follow up: follow up data of 95%
Identification confounders and correction in analysis: Yes. - Logistic regression models were constructed to assess the odds ratios according to medication use, adjustments for maternal age, race, years of education, marital status, smoking during pregnancy, preeclampsia, parity, and singleton/multiple pregnancy.
Limitations: - No information concerning the indications for medication use. It cannot rule out that the association between benzodiazepine and preterm birth was confounded by common indicators, such as maternal anxiety. - It cannot ruled out the possibility that some women with symptoms of preterm labor may have been prescribed psychotropic medications to manage anxiety around the pregnancy. - It cannot be certain that women who received prescriptions during pregnancy actually took the medications as prescribed, nor can we estimate risk of preterm delivery and other adverse outcomes in relation to dosages and the exact duration of the use of the medications during pregnancy - Relatively small sample size. - It cannot exclude the possibility of some residual from unmeasured factors, such as maternal illicit drug use.
Funding: Not described. |
|
Diav-Citrin, 1999
|
Prospective cohort
N total = 80, with 40 zopiclon users |
Inclusion criteria: -1993-1997 -Motherisk program -Zopiclon use
Exclusion criteria: - |
Aim of the study: To investigate the potential teratogenic effect of zopiclon.
Intervention: 1st trimester exposure to zopiclon (n=40)
Controls: A matched control group counselled for non-teratogenic exposure (n=40)
-After expected dat a questionnaire was taken by phone. -Medical file from pediatrics |
Primary outcomes: Rate of birth defects in first trimester exposure
Secundary outcomes: -Delivery method -Preterm delivery -Birth weight by GA -Fetal distress -NICU admission
Follow up:- |
Outcomes:
|
-Clearly defined groups: Yes
-Selection bias: No
-Method of assessing the outcome appropriately:
-Identification confounders and correction in analysis: Yes Groups were matched for age, cigarette smoking and alcohol consumption. And obstetric history.
Limitations: - It cannot be certain that women who received prescriptions during pregnancy actually took the medications as prescribed, nor can we estimate risk of preterm delivery and other adverse outcomes in relation to dosages and the exact duration of the use of the medications during pregnancy - Relatively small sample size. - It cannot exclude the possibility of some residual from unmeasured factors, such as maternal illicit drug use.
-Funding:- |
|
Hartz, 1975 |
Retrospective cohort (follow up study)
N= 740 (chlordiazepine) |
Inclusion criteria: -12 US hospitals -GA>5months -1958-1966 -Race white, black or puerto rican
Exclusion criteria: -no consent -Abortion <5 months -Multiple pregnancies -Missing data -Rubella |
Aim of the study: To dentify the risk of antenatal chlordiazepoxide on malformations, metal development and childhood mortality |
Primary outcomes: -Malformations Secundary outcomes: -metal development -mortality Follow up: - |
Primary outcomes: Malformations; -Early exposure 11/257 OR 0.8 (1.6-0.4) -Late exposure 30/483 OR 1.2 (1.7-0.8) Secundary outcomes: -metal development
-mortality 4.8% (4.4% control), similar for early and late exposures |
-Clearly defined groups: Yes -Selection bias: Possible recall bias -Method of assessing the outcome appropriately: Yes -Selective loss to follow up: No, this was a follow up study -Identification confounders and correction in analysis: Yes, correction for race and socioeconomic status. Not for drugs, other medication, smoking, heridity etc. -Funding: Unknown |
|
Kallen, 2012 |
Retrospective cohort (national database)
N total = 701 benzodiazepinen (716 infants) and 648 HBRA (667 infants) |
Inclusion criteria: Women who had given birth the years 2006Y2008 and had redeemed prescriptions of an SSRI drug or other drugs identified from PDR in Sweden. During 2nd or 3rt trimester.
Exclusion criteria: Not mantioned |
Aim of the study: To evaluate the risk of neonatal morbidity and preterm delivery after maternal use of SSRI’s with or without other CNS-active drugs. |
Primary outcomes: Preterm birth (<37 weeks) in liveborn singletons
Secundary outcomes: Diagnoses of respiratory problems, Low 5-minute Apgar score if such score was recorded. If no 5-minute score was recorded but 1-minute score was higher than 8, the 5-minute score was regarded as higher than 7. Diagnoses of intraventricular hemorrhage Diagnoses of hypoglycemia Diagnoses of neonatal convulsions and other cerebral distur- bances floppy baby syndrome
Follow up: - |
Primary outcomes: The risks for preterm birth and for neonatal complications after maternal use of the different drug groups without the use of other CNS-active drugs are shown in Table 4 Benzodiazepines preterm 23/200 OR 1.87 (95%CI 1.20-2.89) HBRA preterm 15/210 OR 1.31 (95%CI 0.77-2.23)
Secundary outcomes: Not specified! Benzodiazepines neonatal complications 24/204 OR 1.63 (95%CI 1.05-2.53) HBRA preterm 20/234 OR 1.29 (95%CI 0.82-2.05) |
-Clearly defined groups: Yes
-Selection bias: No
-Method of assessing the outcome appropriately: Risk estimates were determined as odds ratios (ORs) using Mantel-Haenszel analyses and approximate 95% confidence intervals (95% CIs) were estimated with Miettinen method.
-Selective loss to follow up: No
-Identification confounders and correction in analysis: Adjustments were made for year of birth, maternal age (<20, 20-24, 25-29, 30-34, 35-39, 40-44, and >45, or >40 in some tables), parity (1, 2, 3, and >4), smoking (unknown, none, <10 cigarettes per day, >10 cigarettes per day), number of previous miscarriages (0, 1, 2, and >3), and body mass index (BMI; unknown, <19.8, 19.8-24.9, 25-29.9, >30). Maternal smoking in early pregnancy and prepregnancy weight and height were recorded at midwife interviews, usually in weeks 10 to 12.
Probably underreportation of benzo use in national database No information about iliat drug use and if the prescibed drugs were taken indeed.
-Funding: Not mentioned |
|
Ornoy, 1998
|
Prospective cohort
N total = 1023 (599 benzodiazepine users and 424 controls) |
Inclusion criteria: - 1988 to 1996 - women called the Israeli TIS concerning exposures to BD during pregnancy -pregant
Exclusion criteria: -Not mentioned |
Aim of the study: To examine if BD causes an increase in spontaneous abortions or congenital anomalies
Intervention: 599 women
Controls: 424 control pregnancies (nonteratogenic exposure)
The results are based on the information provided by the women (questionnaire) or their physicians |
Primary outcomes: -congenital anomalies, -major medical problems
Secundary outcomes: -sex, birth age and birth weight of the newborn -spontaneous and induced abortions -maternal age
Follow up: 460 pregnancies (76.6%)= 355 children in exposure group. |
Primary outcomes: The incidence of congenital anomalies (3.1%) was not different from that found in 424 control pregnancies (2.6%).
Secundary outcomes: There was a significantly higher incidence of induced abortions (14.1% vs. 4.7%, P = 0.00) and of spontaneous abortions (8.7% vs. 5.2%, P = 0.01).
|
-Clearly defined groups: Yes
-Selection bias: 1105 loss to follow up, not explained
-Method of assessing the outcome appropriately: No, they tested for significance with the chi-square and Fisher exact test (two-tail) for differences in proportions between the BD exposed group and the control group. No multivariable analyses.
-Selective loss to follow up: (599-460=139 in BDP, in control 1390-424=966)
-Identification confounders and correction in analysis: No identification or analyses. E.g. they mention the weakness in other studies regarding co-medication, but do not correct this in their own study.
-Funding: Not mentioned |
|
Wang, 2010
|
Prospective cohort
N total = 14955 (2497 zolpidem users, 12485 in the control group) |
Inclusion criteria: - Taiwan national health insurance research Dataset
Exclusion criteria: Not mentioned |
Aim of the study: Comparing the risk of adverse pregnancy outcomes in women who received zolpidem treat-ment for insomnia during pregnancy with that in women who did not.
Intervention: Analysed from the dataset.
Controls: Adjusted for infant’s gender, parity, maternal educational level, gestational hypertension, gesta- tional diabetes, pre-eclampsia/eclampsia, and anemia |
Primary outcomes: -delivery of low-birth-weight (lBW) infants, -preterm deliveries, -delivery of small-for-gestational-age (sga) infants, -delivery of infants with congenital anomalies, -cesarean delivery
Secundary outcomes: Exposure to zolpidem during 1st trimester vs 2nd or 3rd trimester of pregnancy. Duration of use.
Follow up: |
Outcomes: lBW infants, preterm, sga and cesarean delivery—were all higher in mothers who received zolpidem treatment during pregnancy, (1.39 (95% Ci = 1.17–1.64), 1.49 (95% Ci = 1.28–1.74), 1.34 (95% Ci = 1.20–1.49), and 1.74 (95% Ci = 1.59–1.90), respectively). There was no significant difference between the two groups in the rates of congenital anomalies (0.48 vs. 0.65%, P = 0.329).
Secundary outcomes: First- trimester exposure did not result in higher odds of adverse pregnancy outcomes. In general, after adjusting for potential confounders, the adjusted ORs for mothers who received zolpidem were further increased in the group of women who received the drug for >90 days.
---
---
|
-Clearly defined groups: Yes
-Selection bias: No, although they all seem to be live births
-Method of assessing the outcome appropriately: Yes
-Selective loss to follow up: No
-Identification confounders and correction in analysis: Yes and no; they adjusted for infant’s gender, parity, maternal educational level, gestational hypertension, gestational diabetes, pre-eclampsia/eclampsia, and anemia. But did not idntify or correct for smoking, other medication of alcohol use. It is unknown what dosis they used and if it was regulary or once.
-Funding: Not mentioned |
|
St Clair, 1992
|
Prospective cohort
N total = 411 |
Inclusion criteria: -1982-1990 -Known alprazolam use in 1st trimester
Exclusion criteria: -Loss to follow up |
Aim of the study: To assess prospectively pregnancy outcome associated with first-trimester exposure to alprazolam in order to monitor for early signals of potential drug-related risks to the fetus.
Intervention: -
Controls: - |
Primary outcomes: Congenital anomalies
Secundary outcomes: Spontaneous and elective abortions
Follow up: 4.5-9 months after registration. 276 live births |
Outcomes:
|
-Clearly defined groups: Yes
-Selection bias: Not expected
-Method of assessing the outcome appropriately: Yes
-Selective loss to follow up: No
-Identification confounders and correction in analysis: No, not identified or corrected. - Other medication use - Did they really take the prescribed medication? -No correction for smoking or alcohol use.
-Funding: Not mentioned |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-03-2014
Beoordeeld op geldigheid : 01-01-2013
Binnen 5 jaar bepaalt het bestuur van de Nederlandse Vereniging voor Obstetrie en Gynaecologie in samenspraak met de NVVP en de NVK of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Obstetrie en Gynaecologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Gezien de opzet van de richtlijn, kan bij bekend worden van relevant onderzoek waarbij (een deel van) de richtlijn zou moeten worden aangepast, dit tussentijds per uitgangsvraag plaatsvinden.
Algemene gegevens
Deze richtlijn is tot stand gekomen in met ondersteuning van de Orde van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doelstelling
Het doel van deze richtlijn is de onduidelijkheid en onzekerheid over het al dan niet continueren of aanpassen van de dosis van (specifieke) benzodiazepinen tijdens zwangerschap en/of lactatie te verminderen door het geven van informatie en aanbevelingen voor het gebruik van benzodiazepinen in deze periode en voor het beleid met betrekking tot de pasgeborene. Tevens wordt door het ontwikkelen van deze richtlijn multidisciplinaire samenwerking gestimuleerd, zodat zwangere vrouwen met psychische problemen en medicijngebruik gezamenlijk geëvalueerd en behandeld worden.
Patiëntencategorie
In principe geldt de richtlijn voor alle vrouwen met kinderwens, zwangere vrouwen en/of vrouwen die borstvoeding (willen) geven bij wie er een indicatie bestaat voor behandeling met benzodiazepinen of bij wie er reeds sprake is van benzodiazepinegebruik ongeacht de indicatie voor het benzodiazepinegebruik.
Richtlijngebruikers
De richtlijn kan worden gebruikt door alle zorgverleners die betrokken zijn bij de zorg voor vrouwen die een benzodiazepine gebruiken tijdens zwangerschap en/of lactatie maar is primair geschreven voor leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen: de Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Nederlandse Vereniging voor Kindergeneeskunde en de Nederlandse Vereniging voor Psychiatrie.
Samenstelling werkgroep
Voor het ontwikkelen van deze richtlijn is in 2012 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van de Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Nederlandse Vereniging voor Kindergeneeskunde en de Nederlandse Vereniging voor Psychiatrie. Deze drie wetenschappelijke verenigingen zijn betrokken bij het zorgproces in de tweede lijn van vrouwen die benzodiazepinen gebruiken in de zwangerschap, het kraambed of tijdens de lactatie.
De werkgroepleden werden door de wetenschappelijke verenigingen gemandateerd voor deelname aan deze werkgroep. De werkgroepleden zijn gezamenlijk verantwoordelijk voor de integrale tekst van deze conceptrichtlijn.
De werkgroep werd ondersteund door een klinisch epidemioloog en twee richtlijnondersteuners.
Partijen die geen zitting hadden in de werkgroep maar wel voor advies geraadpleegd werden vanwege hun betrokkenheid bij het onderwerp zijn het Nederlandse Huisartsen Genootschap (NHG), de Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) en de Angst, Dwang en Fobie (ADF) stichting.
Samenstelling van de werkgroep
- Dhr. dr. J.J. Duvekot, gynaecoloog-perinatoloog, Erasmus MC, Rotterdam (voorzitter)
- Mw. M.E. van Hoorn, gynaecoloog-perinatoloog, VU Medisch Centrum, Amsterdam
- Mw. dr. I.L. van Kamp, gynaecoloog-perinatoloog, Leids Universitair Medisch Centrum, Leiden
- Dhr. dr. M.J.K. de Kleine, kinderarts-neonatoloog, Máxima Medisch Centrum, Veldhoven
- Mw. S.D. Sie, kinderarts-neonatoloog, VU Medisch Centrum, Amsterdam
- Mw. dr. M.M. van Weissenbruch, kinderarts-neonatoloog, VU Medisch Centrum, Amsterdam
- Dhr. dr. K.P. Grootens, psychiater, Canisius Wilhelmina Ziekenhuis, Nijmegen
- Mw. dr. I.M. van Vliet, psychiater, Leids Universitair Medisch Centrum, Leiden
- Dhr. Ir. T.A. van Barneveld, klinisch epidemioloog, Orde van Medisch Specialisten, Utrecht
- Mw. C.A.L. van Rijn, arts, richtlijnondersteuner Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
- Mw. M.E.P.F. Rückert, arts, richtlijnondersteuner Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
Extern advies:
Mw. drs. M. Wessels, informatiespecialist, Orde van Medisch Specialisten, Utrecht
Belangenverklaringen
De werkgroepleden hebben geen strijdige belangen aangegeven. De originele belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG. Zie hieronder voor een voorbeeldformulier belangenverklaring.
De inhoud van de conclusies en aanbevelingen uit deze richtlijn werd onafhankelijk opgesteld van en niet beoordeeld door de financier van deze richtlijn, de Stichting Kwaliteitsgelden Medisch Specialisten.
Belangenverklaring formulier
Verklaring omtrent mogelijke belangenverstrengeling en embargo met betrekking tot de richtlijn ‘gebruik van benzodiazepinen en zwangerschap’ op initiatief van ‘NVOG’
Utrecht, ………………………. 2011
Betreft: Richtlijn ‘Gebruik van Benzodiazepinen en zwangerschap’
Geachte heer, mevrouw,
In verband met uw deelname aan de ontwikkeling van de richtlijn ‘gebruik van Benzodiazepinen en zwangerschap’ vragen wij u bijgevoegde verklaring in te vullen.
Mogelijke belangenverstrengeling:
Mogelijke belangenverstrengeling valt niet steeds te vermijden, maar de Orde van Medisch Specialisten en NVOG vinden het wel van belang dat hierover openheid bestaat. U wordt daarom gevraagd op bijgaand formulier te vermelden of u in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhield met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn ‘Benzodiazepine gebruik in de zwangerschap en tijdens de lactatie’.
Hetgeen u in uw verklaring vermeldt, zal bij het secretariaat van de NVOG opvraagbaar zijn.
Embargo
Gedurende de richtlijnontwikkeling rust een embargo op de teksten van de conceptrichtlijn.
Dit betekent dat het zonder schriftelijke toestemming van de opdrachtgever niet is toegestaan om passages uit de conceptrichtlijn, of de gehele conceptrichtlijn inclusief bijlagen zoals evidence-tabellen te verstrekken aan derden.
Ondergetekende verklaart zich door ondertekening akkoord met het bovenstaande.
.......................................................................................................................................
(naam)
........................................................... ...............................................................
(plaats, datum) (handtekening)
Formulier belangenverklaring
Heeft u naar uw mening in de afgelopen vijf jaar en/of gedurende de looptijd van het project belangen die mogelijk kunnen interfereren met de besluitvorming in de werkgroep ten aanzien van de interpretatie van het wetenschappelijk bewijs en het opstellen van aanbevelingen?
Ja / Neen i
Zo ja, wilt u aangeven uit welke activiteiten deze belangen voortvloeien en welke organisaties/bedrijven het betreft? Voorbeelden van activiteiten kunnen gevonden worden in consultatie/advisering, (na)scholing / cursus en ondersteuning van wetenschappelijk onderzoek.
1. ..................................................................................................................................
2. ..................................................................................................................................
3. ..................................................................................................................................
Bij meer dan deze drie vermeldingen graag een extra blad bijvoegen.
Ondergetekende verklaart bovenstaande informatie naar waarheid te hebben ingevuld en mutaties t.a.v. bovenstaande te vermelden aan de voorzitter en secretaris van de werkgroep:
Betreft: richtlijn ‘gebruik van Benzodiazepinen en zwangerschap’
Naam: ............................................................................................................................
Afgevaardigde namens: ....................................................................................................
........................................................... ...............................................................
(plaats, datum) (handtekening)
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is geprobeerd rekening te houden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn wordt verspreid onder alle relevante beroepsgroepen. Daarnaast is een patiëntenfolder opgesteld. Ook is de richtlijn te downloaden vanaf de websites van de Nederlandse Vereniging voor Obstetrie en Gynaecologie (www.nvog.nl), de Nederlandse Vereniging voor Psychiatrie (www.nvvp.net) en de Nederlandse Vereniging voor Kindergeneeskunde (www.nvk.nl).
In module 'Organisatie van zorg benzodiazepinegebruik' worden de consequenties voor zwangere vrouwen die benzodiazepinen gebruiken tijdens zwangerschap en/of lactatie nader besproken.
Werkwijze
Methode richtlijnontwikkeling
Deze richtlijn is opgesteld aan de hand van het ‘Appraisal of Guidelines for Research & Evaluation’ (AGREE-II) instrument (www.agreetrust.org). Dit is een breed (internationaal) geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen. Bovendien werd gekozen om -volgens de meest recente ontwikkelingen op het gebied van richtlijnen - de methode toe te passen van The Grading of Recommendations Assessment, Development and Evaluation (GRADE) voor het graderen van de kwaliteit van bewijs en de sterkte van de aanbevelingen. Voor deze methode werd gekozen omdat naast de grootte van studies hierbij ook de kwaliteit van het onderzoek in de beoordeling wordt meegenomen. Formeel is de GRADE methode ontworpen voor het beoordelen van onderzoek naar interventies. Daarom werd afgezien van het aangeven van de sterkte van de aanbevelingen en is alleen de kwaliteit van bewijs in de richtlijn vermeld.
Literatuur zoekstrategieën
Er werd eerst oriënterend gezocht naar bestaande richtlijnen (https://www.ahrq.gov, www.nice.org.uk, het cbo en www.sign.ac.uk en naar systematische reviews in de Cochrane Library. Vervolgens werd er voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke onderzoeken in de elektronische databases PubMed, Embase en PsychINFO van 1940 tot november 2011 in de Engelse of Nederlandse taal. De gebruikte zoekverantwoording staat vermeld in onder kopje 'zoekverantwoording'.
Uitkomstmaten
Bij de beoordeling van de literatuur heeft de werkgroep vooral gekeken naar onderzoeken waarbij, naar inzicht van de werkgroepleden, klinisch relevante uitkomstmaten gebruikt werden. Deze werden voorafgaand aan de literatuurselectie door de werkgroep bepaald en gedefinieerd. Ook de meetinstrumenten die volgens de werkgroep relevant en acceptabel (valide) waren voor het meten van de uitkomstmaten werden vooraf vastgesteld.
Tabel 1 is een overzicht van door de werkgroep opgestelde klinisch relevante uitkomstmaten en daarbij opgestelde geaccepteerde meetinstrumenten met klinisch relevante afkappunten.
Tabel 1: Uitkomstmaten
|
Uitkomstmaten |
Operationalisatie |
|
Zwangerschapscomplicaties |
|
|
spontane miskraam |
frequentie voorkomen |
|
hypertensieve complicaties |
frequentie voorkomen |
|
diabetes gravidarum |
frequentie voorkomen |
|
Intrauteriene vruchtdood (IUVD) |
frequentie voorkomen |
|
Intrauteriene groeivertraging (IUGR) |
< P2.3, < P10 |
|
Zwangerschapsduur |
< 37 weken (< 32 weken) en > 42 weken, continue uitkomsten |
|
Complicaties tijdens de baring |
|
|
kunstverlossingen |
frequentie voorkomen |
|
sectio’s |
frequentie voorkomen |
|
inleiding van de baring (vordering?) |
ja/nee |
|
Complicaties bij het kind |
|
|
congenitale afwijkingen |
ja/nee (mild,ernstig) |
|
vroege effecten |
|
|
Geboortegewicht |
SGA (< -2 SD, < P10) of > P90 en continue uitkomsten |
|
Apgar score |
< 7 na 5 minuten |
|
pH navelstrengarterie |
< 7.00 (geen continue uitkomst) |
|
opname op de NICU |
ja/nee |
|
opname op kinderafdeling (niet NICU indicatie) |
ja/nee |
|
Onttrekkingsverschijnselen |
ja/nee -> tonusproblemen, voedingsproblemen, tremoren, prikkelbaarheid en convulsies |
|
Intoxicatie verschijnselen |
ja/nee -> ‘floppy infant’ syndroom, tonusproblemen, ademhalingsdepressie, hypotensie |
|
lange-termijn effecten |
definitie: vanaf 2 jaar tot volwassen (gevalideerde/gestandaardiseerde meetinstrumenten) |
|
motorische effecten |
vb. BSID (Bayley), Aims |
|
emotionele, sociale en gedragseffecten |
vb. CBCL (child behavior checklist), BSID, SST (strange situation procedure) |
|
cognitieve effecten |
vb. IQ als continue maat, BSID |
|
psychiatrische aandoeningen |
ja/nee -> slaapstoornissen, angst en stress |
Literatuurselectie
Per uitgangsvraag werden twee werkgroepleden aangesteld om onafhankelijk van elkaar de literatuur te beoordelen op relevantie. Bij de eerste selectie op titel en abstract werden de volgende exclusiecriteria gehanteerd:
- niet van toepassing op de vraagstelling
- niet vergelijkbaar met de Nederlandse populatie
- niet-gedefinieerde uitkomstmaat
- minder dan tien vrouwen in de onderzoekspopulatie (wegens imprecisie)
- meer dan 5% van de vrouwen gebruikten andere psychofarmaca of andere comedicatie, waarvoor niet was gecorrigeerd (minimaal een subgroepanalyse of multivariate analyse)
- andere indicatie voor benzodiazepinegebruik dan slaap-, stress- en angststoornissen (zoals epilepsie, anesthesiologische sedatie, preëclampsie en hyperemesis gravidarum)
Een exacte definitie voor chronisch of incidenteel gebruik ontbreekt. De Stichting Farmaceutische Kengetallen definieert een periode van meer dan drie maanden als chronisch gebruik. In principe zou bij chronisch gebruik continu een spiegel van het medicament in het bloed aanwezig moeten zijn. Uiteraard is dit laatste dan afhankelijk van de inname frequentie en de halfwaardetijd van het medicament.
Voor het opstellen van antwoorden op de uitgangsvragen van deze richtlijn werden de volgende specifieke definities gebruikt:
1. Mate van gebruik
- Niet-chronisch gebruik: maximaal 2 weken onafgebroken gebruik (in één trimester) of in totaal tijdens de zwangerschap maximaal 2 weken gebruik. Onder deze categorie valt dus zowel het incidenteel als het intermitterend gebruik van de medicatie.
- Chronisch gebruik: meer dan 2 weken onafgebroken gebruik tijdens de zwangerschap.
2. Hoge en lage dosering
- Hoog:
- Oxazepam > 30 mg/dag
- Temazepam > 20 mg/dag
- Zolpidem >10 mg/dag
- Laag:
- Oxazepam ≤ 30 mg/dag
- Temazepam ≤ 20 mg/dag
- Zolpidem ≤ 10 mg/dag
Comedicatie
Een deel van de patiënten die benzodiazepinen gebruiken, gebruiken hiernaast andere medicatie, zoals antidepressiva, antipsychotica, stemmingsstabilisatoren, of somatische medicatie. Deze richtlijn probeert om zoveel mogelijk alleen de effecten van benzodiazepinen te beschrijven. Bij de literatuurselectie is hier rekening mee gehouden en worden alleen onderzoeken met comedicatie gebruikt als er een adequate subanalyse is gemaakt.
Diverse vormen van comedicatie, ondermeer antipsychotica en antidepressiva maar ook vele andere somatische medicamenten, alsook alcohol en drugs, kunnen de werking van benzodiazepinen beïnvloeden. Mogelijk geldt dit ook voor de effecten op het (ongeboren) kind. Deze invloed op de werking van benzodiazepinen kan worden veroorzaakt door remming of juist stimulatie van bepaalde leverenzymen (cytochroom P450-systeem). Ook kan er sprake zijn van directe effecten op neurotransmittersystemen in de hersenen. De effecten van comedicatie dienen daarom bij de diverse afwegingen meegenomen te worden (zie ook bijlage 'Achtergrondinformatie').
Antipsychotica, antidepressiva, opioïden, anti-epileptica, anaesthetica en sedatieve antihistaminica kunnen de werking en de bijwerkingen van benzodiazepinen versterken. Stoffen die bepaalde leverenzymen (met name CYP3A4) remmen (zoals grapefruitsap, cimetidine, erytromycine en azoolantimycotica zoals ketoconazol en itraconazol), kunnen de werking van alprazolam, diazepam, midazolam, zolpidem en zopiclon versterken. Klinisch relevante interacties zijn gemeld met midazolam. Deze interactie zal zich niet voordoen bij temazepam, lormetazepam, lorazepam en oxazepam, die vooral worden geglucuronideerd. (bron: Farmacotherapeutisch Kompas, 2013)
Beoordeling van de kwaliteit van onderzoeken
Na selectie door de werkgroepleden bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De geselecteerde artikelen werden vervolgens door de werkgroepleden beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is de indeling gebruikt, zoals weergegeven in tabel 2.
De beoordeling van de verschillende artikelen vindt u in de verschillende teksten terug onder ‘Samenvatting literatuur’. De richtlijnondersteuners maakten in samenspraak met de subgroepen per vraag evidence tabellen van de geselecteerde individuele onderzoeken als hulpmiddel bij het beoordelen en samenvatten van deze onderzoeken. Vervolgens werd de kwaliteit van het bewijs van het totaal aan gevonden onderzoeken van de betreffende vraag en uitkomstmaat (‘body of evidence’) beoordeeld. Met de kwaliteit van het bewijs wordt bedoeld in hoeverre er vertrouwen is dat de aanbevelingen gebaseerd kunnen worden op de (effectschatting van de) evidence en de GRADE tabellen. Het wetenschappelijk bewijs werd vervolgens kort samengevat in een ‘conclusie’. De belangrijkste literatuur waarop deze conclusie is gebaseerd staat bij de conclusie vermeld inclusief de GRADE gradering van bewijs.
Bij GRADE wordt de evidence per uitkomstmaat beoordeeld. De beoordeling wordt gedaan door het invullen van een evidenceprofiel. Alleen voor kritieke en/of belangrijke uitkomstmaten is een evidenceprofiel gemaakt. Er zijn in totaal vijf factoren die de kwaliteit van het bewijs per uitkomstmaat kunnen verlagen en drie factoren die de kwaliteit kunnen verhogen. Per factor kan de kwaliteit met een of twee niveaus omlaag gaan. Als het om een ernstige beperking gaat, gaat de kwaliteit met een niveau omlaag; als het om een zeer ernstige beperking gaat, gaat de kwaliteit met twee niveaus omlaag.
De verschillende typen onderzoek kunnen worden ingedeeld naar mate van bewijs. Randomized controlled trials (RCT’s) zijn in beginsel van hogere methodologische kwaliteit dan observationele onderzoeken, omdat RCT’s minder kans op vertekening (bias) geven. In het GRADE systeem beginnen daarom RCT’s met hoge kwaliteit (4) en observationele onderzoeken met lage kwaliteit (2). Niet-vergelijkende, niet-systematische onderzoeken (zoals ‘case series’ en ‘case reports’) worden altijd gekwalificeerd als zeer lage kwaliteit. Een overzicht van de GRADE indeling van kwaliteit van de onderzoeken per uitkomstmaat is weergegeven in tabel 2.
Aangezien de GRADE systematiek niet geschikt is voor de beoordeling van case reports en case series werden deze onderzoeken niet geselecteerd. Review artikelen waarin een overzicht van dit soort onderzoeken worden vermeld, werden alleen geselecteerd als geen andere onderzoeken voorhanden waren.
Tabel 2. GRADE-indeling van de kwaliteit van de onderzoeken per uitkomstmaat.
|
Kwaliteit |
Studiedesign |
Kwaliteit verlagen |
Kwaliteit verhogen |
|
Hoog (4) |
RCT |
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 waarschijnlijk -2 zeer waarschijnlijk |
+1 groot +2 zeer groot
+1 bewijs voor relatie
+1 zou het effect onderschatten +2 zou het effect overschatten als er geen effect was aangetoond
|
|
Matig (3) |
|
||
|
Laag (2) |
Observationele vergelijkend onderzoek (bijv. patiënt-controle onderzoek, cohort onderzoek) |
||
|
Zeer laag (1) |
Niet-systematische klinische observaties (bijv. ‘case studies’, ‘case reports’) |
RCT’s beginnen ‘hoog’ (4), observationele onderzoeken ‘laag’ (2).
Bij RCT’s: bijvoorbeeld 1 punt downgraden: dan van hoog (4) naar matig (3), 2 punten downgraden: dan van hoog (4) naar laag (2), 3 punten downgraden: dan van hoog (4) naar zeer laag (1).
Bij observationele onderzoeken: bijvoorbeeld 1 punt upgraden: dan van laag (2) naar matig (3).
Formuleren van aanbevelingen
Nadat de gegevens uit de GRADE tabellen waren samengevat als tekst werden hieruit conclusies getrokken. Om vervolgens tot een gewogen aanbeveling te komen werden de overige overwegingen besproken en geformuleerd. Dit is van belang omdat voor een aanbeveling naast het wetenschappelijke bewijs ook nog andere aspecten meegewogen horen te worden, zoals patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen en organisatorische aspecten. Bij de overwegingen spelen ook de ervaring en opvattingen van de werkgroepleden een rol (‘authority-based’). De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en op de belangrijkste overwegingen. De gebruikte methodiek voor richtlijnontwikkeling verhoogt de transparantie van de totstandkoming van de aanbevelingen in deze richtlijn.
Bij het beoordelen van de literatuur werd de volgende tekortkoming vastgesteld. Ondanks het feit dat benzodiazepinen al lang en veel worden gebruikt en er veel over is geschreven, werd weinig literatuur aangetroffen die voldeed aan de vooraf vastgestelde inclusiecriteria. In wetenschappelijk onderzoek naar dit onderwerp wordt vaak gebruik gemaakt van door patiënten zelf ingevulde vragenlijsten waarbij symptomen uitgevraagd worden zonder deze in de bredere context van duur, beperkingen en bijkomende relevante factoren te plaatsen. Meer in het bijzonder zijn er weinig vragenlijsten die specifiek rekening houden met de zwangerschap als lichamelijke bron van angst- en slaapstoornissen.
Alle conclusies en aanbevelingen werden plenair in de vergaderingen van de werkgroep besproken, waarbij door consensus tot een concepttekst werd gekomen. Indien dit niet mogelijk bleek werd door meerderheid van stemmen de uiteindelijke concepttekst bepaald. Uiteindelijk waren alle werkgroepleden akkoord met de voorliggende conceptteksten.
Zoekverantwoording
|
Onderwerp: Zwangerschaps- en baringscomplicaties |
Database |
Zoekstrategie |
Aantal ref. |
|
1. Is er een verband tussen benzodiazepinegebruik in het algemeen in de zwangerschap en het optreden van zwangerschaps- en baringscomplicaties bij de moeder (spontane miskraam, hypertensieve complicaties, diabetes gravidarum, IUVD, groeivertraging, zwangerschapsduur (vroeggeboorte; electief / spontaan, serotiniteit), kunstverlossingen, inleidingen)?
2. Is er een verschil in verband bij gebruik van verschillende benzodiazepinen in de zwangerschap en deze complicaties?
3. Dragen dosering van de benzodiazepinen, duur van de expositie (incidenteel versus chronisch) en tijdstip van de expositie bij aan het optreden van zwangerschaps- en baringscomplicaties?
4. Welke benzodiazepinen hebben de voorkeur voor gebruik in de zwangerschap m.b.t. het risico op zwangerschaps- en baringscomplicaties?
|
Medline (OVID) 1980- dec. 2011 Engels, Nederlands
Aanvullende search 1940-1979
PsycInfo (OVID)
Embase (Elsevier)
|
1 exp Anti-Anxiety Agents/ (54754) 2 exp Benzodiazepines/ (55789) 3 exp Anxiety Disorders/dt [Drug Therapy] (8292) 4 (alprazolam or Xanax or bromazepam or chlordiazepoxide or Librium or clobazam or Frisium or chlorazepate or Tranxene or diazepam or Stesolid or lorazepam or Temesta or oxazepam or Seresta or prazepam or Reapam or midazolam or Dormicum or brotizolam or lendormin or flunitrazepam or flurazepam or Dalmadorm or loprazolam or Noctamid or lormetazepam or Noctamid or nitrazepam or Mogadon or temazepam or Normison or zolpidem or Stilnoct or zopiclon or Imovane).af. (46775) 5 "anxiolytic drug*".ti,ab. (958) 6 1 or 2 or 3 or 4 or 5 (87322) 7 pregnancy/ or gravidity/ or exp labor, obstetric/ or exp parturition/ or exp pregnancy in adolescence/ or exp pregnancy, high-risk/ or exp pregnancy maintenance/ or exp pregnancy outcome/ or exp pregnancy, unplanned/ or exp pregnancy, unwanted/ (657181) 8 Prenatal Exposure Delayed Effects/ (17196) 9 pregnan*.ti,ab. (330688) 10 7 or 8 or 9 (725265) 11 6 and 10 (2560) 15 Postpartum Hemorrhage/ (4087) 16 "Postpartum Hemorrhage".ti,ab. (1530) 17 exp Labor, Obstetric/co [Complications] (828) 18 exp Obstetric Labor Complications/ (46106) 19 Delivery, Obstetric/ (18848) 20 Obstetrical Forceps/ (1360) 21 ("vacuum extraction" or "forceps extraction*" or (sectio adj2 caesar*) or "artificial deliver*" or (induction adj3 labor) or (induction adj3 labour)).ti,ab. (5432) 22 exp Hypertension, Pregnancy-Induced/ (25237) 23 exp Diabetes, Gestational/ (5518) 24 ("gestational hypertension" or "gestational diabetes" or "gravidarum diabetes" or "preeclampsia" or "pre-eclampsia" or eclampsia).ti,ab. (23485) 25 exp Abortion, Spontaneous/ (27169) 26 (miscarriage or (spontaneous adj3 abortion)).ti,ab. (10320) 27 exp *pregnancy complications/ (242086) 28 ((fetal adj3 death*) or (perinatal adj3 death*)).ti,ab. (8963) 29 pregnancy outcome/ or stillbirth/ (33859) 30 exp Abortion, Spontaneous/ (27169) 31 (miscarriage or (spontaneous adj3 abortion)).ti,ab. (10320) 32 exp *pregnancy complications/ (242086) 33 ((fetal adj3 death*) or (perinatal adj3 death*)).ti,ab. (8963) 34 exp obstetric labor complications/ or obstetric labor, premature/ (46106) 35 Fetal Growth Retardation/ (11602) 36 IUGR.ti,ab. (3269) 37 (pregnancy adj2 duration).ti,ab. (1156) 38 or/15-37 (301904) 39 6 and 38 (885) 45 limit 39 to (yr="1980 -Current" and (dutch or english)) (583) 46 limit 45 to animals (186) 47 limit 46 to humans (17) 48 45 not (46 not 47) (414) > 407 uniek
1 "Anxiolytic drugs".ti,ab. (335) 2 exp Benzodiazepines/ (8773) 3 exp Minor Tranquilizers/ (5817) 4 (alprazolam or Xanax or bromazepam or chlordiazepoxide or Librium or clobazam or Frisium or chlorazepate or Tranxene or diazepam or Stesolid or lorazepam or Temesta or oxazepam or Seresta or prazepam or Reapam or midazolam or Dormicum or brotizolam or lendormin or flunitrazepam or flurazepam or Dalmadorm or loprazolam or Noctamid or lormetazepam or Noctamid or nitrazepam or Mogadon or temazepam or Normison or zolpidem or Stilnoct or zopiclon or Imovane).af. (24454) 5 1 or 2 or 3 or 4 (27339) 6 pregnancy/ or gravidity/ or exp labor, obstetric/ or exp parturition/ or exp pregnancy in adolescence/ or exp pregnancy, high-risk/ or exp pregnancy maintenance/ or exp pregnancy outcome/ or exp pregnancy, unplanned/ or exp pregnancy, unwanted/ (21020) 7 exp Prenatal Exposure/ (4398) 8 pregnan*.ti. (8220) 9 6 or 7 or 8 (26193) 10 5 and 9 (352) 11 "Postpartum Hemorrhage".ti,ab. (20) 12 obstetrical complications/ (1063) 13 ("vacuum extraction" or "forceps extraction*" or (sectio adj2 caesar*) or "artificial deliver*" or (induction adj3 labor) or (induction adj3 labour)).ti,ab. (78) 14 11 or 12 or 13 (1131) 15 exp Hypertension/ (4587) 16 exp diabetes/ (8499) 17 pregnan*.ti. (8220) 18 exp Pregnancy/ (14309) 19 ("gestational hypertension" or "gestational diabetes" or "gravidarum adj/2diabetes" or "preeclampsia" or "pre-eclampsia" or eclampsia).ti,ab. (355) 20 15 or 16 (12776) 21 17 or 18 (15157) 22 20 and 21 (199) 23 19 or 22 (454) 24 exp Abortion, Spontaneous/ (571) 25 (miscarriage or (spontaneous adj3 abortion)).ti,ab. (636) 26 stillbirth.ti,ab. (279) 27 ((fetal adj3 death*) or (perinatal adj3 death*)).ti,ab. (233) 28 24 or 25 or 26 or 27 (1193) 29 exp prenatal development/ (5316) 30 (IUGR or "intra uterine growth retardation").ti,ab. (86) 31 11 or 12 or 13 or 23 or 24 or 25 or 26 or 27 or 29 or 30 (7793) 32 5 and 31 (75) 33 limit 32 to animal (59) 34 limit 33 to human (2) 35 32 not (33 not 34) (18) Limit to Dutch, English > (17) – 15 uniek
alprazolam:ab,ti OR xanax:ab,ti OR bromazepam:ab,ti OR chlordiazepoxide:ab,ti OR librium:ab,ti OR clobazam:ab,ti OR frisium:ab,ti OR chlorazepate:ab,ti OR tranxene:ab,ti OR diazepam:ab,ti OR stesolid:ab,ti OR lorazepam:ab,ti OR temesta:ab,ti OR oxazepam:ab,ti OR seresta:ab,ti OR prazepam:ab,ti OR reapam:ab,ti OR midazolam:ab,ti OR dormicum:ab,ti OR brotizolam:ab,ti OR lendormin:ab,ti OR flunitrazepam:ab,ti OR flurazepam:ab,ti OR dalmadorm:ab,ti OR loprazolam:ab,ti OR lormetazepam:ab,ti OR noctamid:ab,ti OR nitrazepam:ab,ti OR mogadon:ab,ti OR temazepam:ab,ti OR normison:ab,ti OR zolpidem:ab,ti OR stilnoct:ab,ti OR zopiclon:ab,ti OR imovane:ab,ti OR (anxiolytic NEAR/1 drug*):ab,ti OR 'anxiolytic agent'/exp/mj OR 'benzodiazepine derivative'/exp/mj OR 'anxiety disorder'/exp/mj/dm_dt AND ('spontaneous abortion'/exp/mj OR 'miscarriage'/exp/mj OR (spontaneous NEAR/1 abortion*):ab,ti OR 'fetus death'/exp/mj OR fetal NEAR/3 death* OR (fetal NEAR/3 death*):ab,ti OR (perinatal NEAR/3 death*):ab,ti OR ('pregnancy complication'/exp/mj AND 'pregnancy outcome'/exp/mj) OR miscarri*:ab,ti OR 'labor complication'/exp/mj OR 'postpartum hemorrhage'/exp/mj OR 'instrumental delivery'/exp/mj OR ('postpartum hemorrhage':ab,ti AND [1966-2012]/py) OR ((vacuum NEAR/2 extraction):ab,ti OR (forceps NEAR/2 extraction*):ab,ti OR (sectio NEAR/2 caesar*):ab,ti OR (artificial NEAR/2 deliver*):ab,ti OR (induction NEAR/3 labor):ab,ti OR (induction NEAR/3 labour):ab,ti AND [1966-2012]/py) OR ((labor NEAR/2 complication*):ab,ti OR (labour NEAR/2 complication):ab,ti AND [1966-2012]/py) OR ('eclampsia and preeclampsia'/exp/mj OR 'gestational hypertension'/exp/mj OR 'gestational diabetes'/exp/mj AND [1980-2011]/py) OR ('gestational hypertension':ab,ti OR 'gestational diabetes':ab,ti OR 'gravidarum diabetes':ab,ti OR preeclampsia:ab,ti OR eclampsia:ab,ti AND [1980-2011]/py)) AND ([dutch]/lim OR [english]/lim) AND [1980-2012]/py 318 referenties > 238 uniek Aanvullende search 115 extra referenties (Embase) |
660
Plus aanvullende search 115 |