Aangeboren afwijkingen door benzodiazepinen
Uitgangsvraag
-
Is er een verband tussen benzodiazepinegebruik in het algemeen tijdens de zwangerschap en het optreden van aangeboren afwijkingen bij de foetus/pasgeborene? Is er een verband tussen specifieke benzodiazepinen en het optreden van aangeboren of functionele afwijkingen?
-
Is het verband met aangeboren of functionele afwijkingen bij benzodiazepinegebruik dosisafhankelijk, afhankelijk van het tijdstip van het gebruik van de medicatie in de zwangerschap (1ste/2de/3de trimester) of de duur van medicatiegebruik (incidenteel versus chronisch)?
-
Welke benzodiazepine(n) heeft/hebben de voorkeur voor gebruik in de zwangerschap m.b.t. het risico op aangeboren of functionele afwijkingen?
Aanbeveling
Er zijn geen aanwijzingen om tijdens de zwangerschap op basis van het risico op aangeboren afwijkingen het gebruik van een benzodiazepine (in standaarddosering) af te raden of van middel te veranderen.
Het combineren van chronisch benzodiazepinegebruik met andere psychofarmaca in het eerste trimester dient afgewogen en indien mogelijk beperkt te worden.
Structureel echoscopisch onderzoek (SEO) volstaat bij chronisch of incidenteel benzodiazepinegebruik in de zwangerschap, omdat de in literatuur genoemde, mogelijk geassocieerde afwijkingen ook met dit onderzoek gediagnosticeerd kunnen worden.
Overwegingen
Bij kinderwens of zwangerschap bij vrouwen die chronisch of incidenteel een benzodiazepine gebruiken is het belangrijk om afwegingen te maken over de noodzaak van het toepassen van deze medicatie. De keuze wordt in belangrijke mate bepaald door eventuele risico’s voor het kind, zoals de kans op aangeboren afwijkingen. Het is belangrijk in alle overwegingen en in de counseling ook het algemene risico op aangeboren afwijkingen van 3-5% te betrekken.
In de jaren zeventig van de vorige eeuw werd melding gemaakt van een verhoogde incidentie van lip- en/of gehemeltespleten bij gebruik van benzodiazepinen en zelfs ook van een ‘benzodiazepine-syndroom’, met dysmorfe kenmerken en multipele afwijkingen. Kort na de eerste publicaties verschenen er ook onderzoeken waarin dergelijke verbanden niet werden gevonden. Vanwege deze vroege onderzoeken werd voor de ontwikkeling van deze richtlijn besloten om alle onderzoeken vanaf 1940 te gebruiken voor selectie van de referenties. Helaas voldeden erg weinig onderzoeken aan de gestelde inclusiecriteria. Belangrijke methodologische beperkingen waren: het ontbreken van een controlegroep, geen correctie voor belangrijke confounders en het gebruik van te veel comedicatie zonder adequate correctie. Mede hierdoor was het aantal uiteindelijk bruikbare onderzoeken zeer beperkt en de kwaliteit meestal laag tot zeer laag.
In de beschikbare literatuur werden geen aanwijzingen gevonden voor een verhoogd risico op ernstige aangeboren afwijkingen bij gebruik van benzodiazepinen in het algemeen en evenmin bij gebruik van de meeste afzonderlijke benzodiazepinen. Alleen voor diazepam werd, in slechts één studie, een gering en net significant verhoogd risico gevonden op aangeboren afwijkingen, in het bijzonder darmatresie en ledemaatsafwijkingen. Deze bevinding werd in geen van de overige studies teruggevonden.
Mogelijk geven benzodiazepinen in combinatie met een SSRI wel een hoger risico op cardiovasculaire afwijkingen dan bij gebruik van beide preparaten afzonderlijk. Dit impliceert dat benzodiazepinen mogelijk een potentiërend effect kunnen hebben, wanneer ze worden gebruikt in combinatie met andere psychofarmaca. Hoewel verder bewijs ontbreekt, is het op grond van deze bevindingen raadzaam om preconceptioneel of in het eerste zwangerschapstrimester goede afwegingen te maken bij gebruik van benzodiazepinen in combinatie met andere psychofarmaca.
Het achtergrondrisico op lip- en/of gehemeltespleten in de populatie is 1-1.5/1000. De incidentie van lip- en/of gehemeltespleten werd in de meeste onderzoeken naar aangeboren afwijkingen bij gebruik van benzodiazepinen niet apart geanalyseerd. Dit geldt zowel voor onderzoeken naar effecten van afzonderlijke benzodiazepinen als voor die van benzodiazepinen in het algemeen. Omdat lip- en gehemeltespleten meestal eenvoudig worden gediagnosticeerd, is het niet erg aannemelijk dat de incidentie van deze afwijkingen nog hoger is. Beperkt specifiek onderzoek naar lip- en gehemeltespleten bij gebruik van afzonderlijke benzodiazepinen toonde wel een mogelijk verband met zowel oxazepam als diazepam. Bij oxazepam was het risico weliswaar acht maal verhoogd, maar de betrouwbaarheid van deze bevinding is ter discussie vanwege de opzet van de studie en het hiermee samenhangende forse betrouwbaarheidsinterval. Voor diazepam waren twee onderzoeken beschikbaar, waarvan slechts één een zeer gering verhoogd risico aantoonde. Al met al zijn de aanwijzingen voor een verband tussen benzodiazepinen en lip- en/of gehemeltespleten bij het kind nog zwak en discutabel. Als er al een verhoogd risico bestaat, is het absolute risico naar verwachting maximaal 1-2%.
Ernstige aangeboren afwijkingen kunnen goed worden aangetoond met het in Nederland gebruikelijke echografische onderzoek rond een zwangerschapsduur van 20 weken (SEO). Vanwege het zeer geringe bewijs op foetale afwijkingen bij chronisch gebruik van een benzodiazepine in het eerste zwangerschapstrimester, is de werkgroep van mening dat ook in deze gevallen een SEO volstaat.
Onderbouwing
Achtergrond
Bij starten of het gebruik van benzodiazepinen bij angst-, stress- en slaapstoornissen bij zwangere vrouwen, dient een afweging te worden gemaakt tussen het verbeteren van de maternale gezondheid en het mogelijk veroorzaken van schadelijke effecten bij de foetus, zoals het optreden van aangeboren afwijkingen. In dit hoofdstuk wordt inzichtelijk gemaakt welke aangeboren afwijkingen geassocieerd zijn met benzodiazepinegebruik. Omdat benzodiazepinen in het verleden in verband zijn gebracht met het optreden van lip- en gehemeltespleten (cheilo-gnatho-palatoschisis) bij het kind zal deze uitkomstmaat, naast aangeboren afwijkingen in algemene zin, apart worden beschouwd.
Conclusies / Summary of Findings
Uitgangsvraag 1:
Niet nader gespecificeerd benzodiazepinegebruik
|
Kwaliteit van bewijs ZEER LAAG |
Er zijn geen aanwijzingen gevonden voor een verband tussen gebruik van benzodiazepinen tijdens de zwangerschap en het optreden van ernstige aangeboren afwijkingen bij de foetus of pasgeborene. Oberlander 2008, Ornoy 1998, Reis 2013 |
Afzonderlijke benzodiazepinen
|
Kwaliteit van bewijs ZEER LAAG |
Er zijn in het beperkte beschikbare onderzoek geen aanwijzingen gevonden voor een verhoogd risico op ernstige aangeboren afwijkingen bij gebruik van: alprazolam, chloordiazepoxide, clonazepam, zolpidem en zoplicon. Cornel 1996, Diav-Citrin 1999, Lin 2004, Milkovich 1974, Hartz 1975, St Clair 1992, Wang 2010 |
|
Kwaliteit van bewijs ZEER LAAG |
In slechts 1 studie zijn aanwijzingen gevonden voor een verband tussen gebruik van diazepam en het optreden van darmatresie, ledemaats-afwijkingen en lipspleten. Kjaer 2007 |
|
Kwaliteit van bewijs ZEER LAAG |
Een verband tussen gebruik van oxazepam en het optreden van lip- en/of verhemeltespleten werd eenmaal gevonden. Door de opzet van deze studie en het ontbreken van verder bewijs is deze associatie nog discutabel. Cornel 1996 |
|
Geen bewijs |
Er is geen onderzoek beschikbaar over het verband tussen gebruik van de overige benzodiazepinen en het optreden van aangeboren afwijkingen. |
Uitgangsvraag 2:
|
Kwaliteit van bewijs ZEER LAAG |
Er werden geen aanwijzingen gevonden voor een verband tussen tijdstip van expositie van de benzodiazepinen en het optreden van aangeboren of functionele afwijkingen. Hartz 1975 |
|
Geen bewijs |
Er is geen adequaat onderzoek beschikbaar over het verband tussen de duur en dosering van benzodiazepinen en het optreden van aangeboren afwijkingen. |
Samenvatting literatuur
Uitgangsvraag 1: Effecten van benzodiazepinen in het algemeen en van specifieke benzodiazepinen
In drie onderzoeken werd het verband tussen het gebruik van benzodiazepinen tijdens de zwangerschap en het optreden van aangeboren afwijkingen bij het kind onderzocht (Oberlander, 2008; Ornoy, 1998, Reis, 2013). Er was sprake van gebruik van verschillende benzodiazepinen in de afzonderlijke onderzoeken en ook was niet altijd vermeld welke benzodiazepinen het betrof. Er waren negen onderzoeken waarin het effect van specifieke benzodiazepinen op aangeboren afwijkingen werd bestudeerd (Cornel, 1996; Diav-Citrin, 1999; Kjaer, 2007; Rosenberg, 1983; Lin, 2004; Milkovich, 1974; Hartz, 1975; St Clair, 1992; Wang, 2010). Bij gebrek aan RCT’s, werden onderzoeken met een ander ontwerp (prospectieve en retrospectieve cohort onderzoeken met een controlegroep en patiënt-controle onderzoeken) gebruikt. De bevindingen van de studies zijn samengevat in table 5.1. De kwaliteit van de onderzoeken werd als zeer laag beoordeeld (zie GRADE tabel).
Aangeboren afwijkingen algemeen
In het onderzoek van Ornoy werd geen significant verschil gevonden in incidentie van aangeboren afwijkingen tussen zwangerschappen waarin de moeders benzodiazepinen gebruikten (3.1%) en die waarin de moeders geen medicatie gebruikten (2,6%; p=0,51). De meest gebruikte benzodiazepinen (554 door 460 vrouwen) waren alprazolam (149) en lorazepam (112), maar het effect van de middelen werd niet apart geanalyseerd. In sommige zwangerschappen werd meer dan één benzodiazepine gebruikt, zodat een versterkend effect mogelijk is. De kwaliteit van dit onderzoek is zeer laag.
In het onderzoek van Oberlander werden mogelijke teratogene effecten van SSRI’s, al dan niet in combinatie met benzodiazepinen, onderzocht. Van de 968 vrouwen die alleen een benzodiazepine gebruikten, bleek dit in 44% om lorazepam te gaan en in respectievelijk 21% en 15% om clonazepam en oxazepam. Er werd wel gekeken naar de effecten van benzodiazepinen zonder additionele medicatie, maar de afzonderlijke benzodiazepinen werden niet apart geanalyseerd. Er werd geen verband gevonden van benzodiazepinegebruik met ernstige aangeboren afwijkingen, cardiovasculaire afwijkingen en atriumseptum defecten (ASD) en ventrikelseptum defecten (VSD) in het bijzonder. SSRI’s bleken wel geassocieerd te zijn met een verhoogd risico op ASD. Een belangrijke bevinding van dit onderzoek was dat een combinatie van SSRI’s met benzodiazepinen een verhoogd risico gaf op cardiovasculaire afwijkingen. Dit zou kunnen wijzen op een potentierend effect bij gelijktijdig gebruik van een SSRI met een benzodiazepine. Het recent gepubliceerde onderzoek van Reis heeft een vergelijkbare opzet. Ook in dit onderzoek waren benzodiazepinen niet geassocieerd met (relatief) ernstige algemene of cardiovasculaire aangeboren afwijkingen. In tegenstelling tot het onderzoek van Oberlander werd in de studie van Reis ook geen verhoogd risico op afwijkingen gevonden wanneer benzodiazepinen gecombineerd met een SSRI werden gebruikt.
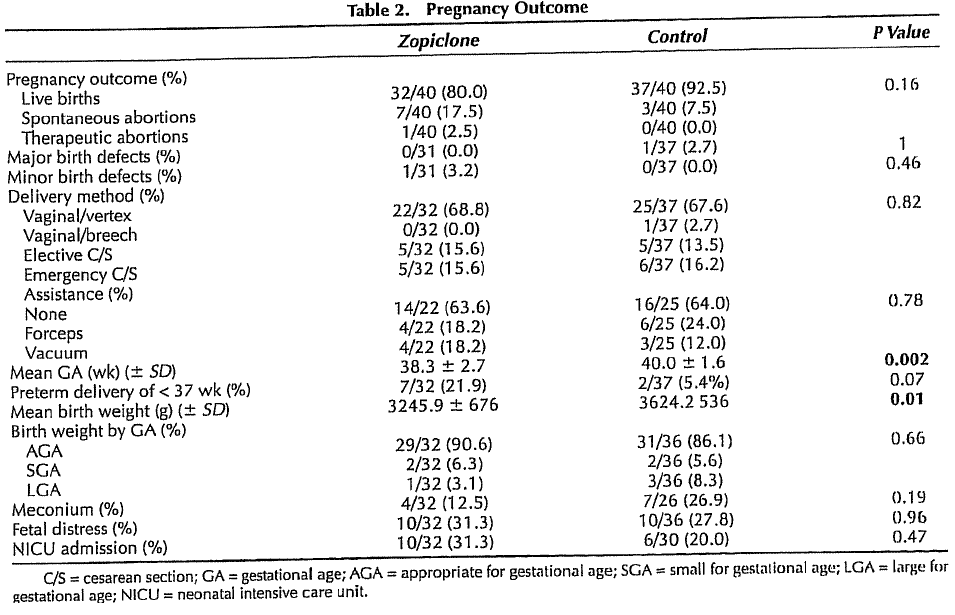
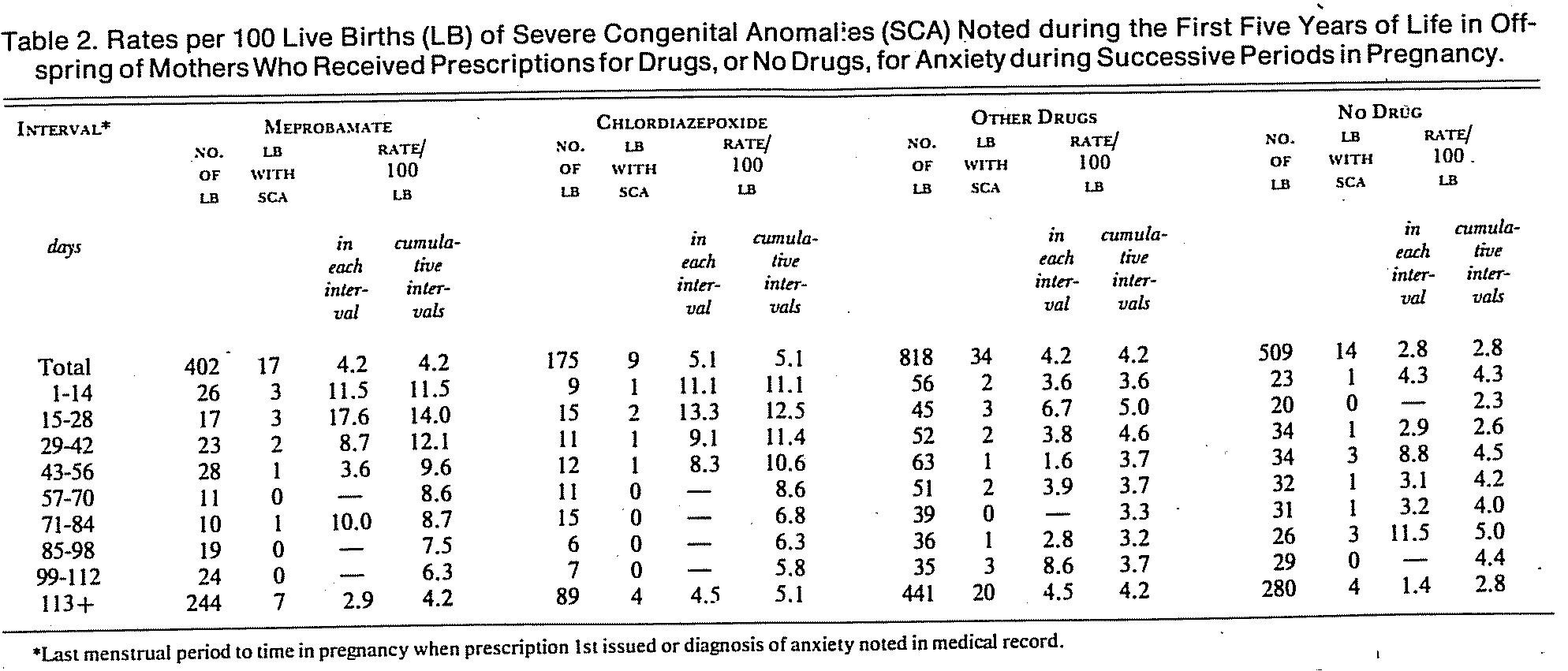
De bevindingen van de geïncludeerde onderzoeken waarin het verband van specifieke benzodiazepinen met aangeboren afwijkingen bij de foetus of pasgeborene werd bestudeerd, zijn allen weergegeven in de navolgende tabel. De kwaliteit van de onderzoeken is laag tot zeer laag (zie GRADE tabel) en voor de meeste middelen was slechts één onderzoek beschikbaar (uitgezonderd diazepam en chlordiazepoxide). In het beperkte onderzoek betreffende de middelen zoplicon, clonazepam, alprazolam en zolpidem werden geen aanwijzingen gevonden voor een verband met aangeboren afwijkingen. Voor chloordiazepoxide waren alleen twee oudere onderzoeken beschikbaar. Hoewel in beide onderzoeken geen significant verhoogd risico op aangeboren afwijkingen werd gevonden, werd in het onderzoek van Milkovich wel een veel hogere incidentie van aangeboren afwijkingen gevonden bij gebruik van chloordiazepoxide (11.4% vgl. 2.6% zonder medicatie; p=0.08).
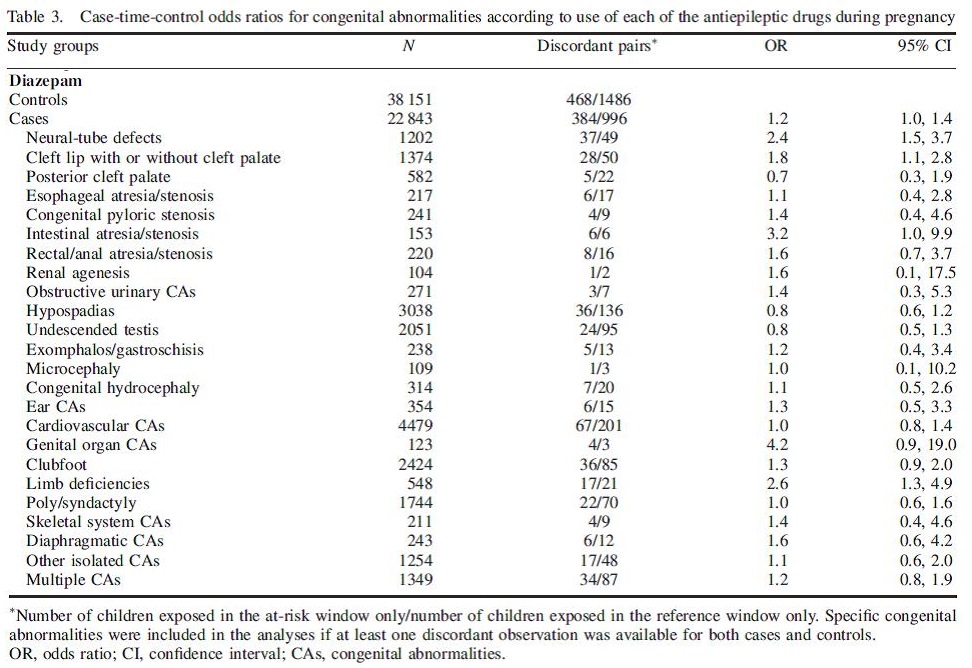
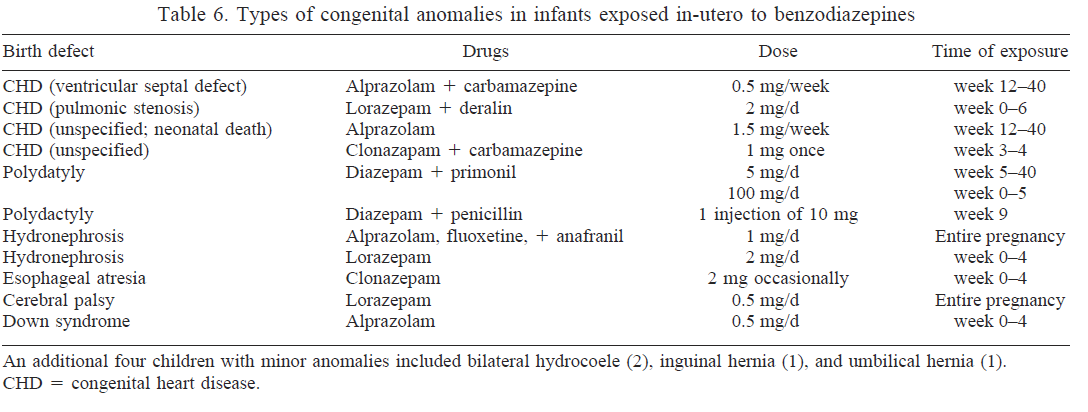
Het onderzoek van Kjaer onderzocht het verband tussen diazepam en aangeboren afwijkingen in een groot cohort van aangeboren afwijkingen (n=22.843), in vergelijking met een grote controlegroep (n=38.151). Er werd een geringe en net significante associatie van diazepam met aangeboren afwijkingen in het algemeen (OR 1.2; BI 1.0-1.4) gevonden. In het bijzonder was sprake van een associatie met darmatresie/-stenose, ledemaatafwijkingen en lip/gehemeltespleten (zie tabel 5.1).
Lip- en gehemeltespleten
In de onderzoeken waarin benzodiazepinen in het algemeen werden bestudeerd, werd vaak niet apart gekeken naar de uitkomstmaat lip- of gehemeltespleten. Rosenberg bestudeerde het verband met lipspleten bij gebruik van diazepam. In dit onderzoek werd geen verhoogd risico gevonden. In het onderzoek van Kjaer bleek diazepam wel geassocieerd te zijn met een gering verhoogd risico op lipspleten (OR 1.8; BI 1.1-2.8). In het onderzoek van Cornel, waarin 2464 combinaties van aangeboren afwijkingen en potentiële riscofactoren werd onderzocht, werd ook het effect van anxiolytica bestudeerd, echter zonder subanalyse van de groep benzodiazepinen. Nadere analyse van de resultaten toonde wel een verband tussen oxazepamgebruik en lip-en/of gehemeltespleten (OR 8.2; BI 1.3-42.2; p=0.014). Omdat de gevonden associatie berust op slechts 3 gevallen, is het niet uitgesloten dat deze bevinding op toeval zou kunnen berusten, hetgeen mede ondersteund wordt door het zeer grote betrouwbaarheidsinterval.
Uitgangsvraag 2: Dosering, duur en tijdstip van de expositie
In de selectie van de literatuur werden vrijwel alleen onderzoeken gevonden waarin sprake was van 1e trimester expositie, al dan niet voortgezet tijdens de verdere zwangerschap. Alleen Hartz (1975) maakte onderscheid tussen vroege en late blootstelling aan chloordiazepoxide en vond geen verhoogd risico op aangeboren afwijkingen in beide groepen. Uit de beschikbare literatuur kan geen conclusie worden getrokken over de effecten van gebruik van benzodiazepinen in het 2e of 3e trimester op aangeboren of functionele afwijkingen.
In de geselecteerde literatuur kon geen antwoord worden gevonden op de vraag of de duur van het benzodiazepinegebruik verband houdt met een risico op aangeboren afwijkingen.
Wel was in alle onderzoeken sprake van chronisch gebruik van benzodiazepinen. Er kan dus geen uitspraak worden gedaan over de effecten van incidenteel benzodiazepinegebruik van de moeder op het optreden van aangeboren afwijkingen.
Uitgangsvraag 3: Voorkeursmedicatie
Op basis van de geringe hoeveelheid beschikbare gegevens uit de literatuur kan geen voorkeur voor een van de benzodiazepinen worden gegeven, met het oog op het risico op aangeboren afwijkingen.
Tabel 5.1: Associatie van benzodiazepinen met aangeboren afwijkingen
|
BENZODIAZEPINEN |
Aangeboren afwijkingen |
Cleft lip/palate |
Opmerkingen/Conclusie |
|
Ornoy 1998 benzo n=355 |
Benzo 3.1% versus 2,6% in controlegroep NS p=0.51 |
- |
Comedicatie ook benzo Geen verhoogd risico |
|
Oberlander 2008 benzo n=968 benzo+SSRI n= 392 |
Ernstige afw.: NS Cardiovasc. afw. NS ASD/VSD NS |
- |
Benzo: risico niet verhoogd Benzo+SSRI: ↑ risico op cardiovasc. afwijkingen |
|
Reis 2013 benzo n=1000 HBRA n=776 benzo+SSRI n=406 HBRA+SSRI n=309 |
Benzo, HBRA en combinaties van beiden met SSRI: géén verhoogd risico op algemene of cardiovasc. aangeboren afwijkingen |
|
Geen verhoogd risico van benzo of HBRA, ook niet wanneer in combinatie met een SSRI |
|
OXAZEPAM |
Aangeboren afwijkingen |
Cleft lip/palate |
Conclusie |
|
Cornel 1996 Studie van 2464 (mogelijke) combinaties van aangeboren afwijkingen en risicofactoren |
- |
Oxazepam 3/274 (1.1%) vs controles 5/3732 (0.1%) OR 8.2 (BI 1.3-42.2) |
Verhoogd risico, maar vanwege methode is toeval van 3 cases goed mogelijk, (zich uitend in groot betrouwbaarheidsinterval) |
|
ZOPLICON |
Aangeboren afwijkingen |
Cleft lip/palate |
Conclusie |
|
Diav-Citrin 1999 zoplicon n=40 |
Ernstige aangeboren afw. 0/31 vs 1/37 |
- |
Geen verhoogd risico |
|
DIAZEPAM |
Aangeboren afwijkingen |
Cleft lip/palate |
Conclusie |
|
Kjaer 2007 Case-time-control study aangeboren afw. n=22843 controles n=38151 Blootstelling medicatie
|
Aangeboren afwijkingen: OR 1.2 (1.0-1.4) Darmstresie/stenose: OR 3.2 (1.0-9.9) Ledemaatsafwijkingen: OR 2.6 (OR 1.3-4.9) |
CLP OR 1.8 (1.1-2.8)
|
Gering verhoogd risico op algemene aangeboren afwijkingen en CLP |
|
Rosenberg 1983 Case-control CLP n=445 CP n=166 Controles n=2498 |
- |
CLP aOR 0.8 (0.4-1.7) CP aOR 0.8 (0.2-2.5) |
Geen verhoogd risico |
|
CLONAZEPAM |
Aangeboren afwijkingen |
Cleft lip/palate |
Conclusie |
|
Lin 2004 Clonazepam n=43 (33 1e trim)
|
3% cong. afw (1/33) Géén controlegroep! |
- |
Geen verhoogd risico |
|
CHLOORDIAZEPOXIDE |
Aangeboren afwijkingen |
Cleft lip/palate |
Conclusie |
|
Milkovich 1974 Chloordiazepoxide n=175 controles (3): meprobamaat, medicatie overig, géén medicatie |
1e trim 11.4% vs later 3.6% (p=0.08). Vs géén medicatie in 1e trim 2.6% (p=0.08). |
- |
Hoger risico, doch geen significantie |
|
Hartz 1975 Chloordiazepoxide n=257 vroege en n=483 late exposities Controles n=48412 |
Blootstelling: vroeg RR 0.8 (0.4-1.6) laat RR 1.2 (0.8-1.7) |
- |
Geen verhoogd risico |
|
ALPRAZOLAM |
Aangeboren afwijkingen |
Cleft lip/palate |
Conclusie |
|
St Clair 1992 Alprazolam n=411 (1e trim), 276 levendgeboren |
13/276 (4.7%) (ook 1 trisomie en 1 lipoom) Geen bepaald patroon. |
- |
Geen goede controlegroep |
|
ZOLPIDEM |
Aangeboren afwijkingen |
Cleft lip/palate |
Conclusie |
|
Wang 2010Aziatische studie zolpidem n=2497 (1e trim 535) controles n=12485 |
Zolpidem vs controles: 0.5% vs. 0.6%, p=0.33) aOR 0.7 (0.4-1.3) |
- |
Geen verhoogd risico |
Zoeken en selecteren
In totaal zijn er 12 onderzoeken bruikbaar voor het beantwoorden van de uitgangsvragen (Cornel, 1996; Diav-Citrin, 1999; Hartz, 1975; Kjaer, 2007; Lin, 2004; Milkovich, 1974; Oberlander, 2008; Ornoy, 1998; Reis, 2013; Rosenberg, 1983; St Clair, 1992; Wang, 2010). Hoewel zeer recent gepubliceerd, heeft de werkgroep besloten om het onderzoek van Reis toch te includeren, omdat het in belangrijke mate bijdraagt aan het beantwoorden van de uitgangsvragen. Zie tabblad 'Verantwoording' voor de zoekverantwoording en kopje 'Evidence tabellen' voor de evidence tabel.
GRADE tabel
|
Beoordeling van kwaliteit |
Kwaliteit |
||||||
|
Aantal studies |
Studie ontwerp |
Studie beperkingen |
Inconsistentie |
Indirectheid |
Imprecisie |
Andere opmerkingen |
|
|
Aangeboren afwijkingen (benzodiazepinen in het algemeen) |
|||||||
|
3 |
Observationele studies 1 |
Ernstige beperkingen 1 |
Geen ernstige inconsistentie |
Ernstige indirectheid 1 |
Geen ernstige imprecisie |
Geen |
ZEER LAAG |
|
Aangeboren afwijkingen (afzonderlijke benzodiazepinen) |
|||||||
|
8 |
Observationele studies 2 |
Ernstige beperkingen 2 |
Geen ernstige inconsistentie |
Geen ernstige indirectheid |
Ernstige imprecisie 2 |
Geen |
ZEER LAAG |
1 Oberlander 2008 en Ornoy 1998. Er was sprake van gebruik van verschillende benzodiazepinen in de afzonderlijke onderzoeken en ook was niet altijd vermeld welke benzodiazepinen het betrof. Daarnaast werd in de studie van Oberlander gebruik van meer dan 1 benzodiazepine meegenomen. Door deze beperkingen werd gedowngrade.
Reis 2013, goede studie. Echter door de beperkingen van de andere 2 studies blijft de kwaliteit van bewijs zeer laag voor benzodiazepinegebruik in het algemeen en aangeboren afwijkingen.
2 Cornel, 1996; Diav-Citrin, 1999; Kjaer, 2007; Rosenberg, 1983; Lin, 2004; Milkovich, 1974; Hartz, 1975; St Clair, 1992; Wang, 2010. Voor oxazepam, zoplicon, clonazepam, alprazolam en zolpidem werd een ieder slechts in één artikel beschreven. De overige benzodiazepinen (diazepam en chloordiazepoxide) slechts in 2 artikelen. Over het algemeen betrof het kleine studiepopulaties. Er werd gedowngrade naar een lage kwaliteit van bewijs.
Referenties
- Cornel MC, Erickson JD, Khoury MJ, James LM, Liu Y. Population-based birth-defect and risk-factor surveillance: Data from the northern Netherlands. Int J Risk Saf Med 1996;8:197-209.
- Diav-Citrin O, Okotore B, Lucarelli K, Koren G. Pregnancy outcome following first-trimester exposure to zopiclone: a prospective controlled cohort study. Am J Perinatol 1999;16:157-60.
- Hartz SC, Heinonen OP, Shapiro S, Siskind V, Slone D. Antenatal exposure to meprobamate and chlordiazepoxide in relation to malformations, mental development, and childhood mortality. N Eng J Med 1975;292:726-8.
- Kjaer D, Horvath-Puho E, Christensen J, Vestergaard M, Czeizel AE, Sorensen HT. Use of phenytoin, phenobarbital, or diazepam during pregnancy and risk of congenital abnormalities: a case-time-control study. Pharmacoepidemiology & Drug Saf 2007;16:181-8.
- Lin AE, Peller AJ, Westgate MN, Houde K, Franz A, Holmes LB. Clonazepam use in pregnancy and the risk of malformations. Birth Defects Res 2004;70:534-6.
- Milkovich L, van den Berg BJ. Effects of prenatal meprobamate and chlordiazepoxide hydrochloride on human embryonic and fetal development. N Eng J Med 1974;291:1268-71.
- Oberlander TF, Warburton W, Misri S, Riggs W, Aghajanian J, Hertzman C. Major congenital malformations following prenatal exposure to serotonin reuptake inhibitors and benzodiazepines using population-based health data. Birth Defects Res 2008;Part(1):68-76.
- Ornoy A, Arnon J, Shechtman S, Moerman L, Lukashova I. Is benzodiazepine use during pregnancy really teratogenic? Reprod Toxicol 1998;12:511-5.
- Reis M, Kallen B. Combined use of selective serotonin reuptake inhibitors and sedatives/ hypnotics during pregnancy: risk of relatively severe congenital malformations or cardiac defects. A register study. BMJ Open 2013;3:e002166.
- Rosenberg L, Mitchell AA, Parsells JL, Pashayan H, Louik C, Shapiro S. Lack of relation of oral clefts to diazepam use during pregnancy. N Engl J Med 1983;309:1282-5.
- St Clair SM, Schirmer RG. First-trimester exposure to alprazolam. Obstet Gynecol 1992;80:843-6.
- Wang LH, Lin HC, Lin CC, Chen YH, Lin HC. Increased risk of adverse pregnancy outcomes in women receiving zolpidem during pregnancy. Clin Pharmacol Ther 2010;88(3):369-74.
- Cornel MC, Erickson JD, Khoury MJ, James LM, Liu Y. Population-based birth-defect and risk-factor surveillance: Data from the northern Netherlands. Int J Risk Saf Med 1996;8:197-209.
- Diav-Citrin O, Okotore B, Lucarelli K, Koren G. Pregnancy outcome following first-trimester exposure to zopiclone: a prospective controlled cohort study. Am J Perinatol 1999;16:157-60.
- Hartz SC, Heinonen OP, Shapiro S, Siskind V, Slone D. Antenatal exposure to meprobamate and chlordiazepoxide in relation to malformations, mental development, and childhood mortality. N Eng J Med 1975;292:726-8.
- Kjaer D, Horvath-Puho E, Christensen J, Vestergaard M, Czeizel AE, Sorensen HT. Use of phenytoin, phenobarbital, or diazepam during pregnancy and risk of congenital abnormalities: a case-time-control study. Pharmacoepidemiology & Drug Saf 2007;16:181-8.
- Lin AE, Peller AJ, Westgate MN, Houde K, Franz A, Holmes LB. Clonazepam use in pregnancy and the risk of malformations. Birth Defects Res 2004;70:534-6.
- Milkovich L, van den Berg BJ. Effects of prenatal meprobamate and chlordiazepoxide hydrochloride on human embryonic and fetal development. N Eng J Med 1974;291:1268-71.
- Oberlander TF, Warburton W, Misri S, Riggs W, Aghajanian J, Hertzman C. Major congenital malformations following prenatal exposure to serotonin reuptake inhibitors and benzodiazepines using population-based health data. Birth Defects Res 2008;Part(1):68-76.
- Ornoy A, Arnon J, Shechtman S, Moerman L, Lukashova I. Is benzodiazepine use during pregnancy really teratogenic? Reprod Toxicol 1998;12:511-5.
- Reis M, Kallen B. Combined use of selective serotonin reuptake inhibitors and sedatives/ hypnotics during pregnancy: risk of relatively severe congenital malformations or cardiac defects. A register study. BMJ Open 2013;3:e002166.
- Rosenberg L, Mitchell AA, Parsells JL, Pashayan H, Louik C, Shapiro S. Lack of relation of oral clefts to diazepam use during pregnancy. N Engl J Med 1983;309:1282-5.
- St Clair SM, Schirmer RG. First-trimester exposure to alprazolam. Obstet Gynecol 1992;80:843-6.
- Wang LH, Lin HC, Lin CC, Chen YH, Lin HC. Increased risk of adverse pregnancy outcomes in women receiving zolpidem during pregnancy. Clin Pharmacol Ther 2010;88(3):369-74.
Evidence tabellen
|
Reference |
Study type |
Characteristics |
Intervention (I)
Controls (C)
|
Outcome measures and follow-up time |
Results |
Quality assessment study |
|
Cornel, 1996 |
Cohort study
N total = 4014
Setting: Northern Netherlands
|
Aim of the study: To identify risk factors for malformations.
To investigate whether the occurrence of defects in any of the 32 diagnostic catergories were associated with any of 77 risk factors.
Inclusion criteria:
Exclusion criteria:
|
Case: Birth defect E: risk factor
Controls: No birth defect E: risk factor
|
Primary outcomes: Birth defects (ICD 9) Risk factor surveillance
Potential risk factors: Maternal drug use, chronic illness, family history.
Secondary outcomes:
Follow up: 1981-1994
|
Primary outcomes: An association between maternal use of psychotropic drugs (psycholeptics) and cleft lip with or without cleft palate (CLP) was present.
CPL and maternal use of oxazepam OR 8.17, 95% CI 1.26-42.2
Cleft lip with or without CLP and exosure to Anxiolytics: Cases E: 4 NE: 273
Controls: E:11 NE: 3726
OR 4.96, 95% CI 1.14-16.88
Secondary outcomes: -
|
Clearly defined groups: Yes.
Selection bias: Possible, informed consent.
Method of assessing the outcome appropriately: Yes.
Selective loss to follow up: No.
Identification confounders and correction in analysis: No.
Funding: Not described.
Limitations: - possible type 1 errors (only exposure defect combinations involving at least three infants) - Lack of outcome specificity. |
|
Diav-Citrin, 1999
|
Prospective cohort study
N total = 80
Setting: Canada
|
Aim of the study: To compare pregnancy outcome following 1st trimester exposure to zoplicone.
Inclusion criteria: Not applicable.
Exclusion criteria: Not applicable. |
Exposure: Zoplicone in 1st trimester N=40
Controls: Matched controls with nonteratogenic exposure. N=40
Matched for age, cigarette smoking and alcohol consumption. |
Telephone interview
Primary outcomes: Malformations
Secondary outcomes: Pregnancy outcome and offspring characteristics.
-Delivery method -Preterm delivery -Birth weight by GA -Fetal distress -NICU admission
Follow up: Motherrisk program 1993-1997
|
Primary outcomes: No increase in rate of major malformations 0/31 (0%) for zoplicone group vs 1/37 (2.7%) for control group, p=1
Secondary outcomes: No differences in outcome of pregnancy, delivery method, assisted deliveries, fetal distress, presence of meconium at birth, preterm deliveries, NICU admissions.
Newborns in the zoplicone group had significantly lower mean birth weight and lower gestatrional age compared to the control group.
Characteristics:
|
Clearly defined groups: yes.
Selection bias: Recall/report bias.
Method of assessing the outcome appropriately: Yes.
Selective loss to follow up: No.
Identification confounders and correction in analysis: No. But they used matched control groups. No major differences in characteristics.
Funding: Not applicable.
Limitations: - relatively smal sample size for number of variables -> underpowered. - No information about co-medication |
|
Hartz, 1975 |
Retrospective cohort (follow up study)
N= 740 (chlordiazepine) |
Inclusion criteria: -12 US hospitals -GA>5months -1958-1966 -Race white, black or puerto rican
Exclusion criteria: -no consent -Abortion <5 months -Multiple pregnancies -Missing data -Rubella |
Aim of the study: To dentify the risk of antenatal chlordiazepoxide on malformations, metal development and childhood mortality |
Primary outcomes: -Malformations Secundary outcomes: -metal development -mortality Follow up: - |
Primary outcomes: Malformations; -Early exposure 11/257 OR 0.8 (1.6-0.4) -Late exposure 30/483 OR 1.2 (1.7-0.8) Secundary outcomes: -metal development
-mortality 4.8% (4.4% control), similar for early and late exposures |
-Clearly defined groups: Yes -Selection bias: Possible recall bias -Method of assessing the outcome appropriately: Yes -Selective loss to follow up: No, this was a follow up study -Identification confounders and correction in analysis: Yes, correction for race and socioeconomic status. Not for drugs, other medication, smoking, heridity etc. -Funding: Unknown |
|
Kjaer, 2007
|
Case-time-control study
N total = 22 843 children with congenital abnormalities (cases) and 38 151 children with no abnormalities (controls)
|
Aim of the study: Congenital abnormalities following exposure to phenytoin, phenobarbital, and diazepam in early pregnancy, i.e., second and third month, compared to mid-pregnancy, i.e., fifth and sixth month of pregnancy
Inclusion criteria: -
Exclusion criteria: congenital dislocation of the hip based on Ortolani click, congenital inguinal hernia, haemangioma, umbilical hernia and hydrocele, specified Mendelian and chromosomal congenital abnormality Syndrome, Down’s syndrome Children without Hungarian citizenship and those with unknown mother’s Controls with no Hungarian citizenship and with unknown addresses. |
Cases: 22.843 children with congenital abnormalities
Controls: 38.151 children with no abnormalities
Controls were matched to cases on sex, residence, and calendar birth week. |
Primary outcomes: Congenital abnormalities following exposure to phenytoin, phenobarbital, and diazepam in early pregnancy, i.e., second and third month, compared to mid-pregnancy, i.e., fifth and sixth month of pregnancy.
Secondary outcomes:
Follow up: Hungarian Case-Control Surveillance of Congenital Abnormalities 1980-1996
|
Primary outcomes: diazepam, OR for congenital abnormalities was 1.2 (95%CI: 1.0–1.4). Statistically significant case-time-control odds ratios were seen for all drugs combined especially for neural tube defects, cleft lip—with or without cleft palate—, intestinal atresia/stenosis and limb deficiencies in offspring exposed in early compared to late pregnancy.
Diazepam: Statistically significant case-time-control odds ratios were seen for diazepam, and among diazepam users, we found an increased risk of neural tube defects, cleft lip—with or without cleft palate—, and limb deficiencies in offspring exposed in early compared to late pregnancy. The use of diazepam tended to be more frequent in late pregnancy than in the second and third months of gestation while this was not the case for phenytoin and phenobarbital (data not presented).
Secondary outcomes: -
|
Clearly defined groups: Yes.
Selection bias: Possible, but study method pprotects
Method of assessing the outcome appropriately: yes.
Selective loss to follow up: Not described.
Identification confounders and correction in analysis: Yes. Logistic regression.
Funding: The Danish pharmaceutical Association
Limitations: - Dependence on variability of drug use over time, with only those matched pairs that are discordant on exposure status contributing inforation about the effect. - Maybe drug use later in pregnancy, no correcton for time -> effect bias.
|
|
Lin, 2004
|
Prospective cohort.
N total = 28,565 infants
N= 52 - Clonazepam
|
Aim of the study: To obtain more information about the potential teratogenicity of clonazepam
Inclusion criteria: All births with a major malformation, including live births prior to hospital discharge, stillbirths older than 20 gestational weeks, and elective terminations.
Exclusion criteria: Conditions associated with prematurity (such as a patent ductus arteriosus or undescended testes at <36 gestational weeks); “ultrasound only” diagnoses (such as unilateral renal agenesis that were not identifiable by an examining pediatrician); positional deformities (e.g., flexible metatarsus adductus); minor anomalies (such as glanular hypospadias); birth marks; and any genetic disorders or chromosome abnormalities. |
Intervention: N= 43 monotherapy Clonazepam
Controls: None.
|
Primary outcomes: Major malformations (dose and timing medication).
Secondary outcomes: -
Follow up: 32-month period from May 1, 1998 to Dec. 31, 2000 at the Brigham and Women’s Hospital in Boston.
|
Primary outcomes: During a 32-month period, 166 anticonvulsant-exposed infants were identified; 52 had been exposed to clonazepam, 43 as monotherapy, 9 as polytherapy. Of the 43 mothers who used clonazepam alone, the treatment indication included seizures (1/43; 2.3%), migraine headaches (1/43; 2.3%), and psychiatric diagnoses including depression, bipolar disorder, panic attacks, anxiety, and obsessive compulsive disorder (41/43; 95.3%). In 19 of 41 (46.3%) mothers, there were two or more comorbid psychiatric disorders.
A total of 33 (76.7%) of the monotherapy infants were exposed during the first trimester. One (3.0%) infant had dysmorphic features, growth retardation, and a heart malformation (tetralogy of Fallot). Mother treated in the first trimester for depression with 1–2 mg per day of clonazepam. No malformations in infants born to nine mothers who used clonazepam and other anticonvulsants.
Of these 33 mothers, 25 (75.7%) ingested clonazepam at the recommended frequency of one to two times per day. A total of 29 (87.9%) mothers reported using an appropriate dose of 0.5–2.0 mg per day. Three (9.1%) used more than 2.0 mg per day, and in one patient (3.0%) the dose was not reported.
Data about the timing of clonazepam exposure was available (or reasonably estimated) on all patients, having been provided through interview in 20 of 43 (46.5%) mothers.
Secondary outcomes:
Characteristics: Brief questionnaire to determine medication use, dose, duration, and indication, e.g., seizure disorder, panic attacks. |
Clearly defined groups: one group.
Selection bias: Possible.
Method of assessing the outcome appropriately: Yes. But no logistic regression, no information about characteristics and possible confounding effect.
Selective loss to follow up: Not described.
Identification confounders and correction in analysis: No information or correction for confounders. No logistic regression analysis, no control groups.
Funding: No.
Limitations: - small sample size – underpowered.
Strong: - timing and dosis information. |
|
Milkovich, 1974
|
Prospective cohort.
N total = 1904
|
Aim of the study: To examine the teratogenic potential of the minor tranquilizers.
|
4 populations:
1. Meprobamate n=402 2. Chlordiazepoxide n=175 3. other drugs n=818 4. no drugs n=509 |
Primary outcomes: Incidence of severe congenital anomalies
- Categorization severe, moderate, mild.
- Fetal deaths
According to gestational age at the time the diagnosis of anxiety was entered into the record.
|
Primary outcomes: Rates of the anomalies after prescription of meprobamate or chlordiazepoxide in early pregnancy (the first 42 days) were higher 12.1/100 and 11.4/100 respectively than in children of the other-drug, 4.6/100, or no-drug cohorts 2.6/100.
When the reference date was later in pregnancy (43 days to termination), statistically insignificant differences in rates of the anomalies were observed among the 4 groups. These data suggest that meprobamate, and possibly chlordiazepoxide, may be teratogenic when taken during the first six weeks of gestation.
Type of anomaly:
Fetal deaths:
No significantly differences between the groups.
Secondary outcomes:
Characteristics: There is agreement among the 4 study populations in mothers ages and racial backgrounds.
The three drug groups were not mutually exclusive. Fewer than 10 % of the mothers belonged in two cohorts. When this doubling occurred, the vast majority had received the second drug after the first trimester.
|
Clearly defined groups: yes.
Selection bias: Possible.
Method of assessing the outcome appropriately: Yes. But possibility of underreportion.
Selective loss to follow up: Not mentioned.
Identification confounders and correction in analysis: Not mentioned.
Funding: Yes. Grant from the national institute of child health and human development, national institutes of health.
|
|
Oberlander, 2008 |
Retrospective cohort
N= 968 (BDP onl;y)
Data used in this study came from five administrative sources housed in the BC Linked Health Database (Chamberlayne et al., 1998) (BC registry of births, hospital separation records, the PharmaCare registry of subsidized prescriptions; the Medical Services Plan physician billing records; and the registry of Medical Services Plan subscribers) linked to PharmaNet, a province-wide network recording all prescriptions dispensed by BC pharmacists outside hospitals |
Aim of the study: To determine a population-based incidence of congenital anomalies following prenatal exposure to serotonin reuptake inhibitor (SRI) antidepressants used alone and in combination with a benzodiazepines (BZ).
Inclusion criteria: -1979-2002 -live births
Exclusion criteria: -Anticonvulsiva |
|
Primary outcomes: Major congenital anomalies Secundary outcomes: Cardiovascular congenital defects Ventricular septal defects Atrial septal defects
|
Primary outcomes: Major congenital anomalies 31/968, OR 3.20 (2.27-4.51)
Secundary outcomes: Cardiovascular congenital defects 5/968, OR 0.52 (0.22-1.20) Ventricular septal defects 3/968, OR 0.31 (0.11-0.91) Atrial septal defects 1/968, OR 0.10 (0.02-0.58)
|
-Clearly defined groups: Yes -Selection bias: No -Method of assessing the outcome appropriately: Yes -Selective loss to follow up: No -Identification confounders and correction in analysis: Not always known which BDP were used, thereby sometimes comedication of more BDP -Funding: BC Ministry of Children and Family Development through the Human Early Learning Partnership |
|
Ornoy, 1998
|
Prospective cohort
N total = 1023 (599 benzo users and 424 controls) |
Inclusion criteria: - 1988 to 1996 - women called the Israeli TIS concerning exposures to BD during pregnancy -pregant
Exclusion criteria: -Not mentioned |
Aim of the study: To examine if BD causes an increase in spontaneous abortions or congenital anomalies
Intervention: n= 460
Total percent use is greater than 100 due to use of more than one drug by some women. There were 554 benzodiazepines used by 460 women.
Controls: 424 control pregnancies (nonteratogenic exposure)
The results are based on the information provided by the women (questionnaire) or their physicians |
Primary outcomes: -congenital anomalies, -major medical problems
Secundary outcomes: -sex, birth age and birth weight of the newborn -spontaneous and induced abortions -maternal age
Follow up: 460 pregnancies (76.6%)= 355 children in exposure group. |
Primary outcomes: The incidence of congenital anomalies (3.1%) was not different from that found in 424 control pregnancies (2.6%).
Secundary outcomes: There was a significantly higher incidence of induced abortions (14.1% vs. 4.7%, P = 0.00) and of spontaneous abortions (8.7% vs. 5.2%, P = 0.01).
|
-Clearly defined groups: Yes
-Selection bias: 1105 loss to follow up, not explained
-Method of assessing the outcome appropriately: No, they tested for significance with the chi-square and Fisher exact test (two-tail) for differences in proportions between the BD exposed group and the control group. No multivariable analyses.
-Selective loss to follow up: (599-460=139 in BDP, in control 1390-424=966)
-Identification confounders and correction in analysis: No identification or analyses. E.g. they mention the weakness in other studies regarding co-medication, but do not correct this in their own study.
-Funding: Not mentioned |
|
Reis, 2013 |
Retrospective cohort
N=1776
Swedish national health registers. |
Aim of the study: To investigate the proposed synergistic teratogenic effect of use of selective serotonin receptor inhibitors (SSRI) together with sedatives or hypnotics, primarily benzodiazepines, during pregnancy.
Inclusion criteria: Benzodiazepines or HBRA use Data from the Swedish Medical Birth Register were used.3 Women giving birth between 1 July 1995 and 31 December 2008 (n=1 290 672) were interviewed by midwives at the first antenatal care visit, usually before the end of the first trimester.
Exclusion criteria: - |
|
Primary outcomes: Congenital malformations and cardiac defects
|
Primary outcomes: Benzodiazepines: Servere malformation 37/1000, OR 1.10 (0.79-1.54) Cardiovasculair defect 13/1000, OR 1.30 (0.75-2.24) HBRA: Servere malformation 22/776, OR 0.86 (0.57-1.72) Cardiovasculair defect 2/776, OR 0.26 (0.63-0.94)
|
-Clearly defined groups: Yes -Selection bias: No -Method of assessing the outcome appropriately: Yes -Selective loss to follow up: Not apllicable -Identification confounders and correction in analysis: Yes, adjustment fora ge, parity, smoking and BMI, but not for inherited risk, concominant medication or drug use -Funding: The study was supported by grants from Evy and Gunnar Sandberg’s Foundation, Lund (BK) and the Swedish Medical Research Council (No. 2009-4740) (MR). The authors’ work was independent of the funders. |
|
Rosenberg, 1983
|
Retrospective cohort.
N total = 3109
Setting: Boston, Philadelphia and Toronto |
Aim of the study: The present report provides further data on the risks of cleft lip and cleft palate from in utero exposure to diazepam.
Inclusion criteria:
Exclusion criteria:
|
Cases: 1. all children with any cleft lip with or without cleft palate (n=445) 2. all children with any cleft palate alone. (n=166)
Controls: All other malformed children (n=2498)
N=1260 gastrointestinal defects N=449 cardiovascular defects N=383 central-nervous-system defects N=308 musculoskeletal defects N=263 various syndromes N=259 genitourinary defects N=254 neoplasms N=116 respiratory defects 70 defects of eyes and ears
|
Primary outcomes: Risk of oral cleft anomalies
Secondary outcomes: - Follow up: March 1976 – April 1982
|
Primary outcomes: After control for identified confounders the corresponding relative risk of Diazepam exposure in the first 4 lunar months of pregnancy was 0.8 (95% CI 0.4-1.7) for cleft lip with or without cleft palate and 0.8 (95% CI 0.2-2.5) for cleft palate alone.
Secondary outcomes: - Characteristics: -
|
Clearly defined groups: Yes.
Selection bias: Possible.
Method of assessing the outcome appropriately:
Selective loss to follow up: No.
Identification confounders and correction in analysis: Yes. Correction for confounders and logistic regression. (Year of interview, maternal age, geographic area, maternal cigarette smoking, maternal history of influenza or other infection during the 1st trimester, maternal history of convulsive disorder or use of anticonvulsants during the pregnancy, maternal history of diabetes mellitus, sex of the child, use of benzodiazepines other than diazepam during pregnancy, history of cleft lip or palate in the mother, father, sibling, or half sibling, and suspicion by the mother that diazepam is a teratogen).
Funding: Not mentioned.
Limitations:
|
|
St. Clair, 1992 |
|
Aim of the study:
Inclusion criteria:
Exclusion criteria:
|
|
Primary outcomes:
Secundary outcomes:
Follow up: |
Primary outcomes:
Secundary outcomes:
|
-Clearly defined groups:
-Selection bias:
-Method of assessing the outcome appropriately:
-Selective loss to follow up:
-Identification confounders and correction in analysis:
-Funding: |
|
Wang, 2010
|
Retrospective cohort.
N= 14.982
2,497 mothers who received zolpidem treatment during pregnancy and those from 12.485 randomly selected mothers who did not receive the drug
Setting: Taiwan |
Aim of the study: The aim of comparing the risk of adverse pregnancy outcomes in women who received zolpidem treatment for insomnia during pregnancy with that in women who did not.
Inclusion criteria: Live singleton births and used prenatal care services
Exclusion criteria: History of mental disorder. Diagnosed with hypertension, diabetes, or coronary heart disease prior to conceiving.
Exclusion for control group: prescribed any type of medication for >30 days during pregnancy. |
Exposure: 2497 mothers who received zolpidem
Defined women who had been prescribed zolpidem for >30 days during pregnancy as those who had received zolpidem treatment.
Controls: 12.485 randomly picked mothers who received no zolpidem.
Matched with the study group in terms of age
|
Primary outcomes: Adverse outcomes identified and assessed were delivery of low-birth-weight (LBW) infants, preterm deliveries, delivery of small-for-gestational-age (SGA) infants, delivery of infants with congenital anomalies, and cesarean delivery. (Incidence)
Major malformations included in this study: Hydrocephaly, anencephaly, microcephaly, meningomyelocele, encephalocele, and spina bifida
Follow up: 1 January 2005 and 31 December 2005.
|
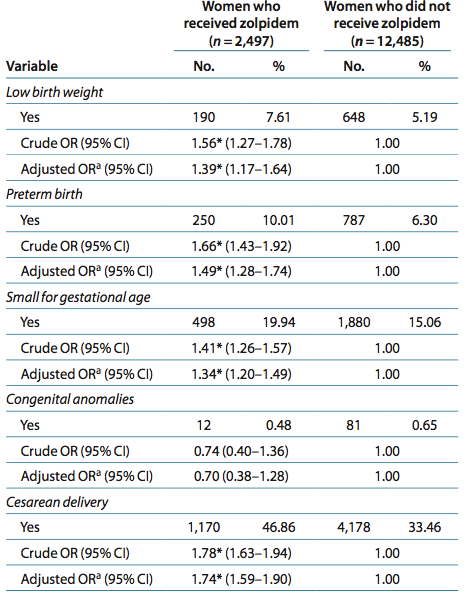
Primary outcomes: The results show that the adjusted odds ratios (ORs) for adverse pregnancy outcomes—LBW infants, preterm deliveries, SGA infants, and caesarean delivery—were all higher in mothers who received zolpidem treatment during pregnancy, relative to the randomly selected controls (1.39 (95% confidence interval (CI) = 1.17–1.64), 1.49 (95% CI = 1.28–1.74), 1.34 (95% CI = 1.20–1.49), and 1.74 (95% CI = 1.59–1.90), respectively).
Major malformations: There was no significant difference between the two groups in the rates of congenital anomalies (0.48 vs. 0.65%, P = 0.329).
Characteristics: In the total sample of 14,982 mothers, the mean age was 29.7 years with a SD of 4.9 years. Mothers who received zolpidem were more likely to have lower educational levels (P < 0.001), gestational hypertension (P < 0.001), and anemia (P = 0.001) than mothers who did not take zolpidem. Also, in mothers who received the drug, the parity of the infants was higher than in the control group (P < 0.001). |
Clearly defined groups: Yes.
Selection bias: Possible.
Method of assessing the outcome appropriately: Yes.
Selective loss to follow up: No.
Identification confounders and correction in analysis: Yes. Adjusting for other characteristics of the mothers and infants (the characteristics of the mother (level of education, gestational diabetes, gestational hypertension, preeclampsia/eclampsia, and anemia) and those of the infant (gender and parity). Maternal educational levels were categorized as elementary school or below, junior high school, senior high school, and college or above. Parity was recorded as 1, 2, or ≥3.)
Funding: Conflict of Interest: The authors declared no conflict of interest.
Limitations: - study was based on administrative data - Data did not include complete information on the social history of the patients (including smoking and alcohol use), on non prescription medications taken during pregnancy, and on the nutritional state of the mothers. - No information on co-medication
Strong: Duration and dosis included. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-03-2014
Beoordeeld op geldigheid : 01-01-2013
Binnen 5 jaar bepaalt het bestuur van de Nederlandse Vereniging voor Obstetrie en Gynaecologie in samenspraak met de NVVP en de NVK of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Obstetrie en Gynaecologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Gezien de opzet van de richtlijn, kan bij bekend worden van relevant onderzoek waarbij (een deel van) de richtlijn zou moeten worden aangepast, dit tussentijds per uitgangsvraag plaatsvinden.
Algemene gegevens
Deze richtlijn is tot stand gekomen in met ondersteuning van de Orde van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doelstelling
Het doel van deze richtlijn is de onduidelijkheid en onzekerheid over het al dan niet continueren of aanpassen van de dosis van (specifieke) benzodiazepinen tijdens zwangerschap en/of lactatie te verminderen door het geven van informatie en aanbevelingen voor het gebruik van benzodiazepinen in deze periode en voor het beleid met betrekking tot de pasgeborene. Tevens wordt door het ontwikkelen van deze richtlijn multidisciplinaire samenwerking gestimuleerd, zodat zwangere vrouwen met psychische problemen en medicijngebruik gezamenlijk geëvalueerd en behandeld worden.
Patiëntencategorie
In principe geldt de richtlijn voor alle vrouwen met kinderwens, zwangere vrouwen en/of vrouwen die borstvoeding (willen) geven bij wie er een indicatie bestaat voor behandeling met benzodiazepinen of bij wie er reeds sprake is van benzodiazepinegebruik ongeacht de indicatie voor het benzodiazepinegebruik.
Richtlijngebruikers
De richtlijn kan worden gebruikt door alle zorgverleners die betrokken zijn bij de zorg voor vrouwen die een benzodiazepine gebruiken tijdens zwangerschap en/of lactatie maar is primair geschreven voor leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen: de Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Nederlandse Vereniging voor Kindergeneeskunde en de Nederlandse Vereniging voor Psychiatrie.
Samenstelling werkgroep
Voor het ontwikkelen van deze richtlijn is in 2012 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van de Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Nederlandse Vereniging voor Kindergeneeskunde en de Nederlandse Vereniging voor Psychiatrie. Deze drie wetenschappelijke verenigingen zijn betrokken bij het zorgproces in de tweede lijn van vrouwen die benzodiazepinen gebruiken in de zwangerschap, het kraambed of tijdens de lactatie.
De werkgroepleden werden door de wetenschappelijke verenigingen gemandateerd voor deelname aan deze werkgroep. De werkgroepleden zijn gezamenlijk verantwoordelijk voor de integrale tekst van deze conceptrichtlijn.
De werkgroep werd ondersteund door een klinisch epidemioloog en twee richtlijnondersteuners.
Partijen die geen zitting hadden in de werkgroep maar wel voor advies geraadpleegd werden vanwege hun betrokkenheid bij het onderwerp zijn het Nederlandse Huisartsen Genootschap (NHG), de Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) en de Angst, Dwang en Fobie (ADF) stichting.
Samenstelling van de werkgroep
- Dhr. dr. J.J. Duvekot, gynaecoloog-perinatoloog, Erasmus MC, Rotterdam (voorzitter)
- Mw. M.E. van Hoorn, gynaecoloog-perinatoloog, VU Medisch Centrum, Amsterdam
- Mw. dr. I.L. van Kamp, gynaecoloog-perinatoloog, Leids Universitair Medisch Centrum, Leiden
- Dhr. dr. M.J.K. de Kleine, kinderarts-neonatoloog, Máxima Medisch Centrum, Veldhoven
- Mw. S.D. Sie, kinderarts-neonatoloog, VU Medisch Centrum, Amsterdam
- Mw. dr. M.M. van Weissenbruch, kinderarts-neonatoloog, VU Medisch Centrum, Amsterdam
- Dhr. dr. K.P. Grootens, psychiater, Canisius Wilhelmina Ziekenhuis, Nijmegen
- Mw. dr. I.M. van Vliet, psychiater, Leids Universitair Medisch Centrum, Leiden
- Dhr. Ir. T.A. van Barneveld, klinisch epidemioloog, Orde van Medisch Specialisten, Utrecht
- Mw. C.A.L. van Rijn, arts, richtlijnondersteuner Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
- Mw. M.E.P.F. Rückert, arts, richtlijnondersteuner Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
Extern advies:
Mw. drs. M. Wessels, informatiespecialist, Orde van Medisch Specialisten, Utrecht
Belangenverklaringen
De werkgroepleden hebben geen strijdige belangen aangegeven. De originele belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG. Zie hieronder voor een voorbeeldformulier belangenverklaring.
De inhoud van de conclusies en aanbevelingen uit deze richtlijn werd onafhankelijk opgesteld van en niet beoordeeld door de financier van deze richtlijn, de Stichting Kwaliteitsgelden Medisch Specialisten.
Belangenverklaring formulier
Verklaring omtrent mogelijke belangenverstrengeling en embargo met betrekking tot de richtlijn ‘gebruik van benzodiazepinen en zwangerschap’ op initiatief van ‘NVOG’
Utrecht, ………………………. 2011
Betreft: Richtlijn ‘Gebruik van Benzodiazepinen en zwangerschap’
Geachte heer, mevrouw,
In verband met uw deelname aan de ontwikkeling van de richtlijn ‘gebruik van Benzodiazepinen en zwangerschap’ vragen wij u bijgevoegde verklaring in te vullen.
Mogelijke belangenverstrengeling:
Mogelijke belangenverstrengeling valt niet steeds te vermijden, maar de Orde van Medisch Specialisten en NVOG vinden het wel van belang dat hierover openheid bestaat. U wordt daarom gevraagd op bijgaand formulier te vermelden of u in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhield met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn ‘Benzodiazepine gebruik in de zwangerschap en tijdens de lactatie’.
Hetgeen u in uw verklaring vermeldt, zal bij het secretariaat van de NVOG opvraagbaar zijn.
Embargo
Gedurende de richtlijnontwikkeling rust een embargo op de teksten van de conceptrichtlijn.
Dit betekent dat het zonder schriftelijke toestemming van de opdrachtgever niet is toegestaan om passages uit de conceptrichtlijn, of de gehele conceptrichtlijn inclusief bijlagen zoals evidence-tabellen te verstrekken aan derden.
Ondergetekende verklaart zich door ondertekening akkoord met het bovenstaande.
.......................................................................................................................................
(naam)
........................................................... ...............................................................
(plaats, datum) (handtekening)
Formulier belangenverklaring
Heeft u naar uw mening in de afgelopen vijf jaar en/of gedurende de looptijd van het project belangen die mogelijk kunnen interfereren met de besluitvorming in de werkgroep ten aanzien van de interpretatie van het wetenschappelijk bewijs en het opstellen van aanbevelingen?
Ja / Neen i
Zo ja, wilt u aangeven uit welke activiteiten deze belangen voortvloeien en welke organisaties/bedrijven het betreft? Voorbeelden van activiteiten kunnen gevonden worden in consultatie/advisering, (na)scholing / cursus en ondersteuning van wetenschappelijk onderzoek.
1. ..................................................................................................................................
2. ..................................................................................................................................
3. ..................................................................................................................................
Bij meer dan deze drie vermeldingen graag een extra blad bijvoegen.
Ondergetekende verklaart bovenstaande informatie naar waarheid te hebben ingevuld en mutaties t.a.v. bovenstaande te vermelden aan de voorzitter en secretaris van de werkgroep:
Betreft: richtlijn ‘gebruik van Benzodiazepinen en zwangerschap’
Naam: ............................................................................................................................
Afgevaardigde namens: ....................................................................................................
........................................................... ...............................................................
(plaats, datum) (handtekening)
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is geprobeerd rekening te houden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn wordt verspreid onder alle relevante beroepsgroepen. Daarnaast is een patiëntenfolder opgesteld. Ook is de richtlijn te downloaden vanaf de websites van de Nederlandse Vereniging voor Obstetrie en Gynaecologie (www.nvog.nl), de Nederlandse Vereniging voor Psychiatrie (www.nvvp.net) en de Nederlandse Vereniging voor Kindergeneeskunde (www.nvk.nl).
In module 'Organisatie van zorg benzodiazepinegebruik' worden de consequenties voor zwangere vrouwen die benzodiazepinen gebruiken tijdens zwangerschap en/of lactatie nader besproken.
Werkwijze
Methode richtlijnontwikkeling
Deze richtlijn is opgesteld aan de hand van het ‘Appraisal of Guidelines for Research & Evaluation’ (AGREE-II) instrument (www.agreetrust.org). Dit is een breed (internationaal) geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen. Bovendien werd gekozen om -volgens de meest recente ontwikkelingen op het gebied van richtlijnen - de methode toe te passen van The Grading of Recommendations Assessment, Development and Evaluation (GRADE) voor het graderen van de kwaliteit van bewijs en de sterkte van de aanbevelingen. Voor deze methode werd gekozen omdat naast de grootte van studies hierbij ook de kwaliteit van het onderzoek in de beoordeling wordt meegenomen. Formeel is de GRADE methode ontworpen voor het beoordelen van onderzoek naar interventies. Daarom werd afgezien van het aangeven van de sterkte van de aanbevelingen en is alleen de kwaliteit van bewijs in de richtlijn vermeld.
Literatuur zoekstrategieën
Er werd eerst oriënterend gezocht naar bestaande richtlijnen (https://www.ahrq.gov, www.nice.org.uk, het cbo en www.sign.ac.uk en naar systematische reviews in de Cochrane Library. Vervolgens werd er voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke onderzoeken in de elektronische databases PubMed, Embase en PsychINFO van 1940 tot november 2011 in de Engelse of Nederlandse taal. De gebruikte zoekverantwoording staat vermeld in onder kopje 'zoekverantwoording'.
Uitkomstmaten
Bij de beoordeling van de literatuur heeft de werkgroep vooral gekeken naar onderzoeken waarbij, naar inzicht van de werkgroepleden, klinisch relevante uitkomstmaten gebruikt werden. Deze werden voorafgaand aan de literatuurselectie door de werkgroep bepaald en gedefinieerd. Ook de meetinstrumenten die volgens de werkgroep relevant en acceptabel (valide) waren voor het meten van de uitkomstmaten werden vooraf vastgesteld.
Tabel 1 is een overzicht van door de werkgroep opgestelde klinisch relevante uitkomstmaten en daarbij opgestelde geaccepteerde meetinstrumenten met klinisch relevante afkappunten.
Tabel 1: Uitkomstmaten
|
Uitkomstmaten |
Operationalisatie |
|
Zwangerschapscomplicaties |
|
|
spontane miskraam |
frequentie voorkomen |
|
hypertensieve complicaties |
frequentie voorkomen |
|
diabetes gravidarum |
frequentie voorkomen |
|
Intrauteriene vruchtdood (IUVD) |
frequentie voorkomen |
|
Intrauteriene groeivertraging (IUGR) |
< P2.3, < P10 |
|
Zwangerschapsduur |
< 37 weken (< 32 weken) en > 42 weken, continue uitkomsten |
|
Complicaties tijdens de baring |
|
|
kunstverlossingen |
frequentie voorkomen |
|
sectio’s |
frequentie voorkomen |
|
inleiding van de baring (vordering?) |
ja/nee |
|
Complicaties bij het kind |
|
|
congenitale afwijkingen |
ja/nee (mild,ernstig) |
|
vroege effecten |
|
|
Geboortegewicht |
SGA (< -2 SD, < P10) of > P90 en continue uitkomsten |
|
Apgar score |
< 7 na 5 minuten |
|
pH navelstrengarterie |
< 7.00 (geen continue uitkomst) |
|
opname op de NICU |
ja/nee |
|
opname op kinderafdeling (niet NICU indicatie) |
ja/nee |
|
Onttrekkingsverschijnselen |
ja/nee -> tonusproblemen, voedingsproblemen, tremoren, prikkelbaarheid en convulsies |
|
Intoxicatie verschijnselen |
ja/nee -> ‘floppy infant’ syndroom, tonusproblemen, ademhalingsdepressie, hypotensie |
|
lange-termijn effecten |
definitie: vanaf 2 jaar tot volwassen (gevalideerde/gestandaardiseerde meetinstrumenten) |
|
motorische effecten |
vb. BSID (Bayley), Aims |
|
emotionele, sociale en gedragseffecten |
vb. CBCL (child behavior checklist), BSID, SST (strange situation procedure) |
|
cognitieve effecten |
vb. IQ als continue maat, BSID |
|
psychiatrische aandoeningen |
ja/nee -> slaapstoornissen, angst en stress |
Literatuurselectie
Per uitgangsvraag werden twee werkgroepleden aangesteld om onafhankelijk van elkaar de literatuur te beoordelen op relevantie. Bij de eerste selectie op titel en abstract werden de volgende exclusiecriteria gehanteerd:
- niet van toepassing op de vraagstelling
- niet vergelijkbaar met de Nederlandse populatie
- niet-gedefinieerde uitkomstmaat
- minder dan tien vrouwen in de onderzoekspopulatie (wegens imprecisie)
- meer dan 5% van de vrouwen gebruikten andere psychofarmaca of andere comedicatie, waarvoor niet was gecorrigeerd (minimaal een subgroepanalyse of multivariate analyse)
- andere indicatie voor benzodiazepinegebruik dan slaap-, stress- en angststoornissen (zoals epilepsie, anesthesiologische sedatie, preëclampsie en hyperemesis gravidarum)
Een exacte definitie voor chronisch of incidenteel gebruik ontbreekt. De Stichting Farmaceutische Kengetallen definieert een periode van meer dan drie maanden als chronisch gebruik. In principe zou bij chronisch gebruik continu een spiegel van het medicament in het bloed aanwezig moeten zijn. Uiteraard is dit laatste dan afhankelijk van de inname frequentie en de halfwaardetijd van het medicament.
Voor het opstellen van antwoorden op de uitgangsvragen van deze richtlijn werden de volgende specifieke definities gebruikt:
1. Mate van gebruik
- Niet-chronisch gebruik: maximaal 2 weken onafgebroken gebruik (in één trimester) of in totaal tijdens de zwangerschap maximaal 2 weken gebruik. Onder deze categorie valt dus zowel het incidenteel als het intermitterend gebruik van de medicatie.
- Chronisch gebruik: meer dan 2 weken onafgebroken gebruik tijdens de zwangerschap.
2. Hoge en lage dosering
- Hoog:
- Oxazepam > 30 mg/dag
- Temazepam > 20 mg/dag
- Zolpidem >10 mg/dag
- Laag:
- Oxazepam ≤ 30 mg/dag
- Temazepam ≤ 20 mg/dag
- Zolpidem ≤ 10 mg/dag
Comedicatie
Een deel van de patiënten die benzodiazepinen gebruiken, gebruiken hiernaast andere medicatie, zoals antidepressiva, antipsychotica, stemmingsstabilisatoren, of somatische medicatie. Deze richtlijn probeert om zoveel mogelijk alleen de effecten van benzodiazepinen te beschrijven. Bij de literatuurselectie is hier rekening mee gehouden en worden alleen onderzoeken met comedicatie gebruikt als er een adequate subanalyse is gemaakt.
Diverse vormen van comedicatie, ondermeer antipsychotica en antidepressiva maar ook vele andere somatische medicamenten, alsook alcohol en drugs, kunnen de werking van benzodiazepinen beïnvloeden. Mogelijk geldt dit ook voor de effecten op het (ongeboren) kind. Deze invloed op de werking van benzodiazepinen kan worden veroorzaakt door remming of juist stimulatie van bepaalde leverenzymen (cytochroom P450-systeem). Ook kan er sprake zijn van directe effecten op neurotransmittersystemen in de hersenen. De effecten van comedicatie dienen daarom bij de diverse afwegingen meegenomen te worden (zie ook bijlage 'Achtergrondinformatie').
Antipsychotica, antidepressiva, opioïden, anti-epileptica, anaesthetica en sedatieve antihistaminica kunnen de werking en de bijwerkingen van benzodiazepinen versterken. Stoffen die bepaalde leverenzymen (met name CYP3A4) remmen (zoals grapefruitsap, cimetidine, erytromycine en azoolantimycotica zoals ketoconazol en itraconazol), kunnen de werking van alprazolam, diazepam, midazolam, zolpidem en zopiclon versterken. Klinisch relevante interacties zijn gemeld met midazolam. Deze interactie zal zich niet voordoen bij temazepam, lormetazepam, lorazepam en oxazepam, die vooral worden geglucuronideerd. (bron: Farmacotherapeutisch Kompas, 2013)
Beoordeling van de kwaliteit van onderzoeken
Na selectie door de werkgroepleden bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De geselecteerde artikelen werden vervolgens door de werkgroepleden beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is de indeling gebruikt, zoals weergegeven in tabel 2.
De beoordeling van de verschillende artikelen vindt u in de verschillende teksten terug onder ‘Samenvatting literatuur’. De richtlijnondersteuners maakten in samenspraak met de subgroepen per vraag evidence tabellen van de geselecteerde individuele onderzoeken als hulpmiddel bij het beoordelen en samenvatten van deze onderzoeken. Vervolgens werd de kwaliteit van het bewijs van het totaal aan gevonden onderzoeken van de betreffende vraag en uitkomstmaat (‘body of evidence’) beoordeeld. Met de kwaliteit van het bewijs wordt bedoeld in hoeverre er vertrouwen is dat de aanbevelingen gebaseerd kunnen worden op de (effectschatting van de) evidence en de GRADE tabellen. Het wetenschappelijk bewijs werd vervolgens kort samengevat in een ‘conclusie’. De belangrijkste literatuur waarop deze conclusie is gebaseerd staat bij de conclusie vermeld inclusief de GRADE gradering van bewijs.
Bij GRADE wordt de evidence per uitkomstmaat beoordeeld. De beoordeling wordt gedaan door het invullen van een evidenceprofiel. Alleen voor kritieke en/of belangrijke uitkomstmaten is een evidenceprofiel gemaakt. Er zijn in totaal vijf factoren die de kwaliteit van het bewijs per uitkomstmaat kunnen verlagen en drie factoren die de kwaliteit kunnen verhogen. Per factor kan de kwaliteit met een of twee niveaus omlaag gaan. Als het om een ernstige beperking gaat, gaat de kwaliteit met een niveau omlaag; als het om een zeer ernstige beperking gaat, gaat de kwaliteit met twee niveaus omlaag.
De verschillende typen onderzoek kunnen worden ingedeeld naar mate van bewijs. Randomized controlled trials (RCT’s) zijn in beginsel van hogere methodologische kwaliteit dan observationele onderzoeken, omdat RCT’s minder kans op vertekening (bias) geven. In het GRADE systeem beginnen daarom RCT’s met hoge kwaliteit (4) en observationele onderzoeken met lage kwaliteit (2). Niet-vergelijkende, niet-systematische onderzoeken (zoals ‘case series’ en ‘case reports’) worden altijd gekwalificeerd als zeer lage kwaliteit. Een overzicht van de GRADE indeling van kwaliteit van de onderzoeken per uitkomstmaat is weergegeven in tabel 2.
Aangezien de GRADE systematiek niet geschikt is voor de beoordeling van case reports en case series werden deze onderzoeken niet geselecteerd. Review artikelen waarin een overzicht van dit soort onderzoeken worden vermeld, werden alleen geselecteerd als geen andere onderzoeken voorhanden waren.
Tabel 2. GRADE-indeling van de kwaliteit van de onderzoeken per uitkomstmaat.
|
Kwaliteit |
Studiedesign |
Kwaliteit verlagen |
Kwaliteit verhogen |
|
Hoog (4) |
RCT |
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 ernstig -2 zeer ernstig
-1 waarschijnlijk -2 zeer waarschijnlijk |
+1 groot +2 zeer groot
+1 bewijs voor relatie
+1 zou het effect onderschatten +2 zou het effect overschatten als er geen effect was aangetoond
|
|
Matig (3) |
|
||
|
Laag (2) |
Observationele vergelijkend onderzoek (bijv. patiënt-controle onderzoek, cohort onderzoek) |
||
|
Zeer laag (1) |
Niet-systematische klinische observaties (bijv. ‘case studies’, ‘case reports’) |
RCT’s beginnen ‘hoog’ (4), observationele onderzoeken ‘laag’ (2).
Bij RCT’s: bijvoorbeeld 1 punt downgraden: dan van hoog (4) naar matig (3), 2 punten downgraden: dan van hoog (4) naar laag (2), 3 punten downgraden: dan van hoog (4) naar zeer laag (1).
Bij observationele onderzoeken: bijvoorbeeld 1 punt upgraden: dan van laag (2) naar matig (3).
Formuleren van aanbevelingen
Nadat de gegevens uit de GRADE tabellen waren samengevat als tekst werden hieruit conclusies getrokken. Om vervolgens tot een gewogen aanbeveling te komen werden de overige overwegingen besproken en geformuleerd. Dit is van belang omdat voor een aanbeveling naast het wetenschappelijke bewijs ook nog andere aspecten meegewogen horen te worden, zoals patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen en organisatorische aspecten. Bij de overwegingen spelen ook de ervaring en opvattingen van de werkgroepleden een rol (‘authority-based’). De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en op de belangrijkste overwegingen. De gebruikte methodiek voor richtlijnontwikkeling verhoogt de transparantie van de totstandkoming van de aanbevelingen in deze richtlijn.
Bij het beoordelen van de literatuur werd de volgende tekortkoming vastgesteld. Ondanks het feit dat benzodiazepinen al lang en veel worden gebruikt en er veel over is geschreven, werd weinig literatuur aangetroffen die voldeed aan de vooraf vastgestelde inclusiecriteria. In wetenschappelijk onderzoek naar dit onderwerp wordt vaak gebruik gemaakt van door patiënten zelf ingevulde vragenlijsten waarbij symptomen uitgevraagd worden zonder deze in de bredere context van duur, beperkingen en bijkomende relevante factoren te plaatsen. Meer in het bijzonder zijn er weinig vragenlijsten die specifiek rekening houden met de zwangerschap als lichamelijke bron van angst- en slaapstoornissen.
Alle conclusies en aanbevelingen werden plenair in de vergaderingen van de werkgroep besproken, waarbij door consensus tot een concepttekst werd gekomen. Indien dit niet mogelijk bleek werd door meerderheid van stemmen de uiteindelijke concepttekst bepaald. Uiteindelijk waren alle werkgroepleden akkoord met de voorliggende conceptteksten.
Zoekverantwoording
|
Onderwerp: Aangeboren afwijkingen |
Database |
Zoekstrategie |
Aantal ref. |
|
1. Is er een verband tussen benzodiazepinegebruik in het algemeen in de wangerschap en het optreden van aangeboren afwijkingen bij de foetus/pasgeborene?
2. Is er een verband met afzonderlijke benzodiazepinen gebruikt in de zwangerschap en het optreden van aangeboren afwijkingen bij de foetus/pasgeborene?
3. Is het verband met aangeboren afwijkingen bij benzodiazepinegebruik dosisafhankelijk?
4. Is het verband met aangeboren afwijkingen afhankelijk van het tijdstip van het gebruik van de medicatie in de zwangerschap (1ste/2de/3de trimester)?
5. Is het verband met aangeboren afwijkingen afhankelijk van de duur (incidenteel versus chronisch) van het gebruik van de medicatie?
6. Welke benzodiazepine(s) heeft/hebben de voorkeur voor gebruik in de zwangerschap m.b.t. het risico op aangeboren afwijkingen?
|
Medline (OVID) 1980-dec. 2011
Aanvullende search 1940-1979
PsychInfo (OVID)
Embase (Elsevier)
|
1 exp Anti-Anxiety Agents/ (54746) 2 exp Benzodiazepines/ (55777) 3 exp Anxiety Disorders/dt [Drug Therapy] (8287) 4 (alprazolam or Xanax or bromazepam or chlordiazepoxide or Librium or clobazam or Frisium or chlorazepate or Tranxene or diazepam or Stesolid or lorazepam or Temesta or oxazepam or Seresta or prazepam or Reapam or midazolam or Dormicum or brotizolam or lendormin or flunitrazepam or flurazepam or Dalmadorm or loprazolam or Noctamid or lormetazepam or Noctamid or nitrazepam or Mogadon or temazepam or Normison or zolpidem or Stilnoct or zopiclon or Imovane).af. (46694) 5 "anxiolytic drug*".ti,ab. (954) 6 1 or 2 or 3 or 4 (87028) 7 pregnancy/ or gravidity/ or exp labor, obstetric/ or exp parturition/ or exp pregnancy in adolescence/ or exp pregnancy, high-risk/ or exp pregnancy maintenance/ or exp pregnancy outcome/ or exp pregnancy, unplanned/ or exp pregnancy, unwanted/ (656993) 8 Prenatal Exposure Delayed Effects/ (17167) 9 pregnan*.ti,ab. (329828) 10 7 or 8 or 9 (724312) 11 6 and 10 (2556) 12 exp Congenital Abnormalities/ or "birth defects".ti,ab. or "congenital malformations".ti,ab. or exp Teratogens/ or "teratogenic effects".ti,ab. (451525) 13 exp "Embryonic and Fetal Development"/de [Drug Effects] (19515) 14 exp Fetus/de [Drug Effects] (11678) 15 ("birth defects" or "congenital malformations").ti,ab. (12300) 16 Heart Defects, Congenital/ (38554) 17 12 or 13 or 14 or 15 or 16 (477436) 18 6 and 17 (885) 19 10 and 6 (2556) 20 (safe* or abnormalit*).ti,ab. (676605) 21 exp Benzodiazepines/ae, to [Adverse Effects, Toxicity] (7747) 22 20 or 21 (683408) 23 19 and 22 (570) 24 18 or 23 (1238) 25 limit 24 to (yr="1980 -Current" and (dutch or english)) (801) 32 zoekfilter SR (20) 61 25 not 60 (781) 62 limit 61 to animals (247) 63 limit 61 to humans (582) 64 62 and 63 (54) 65 62 not 64 (193) 66 61 not 65 (588) – 569 uniek Aanvullende search: 143 referenties – 142 uniek
1 "Anxiolytic drugs".ti,ab. (334) 2 exp Benzodiazepines/ (8751) 3 exp Minor Tranquilizers/ (5805) 4 (alprazolam or Xanax or bromazepam or chlordiazepoxide or Librium or clobazam or Frisium or chlorazepate or Tranxene or diazepam or Stesolid or lorazepam or Temesta or oxazepam or Seresta or prazepam or Reapam or midazolam or Dormicum or brotizolam or lendormin or flunitrazepam or flurazepam or Dalmadorm or loprazolam or Noctamid or lormetazepam or Noctamid or nitrazepam or Mogadon or temazepam or Normison or zolpidem or Stilnoct or zopiclon or Imovane).af. (24311) 5 1 or 2 or 3 or 4 (27190) 6 pregnancy/ or gravidity/ or exp labor, obstetric/ or exp parturition/ or exp pregnancy in adolescence/ or exp pregnancy, high-risk/ or exp pregnancy maintenance/ or exp pregnancy outcome/ or exp pregnancy, unplanned/ or exp pregnancy, unwanted/ (20932) 7 exp Prenatal Exposure/ (4379) 8 pregnan*.ti. (8182) 9 6 or 7 or 8 (26085) 10 5 and 9 (349) 11 exp congenital disorders/ or teratogens/ (5194) 12 exp prenatal development/ (5307) 13 ("birth defects" or "congenital malformations").ti,ab. (562) 14 (safe* or abnormalit*).ti,ab. (67515) 15 11 or 12 or 13 (10491) 16 5 and 15 (118) 17 10 and 14 (37) 18 16 or 17 (146) 19 Zoekfilter SR (5) 48 limit 47 to yr="1990 -Current" (5) – 4 uniek 49 limit 18 to yr="1990 -Current" (114) 50 limit 49 to (dutch or english) (107) 51 50 not 47 (103) – 99 uniek
(alprazolam:ab,ti OR xanax:ab,ti OR bromazepam:ab,ti OR chlordiazepoxide:ab,ti OR librium:ab,ti OR clobazam:ab,ti OR frisium:ab,ti OR chlorazepate:ab,ti OR tranxene:ab,ti OR diazepam:ab,ti OR stesolid:ab,ti OR lorazepam:ab,ti OR temesta:ab,ti OR oxazepam:ab,ti OR seresta:ab,ti OR prazepam:ab,ti OR reapam:ab,ti OR midazolam:ab,ti OR dormicum:ab,ti OR brotizolam:ab,ti OR lendormin:ab,ti OR flunitrazepam:ab,ti OR flurazepam:ab,ti OR dalmadorm:ab,ti OR loprazolam:ab,ti OR lormetazepam:ab,ti OR noctamid:ab,ti OR nitrazepam:ab,ti OR mogadon:ab,ti OR temazepam:ab,ti OR normison:ab,ti OR zolpidem:ab,ti OR stilnoct:ab,ti OR zopiclon:ab,ti OR imovane:ab,ti OR (anxiolytic NEAR/1 drug*):ab,ti OR 'anxiolytic agent'/exp/mj OR 'benzodiazepine derivative'/exp/mj OR 'anxiety disorder'/exp/mj/dm_dt) AND (safety:ab,ti OR abnormalities:ab,ti)) AND [embase]/lim AND ([dutch]/lim OR [english]/lim) AND [1980-2012]/py 4 SR, 446 divers : 2, 332 uniek Embase -116 referenties – 90 uniek |
1026
Plus aanvullende search 232 |