Schaalvergroting bij operatieve spoedingrepen
Uitgangsvraag
Leidt schaalvergroting tot verbetering van de uitkomst van operatieve spoedingrepen?
Aanbeveling
Overweeg om bij de organisatie van spoedingrepen afspraken te maken over de minimale volumina waarbij een adequate organisatie/ ketenzorg/ zorgpad kan worden opgesteld.
Zorg voor voldoende capaciteit indien naar een hoger volume van spoed ingrepen wordt gestreefd door bijvoorbeeld regionalisatie of differentiatie van zorg.
Overwegingen
Voor beantwoording van de vraag: Leidt schaalvergroting tot verbetering van de uitkomst van operatieve spoedingrepen? werden alleen artikelen gevonden met lage bewijskracht. Voor mortaliteit en complicaties bleken de gepoolde resultaten ten faveure van schaalvergroting niet significant. Vanwege het gebrek aan studies met voldoende bewijskracht is het naar de mening van de werkgroep dan ook niet mogelijk om bindende aanbevelingen te doen over volumina van spoedeisende zorg in het algemeen of op deelgebieden in het bijzonder.
Hoewel er mogelijk toch een kritische minimum volumenorm voor spoedeisende zorg is, wordt die niet overtuigend aangetoond. Belangrijk daarbij is, dat studies verschillende definities hanteren voor laag of hoog volume zorginstelling. Waar Takahashi als criterium voor laag volume een grens van meer of minder dan 28 ingrepen per jaar aanhoudt, gebruikt Franzo een volume norm van meer of minder dan 45 ingrepen. De studie van Franzo is overigens de enige die een nadelig effect laat zien van hoog volume acute zorg vergeleken met laag volume chirurgie. Mede vanwege de grote heterogeniteit van de studies blijft het onduidelijk wat een kritische ondergrens is voor acute zorg in het algemeen of voor specifieke ingrepen.
Naast een kritische ondergrens is het niet ondenkbaar dat er een kritische bovengrens grens is. Acute zorg legt beslag op vaak schaarse voorzieningen zoals operatiekamer en intensieve care faciliteiten. Bij de hoge volumina kunnen potentiele voordelen van centralisatie en concentratie wegvallen en omslaan in potentiele gevaren, bijvoorbeeld door gebrek aan capaciteit van operatiekamers en of intensive care bedden. Franzo vergeleek ziekenhuizen met minder dan 45 heupfractuur operaties met meer dan 400 en vond toegenomen mortaliteit bij de hoog-volume ziekenhuizen. Mogelijk is de kritische bovengrens overschreden en heeft schaarste aan mensen of middelen in de hoog volumina centra een nadelig effect gehad.
Al met al is een generieke volume norm voor spoedingrepen op grond van de huidige literatuur dus niet vast te stellen. In sommige richtlijnen zullen wellicht specifieke aantallen worden genoemd als minimum volume. Daarnaast zullen instellingen die acute ingrepen verrichten aan een aantal organisatorische voorwaarden moeten voldoen, zodat een goede ketenzorg kan worden gegarandeerd. Goede ketenzorg en zorgpaden zijn dus minstens even belangrijk als volumina, maar omgekeerd moet ook een redelijk volume worden behaald om deze zorg te kunnen bieden. Indien naar een hoger volume van spoed ingrepen wordt gestreefd door bijvoorbeeld regionalisatie of differentiatie dan moet er ook gezorgd worden voor voldoende capaciteit.
Onderbouwing
Achtergrond
Afspraken over de spoedeisende zorg in Nederland zijn onder andere vastgelegd in het “Hoofdlijnenakkoord medisch specialistische zorg 2011” tussen ziekenhuizen, zorgverzekeraars en het ministerie van VWS. Daarin werd afgesproken dat zorgaanbieders en zorgverzekeraars spreiding en specialisatie van ziekenhuis functies zullen bewerkstelligen daar waar dit vanuit het oogpunt van kwaliteit, doelmatigheid en innovatie wenselijk is. Daarnaast moet ongewenste praktijk variatie worden teruggedrongen. Voor diverse electieve ingrepen zijn daarom reeds volume normen afgesproken.
Ook bij spoedeisende ingrepen zou eenzelfde voordeel op basis van volume aanwezig kunnen zijn. Het draait daarbij niet alleen om het minimale volume aan operatieve ingrepen, maar ook om de efficiëntie van de gehele keten vanaf (zelf-)verwijzing tot en met de pre- en postoperatieve bewaking op IC, medium care of afdeling.
Bij de regionalisatie en concentratie van spoedzorg spelen deze volumenormen een belangrijke rol, maar staan nog steeds ter discussie. In de huidige situatie kunnen er dan ook discrepanties gevonden worden tussen het streven naar een optimale volumes en faciliteiten. Daarom is voor de richtlijn de vraag relevant: Is er een relatie tussen het volume van het aantal operatieve spoedingrepen en klinische uitkomst?
Conclusies / Summary of Findings
|
GRADE ZEER LAAG |
Er zijn aanwijzingen dat de mortaliteit voor operatieve spoed ingrepen in hoog-volume instellingen lager is dan in laag-volume.
Bronnen (Bell, 2015; Browne, 2009; Dimick, 2002; Franzo, 2005; Holt, 2007, Marx, 2011; Shah, 2005) |
|
GRADE ZEER LAAG |
Er is geen verschil in complicaties tussen hoog-volume instellingen en laag-volume instellingen als het gaat om operatieve spoed ingrepen.
Bronnen (Takahashi, 2011; Bell, 2015) |
|
GRADE ZEER LAAG |
Het lijkt dat de duur van de ziekenhuisopname voor patiënten met operatieve spoed ingrepen lager is in hoog-volume instellingen dan in laag-volume instellingen.
Bronnen (Takahashi, 2011; Shah, 2005) |
Samenvatting literatuur
Beschrijving studies
Acht studies zijn geschikt bevonden voor analyse middels GRADE (Dimick, 2002; Franzo, 2005; Shah, 2005; Holt, 2007; Browne, 2009; Marx, 2011; Takahashi, 2011; Bell, 2015;). Voor het analyseren van de literatuur worden de hoog-volume instellingen als interventie gezien en de laag-volume instellingen als de controlegroepen. De definitie van hoog-volume en laag-volume verschilde per gevonden studie en is apart vermeld. Dit heeft tot gevolg dat er in het algemeen geen hard onderscheid tussen hoog-volume en laag-volume instellingen gemaakt kan worden. Een andere beperking is dat in de geïncludeerde studies vaak de hoogste volumecategorie met de laagste volumecategorie is vergeleken, verwacht wordt dat de gevonden resultaten het meest extreme verschil representeren tussen hoog-volume en laag-volume. In enkele studies wordt het daadwerkelijke aantal ingrepen bij een bepaalde aandoening beschreven, in andere studies wordt het totale patiëntvolume van het gehele ziekenhuis gebruikt.
In het artikel van Takahasi uit 2011 worden patiënten beschreven die in verschillende categorieën ziekenhuizen zijn geopereerd aan een heupfractuur. Deze in Japan uitgevoerde case-control studie bevatte in totaal 8920 cases in 398 instellingen (6978 in interventiegroep, 1942 in controlegroep). Hoog-volume in de studie was gedefinieerd als ≥28 ingrepen per zes maanden, hetgeen neerkomt op ≥56 ingrepen per jaar, een laag-volume verricht <56 ingrepen per jaar. De gerapporteerde uitkomstmaten waren length of stay en complicaties. Length of stay was gedefinieerd als Length Of Postoperative Stay (LPOS), het aantal dagen van operatie tot ontslag van de afdeling. Deze binaire uitkomstmaat bestond uit twee categorieën, namelijk een kort verblijf (<26 dagen) en een lang verblijf (≥26 dagen). De uitkomstmaat complicaties was gedefinieerd als postoperatieve infecties zoals longontsteking, wondinfectie en urineweginfectie, ook de duur van de ziekenhuisopname is beschreven.
In een retrospectief cohort onderzocht Franzo in 2005 welke risicofactoren de postoperatieve mortaliteit na heupfracturen beïnvloeden. De studie is uitgevoerd in Italië en bevatte 6629 patiënten met een heupfractuur. De uitkomstmaat mortaliteit is in deze studie op vier verschillende momenten gemeten, te weten de in-hospital mortaliteit, één maand mortaliteit, zes maanden mortaliteit en één jaar mortaliteit. Voor het beantwoorden van de uitgangsvraag is gekeken naar de in-hospital mortaliteit. In het artikel zijn voor het volume vier verschillende niveaus gedefinieerd, er werd één gecorrigeerde OR gerapporteerd die de relatie tussen volume en in-hospital mortaliteit over alle klassen aangaf.
In een studie uit de VS (Browne, 2009) is gekeken naar patiënten met heupfracturen. Er zijn drie volume categorieën beschreven in de studie (<57 per jaar, 57 tot 132 per jaar, >132 per jaar). De gecorrigeerde OR is gerapporteerd voor de hoogste categorie versus de laagste categorie. De resultaten van meer dan 60.000 patiënten zijn meegenomen in de studie. In deze studie zijn de gecorrigeerde resultaten voor in-hospital mortaliteit gepresenteerd. Complicaties en duur van ziekenhuisopname zijn ook beschreven, echter zijn hier geen gecorrigeerde gegevens voor beschikbaar.
Een andere studie uit de VS (Shah, 2005) beschreef patiënten met heupfracturen. Hoog-volume was gedefinieerd als >62 ingrepen per jaar, de laagste volume categorie bestond uit instellingen met minder dan 19 ingrepen per jaar. De uitkomstmaten in-hospital mortaliteit en duur ziekenhuisopname waren beschreven.
In een retrospectief cohort uitgevoerd in de USA (Dimick, 2001) zijn aneurysma operaties beschreven. Er is gekeken naar de subpopulatie met geruptureerde aneurysmata om iets over de spoedsetting te kunnen zeggen. Hoog-volume instellingen waren ziekenhuizen met >30 procedures per jaar, laagvolume instellingen voerden ≤30 procedures per jaar uit. De beschreven uitkomstmaat is mortaliteit tijdens ziekenhuisopname en in totaal zijn 2032 patiënten in de studie beschreven. De duur van de ziekenhuisopname is ook beschreven, al is dat niet kwantitatief gedaan.
In de studie van Holt (2007) zijn twee relevante subpopulaties beschreven, namelijk patiënten met geruptureerde aneurysmata (AAA’s) en patiënten bij wie het aneurysma nog niet is geruptureerd, maar die wel een spoedingreep hebben ondergaan. In de eerste categorie is hoog-volume gedefinieerd als jaarlijks meer dan 13,2 patiënten opereren en laag-volume als minder dan 13,2 patiënten per jaar. Hoog-volume bij spoedingrepen voor ongeruptureerde aneurysmata is gedefinieerd als >12,2 patiënten per jaar versus laag-volume, minder dan 12,2 patiënten per jaar. Er waren gecorrigeerde uitkomstgegevens beschikbaar voor in-hospital mortaliteit.
In een recent retrospectief cohortonderzoek uit de VS (Bell, 2015) zijn traumacenters beschreven. Het verschil tussen hoog-volume en laag-volume was erg groot, >2165 patiënten per jaar versus <660 patiënten per jaar respectievelijk. Zowel complicaties als in-hospital mortaliteit zijn in dit artikel beschreven.
Een groot onderzoek uit de VS (Marx, 2011) beschreef de in-hospital mortaliteit onder traumapatiënten. Hoog-volume instellingen hadden 2000 of meer cases per jaar, laag-volume instellingen minder dan 2000 cases per jaar.
Resultaten
Mortaliteit
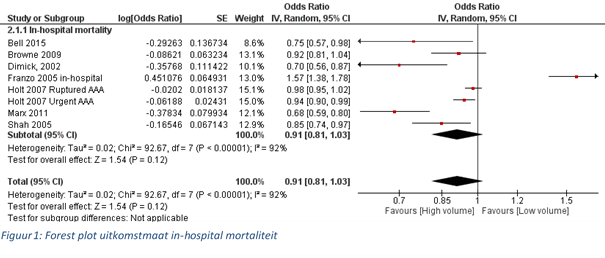
De uitkomstmaat in-hospital mortaliteit is in zeven studies (Bell, 2015; Browne, 2009; Dimick, 2002; Franzo, 2005; Holt, 2007, Marx, 2011; Shah, 2005) op een bruikbare wijze beschreven (gecorrigeerde data). De studie van Holt is om eerdergenoemde redenen tweemaal opgenomen in de meta-analyse. Poolen van de resultaten uit de studies leverde een gecorrigeerde odds ratio van 0,91 [95% CI 0,81 tot 1,03] op, met een hoge mate van heterogeniteit (I2 92%) (Figuur 1).
Dit resultaat is ten faveure van de interventiegroep maar is niet significant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat in-hospital mortaliteit is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet, hoge mate van heterogeniteit en definitieverschillen op het gebied van volume categorieën en op het gebied van interventies; Uitgangspositie van de bewijskracht was vanwege het observationele design LAAG. De uiteindelijke bewijskracht voor deze vraag komt uit op ZEER LAAG.
Figuur 1 Forest plot uitkomstmaat in hospital mortaliteit
Complicaties
De uitkomstmaat complicaties is in twee studies op een bruikbare wijze (gecorrigeerde gegevens) beschreven (Takahashi, 2011; Bell, 2015). De definitie van de uitkomstmaat verschilde echter per studie. In Takahashi werden infective complications beschreven en Bell beschreef major complications, daaronder vielen respiratoire en cardiovasculaire complicaties. De gepoolde gecorrigeerde odds ratio was 0,79 [95% CI 0,60 tot 1,04). Dit resultaat is ten faveure van de interventie, echter is dit niet statistisch significant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties is met één niveau verlaagd gezien de verschillen op het gebied van volume categorieën en de definitie van complicaties tussen de studies (indirectheid), daarnaast valt het nul-effect (OR 1,0) binnen het betrouwbaarheidsinterval.
Uitgangspositie van de bewijskracht was vanwege het observationele design LAAG. De uiteindelijke bewijskracht voor deze vraag komt uit op ZEER LAAG.
Duur ziekenhuisopname
Gecorrigeerde gegevens voor de uitkomstmaat duur ziekenhuisopname is slechts in twee studies beschreven (Takahashi, 2011; Shah, 2005). Poolen van deze leidde tot een gecorrigeerde odds ratio van 0,70 [95% CI 0,62 tot 0,78], wat zou betekenen dat in hoog-volume instellingen de duur van de ziekenhuisopname korter is dan in laag-volume instellingen. Echter gaat deze conclusie gepaard met veel onzekerheid.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat duur ziekenhuisopname is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet en indirectheid tussen de studies. Uitgangspositie van de bewijskracht was vanwege het observationele design LAAG. De uiteindelijke bewijskracht voor deze vraag komt uit op ZEER LAAG.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende vraagstelling:
Verschillen de klinische uitkomsten van operatieve spoedingrepen in instellingen met een hoog-volume van dergelijke ingrepen van de uitkomsten in instellingen met een laag-volume?
Relevante uitkomstmaten
De werkgroep achtte in-patient mortaliteit, complicaties en duur ziekenhuisopname voor de besluitvorming kritieke uitkomstmaten.
In-patient mortaliteit is gedefinieerd als mortaliteit tijdens ziekenhuisopname na spoedoperatie.
De werkgroep definieerde de overige uitkomsten niet a priori, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de database Medline (OVID) is met relevante zoektermen gezocht naar studies die gekeken hebben naar de relatie van het volume aan operatieve spoedingrepen en de klinische uitkomst van de patiënten. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 758 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- primair vergelijkend onderzoek;
- studiedesign RCT of observationeel onderzoek;
- gepubliceerd tussen 2000 en 2015;
- full-tekst artikel beschikbaar in het Engels of Nederlands;
- beschrijving van volume per instelling;
- beschrijving van acute operatieve ingrepen;
- beschrijven van de vastgestelde uitkomstmaten;
- beschrijving van gecorrigeerde data.
Op basis van titel en abstract werden in eerste instantie tien studies voorgeselecteerd. Na het doornemen van de literatuurverwijzingen werden daar nog vier studies aan toegevoegd. Uiteindelijk zijn er na het bestuderen van de full-tekst artikelen vervolgens zes studies geëxcludeerd (zie exclusietabel), en acht studies definitief geselecteerd.
Resultaten
Acht onderzoeken zijn opgenomen in de literatuuranalyse. De evidence-tabellen hiervan en beoordeling van individuele studiekwaliteit kunt u in onder het tabblad Onderbouwing vinden.
Referenties
- Caputo LM, Salottolo KM, Slone DS, et al. The relationship between patient volume and mortality in American trauma centres: a systematic review of the evidence. Injury. 2014;45(3):478-86.
- Dueck AD, Kucey DS, Johnston KW, et al. Survival after ruptured abdominal aortic aneurysm: effect of patient, surgeon, and hospital factors. J Vasc Surg. 2004;39(6):1253-60
- Franzo A, Francescutti C, Simon G. Risk factors correlated with post-operative mortality for hip fracture surgery in the elderly: a population-based approach. Eur J Epidemiol. 2005;20(12):985-91.
- Kim YJ. Relationship of trauma centre characteristics and patient outcomes: a systematic review. J Clin Nurs. 2014;23(3-4):301-14. AIMS AND OBJECTIVES: To systematically review the relationship of trauma centre characteristics and trauma patient outcomes.
- MacKenzie EJ, Rivara FP, Jurkovich GJ, et al. A national evaluation of the effect of trauma-center care on mortality. N Engl J Med. 2006;354(4):366-78. PubMed PMID:16436768.
- Phatak UR, Chan WM, Lew DF, et al. Is nighttime the right time? Risk of complications after laparoscopic cholecystectomy at night. J Am Coll Surg. 2014;219(4):718-24.
- Seule MA, Stienen MN, Gautschi OP, et al. Surgical treatment of unruptured intracranial aneurysms in a low-volume hospital--outcome and review of literature. Clin Neurol Neurosurg. 2012;114(6):668-72.
- Takahashi C, Fushimi K, Matsuda S. Factors associated with a protracted hospital stay after hip fracture surgery in Japan. Geriatr Gerontol Int. 2011;11(4):474-81.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Takahashi, 2011 |
Type of study: Case-control
Setting: Multi-center
Country: Japan
Funding: Work was supported in part by Grants-in-Aid for Research on Policy Planning and Evaluation, from the Ministry of Health, Labor and Welfare, Japan. |
Inclusion criteria: 65 years or older; a primary diagnosis of femoral neck fracture; undergone open reduction and fixation or femoral head replacement.
Exclusion criteria: Previously undergone hip fracture surgery or surgery for any other condition; bilateral hip fractures, total joint arthroplasty or a fatal hospital outcome; number of days from surgery to the start of rehabilitation was 8 or more because of a serious physical status after surgery.
N total at baseline: Intervention: 6978 (78%) Control: 1942 (22%)
|
Describe intervention:
Femoral neck surgery in a high volume hospital. High volume was defined as ≥28 patients in 6 months. Equals ≥56 patients annually
|
Describe control:
Femoral neck surgery in a low volume hospital. Low volume was defined as <28 patients in 6 months. Equals <56 patients annually
|
Length of follow-up: 6 months
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure Length of postoperative hospital stay: defined as short <26 days or long ≥26 days.
Non-adjusted chi2-Test OR: 0.53 0.48–0.59 <0.001*
Adjusted chi2-Test OR: 0.65 0.58–0.72 <0.001* In favour of high volume, low is control)
Outcome infective complications Adjusted OR: 0.79 0.59–1.06 p=0.12 In favour of high volume, low is control) |
Low is reference |
|
Franzo, 2005 |
Type of study: Retrospective cohort
Setting: Multi-center
Country: Italy
Funding: The study was financed by Agenzia Regionale della Sanita` of Friuli Venezia Giulia Region – Italy as partof the institutional research activity. |
Inclusion criteria: Patients aged 65 and over admitted to Friuli Venezia Giulia regional hospitals between 1996 and 2000 with a main diagnosis of hip fracture and surgically treated for hip replacement orinternal fixation.
Exclusion criteria: Patients with a malignant neoplasm diagnosis (made during hospitalization for hip fracture or in the year before) were excluded. In case of multiple hip fracture episodes only the first one was included. Patients with a previous hip fracture or hip replacement were also excluded.
N total at baseline: Intervention: 3243 Control: 3386
The total number of hip fracture surgery treatments performed by each hospital was grouped in four classes. I Low volume: <46 a year II Median volume 46 – 200 a year III High volume 201 – 400 IV Very High volume >401 a year
Data is used to comprise a low volume group (≤200 annually) and a high volume group (>201 annually) |
Describe intervention:
Femoral neck surgery in high volume centers (>400 operations annually)
|
Describe control:
Femoral neck surgery in low centers (≤46 operations annually)
|
Length of follow-up: 12 months
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size (include 95%CI and p-value if available): In-hospital mortality I: 237/3243 C:122/ 3386
OR 1,57 (1,38-1,78) In favour of low volume, low volume is control
1 month mortality I: 364/ 3243 C:270/ 3386
OR 1,26 (1,20-1,33) In favour of low volume, low volume is control
6 months mortality rate I:732 /3243 C: 594/3386
OR: 1,23 (1,16-1,31) In favour of low volume, low volume is control
|
|
|
Dimick, 2002 |
Type of study: Retrospective cohort
Setting: Registry
Country: USA
Source of funding: Not mentioned |
Inclusion criteria: - Patients with an AAA; - Treated in 1996 and 1997
Exclusion criteria: - Aged <40 years; - Diagnosed with injury of blood vessel
N total at baseline: Intervention: 813 Control: 1219
|
Describe intervention: High Volume Hospitals >30 procedures
Both Ruptured Aneurysm Repairs
|
Describe control: Low Volume Hospitals <30 procedures
Ruptured Aneurysm Repairs
|
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: 11% contained missing data, not specified.
|
Outcome measures and effect size:
In-hospital death rate I: 357/841 (42,4%) C:618/1246 (49,6)
Adjusted OR: 1,43 (1,15-1,78) In favour of high volume, high volume is control.
Flipped rate (low-volume is control): 0,6993 (0,5618 – 0,8695)
LOS Not different |
|
|
Murata 2010 |
Type of study: Retrospective cohort
Setting: Multicenter
Country: Japan
Source of funding: Grants-in-Aid for Research on Policy Planning and Evaluation from the Ministry of Health, Labour and Welfare, Japan |
Inclusion criteria: - Patients treated with endoscopic biliary drainage for acute cholangitis; - Between apr – dec 2008. Exclusion criteria: Not mentioned
N total at baseline: Intervention: 2840 Control: 5858 LOW: 2941 Medium: 2917
Important prognostic factors2: age ± SD: I: 72,4 ± 13,3 C: 74 P<0,001
Sex: I: 59% M C: 57% M |
Describe intervention:
High volume >32 cases during study period
|
Describe control:
Low volume <16 cases Medium = 16 – 32 cases |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Drainage related complications I: 91/2840 C:290/5858
Adjusted OR: Low versus medium: 0,764 (0,604-0,965) Low versus High: 0,561 (0,434-0,725)
LOS I: 19,7 ± 17,2 HIGH C:26,8 ± 22,6 LOW Significant p<0,001 |
Low volume is reference, no comparison between low+intermediate versus high |
|
Browne 2009 |
Type of study: Retrospective cohort
Setting: Multicenter
Country: USA
Source of funding: Not mentioned |
Inclusion criteria: - aged >55 years; - Femoral neck fractures or intertrochanteric fractures; - Who received internal fixation, THP, hemiarthroplasty or open reduction.
Exclusion criteria: - Pathologic fractures;
N total at baseline: Intervention: 32522 Control: 32649 + 32723 = 65372
Important prognostic factors2: Not specified.
Groups comparable at baseline?
The total number of hip fracture surgery treatments performed by each hospital was grouped in three classes. Low volume <57 cases/yr Moderate volume 57-132 cases/yr High volume >132 cases/yr
Data is used to comprise a low volume group (≤132 annually) and a high volume group (>132 annually)
|
Describe intervention:
High volume >132 cases annually. |
Describe control:
Low volume ≤57 annually
|
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
In-Hospital Mortality I: 936/32522 C: 1880/65372
Adjusted OR: High versus low: 1,09 (0,96 – 1,23) Flipped rate (low-volume is control): 0,9174 (0,8130 – 1,0417
High versus medium: 1,05 (0,93-1,18)
In favour of high volume, High is control.
Complications (post-op infection, pneumonia, decubitus ulcer, implant failure) I: 1627/32522 C: 3746/65372
LOS: in favour of high volume, not further specified. |
Highest is reference, no comparison between highest versus low+medium |
|
Bell, 2015 |
Type of study: Retrospective cohort
Setting: Database inquiry
Country: USA
Source of funding: |
Inclusion criteria: - between the ages of 18 and 64; - ISS of 9 or greater;
Exclusion criteria: - admitted because of poisoning, drowning, burns, suffocation, overexertion, and environmental causes; - dead on arrival, died in the emergency department, or had a length of stay <2 d.
N total at baseline: Intervention: 339518 Control: 15839
Important prognostic factors2: age ± SD: I:40 ± 14 C: 81,8 ± 14,3
Sex: I: 73% M C: 70% M
Groups comparable at baseline.
|
Describe intervention:
Highest >2165 patients a year
|
Describe control:
Lowest <660 patients a year
|
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Major complications I:33515/339518 C:1569/15839 Adjusted OR: highest is reference High: 1,00 (0,69-1,45) Medium: 0,91 (0,61-1,35) Low 1,03 (0,61-1,66)
Lowest: 1,26 (0,78-2,04)
Flipped rate (low-volume is control): 0,7936 (0,4901 – 1,2820)
Mortality I:10131/339518 C:665/15839
Adjusted OR: highest is reference High: 1,05 (0,89-1,24) Medium: 1,09 (0,90-1,32) Low: 1,14 (0,90 – 1,45)
Lowest 1,34 (1,03-1,76)
Flipped rate (low-volume is control): 0,7463 (0,568 – 0,9708 |
OR’s niet voor subgroepen versus hoog volume |
|
Holt, 2007 |
Type of study: Retrospective cohort
Setting: Database inquiry
Country: UK
Source of funding: Not mentioned |
Inclusion criteria: - infrarenal AAA repair; - urgent or ruptured;
Exclusion criteria: -
Comparison A Urgent surgery N total at baseline: Intervention: 960 Control:3885
Important prognostic factors2: age : I:71,3 C:72,0
Sex: I: 79,5% M C: 80,2% M
Comparison B rupture surgery N total at baseline: Intervention: 1353 Control:5109
Important prognostic factors2: age: I:73,9 C:73,6
Sex: I: 83,3% M C: 83,7% M
Groups comparable at baseline?
|
Describe intervention:
Comparison A >12,2 annually urgent
Comparison B >13,2 annually rupture |
Describe control:
Comparison A ≤12,2 annually urgent
Comparison B ≤13,2 annually rupture
|
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: 0,7 %, not further specified
|
Outcome measures and effect size:
Comparison A In-patient mortality rates I:227/960 C:916/3885
Adjusted OR: 0,94 (0,90-0,99) in favour of high volume, low volume is control
Complication rate I:336/960 C:1367/3885
No adjusted rates
LOS Longer for high volume (p=0,041)
Comparison B In-patient mortality rates I:573/1353 C:2129/5109
Adjusted OR:0,98 (0,95-1,02)
in favour of high volume, low volume is control
Complication rate I:500/1353 C:1954/5109
No adjusted rates
LOS NS difference. |
OR’s niet voor laag versus hoog volume |
|
Marx, 2011 |
Type of study: Retrospective cohort
Setting: Database inquiry
Country: USA
Source of funding: Not mentioned |
Inclusion criteria: - aged 13 years or older; - mechanism of injury classified as motor vehicle crash, low fall, other blunt, stab wound, or gunshot wound;
Exclusion criteria: -
N total at baseline: Intervention: 25302 Control:27536
Important prognostic factors2: age ± SD: I:46,2 ± 22,8 C:48,4 ± 23,4
Sex: I: 68% M C: 68% M
Groups comparable at baseline. |
Describe intervention:
Level I hospital annual volume ≥2000 cases
|
Describe control:
Level I hospital annual volume <2000 cases
|
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Inpatient-mortality I:1798/25302 C:1915/27536
Adjusted OR 1,46 (1,25-1,71) In favour of high volume, high volume is control 1,00.
Flipped rate (low-volume is control): 0,685 (0,5848 – 0,8
|
|
|
Shah, 2005 |
Type of study: Retrospective cohort
Setting: Database inquiry: Nationwide Inpatient Sample (NIS)
Country: USA
Source of funding: No benefits or funds were received in support of this study. |
Inclusion criteria: - diagnosis of femoral neck fracture; - undergoing hemiarthroplasty;
Exclusion criteria: - none mentioned;
N total at baseline: Intervention: 49621 Control:123887
Important prognostic factors2: Not possible to assess
|
Describe intervention:
≥62 procedures annually
|
Describe control:
<62 procedures annually |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
In-Hospital mortality I:1439/49621 C:3980/123887
Adjusted OR 1,18 (1,03 – 1,34) in favour of high volume, high volume is control.
Flipped rate (low-volume is control): 0,8475 (0,7463 – 0,971
Prolonged LOS I: 8684/49621 C:28268/123887
Adjusted OR 1,37 (1,29 – 1,45) in favour of high volume, high volume is control.
Flipped rate (low-volume is control): 0,7299 (0,6897 – 0,7751 |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Takahashi, 2011 |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Franzo, 2005 |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Dimick 2002 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Murata 2010 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Browne, 2009 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Bell, 2015 |
Unlikely |
Unlikely |
Unclear |
Unlikely |
|
Holt, 2007 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Marx, 2011 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Shah, 2005 |
Unlikely |
Unlikely |
Unclear |
Unclear |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-05-2018
Beoordeeld op geldigheid : 04-09-2024
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. De werkgroep beoordeelt jaarlijks of modules of andere onderdelen van de richtlijn aan herziening toe zijn. De werkgroep valt onder de NVvH. Als onderdeel van deze richtlijn zijn door de werkgroep spoedlijst opgesteld die door de wetenschappelijke verenigingen geaccordeerd en onderhouden moet worden.
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In samenwerking met:
- Landelijke Vereniging van Operatieassistenten
- Stichting Kind en Ziekenhuis
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft tijdens het ontwikkelproces op geen enkele wijze invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van deze richtlijn is om een landelijk uniform classificatiesysteem vast te stellen voor het prioriteren van acute operaties en interventies waarbij een anesthesieteam, een medisch specialist en ondersteunend personeel aanwezig moeten zijn. In dit systeem kunnen wetenschappelijke verenigingen de prioriteit aangeven van (hun) specifieke ingrepen. Het beoogde effect van de richtlijn is dat transparanter wordt wat een acceptabele wachttijd is voor een acute ingreep door het proces rondom spoedoperaties duidelijker te beschrijven. Deze transparantie geldt voor zorgverleners, zorginstellingen en patiënten. Daarnaast wordt geprobeerd om de randvoorwaarden te beschrijven met betrekking tot de organisatie en communicatie rondom deze ingrepen.
Doelgroep
Alle leden van de beroepsgroepen die betrokken zijn bij de spoedzorg voor patiënten die een behandeling met anesthesiologische begeleiding of bewaking moeten ondergaan. Indien een spoed-patiënt op een electieve plaats wordt gezet dan kan electieve patiënt daar hinder van ondervinden.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2013 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een indicatie voor een acute interventie waarbij gebruik wordt gemaakt van tenminste een anesthesioloog, een ondersteunend/ assisterend team en een tweede medisch specialist (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. P.H.W. Lubbert, chirurg, werkzaam in ziekenhuis de Tjongerschans, Heereveen, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Drs. L.F.M. Beenen, radioloog, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Radiologie
- Drs. J.H.J.M. Bessems, orthopedisch chirurg, werkzaam in het Erasmus MC, Rotterdam, Nederlandse Orthopaedische Vereniging
- Prof. dr. M.A. Boermeester, gastro-intestinale / oncologisch chirurg, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Heelkunde
- Dr. L. Dubois, MKA-chirurg, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Dr. K.H. Kho, neurochirurg, Medisch Spectrum Twente, Enschede, Nederlandse Vereniging voor Neurochirurgie
- Dr. S.V. Koenen, gynaecoloog, werkzaam in het Universitair Medisch Centrum Utrecht, Nederlandse Vereniging voor Obstetrie Gynaecologie
- Dr. B. van Minnen, MKA-chirurg, werkzaam in het Universitair Medisch Centrum, Groningen, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- H. Rippen, patiëntvertegenwoordiger, Stichting Kind en Ziekenhuis, Utrecht
- Drs. A. Schuurhuis, anesthesioloog/intensivist, werkzaam in het Universitair Medisch Centrum Utrecht, Nederlandse Vereniging voor Anesthesiologie
- Dr. G.J.M.W. van Thiel, medisch ethicus, werkzaam in het Universiteit Medisch Centrum, Utrecht
Subgroep
- N. Dreessen, bestuurslid LVO, werkzaam in het Zuyderland Medisch Centrum, Landelijke Vereniging van Operatieassistenten
- drs. B.C. Jacod, gynaecoloog i.o., werkzaam in het Universitair Medisch Centrum, Utrecht, Nederlandse Vereniging voor Obstetrie Gynaecologie
- drs. A. Janse, klinisch geriater, werkzaam in Ziekenhuis Gelderse Vallei, Ede, Nederlandse Vereniging voor Klinische Geriatrie
- B.D.D. van Loo, anesthesiemedewerker, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging van Anesthesie-Medewerkers
- Dr. B.M.P. Rademaker, anesthesioloog, werkzaam in het OLVG, Amsterdam, Nederlandse Vereniging voor Anesthesiologie
- drs. E.M. Verhoog, SEH-arts, werkzaam in Tergooi Ziekenhuizen, Blaricum, Nederlandse Vereniging van Spoedeisende Hulp Artsen
- F. Wienen, operatieassistent, werkzaam in Isala Klinieken, Zwolle, Landelijke Vereniging van Operatieassistenten
Met ondersteuning van:
- Ir. T.A. van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- A.A. Lamberts MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- M.E. Wessels MSc, literatuurspecialiste, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Met dank aan:
- S. van Dijk MSc, arts-onderzoeker chirurgie, afdeling Chirurgie, Academisch Medisch Centrum, Amsterdam
- N.W. de Cort, student geneeskunde, Faculty of Health, Medicine and Life Science, Maastricht Universiteit, Maastricht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar directe financiële (betrekking commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de bijlage van deze richtlijn. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten. De belangen zijn bij aanvang van het project geïnventariseerd bij de leden van de werkgroep. De leden van de werkgroep is gevraagd gedurende het ontwikkeltraject wijzigingen in de belangen te melden bij de ondersteuners. Aan het eind van het ontwikkeltraject zijn de belangen nogmaals plenair besproken.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Boermeester |
|
|
|
|
|
|
|
|
|
Beenen |
Radioloog, afgevaardigde NVvR |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Bessems |
Orthopedisch chirurg |
Docent Hogeschool Rotterdam, Docent Albeda College Rotterdam (Beiden uurvergoeding (EUR 500,00 per jaar)). |
geen |
geen |
Lid medische adviesraad vereniging aangeboren heupafwijkingen |
geen |
geen |
geen |
|
Dubois |
MKA chirug AMC Amsterdam (betaald) MKA chirug Antonius ziekenhuis (betaald) |
Secretaris stichting Bridge the Gap-> (onbetaald) Richtlijnontwikkeling NVMKA mbt aangezichtstraumatologie -> (onbetaald) docent na bijscholing (AO Foundation/SORG/ACTA/NVT/CCO) -> (onbetaald) Vereniging Medisch Tandheelkundige interactie, oud voorzitter, adviserend -> (onbetaald) |
geen |
geen |
geen |
ontwikkeling orbita implantaat via KLS Martin; geen belangenverstrengeling met oop op de richtlijn. |
zie geen reden tot belangenverstrengeling, enkel bijzondere aandacht voor orbitachirurgie met ontwikkeling in 3D software planning, patientspecifieke oplossingen en implantaten; zie extra gefinancieerd onderzoek. |
geen |
|
Kho |
Neurochirug |
geen |
nvt |
nvt |
nvt |
geen |
nvt |
neen |
|
Koenen |
Gynaecoloog / periatoloog UMC Utrecht |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Lubbert |
Chirurg |
geen |
geen |
echtgenote cardioloog |
lid van commissie patient veiligheid Ned Vereniging voor Heelkunde |
geen |
geen eigendom van patent of product. Proefschrift gericht op kwaliteit in patientenzorg. Derhalve geinteresseerd in veiligheid en kwaliteit. |
geen |
|
van Minnen |
Kaakchirurg, chef de clinique, UMC Groningen |
Bestuurslid vereniging Regiotafel Antistolling Gronigen, overlegorgaan om de (perioperatieve) zorg rond geantistolde patient in de regio te organiseren. (onbezoldigd) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Rippen |
Directeur Stichting Kind en Ziekenhuis |
Bestuurslid Onbeperkt aan de slag – ontbetaald Bestuurslid Vereniging van Ehlers-Danlos patienten - onbetaald Feelance projectadviseur/consultant - diverse belangenbehartigings-organisaties en soms zorgorganisaties - betaald per opdracht |
geen |
geen |
geen |
geen |
geen |
geen |
|
Schuurhuis |
Anethesioloog in het UMCU |
Voorzitter commisie Richtlijnen en Indicatoren NVA (vacatiegeld voor vergaderingen) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van Thiel |
UD Medisch Ethiek / UMC Utrecht div. Julius Centrum |
Plv lid - ethicus VCMO (een erkende METC) betaald |
geen |
geen |
geen |
Geen belangen die relevant zijn voor dit onderzoek. |
geen |
geen |
|
Lamberts |
Adviseur Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
van Barneveld |
Directeur Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
|
|
|
|
|
|
|
|
|
|
Subwerkgroep |
||||||||
|
Dreessen |
Operatieassistent |
Bestuurslid LVO (onbetaald) |
geen |
geen |
Erkenning beroep operatieassistent |
geen |
geen |
geen |
|
Janse |
Klinisch Geriater |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Jacod |
AIOS Gynaecologie UMC Utrecht |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Rademaker |
subwerkgroep 'Medisch inhoudelijk'. |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Verhoog |
SEH-arts Ter Gooi Eigen bedrijf, eenmanszaak, partime Auxilium primum; lesgeven, trainingen, waarneming binnen (acute) geneeskunde (betaald) |
geen |
geen |
geen |
Richtlijne-commissie NVSHA |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Inbreng van het patiëntenperspectief werd gewaarborgd door een afgevaardigde van een landelijke patiëntenvereniging in de werkgroep op te nemen en uitgangsvragen op te stellen specifiek over voor de patiënt relevante onderwerpen. Tijdens de oriënterende zoekactie werd er specifiek gezocht naar literatuur over het patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is voor commentaar voorgelegd aan Kind en Ziekenhuis, de Patiëntenfederatie Nederland en Zorgbelang Nederland. Vanwege de te verwachten ethische dilemma’s in de richtlijn die gepaard gaan met het verdelen van schaarse middelen en tijd in de gezondheidszorg heeft er een medisch ethicus zitting gehad in de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is nadrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatiemodule is te vinden bij de aanverwante producten.
Werkwijze
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijn voor richtlijnen’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor de kritieke en belangrijke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, systematische reviews (Medline (OVID)), en literatuur over patiëntvoorkeuren (patiëntenperspectief; Medline (OVID)). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (Risk of Bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals criteria die van invloed zijn op de aanbeveling, de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn is er een interne kwaliteitsindicator ontwikkeld om het toepassen het classificatiesysteem van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de module Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers M, Kho ME, Browman GP, et al. for the AGREE Next Steps Consortium. AGREE II: Advancing guideline development, reporting and evaluation in healthcare. Can Med Assoc J. 2010; 182:E839-842; doi:10.1503/090449.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Link: https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from www.guidelinedevelopment.org/handbook.
Schünemann HJ, Oxman AD, Brozek J, et al.; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. Erratum in: BMJ. 2008;336(7654).
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
|
5 exp specialties, surgical/ or colorectal surgery/ or general surgery/ or neurosurgery/ or orthopedics/ or traumatology/ or "Anesthesiology"/ or exp surgical procedures, operative/ or gynecologic surgical procedures/ or exp "dilatation and curettage"/ or uterine artery embolization/ or obstetric surgical procedures/ or exp delivery, obstetric/ or angioplasty, balloon, coronary/ or exp percutaneous coronary intervention/ or "Heart Defects, Congenital"/su or Appendectomy/ or Appendicitis/su or exp "Wounds and Injuries"/ or (injur* or trauma* or wound* or emergen*).ti. (3269775) 6 ((Emergen* or acute or urgent* or nocturnal or unplanned or night or trauma or non-elective*) adj3 (surger* or operation* or procedure*)).ti,ab. or "Emergency Treatment"/ or (Emergency or acute or urgent* or nocturnal or unplanned or night or trauma or non-elective*).ti. or Appendectomy/ or Appendicitis/su or Appendicitis/su or exp Aneurysm/su or Cesarean Section/ or exp Hip Fractures/su (624452) 7 5 and 6 (289709) 10 ((high* or large* or low* or medium or unit* or hospital* of surgery or department* or clinic*) adj3 volume*).ti,ab,kw. (59440) 12 7 and 10 (1684) 13 limit 12 to yr="2000 -Current" (1395) 14 11 and 13 (55) 15 13 not (h?emofiltration or tidal or PEEP).ti. (1305) 16 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (227308) 17 15 and 16 (46) 18 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1419681) 19 15 and 18 (270) 20 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective.tw. or prospective.tw. (1888223) 21 15 and 20 (558) 22 (high and volume and surgery).ti. (85) 23 (volume and ("hip fracture*" or appendic* or aneurysm or cesarian)).ti. (142) 24 22 or 23 (226) 25 16 and 24 (4) 26 18 and 24 (28) 27 20 and 24 (89) 28 17 or 25 (46) – SR - 45 uniek 29 19 or 26 (296) - vanaf 2000 (293) 30 21 or 27 (637) vanaf 2000 (625) 31 29 not 28 (272) – RCT – 269 uniek 32 30 not (28 or 29) (452) =- observationele studies. – 444 uniek |
758 |
In- en exclusietabel
|
Art. nr. |
Auteur, jaartal |
Inclusie/ Exclusie |
Toelichting |
|
Alle designs |
|
|
|
|
SR15 |
Seule 2012 |
Exclusie |
Geen geadjusteerde uitkomsten |
|
R250 |
Dimick 2002 |
Inclusie |
|
|
R258 |
Nathens, 2001 |
Exclusie |
Geen geadjusteerde uitkomsten |
|
O162 |
Takahashi 2011 |
Inclusie |
|
|
O216 |
Murata 2010 |
Inclusie |
|
|
O267 |
Browne, 2009 |
Inclusie |
|
|
O343 |
Greco, 2006 |
Exclusie |
Exclusie: niet juiste data voor analyse. |
|
O344 |
Freeman 2006 |
Exclusie |
Exclusie: niet juiste data voor analyse. |
|
O367 |
Franzo 2005 |
Inclusie |
|
|
O385 |
Glance 2004 |
Exclusie |
Geen geadjusteerde uitkomsten |
|
X |
Bell 2015 |
Inclusie |
Gepubliceerd kort na uitvoeren literatuursearch, alsnog toegevoegd. |
|
X |
Holt 2007 |
Inclusie |
|
|
X |
Marx 2011 |
Inclusie |
|
|
X |
Shah 2005 |
Inclusie |
|
