Opname-/operatietijd proximale femurfractuur
Uitgangsvraag
Wat is de optimale tijd tussen opname en operatie voor een proximale femurfractuur rekening houdend met patiëntfactoren, logistieke factoren en patiëntveiligheid?
Aanbeveling
Opereer een proximale femurfractuur tijdens de dag van opname, of tijdens de volgende kalenderdag na opname
Research aanbeveling
Wat is de klinische en kosteneffectiviteit van operatie binnen 36 of 48 uur na opname vergeleken met chirurgie later dan 36 of 48 uur na opname voor mortaliteit, morbiditeit en kwaliteit van leven parameters in patiënten met een proximale femurfractuur?
Overwegingen
De werkgroep acht het uit ethisch oogpunt belangrijk om alle middelen om vertraging te vermijden prioriteit te geven. Chirurgie is de beste vorm van pijnstilling en zeker voor de kwetsbare oudere is het nauwelijks acceptabel meer dan één nacht in het ziekenhuis door te brengen zonder operatieve behandeling van een proximale femurfractuur. Uitstel van chirurgie leidt tot een mogelijk verhoogd risico op complicaties, verlenging van pijn en herhaaldelijk nuchter zijn. De gekozen literatuur uitkomsten mortaliteit, complicaties en opnameduur werden beschouwd als parallelle uitkomstindicatoren van zorg. De literatuur vermeldt geen voordeel bij uitstel van zorg.
Het huidige niveau van bewijs over tijd tot operatie is laag. De verklaring hiervoor is dat alle studies tot nu toe retrospectief observationeel van aard zijn, aangezien het onethisch is om meer en niet noodzakelijke vertraging in te voeren voor gerandomiseerde studie. Om vertraging te vermijden, comfort en service naar de patiënt en familie toe te verhogen wordt in de laatste jaren door een toenemend aantal instellingen tijd gereserveerd overdag op bestaande electieve operatiekamers of acute operatiekamers. Hierin ligt ook de ratio dat dergelijke sessies worden bemand of gesuperviseerd door senior anesthesisten en chirurgen met een dedicated OK-team.
De gevonden literatuur bevat geen duidelijke arbitraire of pragmatische tijdspanne van opname tot operatie binnen de periode van 48 uur na opname. Dit hangt mede af van de individuele setting waarbinnen een patiënt opgenomen wordt en eventuele optimalisatie die nodig is. Derhalve onthoudt de richtlijncommissie zich van een exacte aanbeveling over de tijdspanne tussen opname en operatie.
Een operatie op de dag van opname of tijdens de kalenderdag volgend op de dag van opname maakt optimalisatie en adequate planning mogelijk. Het geeft verder de mogelijkheid om patiënten te plannen op de door de organisatie vastgestelde tijdstippen en de mogelijkheid om te gaan met de het andere acute aanbod op het operatiekamercomplex.
De bewijskracht van de literatuur is na GRADE-analyse laag, maar het aggregaat van bewijs ondersteunt het vermijden van chirurgische vertraging. In het verwoorden van de aanbeveling is hierdoor ook een deel consensusmening van de werkgroep opgenomen, welke ook een ethische grondslag bevat. Deze consensus was unaniem binnen de richtlijnwerkgroep.
De literatuur heeft nog geen specifiek tijdsinterval geïdentificeerd waarbinnen minder vertraging tot operatie beter is voor de gekozen uitkomsten. De huidige ethische, pragmatische en organisatorische overwegingen hebben geleid tot de huidige aanbeveling. Er is behoefte het effect van een dergelijke arbitraire aanbeveling te onderzoeken. Drempels van 36 of 48 uur kunnen worden gekozen. Kosteneffectiviteit, terugkeer van functie, arbeidshervatting, revalidatieduur en terugkeer naar huis kunnen naast de gekozen uitkomstmaten worden geanalyseerd. Om ethische redenen is een prospectief cohortonderzoek te verkiezen met confounding variabelen correctie. De in 2016 te starten Dutch Hip Fracture Audit (DHFA) is hiervoor een waardevolle database.
Onderbouwing
Achtergrond
De tijd tussen opname en operatie van patiënten met een proximale femurfractuur vereist een optimale multidisciplinaire coördinatie tussen de SEH, de traumachirurgie of orthopedie, geriatrie of interne ouderengeneeskunde, de anesthesie, eventuele consulenten preoperatief en de beschikbaarheid van geschikte OK-ruimte met een geschoold team en alle relevante apparatuur. Door deze patiënten in het huidige systeem lage urgentie te geven in het (semi-)acute aanmeldingssysteem voor de operatiekamer ontstaat vaak vertraging en doorstaat een patiënt vaak herhaalde periodes van nuchter zijn. Er wordt door de beroepsgroepen erkend dat de meerderheid van deze groep patiënten kwetsbare ouderen zijn. Pijn/comfort van de patiënt, service naar de patiënt en de familie toe en een ethische standaard hoe lang een kwetsbare oudere kan wachten zijn in studies niet gemeten of vergeleken. Er zijn soms onvermijdelijke redenen voor vertraging. Op de volgende comorbiditeiten kan worden geanticipeerd: anaemie, antistollingsmedicatie, acute pneumonie, cardiale ischaemie of ritmestoornissen, diabetes ongecontroleerd, exacerbatie COPD, decompensatio cordis en elektrolyten disbalans. Optimalisatie van de meerderheid van deze condities kan binnen 24 uur plaatsvinden. Ziekenhuizen, die proximale femurfracturen behandelen, dienen protocollen en een tijdspad te hebben om deze te anticiperen condities te optimaliseren.
Conclusies / Summary of Findings
Operatie <24 uur versus >24 uur
|
GRADE ZEER LAAG |
Er zijn aanwijzingen dat de kans op overlijden lager is wanneer patiënten <24 uur na opname worden geopereerd versus >24 uur na opname.
Bronnen (Al-Ani, 2008; Bergeron, 2006; Bottle, 2006; Bretherton, 2015; Lefaivre, 2009; Majumdar, 2006; Pillay, 2007; Weller, 2005) |
|
GRADE ZEER LAAG |
Het is onduidelijk of de kans op complicaties voor patiënten die <24 uur versus >24 uur na opname zijn geopereerd verschilt.
Bronnen (Bergeron, 2006; Lefaivre, 2009; Orosz, 2004) |
Operatie <48 uur versus >48 uur
|
GRADE ZEER LAAG |
Er zijn aanwijzingen dat een operatie die uitgevoerd wordt later dan 48 uur na opname leidt tot een hogere kans op overlijden.
Bronnen (Al-Ani, 2008; Bergeron, 2006; Bottle, 2006; Bretherton, 2015; Lefaivre, 2009; Majumdar, 2006; Weller, 2005) |
|
GRADE ZEER LAAG |
Er lijkt niet vastgesteld te kunnen worden dat een operatie uitgevoerd na meer dan 48 uur na opname leidt tot meer complicaties.
Bronnen (Bergeron, 2006; Lefaivre, 2009) |
Samenvatting literatuur
In totaal zijn er negen artikelen geïncludeerd in de literatuuranalyse. Het betreft in alle gevallen observationele onderzoeken. Er is één systematische review opgenomen, alle studies die in de review zijn betreffen eveneens observationeel onderzoek. Voor deze uitgangsvraag is er naar verschillende uitkomsten bij twee vergelijkingen gekeken, namelijk:
- tijd tot operatie <24 uur versus >24 uur;
- tijd tot operatie <48 uur versus >48 uur.
In de aanvankelijke literatuursearch werden slechts één artikel gevonden waar men gecorrigeerde cijfers voor de verschillen tussen de onderzochte studiepopulaties presenteerde (Bretherton, 2015). Het doornemen van de literatuurlijsten van de geselecteerde studies en het bestuderen van de NICE-richtlijn leverde zeven additionele artikelen op (Orosz, 2004; Weller, 2005; Majumdar, 2006; Lefaivre, 2009; Bottle, 2009; Bergeron, 2006; Al-Ani, 2008; Pillay, 2007). Het is van belang dat de geïncludeerde studies gecorrigeerde data beschrijven om te corrigeren voor verschillen tussen de onderzoeksgroepen. Hier kunnen logistieke redenen achter zitten, patiëntgebonden factoren of persoonlijke voorkeuren van de behandelaren.
De uitkomstmaat complicaties is beschreven in drie studies en in de artikelen worden dergelijke complicaties beschreven als major complications, zoals myocardinfarct, longontsteking, hartritmestoornissen en urineweginfectie, kortom, complicaties met mogelijk grote nadelige gevolgen voor de patiënt.
Korte beschrijving van de individuele studies
Een retrospectief cohort (Bretherton, 2015), uitgevoerd in het Verenigd Koninkrijk, heeft de resultaten van 6638 patiënten na een chirurgische ingreep vanwege een proximale femurfractuur onderzocht. In dit artikel zijn beide bovenstaande vergelijkingen beschreven. De enige beschreven uitkomstmaat was 30 dagen mortaliteit.
In een Nederlandse studie uit 2007 (Pillay, 2007), is gekeken naar de vergelijking operatie binnen 24 uur versus >24 uur. In totaal zijn er 216 patiënten beschreven met een gemiddelde leeftijd van 81 jaar. De gerapporteerde uitkomstmaat was mortaliteit tijdens opname.
Een onderzoek uit Sweden (Al-Ani, 2008), uitgevoerd in twee ziekenhuizen bij circa 750 patiënten heeft gekeken naar zowel de vergelijking <24 uur versus >24 uur en <48 uur versus >48 uur. Enige beschreven uitkomstmaat is mortaliteit na vier maanden. In dit onderzoek is gecorrigeerd voor leeftijd, geslacht, dementie, mobiliteit en ASA-score.
Een retrospectief cohort uit Canada (Bergeron, 2006) beschreef ook de twee bovenstaande vergelijkingen, echter vergeleek men in deze studie <24 uur versus 24-48 uur en <24 uur met >48 uur. Er werden bijna 1000 patiënten geïncludeerd met een gemiddelde leeftijd van 80 jaar (25% man). Mortaliteit en complicaties waren de beschreven uitkomstmaten.
Een multicenter onderzoek uit Canada (Majumdar, 2006) beschreef dezelfde vergelijking als Bergeron, 2006. Enige beschreven uitkomstmaat was mortaliteit en in totaal waren er 3100 patiënten geïncludeerd, allen >60 jaar.
In een groot databaseonderzoek uit Engeland (Bottle, 2006) is gekeken naar 114.942 patiënten. De vergelijkingen <24 uur versus >24 uur en <48 uur en >48 uur zijn beschreven. Geïncludeerde patiënten waren 65+. Complicaties en mortaliteit tijdens ziekenhuisopname waren de beschreven uitkomstmaten.
In een Canadees databaseonderzoek (Weller, 2005) waarin meer dan 50.000 patiënten zijn beschreven heeft men alleen gekeken naar mortaliteit tijdens ziekenhuisopname. Men heeft gekeken naar de vergelijking <24 uur versus >24 uur en <48 uur versus >48 uur. Geïncludeerde patiënten waren >50 jaar.
In een ander Canadees onderzoek (Lefaivre, 2009) zijn patiënten >65 jaar beschreven. De vergelijkingen waren <24 uur versus 24 tot 48 uur en <24 uur met >48 uur, voor zowel mortaliteit tijdens ziekenhuisopname als complicaties.
Eén studie uit de VS beschreef alleen complicaties als uitkomstmaat (Orosz, 2004), dit deden zij alleen voor de vergelijking <24 uur en >24 uur, uitgevoerd in vier ziekenhuizen bij meer dan 1000 patiënten.
Resultaten
Operatie <24 uur versus >24 uur
Uitkomstmaat Mortaliteit
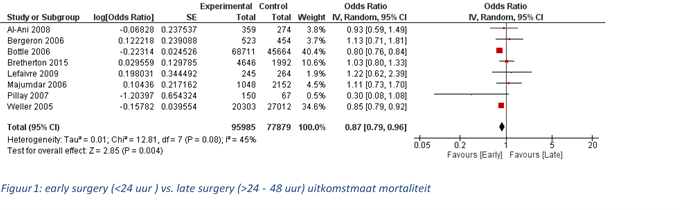
Deze uitkomstmaat is in acht studies beschreven (Al-Ani, 2008; Bergeron, 2006; Bottle, 2006; Bretherton, 2015; Lefaivre, 2009; Majumdar, 2006; Pillay, 2007; Weller, 2005). Het betreft allemaal observationeel onderzoek waarin naar de vergelijking tussen opereren binnen 24 uur na ziekenhuisopname versus opereren na 24 uur na opname is gekeken. In Majumdar (2006), Lefaivre (2009) en Bergeron (2006) is alleen naar de periode 24 tot 48 uur na opname gekeken, de andere studies stelden geen limiet. Er zijn meer dan 150.000 patiënten beschreven in de acht geïncludeerde studies, 140.000 patiënten komen echter uit slechts twee studies (Bottle, 2006; Weller, 2005). Deze studies hebben een aanzienlijk gewicht in de meta-analyse. Zes artikelen beschreven mortaliteit tijdens ziekenhuisopname, één artikel beschreef mortaliteit binnen 30 dagen en één artikel (Bretherton, 2015) beschreef mortaliteit na vier maanden (Al-Ani, 2008). Er werd een gecorrigeerde odds ratio van 0,87 [95% CI 0,78 tot 0,96] gevonden, met een zekere mate van heterogeniteit (figuur 1), ook zonder de drie studies die alleen naar 24 tot 48 uur keken blijft de gevonden OR statistisch significant (0,85[95%CI 0,77 tot 0,92] in het voordeel van opereren binnen 24 uur.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is met één niveau verlaagd vanwege het feit dat de betrouwbaarheidsintervallen van veel studies erg breed zijn (imprecisie). Slechts twee van de acht studies hebben een betrouwbaarheidsinterval dat niet de waarde 1,0 bevat. In de onderzoeksopzet van de studies werden geen zwaarwegende beperkingen gesignaleerd. De uitgangswaarde van de GRADE-beoordeling was vanwege het observationele design van de studie LAAG, de uiteindelijke bewijskracht komt uit op ZEER LAAG.
Figuur 1 Early surgery (<24 uur) versus late surgery (>24 tot 48 uur) uitkomstmaat mortaliteit
Uitkomstmaat Complicaties
Deze uitkomstmaat is in drie studies beschreven (Bergeron, 2006; Lefaivre, 2009; Orosz, 2004). De definitie verschilde licht per studie, maar in alle gevallen ging het om majeure, zware complicaties met heroperatie of blijvende gevolgen voor de patiënt. Deze zijn beschreven in de evidence-tabel. De studies van Bergeron en Lefaivre lieten geen verschil tussen de twee groepen zien, de studie van Orosz liet een statistisch significant voordeel zien voor operatie binnen 24 uur, het gewicht van deze studie in de meta-analyse was 15%. Het samenvoegen van deze drie studies leverde een gecorrigeerde odds ratio op van 0,88 [95%CI 0,49 tot 1,58), met een zekere mate van heterogeniteit. Er lijkt dus geen verschil te zijn tussen de twee groepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties is met één niveau verlaagd gezien de brede betrouwbaarheidsintervallen van de studies, de heterogeniteit en de onduidelijkheid over het daadwerkelijke effect (imprecisie). De uitgangswaarde van de GRADE-beoordeling was vanwege het observationele design van de studie LAAG, de uiteindelijke bewijskracht komt uit op ZEER LAAG.
Operatie <(24) 48 uur versus >48 uur
Uitkomstmaat Mortaliteit
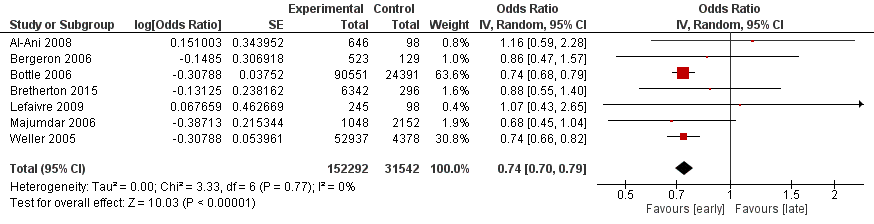
Deze uitkomstmaat is in zeven studies beschreven (Al-Ani, 2008; Bergeron, 2006; Bottle, 2006; Bretherton, 2015; Lefaivre, 2009; Majumdar, 2006; Weller, 2005). Het betreft in alle gevallen observationeel onderzoek. De vergelijkingen die zijn beschreven in de studies zijn <48 uur versus >48 uur en <24 uur versus >48 uur. Majumdar (2006), Lefaivre (2009) en Bergeron (2006) beschrijven <24 uur versus >48 uur, de overige studies beschrijven <48 uur versus >48 uur. De literatuurconclusie verandert niet indien deze drie studies uit de meta-analyse worden gelaten. Wanneer alle zeven studies gepoold worden (figuur 2) vindt men een geadjusteerde odds ratio van 0,74 [95% CI 0,70 tot 0,79], met een lage mate van heterogeniteit (I2: 0%, τ2: 0,01), ten faveure vanbinnen 48 uur opereren. Langer dan 48 uur na opname opereren lijkt dus een hogere kans op overlijden met zich mee te brengen.
Figuur 2 Early surgery (<24 tot 48 uur) versus late surgery (>48 uur) uitkomstmaat mortaliteit
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is met één niveau verlaagd vanwege het feit dat de betrouwbaarheidsintervallen van veel studies erg breed zijn (imprecisie). Slechts twee van de zeven studies heeft een betrouwbaarheidsinterval dat niet de waarde 1,0 bevat. In de onderzoeksopzet van de studies werden geen zwaarwegende beperkingen gesignaleerd. De uitgangswaarde van de GRADE-beoordeling was vanwege het observationele design van de studie LAAG, de uiteindelijke bewijskracht komt uit op ZEER LAAG.
Uitkomstmaat Complicaties
Deze uitkomstmaat is in twee studies beschreven (Bergeron, 2006; Lefaivre, 2009). De definitie verschilde licht per studie, maar in beide gevallen ging het om majeure, zware complicaties met heroperatie of blijvende gevolgen voor de patiënt. Beide studies rapporteerde een odds ratio in het voordeel van vroeg opereren, echter was alleen het betrouwbaarheidsinterval van Lefaivre statistisch significant. De omvang van de totale patiëntenpopulatie in de twee studies bedroeg nog geen 2000 patiënten. Het samenvoegen van de studies leverde een gecorrigeerde odds ratio op van 0,63 [95%CI 0,38 tot 1,02), met een lage mate van heterogeniteit. Er lijkt niet vastgesteld te kunnen worden dat een operatie na meer dan 48 uur na opname tot meer complicaties leidt.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties is met één niveau verlaagd gezien hoeveelheid patiënten en de onduidelijkheid over het daadwerkelijke effect (imprecisie). De uitgangswaarde van de GRADE-beoordeling was vanwege het observationele design van de studie LAAG, de uiteindelijke bewijskracht komt uit op ZEER LAAG.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende vraagstelling:
Wat is de ideale tijd tussen binnenkomst in het ziekenhuis en start operatie bij patiënten met proximale femurfracturen?
Relevante uitkomstmaten
De werkgroep achtte mortaliteit en complicaties voor de besluitvorming kritieke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de database Medline (OVID), is met relevante zoektermen gezocht naar studies naar de timing van operaties bij patiënten met proximale femurfracturen. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 406 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- primair vergelijkend onderzoek;
- gepubliceerd tussen 2004 en mei 2015;
- full-tekst beschikbaar in het Engels of Nederlands;
- vergelijking tussen minimaal twee tijdframes tot operatie;
- patiëntenpopulatie met proximale femurfracturen;
- volwassen patiënten;
- beschrijving van minimaal één van de uitkomstmaten (mortaliteit, complicaties);
- operatieve behandeling van de proximale femurfractuur;
- beschrijven van gecorrigeerde data voor de uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 37 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 35 studies geëxcludeerd (zie exclusietabel), en twee studies geselecteerd. Doornemen van de referentielijsten leverde zeven additionele artikelen op. Uiteindelijk zijn negen artikelen definitief geselecteerd en opgenomen in de literatuuranalyse. De evidence-tabellen hiervan en beoordeling van individuele studiekwaliteit kunt u in onder het tabblad Onderbouwing vinden.
Referenties
- Al-Ani A, Samuelsson B, Tidermark J, et al. Early operation on patients with a hip fracture improved the ability to return to independent living. A prospective study of 850 patients. J Bone Joint Surg Am. 2008;90(7):1436-42. PubMed PMID:18594090.
- Bergeron E, Lavoie A, Moore L, et al. Is the delay to surgery for isolated hip fracture predictive of outcome in efficient systems? J Trauma. 2006;60(4):753-7. PubMed PMID: 16612294.
- Bottle A, Aylin P. Mortality associated with delay in operation after hip fracture: observational study. BMJ. 2006;332(7547):947-51. PubMed PMID: 16554334.
- Bretherton C, Parker M. Early surgery for patients with a fracture of the hip decreases 30-day mortality. Bone Joint J. 2015;97-B(1):104-8.
- Lefaivre K, Macadam S, Davidson D, et al. Length of stay, mortality, morbidity and delay to surgery in hip fractures. J Bone Joint Surg Br. 2009;91(7):922-7. PubMed PMID: 19567858.
- Majumdar S, Beaupre L, Johnston D, et al. Lack of association between mortality and timing of surgical fixation in elderly patients with hip fracture: results of a retrospective population-based cohort study. Med Care. 2006;44(6):552-9. PubMed PMID: 16708004.
- Orosz G, Magaziner J, Hannan E, et al. Association of timing of surgery for hip fracture and patient outcomes. JAMA. 2004;291(14):1738-43. PubMed PMID: 15082701.
- Pillay J, van der Wouden JC, Leenen L. [Retrospective application of the performance indicator 'hip fracture: operate within 24 hours' in 217 patients treated at the University Medical Centre Utrecht in 2000-2003: reduction in postoperative pneumonia but not mortality]. Ned Tijdschr Geneeskd. 2007;151(17):967-70. Dutch. PubMed PMID: 17520850.
- Weller I, Wai EK, Jaglal S, et al. The effect of hospital type and surgical delay on mortality after surgery for hip fracture. J Bone Joint Surg Br. 2005;87(3):361-6. PubMed PMID: 15773647.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Pillay, 2007 |
Type of study: Retrospectief cohort
Setting: Database inquiry
Country: Netherlands
Source of funding: None mentioned |
Inclusion criteria: Patients with hip fractures;
Exclusion criteria: <60 years; Pathological fractures; Multi-trauma fractures; Fracture sustained >48 hours before admission;
N total at baseline: Intervention: 150 Control:67
Important prognostic factors2: age ± SD: I:80.5 ± 9 C: 80,9 ± 8
Sex: I: 25% M C: 18% M |
Describe intervention:
<24 hours
|
Describe control:
>24 hours
|
Length of follow-up: 36 months
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
In-Hospital mortality (early) Adjusted OR 0,3 (0,1-1,3) |
<24h versus >24 h. Late is control |
|
Al-Ani 2008 |
Type of study: Prospective cohort
Setting: Two hospitals
Country: Sweden
Source of funding: One or more authors received, in any one year, outside funding or grants in excess of $10,000 from the Stockholm County Council Research Fund for clinical studies. No benefits received from commercial entities. |
Inclusion criteria: Patients with hip fractures;
Exclusion criteria: - Pathological fractures; - Patients presented one calendar day after injury;
Comparison 1 <24 h versus >24 h N total at baseline: Intervention: 359 Control:274
Important prognostic factors2: age: I:81 C:81
Comparison 2 <48 h. versus >48 h. N total at baseline: Intervention: 646 Control:98
Important prognostic factors2: age: I: 81 C:81
Sex: I: 26% M C: 35% M
Groups comparable at baseline |
Describe intervention:
1. <24 hours 2. <48 hours
|
Describe control:
1. >24 hours 2. >48 hours |
Length of follow-up: Hospital stay
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Mortality rate 4 months Comparison 1: Adjusted OR Delay >24h: 1.07 (0.67 to 1.70)
Flipped with late control:0.934 (0.588-1.492)
Comparison 2: Adjusted OR Delay >48h: 0.86 (0.44 to 1.69)
Flipped with late control: 1.163 (0.59 – 2.272)
|
Comparisons: <24 h versus >24 h <48 h versus >48 h
Late is control
Adjusted for: Adjusted odds ratio adjusted for age, sex, prefracture walking ability, dementia and ASA score. |
|
Bergeron, 2006 |
Type of study: Retrospective cohort
Setting: Database inquiry
Country: Canada
Source of funding: Not mentioned |
Inclusion criteria: Patients aged 15 or older; Patients with low-energy trauma; Patients with hip fractures
Exclusion criteria: - delay injury to admission >24 hours;
Comparison 1 <24 h versus >24-48 h
N total at baseline: Intervention: 523 Control:454
Important prognostic factors2: age: I:79 C:80
Sex: I: 25% M C: 22% M
Comparison 1 <24 h versus >48 h
N total at baseline: Intervention: 523 Control:129
Important prognostic factors2: age: I:79 C:80
Sex: I: 24% M C: 24% M
Groups comparable at baseline
|
Describe intervention:
1. <24 hours 2. <24 hours
|
Describe control:
1. >24-48 hours 2. >48 hours |
Length of follow-up: Hospital stay
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
In-hospital mortality Comparison 1 Adjusted Odds ratio: 24-48hs (versus24h): 0.88 (0.55-1.41)
Flipped with late control: 1.13 (0.709 – 1.81)
Comparison 2 Adjusted Odds ratio: >48 hours (versus 24h): 1.16 (0.64-2.13)
Flipped with late control: 0.862 (0.469-1.562)
Severe complications (Cerebrovascular accident, cardiovascular complication, digestive complication – except unspecified paralytic ileus- dialysis)
Comparison 1 Adjusted Odds ratio: 24-48hs (versus 24h): 0.87 (0.58-1.29)
Flipped with late control: 1.149 (0.775-1.724)
Comparison 2 Adjusted Odds ratio: >48 hours (versus 24h): 1.32 (0.79-2.20)
Flipped with late control: 0.757 (0.45-1.266) |
Comparisons: <24 h versus >24-48 h <24 h versus >48 h
Late is converted to control
|
|
Bottle, 2009 |
Type of study: Retrospective cohort
Setting: Multicenter
Country: England
Source of funding: The unit is funded by a grant from Dr Foster Ltd. |
Inclusion criteria: - Aged >65 years; - Neck of femur fracture;
Exclusion criteria: - patients admitted from nursing and residential homes
Comparison 1 <24 h versus >24 h
N total at baseline: N= 114942
C: 22% M
Comparison 1 <48 h versus >48 h
N total at baseline: Intervention: 90551 Control: 24391
Important prognostic factors2: age: I:79 C:80
Sex: I: 24% M C: 24% M |
Describe intervention:
1. <24 hours 2. <48 hours
|
Describe control:
1. >24 hours 2. >48 hours |
Length of follow-up: 12 months
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
In-hospital mortality Comparison 1 Adjusted OR >1 day versus ≤1 day: 1.25 (1.19 to 1.31)
Flipped with late control: 0.8 (0.763-0.840)
Comparison 2 Adjusted OR >2 day versus ≤2 day: 1.36 (1.29 to 1.43)
Flipped with late control: 0.735 (0.699-0.775) |
<24 h versus >24 h <48 h versus >48 h
(adjusted for age, sex,deprivation fifth and comorbidity) |
|
Lefaivre, 2009 |
Type of study: Retrospective cohort
Setting: Single center
Country: Canada
Source of funding: Not mentioned |
Inclusion criteria: Patients with hip fractures; Patients aged >65;
Exclusion criteria: None mentioned
Comparison 1 <24 h versus >24-48 h
N total at baseline: Intervention: 245 Control:264
Comparison 2 <24 h versus >48 h
N total at baseline: Intervention: 245 Control: 98
|
Describe intervention:
1. <24 hours 2. <24 hours
|
Describe control:
1. >24 - 48 hours 2. >48 hours |
Length of follow-up: Hospital stay
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
In-hospital Mortality Comparison 1 Adjusted OR 0.82 (0.42 to 1.62)
Flipped with late control: 1.219 (0.617 – 2.381)
Comparison 2 Adjusted OR 0.93 (0.38 to 2.33)
Flipped with late control: 1.07 (0.429 – 2.631)
Major complications Comparison 1 Adjusted OR 0.96 (0.52 to 1.75)
Flipped with late control: 1.04 (0.571 – 1.92)
Comparison 2 Adjusted OR 2.21 (1.01 to 4.34)
Flipped with late control: 0.452 ( 0.23-0.99) |
<24 h versus >24-48 h <24 h versus >48 h
(adjusted for medical comorbidity age, gender and fracture type) Major complications: Major complications included pulmonary embolism, a major cardiac event requiring urgent pharmacological treatment, consultation with a cardiologist or transfer to the cardiac care unit, major infection requiring systemic antibiotic therapy, renal failurerequiring dialysis and major pulmonary complicationrequiring positive-pressure ventilation. |
|
Majumdar, 2006 |
Type of study: Retrospective cohort
Setting: Multi center
Country: Canada
Source of funding: Not mentioned |
Inclusion criteria: Patients aged >60; Patients with hip fracture;
Exclusion criteria: Multiple traumatic fractres; Pathological fractures; Bilateral hip fractues;
Comparison 1 <24 h versus >24-48 h
N total at baseline: Intervention: 1048 Control:2152
Important prognostic factors2: age ± SD: 82 ± 8.52
Sex: 29% m
Comparison 2 <24 h versus >48 h
N total at baseline: Intervention: 1048 Control:664
Important prognostic factors2: age ± SD: 82 ± 8.52
Sex: 29% m |
Describe intervention:
1. <24 hours 2. <24 hours
|
Describe control:
1. >24 - 48 hours 2. >48 hours |
Length of follow-up: 30 days
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
In-hospital Mortality Comparison 1 Adjusted OR 0.90 (0.85-1.99)
Flipped with late control:1.11 (0.502-1.176)
Comparison 2 Adjusted OR 1.30 (0.86-2)
Flipped with late control: 0.679 (0.50-1.163)
|
<24 h versus >24-48 h <24 h versus >48 h
|
|
Weller, 2005 |
Type of study: Retrospective cohort
Setting: Database inquiry
Country: Canada
Source of funding: Not mentioned |
Inclusion criteria: Patients aged >50 years
Exclusion criteria: Delay to surgery >7 days;
Comparison 1 <24 h versus >24 h Intervention: 20303 Control: 37012
Comparison 1 <48 h versus >48 h
N total at baseline: Intervention: 52937 Control: 4378 |
Describe intervention:
<24 hours <48 hours
|
Describe control:
>24 hours >48 hours |
Length of follow-up: 12 months
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
In-hospital Mortality Comparison 1 Adjusted OR 1.17 (1.08-1.26)
Flipped with late control: 0.854 (0.793-0.926)
Comparison 2 Adjusted OR 1.36 (1.23 – 1.52)
Flipped with late control: 0.735 (0.658-0.813) |
<24 h versus >24 h <48 h versus >48 h
|
|
Orosz, 2004 |
Type of study: Prospective cohort
Setting: 4 hospitals
Country: USA
Source of funding: Grants were received from the Agency for Healthcare Research and Quality |
Inclusion criteria: Patients with hip fractures; Patients aged >50 years
Exclusion criteria: Multiple trauma; Pathological fractures; Bilateral hip fractures; Previous femur fractures;
N total at baseline: Intervention: 398 Control: 780
Important prognostic factors2: age ± SD: I: 82 ± 9.2 C: 82 ± 8.6
Sex: I: 21% M C:18 % M |
Describe intervention:
<24 hours
|
Describe control:
>24 hours |
Length of follow-up: 6 months
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size: Major postoperative complications Adjusted OR (early) 0.26 ( 0.07 to 0.95) |
<24 versus >24 h
Major postoperative complications (those that pose a threat to life or bodily functions and that typically are treated with parenteral medications, procedures, or intensive monitoring e.g. pneumonia or arrhythmias |
|
Bretherton, 2015 |
Type of study: Retrospective cohort
Setting: Single center
Country: UK
Source of funding: Not mentioned |
Inclusion criteria: - none mentioned Exclusion criteria: - <60 years; - pathological fractures; - treated non-operatively;
N total at baseline:
1: Intervention:4646 Control:1992
2: Intervention:6342 Control:296
|
Describe intervention:
1: <24 hours admission to surgery
2: <48 hours admission to surgery
|
Describe control:
>24 hours admission to surgery
>48 hours admission to surgery
|
Length of follow-up: Not mentioned
Loss-to-follow-up: Total: n=18 (<1%)
Incomplete outcome data: Total: n=453 (<10%)
|
Outcome measures and effect size:
<24h versus >24h. Mortality 30d I:261/4646 C:141/1992
Adjusted OR (favour late) 0.972 (0.776 – 1.219)
Flipped with late control: 1.03 (0.775-1.289)
<48h versus >48h. Mortality 30d I:377/6342 C:25/296
Adjusted OR (Early) 1.140 (0.715 – 1.818)
Flipped with late control:0.877 (0.550-1.399) |
<24 h versus >24 h <48 h versus >48 h
|
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Pillay, 2007 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Bretherton 2015 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Bergeron, 2006 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Lefaivre, 2009 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Majumdar, 2006 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Weller, 2005 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Orosz, 2004 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Al-Ani, 2008 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Bottle, 2009 |
Unclear, no stratified baseline data available |
Unlikely |
Unlikely |
Unlikely |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-05-2018
Beoordeeld op geldigheid : 04-09-2024
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. De werkgroep beoordeelt jaarlijks of modules of andere onderdelen van de richtlijn aan herziening toe zijn. De werkgroep valt onder de NVvH. Als onderdeel van deze richtlijn zijn door de werkgroep spoedlijst opgesteld die door de wetenschappelijke verenigingen geaccordeerd en onderhouden moet worden.
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In samenwerking met:
- Landelijke Vereniging van Operatieassistenten
- Stichting Kind en Ziekenhuis
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft tijdens het ontwikkelproces op geen enkele wijze invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van deze richtlijn is om een landelijk uniform classificatiesysteem vast te stellen voor het prioriteren van acute operaties en interventies waarbij een anesthesieteam, een medisch specialist en ondersteunend personeel aanwezig moeten zijn. In dit systeem kunnen wetenschappelijke verenigingen de prioriteit aangeven van (hun) specifieke ingrepen. Het beoogde effect van de richtlijn is dat transparanter wordt wat een acceptabele wachttijd is voor een acute ingreep door het proces rondom spoedoperaties duidelijker te beschrijven. Deze transparantie geldt voor zorgverleners, zorginstellingen en patiënten. Daarnaast wordt geprobeerd om de randvoorwaarden te beschrijven met betrekking tot de organisatie en communicatie rondom deze ingrepen.
Doelgroep
Alle leden van de beroepsgroepen die betrokken zijn bij de spoedzorg voor patiënten die een behandeling met anesthesiologische begeleiding of bewaking moeten ondergaan. Indien een spoed-patiënt op een electieve plaats wordt gezet dan kan electieve patiënt daar hinder van ondervinden.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2013 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een indicatie voor een acute interventie waarbij gebruik wordt gemaakt van tenminste een anesthesioloog, een ondersteunend/ assisterend team en een tweede medisch specialist (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. P.H.W. Lubbert, chirurg, werkzaam in ziekenhuis de Tjongerschans, Heereveen, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Drs. L.F.M. Beenen, radioloog, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Radiologie
- Drs. J.H.J.M. Bessems, orthopedisch chirurg, werkzaam in het Erasmus MC, Rotterdam, Nederlandse Orthopaedische Vereniging
- Prof. dr. M.A. Boermeester, gastro-intestinale / oncologisch chirurg, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Heelkunde
- Dr. L. Dubois, MKA-chirurg, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Dr. K.H. Kho, neurochirurg, Medisch Spectrum Twente, Enschede, Nederlandse Vereniging voor Neurochirurgie
- Dr. S.V. Koenen, gynaecoloog, werkzaam in het Universitair Medisch Centrum Utrecht, Nederlandse Vereniging voor Obstetrie Gynaecologie
- Dr. B. van Minnen, MKA-chirurg, werkzaam in het Universitair Medisch Centrum, Groningen, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- H. Rippen, patiëntvertegenwoordiger, Stichting Kind en Ziekenhuis, Utrecht
- Drs. A. Schuurhuis, anesthesioloog/intensivist, werkzaam in het Universitair Medisch Centrum Utrecht, Nederlandse Vereniging voor Anesthesiologie
- Dr. G.J.M.W. van Thiel, medisch ethicus, werkzaam in het Universiteit Medisch Centrum, Utrecht
Subgroep
- N. Dreessen, bestuurslid LVO, werkzaam in het Zuyderland Medisch Centrum, Landelijke Vereniging van Operatieassistenten
- drs. B.C. Jacod, gynaecoloog i.o., werkzaam in het Universitair Medisch Centrum, Utrecht, Nederlandse Vereniging voor Obstetrie Gynaecologie
- drs. A. Janse, klinisch geriater, werkzaam in Ziekenhuis Gelderse Vallei, Ede, Nederlandse Vereniging voor Klinische Geriatrie
- B.D.D. van Loo, anesthesiemedewerker, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging van Anesthesie-Medewerkers
- Dr. B.M.P. Rademaker, anesthesioloog, werkzaam in het OLVG, Amsterdam, Nederlandse Vereniging voor Anesthesiologie
- drs. E.M. Verhoog, SEH-arts, werkzaam in Tergooi Ziekenhuizen, Blaricum, Nederlandse Vereniging van Spoedeisende Hulp Artsen
- F. Wienen, operatieassistent, werkzaam in Isala Klinieken, Zwolle, Landelijke Vereniging van Operatieassistenten
Met ondersteuning van:
- Ir. T.A. van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- A.A. Lamberts MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- M.E. Wessels MSc, literatuurspecialiste, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Met dank aan:
- S. van Dijk MSc, arts-onderzoeker chirurgie, afdeling Chirurgie, Academisch Medisch Centrum, Amsterdam
- N.W. de Cort, student geneeskunde, Faculty of Health, Medicine and Life Science, Maastricht Universiteit, Maastricht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar directe financiële (betrekking commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de bijlage van deze richtlijn. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten. De belangen zijn bij aanvang van het project geïnventariseerd bij de leden van de werkgroep. De leden van de werkgroep is gevraagd gedurende het ontwikkeltraject wijzigingen in de belangen te melden bij de ondersteuners. Aan het eind van het ontwikkeltraject zijn de belangen nogmaals plenair besproken.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Boermeester |
|
|
|
|
|
|
|
|
|
Beenen |
Radioloog, afgevaardigde NVvR |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Bessems |
Orthopedisch chirurg |
Docent Hogeschool Rotterdam, Docent Albeda College Rotterdam (Beiden uurvergoeding (EUR 500,00 per jaar)). |
geen |
geen |
Lid medische adviesraad vereniging aangeboren heupafwijkingen |
geen |
geen |
geen |
|
Dubois |
MKA chirug AMC Amsterdam (betaald) MKA chirug Antonius ziekenhuis (betaald) |
Secretaris stichting Bridge the Gap-> (onbetaald) Richtlijnontwikkeling NVMKA mbt aangezichtstraumatologie -> (onbetaald) docent na bijscholing (AO Foundation/SORG/ACTA/NVT/CCO) -> (onbetaald) Vereniging Medisch Tandheelkundige interactie, oud voorzitter, adviserend -> (onbetaald) |
geen |
geen |
geen |
ontwikkeling orbita implantaat via KLS Martin; geen belangenverstrengeling met oop op de richtlijn. |
zie geen reden tot belangenverstrengeling, enkel bijzondere aandacht voor orbitachirurgie met ontwikkeling in 3D software planning, patientspecifieke oplossingen en implantaten; zie extra gefinancieerd onderzoek. |
geen |
|
Kho |
Neurochirug |
geen |
nvt |
nvt |
nvt |
geen |
nvt |
neen |
|
Koenen |
Gynaecoloog / periatoloog UMC Utrecht |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Lubbert |
Chirurg |
geen |
geen |
echtgenote cardioloog |
lid van commissie patient veiligheid Ned Vereniging voor Heelkunde |
geen |
geen eigendom van patent of product. Proefschrift gericht op kwaliteit in patientenzorg. Derhalve geinteresseerd in veiligheid en kwaliteit. |
geen |
|
van Minnen |
Kaakchirurg, chef de clinique, UMC Groningen |
Bestuurslid vereniging Regiotafel Antistolling Gronigen, overlegorgaan om de (perioperatieve) zorg rond geantistolde patient in de regio te organiseren. (onbezoldigd) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Rippen |
Directeur Stichting Kind en Ziekenhuis |
Bestuurslid Onbeperkt aan de slag – ontbetaald Bestuurslid Vereniging van Ehlers-Danlos patienten - onbetaald Feelance projectadviseur/consultant - diverse belangenbehartigings-organisaties en soms zorgorganisaties - betaald per opdracht |
geen |
geen |
geen |
geen |
geen |
geen |
|
Schuurhuis |
Anethesioloog in het UMCU |
Voorzitter commisie Richtlijnen en Indicatoren NVA (vacatiegeld voor vergaderingen) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van Thiel |
UD Medisch Ethiek / UMC Utrecht div. Julius Centrum |
Plv lid - ethicus VCMO (een erkende METC) betaald |
geen |
geen |
geen |
Geen belangen die relevant zijn voor dit onderzoek. |
geen |
geen |
|
Lamberts |
Adviseur Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
van Barneveld |
Directeur Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
|
|
|
|
|
|
|
|
|
|
Subwerkgroep |
||||||||
|
Dreessen |
Operatieassistent |
Bestuurslid LVO (onbetaald) |
geen |
geen |
Erkenning beroep operatieassistent |
geen |
geen |
geen |
|
Janse |
Klinisch Geriater |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Jacod |
AIOS Gynaecologie UMC Utrecht |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Rademaker |
subwerkgroep 'Medisch inhoudelijk'. |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Verhoog |
SEH-arts Ter Gooi Eigen bedrijf, eenmanszaak, partime Auxilium primum; lesgeven, trainingen, waarneming binnen (acute) geneeskunde (betaald) |
geen |
geen |
geen |
Richtlijne-commissie NVSHA |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Inbreng van het patiëntenperspectief werd gewaarborgd door een afgevaardigde van een landelijke patiëntenvereniging in de werkgroep op te nemen en uitgangsvragen op te stellen specifiek over voor de patiënt relevante onderwerpen. Tijdens de oriënterende zoekactie werd er specifiek gezocht naar literatuur over het patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is voor commentaar voorgelegd aan Kind en Ziekenhuis, de Patiëntenfederatie Nederland en Zorgbelang Nederland. Vanwege de te verwachten ethische dilemma’s in de richtlijn die gepaard gaan met het verdelen van schaarse middelen en tijd in de gezondheidszorg heeft er een medisch ethicus zitting gehad in de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is nadrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatiemodule is te vinden bij de aanverwante producten.
Werkwijze
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijn voor richtlijnen’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor de kritieke en belangrijke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, systematische reviews (Medline (OVID)), en literatuur over patiëntvoorkeuren (patiëntenperspectief; Medline (OVID)). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (Risk of Bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals criteria die van invloed zijn op de aanbeveling, de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn is er een interne kwaliteitsindicator ontwikkeld om het toepassen het classificatiesysteem van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de module Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers M, Kho ME, Browman GP, et al. for the AGREE Next Steps Consortium. AGREE II: Advancing guideline development, reporting and evaluation in healthcare. Can Med Assoc J. 2010; 182:E839-842; doi:10.1503/090449.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Link: https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from www.guidelinedevelopment.org/handbook.
Schünemann HJ, Oxman AD, Brozek J, et al.; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. Erratum in: BMJ. 2008;336(7654).
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000-mei 2015
Engels, Nederlands |
1 exp *Femoral Neck Fractures/ (5848) 2 ((hip* or ((femur* or femoral*) adj3 (neck or proximal))) adj4 fracture*).tw. (19745) 3 1 or 2 (21054) 4 "Fracture Fixation, Internal"/ or fixation*.ti,ab. (121250) 5 Arthroplasty/ or Arthroplasty, Replacement,Hip/ or hemiarthroplasty/ (24802) 6 "prostheses and implants"/ or hip prosthesis/ (56570) 7 (arthroplast* or hemiarthroplast* or hemi-arthroplast* or prosthes* or implant* or "total hip*" or ((hip or femur or femor*) adj3 replacement)).tw. (366693) 8 4 or 5 or 6 or 7 (494355) 9 3 and 8 (6986) 10 limit 9 to (yr="2000 -Current" and (dutch or english)) (3601) 11 "time to surgery".ti,ab. (11927) 12 10 and 11 (74) 13 (time adj1 (surgery or operati*)).ti,ab. (32908) 14 delay*.ti,ab. (352095) 15 13 or 14 (383850) 16 10 and 15 (345) 17 *time factors/ (1148) 18 time factors/ (1029693) 19 10 and 18 (272) 20 ((time* or timing or early) adj1 (surgery or operati* or fixation*)).ti,ab. (41966) 21 14 or 18 or 20 (1366007) 22 10 and 21 (577) 23 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (236942) 24 22 and 23 (43) – 36 uniek 25 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1460265) 26 22 and 25 (145) 27 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw,kw. or (cohort adj (study or studies)).tw,kw. or Cohort analy$.tw,kw. or (Follow up adj (study or studies)).tw,kw. or (observational adj (study or studies)).tw,kw. or Longitudinal.tw,kw. or Retrospective.tw,kw. or Prospective.tw,kw. or Cross sectional.tw,kw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (2142016) 28 22 and 27 (359) 29 24 or 26 or 28 (426) 30 26 not 24 (109) – 104 uniek 31 28 not (24 or 26) (274) – 266 uniek |
406 |
In- en exclusietabel
|
Art. nr. |
Auteur, jaartal |
Inclusie / Exclusie |
Toelichting |
|
SR |
|||
|
SR1 |
Papakostidis, 2015 |
Exclusie |
Voldoet niet aan selectiecriteria. |
|
SR10 |
Yeranosian, 2013 |
Exclusie |
Voldoet niet aan selectiecriteria. |
|
SR27 |
Williams, 2005 |
Exclusie |
Voldoet niet aan selectiecriteria. |
|
SR31 |
Bhandari, 2003 |
Exclusie |
Voldoet niet aan selectiecriteria, geen gecorrigeerde cijfers. |
|
RCT’s |
|||
|
R7 |
Hapaurachchi, 2014 |
Exclusie |
Voldoet niet aan selectiecriteria, geen gecorrigeerde cijfers. |
|
R9 |
De Palma, 2014 |
Exclusie |
Voldoet niet aan selectiecriteria. |
|
R33 |
Pioli 2012 |
Exclusie |
Geen antwoord op PICO. |
|
R87 |
Upadhyay 2004 |
Exclusie |
Geen antwoord op PICO. |
|
Overige designs |
|||
|
O9 |
Bretherton 2015 |
Inclusie |
|
|
O13 |
Steinberg 2014 |
Exclusie |
Geen antwoord op PICO. |
|
O14 |
Salem 2014 |
Exclusie |
Geen antwoord op PICO. |
|
O23 |
Kim 2014 |
Exclusie |
Voldoet niet aan selectiecriteria, geen gecorrigeerde cijfers. |
|
O33 |
Westberg 2013 |
Exclusie |
Voldoet niet aan selectiecriteria, geen gecorrigeerde cijfers. |
|
O35 |
Rashid 2013 |
Exclusie |
Geen antwoord op PICO. |
|
O47 |
Elmi 2013 |
Exclusie |
Geen antwoord op PICO. |
|
O55 |
Wongwai 2012 |
Exclusie |
Geen antwoord op PICO. |
|
O60 |
Razik 2012 |
Exclusie |
Voldoet niet aan selectiecriteria, geen gecorrigeerde cijfers. |
|
O73 |
Hoelsbrekken 2012 |
Exclusie |
Voldoet niet aan selectiecriteria, geen gecorrigeerde cijfers. |
|
O84 |
Daugaard 2012 |
Exclusie |
Geen antwoord op PICO. |
|
O90 |
Vitale 2011 |
Exclusie |
Geen antwoord op PICO. |
|
O98 |
O’Heiramhoin 2011 |
Exclusie |
Geen antwoord op PICO. |
|
O106 |
Fantini 2011 |
Exclusie |
Geen antwoord op PICO. |
|
O110 |
Chacko 2011 |
Exclusie |
Geen antwoord op PICO. |
|
O111 |
Carretta 2011 |
Exclusie |
Geen antwoord op PICO. |
|
O131 |
Bosma 2010 |
Exclusie |
Geen antwoord op PICO. |
|
O137 |
Yasunaga 2009 |
Exclusie |
Geen antwoord op PICO. |
|
O142 |
Varshney 2009 |
Exclusie |
Voldoet niet aan selectiecriteria |
|
O146 |
Sirois 2009 |
Exclusie |
Geen antwoord op PICO. |
|
O148 |
Ly 2009 |
Exclusie |
Geen antwoord op PICO. |
|
O150 |
Loizou 2009 |
Exclusie |
Geen antwoord op PICO. |
|
O151 |
Lim 2009 |
Exclusie |
Geen antwoord op PICO. |
|
O163 |
Smektala 2008 |
Inclusie |
Voldoet niet aan selectiecriteria, geen gecorrigeerde cijfers. |
|
O165 |
Radcliff 2008 |
Exclusie |
Geen antwoord op PICO. |
|
O176 |
Butt 2008 |
Exclusie |
Geen antwoord op PICO. |
|
O183 |
Rae 2007 |
Exclusie |
Geen antwoord op PICO. |
|
O228 |
Doruk 2004 |
Exclusie |
Voldoet niet aan selectiecriteria, geen gecorrigeerde cijfers. |
|
O230 |
Casaletto 2004 |
Exclusie |
Geen antwoord op PICO. |
|
|
Orosz, 2004 |
Inclusie |
|
|
|
Weller, 2005 |
Inclusie |
|
|
|
Majumdar, 2006 |
Inclusie |
|
|
|
Lefaivre, 2009 |
Inclusie |
|
|
|
Bottle, 2009 |
Inclusie |
|
|
|
Bergeron, 2006 |
Inclusie |
|
|
|
Al-Ani, 2008 |
Inclusie |
|
|
|
Pillay, 2007 |
Inclusie |
|
