Dag/nacht verschil uitkomst operaties
Uitgangsvraag
Zijn er dag/nacht verschillen in de uitkomsten van (spoed) operatieve zorg?
Aanbeveling
Streef naar dezelfde kwaliteitseisen voor een spoedoperatie- of interventieteam in termen van ervarenheid en specialisatie als overdag indien er een dwingende tijdsgebonden reden is om een operatieve ingreep buiten kantooruren uit te voeren.
Overwegingen
Een belangrijk aspect in de organisatie van acute zorg zijn spoed-chirurgische interventies in de nacht. De eis om kwalitatief goede zorg te leveren op een 24 uurs basis zou in deze gevallen kunnen botsen met de werkelijkheid van een andere zorgorganisatie en de impact van menselijke factoren zoals vermoeidheid. In deze module is gekeken naar de invloed van menselijke factoren op verschillen in twee klinische uitkomsten, 30 dagen mortaliteit en incidentie van complicatie, van chirurgische ingrepen uitgevoerd in de nacht ten opzichte van dezelfde ingrepen uitgevoerd overdag.
De werkgroep heeft ervoor gekozen om een algemene search te verrichten waarin de uitkomsten niet per discipline of type interventie gespecificeerd werden. Uiteindelijk zijn met name studies over resultaten van orgaantransplantaties (nier, lever, hart, longen) en over orthopedische ingrepen bij heupfracturen gevonden en tevens een studie over kaak chirurgische ingrepen na trauma. Als deze studies samengevoegd worden is het algemene beeld dat er zowel voor de 30-dagen mortaliteit als voor de incidentie van complicaties geen verschil lijkt te zijn tussen ingrepen uitgevoerd overdag en in de nacht. Zoals in de inleiding werd benadrukt, zijn de klinische uitkomsten het resultaat van een combinatie van factoren waarvan de impact van tijdstip van de dag op het functioneren van het operatieteam er maar één is. De invloed van het menselijk factor is in wisselende mate te herleiden van de verschillende studie die in deze analyse geïncludeerd zijn.
De beste studies hiervoor zijn de studies over uitkomsten van orgaantransplantatie en met name de grote retrospectieve studie van George et al. In deze studie is retrospectief gekeken naar uitkomsten van hart en longtransplantatie over 10 jaar (2000 tot 2010) in de Verenigde Staten. Interventies werden verdeeld in een dag groep van 07.00 tot 19.00 uur en een nacht groep van 19.00 tot 07.00 uur waarin de start van de operatie bij de ontvanger de indeling bepaalde. In de deze studie werden 27118 patiënten geïncludeerd met een evenredige distributie in dag en nacht groepen. Er werden geen verschillen gezien in 30-dagen mortaliteit of complicaties tussen beide groepen gezien. Deze studie is vrij van selectiebias wat betreft indeling van ingrepen overdag of ’s nachts door de spoed karakter van de ingreep: er is een zeer kort interval tussen operatie bij donor en ontvanger van gemiddeld drie uur met uiteindelijk en evenredige distributie van dag- en nachtgroepen. De operaties in beide groepen werden door dezelfde teams uitgevoerd dus is er geen sprake van invloed van verschil in ervaring of op elkaar ingespeelde teams op de uitkomsten. Ten slotte, alhoewel de nachtgroep al om 19.00 uur start, is te verwachten dat gezien de gemiddelde duur van de operaties een significante deel daarvan echt in de nachtelijke uren plaatsgevonden heeft en dat vermoeidheid en circadiaan ritme zeker een invloed zou spelen in deze groep. De auteurs concluderen dat in ervaren chirurgische en anesthesiologische teams die goed op elkaar zijn ingespeeld en gewend zijn aan complexe nachtelijke operaties, de menselijke factor geen impact heeft op klinische uitkomsten.
In de andere vergelijkbare studie van Lonze over levertransplantatie worden vergelijkbare resultaten gevonden. Het betreft een retrospectieve studie over uitkomsten van 578 levertransplantaties in een centrum tussen 1995 en 2008 in de Verenigde Staten. Operaties werden afhankelijk van de starttijd ingedeeld in intervallen van 4u. Alhoewel 30-dagen mortaliteit en incidentie van complicaties niet verschillend was in de verschillende intervallen duurde overwegend nachtelijke operaties langer en was er een trend voor de noodzaak voor meer bloedproducten in de nacht. Hierbij is wel op te merken dat de samenstelling van de teams verschillend was overdag en in de nacht (alleen dedicated anesthesie en verpleegkundig personeel overdag). Daarbij merken de auteurs op dat in de intervallen waar deze verschillen het grootst waren ook vaker een dienstwisseling was vergeleken met operaties uitgevoerd overdag. Dit alles maakt het moeilijk om de invloed van de menselijke factor te onderscheiden van andere organisatorische factoren.
De andere studies over niertransplantatie en orthopedische chirurgie lenen zich alleen in zeer geringe mate voor analyse van dit aspect. In het geval van niertransplantatie omdat het spoedkarakter van de ingreep veel minder aanwezig is en dus het risico op selectiebias groter is. Daarnaast waren de operatieteams overdag en in de nacht zowel in mate van specialisatie als ervaring verschillend. In de orthopedische studies worden heel weinig patiënten echt in de nacht geopereerd en de selectie van de patiënten is onduidelijk.
Concluderend laat de literatuursearch voor beide klinische uitkomsten geen verschil zien van overdag interventies ten opzichte van interventies in de nacht. De kwaliteit van bewijsvoering is zeer laag. In de studies waar het meest selectief gekeken kan worden naar de invloed van de menselijke factor op klinische uitkomsten lijkt deze, indien de andere organisatorische factoren geoptimaliseerd zijn en de operatie door een ervaren team wordt uitgevoerd niet van klinisch belang. De andere studies waarin geen dedicated teams van vergelijkbare ervaring werden vergeleken laten subtiele verschillen zien ten nadele van de operaties uitgevoerd in de nacht met minder ervaren of niet dedicated team. Om deze reden wordt ondanks de algemene bevinding dat er geen verschil is in spoedoperaties overdag en ’s nachts in de aanbeveling wel benadrukt dat dit waarschijnlijk alleen geldt als organisatorische aspecten geoptimaliseerd zijn.
Onderbouwing
Achtergrond
In de module organisatie van de zorg worden organisatorische factoren bestudeerd die van invloed zijn op de uitkomsten van spoedprocedures. Eén aspect hiervan is het uitvoeren van (spoed)operaties in de nacht. Er zijn meerdere redenen te bedenken waarom een operatie die in de nacht uitgevoerd wordt andere uitkomsten kan hebben dan dezelfde operatie overdag: organisatorische factoren (delay van beslissing tot uitvoering door bijvoorbeeld afwezigheid van het team of benodigde apparatuur, opvang, triage of behandeling door relatief onervaren artsen) maar ook menselijke aspecten (vermoeidheid, fysiologisch dag-nacht ritme, verminderde alertheid) kunnen zowel op klinische beslispunten als technische uitvoering van invloed zijn.
Deze module richt zich op het laatste genoemde aspect: de invloed van menselijke factoren op klinische uitkomsten (complicaties, mortaliteit) op operaties uitgevoerd in de nacht vergeleken met dezelfde operaties uitgevoerd overdag. Het vergelijken van uitkomsten na operaties uitgevoerd in het weekend (het weekend effect) valt dus buiten deze vraag. In de praktijk zullen echter meerdere factoren invloed uitoefenen op de uitkomsten waardoor het herleiden van de contributie van alleen de menselijke factor niet altijd eenvoudig zal zijn.
Uiteindelijk probeert deze module te evalueren in hoeverre het uitvoeren van spoedeisende chirurgie ’s nachts de klinische uitkomst (negatief) beïnvloedt ten opzichte van dezelfde operatie overdag, uitgaande van een situatie waar andere organisatorische factoren voor zover mogelijk geoptimaliseerd zijn. De beslissing over het vervolgens wel of niet uitvoeren van een operatie is uiteindelijk afhankelijk van de balans tussen dit effect en een eventuele nadelig effect van afwachtend beleid. Dit zal per ingreep afzonderlijk bekeken moeten worden wat buiten het kader van deze richtlijn valt.
Conclusies / Summary of Findings
|
GRADE ZEER LAAG |
Er lijkt geen verschil te zijn in de 30-dagen mortaliteit van spoedingrepen ’s nachts ten opzichte van ingrepen gedurende de dag.
Bronnen (Chacko, 2011; George, 2011; Rashid, 2013; Switzer, 2013) |
|
GRADE ZEER LAAG |
Er lijkt geen verschil te zijn in het aantal complicaties van spoedingrepen ’s nachts ten opzichte van ingrepen gedurende de dag.
Bronnen (Fechner, 2008; Lonze, 2010; Seow, 2004; Shaw, 2012; Switzer, 2013) |
Samenvatting literatuur
Beschrijving studies
In totaal zijn acht studies opgenomen in de literatuuranalyse. De volgende studies (N=4) onderzochten de 30-dagen mortaliteit: Chacko, 2011; George, 2011; Rashid, 2013; Switzer, 2013.
De volgende studies (N=5) hebben naar complicaties gekeken: Fechner, 2008; Lonze, 2010; Seow, 2004; Shaw, 2012; Switzer, 2013.
Alle studies beschrijven de verschillen tussen acute (chirurgische) ingrepen die gedurende de dag plaatsvinden in vergelijking met ingrepen die in de nacht werden uitgevoerd. De termen “during office hours” en “out-of-office hours” zijn wellicht passender. De definitie van dag en nacht verschilt per studie, maar over het algemeen wordt 07:00 of 08:00 uur als begintijd voor overdag gezien en 17:00 of 18:00 uur als het startmoment voor de nachtperiode. Ingrepen ’s nachts werden beschouwd als de interventiegroep en ingrepen overdag als controlegroep.
In één studie (Switzer, 2013) is zowel de uitkomstmaat 30-dagen mortaliteit als complicaties beschreven. Alle studies betreffen retrospectieve cohortstudies. De studies beschrijven een diversiteit aan aandoeningen waarvoor de patiënten behandeld zijn, daarnaast varieert de definitie van night-time surgery en day-time surgery per studie.
Korte beschrijving per geïncludeerde studie, voor meer informatie zie de evidence tabellen.
Rashid (2013) beschrijft een studie uit Pakistan en beschrijft de dag/nachtverschillen bij 194 patiënten met (per)trochantere femurfracturen. Patiënten zijn gemiddeld 58 jaar oud. Tijdframe nacht 17:00 tot 07:00 uur.
Chacko (2011) is een studie die een retrospectief cohort uit Israël beschrijft van 767 patiënten met heupfracturen. Gemiddelde leeftijd is 83 jaar. Tijdframe nacht 18:00 tot 07:00 uur.
Switzer (2013) bestudeert een retrospectief cohort uit de VS naar de chirurgische behandeling van heupfracturen bij 859 patiënten met een gemiddelde leeftijd van 79 jaar. Tijdframe nacht 16:00 tot 07:00 uur.
In George (2011) zijn twee relevante cohorten patiënten beschreven. Een groep patiënten die een longtransplantatie ondergingen en een groep die harttransplantaties onderging. Deze studie is vanwege die reden tweemaal opgenomen in de meta-analyse. In totaal zijn meer dan 25.000 patiënten opgenomen in deze studie. Tijdframe nacht 19:00 tot 07:00 uur.
Fechner (2008) is een retrospectief cohortstudie uit Duitsland naar niertransplantaties. Gemiddelde leeftijd was 48 jaar. Tijdframe nacht 20:00 tot 08:00 uur.
Lonze (2010) beschrijft een single center retrospectief cohort uit de VS bij 578 patiënten die een levertransplantatie ondergingen. Tijdframe nacht 15:00 tot 03:00 uur.
Shaw (2012) analyseerde een retrospectief cohort met niertransplantaties. Patiënten hadden een gemiddelde leeftijd van 55 jaar. Tijdframe nacht 18:00 tot 06:00 uur.
Seow (2004) beschrijft tot slot een single center studie uit de UK naar niertransplantaties. Tijdframe nacht bestond uit twee delen. Deel 1 18:00 tot 00:00 uur en deel 2 00:00 tot 7:30 uur. De resultaten van de twee tijdsframes zijn samengevoegd.
Resultaten
Uitkomstmaat 30-dagen mortaliteit
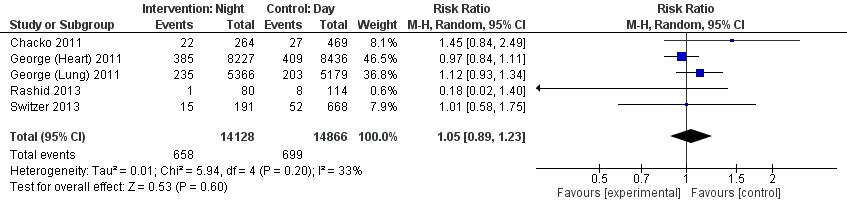
Deze uitkomstmaat is in vier verschillende studies beschreven, waarbij George (2011) de uitkomstmaat voor twee verschillende populaties beschreef. In totaal is vijf keer de uitkomstmaat 30-dagen mortaliteit meegenomen in de meta-analyse (zie figuur 1). Drie keer werd er een RR ten faveure van de controlegroep (interventie overdag) gevonden en twee keer een RR ten faveure van de interventiegroep. Het relatieve risico van een interventie ’s nachts ten opzichte van een interventie gedurende de dag was 1,05 [0,89 tot 1,22]. Het nul-effect (RR=1,00) valt binnen het 95% CI. Afgaande op de verschillende parameters voor heterogeniteit kan men concluderen dat heterogeniteit naar alle waarschijnlijkheid een beperkte rol speelt in het resultaat. Afgaande op de parameter voor heterogeniteit kan men concluderen dat heterogeniteit een kleine rol speelt in het resultaat. De τ2-waarde van 0,01 is hier een indicatie voor.
Figuur 1 Forest plot uitkomstmaat 30-dagen mortaliteit
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat 30-dagen mortaliteit is met één niveau verlaagd gezien het verschil in de puntschatters van de studies en het omvatten van de waarde 1,0 in het betrouwbaarheidsinterval (imprecisie). Uitgangspositie bewijskracht was vanwege het observationele studiedesign LAAG. Het niveau van de bewijskracht komt uit op ZEER LAAG.
Uitkomstmaat complicaties
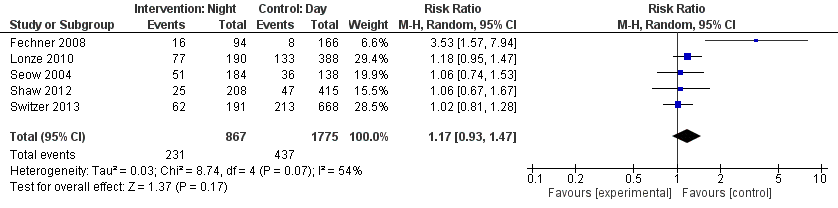
Deze uitkomstmaat is in zeven verschillende studies beschreven. De interpretatie van deze uitkomstmaat vormt een probleem omdat de definitie van de uitkomstmaat per studie licht verschilt. De uitgevoerde meta-analyse (figuur 2) geeft een inzicht in het relatieve risico van een ingreep ’s nachts ten opzichte van een ingreep gedurende de dag. Zes studies rapporteerden een RR ten faveure van de controlegroep, terwijl één studie een RR rapporteerde ten gunste van de interventie. Het relatieve risico van een interventie ’s nachts ten opzichte van een interventie gedurende de dag was 1,17 [0,93 tot 1,47]. Het nul-effect (RR=1,00) valt op de rand van het 95% CI. Afgaande op de parameter voor heterogeniteit kan men concluderen dat heterogeniteit een kleine rol speelt in het resultaat. De τ2-waarde van 0,03 is hier een indicatie voor.
Figuur 2 Forest plot uitkomstmaat complicaties
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (uiteenlopende definities uitkomstmaat), het bevatten van de waarde 1,0 in het betrouwbaarheidsinterval (imprecisie) en niet halen van de vooraf gedefinieerde grens van klinische besluitvorming (imprecisie, RR 2,00).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende vraagstelling:
Is er een verschil in uitkomst tussen acute chirurgische of radiologische ingrepen die ’s nachts plaatsvinden versus acute ingrepen of interventies die overdag worden uitgevoerd?
Relevante uitkomstmaten
De werkgroep achtte mortaliteit en complicaties voor de besluitvorming kritieke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt:
Mortaliteit is gedefinieerd als 30-dagen mortaliteit.
De werkgroep definieerde niet a priori de uitkomstmaat complicaties, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID) en Embase (Elsevier) is met relevante zoektermen gezocht naar studies die acute (chirurgische) ingrepen beschreven en de verschillen tussen ingrepen ’s nachts en ingrepen overdag hebben bestudeerd. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 3435 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- primair vergelijkend onderzoek;
- acute (chirurgische) ingreep;
- uitkomstmaat 30-dagen mortaliteit of uitkomstmaat (algemene) complicaties. – Toelichting: alleen indien er cijfers over de postoperatieve complicaties in het algemeen bekend waren werd de studie meegenomen;
- beschrijving operaties ’s nachts versus operatie overdag (definitie van operatie ’s nachts en operatie overdag verschilt per studie);
- Gepubliceerd vanaf begin database tot en met december 2014;
Op basis van titel en abstract werden in eerste instantie 65 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 57 studies geëxcludeerd (zie exclusietabel), en acht studies definitief geselecteerd.
(Resultaten)
Acht onderzoeken zijn opgenomen in de literatuuranalyse. De evidence tabellen hiervan en beoordeling van individuele studiekwaliteit kunt u in onder het tabblad Onderbouwing vinden.
Referenties
- Chacko AT, Ramirez MA, Ramappa AJ, et al. Does late night hip surgery affect outcome? J Trauma. 2011;71(2):447-53. PubMed PMID: 21825947.
- Fechner G, Pezold C, Hauser S, et al. Kidney's nightshift, kidney's nightmare? Comparison of daylight and nighttime kidney transplantation: impact on complications and graft survival. Transplant Proc. 2008;40(5):1341-4. PubMed PMID: 18589101.
- George TJ, Arnaoutakis GJ, Merlo CA, et al. Association of operative time of day with outcomes after thoracic organ transplant. JAMA. 2011;305(21):2193-9. PubMed PMID: 21632483.
- Lonze BE, Parsikia A, Feyssa EL, et al. Operative start times and complications after liver transplantation. Am J Transplant. 2010;10(8):1842-9. PubMed PMID: 20659090.
- Powell JT, Hinchliffe RJ, Thompson MM, et al. IMPROVE trial investigators. Observations from the IMPROVE trial concerning the clinical care of patients with ruptured abdominal aortic aneurysm. Br J Surg. 2014;101(3):216-24; discussion 224. PubMed PMID: 24469620.
- Rashid RH, Zubairi AJ, Slote MU, et al. Hip fracture surgery: does time of the day matter? A case-controlled study. Int J Surg. 2013;11(9):923-5. PubMed PMID: 23872033.
- Seow YY, Alkari B, Dyer P, et al. Cold ischemia time, surgeon, time of day, and surgical complications. Transplantation. 2004;77(9):1386-9. PubMed PMID: 15167595.
- Shaw TM, Lonze BE, Feyssa EL, et al. Operative start times and complications after kidney transplantation. Clin Transplant. 2012;26(3):E177-83. PubMed PMID: 22563648.
- Switzer JA, Bennett RE, Wright DM, et al. Surgical time of day does not affect outcome following hip fracture fixation. Geriatr Orthop Surg Rehabil. 2013;4(4):109-16.PubMed PMID: 24600531.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Rashid, 2013 |
Type of study: Case-control
Setting: Single center
Country: Pakistan
Funding: None |
Inclusion criteria: Patients who underwent DHS surgery for Inter-trochanteric (IT) fractures.
Exclusion criteria: Patients with incomplete records, bilateral fractures, periprosthetic fracture, previous hip fracture, other concomitant fractures, with a fracture as a result of primary or metastatic bone tumors were excluded.
N total at baseline: Intervention: 80 Control: 114
Important prognostic factors2: age ± SD: I: 68 ± 14 C: 68 ± 14
Gender: I: 58 % M C: 46 % M
Groups comparable at baseline. |
Describe intervention: Night-time surgery, defined as start time between 17:00 – 07:00
Dynamic Hip Screw (DHS) surgery for Intertrochanteric fractures.
|
Describe control: Day-time surgery, defined as start time 07:00 – 17:00
Dynamic Hip Screw (DHS) surgery for Intertrochanteric fractures.
|
Length of follow-up: 30 days
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
30-day mortality I: 1/80 (1,25%) C: 8/114 (7%)
RR: 0,18 (0,02 – 1,39) P = 0,10
In favour of intervention (RR), although not statistically significant.
|
|
|
Chacko, 2011 |
Type of study: Retrospective cohort
Setting: Single Center
Country: Israel
Funding: not mentioned. |
Inclusion criteria: Patients aged 65 years or older with isolated hip fractures Exclusion criteria: Patients with periprosthetic fractures, bilateral fractures, previous hip fracture, or ipsilateral fracture within the previous year were excluded. Patients with a fracture as a result of primary or metastatic bone tumors were also excluded.
N total at baseline: Intervention: 268 Control: 499
Important prognostic factors2: age ± SD: I: 83 ± 8,3 C: 83 ±
Gender: I: 22 % M C: 30 % M
Groups comparable at baseline, although they differ in the gender distribution. |
Describe intervention: Night-time surgery, defined as start time between 18:00 – 07:00
Hip surgery for patients with intertrochanteric, subtrochanteric, or femoral neck fractures.
|
Describe control: Day-time surgery, defined as start time 07:00 – 18:00
Hip surgery for patients with intertrochanteric, subtrochanteric, or femoral neck fractures.
|
Length of follow-up: 48 months
Loss-to-follow-up: Not mentioned
Incomplete outcome data: I: 4/268 C: 30/499 |
Outcome measures and effect size:
30-day mortality I: 22/264 (9,3%) C: 27/469 (7,4%) Chi-2 p-value = 0,42
RR: 1,45 (0,84 – 2,49) P = 0,18
In favour of control (RR), although not statistically significant.
|
|
|
Switzer, 2013 |
Type of study: Retrospectivecohort
Setting: Single Center
Country: USA
Funding: No financial support for the research, authorship, and/or publication of this article was received. |
Inclusion criteria: Patients aged 50 years or older with an isolated hip fracture (intertrochanteric, subtrochanteric, or femoral neck fracture) who underwent surgical intervention.
Exclusion criteria: Patients with periprosthetic fractures, osteotomies (Girdlestone procedures), multiple injuries, or incomplete records were excluded.
N total at baseline: Intervention: 191 Control: 668
Important prognostic factors2: age ± SD: I: 81,0 ± 11,3 C: 77,7 ± 12,3
Gender: I: 32 % M C: 34 % M
Groups comparable at baseline, although there is a difference in age. |
Describe intervention: Night-time surgery, defined as start time between 16:00 – 07:00
Hip surgery for patients with a intertrochanteric, subtrochanteric, or femoral neck fracture.
|
Describe control: Day-time surgery, defined as start time 07:00 – 16:00
Hip surgery for patients with a intertrochanteric, subtrochanteric, or femoral neck fracture.
|
Length of follow-up: 30 days
Loss-to-follow-up: None
Incomplete outcome data: None
|
Outcome measures and effect size:
30-day mortality I: 15/191 (7,8%) C: 52/668 (7,9%) Fisher’s exact p-value = 0,99
RR: 1,01 (0,58 – 1,75) P = 0,03
In favour of control (RR), although not statistically significant.
|
|
|
George, 2011 |
Type of study: Retrospective cohort
Setting: United Network of Organ Sharing database.
Country: USA
Funding: Grant of the National Institutes of Health (USA). |
Inclusion criteria: Adults older than 18 years who underwent heart or lung transplants.
Exclusion criteria: Patients undergoing retransplant surgery were excluded.
Heart transplants N total at baseline: Intervention: 8227 Control: 8346
age ± SD: I: 51,9 ± 12,4 C: 52,1 ± 12,0
Gender: I: 76 % M C: 76 % M
Lung transplants N total at baseline: Intervention: 5366 Control: 5179
age ± SD: I: 52,6 ± 12,8 C: 52,5 ± 12,6
Gender: I: 55 % M C: 55 % M
Groups comparable at baseline |
Describe intervention: Night-time surgery, defined as start time between 19:00 – 07:00
Transplantation surgery for heart or lungs. |
Describe control: Day-time surgery, defined as start time 07:00 – 19:00
Transplantation surgery for heart or lungs. |
Length of follow-up: 32 months
Loss-to-follow-up: Not mentioned
Incomplete outcome data: None
|
Outcome measures and effect size: Heart transplants: 30-day mortality I: 385/8227 (4,8%) C: 409/8436 (4,9%) P-value = 0,67* HR 1.05 (0.83-1.32)
RR: 0,97 (0,84 – 1,11) P = 0,61
In favour of intervention (OR), although not statistically significant.
Lung Transplants: 30-day mortality I: 235/5366 (4,5%) C: 203/5179 (4,0%) p-value = 0,09 HR 1.22 (0.97-1.55) p=0.09
RR: 1,12 (0,93 – 1,34) P = 0,24
In favour of control (RR), although not statistically significant.
|
|
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Rashid, 2013 |
Unlikely |
Unclear, lost to follow-up not mentioned, but no reason to expect problems. |
Unlikely |
Unlikely |
|
Chacko, 2011 |
Unlikely |
Unclear, 20-30% lost to follow-up |
Unlikely |
Unlikely |
|
Switzer, 2013 |
Unlikely |
Unclear, no reason to expect problems. |
Unlikely |
Unlikely |
|
George, 2011 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Orman, 2012 |
Unlikely |
Unclear |
Unlikely |
Unlikely |
|
Powell, 2014 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Bertram, 2013 |
Unclear |
Unclear (follow-up of 6 weeks) |
Unclear |
Unlikely |
|
Bosma, 2010 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Fechner, 2008 |
Unlikely |
Unclear |
Unclear |
Likely |
|
Lonze, 2010 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Shaw, 2012 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Seow, 2004 |
Unlikely |
Unclear |
Unclear |
Likely |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-05-2018
Beoordeeld op geldigheid : 04-09-2024
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. De werkgroep beoordeelt jaarlijks of modules of andere onderdelen van de richtlijn aan herziening toe zijn. De werkgroep valt onder de NVvH. Als onderdeel van deze richtlijn zijn door de werkgroep spoedlijst opgesteld die door de wetenschappelijke verenigingen geaccordeerd en onderhouden moet worden.
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In samenwerking met:
- Landelijke Vereniging van Operatieassistenten
- Stichting Kind en Ziekenhuis
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft tijdens het ontwikkelproces op geen enkele wijze invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van deze richtlijn is om een landelijk uniform classificatiesysteem vast te stellen voor het prioriteren van acute operaties en interventies waarbij een anesthesieteam, een medisch specialist en ondersteunend personeel aanwezig moeten zijn. In dit systeem kunnen wetenschappelijke verenigingen de prioriteit aangeven van (hun) specifieke ingrepen. Het beoogde effect van de richtlijn is dat transparanter wordt wat een acceptabele wachttijd is voor een acute ingreep door het proces rondom spoedoperaties duidelijker te beschrijven. Deze transparantie geldt voor zorgverleners, zorginstellingen en patiënten. Daarnaast wordt geprobeerd om de randvoorwaarden te beschrijven met betrekking tot de organisatie en communicatie rondom deze ingrepen.
Doelgroep
Alle leden van de beroepsgroepen die betrokken zijn bij de spoedzorg voor patiënten die een behandeling met anesthesiologische begeleiding of bewaking moeten ondergaan. Indien een spoed-patiënt op een electieve plaats wordt gezet dan kan electieve patiënt daar hinder van ondervinden.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2013 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een indicatie voor een acute interventie waarbij gebruik wordt gemaakt van tenminste een anesthesioloog, een ondersteunend/ assisterend team en een tweede medisch specialist (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. P.H.W. Lubbert, chirurg, werkzaam in ziekenhuis de Tjongerschans, Heereveen, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Drs. L.F.M. Beenen, radioloog, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Radiologie
- Drs. J.H.J.M. Bessems, orthopedisch chirurg, werkzaam in het Erasmus MC, Rotterdam, Nederlandse Orthopaedische Vereniging
- Prof. dr. M.A. Boermeester, gastro-intestinale / oncologisch chirurg, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Heelkunde
- Dr. L. Dubois, MKA-chirurg, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Dr. K.H. Kho, neurochirurg, Medisch Spectrum Twente, Enschede, Nederlandse Vereniging voor Neurochirurgie
- Dr. S.V. Koenen, gynaecoloog, werkzaam in het Universitair Medisch Centrum Utrecht, Nederlandse Vereniging voor Obstetrie Gynaecologie
- Dr. B. van Minnen, MKA-chirurg, werkzaam in het Universitair Medisch Centrum, Groningen, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- H. Rippen, patiëntvertegenwoordiger, Stichting Kind en Ziekenhuis, Utrecht
- Drs. A. Schuurhuis, anesthesioloog/intensivist, werkzaam in het Universitair Medisch Centrum Utrecht, Nederlandse Vereniging voor Anesthesiologie
- Dr. G.J.M.W. van Thiel, medisch ethicus, werkzaam in het Universiteit Medisch Centrum, Utrecht
Subgroep
- N. Dreessen, bestuurslid LVO, werkzaam in het Zuyderland Medisch Centrum, Landelijke Vereniging van Operatieassistenten
- drs. B.C. Jacod, gynaecoloog i.o., werkzaam in het Universitair Medisch Centrum, Utrecht, Nederlandse Vereniging voor Obstetrie Gynaecologie
- drs. A. Janse, klinisch geriater, werkzaam in Ziekenhuis Gelderse Vallei, Ede, Nederlandse Vereniging voor Klinische Geriatrie
- B.D.D. van Loo, anesthesiemedewerker, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging van Anesthesie-Medewerkers
- Dr. B.M.P. Rademaker, anesthesioloog, werkzaam in het OLVG, Amsterdam, Nederlandse Vereniging voor Anesthesiologie
- drs. E.M. Verhoog, SEH-arts, werkzaam in Tergooi Ziekenhuizen, Blaricum, Nederlandse Vereniging van Spoedeisende Hulp Artsen
- F. Wienen, operatieassistent, werkzaam in Isala Klinieken, Zwolle, Landelijke Vereniging van Operatieassistenten
Met ondersteuning van:
- Ir. T.A. van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- A.A. Lamberts MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- M.E. Wessels MSc, literatuurspecialiste, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Met dank aan:
- S. van Dijk MSc, arts-onderzoeker chirurgie, afdeling Chirurgie, Academisch Medisch Centrum, Amsterdam
- N.W. de Cort, student geneeskunde, Faculty of Health, Medicine and Life Science, Maastricht Universiteit, Maastricht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar directe financiële (betrekking commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de bijlage van deze richtlijn. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten. De belangen zijn bij aanvang van het project geïnventariseerd bij de leden van de werkgroep. De leden van de werkgroep is gevraagd gedurende het ontwikkeltraject wijzigingen in de belangen te melden bij de ondersteuners. Aan het eind van het ontwikkeltraject zijn de belangen nogmaals plenair besproken.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Boermeester |
|
|
|
|
|
|
|
|
|
Beenen |
Radioloog, afgevaardigde NVvR |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Bessems |
Orthopedisch chirurg |
Docent Hogeschool Rotterdam, Docent Albeda College Rotterdam (Beiden uurvergoeding (EUR 500,00 per jaar)). |
geen |
geen |
Lid medische adviesraad vereniging aangeboren heupafwijkingen |
geen |
geen |
geen |
|
Dubois |
MKA chirug AMC Amsterdam (betaald) MKA chirug Antonius ziekenhuis (betaald) |
Secretaris stichting Bridge the Gap-> (onbetaald) Richtlijnontwikkeling NVMKA mbt aangezichtstraumatologie -> (onbetaald) docent na bijscholing (AO Foundation/SORG/ACTA/NVT/CCO) -> (onbetaald) Vereniging Medisch Tandheelkundige interactie, oud voorzitter, adviserend -> (onbetaald) |
geen |
geen |
geen |
ontwikkeling orbita implantaat via KLS Martin; geen belangenverstrengeling met oop op de richtlijn. |
zie geen reden tot belangenverstrengeling, enkel bijzondere aandacht voor orbitachirurgie met ontwikkeling in 3D software planning, patientspecifieke oplossingen en implantaten; zie extra gefinancieerd onderzoek. |
geen |
|
Kho |
Neurochirug |
geen |
nvt |
nvt |
nvt |
geen |
nvt |
neen |
|
Koenen |
Gynaecoloog / periatoloog UMC Utrecht |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Lubbert |
Chirurg |
geen |
geen |
echtgenote cardioloog |
lid van commissie patient veiligheid Ned Vereniging voor Heelkunde |
geen |
geen eigendom van patent of product. Proefschrift gericht op kwaliteit in patientenzorg. Derhalve geinteresseerd in veiligheid en kwaliteit. |
geen |
|
van Minnen |
Kaakchirurg, chef de clinique, UMC Groningen |
Bestuurslid vereniging Regiotafel Antistolling Gronigen, overlegorgaan om de (perioperatieve) zorg rond geantistolde patient in de regio te organiseren. (onbezoldigd) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Rippen |
Directeur Stichting Kind en Ziekenhuis |
Bestuurslid Onbeperkt aan de slag – ontbetaald Bestuurslid Vereniging van Ehlers-Danlos patienten - onbetaald Feelance projectadviseur/consultant - diverse belangenbehartigings-organisaties en soms zorgorganisaties - betaald per opdracht |
geen |
geen |
geen |
geen |
geen |
geen |
|
Schuurhuis |
Anethesioloog in het UMCU |
Voorzitter commisie Richtlijnen en Indicatoren NVA (vacatiegeld voor vergaderingen) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van Thiel |
UD Medisch Ethiek / UMC Utrecht div. Julius Centrum |
Plv lid - ethicus VCMO (een erkende METC) betaald |
geen |
geen |
geen |
Geen belangen die relevant zijn voor dit onderzoek. |
geen |
geen |
|
Lamberts |
Adviseur Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
van Barneveld |
Directeur Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
|
|
|
|
|
|
|
|
|
|
Subwerkgroep |
||||||||
|
Dreessen |
Operatieassistent |
Bestuurslid LVO (onbetaald) |
geen |
geen |
Erkenning beroep operatieassistent |
geen |
geen |
geen |
|
Janse |
Klinisch Geriater |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Jacod |
AIOS Gynaecologie UMC Utrecht |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Rademaker |
subwerkgroep 'Medisch inhoudelijk'. |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Verhoog |
SEH-arts Ter Gooi Eigen bedrijf, eenmanszaak, partime Auxilium primum; lesgeven, trainingen, waarneming binnen (acute) geneeskunde (betaald) |
geen |
geen |
geen |
Richtlijne-commissie NVSHA |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Inbreng van het patiëntenperspectief werd gewaarborgd door een afgevaardigde van een landelijke patiëntenvereniging in de werkgroep op te nemen en uitgangsvragen op te stellen specifiek over voor de patiënt relevante onderwerpen. Tijdens de oriënterende zoekactie werd er specifiek gezocht naar literatuur over het patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is voor commentaar voorgelegd aan Kind en Ziekenhuis, de Patiëntenfederatie Nederland en Zorgbelang Nederland. Vanwege de te verwachten ethische dilemma’s in de richtlijn die gepaard gaan met het verdelen van schaarse middelen en tijd in de gezondheidszorg heeft er een medisch ethicus zitting gehad in de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is nadrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatiemodule is te vinden bij de aanverwante producten.
Werkwijze
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijn voor richtlijnen’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor de kritieke en belangrijke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, systematische reviews (Medline (OVID)), en literatuur over patiëntvoorkeuren (patiëntenperspectief; Medline (OVID)). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (Risk of Bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals criteria die van invloed zijn op de aanbeveling, de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn is er een interne kwaliteitsindicator ontwikkeld om het toepassen het classificatiesysteem van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de module Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers M, Kho ME, Browman GP, et al. for the AGREE Next Steps Consortium. AGREE II: Advancing guideline development, reporting and evaluation in healthcare. Can Med Assoc J. 2010; 182:E839-842; doi:10.1503/090449.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Link: https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from www.guidelinedevelopment.org/handbook.
Schünemann HJ, Oxman AD, Brozek J, et al.; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. Erratum in: BMJ. 2008;336(7654).
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
Engels, |
1 exp specialties, surgical/ or colorectal surgery/ or general surgery/ or neurosurgery/ or orthopedics/ or traumatology/ or "Anesthesiology"/ or exp surgical procedures, operative/ or gynecologic surgical procedures/ or exp "dilatation and curettage"/ or uterine artery embolization/ or obstetric surgical procedures/ or exp delivery, obstetric/ or surgical procedures, operative/ or angioplasty, balloon, coronary/ or exp percutaneous coronary intervention/ or "Heart Defects, Congenital"/su (2642071) 2 "After-Hours Care"/ (1106) 3 (nighttime or (night adj3 (shift or admission* or schedule*))).ti,ab. (8309) 4 (off-hours or after-hours or "out of hours" or "working hours" or daytime or day-time or "time of day").ti,ab. (34543) 5 2 or 3 or 4 (39539) 6 1 and 5 (3014) 7 limit 6 to (dutch or english or french or german) (2802) 8 exp Mortality/ (294250) 9 complications.fs. (1665919) 10 exp treatment outcome/ (700191) 11 mortality.fs. (442886) 12 (mortality or complication* or morbidity).ti,ab. (1149178) 13 exp Postoperative Complications/ or ((postoperative or perioperative or post-operative or peri-operative) adj2 complication*).ti,ab. (467191) 14 Time-to-Treatment/ (938) 15 "length of stay"/ or patient readmission/ or Reoperation/ (135455) 16 ("length of stay" or readmission* or re-admission* or reoperation* or re-operation*).ti,ab. (65729) 17 8 or 9 or 10 or 11 or 12 or 13 or 14 or 15 or 16 (3605454) 18 7 and 17 (1381) 19 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (233236) 20 7 and 19 (38) 21 18 and 19 (25) –SR met limitering op outcome, 25 uniek 30 7 not 18 (1421) – restgroep zonder limitering op outcome – 1354 uniek 31 18 not 21 (1356) – met limitering op outcome, zonder SRs – 1290 uniek |
1649 (outcomes) 1786 rest |
|
Embase (Elsevier) |
'surgery'/exp/mj OR 'surgery'/mj OR 'colorectal surgery'/exp/mj OR 'general surgery'/exp/mj OR 'neurosurgery'/exp/mj OR 'orthopedics'/exp/mj OR 'orthopedic surgery'/exp/mj OR 'traumatology'/exp/mj OR 'anesthesiology'/exp/mj OR 'gynecologic surgery'/exp/mj OR 'curettage'/exp/mj OR 'dilatation'/exp/mj OR 'uterine artery embolization'/exp/mj OR 'obstetric operation'/exp/mj OR 'delivery'/exp/mj OR 'transluminal coronary angioplasty'/exp/mj OR 'transluminal coronary angioplasty'/mj OR 'percutaneous coronary intervention'/exp/mj OR 'congenital heart heart malformation'
AND ('out-of-hours':ab,ti OR nighttime:ab,ti OR 'off hours':ab,ti OR 'after hours':ab,ti OR 'out of hours':ab,ti OR 'working hours':ab,ti OR daytime:ab,ti OR 'day time':ab,ti OR 'time of day':ab,ti OR ((night OR nocturnal) NEAR/3 (shift* OR schedule* OR admission* OR arrival*)):ab,ti)
AND ([dutch]/lim OR [english]/lim OR [french]/lim OR [german]/lim) AND [embase]/lim
AND ('mortality'/exp OR 'complication'/lnk OR 'treatment outcome'/exp OR complication*:ab,ti OR morbidity:ab,ti OR 'postoperative complication'/exp OR (('postoperative' OR 'perioperative' OR 'post-operative' OR 'peri-operative') NEAR/2 complication*):ab,ti OR 'time to treatment'/exp OR 'length of stay'/exp OR 'hospital readmission'/exp OR 'reoperation'/exp OR 'length of stay':ab,ti OR readmission*:ab,ti OR 're-admission':ab,ti OR 're-admissions':ab,ti OR reoperation*:ab,ti OR 're-operation':ab,ti OR 're-operations':ab,ti)
AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) (13 SR, 9 uniek 1056 (met limitering op complicaties, zonder SR) not 'conference abstract':it (793) – 326 uniek
1075 rest (zonder limitering op complicaties) not 'conference abstract':it (695) – 432 uniek |
Exclusietabel
Obstetrie
|
Auteur, jaartal |
Inclusie/ Exclusie |
Toelichting |
|
Bailit et al., 2006 |
Exclusie |
Niet de juiste uitkomstmaten |
|
Peled et al., 2011 |
Exclusie |
Niet de juiste uitkomstmaten |
Trauma
|
Auteur, jaartal |
Inclusie/ Exclusie |
Toelichting |
|
Rashid, 2013 |
Inclusie |
Heupfractuur, case-controle onderzoek. Mortaliteit (30 dagen: % + p-waarde) |
|
Bertram 2013 |
Exclusie |
MKA-chirurgie, retrospectief cohort. Geen mortaliteit, wel complication rate (% + p-waarde). Beschrijft weekend-effect, niet dag/nacht. |
|
Bosma, 2010 |
Exclusie |
Heupfractuur, retrospectief onderzoek. Geen 30 dagen mortaliteit, wel complication rate (% + p-waarde). Beschrijft weekend-effect, niet dag/nacht. |
|
Busse, 2004 |
Exclusie |
Globale beschrijving, retrospectief cohort. Gaat over time of admission. |
|
Chacko, 2011 |
Inclusie |
Heupfractuur, retrospectief onderzoek. 30 dagen mortaliteit (% + p-waarde), geen complicaties. |
|
Switzer, 2013 |
Inclusie |
Heupfractuur, retrospectief onderzoek. 30 dagen Mortaliteit (% + p-waarde), complicaties (% + p-waarde) |
|
Ricci, 2009 |
Exclusie |
Niet de juiste uitkomstmaten |
Transplantation: welke uitkomstmaten?
|
Auteur, jaartal |
Inclusie/ Exclusie |
Toelichting |
|
Fechner, 2008 |
Inclusie |
Niertransplantatie, retrospectief cohort. Geen mortaliteit, wel algemene chirurgische complicaties. |
|
George, 2011 |
Inclusie |
Thoraxorgaan transplantatie, retrospectief cohort. 30 Mortaliteit (% + p-waarde + hazard ratio), geen algemene complicaties |
|
Kienzl, 2013 |
Exclusie |
Geen antwoord op PICO |
|
Lonze, 2010 |
Inclusie |
Levertransplantatie, retrospectief cohort. Geen 30 dagen mortaliteit, wel algemene complicaties (N + %) |
|
Orman, 2012 |
Exclusie |
Levertransplantatie, retrospectief cohort. 30 dagen mortaliteit (Hazard ratio), geen complicaties |
|
Shaw, 2012 |
Inclusie |
Niertransplantatie, retrospectief cohort. Geen cijfers 30 dagen mortaliteit, complicaties (N + % + OR) |
|
Seow, 2004 |
Inclusie |
Wel complicaties algemeen (N + %) |
General Surgery
|
Auteur, jaartal |
Inclusie/ Exclusie |
Toelichting |
|
Araujo, 2014 |
Exclusie |
Electieve ingrepen |
|
Crandall, 2009 |
Exclusie |
Electieve ingrepen |
|
Forbes, 2014 |
Exclusie |
Electieve ingrepen |
|
Griner, 2011 |
Exclusie |
Retrospectief cohort, geen vergelijkend onderzoek |
|
Kelz, 2008 |
Exclusie |
Electieve ingrepen |
|
Kelz, 2009 |
Exclusie |
Electieve ingrepen |
|
Komen, 2009 |
Exclusie |
Geen vergelijkende studie voor dag/nacht |
|
Lee, 1989 |
Exclusie |
Keek naar intensive care team intervention. |
|
Lee, 2013 |
Exclusie |
Electieve ingrepen |
|
National surgical research collaborative, 2013 |
Exclusie |
Geen vergelijkende studie voor dag/nacht |
|
Phatak, 2014 |
Exclusie |
Retrospectief cohort. Cholecystectomie. Mortaliteit als uitkomstmaat, ook electief. |
|
Powell, 2014 |
Exclusie |
Geen juiste gegevens beschreven |
|
Schnuriger, 2014 |
Exclusie |
Niet goed vergelijkbare studie. |
|
Scott, 2014 |
Exclusie |
Geen vergelijkende studie voor dag/nacht |
|
Turrentine, 2010 |
Exclusie |
Electieve ingrepen |
|
Wu, 2014 |
Exclusie |
Retrospectief cohort, cholecystectomy. Geen mortaliteit |
Anaesthesia: welke uitkomstmaten?
|
Auteur, jaartal |
Inclusie/ Exclusie |
Toelichting |
|
Aya, 1999 |
Exclusie |
Geen relevante uitkomstmaat. |
Cardiologie
|
Auteur, jaartal |
Inclusie/ Exclusie |
Toelichting |
|
|
|
Alg. opmerking: Cardiologische ingrepen vallen af. |
|
Beohar, 2001 |
Exclusie |
|
|
Cardoso, 2014 |
Exclusie |
|
|
Casella, 2011 |
Exclusie |
|
|
Cubeddu, 2013 |
Exclusie |
|
|
De Boer, 2012 |
Exclusie |
|
|
Dominguez, 2007 |
Exclusie |
|
|
Garot, 1997 |
Exclusie |
|
|
Glaser, 2008 |
Exclusie |
|
|
Helve, 2014 |
Exclusie |
|
|
Henriques, 2003 |
Exclusie |
|
|
Lairez, 2009 |
Exclusie |
|
|
Levi, 2014 |
Exclusie |
|
|
Magid, 2005 |
Exclusie |
|
|
Maier, 2010 |
Exclusie |
|
|
Noman, 2012 |
Exclusie |
|
|
Ortolani, 2007 |
Exclusie |
|
|
Rathod, 2013 |
Exclusie |
|
|
Sadeghi, 2004 |
Exclusie |
|
|
Saleem, 2004 |
Exclusie |
|
|
Shavelle, 2014 |
Exclusie |
|
|
Sorita, 2014 |
Exclusie |
|
|
Uyarel, 2009 |
Exclusie |
|
|
Vimalesvaran, 2013 |
Exclusie |
|
|
Zahn, 1999 |
Exclusie |
|
Day After surgery
|
Auteur, jaartal |
Inclusie/ Exclusie |
Toelichting |
|
Benson, 2014 |
Exclusie |
Sleep deprivation and performance next day. Geen antwoord UV, voor overwegingen? |
|
Crudu, 2012 |
Exclusie |
Sleep deprivation and performance next day. Geen antwoord UV. |
|
Rothschild, 2009 |
Exclusie |
Sleep deprivation and performance next day. Geen antwoord UV. |
|
Vinden, 2014 |
Exclusie |
Sleep deprivation and performance next day. Geen antwoord UV. |
|
Sharpe, 2013 |
Exclusie |
Sleep deprivation and performance next day. Geen antwoord UV. |
|
Chu, 2011 |
Exclusie |
Sleep deprivation and performance next day. Geen antwoord UV. |
Simulation
|
Auteur, jaartal |
Inclusie/ Exclusie |
Toelichting |
|
Grantcharov, 2001 |
Exclusie |
Over performance after night shift. |
|
Taffinder, 1998 |
Exclusie |
Over performance after night shift. |
