Acuut operatieteam
Uitgangsvraag
Is de aanwezigheid van een aparte spoed-OK met bijbehorend team in een ziekenhuis tijdens kantooruren van toegevoegde waarde?
Aanbeveling
Overweeg als instelling om afhankelijk van het volume spoed ingrepen zowel een ruimte als personeel beschikbaar te hebben voor niet-geplande ingrepen. Dit betreft zowel een ondersteunend team als een chirurg of interventionist.
Overweeg gebruik te maken van een apart acuut OK-team met chirurg gedurende kantooruren om de beschikbaarheid van specialistische supervisie in opleidingsziekenhuizen te vergroten.
Overweeg in opleidingsziekenhuizen specifieke afspraken te maken over de rol van A(N)IOS bij spoedingrepe.
Overweeg bij de beslissing voor een aparte spoed-OK de volgende criteria mee te laten wegen:
- aanwezigheid traumacentrum in de betreffende kliniek;
- aanwezigheid van een ander specialisme met veel spoedingrepen(obstetrie);
- veel uitval electieve operaties door inbreken voor spoedingrepen;
- veel ingrepen na 22.00 uur.
Overwegingen
ACS
De Acute Care Service is het meest uniform beschreven model in de literatuur en het wordt daarom als voorbeeld in deze Richtlijn gebruikt. De studies zijn vooral gericht op appendectomieën of cholecystectomieën, en kunnen niet zomaar worden geëxtrapoleerd naar andere snijdende (deel)specialismen. Diverse auteurs beschrijven echter de noodzaak en voordelen van een aparte spoed-OK overdag ook voor andere specialismen, zoals spine surgery, aangezichtstraumata, obstetrie of orthopedie, afhankelijk van de patiënten aantallen en specialisatie van het centrum (Rahman, 2007; Kalantzis, 2012; Britton, 2014; Elder, 2005; Sethi, 2015; Leppaniemi, 2014). De werkgroep is van mening dat de aanbevelingen van de ACS ten dele ook van toepassing zijn op andere specialismen. Zo zal de beschikbaarheid van een operatiekamer en een anesthesieteam de doorstroming van opeenvolgende spoedoperaties van verschillende specialismen versnellen. Maar het zal niet mogelijk zijn om van elk specialisme of aandachtsgebied een ter zake kundige operateur vrij te plannen. Oostrum (2006) heeft een alternatief voorgesteld (cyclisch plannen), maar effect op de tijd tot operatie, het optreden van complicaties, de mortaliteit en de opnameduur zijn niet beschreven.
Comfort
De betere uitkomst van behandelingen door invoering van een Acute Care Surgical team kan niet uitgedrukt worden in afgenomen mortaliteit, maar wel in minder complicaties. De gemiddeld kortere wachttijd tot operatie van zeven uur is een enorme verbetering van het patiëntcomfort. Minder angst, minder lang pijn, minder lang nuchter, minder onzekerheid kunnen belangrijke drijfveren zijn om een ingreep met spoed uit te voeren. Elke verbetering hiervan is gerechtvaardigd. In UK, Canada, Ierland, Australië, USA, Nieuw-Zeeland zijn hierover uitvoerige beleidsstukken verschenen.
|
“The Association of Surgeons of Great Britain and Ireland and the Royal Australasian College of Surgeons have both advocated the provision of dedicated emergency surgery theatre space. This is in response to concerns that in many hospitals, emergency surgery was neither planned nor given adequate resources. Emergency surgical patients are therefore made to compete for care with elective patients, to the disservice of both groups. Emergency operations are often delayed until the end of elective surgery lists and performed after hours, in many cases by more junior staff. Conversely, unplanned emergency operations can lead to elective cases being cancelled. This has the potential to lead to suboptimal care of both emergency and elective surgical patients, as well as having a negative impact on the job satisfaction of surgeons.” |
Kwaliteit van het team
In bijna elk artikel wordt de noodzaak voor behandeling of beoordeling door de medisch specialist zelf aangegeven in plaats van die door de arts in opleiding. Omdat spoedingrepen een onderdeel van het opleidingspallet voor AIOS zijn is het belangrijk om afspraken te maken over tijdsduur en supervisie van deze ingrepen. Zeker omdat de aanwezigheid van A(N)IOS in de avonduren zeer beperkt is door het werktijdenbesluit. De instelling van een ACS-team met operatiekamer overdag maakt het tevens mogelijk voor medisch specialisten om zelf bij de acute patiënt aanwezig te zijn (Charalambous, 2005). Sethi (2015) beschrijft de voordelen van een aparte spoed-OK voor KNO-residents zowel voor de opleiding als ook voor efficiënte inzet van OK-teams. Elder (2005) heeft de kwaliteit van het hele team onderzocht en benoemt de voordelen van een gespecialiseerd orthopedisch-trauma-OK-anesthesieteam overdag ten opzichte van een niet gespecialiseerd team bij acute heupfracturen. Hij vindt een significant kortere tijd tot operatie, andere anesthesietechniek, eerder ontslag, sneller herstel, minder morbiditeit en mortaliteit. Bij een ACS-team is vrijwel altijd de medisch specialist zelf aan het werk en speelt de AIOS een kleinere rol.
Onderbouwing
Achtergrond
Bij deze uitgangsvraag is onderzocht of een aparte spoed-OK met bijbehorend team overdag een gunstig effect heeft op de tijd tot operatie, het optreden van complicaties, de mortaliteit en de opnameduur. In de literatuur worden allerlei varianten beschreven om knelpunten bij het uitvoeren van spoedoperaties op te lossen. Het gaat hierbij dan vaak om:
- een lange wachttijd voor ongeplande ingrepen;
- te veel werktijd en werkbelasting buiten kantooruren;
- inefficiënte benutting van OK-tijd overdag;
- de vertraging van geplande operaties en ander werk;
- het aantal spoedingrepen, dat in de wacht blijft staan;
- een mismatch tussen beschikbaarheid van operateur, anesthesioloog, OK-team en operatiekamer.
Het model van Acute Care Surgery is een uitgesproken model van een aparte spoed OK. In het ACS-model is een chirurg gedurende de dag vrij gepland van andere activiteiten en exclusief beschikbaar voor de beoordeling en behandeling van alle acute chirurgische patiënten, zowel patiënten die via de SEH binnenkomen en eventueel met spoed geopereerd dienen te worden als patiënten die een acute operatie moeten ondergaan, terwijl zij reeds zijn opgenomen. De grote verbetering in dit model ten opzichte van de traditionele on-call-variant is dat, in Amerika, Canada en Australië waar dit is ingevoerd, de spoed patiënt niet meer hoeft te wachten tot de consultant vanuit zijn (privé) kliniek naar het ziekenhuis komt. In de Nederlandse situatie hoeft de spoed patiënt dan niet te wachten tot de chirurg de andere reguliere werkzaamheden heeft afgerond als tenminste de beschikbaarheid van anesthesioloog, operatiekamer, OK- en anesthesieteam geregeld is. In Nederland is echter ook binnen ziekenhuizen een verregaande specialisatie en subspecialisatie doorgevoerd van snijdende specialisten, waardoor ‘een acute chirurg’ – die in onze setting immers maar een beperkt deel van het palet kan opereren – wellicht niet zal voldoen. Uit de beschikbare literatuur is getracht de mogelijkheden te presenteren voor de Nederlandse situatie en aanbevelingen te geven voor verbetering.
Conclusies / Summary of Findings
|
GRADE LAAG |
Een Acute Care Surgery model lijkt voor een lager aantal complicaties te zorgen dan een traditioneel On Call-model voor acute operatieve ingrepen.
Bronnen (Britt, 2010; Cubas, 2012; Fu, 2014; Gandy, 2010; Lau, 2011; Lehane, 2010; Lim, 2013; O’Mara, 2014; Poh, 2013) |
|
GRADE ZEER LAAG |
Er zijn indicaties dat het Acute Care Surgery model leidt tot een kortere Length of Stay dan een traditioneel On Call-model voor acute operatieve ingrepen.
Bronnen (O’Mara, 2014; Fu, 2014; Stupart, 2013; Poh, 2013; Lim, 2013; Faryniuk, 2013; Cubas, 2012; Lau, 2011; Lehane, 2010; Gandy, 2010; Britt, 2010) |
|
GRADE LAAG |
Een Acute Care Surgery model lijkt tot een kortere time to operation te leiden dan een traditioneel On Call-model voor acute operatieve ingrepen.
Bronnen (Fu, 2014; Stupart, 2013; Poh, 2013; Lim, 2013; Faryniuk, 2013; Cubas, 2012; Lau, 2011; Gandy, 2010; Britt, 2010) |
Samenvatting literatuur
Beschrijving studies
In totaal voldeden elf studies aan de inclusiecriteria voor de literatuuranalyse (O’Mara, 2014; Fu, 2014; Stupart, 2013; Poh, 2013; Lim, 2013; Faryniuk, 2013; Cubas, 2012; Lau, 2011; Lehane, 2010; Gandy, 2010; Britt, 2010). Het betreft in alle gevallen observationeel onderzoek waarin een periode met een ACS-model in één instelling is vergeleken met een traditioneel model in diezelfde instelling. De meeste studies betreffen een historically controlled cohort waar men van een pre-ACS-periode en een ACS-periode spreekt. Het overgrote deel (10/11) van de studies is uitgevoerd in de VS, Canada of Australië. Ook valt op dat de meeste studies appendectomieën en cholecystectomieën beschrijven. Per studie verschilt de mate van detail waarin de rest van het ACS-model is beschreven. Ook verschilt het per studie of de betreffende chirurg de beschikking heeft over een aparte spoedoperatiekamer. De uitkomstmaat mortaliteit is niet aangetroffen in de geïncludeerde studies.
De studie van O’Mara uit 2014 beschrijft een vergelijking van een Acute Care Surgery Service met een On Call Panel van chirurgen. In deze studie zijn twee groepen patiënten beschreven, namelijk patiënten met een appendectomie (N=423) en patiënten met een cholecystectomie (N=379). Deze groepen zijn afzonderlijk meegenomen in de analyse. In deze studie is een pre-ACS-periode vergeleken met vier verschillende ACS-periodes. Er is door de werkgroep besloten om de pre-ACS-periode te vergelijken met de ACS-II periode. Op deze manier wordt het effect van het omschakelen van een On Call model naar een ACS-model geminimaliseerd. De uitkomstmaten LOS, time to operation en complicaties zijn in deze studie beschreven.
Een studie uit Taiwan (Fu, 2014) beschreef de invloed van het ACS-model op de time to operation, LOS en complicaties. Deze studie bevatte 305 patiënten die een appendectomie ondergingen. De twee studiepopulaties verschilde niet in baselinekarakteristieken zoals leeftijd en geslacht.
Het single center cohortonderzoek van Stupart uit 2013 beschreef de uitkomstmaten LOS en Time to operation. Helaas is alleen de mediaan bij deze uitkomstmaten genoemd en werd er geen verdere informatie in het artikel beschreven, hierdoor was het niet mogelijk deze uitkomstmaten op te nemen in de meta-analyse. In deze studie zijn de resultaten van 1950 patiënten beschreven, echter zijn er geen baseline karakteristieken van de beide patiëntenpopulaties genoemd, daardoor is het niet mogelijk om te beoordelen of de patiëntengroepen vergelijkbaar zijn. Wel wordt het resultaat meegenomen in het formuleren van de literatuurconclusies.
Poh uit 2013 beschrijft acute appendectomieën bij 539 patiënten. Een Acute Surgical Unit-model is vergeleken met een traditioneel On Call-model. In deze studie zijn de uitkomstmaten LOS, time to operation en complicaties beschreven. Helaas zijn van de LOS en time to operation wederom alleen medianen weergegeven, waardoor de resultaten niet in de meta-analyse meegenomen kunnen worden. Wel zullen de uitkomsten van deze studie worden meegenomen in het formuleren van de literatuurconclusies.
In de Canadese studie van Lim uit 2013 zijn patiënten die vanwege problemen aan de galwegen een spoedoperatie moesten ondergaan beschreven. De twee populaties verschilden niet in verschillende patiëntkarakteristieken, al was de interventiegroep (ACS-model) een stuk groter (N=172) dan de controlegroep (On Call model; N=72). In de studie werden complicaties, time to operation en LOS beschreven.
In de studie van Faryniuk uit 2013 werden helaas alleen de gemiddelden van de LOS en time to operation gegeven. Er waren geen aanvullende gegevens over deze uitkomstmaten beschikbaar, waardoor het niet mogelijk was deze uitkomsten mee te nemen in de meta-analyse. Wel zullen de uitkomsten van deze studie worden meegenomen in het formuleren van de literatuurconclusies.
In de historically controlled study van Cubas uit 2012 is gekeken naar de ingrepen appendectomie (N=175) en cholecystectomie (N=113). In deze studie uit de VS is het ACS-model vergeleken met het On Call-model. Voor beide ingrepen verschilden de patiëntenpopulaties niet op patiëntkarakteristieken zoals leeftijd en geslacht. De uitkomstmaten complicaties, LOS en time to operation zijn beschreven. Van de LOS en time to operation waren geen aanvullende gegevens beschikbaar, waardoor het niet mogelijk was deze uitkomsten mee te nemen in de meta-analyse. Wel zullen de uitkomsten van deze studie worden meegenomen in het formuleren van de literatuurconclusies.
Lau beschreef in 2011 een groep van 152 patiënten die een cholecystectomie ondergingen in een ACS-model of een traditioneel On Call-model. LOS en time to operation waren niet in genoeg detail beschreven om mee te kunnen nemen in de meta-analyse. Dit was wel het geval voor de uitkomstmaat complicaties.
De vergelijking van een ACS-model met een On Call-model is ook beschreven in de studie van Lehane uit 2010. Wederom is de LOS niet in genoeg detail beschreven om mee te kunnen nemen in de meta-analyse, de uitkomstmaat complicaties daarentegen wel.
In de studie van Britt, 2010 zijn 186 patiënten met galwegproblemen beschreven. In de studie is het ACS-model vergeleken met het On Call-model. De uitkomstmaten time to operation, LOS en complicaties zijn beschreven.
De laatste studie die is meegenomen voor de literatuuranalyse is die van Gandy uit 2010. In dit onderzoek uit Australië zijn 402 patiënten beschreven die een appendectomie hebben ondergaan. De uitkomstmaten LOS, time to surgery en complicaties zijn beschreven. Helaas waren er over de LOS en time to surgery niet genoeg details vermeldt om deze uitkomstmaten mee te kunnen nemen in de meta-analyse.
Resultaten
Uitkomstmaat Complicaties
De uitkomstmaat complicaties is in negen studies beschreven (Britt, 2010; Cubas, 2012; Fu, 2014; Gandy, 2010; Lau, 2011; Lehane, 2010; Lim, 2013; O’Mara, 2014; Poh, 2013). In twee van die studies (O’Mara, 2014; Cubas, 2012) zijn de resultaten van twee verschillende subgroepen opgenomen (appendectomie en cholecystectomie). In de meta-analyse, uitgevoerd met de gegevens van deze studies, werd een RR van 0,57 95% CI [0,45 – 0,72] gevonden ten faveure van de interventiegroep. Zie figuur 1 voor de Forest plot van de meta-analyse. Er is sprake van een geringe mate van statistische heterogeniteit (I2 23%, τ2=0,03).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties is niet verlaagd. Na uitvoeren van de GRADE-beoordelingen werden er geen redenen gevonden om het niveau van de bewijskracht aan te passen. De startpositie van de bewijskracht was vanwege het observationele studiedesign LAAG, dit houdt in dat het niveau van de bewijskracht uitkomt op LAAG.
Figuur 1 ACS-model versus On Call: uitkomstmaat complicaties
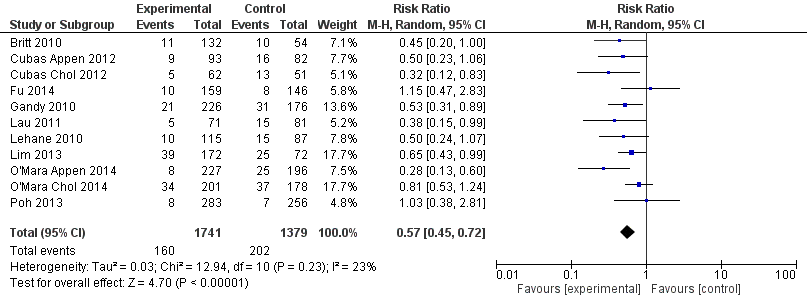
Uitkomstmaat Length of Stay
Deze uitkomstmaat is uitgedrukt in het aantal dagen dat een patiënt in het ziekenhuis van opname tot ontslag heeft doorgebracht. De length of stay is in alle elf de geïncludeerde studies beschreven, echter is deze uitkomstmaat in slechts vier studies in genoeg detail beschreven om meegenomen te kunnen worden in de meta-analyse (figuur 2). De meta-analyse gaf een mean difference van -1,15 [-1,48 tot -0,81] ten faveure van het ACS-model. Dit houdt in dat volgens deze vier studies het ACS-model gemiddeld tot iets meer dan één dag verkorting in de length of stay leidt.
Figuur 2 ACS model versus On Call: uitkomstmaat Length of Stay
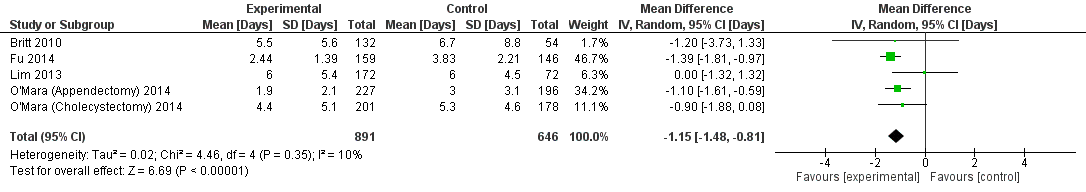
Onderstaand de bevindingen voor de uitkomstmaat LOS die niet mee zijn genomen in de meta-analyse (tabel 1). Bij zeven studies was het niet mogelijk om de resultaten op te nemen in de meta-analyse. Drie van die studies meldden een significant verschil in LOS ten faveure van de interventie (ACS-model).
Tabel 1 Resultaten LOS niet in meta-analyse
|
Studie |
LOS ACS-model |
LOS On Call model |
p-waarde |
|
Stupart, 2013 (median) |
3,0 |
3,0 |
1 |
|
Poh, 2013 (median) |
2 |
2 |
0,16 |
|
Faryniuk, 2013 (mean) |
3,9 |
4,02 |
0,91 |
|
Cubas, 2012 subpopulatie appendectomie (mean) |
1,8 |
2,8 |
0,002 |
|
Cubas, 2012 subpopulatie cholecystectomie (mean) |
3,3 |
5,2 |
0,03 |
|
Lau, 2011 (mean) |
2,63 |
3,23 |
0,11 |
|
Lehane, 2010 (median) |
4 |
6 |
0,001 |
|
Gandy, 2010 (median) |
3 |
2 |
0,92 |
Over het algeheel is er maar één studie die een indicatie geeft dat de LOS langer zou kunnen worden door het ACS-model (Gandy, 2010), echter dit verschil is niet significant (p=0,92).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat length of stay is met één niveau verlaagd gezien het passeren van het nul-effect van de betrouwbaarheidsintervallen van verschillende studies. De startpositie van de bewijskracht was vanwege het observationele studiedesign LAAG, dit houdt in dat het niveau van de bewijskracht uitkomt op ZEER LAAG.
Uitkomstmaat time to operation
Slechts in drie studies is deze uitkomstmaat in genoeg detail beschreven om gebruikt te kunnen worden voor de meta-analyse. De uitkomstmaat zelf is in negen studies beschreven. Zie figuur 3 voor het forest-plot. In de meta-analyse werd een mean difference van -7,08 95% CI [-8,15 tot -6,01] gevonden. Echter is deze uitkomst bijna volledig gebaseerd op de studie van Fu uit 2014. De studie van Lim rapporteert ook een significant verschil in het voordeel van de interventie. In de studie van Britt is de spreiding echter zeer groot en kan niet gezegd worden of de interventie of de controlegroep de voorkeur verdient.
Figuur 3 ACS model versus On Call: uitkomstmaat Time to operation
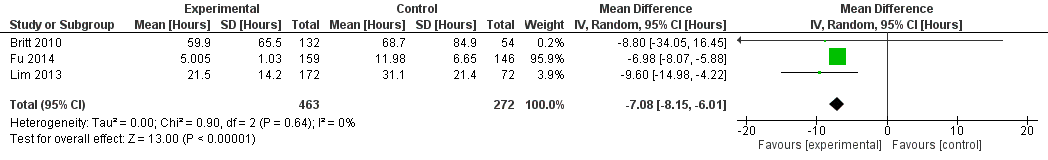
De zes studies die niet meegenomen konden worden in de meta-analyse zijn hieronder vermeld (tabel 2).
Tabel 2 Time to operation niet in meta-analyse
|
Studie |
Time to operation ACS-model |
Time to operation On Call model |
p-waarde |
|
Stupart, 2013 (median) |
18 |
19 |
0,033 |
|
Poh, 2013 (median) |
18,8 |
18 |
0,963 |
|
Faryniuk, 2013 (mean) |
7,55 |
14,17 |
0,01 |
|
Cubas, 2012 subpopulatie appendectomie (mean) |
11 |
16,4 |
0,006 |
|
Cubas, 2012 subpopulatie cholecystectomie (mean) |
34 |
60 |
0,002 |
|
Lau, 2011 (mean) |
24,6 |
35,0 |
0,027 |
|
Gandy, 2010 (median) |
9,60 |
10,45 |
0,29 |
Vier van de zes studies die niet waren meegenomen in de meta-analyse rapporteerden significant kortere time to operation tijdens voor de interventiegroep (Stupart, 2013; Faryniuk, 2013; Cubas, 2012; Lau, 2011). Ook Gandy (2010) rapporteerde een kortere tijd tot operatie, al was dit verschil niet significant. Alleen Poh (2013) gaf een langere tijd tot operatie, maar ook deze was niet significant (p=0,96).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties is niet verlaagd. Na uitvoeren van de GRADE-beoordelingen werden er geen redenen gevonden om het niveau van de bewijskracht aan te passen. De startpositie van de bewijskracht was vanwege het observationele studiedesign LAAG, dit houdt in dat het niveau van de bewijskracht uitkomt op LAAG.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
Leidt een apart acute operatieteam tijdens kantooruren tot betere uitkomsten dan een traditioneel On Call operatieteam.
Relevante uitkomstmaten
De werkgroep achtte complicaties en mortaliteit voor de besluitvorming kritieke uitkomstmaten; en Length of Stay (LOS) en time (from admission) to operation voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de database Medline (OVID) is met relevante zoektermen gezocht naar studies gepubliceerd in het Engels of Nederlands na 1995 waarin een apart acute operatieteam is vergeleken met een traditioneel On Call operatieteam. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 551 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- kwantitatief vergelijkend primair onderzoek;
- gepubliceerd tussen 1995 en april 2015;
- full-tekst beschikbaar in het Engels of Nederlands;
- beschrijving van acute operatieve ingrepen;
- vergelijking voor en na invoering van het acute operatieteam;
- beschrijving van minimaal een van de genoemde uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 23 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens twaalf studies geëxcludeerd (zie exclusietabel), en elf studies definitief geselecteerd. De search heeft geen andere modellen opgeleverd dan varianten van het ACS.
(Resultaten)
Elf onderzoeken zijn opgenomen in de literatuuranalyse. De evidence-tabellen hiervan en beoordeling van individuele studiekwaliteit kunt u onder het tabblad Onderbouwing vinden.
Referenties
- Barlow AP, Wilkinson DA, Wordsworth et al. An emergency daytime theatre list: utilisation and impact on clinical practice. Ann R Coll Surg Engl. 1993;75(6):441-4. PubMed PMID: 8285550; PubMed Central PMCID: PMC2498019.
- Britt RC, Bouchard C, Weireter LJ, et al. Impact of acute care surgery on biliary disease. J Am Coll Surg. 2010;210(5):595-9, 9-601.
- Britton E, Nash W. The new neck of femur fracture target: experience in a district general hospital. Int J Health Care Qual Assur. 2014;27(1):36-43.
- Charalambous CP, Paschalides K, Gunedran T, et al. Availability of orthopaedic trauma lists in the United Kingdom. Injury. 2005;36(10):1156-8.
- Cubas RF, Gomez NR, Rodriguez S, et al. Outcomes in the management of appendicitis and cholecystitis in the setting of a new acute care surgery service model: impact on timing and cost. J Am Coll Surg. 2012;215(5):715-21.
- Elder GM, Harvey EJ, Vaidya R, et al. The effectiveness of orthopaedic trauma theatres in decreasing morbidity and mortality: a study of 701 displaced subcapital hip fractures in two trauma centres. Injury. 2005;36(9):1060-6.
- Faryniuk AM, Hochman DJ. Effect of an acute care surgical service on the timeliness of care. Can J Surg. 2013;56(3):187-91.
- Fu CY, Huang HC, Chen RJ, et al. Implementation of the acute care surgery model provides benefits in the surgical treatment of the acute appendicitis. Am J Surg. 2014;208(5):794-9.
- Gandy RC, Truskett PG, Wong SW, et al. Outcomes of appendicectomy in an acute care surgery model. Med J Aust. 2010;193(5):281-4.
- Helewa RM, Kholdebarin R, Hochman DJ. Attending surgeon burnout and satisfaction with the establishment of a regional acute care surgical service. Can J Surg. 2012;55(5):312-6. PubMed PMID: 22854111; PubMed Central PMCID: PMC3468643.
- Kalantzis A, Weisters M, Saeed NR. Delays in emergency oral and maxillofacial operations: 5 years later. Br J Oral Maxillofac Surg. 2012;50(2):141-3.
- Lau B, Difronzo LA. An acute care surgery model improves timeliness of care and reduces hospital stay for patients with acute cholecystitis. Am Surg. 2011;77(10):1318-21.
- Lehane CW, Jootun RN, Bennett M, et al. Does an acute care surgical model improve the management and outcome of acute cholecystitis? ANZ J Surg. 2010;80(6):438-42.
- Leppaniemi A, Jousela I. A traffic-light coding system to organize emergency surgery across surgical disciplines. Br J Surg. 2014;101(1):e134-40.
- Lim DW, Ozegovic D, Khadaroo RG, et al. Impact of an acute care surgery model with a dedicated daytime operating room on outcomes and timeliness of care in patients with biliary tract disease. World J Surg. 2013;37(10):2266-72.
- Lovett BE, Katchburian MV. Emergency surgery: half a day does make a difference. Ann R Coll Surg Engl. 1999;81(1):62-4. PubMed PMID: 10325690; PubMed Central PMCID: PMC2503227.
- O'Mara MS, Scherer L, Wisner D, et al. Sustainability and success of the acute care surgery model in the nontrauma setting. J Am Coll Surg. 2014;219(1):90-8.
- Oostrum J, van Houdenhoven M, Wullink G, et al.(2006) Hoge OK benutting en minder afgevallen patienten door cyclisch plannen. In: M. van Houdenhoven & A.F. van Hoorn & C.J. Kalkman & G. Kazemier (Eds.), Benchmarking OK - Leren van elkaar. Springer Verlag, Baarn/Leusden, pp. 113-120. ISBN 9789078122036.
- Parasyn AD1, Truskett PG, Bennett M, et al. Acute-care surgical service: a change in culture. ANZ J Surg. 2009;79(1-2):12-8. doi: 10.1111/j.1445-2197.2008.04790.x.
- Poh BR, Cashin P, Dubrava Z, et al. Impact of an acute care surgery model on appendicectomy outcomes. ANZ J Surg. 2013;83(10):735-8.
- Rahman RA, Ramli R, Rahman NA, et al. Maxillofacial trauma of pediatric patients in Malaysia: a retrospective study from 1999 to 2001 in three hospitals. Int J Pediatr Otorhinolaryngol. 2007;71(6):929-36.
- Sethi RK, Kozin ED, Remenschneider AK, et al. Otolaryngology-specific emergency room as a model for resident training. Laryngoscope. 2015;125(1):99-104.
- Sorelli PG, El-Masry NS, Dawson PM, et al.. The Dedicated Emergency Surgeon: Towards Consultant-Based Acute Surgical Admissions.Ann R Coll Surg Engl. 2008;90(2):104108.
- Stupart DA, Watters DA, Guest GD, et al. Dedicated emergency theatres improve service delivery and surgeons' job satisfaction. ANZ J Surg. 2013;83(7-8):549-53.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
O’Mara, 2014
ACS model versus On Call |
Type of study: Historically Controlled Study
Setting: Single Centre
Country: USA
Source of funding:
Dr Owens is the CEO and owner of SAMGI, the corporation that contracted with Sutter Medical Center Sacramento to provide the Acute Care Surgery Service. Drs O’Mara, Scherer, and Wisner have all contracted with SAMGI for professional services.
Nothing mentioned about the funding of the study.
|
Inclusion criteria: - emergency surgery operations,
Exclusion criteria: None mentioned
N total at baseline: Intervention: 428 Control:374
Appendectomy N total I:227 C:196
Cholecystectomy N total I: 201 C:178
Important prognostic factors2: Appendectomy
Case mix index I:1,31 ± 1,42 C:1,29 ± 0,62 NS
Cholecystectomy Case mix index I:1,88 ± 1,48 C:1,74 ± 0,77 NS
No other prognostic factors mentioned. It is assumed that groups are comparable at baseline? |
Describe intervention:
Acute care surgery Acute care surgery service was instituted on January 1, 2008. This service consisted of 4 principal general surgeons, all board certified in general surgery, and 2 with additional certification in surgical critical care. These surgeons covered the acute care surgery service in 24-hour rotations, provided all patient care, evaluated all consults, covered the outpatient clinic, and performed all operations and procedures for the service during their hours of coverage. The surgeons were assisted during their 24-hour rotation by a nurse practitioner or physician assistant. The acute care surgeons were required to evaluate all emergency and inpatient consults, providing definitive operative or nonoperative care as was defined by management guidelines agreed on by the group.
|
Describe control:
On Call panel 9 general surgeons constituted the “call panel” and covered call on a rotating basis as part of medical staff requirements, each covering 24 consecutive hours of consults. Surgeons were paid a stipend by the hospital for this coverage. Patients evaluated by a surgeon during this time period were maintained in that surgeon’s practice and cared for by that surgeon and his or her partners. Critical care of these patients was shared by the surgeon and a consulting pulmonary critical care service. Surgeons were required to evaluate all emergency and inpatient consults, with definitive therapy left to the clinical judgment of the surgeon. |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Appendectomy
Length of Stay in days (LOS) I: 1,9 ± 2,1 C: 3,0 ± 3,1 p<0,01
Complications I: 8/227 C:25/196 p<0,01 Cholecystectomy
Length of Stay in days (LOS) I: 4,4 ± 5,1 C: 5,3 ± 4,6 p<0,01
Complications I: 34/201 C:37/178 p<0,02
|
In this study 4 ACS-periods are described. It was decided to compare the pre-ACS period with ACS-2 because in ACS-1 there might have been adaptation problems. |
|
Fu, 2014
ACS model versus On call |
Type of study: Historically controlled Study
Setting: Single centre
Country: Taiwan
Source of funding: Not mentioned |
Inclusion criteria: - patients with acute appendicitis who underwent appendectomies.
Exclusion criteria: - Patients younger than 16 years of age; - Patients who had a septic shock and then underwent exploratory laparotomy.
N total at baseline: Intervention: 159 Control: 146
Important prognostic factors2: age ± SD: I: 43,8 ± 29,0 C: 41,3 ± 16,9 NS
Sex: I: 55,3 % M C: 50 % M NS
Operation during night time I: 73 % C: 39% P<0,001
Groups comparable at baseline. |
Describe intervention:
ACS model In contrast, in-house attending trauma surgeons primarily provided urgent assessment and treatment of nontrauma abdominal surgical emergencies after the implementation of the ACS model (August 2010 to July 2011).
|
Describe control:
On Call model the surgical evaluations of patients with abdominal emergencies in the ED were primarily conducted by duty residents of general surgery. Further decision making was supervised by on-call doctors according to the resident’s presentation over the telephone (pre-ACS model). |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Appendectomy
Length of Stay in days (LOS) I:2,44 ± 1,39 C: 3,83 ± 2,21
Complications I: 10/159 C: 8/146 NS
Time to operation in min (hours) I: 300,3 ± 61,7 (5,005 ± 1,03) C: 719,1 ± 339,0 (11,98 ± 6,65) p<0,001
|
Time to operation: from presentation on ED to sending patient to OR |
|
Stupart, 2013
Emergency surgical care model versus On call model |
Type of study: Retrospective cohort
Setting: Single Centre
Country: Australia
Source of funding: Financial support for this study was received from the Department of Health in Victoria. The funding was used to provide sessional payments for the on-site surgeons, and for a project officer to collect the data. |
Inclusion criteria: - Patients undergoing emergency surgery.
Exclusion criteria: - planned admissions
N total at baseline: Intervention: 984 Control: 966
Important prognostic factors2: No prognostic factors mentioned.
Not possible to assess whether groups comparable are at baseline?
|
Describe intervention:
Emergency surgical care model implemented a model of emergency surgical care in which daily (Monday–Friday) dedicated emergency general surgery operating sessions were made available, and managed by an on-site consultant surgeon. This surgeon was responsible for deciding which cases could be booked on the list, and their order (according to urgency). The surgeons were also responsible for treating emergency general surgery patients or delegating that care to a more junior colleague at their discretion. The emergency general surgery operating sessions could be made available to other specialties at the discretion of the supervising surgeon according to urgency and the availability of other operating time.
Resources were not available to fund a dedicated emergency surgical unit, and there was strong cultural resistance from some of the involved surgeons to the concept of routine handover of patients (a potential problem of implementation identified by Parasyn et al.3). |
Describe control:
On Call model The general surgery emergency on call service is delivered by 15 surgeons, most of whom have subspecialist private practices. |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Median Length of Stay in days (LOS) I: 3,0 (3,0 - 3,0) C: 3,0 (3,0 - 4,0) P=1,3
Median Time to operation in hours I: 18 (17-19) C: 19 (18-21) P=0,033 |
Time to operation: from presentation on ED to sending patient to OR
Note: The times from ED to theatre, from booking to theatre and hospital stay, were not normally distributed, so the figures are presented as median (95% confidence interval for median) and were compared using the Mann–Whitney U-test. |
|
Poh, 2013
ASU model versus On call model |
Type of study: Historically Controlled Study
Setting: Single Centre
Country: Australia
Source of funding: Not mentioned |
Inclusion criteria: Patiens: - Aged 16-99 years; - underwent emergency appendicectomies.
Exclusion criteria: - elective surgery.
N total at baseline: Intervention: 283 Control: 256
Important prognostic factors2: age ± SD: I: 31,88 ± 0,89 C: 31,52 ± 0,85
Sex: I: 47 % M C: 44,5 % M NS
Groups comparable at baseline.
|
Describe intervention: ASU model The key aspects of the ASU were as follows: Firstly, the availability of an on-site general surgeon from 08.00-17.00 hours every day, who was then exclusively on-call after-hours. This promoted consultant-led patient care. Secondly, the availability of a dedicated ASU theatre every afternoon (13.00–17.00 hours), except Sunday, to cater for the steady flow of expected ‘emergency’ patients. The general emergency operating list remained available to the unit and was often used for ASU patients in the morning since the on-site consultant surgeon was often available during these hours. Thirdly, there was a dedicated unit structure consisting of one consultant, two registrars, one resident and two interns. Consultants rotated through a 24-hour shift, beginning at 19.00 hours daily. Continuity of care was preserved at a registrar and resident level. The management of all patients on the ASU was handed over from one surgeon to the next, unless the patients had been operated on and were expected to require a post-operative stay of greater than 48 h, in which case they were handed over to the appropriate specialist unit. Finally, in the ASU model, surgeons were remunerated at an hourly rate with a fixed on-call moiety. In addition to recognizing the surgeons’ commitment to the ASU, this also eliminated the financial incentive for after-hours surgery |
Describe control: On Call model
the on-call consultant would handle the emergency case load on top of his routine commitments. The consultants were all visiting medical officers (except one full-time consultant appointed in January 2011) with responsibilities at a number of other hospitals. Typically, emergency patients remained under the care of the surgeon on-call when they were admitted. There was an ‘acute surgical registrar’ who assessed the acute surgical patients, but ongoing management at the registrar level was provided by the surgical registrar on the unit to which the consultant on-call belonged. Patients who required surgery were booked on the general emergency list and had to compete with patients from other surgical services. As the surgeons were often committed elsewhere during office hours and there was no guarantee of theatre availability during daylight hours, patients who required surgery were often operated on after-hours despite the fact that there was no pressing need for an operation at this time
|
Length of follow-up: 1 month
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Intervention: N=19 (6,7 %) Reasons (data on time to operation incomplete)
Control: N=13 (5,1%) Reasons (data on time to operation incomplete)
No reason to believe that the incomplete outcome data introduced bias.
|
Outcome measures and effect size:
Median Time to operation in min IQR I: 1129 (617 – 1468) = 18,8 hours C: 1080 (619 – 1467) = 18 hours P=0,963
Median Length of Stay in days IQR (LOS) I: 2 (2 – 3) C: 2 (2 – 3) P=0,16
Complications (surgical site infections) I: 8/283 C: 7/256
|
|
|
Lim 2013
ACES model versus On Call model |
Type of study: Historically Controlled Study
Setting: Single Centre
Country: Canada
Source of funding: Not mentioned |
Inclusion criteria:
Exclusion criteria: - Patients treated nonoperatively; - elective surgery; - primary admission other than biliary tract disease.
N total at baseline: Intervention: 172 Control: 72
Important prognostic factors2: age: I: 51,2 C:49,7 NS
Sex: I: 44,8% M C: 51,4% M
No significant differences in numerous co-morbidities.
Groups comparable at baseline.
|
Describe intervention:
ACES model The Acute Care Emergency Surgery (ACES) service is comprised of nine dedicated surgeons who rotate weekly, as well as a senior resident, two junior residents, and two hospitalists. For a particular week, the designated ACES surgeon and team is on call daily from 07h00 to 19h00 (12 h). At 19h00, a second surgeon and resident team (which varies nightly) takes over call duties until 07h00 the following morning, at which time care is handed back to the designated ACES team. Handovers therefore occur every morning at 07h00 and every evening at 19h00 between the daytime ACES team and the variable nighttime ACES team. The ACES service is unique because of funding that allows for a dedicated emergency general surgery daytime operating room that operates during weekday daytime hours from 07:30 to 15:30. |
Describe control:
On Call model Emergency cases are added to the on-callsurgeon’s elective schedule. |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Complications I: 39/172 C: 25/72
Time to operation in hours I: 21,5 ± 14,2 C:31,1 ± 21,4 P<0,001
Length of Stay in days (LOS) I: 6,0 ± 5,4 C: 6,0 ± 4,5 NS |
|
|
Faryniuk, 2013
ACSS mode versus Traditional model |
Type of study: Historically Controlled Study
Setting: Single Centre
Country: Canada
Source of funding: Not mentioned |
Inclusion criteria: - Patients with acute appendicitis, acute cholecystitis and small bowel obstruction;
Exclusion criteria: Not mentioned.
N total at baseline: Intervention: 137 Control: 67
Important prognostic factors2: For example age ± SD: I: 49,7 C: 50,8 NS
Sex: I: 51 % M C: 57 % M
Groups comparable at baseline. |
Describe intervention:
ACCS model The ACSS model described in this study has a dedicated surgeon committed for a full week, Monday to Sunday, 8 am to 4 pm, focused on the efficient care of the emergent nontrauma surgical patient. Surgeons are thereby allowed to focus completely on their elective practices when not on the ACSS.
|
Describe control:
Traditional model traditional model has relied on an elective subspecialized service to take on the emergent surgical patient load. Tight scheduling of operative, clinic, research and academic time has made care for emergency surgical patients in this setting exceedingly difficult and often illtimed. As a result, emergency procedures have often been done at the end of busy elective slates or through the night, with a negative impact on the surgeon’s daytime schedule. |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Mean Length of Stay in min I: 5677,6 = 3,9 days C: 5803,8 = 4,02 P=0,91
Mean Time to operation in min I: 453,4 = 7,55 C: 850,5 = 14,17 P=0,01 |
Three periods are described in the study. The pre-ACCS period, the newly formed ACSS period and the established ACCS period. It was decided to compare the pre-ACCS period with the established ACCS period. |
|
Cubas, 2012
ACS model versus On Call model |
Type of study: Historically Controlled Study
Setting: Single Centre
Country: USA
Source of funding: Not mentioned |
Inclusion criteria: - Aged ≥15 years; - acute abdomen of appendicular or cholecystic origin. - underwent urgent operation.
Exclusion criteria: - Elective procedures; - procedures as part of another major operation; - patients with associated complications or who were treated conservatively
N total at baseline: Appendectomy Intervention:93 Control:82
Cholecystectomy Intervention: 62 Control:51
Important prognostic factors2: Appendectomy age ± SD: I: 34 ± 17 C: 35 ± 17 NS
Sex: I: 55 % M C: 43 % M NS
Cholecystectomy age ± SD: I: 40 ± 19 C: 38 ± 17 NS
Sex: I: 21 % M C: 16 % M NS
Groups comparable at baseline. |
Describe intervention:
Acute care surgery model (ACS) The acute care surgery service model, designed to combine trauma and emergency general surgery divisions into one 12-hour in-house service.
|
Describe control:
On Call model Traditionally, nontrauma patients needing emergency surgical care had to wait for the general surgeon on call, who was usually preoccupied with other activities, such as office consults or elective surgery, which often occur outside of the hospital. |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Appendectomy Complications I: 9/93 C: 16/82 P=0,06
Mean Time to operation in h I: 11 C: 16,4 P=0,006
Mean Length of Stay in days I: 1,8 C: 2,8 P=0,002
Cholecystectomy Complications I: 5/62 C:13/51 P=0,01
Mean Time to operation I: 34 C:60 P=0,002
Mean Length of Stay in days I: 3,3 C:5,2 P=0,03
|
|
|
Lau, 2011
ACS model versus Traditional model |
Type of study: Historically Controlled Study
Setting: Single Centre
Country: USA
Source of funding: Not mentioned |
Inclusion criteria: - aged ≥18 years of age; - Acute cholecystitis or early cholecystectomy.
Exclusion criteria: - Choledocholithiasis, biliary colic or cholelithiasis without cholecystis; - treated nonoperatively; N total at baseline: Intervention: 71 Control: 81
Important prognostic factors2: age ± SD: I: 45,7 C: 46,7 NS
BMI kg/m2 I: 31,1 C: 29,6
Sex: I: 28% M C: 30% M
Groups comparable at baseline. |
Describe intervention:
ACS model ACS team was composed of an attending surgeon who was free from all other daytime clinical duties and one or two residents. No OR was exclusively available for the on-call team.
|
Describe control:
Traditional model The responsible attending surgeon had other scheduled clinical duties such as outpatient clinic or elective operations. No OR was exclusively available for the on-call team.
|
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Time to operation in h I: 24,6 C: 35,0 P=0,0276
Length of Stay in days (LOS) I: 2,63 C: 3,23 P=0,11
Complications I: 5/71 C: 15/81 |
|
|
Lehane, 2010
ACS model versus On Call model |
Type of study: Historically Controlled Study
Setting: Single Centre
Country: Australia
Source of funding: There has been no research grant. |
Inclusion criteria: - Admitted for acute cholecystitis.
Exclusion criteria: Not mentioned.
N total at baseline: Intervention: 115 Control: 87
Important prognostic factors2: For example age ± SD: I: 47 ± 17,0 C: 50 ± 19,5
Sex: I: 30 % M C: 38 % M
Groups comparable at baseline.
|
Describe intervention:
ACS model An ACS model was introduced in September 2005. The on-call roster was altered, dividing the week into three periods: Monday (08.00 hours)– Wednesday (12.30 hours), Wednesday (12.30 hours)–Friday (18.00 hours) and Friday (18.00 hours)–Monday (08.00 hours). The acute care surgeons rotated through these periods. During their on call period the surgeon was available on-site from 08.00 until 18.00 hours and had no other commitments. On weekdays between 18.00 and 08.00 hours and on weekends the consultant was available but not on site unless required. They also had a dedicated surgical registrar and resident team to manage the ACS patients, ensuring continuity of care. The consultant had full control of the hospitals emergency theatre. This theatre is shared with other specialties including plastics, neurosurgery, orthopaedics, otolaryngology, vascular and renal transplant, ophthalmology and paediatric surgery. All obstetric surgery is undertaken at a separate facility. The ACS surgeon was responsible for the order of cases. This version of an ACS model was created with a view that early consultant presence should fast track appropriate cases and maximize theatre allocation. At the end of the on-call period the consultants’ team would then formally take over all patients whom had received ‘definitive care’. |
Describe control:
On Call model It involves the on-call surgical registrar assessing the patient and relaying the salient information to the consultant, who may or may not be present on site. The decision is then made as to whether further investigation or definitive surgical intervention is required.
Prince of Wales Hospital had a general surgical on-call system based on the traditional consultant-attending model. |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Complications I: 10/115 C:15/87
Median Length of Stay in days I: 4 C: 6 P=0,001 |
|
|
Gandy, 2010
ACS model versus On Call Model |
Type of study: Historically Controlled Study
Setting: Single Centre
Country: Australia
Source of funding: Not mentioned |
Inclusion criteria: - Underwent appendectomy;
Exclusion criteria: - Elective surgery;
N total at baseline: Intervention: 226 Control: 176
Important prognostic factors2: age: I: 32,8 C: 33,6 NS
Sex: I: 54% M C: 47,2% M NS
Groups comparable at baseline.
|
Describe intervention:
ACS Model Separating the elective and emergency workloads and placing control of the emergency theatre under the acute care general surgeon. Control of the emergency operating theatre allowed for planning of the semiurgent caseload. The duty acute care surgeon remained on site during the working day, with no other commitments other than the ACS service. Patients whose surgical care had not been completed by the end of the duty period were handed on to the next acute care duty surgeon for definitive care. The introduction of the ACS service at our institution coincided with the formalised referral of surgical patients from a second emergency department within the area network. There were no changes in the clinical guidelines for patient care. |
Describe control:
On Call model Traditional on call model. |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Complications I: 21/226 C: 30/176 P=0.02
Median Length of Stay in days (LOS) I: 3 (1-13) C:2 (1-17) P=0,92
Median Time to operation in hours I: 9:36 = 576 minutes = 9,6 h C: 10:27 = 627 minutes = 10,45 h P=0,29 |
|
|
Britt, 2010
ACS model versus On Call model |
Type of study: Historically Controlled Study
Setting: Single Centre
Country: USA
Source of funding: Not mentioned |
Inclusion criteria: - patients with biliary disease.
Exclusion criteria: - Elective cases. N total at baseline: Intervention: 132 Control:54
Important prognostic factors2: age: I: 44,4 C:50,2 P=0,05
Sex: I: 23,5 % M C: 37% M
Groups comparable at baseline. |
Describe intervention:
ACS model In July 2007 wij instituted an ACS service staffed by 6 board-certified critical care surgeons to provide all inpatient and emergency room consults. The ACS service is staffed by a PGY-4 and PGY-2 resident team.
|
Describe control:
On Call model surgical evaluations in the emergency department as well as inpatient consultations were done by a rotating group of academic surgeons based on a call schedule, with the patients followed by the professorial academic surgical service. |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned |
Outcome measures and effect size:
Time to operation in m I: 59,9 ± 65,5 C: 68,7 ± 84,9 P=0,045
Length of Stay in days I: 5,5 ± 5,6 C: 6,7 ± 8,8 P=0,027
Complications I: 11/132 C:10/54 P=0,06 |
|
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
O’Mara, 2014 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Fu, 2014 |
Unlikely |
Unlikely |
Unclear |
Unclear |
|
Stupart, 2013 |
Unclear |
Unlikely |
Unclear |
Unclear |
|
Poh, 2013 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Lim, 2013 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Faryniuk, 2013 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Cubas, 2012 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Lau, 2011 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Lehane, 2010 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Gandy, 2010 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Britt, 2010 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-05-2018
Beoordeeld op geldigheid : 04-09-2024
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. De werkgroep beoordeelt jaarlijks of modules of andere onderdelen van de richtlijn aan herziening toe zijn. De werkgroep valt onder de NVvH. Als onderdeel van deze richtlijn zijn door de werkgroep spoedlijst opgesteld die door de wetenschappelijke verenigingen geaccordeerd en onderhouden moet worden.
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In samenwerking met:
- Landelijke Vereniging van Operatieassistenten
- Stichting Kind en Ziekenhuis
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft tijdens het ontwikkelproces op geen enkele wijze invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van deze richtlijn is om een landelijk uniform classificatiesysteem vast te stellen voor het prioriteren van acute operaties en interventies waarbij een anesthesieteam, een medisch specialist en ondersteunend personeel aanwezig moeten zijn. In dit systeem kunnen wetenschappelijke verenigingen de prioriteit aangeven van (hun) specifieke ingrepen. Het beoogde effect van de richtlijn is dat transparanter wordt wat een acceptabele wachttijd is voor een acute ingreep door het proces rondom spoedoperaties duidelijker te beschrijven. Deze transparantie geldt voor zorgverleners, zorginstellingen en patiënten. Daarnaast wordt geprobeerd om de randvoorwaarden te beschrijven met betrekking tot de organisatie en communicatie rondom deze ingrepen.
Doelgroep
Alle leden van de beroepsgroepen die betrokken zijn bij de spoedzorg voor patiënten die een behandeling met anesthesiologische begeleiding of bewaking moeten ondergaan. Indien een spoed-patiënt op een electieve plaats wordt gezet dan kan electieve patiënt daar hinder van ondervinden.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2013 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een indicatie voor een acute interventie waarbij gebruik wordt gemaakt van tenminste een anesthesioloog, een ondersteunend/ assisterend team en een tweede medisch specialist (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. P.H.W. Lubbert, chirurg, werkzaam in ziekenhuis de Tjongerschans, Heereveen, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Drs. L.F.M. Beenen, radioloog, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Radiologie
- Drs. J.H.J.M. Bessems, orthopedisch chirurg, werkzaam in het Erasmus MC, Rotterdam, Nederlandse Orthopaedische Vereniging
- Prof. dr. M.A. Boermeester, gastro-intestinale / oncologisch chirurg, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Heelkunde
- Dr. L. Dubois, MKA-chirurg, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Dr. K.H. Kho, neurochirurg, Medisch Spectrum Twente, Enschede, Nederlandse Vereniging voor Neurochirurgie
- Dr. S.V. Koenen, gynaecoloog, werkzaam in het Universitair Medisch Centrum Utrecht, Nederlandse Vereniging voor Obstetrie Gynaecologie
- Dr. B. van Minnen, MKA-chirurg, werkzaam in het Universitair Medisch Centrum, Groningen, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- H. Rippen, patiëntvertegenwoordiger, Stichting Kind en Ziekenhuis, Utrecht
- Drs. A. Schuurhuis, anesthesioloog/intensivist, werkzaam in het Universitair Medisch Centrum Utrecht, Nederlandse Vereniging voor Anesthesiologie
- Dr. G.J.M.W. van Thiel, medisch ethicus, werkzaam in het Universiteit Medisch Centrum, Utrecht
Subgroep
- N. Dreessen, bestuurslid LVO, werkzaam in het Zuyderland Medisch Centrum, Landelijke Vereniging van Operatieassistenten
- drs. B.C. Jacod, gynaecoloog i.o., werkzaam in het Universitair Medisch Centrum, Utrecht, Nederlandse Vereniging voor Obstetrie Gynaecologie
- drs. A. Janse, klinisch geriater, werkzaam in Ziekenhuis Gelderse Vallei, Ede, Nederlandse Vereniging voor Klinische Geriatrie
- B.D.D. van Loo, anesthesiemedewerker, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging van Anesthesie-Medewerkers
- Dr. B.M.P. Rademaker, anesthesioloog, werkzaam in het OLVG, Amsterdam, Nederlandse Vereniging voor Anesthesiologie
- drs. E.M. Verhoog, SEH-arts, werkzaam in Tergooi Ziekenhuizen, Blaricum, Nederlandse Vereniging van Spoedeisende Hulp Artsen
- F. Wienen, operatieassistent, werkzaam in Isala Klinieken, Zwolle, Landelijke Vereniging van Operatieassistenten
Met ondersteuning van:
- Ir. T.A. van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- A.A. Lamberts MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- M.E. Wessels MSc, literatuurspecialiste, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Met dank aan:
- S. van Dijk MSc, arts-onderzoeker chirurgie, afdeling Chirurgie, Academisch Medisch Centrum, Amsterdam
- N.W. de Cort, student geneeskunde, Faculty of Health, Medicine and Life Science, Maastricht Universiteit, Maastricht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar directe financiële (betrekking commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de bijlage van deze richtlijn. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten. De belangen zijn bij aanvang van het project geïnventariseerd bij de leden van de werkgroep. De leden van de werkgroep is gevraagd gedurende het ontwikkeltraject wijzigingen in de belangen te melden bij de ondersteuners. Aan het eind van het ontwikkeltraject zijn de belangen nogmaals plenair besproken.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Boermeester |
|
|
|
|
|
|
|
|
|
Beenen |
Radioloog, afgevaardigde NVvR |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Bessems |
Orthopedisch chirurg |
Docent Hogeschool Rotterdam, Docent Albeda College Rotterdam (Beiden uurvergoeding (EUR 500,00 per jaar)). |
geen |
geen |
Lid medische adviesraad vereniging aangeboren heupafwijkingen |
geen |
geen |
geen |
|
Dubois |
MKA chirug AMC Amsterdam (betaald) MKA chirug Antonius ziekenhuis (betaald) |
Secretaris stichting Bridge the Gap-> (onbetaald) Richtlijnontwikkeling NVMKA mbt aangezichtstraumatologie -> (onbetaald) docent na bijscholing (AO Foundation/SORG/ACTA/NVT/CCO) -> (onbetaald) Vereniging Medisch Tandheelkundige interactie, oud voorzitter, adviserend -> (onbetaald) |
geen |
geen |
geen |
ontwikkeling orbita implantaat via KLS Martin; geen belangenverstrengeling met oop op de richtlijn. |
zie geen reden tot belangenverstrengeling, enkel bijzondere aandacht voor orbitachirurgie met ontwikkeling in 3D software planning, patientspecifieke oplossingen en implantaten; zie extra gefinancieerd onderzoek. |
geen |
|
Kho |
Neurochirug |
geen |
nvt |
nvt |
nvt |
geen |
nvt |
neen |
|
Koenen |
Gynaecoloog / periatoloog UMC Utrecht |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Lubbert |
Chirurg |
geen |
geen |
echtgenote cardioloog |
lid van commissie patient veiligheid Ned Vereniging voor Heelkunde |
geen |
geen eigendom van patent of product. Proefschrift gericht op kwaliteit in patientenzorg. Derhalve geinteresseerd in veiligheid en kwaliteit. |
geen |
|
van Minnen |
Kaakchirurg, chef de clinique, UMC Groningen |
Bestuurslid vereniging Regiotafel Antistolling Gronigen, overlegorgaan om de (perioperatieve) zorg rond geantistolde patient in de regio te organiseren. (onbezoldigd) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Rippen |
Directeur Stichting Kind en Ziekenhuis |
Bestuurslid Onbeperkt aan de slag – ontbetaald Bestuurslid Vereniging van Ehlers-Danlos patienten - onbetaald Feelance projectadviseur/consultant - diverse belangenbehartigings-organisaties en soms zorgorganisaties - betaald per opdracht |
geen |
geen |
geen |
geen |
geen |
geen |
|
Schuurhuis |
Anethesioloog in het UMCU |
Voorzitter commisie Richtlijnen en Indicatoren NVA (vacatiegeld voor vergaderingen) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van Thiel |
UD Medisch Ethiek / UMC Utrecht div. Julius Centrum |
Plv lid - ethicus VCMO (een erkende METC) betaald |
geen |
geen |
geen |
Geen belangen die relevant zijn voor dit onderzoek. |
geen |
geen |
|
Lamberts |
Adviseur Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
van Barneveld |
Directeur Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
|
|
|
|
|
|
|
|
|
|
Subwerkgroep |
||||||||
|
Dreessen |
Operatieassistent |
Bestuurslid LVO (onbetaald) |
geen |
geen |
Erkenning beroep operatieassistent |
geen |
geen |
geen |
|
Janse |
Klinisch Geriater |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Jacod |
AIOS Gynaecologie UMC Utrecht |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Rademaker |
subwerkgroep 'Medisch inhoudelijk'. |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Verhoog |
SEH-arts Ter Gooi Eigen bedrijf, eenmanszaak, partime Auxilium primum; lesgeven, trainingen, waarneming binnen (acute) geneeskunde (betaald) |
geen |
geen |
geen |
Richtlijne-commissie NVSHA |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Inbreng van het patiëntenperspectief werd gewaarborgd door een afgevaardigde van een landelijke patiëntenvereniging in de werkgroep op te nemen en uitgangsvragen op te stellen specifiek over voor de patiënt relevante onderwerpen. Tijdens de oriënterende zoekactie werd er specifiek gezocht naar literatuur over het patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is voor commentaar voorgelegd aan Kind en Ziekenhuis, de Patiëntenfederatie Nederland en Zorgbelang Nederland. Vanwege de te verwachten ethische dilemma’s in de richtlijn die gepaard gaan met het verdelen van schaarse middelen en tijd in de gezondheidszorg heeft er een medisch ethicus zitting gehad in de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is nadrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatiemodule is te vinden bij de aanverwante producten.
Werkwijze
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijn voor richtlijnen’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor de kritieke en belangrijke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, systematische reviews (Medline (OVID)), en literatuur over patiëntvoorkeuren (patiëntenperspectief; Medline (OVID)). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (Risk of Bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals criteria die van invloed zijn op de aanbeveling, de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn is er een interne kwaliteitsindicator ontwikkeld om het toepassen het classificatiesysteem van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de module Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers M, Kho ME, Browman GP, et al. for the AGREE Next Steps Consortium. AGREE II: Advancing guideline development, reporting and evaluation in healthcare. Can Med Assoc J. 2010; 182:E839-842; doi:10.1503/090449.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Link: https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from www.guidelinedevelopment.org/handbook.
Schünemann HJ, Oxman AD, Brozek J, et al.; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. Erratum in: BMJ. 2008;336(7654).
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1995-heden Engels,
|
1 exp specialties, surgical/ or colorectal surgery/ or general surgery/ or neurosurgery/ or orthopedics/ or traumatology/ or "Anesthesiology"/ or exp surgical procedures, operative/ or gynecologic surgical procedures/ or exp "dilatation and curettage"/ or uterine artery embolization/ or obstetric surgical procedures/ or exp delivery, obstetric/ or angioplasty, balloon, coronary/ or exp percutaneous coronary intervention/ or "Heart Defects, Congenital"/su or Appendectomy/ or Appendicitis/su or exp "Wounds and Injuries"/ or (injur* or trauma* or wound*).ti. (3223608) 2 ((Emergency or acute or urgent* or urgenc* or unplanned or trauma or non-elective*) adj6 (surger* or surgi* or operation* or procedure*)).ti,ab. or "Emergency Treatment"/ or (Emergency or acute or urgent* or urgenc* or unplanned or trauma or non-elective*).ti. or Appendectomy/ or Appendicitis/su (547880) 3 1 and 2 (183503) 4 exp *Emergency Service, Hospital/ (31301) 5 3 or 4 (209211) 6 limit 5 to (yr="1995 -Current" and (dutch or english)) (124386) 15 *"Critical Care"/og [Organization & Administration] (1200) 16 og.fs. (387219) 17 "Models, Organizational"/ (15516) 18 "Patient Care Team"/og [Organization & Administration] (10772) 19 "Consultants"/ (5848) 20 "Critical Care"/og [Organization & Administration] (1708) 21 17 or 18 or 19 or 20 (32714) 22 14 and 21 (5) 23 6 and 21 (1066) 24 ((dedicated adj3 (operating or emergency or surgeon* or team* or theatre*)) or (("acute care" or "emergency surg*" or "acute surg*") adj3 (model* or unit*)) or ((consultant* or subspecialty or solely or dedicated or speciali*) adj3 ("acute surgical" or "emergency surg*" or "acute care surg*")) or queueing).ti,ab. (1968) 25 "Models, Organizational"/ or "Patient Care Team"/og or "Consultants"/ or Surgical Procedures, Operative/st or Operating Rooms/og (35030) 30 *"Surgery Department, Hospital"/og [Organization & Administration] (718) 32 24 or 25 or 30 (37424) 33 6 and 32 (1292) 35 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (231146) 36 33 and 35 (36) 37 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1434091) 38 33 and 37 (108) 39 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Case control.tw,kw. or (cohort adj (study or studies)).tw,kw. or Cohort analy$.tw,kw. or (Follow up adj (study or studies)).tw,kw. or (observational adj (study or studies)).tw,kw. or Longitudinal.tw,kw. or Retrospective.tw,kw. or Prospective.tw,kw. or Cross sectional.tw,kw. or Cross-sectional studies/ or evaluation studies.pt. (2259453) 40 33 and 39 (386) 42 33 not 41 (830) 43 24 and 42 (93) – overige designs, titel,abstract zoals in regel 24 46 36 or 38 (138) – 136 uniek 47 40 not 46 (324) – 322 uniek |
551 |
In- en exclusietabel
|
Art. nr. |
Auteur, jaartal |
Inclusie/ Exclusie |
Toelichting |
|
SR & RCT |
|
|
|
|
8 |
Nagaraja, 2014 |
Exclusie |
Design: SR. ASU (+) versus On-Call. Uitkomstmaten: All complications, night-time-operation. Meer individuele studies gevonden dan opgenomen in de SR. |
|
11 |
Koea, 2014 |
Exclusie |
Design: SR. Meer een narrative review van verschillende acute surgical models. Voor overwegingen. Geen kwantitatieve gegevens. |
|
107 |
Kjekshus, 2005 |
Exclusie |
Design: Retrospectief onderzoek. Gekeken naar ring-fenced systeem. Geen vergelijking tussen apart acuut team en on-call model oid. |
|
Obs. studies |
|
|
|
|
o13 |
O ‘Mara 2014 |
Inclusie |
Design: Historically controlled study. On-call model versus ACS (+). Uitkomstmaten: complicaties, length of stay, mortaliteit. |
|
O22 |
Fu, 2014 |
Inclusie |
Design: Historically controlled study. On-call model versus ACS. Uitkomstmaten: LOS, complications. |
|
O28 |
Beardsley, 2014 |
Exclusie |
Design: Historically controlled study. On-call model versus SAPU. Beschrijft meer een acute chirurgische afdeling dan een acuut chirurgisch team. Uitkomstmaten: time of operation. |
|
O33 |
Stupart, 2013 |
Inclusie |
Design: Historically controlled study. On-call model versus dedicated emergency general surgery operating sessions. Uitkomstmaten: length of stay, |
|
o42 |
Poh, 2013 |
Inclusie |
Design: Historically controlled study. On-call model versus ASU. Uitkomstmaten: operating time, LOS, |
|
O45 |
Lim, 2013 |
Inclusie |
Design: Historically controlled study. On-call model versus ASU with dedicated OR. Uitkomstmaten: operating time, LOS, complications |
|
O53 |
Faryniuk, 2013 |
Inclusie |
Design: Historically controlled study. On-call model versus ACSS. Uitkomstmaten: LOS, time to surgery |
|
O79 |
Pepingco, 2012 |
Exclusie |
Design: Retrospective cohort. No relevant comparison and outcomes are described. |
|
O90 |
Hsee, 2012 |
Exclusie |
Design: Historically controlled study. On-call model versus ACU. Uitkomstmaten: No relevant quantitative outcomes mentioned. |
|
O95 |
Cubas, 2012 |
Inclusie |
Design: Historically controlled study. On-call model versus ACSS. Uitkomstmaten: time to surgery, complicaties, LOS |
|
O108 |
Matsushima, 2011 |
Exclusie |
Geen antwoord op PICP. Kijkt naar samenvoegen emergency surgery en trauma surgery. |
|
O110 |
Lau, 2011 |
Inclusie |
Design: Historically controlled study. On-call model versus ACS. Uitkomstmaten: LOS, time to surgery, complications |
|
O138 |
Lehane, 2010 |
Inclusie |
Design: Historically controlled study. On-call model versus ACS. Uitkomstmaten: complications, |
|
O144 |
Gandy, 2010 |
Inclusie |
Design: Historically controlled study. On-call model (Trad) versus ACS. Uitkomstmaten: complications, time to operation, LOS |
|
O150 |
Britt, 2010 |
Inclusie |
Design: Historically controlled study. On-call model versus ACS. Uitkomstmaten: time to operation, LOS, complications |
|
O152 |
Trompetas, 2009 |
Exclusie |
Design: Retrospective cohort. Beschrijft een half-day dedicated emergency theatre. Geen antwoord op PICO. |
|
O171 |
Britt, 2009 |
Exclusie |
Design: Retrospectief cohort. Geen vergelijking met pre ACS periode. Geen antwoord op PICO |
|
O185 |
Sorelli, 2008 |
Exclusie |
Design: Historically controlled study. On-call model versus SAPU. Beschrijft meer een acute chirurgische afdeling dan een acuut chirurgisch team. Geen relevante uitkomstmaten beschreven. |
|
O296 |
Haddock, 2001 |
Exclusie |
Design: Historically controlled study. On-call model versus ACS. Geen relevante uitkomstmaten beschreven. |
|
Z16 |
Heng, 2013 |
Exclusie |
D Design: Historically controlled study. On-call model versus ACS. Geen relevante uitkomstmaten beschreven. Geen antwoord op PICO |
