Modus partus bij twee sectio’s in de voorgeschiedenis
Uitgangsvraag
Wat is de plaats van vaginale baring vergeleken met sectio bij een patiënte met 2 maal een sectio in de voorgeschiedenis?
Clinical question ENG
What is the value of vaginal birth compared to cesarean section in women with a medical history of two previous cesarean sections?
Aanbeveling
Counsel patiënten met tweemaal sectio caesarea in de anamnese over de modus partus conform de counseling bij éénmaal sectio caesarea in de anamnese. Neem hierbij de onzekerheid ten aanzien van een mogelijk verhoogd risico op uterusruptuur, de iets lagere slagingskans van een vaginale baring, het hogere operatierisico en individuele risicofactoren (zoals beloop van vorige baringen) mee.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
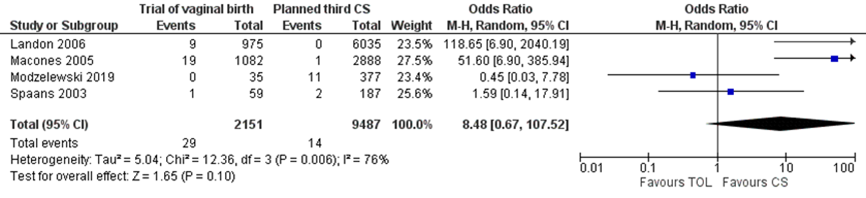
Ten aanzien van het beantwoorden van de vraag naar de plaats van een vaginale baring, vergeleken met een geplande derde sectio, bij vrouwen met twee sectio’s in de voorgeschiedenis, werden vier observationele studies geïncludeerd. De bewijskracht voor de uitkomstmaat uterusruptuur was zeer laag (afwaardering voor heterogeniteit en imprecisie), net als de bewijskracht voor de belangrijke uitkomstmaten (afwaardering wegens imprecisie). De overall bewijskracht is dan ook zeer laag.
Uit de gevonden literatuur wordt een slagingskans voor VBAC (Vaginal Birth After Caesarean) bij TOLAC (Trial Of Labour After Caesarean) na tweemaal sectio caesarea in de voorgeschiedenis gevonden van 62.9-83.1%. Er werden voor deze uitgangsvraag geen RCT's gevonden, hetgeen voor een selectiebias kan hebben gezorgd; de groep vrouwen die koos voor een TOLAC zou mogelijk een betere uitgangssituatie hebben gehad (zoals een eerdere vaginale baring (Macones, 2005; Phelan, 1989) hetgeen de slagingskansen voor VBAC positief kan hebben beïnvloed. De gepoolde incidentie voor de primaire uitkomstmaat, uterusruptuur, was 1.3% in de groep die koos voor TOLAC en 0.1% voor moeders die kozen voor een geplande sectio caesarea (RR 8.37 (95% CI 0.67 to 105.41)). Hierbij dient te worden opgemerkt dat de definitie voor uterusruptuur verschilde tussen de gevonden studies. Ook dient de kanttekening te worden gemaakt dat, afhankelijk van de definitie, niet altijd duidelijk zal zijn geweest of in de groep vrouwen met geslaagde VBAC wel of geen sprake was van een (subklinische) uterusruptuur. Wellicht is het derhalve relevanter om te kijken naar maternale uitkomstmaten ten aanzien van klinische morbiditeit zoals de noodzaak tot bloedtransfusie, hysterectomie, IC-opname, noodzaak tot relaparotomie ofwel uitgebreidere chirurgie en mortaliteit. Alle vier de geïncludeerde studies rapporteerden over HPP en/of de noodzaak tot bloedtransfusie. Hierbij werd een totaal bloedverlies > 500mL na VBAC als HPP beschouwd en een totaal bloedverlies van >1000mL na geplande sectio als HPP beschouwd. Alleen de studie van Landon (2006) vond een significant verhoogde kans op bloedtransfusie in de TOLAC-groep ten opzichte van de geplande sectio-groep. Er werd uit de gepoolde data van in totaal 4 studies geen verschil gevonden ten aanzien van de noodzaak voor bloedtransfusie tussen beide groepen. Er werden in de gevonden studies geen significante verschillen gevonden tussen de TOLAC- en geplande sectio-groep ten aanzien van de noodzaak tot hysterectomie, IC-opname, noodzaak tot relaparotomie, uitgebreidere chirurgie of maternale mortaliteit. Mogelijk werd dit veroorzaakt door een zeer lage absolute kans op de genoemde uitkomsten en daarmee te lage aantallen om significantie te bereiken. In de studie van Landon (2006) werd wel een significant verschil gevonden tussen de twee groepen ten nadele van de TOLAC-groep indien werd gekeken naar samengestelde maternale uitkomsten (uterusruptuur, endometritis, hysterectomie, noodzaak tot bloedtransfusie, trombo-embolische processen óf peroperatieve complicaties). Dit significante verschil lijkt echter grotendeels voort te komen uit de eerder reeds genoemde (significant) verhoogde kans op bloedtransfusie.
Er werden geen klinisch relevante verschillen gevonden aangaande neonatale morbiditeit of mortaliteit. Drie studies rapporteerden over de kans op NICU-opname. Er was mogelijk een verhoogde kans op NICU opname na TOLAC (8.3%) ten opzichte van de groep met geplande sectio caesarea (4.2%) (RR 1.39 (95% CI 1.15 to 1.68), dit werd beschouwd als klinisch niet relevant). Gezien de relatief hoge incidentie voor NICU-opname in beide groepen is het de vraag in hoeverre deze getallen kunnen worden geëxtrapoleerd naar de Nederlandse populatie. Zelfs de Nederlandse studie (Spaans, 2003) rapporteert een opmerkelijk hoge incidentie van NICU-opnames in beide groepen. In het artikel kan niet duidelijk worden teruggevonden wat hiervoor de aanleiding was. Mogelijk kan deze hoge incidentie worden verklaard door het feit dat er ook patiënten werden geïncludeerd met een amenorroeduur onder de 32 weken en kinderen met een (bekende) chromosomale of congenitale afwijking.
Er werd in de gevonden literatuur geen uitspraak gedaan over lange termijn uitkomsten van de kinderen. Ook werden geen uitspraken gedaan over lange termijn uitkomsten voor moeders. Met name het mogelijk toegenomen risico op abnormaal invasieve placenta na iedere volgende sectio caesarea werd in de gevonden literatuur niet meegenomen in de uitkomsten.
In de counseling aangaande de modus partus bij patiënten met tweemaal sectio caesarea in de anamnese kunnen bovengenoemde data worden meegenomen. Hierbij dient wel rekening gehouden te worden met de lage bewijskracht van de literatuur. Hoewel er geen predictiemodel bestaat voor de kans op VBAC na tweemaal sectio caesarea in de anamnese, dienen deze factoren (onder andere BMI, reden van voorgaande sectio, vaginale baring in de voorgeschiedenis, geschat foetaal gewicht >p90, inductie van de baring) wel te worden meegenomen. Daarnaast zullen er ook andere individuele factoren zijn die een invloed hebben bij de afwegingen die men maakt in de keuze tussen geplande sectio caesarea en TOLAC. Hierbij valt bijvoorbeeld te denken aan een toekomstige kinderwens, leeftijd van moeder, de complexiteit van de eerdere sectio caesarea, abdominale ingrepen sinds de laatste sectio caesarea en meerlingzwangerschap.
Inductie van de baring versus geplande 3e sectio
Er werd één studie gevonden met een secundaire analyse ten aanzien van inductie van de baring bij tweemaal sectio caesarea in de anamnese op data uit hetzelfde cohort als dat van Landon (2006) (Miller, 2015). In deze studie kozen 152 (2.5%) van 6162 vrouwen met twee voorgaande sectio's voor inductie van de baring. Hiervan hadden 82 vrouwen (54%) een vaginale partus in hun voorgeschiedenis. In deze groep hadden 99 vrouwen een geslaagde VBAC (65.1%). Er werden geen significante verschillen gevonden in maternale of neonatale uitkomsten ten opzichte van de groep met een geplande sectio caesarea.
Er werden in de overige studies geen duidelijke subgroepen gemaakt aangaande uitkomstmaten in geval van bijstimulatie durante partu.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De waarden en voorkeuren van patiënten zullen afhangen van hun referentiekader, hun ervaringen rondom de voorgaande keizersneden en hun eventuele toekomstige kinderwens.
De verwachting is dat het herstel na een vaginale baring gemiddeld genomen voorspoediger zal verlopen dan na een sectio caesarea. Bij een toekomstige kinderwens is een patiënte ook gebaat bij een VBAC gezien de logaritmische toename van kans op onder andere abnormaal invasieve placenta en maternale morbiditeit anderszins. Anderzijds kan een primaire (geplande) sectio caesarea duidelijkheid patiënten duidelijkheid geven en biedt het de mogelijkheid tot het combineren van de ingreep met een sterilisatie indien er geen toekomstige kinderwens is.
Over de waarden en voorkeuren van patiënten werd in de literatuur geen uitspraak gedaan.
Kosten (middelenbeslag)
Er zijn hier geen data over bekend.
Aanvaardbaarheid, haalbaarheid en implementatie
Momenteel wordt er in Nederland wisselend beleid gevoerd als het gaat om counseling over de modus partus na tweemaal sectio caesarea in de anamnese. Hierbij lijkt te tendens te zijn deze patiëntengroep zonder counseling een primaire sectio te adviseren. Naar aanleiding van de gevonden literatuur lijkt het mogelijk, na counseling, TOLAC na tweemaal sectio in de anamnese te kunnen aanbieden. De benodigde zorg rondom een baring bij iemand met tweemaal sectio caesarea in de anamnese verschilt in wezen niet met de zorg rondom een baring bij iemand met één sectio caesarea in de anamnese. Een dergelijke baring dient plaats te vinden in klinische setting met voldoende expertise en de mogelijkheid tot acute interventie.
Er wordt in de gevonden literatuur onvoldoende onderscheid gemaakt ten aanzien van de toename van risico's indien bijstimulatie middels oxytocine wordt gestart. Hierover kan dus geen uitspraak worden gedaan.
Onderbouwing
Achtergrond
De richtlijn Zwangerschap en bevalling na voorgaande sectio caesarea uit 2010 noemt meer dan één voorgaande sectio caesarea niet als contra-indicatie voor een poging tot vaginale baring. Wel wordt meer dan één sectio caesarea in de voorgeschiedenis genoemd als risicofactor voor het optreden van een uterusruptuur (3 tot 5 keer hoger risico), hoewel de resultaten in de gebruikte literatuur als tegenstrijdig werden gezien. De kans op een succesvolle poging tot vaginale baring was significant lager in 5 van 7 gebruikte studies. Het risico op hysterectomie en bloedtransfusie zou verhoogd zijn. De werkgroep was naar aanleiding van de gevonden literatuur van mening dat voorwaarden voor een poging tot vaginale baring na twee eerdere ongecompliceerde sectio’s waren dat de zorg goed georganiseerd was en dat vrouwen goed geïnformeerd en gemotiveerd waren.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of a trial of vaginal birth on uterine rupture, compared to a planned third caesarean delivery, in women with a medical history of two caesarean sections.
Sources: (Landon, 2006; Macones, 2005; Modzelewski, 2019; Spaans 2003) |
|
Very low GRADE |
The evidence is very uncertain about the effect of a trial of vaginal birth on maternal mortality, compared to a planned third caesarean delivery, in women with a medical history of two caesarean sections.
Sources: (Landon, 2006; Macones, 2005; Modzelewski, 2019; Spaans 2003) |
|
Very low GRADE |
The evidence is very uncertain about the effect of a trial of vaginal birth on postpartum hemorrhage, compared to a planned third caesarean delivery, in women with a medical history of two caesarean sections.
Sources: (Modzelewski, 2019) |
|
Very low GRADE |
The evidence is very uncertain about the effect of a trial of vaginal birth on blood transfusion, compared to a planned third caesarean delivery, in women with a medical history of two caesarean sections.
Sources: (Landon, 2006; Macones, 2005; Modzelewski, 2019; Spaans 2003) |
|
Very low GRADE |
The evidence is very uncertain about the effect of a trial of vaginal birth on term intrapartum stillbirth, compared to a planned third caesarean delivery, in infants of mothers with a medical history of two caesarean sections.
Sources: (Landon, 2006) |
|
Very low GRADE |
The evidence is very uncertain about the effect of a trial of vaginal birth on term neonatal death, compared to a planned third caesarean delivery, in infants of mothers with a medical history of two caesarean sections.
Sources: (Landon, 2006) |
|
Very low GRADE |
The evidence is very uncertain about the effect of a trial of vaginal birth on an Apgar score < 7 at 5 minutes, compared to a planned third caesarean delivery, in infants of mothers with a medical history of two caesarean sections.
Sources: (Spaans, 2003) |
|
Very low GRADE |
The evidence is very uncertain about the effect of a trial of vaginal birth on NICU admission, compared to a planned third caesarean delivery, in infants of mothers with a medical history of two caesarean sections.
Sources: (Landon, 2006; Spaans, 2003) |
Samenvatting literatuur
Description of studies
Landon (2006) performed a prospective observational study of women with prior cesarean delivery undergoing trial of labor versus elective repeat operation. The study was conducted at 19 academic medical centers, from 1999 to 2002, in the USA. Women with a singleton gestation and a history of single or multiple cesarean deliveries were included (i.e., the results of women with a single prior cesarean delivery were not further presented in this evidence report). Of the 7010 women with multiple prior cesarean deliveries, 6035 (86.1%) women had an elective repeat cesarean delivery, 975 (13.9%) women underwent a trial of vaginal birth. The group of women with multiple prior cesarean deliveries undergoing a trial of labour included 871 (89%) with two prior, 84 (9%) with three prior, and 20 (2%) with four prior cesareans. Women undergoing trial of labor were younger and more likely to be unmarried, African American, tobacco users, and receiving public assistance. Lower birth weight, earlier gestational age, history of vaginal delivery, and VBAC were more common in those women undergoing trial of labour.
Macones 2005 performed a secondary analysis of a retrospective cohort study to compare clinical outcomes of women with two prior cesarean deliveries who attempt vaginal birth or opt for a repeat cesarean delivery. The medical records of 17 hospitals (from 1996-2000) in South-eastern Pennsylvania and Delaware (USA) were reviewed. Included were women with 2 previous cesarean deliveries, women who had already had more than 2 previous cesarean deliveries were excluded as well as women with prior classical cesarean delivery. A total of 3970 women who had already had 2 previous caesarean sections were included into this study, 2888 (72.7%) of these women underwent a repeat cesarean section, whereas 1082 (27.3%) opted for a trial of vaginal birth. Those women who attempted a vaginal birth more commonly have had a vaginal delivery in the past (35%) compared with those who opted for a repeat cesarean delivery (8% with a prior vaginal delivery).
Modzelewski (2019) performed a retrospective cohort study by reviewing electronic records of singeleton deliveries between 2010 and 2017 from a hospital in Warsaw, Poland, to compare safety of vaginal birth with repeat third cesarean section after two cesarean sections. Women with two previous cesarean deliveries were included. Exclusion criteria were preterm deliveries, placenta previa, abnormal karyotype, and major congenital anomalies. The final analysis included 412 cases for maternal outcome analysis and 406 cases for neonatal outcome analysis. Of these 412 women, 377 women (91.5%) had a repeat caesarean delivery and 35 (8.5%) women a trial of vaginal birth. No differences were found in baseline characteristics between these two groups. Modzelewski (2019) reported that their retrospective study did not allow for reliable discrimination between symptomatic uterine rupture and asymptomatic uterine scar dehiscence. Therefore, in this study uterine rupture was defined as any detected cesarean scar dehiscence, independently of size or clinical symptoms.
Spaans 2003 performed a retrospective analysis of medical records of 246 women from two university hospitals in The Netherlands (from January 1988 through December 1997) to investigate the safety of a trial of labour after two or more previous cesarean sections. Women with a singleton pregnancy (breech or transverse presentation allowed and fetuses with congenital anomalies were included) with a medical history of more than one previous caesarean section (≥ 2 to ≤ 5) were included. Of the 246 women, 187 (76.0%) underwent an elective repeat caesarean section, 59 (24.0%) women had a trial of vaginal birth. Besides the number of previous caesarean sections, baseline characteristics were not reported by Spaans (2003). Regarding the women with two previous caesarean sections (n=211), 73.9% had an elective repeat caesarean section and 26.1% a trial of vaginal birth. For the women with three previous caesarean sections (n=29), 86.2% had an elective repeat caesarean section and 13.8% a trial of vaginal birth. Four women in this study have had four previous caesarean sections and two women had five previous caesarean sections: none of this women performed a trial of vaginal birth.
Results
Maternal outcomes
Outcome measure 1: uterine rupture
Four studies reported on the outcome measure uterine rupture (Landon, 2006; Macones, 2005; Modzelewski, 2019; Spaans 2003), comparing a trial of vaginal birth (with or without induction) versus a planned third cesarean delivery. The definition of uterine rupture varied between studies (Landon, 2006; Macones, 2005; Modzelewski, 2019) and was not defined in the study of Spaans, 2003. More specifically, Landon, 2006 defined uterine rupture as a disruption of the uterine muscle and visceral peritoneum or a uterine muscle separation with extension to the bladder or broad ligament. Macones, 2005 defined uterine rupture as separation of the uterine scar, immediately preceded by either a nonreassuring fetal heart rate pattern or by signs/symptoms of acute maternal bleeding or by the presence of blood in the maternal abdomen at the time of laparotomy. Modzelewski (2019) applied the definition any detected cesarean scar dehiscence, independently of size or clinical symptoms for the outcome measure uterine rupture.
Uterine rupture was reported for 29 of 2151 (1.3%) mothers with a trial of vaginal birth versus 14 of 9487 (0.1%) mothers with a planned third caesarean delivery (OR 8.48 (95% CI 0.67 to 107.52)) (Figure 1).
Figure 3.1 Uterine rupture, comparison trial of vaginal birth (with or without induction) versus planned third caesarean delivery
Outcome measure 2: mode of delivery (spontaneous vaginal, instrumental, cesarean section)
Four studies reported on trial of vaginal labor success in women with medical history of two caesarean sections attempting vaginal birth (Landon, 2006; Macones, 2005; Modzelewski, 2019; Spaans 2003). Trial of labor success ranged from 62.9% to 83.1% (Table 3.2).
Table 3.2 Trial of vaginal labour success in women with medical history of two caesarean sections
|
Study |
Trial of vaginal labour success, n/N (%) |
|
Landon, 2006 |
648/975 (66.5) |
|
Macones, 2005 |
807/1082 (74.6) |
|
Modzelewski, 2019 |
22/35 (62.9) |
|
Spaans 2003 |
49/59 (83.1) |
Outcome measure 3: indications for cesarean section (failure to progress, fetal distress)
No studies reported on indications of cesarean section.
Outcome measure 4: maternal mortality
Three studies reported on the outcome measure maternal mortality (Landon, 2006; Modzelewski, 2019; Spaans 2003), comparing a trial of vaginal birth (with or without induction) versus a planned third cesarean delivery. Maternal mortality was reported for 0 of 1069 (0.0%) women with a trial of vaginal birth versus 1 of 6599 (0.02%) women with a planned third caesarean delivery.
Outcome measure 5: postpartum hemorrhage
One study reported on the outcome measure postpartum hemorrhage (Modzelewski, 2019), defined as estimated blood loss of 500 mL after vaginal or 1000 mL after cesarean delivery. Postpartum haemorrhage was reported for 4 of 35 (11.4%) women with a trial of vaginal birth compared to 5 of 377 (1.3%) women with a planned third caesarean delivery (RR 8.62 (95% CI 2.42 to 30.63).
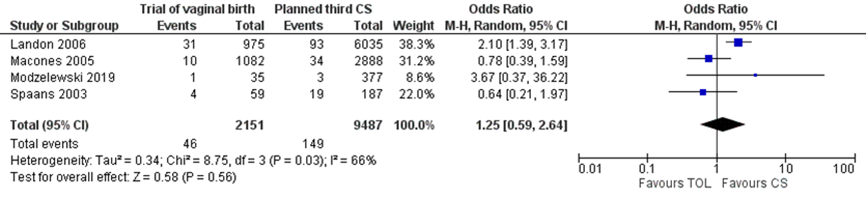
Four studies reported on the outcome measure blood transfusion (Landon, 2006; Macones, 2005; Modzelewski, 2019; Spaans 2003), comparing a trial of vaginal birth (with or without induction) versus a planned repeat third caesarean delivery. Blood transfusion was reported for 46 of 2151 (2.1%) women with a trial of vaginal birth compared to 149 of 9487 (1.6%) women with a planned third caesarean delivery (OR 1.25 (95% CI 0.59 to 2.64)) (Figure 3.3).
Figure 3.3 Blood transfusion, comparison trial of vaginal birth (with or without induction) versus planned third caesarean delivery
Outcome measure 6: use of analgesia postpartum. No studies reported on the outcome measure use of analgesia postpartum.
Outcome measure 7: patient satisfaction
No studies reported on the outcome measure patient satisfaction.
Outcome measure 8: traumatic birth experience
No studies reported on the outcome measure traumatic birth experience.
Neonatal outcomes
Outcome measure 9: perinatal mortality
One study reported on term intrapartum stillbirth as well as term neonatal death (Landon, 2006). Term intrapartum stillbirth was reported for 0 of 672 (0.0%) infants of mothers with a trial of vaginal birth compared to 0 of 5676 (0.0%) infants of mothers with a planned third caesarean delivery.
Term neonatal death was reported for 1 of 672 (0.15%) infants of mothers with a trial of vaginal birth compared to 1 of 5676 (0.02%) infants of mothers with a planned third caesarean delivery (OR 8.46 (95% CI 0.53 to 135.37)).
Outcome measure 10: neonatal infections
No studies reported on the outcome measure neonatal infections.
Outcome measure 11: Apgar score < 7 at 5 minutes
One study reported on the outcome measure Apgar score < 7 at 5 minutes (Spaans, 2003) comparing a trial of vaginal birth (with or without induction) versus a planned third caesarean delivery. An Apgar score < 7 at 5 minutes was reported for 3 of 43 (7.0%) infants of mothers with a trial of vaginal birth compared to 6 of 171 (3.5%) infants of mothers with a planned third caesarean delivery (OR 2.06 (95% CI 0.49 to 8.60)).
Outcome measure 12: NICU admission
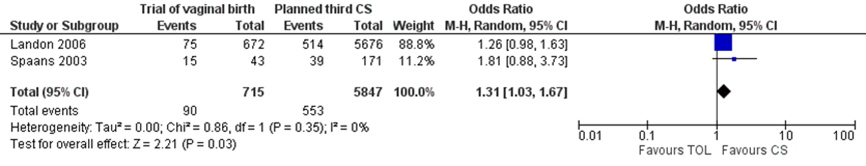
Two studies reported on the outcome measure NICU admission (Landon, 2006; Spaans, 2003) comparing a trial of vaginal birth (with or without induction) versus a planned third cesarean delivery. NICU admission was defined by Landon as term NICU admission, Spaans did not further define NICU admission. NICU admission was reported for 90 of 715 (12.6%) infants of mothers with a trial of vaginal birth compared to 1295 of 30877 (4.2%) 553 of 5847 (9.4%) infants of mothers with a planned third caesarean delivery (OR 1.31 (95% CI 1.03 to 1.67)) (Figure 3.4).
Figure 3.4 NICU admission, comparison trial of vaginal birth (with or without induction) versus planned third caesarean delivery
Level of evidence of the literature
Observational studies for intervention questions start at a low GRADE. The following outcome measures were not reported: indications for cesarean section (failure to progress, fetal distress); use of analgesia postpartum; perineal trauma; patient satisfaction; traumatic birth experience; and neonatal infections.
The level of evidence regarding the outcome measure uterine rupture was downgraded by two levels to a very low GRADE because of inconsistency (-1) and imprecision (-1) (conflicting results and the number of events was low: 29/2151 in the intervention group and 14/9487 in the control group).
The level of evidence regarding the outcome measure maternal mortality was downgraded by two levels to a very low GRADE because of imprecision (-2) (the number of events was very low: 0/1069 in the intervention group and 1/6599 in the control group).
The level of evidence regarding the outcome measure ppostpartum haemorrhage was downgraded by one level to a very low GRADE because of imprecision (-1) (only one study was included for this outcome measure).
The level of evidence regarding the outcome measure blood transfusion was downgraded by two levels to a very low GRADE because of imprecision (-2) (the 95% confidence interval of the effect included both the upper and lower limits of clinical relevance).
The level of evidence regarding the outcome measure term intrapartum stillbirth was downgraded by one level to a very low GRADE because of imprecision (-1) (only one study included for this outcome measure).
The level of evidence regarding the outcome measure term neonatal death was downgraded by two levels to a very low GRADE because of imprecision (-2) (only one study was included for this outcome measure. The number of events was low: 1/672 in the intervention group and 1/5676 in the control group. The 95% confidence interval of the effect included both the upper and lower limits of clinical relevance).
The level of evidence regarding the outcome measure Apgar score < 7 at 5 minutes was downgraded by two levels to a very low GRADE because of imprecision (-2) (only one study was included for this outcome measure. The number of events was low: 3/43 in the intervention group and 6/171 in the control group. The 95% confidence interval of the effect included both the upper and lower limits of clinical relevance).
The level of evidence regarding the outcome measure NICU admission was downgraded by one level to a very low GRADE because of imprecision (-1) (the 95% confidence interval of the effect includes no clinically relevant effect as well as a clinically relevant effect in favour of a planned third caesarean delivery).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favourable effects of vaginal birth (with and without induction) compared to planned caesarean section in women with a medical history of two previous caesarean sections on neonatal and maternal outcomes?
P (patients): Pregnant patients with a medical history of two previous caesarean sections;
I (intervention: Intended vaginal birth (with or without induction);
C: (control): Planned caesarean section;
O: (outcome measure): Maternal outcomes: uterine rupture, mode of delivery (spontaneous vaginal, instrumental, cesarean section), indications for cesarean section (failure to progress, fetal distress), maternal mortality, postpartum hemorrhage, use of analgesia postpartum, patient satisfaction, traumatic birth experience
neonatal outcomes: perinatal mortality, neonatal infections, Apgar score < 7 at 5 minutes, NICU admission.
Relevant outcome measures
The guideline development group considered uterine rupture as a critical outcome measure for decision making; and mode of delivery (spontaneous vaginal, instrumental, cesarean section), indications for cesarean section (failure to progress, fetal distress), maternal mortality, postpartum hemorrhage, use of analgesia, perineal trauma, use of augmentation, patient satisfaction, traumatic birth experience, perinatal mortality, neonatal infections, Apgar score < 7 at 5 minutes, NICU admission as important outcome measures for
decision making.
A priori, the working group did not define the outcome measures uterine rupture, maternal mortality, postpartum hemorrhage, analgesia, perineal trauma, use of augmentation, patient satisfaction, traumatic birth experience, perinatal mortality, neonatal infections, and NICU admission but used the definitions used in the studies.
The working group defined a relative risk ≤0.8 or ≥1.25 as a minimal clinically (patient) important difference for all the outcome measures.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2008 to July 2020. The starting point for the literature search of January 2008 was chosen because of the meta-analysis from Tasheen, published online in September 2009, that was already identified a priori by the guideline working group. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 519 hits. Studies were selected based on the following criteria: 1) the study was published in 2000 or more recent; 2) the study population consisted of women with two previous cesarean sections (i.e., studies that included >15% women with more than two previous cesarean sections were excluded); 3) the study compared vaginal birth versus a planned cesarean section, and 4) at least one of the predefined outcome measures was reported. Sixteen studies were initially selected based on title and abstract screening. After reading the full text, 12 studies were excluded (see the table with reasons for exclusion under the tab Methods), and four studies were included.
Results
Four studies (Macones 2005; Modzelewski, 2019; Landon 2006; Spaans 2003) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Dombrowski M, Illuzzi JL, Reddy UM, Lipkind HS, Lee HC, Lin H, Lundsberg LS, Xu X. Trial of Labor After Two Prior Cesarean Deliveries: Patient and Hospital Characteristics and Birth Outcomes. Obstet Gynecol. 2020 Jul;136(1):109-117. doi: 10.1097/AOG.0000000000003845. PMID: 32541284; PMCID: PMC7321852.
- Landon MB, Spong CY, Thom E, Hauth JC, Bloom SL, Varner MW, Moawad AH, Caritis SN, Harper M, Wapner RJ, Sorokin Y, Miodovnik M, Carpenter M, Peaceman AM, O'sullivan MJ, Sibai BM, Langer O, Thorp JM, Ramin SM, Mercer BM, Gabbe SG; National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Risk of uterine rupture with a trial of labor in women with multiple and single prior cesarean delivery. Obstet Gynecol. 2006 Jul;108(1):12-20. doi: 10.1097/01.AOG.0000224694.32531.f3. PMID: 16816050.
- Macones GA, Cahill A, Pare E, Stamilio DM, Ratcliffe S, Stevens E, Sammel M, Peipert J. Obstetric outcomes in women with two prior cesarean deliveries: is vaginal birth after cesarean delivery a viable option? Am J Obstet Gynecol. 2005 Apr;192(4):1223-8; discussion 1228-9. doi: 10.1016/j.ajog.2004.12.082. PMID: 15846208.
- Miller ES, Grobman WA. Obstetric outcomes associated with induction of labor after 2 prior cesarean deliveries. Am J Obstet Gynecol. 2015 Jul;213(1):89.e1-89.e5. doi: 10.1016/j.ajog.2015.02.003. Epub 2015 Feb 12. PMID: 25683964.
- Modzelewski J, Jakubiak-Proc M, Materny A, Sotniczuk M, Kajdy A, Rabijewski M. Safety and success rate of vaginal birth after two cesarean sections: retrospective cohort study. Ginekol Pol. 2019;90(8):444-451. doi: 10.5603/GP.2019.0076. PMID: 31482547.
- Phelan JP, Ahn MO, Diaz F, Brar HS, Rodriguez MH. Twice a cesarean, always a cesarean? Obstet Gynecol. 1989 Feb;73(2):161-5. PMID: 2911420.
- Spaans WA, van der Vliet LM, Röell-Schorer EA, Bleker OP, van Roosmalen J. Trial of labour after two or three previous caesarean sections. Eur J Obstet Gynecol Reprod Biol. 2003 Sep 10;110(1):16-9. doi: 10.1016/s0301-2115(03)00082-4. PMID: 12932864.
Evidence tabellen
Evidence tables
Risk of bias table
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Landon 2006 |
Unlikely |
Unclear
Prospective cohort study The number of missings were presented for the baseline characteristics, but not for the outcome data. Length of follow-up was not reported, but probably until birth. |
Unlikely
The outcome measure uterine rupture was defined. |
Likely
No correction for confounding. |
|
Macones, 2005 |
Unclear
The only inclusion criterium described was women with 2 previous cesarean deliveries.
|
Unclear
Retrospective cohort study It was not reported if outcome data was missing. |
Unlikely
The outcome measure uterine rupture was defined. |
Unlikely
Adjusted RR’s were presented. However, it is possible that some relevant confounders may not be accounted for in an analysis conducted in a retrospective observational study. |
|
Modzelewski, 2019 |
Unlikely |
Unlikely
Retrospective cohort study There was no missing outcome data. |
Likely
The outcome measure uterine rupture was defined. However, they were not able to discriminate between symptomatic uterine rupture and asymptomatic uterine scar dehiscence |
Likely
No correction for confounding. |
|
Spaans, 2003 |
Likely
Baseline characteristics were not reported. |
Unclear
Retrospective cohort study It was not reported if outcome data was missing. |
Unclear
Outcomes were undefined. |
Likely
No correction for confounding. |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Bashiri 2008 |
Wrong comparison (women with uterine dehiscence were compared to those without dehiscence) |
|
Cahill 2010 |
Wrong comparison (women who attempted trial of labour with three or more prior caesareans versus women with one and two prior caesareans) |
|
Davidson 2020 |
Wrong comparison (women with 1 versus 2 prior caesareans undergoing trial of labour) |
|
Dombrowski 2020 |
Wrong population (inclusion of only live births) |
|
Fitzpatrick 2012 |
Wrong population (not specifically on multiple prior caesarean delivery) |
|
Marshall 2011 |
Wrong comparison (comparison of outcomes between women with different numbers of previous caesarean deliveries) |
|
Miller 2015 |
Secondary analysis data Landon (2006) |
|
Rossi 2008 |
Wrong population (no multiple prior caesarean delivery) |
|
Rotem 2020 |
Wrong comparison (patients who underwent trial of labour following two versus one prior caesarean delivery) |
|
Simsek 2020 |
Wrong comparison (operational type, repeat cesarean number, and major morbidities) |
|
Tasheen 2010 |
The individual studies included by the meta-analysis of Tasheen were reviewed by the guideline working group and included if appropriate. |
|
Yang 2017 |
Wrong population (no multiple prior caesarean delivery) |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 26-06-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor vrouwen met sectio in de voorgeschiedenis en zwangerschapscholestase.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC locatie AMC, NVOG, voorzitter stuurgroep
- Dr. S.V. (Steven) Koenen, gynaecoloog, werkzaam in het ETZ, Tilburg, NVOG, lid stuurgroep
- Dr. J.J. (Hans) Duvekot, gynaecoloog, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVOG, lid stuurgroep
- Drs. R. (Robin) Huizing, gynaecoloog, werkzaam in het Universitair Medisch Centrum Utrecht, NVOG
- Drs. E.C. (Eline) van der Wilk, gynaecoloog, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVOG
- Dr. M. Depmann, gynaecoloog, werkzaam in het Universitair Medisch Centrum Utrecht, NVOG.
- Dr. A. (Anneke) Kwee, gynaecoloog, werkzaam in het Universitair Medisch Centrum Utrecht, NVOG
- Dr. J.J. (Joepe) Kaandorp, werkzaam in het Universitair Medisch Centrum Utrecht, NVOG
- Dr. A.T. (Titia) Lely, gynaecoloog, werkzaam in het Universitair Medisch Centrum Utrecht, NVOG.
- Dr. C.V. (Christian) Hulzebos, Neonatoloog, werkzaam in het UMCG Beatrix Kinderziekenhuis, NVK
- Dr. H.P (Pauline) Haga-Gort, verloskundige, werkzaam als projectleider waardegedreven (geboorte)zorg Saxenburgh Medisch Centrum, Hardenberg, KNOV
- Drs. I.C.M. (Ingrid) Beenakkers, anesthesioloog, werkzaam in het Universitair Medisch Centrum Utrecht, NVA
- Drs. M.L. (Mark) van Zuylen, anesthesioloog in opleiding in het Amsterdam UMC, NVA
- Dr. S. (Sabine) Logtenberg, klinisch verloskundige, werkzaam in OLVG Oost Amsterdam en Academie Verloskunde Amsterdam Groningen, KNOV
- J. (Jacobien) Wagemaker MSc, Vereniging Care4Neo
- Mw I. (Ilse) van Ee, adviseur patiëntenbelang, Patiëntenfederatie Nederland.
- J.C. (Anne) Mooij MSc, adviseur, Patiëntenfederatie Nederland.
Meelezers
- Leden van de Otterlo - werkgroep (2020-2021)
Met ondersteuning van
- Dr. A. (Anne) Bijlsma-Rutte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot augustus 2021)
- Dr. M.A.C. (Marleen) van Son, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bax (voorzitter stuurgroep) |
Gynaecoloog-perinatoloog Amsterdam UMC 0,8 fte |
Gastvrouw Hospice Xenia Leiden (onbetaald) Lid commissie kwaliteitsdocumenten NVOG Voorzitter 50 modulenproject NVOG Voorzitter commissie Otterlo NVOG Penningmeester werkgroep infectieziekten NVOG Lid kernteam NIPT consortium Lid werkgroep voorlichting en deskundigheidsbevordering RIVM Lid werkgroep implementatie scholing RIVM Lid werkgroep nevenbevindingen NIPT RIVM |
geen |
geen |
|
Duvekot (lid stuurgroep) |
Gynaecoloog, Erasmus MC (full time) |
Directeur 'medisch advies en expertise bureau Duvekot', Ridderkerk, ZZP'er |
Geen |
Geen |
|
Koenen (lid stuurgroep) |
Gynaecoloog, ETZ , Tilburg |
Incidenteel juridische expertise (betaald) |
Geen |
Geen |
|
Huizing |
Gynaecoloog in opleiding Erasmus MC |
Seksuoloog NVVS io onbetaald |
Geen |
Geen |
|
Van der Wilk |
Gynaecoloog -perinatoloog, Erasmus MC |
Niet van toepassing |
Geen |
Geen |
|
Kwee |
gynaecoloog UMC Utrecht, afdeling verloskunde (o.4 FTE) |
Adviescommissie zorgevaluatie FMS, niet betaald |
Geen |
Geen |
|
Kaandorp |
Gynaecoloog, Fellow Perinatologie Universitair Medisch Centrum Utrecht |
Bestuurslid werkgroep Perinatologie en Maternaly ziekten, onbetaald |
Geen |
Geen |
|
Lely |
Werkgroeplid |
Off-road commissie lid ZonMw (onkostenvergoeding, onbetaald) |
Geen |
Geen |
|
Depmann |
AIOS gynaecoloog & verloskunde Universitair Medisch Centrum Utrecht |
niet van toepassing |
Geen |
Geen |
|
Hulzebos |
Kinderarts-neonatoloog UMC Groningen |
NLS en NALS instructeur (tegen een vrijwilligersvergoeding) |
Geen |
Geen |
|
Beenakkers |
Anesthesioloog UMCU/WKZ |
Geen |
Geen |
Geen |
|
Van Zuylen |
Anesthesioloog, UMC, locatie AMC |
- |
Geen |
Geen |
|
Logtenberg |
Academie Verloskunde Amsterdam Groningen: 3 dagen docent |
Niet van toepassing |
Geen |
Geen |
|
Haga-Gort |
Verloskundige, Tot 1-4-2018 werkzaam als maat bij Verloskundige Praktijk De Nieuwe Vaart (Dedemsvaart) |
Voorheen voorzitter van de Verloskundige vereniging Hardenberg e.o. (vrijwilligersvergoeding) en lid van verschillende werkgroepen binnen het VSV (onbetaald). |
Geen |
Geen |
|
Mooij |
Adviseur Patientenbelang, Patientenfederatie Nederland |
Niet van toepassing |
Geen |
Geen |
|
Van Ee |
Adviseur Patientenbelang, Patientenfederatie. |
Vrijwilliger Psoriasispatiënten Nederland |
Geen |
Geen |
|
Wagemaker |
Projectleider PATH in het Maasstad Ziekenhuis Rotterdam 0,55 fte |
Vrijwilliger Vereniging van Ouders van Couveusekinderen - ervaringsexpert richtlijnontwikkeling, promotie Kwaliteitskader Kwaliteitscriteria VOC - soms vacatiegelden |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van patiëntvertegenwoordigers van verschillende patiëntverenigingen voor de Invitational conference en afvaardigen van patiëntenverenigingen in de clusterwerkgroep. Het verslag hiervan is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie per module ook ‘Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)’. De conceptrichtlijn wordt tevens ter commentaar voorgelegd aan de betrokken patiëntenverenigingen.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor vrouwen met hypertensieve aandoeningen in de zwangerschap. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen tijdens de Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://gdt.gradepro.org/app/handbook/handbook.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

