Phimosis: operatie versus medicatie
Uitgangsvraag
Wat is de rol van medicamenteuze behandeling van phimosis, in vergelijking met afwachtend beleid of circumcisie?
De uitgangsvraag omvat de volgende deelvragen:
- Verdient een medicamenteuze behandeling van phimosis de voorkeur boven een operatieve behandeling?
- Verdient een medicamenteuze behandeling van phimosis de voorkeur boven afwachten?
- Verdient de ene behandelmodaliteit de voorkeur boven een andere modaliteit bij bepaalde subgroepen van patiënten met phimosis, zoals kinderen of ouderen?
Aanbeveling
Geef aan ouders van een kind met een niet retraheerbare voorhuid zonder klachten, duidelijke voorlichting over de fysiologische vernauwing en de verzorging ervan.
Schrijf bij een kind met een primaire phimosis die behandeling behoeft eerst een corticosteroïdzalf voor.
Overweeg een operatieve behandeling indien na gebruik van corticosteroïdzalf er onvoldoende effect wordt bereikt.
Bespreek met een volwassen patiënt met een primaire phimosis beide opties: corticosteroïdzalf en circumcisie en maak samen een keuze.
Overwegingen
De onderzochte studies tonen in het algemeen een beter resultaat van een behandeling met een corticosteroïdcrème of -zalf (bij 45 tot 95% van de gevallen kan de voorhuid worden teruggetrokken) in vergelijking met afwachten (bij 0 tot 50% van de gevallen kan de voorhuid worden teruggetrokken) of het gebruik van een indifferente crème. Daarbij lijkt de frequentie van aanbrengen van de crème of zalf geen invloed op het resultaat te hebben.
Het effect is klinisch relevant daar de noodzaak tot opereren afnam in de met corticosteroïden behandelde groep.
De bewijskracht is laag, omdat het vrijwel in alle gevallen gaat om kleine, niet gerandomiseerde studies. Bovendien betreffen alle gemelde studies de behandeling bij kinderen. Over de behandeling bij volwassenen is geen adequate informatie voorhanden. Daar ligt een kennislacune.
Bij een kind met een primaire phimosis die behandeling behoeft wordt begonnen met de minst ingrijpende behandeling, namelijk behandeling met een corticosteroïdzalf. Over volwassenen valt geen uitspraak te doen.
Het belangrijkste doel voor de patiënt is een goed resultaat te verkrijgen met de minste kans op recidief en bijwerkingen/complicaties.
Er zijn nauwelijks extra kosten. Enerzijds zijn er weliswaar de kosten van een behandeling met corticosteroïdzalf, anderzijds kunnen daarmee operaties worden voorkomen. De interventie (behandeling met corticosteroïdzalf) is zeker haalbaar, daar deze behandeling zo langzamerhand al gemeengoed aan het worden is. Bovendien zijn veel (ouders van) patiënten geneigd te opteren voor de minst ingrijpende behandeling.
Rationale van de aanbevelingen
Bij de geboorte hebben vrijwel alle mannelijke baby’s een fysiologische vernauwing van de voorhuid. Tegen het einde van het eerste levensjaar is retractie van de voorhuid tot achter de sulcus coronarius van de glans mogelijk in ongeveer 50% van de jongentjes. Tegen de leeftijd van 3 jaar lukt dit bij 89% van de jongens. De incidentie van een vernauwde voorhuid is 8% in de groep van 6 tot 7 jaar en slechts 1% in de groep van 16 tot 18 jaar.
Hoewel de beschikbare literatuur bescheiden van omvang en inhoud is, is bij een kind met phimosis die behandeling behoeft, de behandeling met een corticosteroïdzalf een goede eerste keuze. De kans is redelijk aanwezig (45 tot 95%) dat daarmee al een toereikend effect wordt bereikt.
Hier is geen literatuur onderbouwing voor gevonden, maar het is de mening van de werkgroep dat: indien na gebruik van corticosteroïdzalf er onvoldoende effect wordt bereikt en er sprake is van recidiverende balanitis of bewezen recidiverende urineweginfecties zonder andere verklaring is een operatieve behandeling de volgende verstandige stap. Wanneer een kind geen van de bovengenoemde complicaties ondervindt van de phimosis, kan er ook in overleg met de ouders worden gekozen voor afwachten.
Over volwassen patiënten is er te weinig informatie om tot een gerichte aanbeveling te komen.
Onderbouwing
Achtergrond
Een vernauwde voorhuid of phimosis bij kinderen of volwassenen is een vervelende en veelvoorkomende aandoening, met mogelijke complicaties. De behandeling hiervan is op meerdere manieren mogelijk, hetzij medicamenteus danwel operatief. Van belang om op te merken is dat een circumcisie door patiënten geassocieerd wordt met negatieve aspecten van het sexueel functioneren op latere leeftijd. Er zijn echter sociale aspecten die meespelen in de keuze voor een behandeling van een phimosis. In deze zoekvraag wordt gericht op de behandeling van voorhuidafwijking, dus niet de religieuze circumcisie van een normale voorhuid.
Conclusies / Summary of Findings
Medicamenteuze behandeling versus neutrale zalf of crème
|
Laag GRADE |
Behandeling met een corticosteroïde zalf geeft waarschijnlijk een grotere kans op partiële of volledige resolutie van phimosis bij jongens in vergelijking met behandeling met een neutrale zalf of crème.
Bronnen: (Moreno, 2014) |
|
Zeer laag GRADE |
Het lijkt erop dat bij jongens met phimosis behandeling met diclofenac sodium tot een beter resultaat leidt dan behandeling met retractie adviezen.
Bronnen: (Atilla, 1997) |
Medicamenteuze behandeling versus retractie adviezen
|
Zeer laag GRADE |
Het lijkt erop dat bij jongens met phimosis behandeling met betamethasone valeraat tot een beter resultaat leidt dan behandeling met retractie adviezen.
Bronnen: (Balamtekin, 2006 (uit Moreno, 2014)) |
Medicamenteuze behandeling versus een andere medicamenteuze behandeling
|
Zeer laag GRADE |
Het is niet duidelijk of bij jongens met phimosis behandeling met betamethasone valeraat tot een beter resultaat leidt dan behandeling met clomethasone butyraat.
Bronnen: (Yang, 2005) |
Medicamenteuze behandeling versus circumcisie
|
Laag GRADE
Zeer laag GRADE
|
Bij jongens met phimosis geeft een circumcisie waarschijnlijk een grotere kans op een resolutie van de phimosis, dan een medicamenteuze behandeling.
Het is onzeker of een circumcisie een hoger risico op complicaties geeft dan een medicamenteuze behandeling bij jongens met phimosis.
Bronnen: (Moreno, 2014; Nobre, 2010) |
Medicamenteuze behandeling bij volwassenen
|
- GRADE |
Het is niet bekend bij volwassen mannen met phimosis of een medicamenteuze behandeling meer of minder kans geeft op een resolutie van phimosis dan een neutrale zalf, retractie adviezen of een circumcisie. |
Samenvatting literatuur
Beschrijving studies
Er werden geen studies gevonden waarin het effect van een medicamenteuze behandeling van phimosis werd vergeleken met een andere behandeling bij volwassen mannen.
De systematische review van Moreno (2014) werd als uitgangspunt genomen en aangevuld met studies die wel aan de zoekvraag voldeden maar buiten Moreno (2014) vielen; of studies die na de zoekdatum van deze review waren verschenen.
Medicamenteuze behandeling versus circumcisie
Er werden twee RCT’s gevonden die een behandeling met corticosteroïdzalf vergeleken met circumcisie (Nobre, 2010; Yilmaz, 2003). De studie was Yilmaz (2003) was geëxtraheerd uit de systematische review van Moreno (2014). Nobre (2010) vergeleek de behandeling met 0,2% betamethason and hyaluronidase crème 2dd gedurende 8 weken (n=29) met circumcisie (n=30). Yilmaz (2003) vergeleek de behandeling met 0.01% betamethason, 2dd gedurende 1 maand (n=50) met circumcisie (n-51).
Medicamenteuze behandeling versus een andere medicamenteuze behandeling
Yang (2010) beschreef in een RCT de vergelijking tussen beclamethasone valeraat 0,06% (n=32) en clomethasone butyrate 0,05% (n=31) bij jongens met phimosis tussen de 1 n 12 jaar. In beide groepen werd er 2 maal daags gedurende 1 maand gesmeerd, en, indien er onvoldoende verbetering optrad nogmaals 2 maal daags 1 maand lang. Patiënten werden gedurende 24 weken gevolgd.
Medicamenteuze behandeling versus neutral crème of zalf
Binnen de systematische review van Moreno (2014) zijn er 11 RCT’s beschreven die bij jongens met phimosis het gebruik van een corticosteroïd crème vergeleken met een placebo-neutrale crème. Het aantal patiënten in de studies varieerde tussen de 25 en de 240 personen; en de meeste studies includeerden patiënten gemiddeld jonger dan 6 jaar. Er werden verschillende soorten corticosteroïden gebruikt (zie tabel hieronder). De meest voorkomende was betamethason. De behandelfrequentie was meestal 2 maal daags, en de behandeling duurde tussen de 4 en de 8 weken. De behandelfrequentie en behandelduur met neutrale crème in de controlegroep was dezelfde.
Daarnaast werd er één RCT van Atilla (1997) gevonden die het gebruik van diclofenac sodium zalf (n=32) vergeleek met neutrale zelf (n=20) bij jongens met phimosis in de leeftijd van 2 tot 6 jaar.
Medicamenteuze behandeling versus retractie adviezen
In de systematische review van Moreno (2014) werd één RCT (Balantekin, 2006) beschreven waarin het gebruik van 0.05% beclamethasone diproprionate 2dd gedurende 4 weken (n=36) werd vergeleken met retractie adviezen (n=17).
|
Studie |
Patienten |
Behandeling |
Controle |
Uitkomst |
|
Medicamenteuze behandeling versus neutrale crème/placebo |
||||
|
Atilla, 1997 |
Jongens met phimosis N=52
Leeftijd 2 tot 6 jaar
|
Zalf met diclofenac sodium 3dd aanbrengen op voorhuid gedurende 4 weken N=32 Leeftijd: 2 tot 6 jaar (gem 4.6) |
Neutrale zalf
3dd aanbrengen op voorhuid gedurende 4 weken N=20 Leeftijd: 2 tot 6 jaar (gem 4.2) |
Responders (verbetering naar (vrijwel) normale toestand: Diclofenac zalf: 24/32 (75%) Zalf: 3/20 (15%) |
|
Chao, 2006 (uit Moreno, 2014) |
Jongens met phimosis
N= 300 Leeftijd: gemiddeld 6.9 (3-17) jaar |
Betamethasone 0.1% 2dd gedurende 8 weken
retractie preputium oefenen
|
Creme op waterbasis 2dd gedurende 8 weken
retractie preputium oefenen
|
Succes: Cortico: 114/149 (77%) Neutrale crème: 76/151 (50%) |
|
Esposito, 2008 (uit Moreno, 2014) |
jongens met phimosis
n=240 Leeftijd 3 tot 13 jaar (mediaan: 4.7) |
Corticosteroid (monometasone furoate 0.1%) crème 2dd gedurende 4 weken aanbrengen n=120 |
Neutrale crème 2dd gedurende 4 weken aanbrengen N=120 |
Geen succesvolle retractie: Cortico: 80/120 (67%) Neutrale crème: 41/120 (34%)
|
|
Golubovic, 1996 (uit Moreno, 2014) |
Jongens met phimosis
N=40 Leeftijd: 3 tot 6 jaar |
0.05% betamethasone 2dd gedurende 4 weken |
Vaseline 2dd gedurende 4 weken |
Succes: Cortico: 19/20 (95%) Neutrale crème: 4/20 (20%) |
|
Kiss, 2001 (uit Moreno, 2014) |
Jongens met phimosis
N=40 Leeftijd: 8.9 (3-15) jaar |
Mometasone furoate 0.05% 1dd gedurende 5 wekene |
Neutrale creme 1dd gedurende 5 weken |
Succes: Cortico: 7/20 (35%) Neutrale crème: 0/20 (0%) |
|
Lee, 2006 (uit Moreno, 2014) |
Jongens met phimosos
N=25 Leeftijd 5.6 (3 tot 9) |
0.1% hydrocortisone crème gedurende 4 weken |
Vaseline gedurende 4 weken |
Succes (makkelijke retractie van de voorhuid): Hydroc: 10/13 (77%) Vaseline: 0/12 (0%) |
|
Letendre, 2009 (uit Moreno, 2014) |
Jongens met phimosis
N= 63 Leeftijd 3 tot 12 jaar |
0.1% triamcinolone crème
N=21 |
Neutrale crème
N=25 |
Succes (makkelijke retractie van de voorhuid): Triamcinolon: 16/21 (76%) Neutrale crème: 9/25 (39%)
Noodzaak tot circumcisie: Triamcinolon: 1/21 (5%) Neutrale crème: 4/25 (16%) |
|
Lindhagen, 1996 (uit Moreno, 2014) |
Jongens met phimosis
N=27 Leeftijd: 7.5 (5 tot 12) jaar |
0.05% Clobetasol propionate
N=13 |
Neutrale crème
N=14 |
Succes (makkelijke retractie van de voorhuid): Clobetasol: 10/13 (77%) Neutrale crème: 7/14 (50%) |
|
Lund, 2005 (uit Moreno, 2014) |
Jongens met graad 4-6 phimosis
N=137 Leeftijd: 3 tot 15 jaar |
0.1% betamethason crème 2dd gedurende 4 weken aanbrengen N=66 |
Neutrale crème 2dd gedurende 4 weken aanbrengen
N=71 |
Succes (makkelijke retractie van de voorhuid): Betamethasone: 49/66 (74%) Neutrale crème: 31/71 (44%)
|
|
Nascimento, 2001 (uit Moreno, 2014) |
Jongens met graad 1-5 phimosis
N=192 Lweftijd: 5 (3 tot 10) jaar |
0.2% betamethason _ hyluronzuur crème 2 dd gedurende 8 weken N=51
0.2% betamethason crème 2 dd gedurende 8 weken N=54 0.1% betamethasone 2 dd gedurende 8 weken N=52 |
Neutrale crème 2 dd gedurende 8 weken |
Succes: betamethason: 86/157 (54%) Neutrale crème: 11/35 (31%) |
|
Pileggi, 2007 (uit Moreno, 2014) |
Jongens met phimosis
N= 110 Leeftijd 4.6 (2 tot 13) jaar |
0.1% mometasone furoate, gedurende 2x 8 weken |
Neutrale crème gedurende 2x 8 weken |
Succes (makkelijke retractie van de voorhuid): Mometasone: 49/56 (88%) Neutrale crème: 28/44 (64%) |
|
Yilmaz, 2003 (uit Moreno, 2014) |
Jongens met phimosis
N=98 Leeftijd 4.5 (3 tot 6) jaar |
0.05% betathasone 2dd gedurende 1 maand |
Vaseline, 2dd gedirende 1 maand |
Succes: Cortico: 42/50 (84%) Neutrale crème: 2/48 (4%) |
|
Medicamenteuze behandeling versus medicamenteuze behandeling |
||||
|
Yang, 2005 |
Jongens met phimosis
N=70 Leeftijd 1 tot 12 jaar |
betamethasone valerate 0.06%; 2dd gedurende 4 weken |
clobetasone butyrate 0.05%; 2dd gedurende 4 weken |
Respons (toename retractabiliteitsscore met meer dan 2 punten) Betamethason: 81% Clobetasone: 77% p>0.05
Volledige retractie voohuid (grade 0 of 1) Betamethason: 50% Clobetasone: 45% |
|
Medicamenteus versus afwachten/leefadviezen |
||||
|
Balemtekin, 2006 (uit Moreno, 2014) |
jongens met phimosis
n=53 leeftijd: 3 tot 8 jaar |
0.05% beclamethasone diprprionate 2dd gedurende 4 weken N=36 |
Retractie adviezen N=17 |
Succesvolle retractie: Cortico: 21/36 (58%) Retractie adviezen: 1/17 (6%) |
|
Medicamenteus versus circumcisie |
||||
|
Nobre, 2010 |
Jongens met phimosis
N=85 Leeftijd 3 tot 10 |
0.2% betamethasone and hyaluronidase creme 2dd gedurende 8 weken N=42 à 29 (dropout) |
Circumcisie N=43 à30 (dropout) |
Succes (geen phimosis klachten meer): Betamethasone: 15/29 (52%) Circumcisie: 30/30 (100%)
Complicaties Betamethasone: 10/29 (33%) (hyperemie) Circumcisie: 5/30 (17%) (2 nabloeden, 3 infectie) |
|
Yilmaz, 2003 (uit SR Moreno, 2014) |
Jongens met phimosis
N=101 leeftijd |
0.01% betamethason, 2dd gedurende 1 maand N=50 |
Circumcisie N=51 |
Succes: Cortico: 42/50 (84%) Circumcisie: 51/51 (100%) |
Resultaten
Succesvolle interventie
Over het algemeen werd een succesvolle interventie gedefinieerd als “volledige of partiële retractie van de voorhuid mogelijk”.
Corticosteroïd versus neutrale zalf/crème
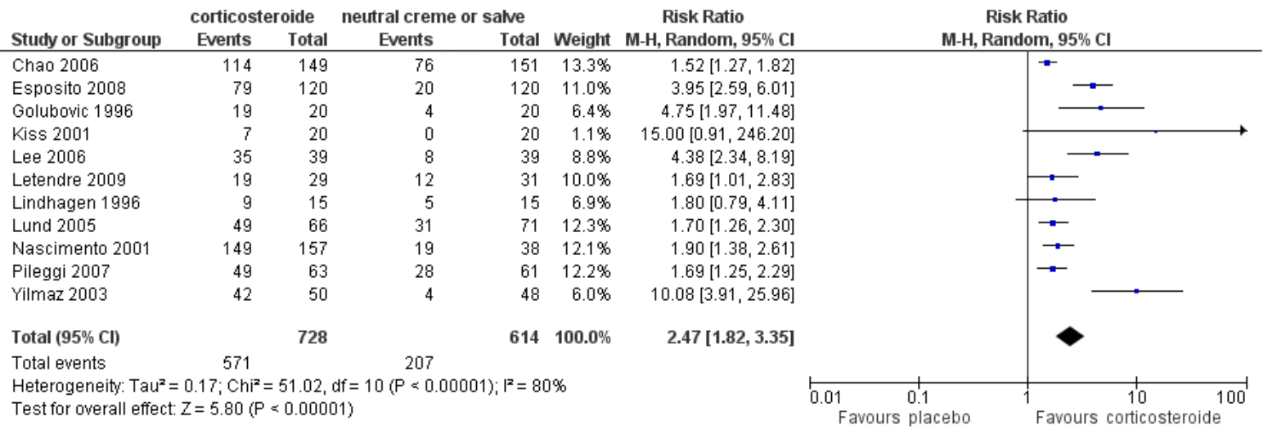
De kans op een succesvolle interventie was hoger in de groep dat een corticosteroïd kreeg, vergeleken met een neutrale zalf/crème. Moreno (2014) beschreef in 11 RCT’s met 1342 patiënten dat de kans op een succesvolle interventie hoger was in de corticosteroïd groep vergeleken met de neutrale crème groep; risk ratio 2,47 (95% BI: 1,82 tot 3,35; p<0,001). Geen van de studies rapporteerden complicaties in de interventie- of controlegroep.
Figuur 1 Forest plot corticosteroïden versus neutrale zalf/ crème met als uitkomst volledige of partiële retractie van de voorhuid
Atilla (2007) beschreef dat in de diclofenac sodium 24/32 (75%) patiënten resolutie van phimosis hadden, versus 3/20 (15%) in de neutrale crème groep.
Bewijskracht van de literatuur
Corticosteroïden: De bewijskracht voor de uitkomstmaat resolutie van phimosis is met 2 niveaus verlaagd, van hoog naar laag gezien beperkingen in de onderzoeksopzet (risk of bias; randomisatie en allocatie onduidelijk) en het geringe aantal patiënten (imprecisie).
Diclofenac sodium: De bewijskracht voor de uitkomstmaat succesvolle interventie is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: randomisatie en allocatie procedure onduidelijk, geen blindering patiënten); en 2 niveaus wegens het geringe aantal patiënten (imprecisie).
Medicamenteuze behandeling versus een andere medicamenteuze behandeling
Yang (2005) beschreef dat er geen significant verschil werd gevonden in de kans op een succesvolle interventie tussen de verschillende soorten corticosteroïden die werden gebruikt. De retractibiliteitsscore verschilde niet tussen de beclamethason-groep (3,9 ± 1,0) en clomethason-groep (4,2 ± 1,0, p = 0,32). Er werden in beide behandelgroepen geen complicaties gerapporteerd.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat succesvolle interventie is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: randomisatie en allocatie procedure onduidelijk, geen blindering patiënten); en 2 niveaus wegens het geringe aantal patiënten (imprecisie).
Corticosteroïd versus retractie oefeningen en/of leef-adviezen
Balamtekin (2006) beschreef dat in de betamethasone-groep 30/36 (83%) patiënten volledige of partiële resolutie van phimosis had, terwijl dit in de retractie adviezen groep 6/17 (35%) waren; risk ratio 2,36 (95% CI: 1,22 tot 4,57).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat succesvolle interventie/partiële resolutie phimosis is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: randomisatie en allocatie procedure onduidelijk, geen blindering patiënten); en 2 niveaus wegens het geringe aantal patiënten (imprecisie).
Medicamenteuze behandeling versus circumcisie
De kans op een complete of volledige resolutie van phimosis was hoger in de groep dat een circumcisie kreeg, vergeleken met een corticosteroïd. Nobre (2010) rapporteerde een resolutie van phimosis van 52% in de bethametason-groep versus 100% in de circumcisie-groep. Yilmaz (2003) rapporteerde een rapporteerde een resolutie van phimosis van 84% in de bethametason-groep versus 100% in de circumcisie-groep.
Wat betreft complicaties, Nobre (2010) rapporteerde dat 33% (10/29) in de betamethason-groep hyperemie kreeg, en 5/30 (17%) in de circumcisie-groep een postoperatieve complicaties kreeg (2 nabloedingen, 3 infecties).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat resolutie van phimosis is met 2 niveaus verlaagd, van hoog naar laag gezien beperkingen in de onderzoeksopzet (risk of bias; randomisatie en allocatie onduidelijk; geen blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat resolutie van complicaties is met 3 niveaus verlaagd, van hoog naar zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias; randomisatie en allocatie onduidelijk; geen blindering) en wegens het geringe aantal patiënten (imprecisie) en inconsistentie (heterogeniteit van vermelde complicaties).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse
verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van een medicamenteuze behandeling (corticosteroïd) van een phimosis, in vergelijking met afwachtend beleid of een medicamenteuze behandeling (corticosteroíden) of een operatieve behandeling?
Subvragen:
- Welke patiënteigenschappen zijn gerelateerd aan een goede reactie op een medicamenteuze behandeling?
- Welke patiënteigenschappen zijn gerelateerd aan een goede reactie op een operatieve behandeling?
PICO
P: (patienten): jongens en mannen met een benigne phimosis;
I: (interventie): topische behandeling;
C: (comparison): operatieve behandeling, afwachtend beleid of andere topische b behandeling;
O: (outcome): recidieven, herbehandeling, tevredenheid, succespercentages, complicaties, therapietrouw.
Relevante uitkomstmaten
De werkgroep achtte succespercentages en recidieven voor de besluitvorming cruciale uitkomstmaten; en tevredenheid, complicaties en therapietrouw voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley)] is op 5 maart 2018 met relevante zoektermen gezocht naar origineel vergelijkend onderzoek, of systematische reviews hiervan, waarin een topische behandeling van benigne phimosis werd vergeleken met een andere topische behandeling, afwachten of een operatieve behandeling. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 169 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: origineel onderzoek, of een systematische review van origineel onderzoek, onderzoek gepubliceerd vanaf 1990, patiëntpopulatie bestaande uit jongens en/ of mannen met benigne phimosis, studies waarin een medicamenteuze behandeling werd vergeleken met een andere medicamenteuze behandeling, een operatieve behandeling of afwachten. Op basis van titel en abstract werden in eerste instantie 22 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 17 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 5 studies definitief geselecteerd.
Vijf onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Atilla, K. M., Dundaroz, R., Odabas, O., Ozturk, H., Akin, R., & Gokcay, E. (1997). A nonsurgical approach to the treatment of phimosis: local nonsteroidal anti-inflammatory ointment application. The Journal of urology, 158(1), 196-197.
- Balamtekin, N., Uluocak, N., Atay, A., Aydın, H. I., & Karabıyık, I. (2006). The Effect of Topical Corticosteroid Creams on Phimosis Treatment. Erciyes Medical Journal, 28(3), 120-124.
- Moreno, G., Corbalán, J., Peñaloza, B., & Pantoja, T. (2014). Topical corticosteroids for treating phimosis in boys. Cochrane Database of Systematic Reviews, (9).
- Nobre, Y. D., Freitas, R. G., Felizardo, M. J., Ortiz, V., & Macedo Jr, A. (2010). To circ or not to circ: clinical and pharmacoeconomic outcomes of a prospective trial of topical steroid versus primary circumcision. International braz j urol, 36(1), 75-85.
- Yang, S. S. D., Tsai, Y. C., Wu, C. C., Liu, S. P., & Wang, C. C. (2005). Highly potent and moderately potent topical steroids are effective in treating phimosis: a prospective randomized study. The Journal of urology, 173(4), 1361-1363.
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Moreno, 2014 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
there were insufficient studies included to enable assessment of publication bias |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests ( for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Moreno, 2014
[individual study characteristics deduced from [1st author, year of publication ]]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to June 2014
A: Balamtekin, 2006 B: Chao, 2006 C: Esposito, 2008 D: Golubovic, 1996 E: Kiss, 2001 F: Lee, 2006 G: Letendre, 2009 H: Lindhagen, 1996 I: Lund, 2005 J: Nascimento, 2001 K: Pileggi, 2007 L: Yilmaz, 2003
Study design: RCT
Setting and Country: Chile
Source of funding and conflicts of interest: None reported
|
Inclusion criteria SR: Study type: All RCTs and quasi-RCTs (RCTs in which allocation to treatment was obtained by alternation, use of alternate medical records, date of birth or other predictable methods) comparing the use of any topical corticosteroid ointment with placebo ointment or no treatment in boys with phimosis were included. Participants: Children from birth to 18 years, with any degree of physician diagnosed phimosis (physiological or pathological) intervention: The use of any type or concentration of a topical corticosteroid ointment applied to the stenotic distal portion of the prepuce, used for varying periods of time compared to placebo, with or without gentle manual retraction of the foreskin. Primary outcome: The primary outcome soughtwas resolution of phimosis following treatment. Resolution was defined as a retractable prepuce with exposure of the glans without any visible narrowing.
Exclusion criteria SR: 1) Studies that include boys with non-retractable prepuce due to balano-preputial adhesions without a phimotic ring or boys with previous treatments for phimosis, such as, circumcision, prepuce plasty, topical corticosteroids or other topical medication
11 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A:52; age 2-8 years B: 300; 2-6 years C: 240; 3-13 years D: 40; 3-6 years E: 40; 9 (3-15) years F: 78; 5.2 ± 3.2 years G: 60; 62 months (20 – 84) H: 30; 7.5 (5-12) years I: 137; 6.7 (3-15) years J: 195; 5 (3-12) years K: 124; 6.4 (2-13) L: 98; 4.5 (3-6) years
Sex: all 100% Male
Groups comparable at baseline? yes |
Describe intervention:
A: Beclomethasone dipropionate 0.05%; Frequency: twice daily; Duration: 6 weeks B: Betamethasone 0.1%; Frequency: twice daily; Duration: at least 8 weeks C: Mometasone furoate 0.1%; Frequency: twice daily; Duration: 4 weeks D: Betamethasone 0.05%; Frequency: twice daily; Duration: 4 weeks E: Mometasone furoate 0.05%; Frequency: once daily; Duration: 5 weeks F: Hydrocortisone butyrate 0.1%; Frequency: twice daily; Duration: 4 weeks G: Triamcinolone 0.1%; Frequency: twice daily; Duration: 8 weeks H: Clobetasol propionate 0.05%; Frequency: once daily; Duration: 4 weeks I: Betamethasone 0.1%; Frequency: twice a day; Duration: 4 weeks J: Treatment group 1: Betamethasone valerate 0.2% + hyaluronidase; Frequency: twice daily; Duration: 60 days (8 weeks). Treatment group 2: Betamethasone valerate 0.2%; Frequency: twice daily; Duration: 60 days (8 weeks). Treatment group 3: Betamethasone valerate 0.1%; Frequency: twice daily; Duration: 60 days (8 weeks) K: Mometasone furoate 0.1%; Frequency: twice daily; Duration: 8 weeks L: Betamethasone 0.05%; Frequency: twice daily; Duration: 1 month
|
Describe control:
A: Manual retraction B: Aqueous cream; Frequency: twice daily; Duration: 4 weeks; Betamethasone 0.1%; Frequency: twice daily; Duration: from week 5 for 4 weeks C: Placebo cream; Frequency: twice daily; Duration: 4 weeks D: Vaseline; Frequency: twice daily; Duration: 4 weeks E: Mometasone furoate vehicle; Frequency: once daily; Duration: 5 weeks F: Vaseline; Frequency: twice daily; Duration: 4 weeks G: Emollient cream Aquatain; Frequency: twice daily; Duration: 8 weeks H: Placebo; Frequency: once daily; Duration: 4 weeks I: Aqueous cream; Frequency: twice a day; Duration: 4 weeks J: Placebo cream; Frequency: twice daily; Duration: 60 days (8 weeks) K: Moisturizing cream; Frequency: twice daily; Duration: 8 weeks L: Vaseline; Frequency: twice daily; Duration: 1 month
|
End-point of follow-up:
A: 6 weeks B: 25 weeks C: 6-30 months D: 6-18 months E: 5 weeks F: 4 weeks G: 12 months H: 6 months I: 8 weeks J: 60-180 days K: 8 weeks L: 2 months
For how many participants were no complete outcome data available? (intervention/control) A: No losses to follow-up B: 129/149 (86.5%) treatment group participants completed treatment. 128/151 (84. 7%) control group participants completed treatment. Losses to follow-up not reported C: Time of follow-up and losses are not clear, but “All the patients in our series completed the two treatment periods without interruption” D: Not reported E: In the steroid and placebo group 3 and 4 boys were withdrawn from the study, including 4 lost to follow-up and 3 in whom clinically suspected balanitis xerotica obliterans was not confirmed by histological evaluations’ F: One participant lost to follow-up per group G: Authors reported 8/29 losses to follow-up from the treatment group and 6/31 in the control group H: One participant lost to follow-up per group for ’factors unrelated to the disorder or treatment’ I: There was no losses to follow up J: 25 (11.4%) patients were not considered in the analysis, but reasons were explicit and distribution across treatment and control groups was similar K: Follow-up: 88.8% (56/63) in the treatment group and 88.5% (54/61) in the control group L: No losses to follow-up
|
Outcome measure-1 Defined as.
Effect measure: RR, RD, mean difference [95% CI]: A: I: 30/36 (83%); C: 6/17 (35%) B: RR:1.52 (1.27 – 1.82) C: RR: 3.95 (2.59 – 6.01) D: RR: 4.75 (1.97 – 11.47) E: RR: 15.00 (0.91- 246.20) F: RR: 4.38 (2.34- 8.19) G: RR: 1.69 (1.01 – 2.83) H: R: 1.80 (0.49 – 4.11) I: RR: 1.70 (1.26 - 2.30) J: RR: 1.90 (1.30 – 2.61) K: RR: 1.69 (1.20 – 2.29) L: RR: 10.08 (3.91 – 25.96)
Pooled effect (random effects model): Complete or partial resolution of phimosis risk ratio 2.47 (95% CI: 1.82 – 3.35; p<0,001). favoring corticosteroid Heterogeneity (I2): 80%
Outcome measure-2: complications None were reported in any of the included studies
|
Facultative:
Brief description of author’s conclusion: Topical corticosteroids offer an effective alternative for treating phimosis in boys. Although sub optimal reporting among the included studies meant that the size of the effect remains uncertain, corticosteroids appear to be a safe, less invasive first-line treatment option before undertaking surgery to correct phimosis in boys.
Heterogeneitry in type of corticosteroid used and application regime and duration of treatment. Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading Low (due to high risk of bias in studies and imprecision) |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Medicine versus circumcision |
||||||||
|
Nobre, 2010 |
Not reported |
Unclear |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unclear |
|
Comparison of differents medicinal treatments |
||||||||
|
Yang, 2005 |
“patients were randomly assigned” |
Unlcear |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Medicine versus neutral creme |
||||||||
|
Atilla, 1997 |
“Study and control groups were allocated randomly” |
Unlcear |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Medicine versus circumcision |
|||||||
|
Nobre, 2010 |
Type of study: randomized trial
Setting and country: Brazil; single center university hospital
Funding and conflicts of interest: none reported |
Inclusion criteria: children, from 3 to 10 years of age, diagnosed with phimosis. We defined as phimosis, in this age bracket, phimosis type I (no retraction of the foreskin) and type II (external urethral meatus exposure only), in accordance with the classification system devised by Kayaba, 1996.
Exclusion criteria: none reported
N total at baseline: Intervention: 30 Control: 29
Important prognostic factors2: For example Age: 5.8 years (not reporte for group, no SD reported)
Sex: I:100 % M C: 100% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
Circumcision inhalation anesthesia with sevoflurane, in conjunction with nerve block of the penis
|
Describe control (treatment/procedure/test):
0.2% betamethasone and hyaluronidase cream for 8 weeks Patients who responded well to the topical treatment underwent outpatient follow-up evaluations at 2 and 4 months after the end of treatment. Patients who did not respond to the topical treatment by week 8 or who presented recurrence during the follow-up period underwent circumcision. |
Length of follow-up: 3 months after circumcision, 4 months in control group (unless patients crossed over to circumcision group)
Loss-to-follow-up: Of the 85 children included in the study, 43 were allocated to the surgical group and 42 were allocated to the clinical group. From the surgical group, 13 children were excluded: 1 due to uncooperativeness; 2 due to refusal to undergo surgery; and 10 due to failure to return for surgery. Coincidentally, 13 children were also excluded from the clinical group: 1 due to irregular use of medication; 1 due to being clinically diagnosed with balanitis xerotica obliterans; 1 due to previous use of medication; and 10 due to failure to appear for medical visits.
Incomplete outcome data: Not reported, the 59 patients that were included in the analysis were not reported to have missing data |
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome: resolution of phimosis I: not explicitly reported but assumed 30/30 (100%) C: 15 (51.7%) of the 29 patients presented complete exposure of the glans at 2 months after the end of treatment
Complications of treatment: I: On postoperative day 15, 5 patients presented complications of the procedure: 2 due to infection caused by improper cleaning; and 3 due to hematomas and scarring on the glans C: adverse effects or complications in 10 patients: 4 patients experienced hyperemia and a burning sensation in the foreskin; 4 patients experienced a burning sensation in the foreskin; and 2 patients presented balanopreputial hyperemia. No intervention or treatment interruption was necessary in any of the cases. |
Outcome: resolution of phimosis is not explicitly reported in the circumcision group but assumed 30/30 (100%)
|
|
Comparison of different medicinal treatments |
|||||||
|
Yang, 2005 |
Type of study: randomized controlled trial
Setting and country: University hospital, Taiwan
Funding and conflicts of interest: not reported |
Inclusion criteria: boys with phimosis
Exclusion criteria: phimosis secondary to incomplete circumcision
N total at baseline: Intervention: 32 Control: 31
Important prognostic factors2: For example age ± SD: I: 4.9 ± 2.5 C: 4.5 ± 2.9
Sex: I: 100% M C: 100% M
Retractability score: I: 3.9 ± 1.0 C: 4.2 ± 1.0,
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
topical application of betamethasone valerate 0.06%
apply the topical steroids over the stenotic opening of the prepuce and the adhesion between the prepuce and glans twice daily for 4 weeks, then for another 4 weeks if no improvement was achieved.
|
Describe control (treatment/procedure/test):
topical application of clobetasone butyrate 0.05%
apply the topical steroids over the stenotic opening of the prepuce and the adhesion between the prepuce and glans twice daily for 4 weeks, then for another 4 weeks if no improvement was achieved.
|
Length of follow-up: 24 weeks
Loss-to-follow-up: Intervention: 3/32 (10%) Reasons not reported
Control: 4/31 (13%) Reasons not reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
The retractibility score improved to 1.7 ± 1.1 and 1.9 ± 1.0 in the betamethasone and clobetasone groups, respectively (p =0.01 in each group). The response rates were similar between the 2 groups (81.3% vs 77.4%, p =0.63). Excellent results of grade 0 or 1 were achieved in 16 (50%) and 14 (45.2%) boys in the betamethasone and clobetasone groups, respectively.
After treatment circumcision was recommended in boys with grade 4 or 5 phimosis. Two thirds of patients in the betamethasone group and half of those in the clobetasone group underwentcircumcision because of remaining high grade phimosis.
No significant adverse effectwas encountered during the study period. |
|
|
Medicine versus neutral cree |
|||||||
|
Atilla, 1997 |
Type of study: randomized trial
Setting and country: Turkey; single center
Funding and conflicts of interest: not reported |
Inclusion criteria: boys with phimosis
Exclusion criteria: Phimosis secondary to incomplete circumcision
N total at baseline: Intervention: 32 Control: 20
Important prognostic factors2: For example age ± SD: I: 4,6 (SD not reported) C: 4,2 (SD not reported)
Sex: I: 100% M C: 100% M
Groups comparable at baseline? unclear |
Describe intervention (treatment/procedure/test):
0.075gm. diclofenac sodium, 3 gm. lanolin, 9 gm. petrolatum and 15 gm. distilled water Applied 3 times a day for 4 weeks
|
Describe control (treatment/procedure/test):
3 gm. lanolin, 9 gm. petrolatum and 15 gm. distilled water Applied 3 times a day for 4 weeks
|
Length of follow-up: not clear; at least 4 weeks
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Normal or almost normal foreskin retractability: I: 24/32 (75%) C: 3/20 (15%) p-value not reported |
|
References:
Kayaba H, Tamura H, Kitajima S, Fujiwara Y, Kato T, Kato T: Analysis of shape and retractability of the prepuce in 603 Japanese boys. J Urol. 1996; 156: 1813-5.
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors [(potential) confounders].
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Balemtekin, 2006 |
Opgenomen in systematische review van Moreno, 2014 |
|
Berdeu, 2001 |
Geen gebruik van origineel data; kosteneffectiviteitsanalyse op basis van eerder gepubliceerde studies, zonder controlegroep die aan de gestelde PICO voldoet |
|
Chu, 1999 |
Observationele studie, terwijl er RCT’s bestaan die ook de (deel)zoekvraag beantwoorden |
|
Esposito, 2008 |
Opgenomen in systematische review van Moreno, 2014 |
|
Golubovic, 1996 |
Opgenomen in systematische review van Moreno, 2014 |
|
Ku, 2007 |
Geen controlegroep |
|
Lee, 2006 |
Opgenomen in systematische review van Moreno, 2014 |
|
Letendre, 2009 |
Opgenomen in systematische review van Moreno, 2014 |
|
Lindhagen, 1996 |
Opgenomen in systematische review van Moreno, 2014 |
|
Lund, 2005 |
Opgenomen in systematische review van Moreno, 2014 |
|
Marques, 2005 |
Geen controlegroep |
|
Nascimento, 2006 |
Opgenomen in systematische review van Moreno, 2014 |
|
Palmer, 2008 |
Vergelijkt twee doseringen van betamethason met elkaar; dit valt buiten de PICO; wordt wel besproken in Module 5c |
|
Pileggi, 2007 |
Opgenomen in systematische review van Moreno, 2014 |
|
Sookpathoram, 2013 |
Vergelijkt twee doseringen van betamethason met elkaar; dit valt buiten de PICO; wordt wel besproken in Module 5c |
|
Yilmaz, 2003 |
Opgenomen in systematische review van Moreno, 2014 |
|
Zampieri, 2007 |
Observationele studie, terwijl er RCT’s bestaan die ook de (deel)zoekvraag beantwoorden |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 20-01-2020
Beoordeeld op geldigheid : 20-01-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Urologie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Urologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Phimosis: operatie versus indicatie |
NVU |
2019 |
2024 |
5 jaar |
NVU |
Ontwikkelingen in wetenschappelijk onderzoek |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
De richtlijn heeft tot doel te komen tot een uniforme en zo mogelijk evidence-based aanpak van de meest voorkomende voorhuidproblemen bij jongens en mannen. Dit betreft zowel de diagnostiek alsook de behandeling.
Doelgroep
Deze richtlijn is geschreven voor alle leden van beroepsgroepen die betrokken zijn bij de zorg voor jongens en mannen met voorhuidproblemen. Deze richtlijn geldt dus niet alleen voor urologen en chirurgen, maar ook voor dermatologen, kinder- en jeugdartsen, physician assistents, verpleegkundig specialisten en bij voorkeur ook voor huisartsen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met voorhuidpathologie te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. J.H.M. (Jan) Blom, uroloog, niet praktiserend, Nederlandse Vereniging voor Urologie, (voorzitter)
- Dr. M.R. (Michael) van Balken, uroloog, Rijnstate Ziekenhuis, Arnhem, Nederlandse Vereniging voor Urologie
- Drs. M.I. (Menuhin) Lampe, uroloog MC Leeuwarden en Sionsberg, Leeuwarden en Dokkum, Nederlandse Vereniging voor Urologie
- Dr. A.B. (Alexander) Stillebroer, uroloog (kinderen), Universitair Medisch Centrum Groningen, Groningen, Nederlandse Vereniging voor Urologie
- Drs. L. (Lineke) Dogger, arts maatschappij en gezondheid, opleider/ adviseur Netherlands School of Public & Occupational Health, Utrecht, AJN Jeugdartsen Nederland
- Prof. dr. V.A. (Victor) de Ridder, chirurg, SFG Rotterdam, Rotterdam, Nederlandse Vereniging voor Heelkunde
- Dr. M.C. (Marius) van den Heuvel, patholoog, Universitair Medisch Centrum Groningen en Pathologie Friesland, Groningen en Friesland, Nederlandse Vereniging voor Pathologie
- Dr. K.D. (Koen) Quint, dermatoloog, Leids Universitair Medisch Centrum en Roosevelt Kliniek, Leiden, Nederlandse Vereniging voor Dermatologie en Venerologie
- Prof. Dr. M. (Martine) de Vries, Hoogleraar medische ethiek Leids Universitair Medisch Centrum, Leiden, Nederlandse Vereniging voor Kindergeneeskunde
Klankbordgroep
- E. (Ellen) Swanborn, voorzitter van de Stichting Lichen Sclerosus, Nieuwerkerk a/d IJssel, Stichting Lichen Sclerosus
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. (Stefanie) Hofstede, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Blom |
Uroloog niet praktiserend Lid Commissie Kwaliteit NVU |
St. Franciscus Gasthuis Rotterdam, commissie Dosieranalyse - betaald R.K. Parochie St. Antonius & Cornelius Den Hoorn , Voorzitter pastoraantsgroep onbetaald begeleiding statushouder onbetaald |
Geen |
Geen actie |
|
Dogger |
Opleider/adviseur NSPOH, eerste fase opleiding arts maatschappij en gezondheid profiel |
Geen |
Geen |
Geen actie |
|
De Ridder |
Algemeen chirurg en chirurg bij kinderen lid bestuur Nederlandse Vereniging Voor Kinderchirurgie |
Hoogleraar Emergency and Logistics UMCU Hoogleraar Pediatric Trauma UMCU |
Geen |
Geen actie |
|
Lampe |
Uroloog MCL Leeuwarden 6 dagdelen en Sionsberg Dokkum 2 dagdelen |
Geen |
Geen |
Geen actie |
|
Van Balken |
Uroloog Rijnstate Ziekenhuis |
Opleider (onbetaald) Voorzitter vakgroep (onbetaald) Lid bestuur NVU (penningmeester 11, Bureau-verantwoordelijke) (vacatiegelden) Lid Werkgroep Functionele Urologie en Reconstructieve Urologie NVU (vacatiegelden) Lid European Society for Female and Functional Urology EAU (onbetaald) Lid Concilium Urologicum NVU (vacatiegelden) Oprichter Aap-Noot-Nier (internationaal: Easy Peesy): vervaardigen medisch informatiemateriaal voor laaggeletterden (onbetaald) |
Geen |
Geen actie |
|
Heuvel |
Patholoog Pathologie Friesland tevens voorzitter vakgroep part time detachering afdeling pathologie UMCG |
Geen |
Geen |
Geen actie |
|
Stillebroer |
Uroloog (kinderen), UMCG |
Geen |
Geen |
Geen actie |
|
Quint |
Dermatoloog afdeling huidziekten LUMC (0.8 fte) dermatoloog Roosevelt kliniek (0.2 fte) |
Dermatoloog-adviseur SOAcare (betaald) penningmeester Nederlandse vereniging Vulvapathologie (onbetaald) bestuurslid Nederlandse vereniging Dermatopathologie (onbetaald) bestuurslid Stichting voor historische microscopie (onbetaald) |
Geen |
Geen actie |
|
De Vries |
Hoogleraar medische ethiek LUMC |
Kinderarts uc (betaald) Lid gezondheidsraad (onbetaald) Lid ZonMw commissie zwangerschap en geboorte (onbetaald) |
Geen |
Geen actie |
|
Swanborn |
Eigenaar Swanborn Illustratie |
Voorzitter van stichting lichen sclerosus (onbetaald) |
Geen |
Geen actie |
|
Mostovaya |
Senior adviseur Kennisinstituut van de Federatie Medische Specialisten |
Geen |
Geen |
Geen actie |
|
Hofstede |
Adviseur Kennisinstituut van de Federatie Medische Specialisten |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging de Stichting Lichen Sclerosus in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging Stichting Lichen Sclerosus.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens werden stakeholders uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference). Vanwege het lage aantal aanmeldingen (één vanuit de V&VN, 2 vanuit de Stichting Lichen Sclerosus) is de bijeenkomst geannuleerd en een schriftelijke knelpuntenanalyse georganiseerd. Er is schriftelijk een knelpunt aangedragen door de V&VN (tabel 1). Na overleg met de Stichting Lichen Sclerosus is de voorzitter toegevoegd aan de klankbordgroep.
Tabel 1 Schriftelijk aangedragen knelpunt
|
Vereniging |
Knelpunt |
|
V&VN |
Er moet adequate voorlichting worden gegeven over de behandelmethoden en het te verwachten resultaat hierbij. Vanzelfsprekend geldt dit voor alle typen behandelingen. Inclusief gevoelsstoornissen na circumcisie onder andere bij seksueel verkeer. Met enige regelmaat zijn er patiënten met problemen na bijvoorbeeld een circumcisie, waarbij er weinig huid beschikbaar is gebleven en de huid van het scrotum omhoog getrokken wordt bij erectie, waardoor bevredigende coïtus wordt belemmerd. |
Tevens werden stakeholders uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference). Vanwege het lage aantal aanmeldingen (drie, IGZ, NVA en de Patiëntenfederatie) is de bijeenkomst geannuleerd. Gevraagd is schriftelijk op het raamwerk te reageren. Er zijn schriftelijk knelpunten aangedragen door NVKC, NVSHA, NVvH, NVZ en V&VN. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1990 – september 2018
|
1 exp PHIMOSIS/ or phimosis.ti,ab. or prepuce.ti,ab. or foreskin*.ti,ab. (5931) 2 exp Adrenal Cortex Hormones/ or exp STEROIDS/ or exp Fluticasone/ or exp PROPIONATES/ or exp BETAMETHASONE/ or repeat*.ti,ab. or corticosteroid*.ti,ab. or steroid*.ti,ab. or betamethasone.ti,ab. or fluticasone proprionate.ti,ab. or clobetasol propionate.ti,ab. or ((therapy or treat*) adj3 (local or topical)).ti,ab. or calcineurin*.ti,ab. or retinoic*.ti,ab. or exp CALCINEURIN INHIBITORS/ or exp CALCINEURIN/ (1620098) 3 1 and 2 (581) 4 limit 3 to (english language and yr="1990 -Current") (390) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (366970) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1786519) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3034537) 8 4 and 5 (13) 9 4 and 6 (44) 10 9 not 8 (39) 11 4 and 7 (77) 12 11 not 8 not 10 (55) 13 4 not 8 not 10 not 12 (283) 14 8 or 10 or 12 or 13 (390) 15 8 or 10 or 12 (107)
= 107 |
169 |
|
Embase (Elsevier) |
('phimosis'/exp OR phimosis:ti,ab OR prepuce:ti,ab OR foreskin*:ti,ab) AND ('corticosteroid'/exp OR 'steroid'/exp OR 'fluticasone propionate'/exp OR 'clobetasol propionate'/exp OR 'betamethasone'/exp OR repeat*:ti,ab OR corticosteroid*:ti,ab OR steroid*:ti,ab OR betamethasone:ti,ab OR 'fluticasone proprionate':ti,ab OR 'clobetasol propionate':ti,ab OR (((therap* OR treat*) NEAR/3 (local OR topical)):ti,ab) OR 'calcineurin inhibitor'/exp OR 'retinoic acid'/exp OR calcineurin*:ti,ab OR retinoic*:ti,ab) AND [english]/lim AND [1990-2018]/py NOT 'conference abstract':it
Gebruikte filters: Systematic Reviews: 'meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) = 17
Randomized Controlled Trials: 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it = 77
Observationele studies: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR (cohort NEAR/1 (study OR studies)):ab,ti OR (case:ab,ti AND (control NEAR/1 (study OR studies)):ab,ti) OR (follow:ab,ti AND (up NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)):ab,ti OR (epidemiologic NEAR/1 (study OR studies)):ab,ti OR ('cross sectional' NEAR/1 (study OR studies)):ab,ti = 30
= 124 |
