Patiënten in de stervensfase met pijn bij kanker
Uitgangsvraag
Hoe moet pijn worden behandeld bij patiënten met kanker in de stervensfase?
Aanbeveling
Bij patiënten met pijn in de stervensfase:
- Minimaliseer pijn gerelateerd aan beweging door langzaam en behoedzaam te handelen en onnodige bewegingen te vermijden. Wisselligging en dagelijks lichamelijke verzorging vinden alleen plaats als dat wenselijk is; dien 15-30 minuten tevoren preventief medicatie tegen doorbraakpijn toe.
- Begeleid de naasten van een bewusteloze patiënt in het interpreteren van verschijnselen die kunnen lijken op een uiting van pijn, maar dat niet hoeven te zijn. Dit betreft met name fronsen en kreunen.
- Maak bij onrust in het sterfbed onderscheid tussen onrust door een terminaal delier (verlaag dosering of roteer opioïd) en onrust door pijn (intensiveer pijnbestrijding).
- T.a.v. pijnmedicatie:
- T.a.v. paracetamol en NSAID’s: In principe staken. Rectale toediening is mogelijk, maar meestal niet gewenst.
- Continueer transdermale toediening van fentanyl of evt. buprenorfine.
- Zet orale toediening van opioïden om in transdermale toediening van fentanyl of in subcutane of (bij aanwezige toedieningsweg) intraveneuze toediening van opioïden. Continue toediening van morfine heeft niet de voorkeur als er tevoren al een gestoorde nierfunctie (creatinineklaring <50 ml/min) was.
- Dien doorbraakmedicatie subcutaan of evt. intraveneus toe, of via het mondslijmvlies (alleen snelwerkende fentanylpreparaten).
Overwegingen
2008
Delier is een frequent voorkomend symptoom in de terminale fase. Het komt bij ongeveer 25% van de patiënten met kanker voor (CBO-richtlijn Delirium, 2005). Een delier in de terminale fase wordt niet altijd als zodanig herkend. Vaak wordt ‘confusion’, verwardheid, als symptoom benoemd (Teunissen, 2007). Een delier is volgens de definitie een organisch psychiatrische stoornis, die altijd het gevolg is van cerebrale ontregeling door een lichamelijke aandoening of het gebruik van (genees)middelen. Bij de behandeling van een delier in het algemeen is het van belang allereerst de onderliggende somatische oorzaak te behandelen (CBO-richtlijn Delirium, 2005). Dit is in het geval van kanker in de terminale fase vaak maar beperkt mogelijk. Altijd moet kritisch worden gekeken naar de medicatie, mede in verband met achteruitgang van de nierfunctie in de terminale fase. Wijziging van (de dosis van) pijnstillende medicatie kan bijdragen aan de preventie of behandeling van een delier in de terminale fase.
2019
Een systematische review over de effectiviteit van medicamenteuze behandeling in het sterfbed (Jansen 2017) leverde slechts twee studies (uit 1977 en 2002) op t.a.v. de behandeling van pijn. De aanbevelingen zijn dus vrijwel geheel gebaseerd op expert opinion c.q. de mening van de werkgroep en op bestaande richtlijnen.
De richtlijn Zorg in de stervensfase (Van Zuylen 2010) geeft de volgende aanbevelingen t.a.v. pijnbestrijding in de stervensfase:
- Minimaliseer pijn gerelateerd aan beweging door langzaam en behoedzaam te handelen en onnodige bewegingen te vermijden. Wisselligging en dagelijks lichamelijke verzorging vinden alleen plaats als dat noodzakelijk is; 15-30 minuten tevoren kan preventief medicatie tegen doorbraakpijn worden toegediend.
- Begeleid de naasten van een bewusteloze patiënt in het interpreteren van verschijnselen die kunnen lijken op een uiting van pijn, maar dat niet hoeven te zijn. Dit betreft met name fronsen en kreunen.
- Staak orale pijnmedicatie. Oraal opioïdgebruik wordt zo nodig omgezet in parenterale toediening, transdermale toediening wordt voortgezet. Doorbraakmedicatie wordt vaak subcutaan toegediend, maar kan ook buccaal (in de wangzak) of nasaal (in de neus) gegeven worden.
T.a.v. de pijnbestrijding in de stervensfase moet rekening gehouden worden met:
- Problemen t.a.v. het vaststellen of er sprake is van pijn omdat de patiënt het zelf niet meer kan aangeven en signalen van de patiënt verschillend worden geïnterpreteerd. Een valkuil daarbij is dat onrust geïnterpreteerd wordt als een gevolg van niet goed gecontroleerde pijn, terwijl er sprake is van een terminaal delier. In het eerste geval zou de pijnstilling geïntensiveerd moeten worden, terwijl in het tweede geval er gekozen zou moeten worden voor dosisreductie of opioïdrotatie;
- Onvermogen tot inname van orale pijnmedicatie. Er moet dan gekozen worden voor een andere toedieningsweg. Paracetamol en/of NSAID’s worden in principe gestaakt; rectale toediening is mogelijk, maar in het sterfbed meestal niet gewenst. Opioïden kunnen transdermaal (onderhoudsbehandeling), s.c. of (bij aanwezige toedieningsweg) i.v. (onderhoudsbehandeling en doorbraakmedicatie) of via het mondslijmvlies (snelwerkende fentanylpreparaten voor doorbraakpijn; de intranasale toediening heeft niet de voorkeur bij sterk verzwakte patiënten) worden toegediend. Er is geen onderbouwing om te veronderstellen dat transdermale toediening van fentanyl in de stervensfase minder effectief zou zijn dan een subcutaan of intraveneus toegediende opioïd (Ellershaw 2002, Jacobsen 1999). Over de resorptie van fentanyl uit de pleister bij cachectische patienten wordt zowel een versterkte resorptie (Suno 2015) als een afgenomen resorptie (Heiskanen 2009) vermeld. Adjuvante analgetica voor neuropatische pijn kunnen voor het overgrote deel alleen oraal toegediend worden en zullen dus meestal worden gestaakt.
- Verslechtering van de nierfunctie, waardoor stapeling kan optreden van middelen (m.n. morfine) die renaal worden uitgescheiden (zie de uitgangsvraag Nierfunctiestoornissen). Hier moet rekening mee worden gehouden als de nierfunctie tevoren reeds gestoord was (creatinineklaring <50 ml/min).
Onderbouwing
Achtergrond
In deze tekst wordt de stervensfase gedefinieerd als de laatste dagen tot hooguit 1-2 weken voor het overlijden. Deze periode wordt gekenmerkt door toenemende verzwakking en bedlegerigheid, afname van het bewustzijn en onvermogen tot innemen van orale medicatie. Deze kenmerken hebben consequenties voor de pijn en de diagnostiek en behandeling ervan.
Pijn komt voor bij 45% van de patiënten met kanker in de laatste 1-2 weken voor het overlijden (Teunissen 2007). De prevalentie is lager dan in de periode ervoor (45% vs 70%, Teunissen 2007). Mogelijk hangt dit samen met minder bewegen en daardoor minder uitlokkende momenten voor de pijn. Andere mogelijke verklaringen zijn een betere behandeling en/of een verminderde pijnbeleving door de daling van het bewustzijn.
Pijn komt voor bij 49% van de patiënten met COPD in de laatste 1-2 weken voor het overlijden en bij 42% van de patiënten met hartfalen in de laatste 1-2 weken voor het overlijden (Janssen 2008).
Vaak is de patiënt in de stervensfase niet meer goed in staat om pijnklachten aan te geven. Het interpreteren van verschijnselen (onrust, fronsen, kreunen) die kunnen wijzen op pijn kan moeilijk zijn. Artsen, verpleegkundigen en naasten kunnen in dergelijke situaties soms verschillen van mening of er sprake is van pijnklachten of niet. Onrust in het sterfbed kan wijzen op pijn, maar kan ook samenhangen met een terminaal delier, mogelijk mede uitgelokt door opioïden.
Op basis van deze conclusies en andere overwegingen kwam de werkgroep tot de volgende aanbevelingen:
- In de laatste dagen van het leven van patiënten met pijn bij kanker die opioïden gebruiken, moet worden overwogen of de dosering opioïden moet worden aangepast. Soms is dosisverhoging nodig, maar vaak kan de dosis worden verlaagd door afname van pijn of ten gevolge van verminderde klaring bij achteruitgang van de nierfunctie. Bij dosisverlaging neemt de kans op bijwerkingen (vooral delier) af.
- Het is zinvol bij patiënten met pijn bij kanker in de terminale fase aandacht te besteden aan begeleiding en ondersteuning van de naasten.
Conclusies / Summary of Findings
2008
Er zijn aanwijzingen dat pijn bij patiënten met kanker in de laatste één tot twee weken van het leven voorkomt bij 45% van de patiënten. Pijn komt minder frequent voor dan in de periode daarvoor (niveau 3).
(B: Teunissen 2007)
Er zijn aanwijzingen dat ondersteuning van de mantelzorg patiënten met pijn bij kanker in de terminale fase helpt om hun pijn beter te kunnen hanteren (niveau 3).
(B: Keefe 2005)
Over de opioïdbehoefte bij patiënten met kanker in de laatste twee levensweken zijn onderzoeken niet conclusief.
(Lichter 1990, Mercadante 2000)
2019
Op basis van het aanvullend literatuuronderzoek kunnen geen conclusies worden getrokken over behandeling van pijn bij patiënten met kanker in de stervensfase.
Samenvatting literatuur
Tot 2007
Er zijn 11 artikelen gevonden die handelen over patiënten met kanker in de terminale fase met pijn. Het betrof slechts drie reviewartikelen (Ingham, 1998; Yennurajalingam, 2005; Teunissen, 2007). Er was één vergelijkend onderzoek (Keefe 2005). De overige artikelen waren cohortonderzoeken (Georges, 2005; Grond, 1991; Higginson, 2002; Ingham, 1998; Lichter, 1990; Mercadante, 1999; Oi-Ling, 2005).
De literatuur is beoordeeld met betrekking tot de volgende onderwerpen:
- het vóórkomen van pijn bij patiënten met kanker in de terminale fase;
- opioïdbehoefte in de terminale fase;
- communicatie en ondersteuning van de mantelzorg in de terminale fase.
Vóórkomen van pijn bij patiënten met kanker in de terminale fase
In een systematische review over symptoomprevalentie bij patiënten met kanker in de palliatieve fase bleek dat pijn voorkomt bij 45% (95%-betrouwbaarheidsinterval 32 tot 59%) van de patiënten één tot twee weken voor het overlijden; dit percentage is significant lager dan in de periode daarvoor (71%; p <0,05) (Teunissen, 2007).
Opioïdgebruik bij patiënten met pijn bij kanker in de terminale fase
De meeste patiënten met pijn bij kanker in de terminale fase gebruiken opioïden. Voor opioïdgebruik worden percentages van 84 tot 91% gerapporteerd (Grond, 1991; Lichter, 1990; Mercadante, 1999).
In een cohortonderzoek bij 181 patiënten met kanker in de terminale fase die opioïden gebruikten, werd de benodigde opioïddosis beoordeeld. De dosering pijnstillende medicatie bleef gelijk in laatste twee levensweken, terwijl de pijn afnam. Patiënten ouder dan 74 jaar hadden de laatste twee weken minder opioïden nodig (Mercadante, 2000). Van de patiënten uit een cohortonderzoek bij 200 patiënten in de terminale fase had 51% de laatste 48 uur pijn. Eenennegentig procent van de patiënten gebruikte morfine.
Hiervan had 40% een hogere dosis morfine nodig, 12% een lagere dosis en 39% geen wijziging (Lichter 1990). In de laatste weken tot dagen van het leven kunnen klachten voorkomen als gevolg van bijwerkingen van morfine door een verminderde klaring en
stapeling van metabolieten bij achteruitgang van de nierfunctie (Mercadante, 2000; Lichter, 1990).
Communicatie en ondersteuning van de mantelzorg in de terminale fase
In een uitgebreid prospectief onderzoek bij patiënten met kanker komen in de laatste levensweek ernstige communicatieproblemen voor bij 40% (Higginson, 2002). Hoewel pijn geen directe uitkomst van het onderzoek is, is communicatie wel relevant omdat dit indirect gerelateerd is aan rapportage van pijn die adequate behandeling van pijn mogelijk maakt.
Een vergelijkend onderzoek bij 78 patiënten met pijn bij kanker in een vergevorderd stadium liet zien dat ondersteuning van partners van patiënten met kanker in de terminale fase (‘partner-guided pain management training’) de patiënten hielp om de pijn beter te hanteren (Keefe, 2005). De pijn werd als minder ervaren en de kwaliteit van leven werd door naasten en patiënten als beter beoordeeld.
2008-2017
Er zijn geen studies gevonden, waarbij systematisch is gekeken naar het effect van pijnbestrijding in de stervensfase.
Referenties
- AGS Panel on Persistent Pain in Older Patients. The management of persistent pain in older persons. J Am Geriatr Soc 2002;50:S205-24.
- Balducci L, Berghe C. The application of the principles of geriatrics to the management of the older person with cancer. Crit Rev Oncol Hematol 2000;35:147-54.
- Balducci L. Management of cancer pain in geriatric patients. J Supp Oncology 2003;1:175-91.
- Bernabei R, Gambassi G, Lapane K, et al. Management of pain in elderly patients with cancer. JAMA 1998;279:1877-82.
- CBO richtlijn Delirium 2005. http://www.cbo.nl/product/richtlijnen/folder20021023121843/delirium_rl_2005.pdf/view
- College ter Beoordeling van Geneesmiddelen CBG, 1-B teksten 2006.
- http://www.cbg-meb.nl/nl/prodinfo/index/htm
- Cleary JF, Carbone PP. Palliative medicine in the elderly. Cancer 1997;80:1335-47.
- Cleeland CS, Gonin R, Hatfield AK, et al. Pain and its treatment in outpatients with metastatic cancer. New Engl J Med1994;330:592-6.
- Dean M. Opioids in renal failure and dialysis patients. J Pain Symptom Manage 2004;28:497-504.
- Ellershaw JE, Kinder C, Aldridge J, Allison M, Smith JC. Care of the dying: is pain control compromised or enhanced by continuation of the fentanyl transdermal patch in the dying phase? J Pain Symptom Manage 2002; 24: 398e403.Georges JJ , Onwuteaka-Philipsen BD, Heide A van der, et al. Symptoms, treatment and dying peacefully in terminal ill cancer patients: a prospective study. Support Care Cancer 2005;13:160-8.
- Gibson SJ, Farrell M. A review of age differences in the neurophysiology of nociception and the perceptual experience of pain. Clin J Pain 2004;20:227-39.
- Given CW, Given B, Azzouz F, et al. Predictors of pain and fatigue in the year following diagnosis among elderly cancer patients. J Pain Symptom Manage 2001;21:456-66.
- Gloth FM, 3rd. Geriatric pain. Factors that limit pain relief and increase complications. Geriatrics 2000;55:46- 8,51-4.
- Gosney MA. Clinical assessment of elderly people with cancer. Lancet Oncol 2005;6:790-7.
- Graeff A de, Verhagen EH, Besse TC, et al. Richtlijn pijn. In: Graeff A de, Hesselmann GM, Krol RJA, et al (red). Palliatieve zorg: richtlijnen voor de praktijk. Utrecht: Vereniging van Integrale Kankercentra, 2006:565-621.
- Grond S, Zech D, Schug SA, et al. Validation of World Health Organization guidelines for cancer pain relief during the last days and hours of life. J Pain Symptom Manage 1991;6:411-22.
- Heiskanen T, Mätzke S, Haakana S, Gergov M, Vuori E, Kalso E. Transdermal fentanyl in cachectic cancer patients. Pain 2009; 144(1-2): 218-22Higginson I, Wade A, McCarthy M. Palliative care: views of patients and their families. BMJ 1990;301:277-81.
- Higginson I, Wade A, McCarthy M. Palliative care: views of patients and their families. BMJ 1990;301:277-81.
- Hillen HFP, Schouten HC. Kanker bij ouderen. Breda: Amgen BV, 2004.
- Ingham JM, Foley KM. Pain and the barriers to its relief at the end of life: a lesson for improving end of life health care. Hosp J 1998;13:89-100.
- Ingram SS, Seo PH, Martell RE, et al. Comprehensive assessment of the elderly cancer patient: the feasibility of self-report methodology. J Clin Oncol 2002;20:770-5.
- Jansen K, Haugen DF, Pont L, Ruths S. Safety and effectiveness of palliative drug treatment in the last days of life - a systematic literature review. J Pain Symptom Manage 2017 Aug 9. pii: S0885-3924(17)30381-0.
- Janssen DJ, Spruit MA, Wouters EF et al. Daily symptom burden in end-stage chronic organ failure: a systematic review. Palliative Medicine 2008; 22: 938-948.
- Jakobsson M, Strang P. Fentanyl patches for the treatment of pain in dying cancer patients. Anticancer Res. 1999;19(5C):4441-2Keefe FJ, Ahles TA, Sutton L, et al. Partner-guided cancer pain management at the end of life: a preliminary study. J Pain Symptom Manage 2005;29:263-72.
- Landi F, Onder G, Cesari M, et al. Pain management in frail, community-living elderly patients. Arch Intern Med 2001;161:2721-4.
- Launay-Vacher V, Karie S, Fau JB, et al. Treatment of pain in patients with renal insufficiency: the World Health Organization three-step ladder adapted. J Pain 2005;6:137-48.
- Lichter I, Hunt E. The last 48 hours of life. J Palliat Care 1990;6:7-15.
- McDonald M. Assessment and management of cancer pain in the cognitively impaired elderly. Geriatr Nurs 1999:20:249-54.
- Mercadante S, Casuccio A, Pumo S, et al. Factors influencing the opioid response in advanced cancer patients with pain followed at home: the effects of age and gender. Support Care Cancer 2000;8(2)123-30.
- Mercandante S. Pain treatment and outcomes for patients with advanced cancer who receive follow-up care at home. Cancer 1999;85:1849-58.
- Oi-Ling K, Man-Wah DTSE, Kam-hung DNG. Symptom distress as rated by advanced cancer patients, caregivers and physicians in the last week of life. Palliat Med 2005;19:228-33.
- Olmi P, Ausili Cefaro G, et al. Radiotherapy in the aged. Clin Geriatr Med 1997;13:143-68.
- Patel P, Henry LL, Ganti AK, et al. Clinical course of lung cancer in patients with chronic kidney disease. Lung Cancer 2004;43:297-300.
- Pautex S, Berger A, Chatelain C, et al. Symptom assessment in elderly cancer patients receiving palliative care. Crit Rev Oncol Hematol 2003;47:281-6.
- Rao AV, Cohen HJ. Symptom management in the elderly cancer patient: fatigue, pain and depression. J Nat Cancer Institute Monogr 2004;32:150-7.
- Scherder EJA, Oosterman JM, Ooms ME, et al. Chronische pijn bij dementie en bij aandoeningen met een verhoogd risico op cognitieve achteruitgang Tijdschr Gerontol Geriatr 2005;36:116-21.
- Spreeuwenberg C, Bakker DJ, Dillmann RJM. Handboek palliatieve zorg. Maarssen: Elsevier Gezondheidszorg, 2002.
- Suno M, Endo Y, Nishie H, Kajizono M, Sendo T, Matsuoka J. Refractory cachexia is associated with increased plasma concentrations of fentanyl in cancer patients.Ther Clin Risk Manag 2015;11:751-7.
- Sutton LM, Denmark-Wahnefried W, Clipp EC. Management of terminal cancer in elderly patients. Lancet Oncol 2003;4:149-57.
- Teunissen SCCM, Wesker W, Kruitwagen C, et al. Symptom prevalence in patients with incurable cancer. J Pain Symptom Manage 2007 (in press).
- Vamvakas S, Bahner U, Heidland A. Cancer in end-stage renal disease: potential factors involved. Am J Nephrol 1998;18:89-95.
- Wasil T, Lichtman SM, Gupta V, et al. Radiation therapy in cancer patients 80 years of age and older. Am J Clin Oncol 2000;23:526-30.
- Wedding U, Höffken K. Care of breast cancer in the elderly woman-what does comprehensive geriatric assessment (CGA) help? Support Care Cancer 2003;11:769-74.
- Winell J, Roth AJ. Psychiatric assessment and symptom management in elderly cancer patients. Oncology 2005;19:1479-90.
- Yates PM, Edwards HE, Nash RE, et al. Barriers to effective cancer pain management: a survey of hospitalized cancer patients in Australia. J Pain Symptom Manage 2002;23:393-405.
- Yennurajalingam S, Braiteh F, Bruera E. Pain and terminal delirium research in the elderly. Clin Geriatr Med 2005;21:93-119.
- Van Zuylen, van Veluw H, van Es J. Richtlijn Zorg in de stervensfase, 2010. www.pallialine.nl
- Zwakhalen SM, Hamers JP, Berger MP. The psychometric quality and clinical usefulness of three pain assessment tools for elderly patients with dementia. Pain 2006;126:210-20.
- Zylicz Z, Teunissen SCCM, Graeff A de. Inleiding. In: Graeff A de, Hesselmann GM, Krol RJA, et al (red). Palliatieve zorg. Richtlijnen voor de praktijk. Utrecht: Vereniging van Integrale Kankercentra, 2006:13-32.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-11-2023
Actualisatie
Deze richtlijn is goedgekeurd op 6 december 2019. De Nederlandse Vereniging voor Anesthesiologie (NVA) bewaakt samen met betrokken verenigingen de houdbaarheid van deze (modules van de) richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. De geldigheidstermijn van de richtlijn is maximaal 5 jaar na vaststelling. Indien de richtlijn dan nog actueel wordt bevonden, wordt de geldigheidsduur van de richtlijn verlengd.
Houderschap richtlijn
De houder van de richtlijn (NVA) moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen.
IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
Een richtlijn is een kwaliteitsstandaard. Een kwaliteitsstandaard beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een kwaliteitsstandaard in het Register van Zorginstituut Nederland betekent dus niet noodzakelijkerwijs dat de in de kwaliteitsstandaard beschreven zorg verzekerde zorg is.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Algemene gegevens
Autoriserende/instemmende en bij de werkgroep betrokken verenigingen:
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Anesthesiologie
- Nederlandse Vereniging voor Klinische Geriatrie
- Nederlandse Vereniging voor Neurologie
- Vereniging voor Specialisten Ouderengeneeskunde
- Verpleegkundigen en Verzorgenden Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse vereniging voor professionele palliatieve zorg
Financiering
Deze richtlijn c.q. module is gefinancierd door IKNL. De inhoud van de richtlijn c.q. module is niet beïnvloed door de financierende instantie.
Procesbegeleiding
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence-based richtlijnen voor de oncologische en palliatieve zorg tot een van haar primaire taken. IKNL werkt hierbij conform de daarvoor geldende (inter)nationale kwaliteitscriteria. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen.
Doel en doelgroep
Doel
Een richtlijn geeft aanbevelingen ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek en consensus. De richtlijn 'Pijn’ geeft aanbevelingen over begeleiding en behandeling van patiënten met pijn bij kanker (zowel in de curatieve als de palliatieve fase) en beoogt hiermee de kwaliteit van de zorgverlening te verbeteren.
Hoewel de evidentie alleen is verzameld voor de diagnostiek en behandeling van pijn bij patiënten met kanker zijn de aanbevelingen ook grotendeels van toepassing voor patiënten met andere levensbedreigende aandoeningen.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de zorg voor patiënten met pijn zoals huisartsen, specialisten ouderengeneeskunde, medisch specialisten, apothekers, verpleegkundigen, verzorgenden, verpleegkundig specialisten, physician assistants, fysiotherapeuten, medisch maatschappelijk werkers, geestelijk verzorgers, GZ- en klinisch psychologen.
Indien in de richtlijn wordt gesproken over zorgverleners rondom de patiënt met pijn, worden, afhankelijk van de specifieke situatie van de patiënt, alle bovengenoemde professionals bedoeld.
De richtlijn is ook relevant voor zorgverleners van andere disciplines en vrijwilligers die werkzaam zijn in de palliatieve fase. De multidimensionele benadering van de patiënt in de palliatieve fase vergt immers een gezamenlijke, interdisciplinaire verantwoordelijkheid, zoals ook in het Kwaliteitskader palliatieve zorg Nederland is beschreven.
Samenstelling werkgroep
Alle werkgroepleden en klankbordleden zijn afgevaardigd namens wetenschappelijke, beroeps- en patiëntenverenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
Het patiëntenperspectief is vertegenwoordigd door Patiëntenfederatie Nederland.
Bij de uitvoering van het evidence-based literatuuronderzoek is de kaderopleiding Palliatieve Zorg en een literatuuronderzoeker van IKNL en de voorzitter van de richtlijnwerkgroep betrokken geweest.
Werkgroepleden
- Mw. prof. dr. M.H.J. van den Beuken-van Everdingen, internist, NIV
- Dhr. dr. M.J.M.M. Giezeman †, anesthesioloog, NVA
- Dhr. dr. A. de Graeff (voorzitter), internist-oncoloog en hospice-arts, Palliactief
- Mw. drs. H. Klaren, klinisch geriater, NVKG
- Mw. B. Kramp, verpleegkundig specialist, V&VN
- Dhr. drs. M. Martens, specialist ouderengeneeskunde en consulent palliatieve zorg, Verenso
- Mw. drs. M.J. Oortman, huisarts, SCEN-arts, palliatief consulent en hospice-arts, NHG
- Dhr. drs. P. Oosterhof, poliklinisch apotheker, NVZA
- Mw. prof.dr. A.K.L. Reyners, internist, NIV
- Mw. M. Schielke, verpleegkundig pijnspecialist, V&VN
- Mw. drs. M.C. Sieders, huisarts (waarnemend), SCEN-arts, palliatief consulent, NHG
- Dhr. dr. M.F.M. Wagemans, anesthesioloog, NVA
Klankbordleden
- Dhr. prof. dr. K.C.P. Vissers, anesthesioloog, NVA
- Mw. drs. L. Bellersen, cardioloog, NVVC
- Mw. drs. B.A. Brouwer, neuroloog/pijnspecialist NVN/pijnspecialist
- Mw. M. Geerts, verpleegkundig specialist, V&VN
- Dhr. drs. S.M. de Hosson, longarts, NVALT
- Mw. drs. S. Visser, apotheker, KNMP
- Mw. drs. R. Lammers, beleidsmedewerker, Patiëntenfederatie Nederland
Ondersteuning
- Mw. T.T.M. Bluemink-Holkenborg, secretaresse, IKNL
- Mw. drs. M.G. Gilsing, adviseur (richtlijnen) palliatieve zorg, IKNL
- Mw. dr. O.L. van der Hel, literatuuronderzoeker, IKNL
- Prof.dr. J Kleijnen, epidemioloog, literatuuronderzoeker MUMC Maastricht/York
- Mw. L.K. Liu, secretaresse, IKNL
- Dhr. dr. R. Vernooij (i.s.m. de kaderopleiding Palliatieve Zorg), literatuuronderzoeker, IKNL
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke en beroepsverenigingen.
Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld. De bevindingen zijn schriftelijk vastgelegd in de belangenverklaring en opvraagbaar via info@iknl.nl.
Inbreng patiëntenperspectief
De input van patiëntvertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt. Patiëntenfederatie Nederland is in het gehele richtlijntraject meegenomen en heeft plaats gehad in de klankbordgroep (zie ook de Samenstelling van de werkgroep).
Tijdens de landelijke consultatiefase heeft Patiëntenfederatie Nederland commentaar gegeven op de conceptrichtlijn en patiënten/naasten geraadpleegd via een referentenpanel voor onderzoeksaanvragen op het gebied van palliatieve zorg. Ook heeft de Patiëntenfederatie Nederland - naast NFK, nog andere patiëntenorganisaties benaderd voor het leveren van commentaar.
Patiëntenfederatie Nederland heeft tot slot de richtlijn goedgekeurd.
Patiënteninformatie gebaseerd op de richtlijn is opgesteld en gepubliceerd op de daarvoor relevante sites (o.a. zie link https://www.kanker.nl/gevolgen-van-kanker/pijn/wat-is/pijn-bij-kanker#show-menu).
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de zorgpraktijk, inclusief borging daarvan.
Als onderdeel van elke richtlijn stelt IKNL samen met de richtlijnwerkgroep een implementatieplan op en ondersteunt een aantal basis-activiteiten voor de implementatie. De verantwoordelijkheid voor verdere implementatie-activiteiten ligt bij de eigenaar van de richtlijn (en het veld).
Activiteiten en interventies voor verspreiding en implementatie kunnen zowel op landelijk als regionaal niveau plaatsvinden. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor en door de verschillende disciplines.
Werkwijze
In de huidige richtlijn zijn de NVA-richtlijn van 2015 en de richtlijn 'Pijn' van Pallialine samengevoegd. Daarbij zijn de onderdelen van de NVA-richtlijn, die in 2015 niet zijn herzien (en waarbij de teksten van de NVA-versie van 2008 onveranderd zijn gehandhaafd) grotendeels evidence-based (op basis van aanvullend literatuuronderzoek) aangepast en aangevuld met evidence-based en consensus-based teksten over de diagnostiek en behandeling van pijn bij patiënten met gevorderde stadia van COPD of hartfalen. De onderdelen van de NVA-richtlijn die in 2015 zijn herzien zijn onveranderd overgenomen (zie ook de Algemene inleiding).
De bedoeling is om te komen tot een integrale en actuele richtlijn over de diagnostiek en behandeling van pijn bij zowel patiënten met kanker (in de curatieve én de palliatieve fase) als bij patiënten met COPD of hartfalen.
Voor de evidence-based (herzieningen van) modules zijn de aanbevelingen voorzien van een gradering met cijfers en letters om de verhouding tussen de sterkte van de aanbeveling en de kwaliteit van de evidence weer te geven (zie onderstaande tabel). Deze werkwijze is gebaseerd op de methodiek zoals voorgesteld door de GRADE working group (zie http://www.gradeworkinggroup.org).
|
Gradering van aanbevelingen |
|
|
Sterkte van de aanbeveling |
Cijfer |
|
Sterke aanbeveling |
1 |
|
Zwakke aanbeveling |
2 |
|
Kwaliteit van de evidence |
Letter |
|
Hoog |
A |
|
Matig |
B |
|
Laag |
C |
|
Zeer laag |
D |
De richtlijnteksten die gebaseerd zijn op uitgangsvragen, zijn opgebouwd volgens het volgende vaste stramien: uitgangsvraag en aanbevelingen, literatuur, conclusies, overwegingen en referenties. De evidence tabellen staan bij de desbetreffende modules. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
De uitgangsvragen zijn óf evidence-based (via de GRADE methodiek) óf consensus-based (zonder systematisch literatuuronderzoek) uitgewerkt.
De GRADE-methodiek
Selectie
Naast de selectie van studies op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- Gerandomiseerde gecontroleerde studies (RCT's)
- Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
- De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
- De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen’
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.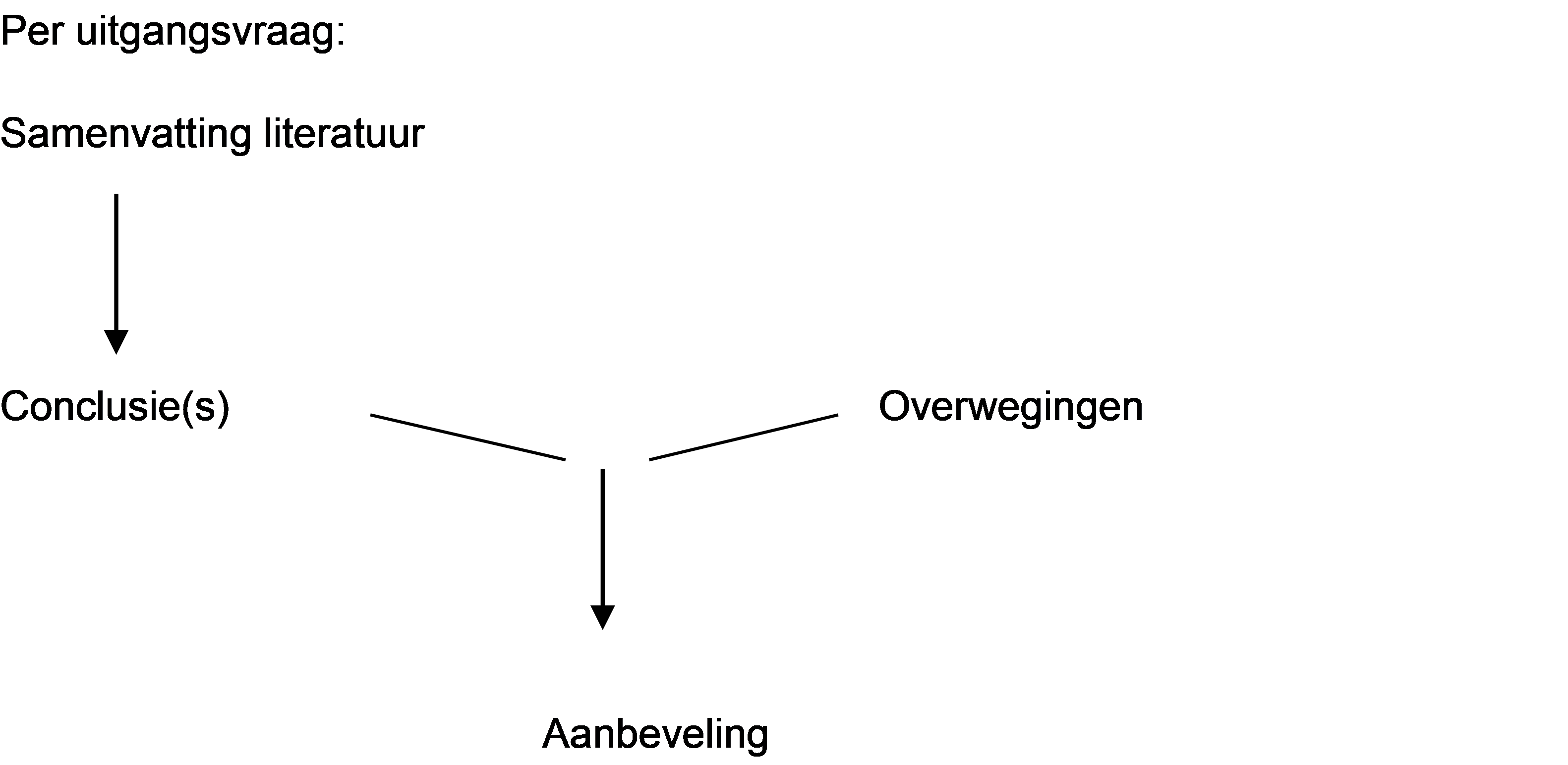
Figuur 1. Van bewijs naar aanbeveling
Bij het schrijven van de overwegingen zijn onderstaande zaken in acht genomen.
- Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
Toelichting:
- Kennis en ervaring met technieken/therapieën.
- Risico’s die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient’ plaats te vinden (sterk) of wel ‘kan worden overwogen’ (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
- Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling. - Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Maatschappelijk perspectief
(Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties)
Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
- Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin – voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Doe/geef etc. (of er dient…. te worden gegeven/gedaan)
- Zwakke/conditionele aanbevelingen: Overweeg….. te geven/te doen.
Consensus-based methodiek
Naast de evidence-based uitwerking (GRADE) zijn er ook uitgangsvragen via de consensus-based methodiek uitgewerkt. Hierbij zijn de richtlijnteksten ook gebaseerd op evidence, maar is er geen systematisch literatuuronderzoek gedaan en zijn de gevonden studies niet methodologisch beoordeeld.
