Massage bij pijn bij kanker
Uitgangsvraag
Wat is het effect van massage op pijn bij patiënten met kanker?
Aanbeveling
Pas klassieke massage (al dan niet met etherische oliën) of hand- of voetmassage alleen toe voor een kortdurend effect (direct na de interventie) op pijn bij patiënten met kanker (2D).
Overwegingen
De resultaten van de meta-analyses (Boyd 2016, Chen 2016, Fellowes 2004 (besproken in de NVA-richtlijn van 2008), Lee 2015) en van recente gerandomiseerde studies (Jane 2011, Kutner 2008, Toth 2013) spreken elkaar deels tegen en zijn moeilijk te interpreteren.
T.a.v. de (uitkomsten van) de meta-analyses zijn er grote verschillen t.a.v.:
- de opgenomen studies: studies die in de ene meta-analyse expliciet zijn geëxcludeerd zijn in andere meta-analyses wel opgenomen;
- soort massage: massage met of zonder etherische oliën, hand- of voetmassage, reflexologie;
- de interventies: deze worden in zowel de experimentele groep als in de controlegroep voor dezelfde studies in de meta-analyses verschillend benoemd en ingedeeld;
- de SMDs: deze worden voor dezelfde studies verschillend weergegeven in de verschillende meta-analyses.
De meta-analyse van Lee (2015) spreekt van een ‘beneficial effect’ van massage op pijn, de meta-analyse van Boyd (2016) geeft een zwakke aanbeveling (gebaseerd op een niet-significante trend in de meta-analyses voor een effect van massage op de pijn) en de meta-analyse van Chen (2016) concludeert dat massage met etherische oliën niet effectief is.
In de onderstaande tabel zijn de studies samengevat, die in ten minste een van de meta-analyses zijn opgenomen en waarbij er sprake is van gerandomiseerde studies, waarbij klassieke massage (met of zonder etherische oliën) of hand- of voetmassage is vergeleken met een behandeling zonder massage of met een onbehandelde controle-arm, met pijn als primair of secundair eindpunt.
Tabel 1. Gerandomiseerde studies, waarbij klassieke massage, aromatherapie of hand- of voetmassage is vergeleken met een behandeling zonder massage of onbehandelde controle-arm, met pijn als primair of secundair eindpunt.
|
Studie |
Jaar |
Patiënten |
N (eva- luabel) |
Vergelijking |
Pijn pri- maire uit- komstmaat |
Uitkomst |
|
Ahles2 |
1999 |
Kanker, autologe SCT |
34 |
Zweedse massage vs standard treatment (max. 9x in 3 wk) |
- |
NS halverwege de studieperiode en voor ontslag |
|
Grealish1 |
2000 |
Kanker |
87 |
Voetmassage vs geen voet-massage (crossover) (2x in 3 dg) |
+ (samen met misselijkheid) |
Significante verbetering van pijn na massage |
|
Jane2,3 |
2011 |
Botmetas-tases |
72 |
Massage vs social attention (4x in 5 dg) |
+ (samen met stemming, spierontspan-ning en slaap) |
Op alle dagen: significant sterkere afname van pijn na 20 minuten in massagegroep |
|
Kutner2 |
2008 |
Gemetas-taseerde kanker |
348 |
Massage vs simple touch (6x in 2 wk) |
+ |
Gemiddeld verschil pijnscore direct na massage -0,90 (p<0,001), enkele dagen later NS |
|
Kiewkhern2 |
2013 |
Colo-rectale kanker |
66 |
Ligt Thai massage vs standard supportive care (3x in 1 wk) |
- |
Pijnscore na 1 week 1,2 vs 2,4 (p=0,001) |
|
Listing2 |
2009 |
Breast cancer |
86 |
Massage vs no treatment (2x/wk ged 5 wk) |
- |
Significant verschil in pijnscore op 5 en 11 weken |
|
Post-White2,3 |
2003 |
Kanker, behandeld met chemo-therapie |
230 |
Massage vs healing touch vs caring presence (4 wk) met crossover van/ naar standard care (4 wk) |
- |
Significante daling van de pijnscore direct na interventie Geen significante verschillen in pijnscore tussen interventies Pijnscores na massage en healing touch significant lager dan bij standard care |
|
Rosen2 |
2013 |
Kanker Plaatsing VIT |
60 |
Massage vs structured attention, voor en na ingreep |
+ (samen met angst) |
Pijn niet vermeld in abstract; volgens meta-analyse Boyd signficicante afname na massage |
|
Soden2,3 |
2013 |
Kanker |
42 |
Aromatherapie vs massage vs usual care (1x/wk in 4 wk) |
+ |
Pijnscores na 4 weken: NS t.o.v. baseline Pijnscores direct na massage alleen significant afgenomen in week 2 |
|
Toth2,3 |
2013 |
Gemetas-taseerde kanker |
39 |
Massage vs no touch vs usual care (3x in 1 wk) |
+ (naast angst en alertheid) |
Pijn na 1 wk en 1 mnd: NS |
|
Weinrich1,2,3,4 |
1990 |
Kanker |
28 |
Zweedse massage vs attention (eenmalig) |
+ |
Mannen: significante afname pijn direct na massage. Vrouwen: geen significante afname direct na massage Geen verschillen 1 en 2 uur na massage |
|
Wilkie2,3,4 |
2000 |
Kanker |
28 |
Massage vs usual care (2x/wk in 2 wk) |
+ |
Significante afname pijn na 1e en 3e massage, niet na 2e en 4e massage |
|
Wilkinson4 |
2007 |
Kanker |
221 |
Aromatherapie vs usual care (1x/wk ged 3 wk) |
- |
Pijn na 6 wk en na 10 wk: NS |
Aromatherapie=Massage met etherische oliën
Kanker=Patiënten met diverse soorten kanker
NS=Geen significant verschil tussen experimentele en controlegroep
SCT=Stamceltransplantatie
VIT=Volledig Implanteerbaar toedieningssysteem
1 Opgenomen in Fellowes (2004)
2 Opgenomen in Boyd (2016)
3 Opgenomen in Lee (2015)
4 Opgenomen in Chen (2016)
Geen van de studies was geblindeerd. T.a.v. deze studies zijn er grote verschillen in kwaliteit, aantal geïncludeerde patiënten, soort massage (massage met of zonder etherische oliën, hand- of voetmassage), de interventie in de controle-arm, de duur van de interventie en het moment van de evaluatie.
In de meta-analyse van Boyd (2016) werd de kwaliteit van de studie van Jane (2011) als hoog beoordeeld, die van Collinge (2013), Khiewkhrn (2013), Listing (2009), Post-White (2003), Rosen (2013), Soden (2013), Toth (2013) en Weinrich (1990) als acceptabel en die van Ahles (1999), Kutner (2008) en Wilkie (2000) als laag.
Hoewel het niet voor alle studies geldt, lijkt de trend te zijn dat er een kortdurend effect is van klassieke massage of hand- of voetmassage op pijn direct na de interventie. Het effect op de lange termijn is inconsistent. De werkgroep is derhalve van mening dat massage (klassieke massage of voet- of handmassage) alleen moet worden toegepast als (uitsluitend) een direct en kortdurend effect gewenst en zinvol wordt geacht. De aanbeveling van de richtlijn van 2008 wordt derhalve genuanceerd.Over het type massage kan geen uitspraak worden gedaan.
Onderbouwing
Achtergrond
Massage kent een aantal vormen die bij pijn toepasbaar zijn. Massage kan al dan niet in combinatie met etherische oliën worden toegepast (aromatherapie). De vorm van massage, die bij pijn zeer vaak wordt toegepast, is klassieke massage. Klassieke massage wordt toegepast in het pijnlijke gebied. De meest effectieve handgrepen zijn strijkingen en druk op pijnlijke plaatsen totdat vermindering van pijn optreedt. Klassieke massage induceert een verminderde transmissie van pijnsignalen en heeft een lokaal effect ten gevolge van relaxatie en verbeterde doorbloeding.
Massage wordt meestal toegepast door een fysiotherapeut, maar soms ook door verpleegkundigen of naasten. Het kan worden gecombineerd met de dagelijkse verzorging.
Bij hand- of voetmassage wordt alleen de hand of de voet gemasseerd. Het doel ervan is niet om lokale pijnklachten te behandelen maar om algemene ontspanning te bereiken.
Massage i.v.m. lymfoedeem blijft hier buiten beschouwing.
Reflexologie is een uit China afkomstige geneeswijze die ervan uitgaat dat alle organen en lichaamsdelen in verbinding staan met de zgn. reflexzones (vooral op de voeten). Door massage van de reflexzones zou vermindering van pijn in de corresponderende delen van het lichaam optreden. Reflexologie blijft in deze richtlijn buiten beschouwing.
Deze module is een evidence-based update van de module van de NVA-richtlijn van 2008.
In 2008 kwam de werkgroep tot de volgende aanbeveling:
- Toepassing van klassieke massage kan worden overwogen om pijn bij patiënten met kanker te behandelen
Conclusies / Summary of Findings
Er is conflicterend bewijs van matige tot zeer lage kwaliteit over het effect van massage vergeleken met géén massage op pijn bij patiënten met kanker.
(Boyd 2016, Chen 2016, Jane 2011, Kutner 2008, Lee 2015, Toth 2013)
Samenvatting literatuur
Beschrijving van de studies
Bij het literatuuronderzoek voor de richtlijn van 2019 zijn alle studies meegenomen die in in de richtlijn van 2008 zijn besproken. Daarom wordt de tekst van het literatuuronderzoek van de richtlijn van 2008 hier achterwege gelaten.
Er zijn drie recente gerandomiseerde studies gevonden die het effect evalueerden van massage op pijn bij patiënten met pijn en kanker. In de studie van Jane (2011) wordt bij 72 patiënten massage vergeleken met social attention. In de studie van Kutner (2008) wordt bij 380 patiënten massage vergeleken met simple touch sessions. In de studie van Toth (2013) wordt bij 42 patiënten massage vergeleken met no touch en usual care.
Daarnaast zijn er drie systematische reviews met gerandomiseerde studies gevonden. De review van Boyd (2016) heeft 12 gerandomiseerde studies geïncludeerd in de vergelijking massage versus geen massage. De review van Chen (2016) heeft 7 gerandomiseerde studies geïncludeerd in de vergelijking van massage met etherische oliën versus geen massage. De review van Lee (2015) heeft 12 gerandomiseerde studies geïncludeerd (waarvan vier het effect van reflexologie onderzochten) in de vergelijking van massage versus geen massage.
Kwaliteit van bewijs
Alle studies hebben een hoog risico op bias, omdat er bij geen enkele studie een adequate blindering op de patiënt en de zorgverlener is toegepast. Dit is een risico op bias omdat alle uitkomstmaten subjectief van aard zijn.
De systematische review van Boyd (2016) is van hoge methodologische kwaliteit. De twee andere systematische reviews hebben een onduidelijk risico op bias, omdat bepaalde methodologische aspecten zoals een protocol, dubbele screening en data-extractie, zoekstrategie, het zoeken van “grijze literatuur”, data synthese van de geïncludeerde artikelen en de conflicts of interests niet duidelijk worden beschreven in de artikelen.
Massage versus géén massage
Alle geïncludeerde gerandomiseerde studies rapporteren de uitkomstmaat pijn op een heterogene manier of zonder mate van variabiliteit (bijv. m.b.v. een standaarddeviatie) waardoor een meta-analyse van de verschillende studies niet mogelijk is.
In de studie van Jane (2013) wordt het verschil in pijn direct na de interventies (massages of social interventions op dag 2, 3 en 4) voor beide groepen beschreven:
- dag 2: Interventie: -2,2 (SD: 2,5) en controle: -0,2 (SD: 2,0). Het verschil tussen de groepen is significant (p<0,01).
- dag 3: Interventie: -1,6 (SD: 2,1) en controle: -0,2 (SD: 1,9), p<0,01.
- dag 4: Interventie: -1,6 (SD: 2,5) en controle: -0,2 (SD: 2,1), p<0,01.
In de studie van Kutner (2008) is het verschil in pijn direct voor en direct na de interventie statistisch significant beter in de interventie-groep (gemiddeld verschil: -0,90, 95%-CI: -1,19 tot -0,61). Het verschil in pijnscore tussen beide groepen enkele uren na de interventie is niet significant.
In de studie van Toth (2013) wordt pijn gerapporteerd als het verschil in VAS tussen baseline en follow-up na 1 week en 1 maand met behulp van een VAS. Dit is niet statistisch significant verschillend tussen beide groepen (p=0,65 resp. p=0,14).
In de systematische review van Boyd (2016) werd in de drie gerandomiseerde studies (Listing 2009, Soden 2004 en Toth 2013), waar massage werd vergeleken met geen behandeling, geen verschil in pijn gevonden tussen de interventie- en de controlegroep (SMD (Standardized Mean Difference):
-0,203, 95%-CI: -0,992 tot 0,585, p=0,613). In de zes studies (Ahles 1996, Collinge 2013, Jane 2011, Post-White 2003, Weinrich 1990, Wilkie 2000), waarin massage werd vergeleken met attention, usual care of caring presence, werd geen verschil in pijnscore gevonden (SMD -0,545, 95%-CI: 1,231 tot 0,140, p=0,119) gevonden. Van de 16 opgenomen studies in de review van Boyd werd de kwaliteit beoordeeld als resp. hoog (1x), acceptabel (11x) en laag (4x).
In de systematische review van Chen (2016) waarin drie gerandomiseerde studies van massage met etherische oliën versus geen massage zijn geïncludeerd (Weinrich 1990, Wilkie 2000, Wilkinson 2007), is geen significant verschil in pijn (SMD: 0,01, 95%-CI: -0,23 tot 0,24) gevonden tussen de interventie- en controlegroep.
In de systematische review van Lee (2015) waarin negen gerandomiseerde (waaronder Jane 2011, Post-White 2003, Soden 2004, Toth 2013, Weinrich 1990, Wilkie 2000 en 3 studies m.b.t. reflexologie) en drie controlled clinical trials bij in totaal 559 patiënten zijn geïncludeerd, is een significant lagere pijnscore gevonden in de interventiegroep vergeleken met de controlegroep
(SMD: -1,25, 95%-CI: -1,63 tot -0,87). Indien de analyse beperkt werd tot het effect van massage zonder etherische oliën (7 studies, N=375 patiënten, waaronder Jane 2011, Post-White 2003, Soden 2004, Toth 2013, Weinrich 1990, Wilkie 2000) bedroeg de SMD -1,11 (95%-CI: -1,50 tot −0,71);
p<0,00001).
Referenties
- Ahles TA, Tope DM, Pinkson B, et al. Massage therapy for patients undergoing autologous bone marrow transplantation. J Pain Symptom Manage 1999; 18(3): 15763.
- Boyd C, Crawford C, Paat CF, et al. The Impact of Massage Therapy on Function in Pain Populations-A Systematic Review and Meta-Analysis of Randomized Controlled Trials: Part II, Cancer Pain Populations. Pain Med 2016; 17: 1553-1568.
- Chen TH, Tung TH, Chen PS, et al. The Clinical Effects of Aromatherapy Massage on Reducing Pain for the Cancer Patients: Meta-Analysis of Randomized Controlled Trials. Evid Based Complement Alternat Med 2016; 2016:9147974. 10,1155/2016/9147974.
- Collinge W, Kahn J, Walton T, et al. Touch, caring, and cancer: Randomized controlled trial of a multimedia caregiver education program. Support Care Cancer 2013; 21(5): 140514.
- Fellowes D, Barnes K, Wilkinson S. Aromatherapy and massage for symptom relief in patients with cancer. Cochrane Database Syst Rev 2004; (2): CD002287.
- Jane SW, Chen SL, Wilkie DJ, et al. Effects of massage on pain, mood status, relaxation, and sleep in Taiwanese patiënts with metastatic bone pain: a randomized clinical trial. Pain 2011; 152: 2432-42.
- Khiewkhern S, Promthet S, Sukprasert A, Eunhpinitpong W, Bradshaw P. Effectiveness of aromatherapy with light thai massage for cellular immunity improvement in colorectal cancer patiënts receiving chemotherapy. Asian Pac J Cancer Prev 2013; 14(6): 39037.
- Kutner JS, Smith MC, Corbin L, et al. Massage therapy versus simple touch to improve pain and mood in patiënts with advanced cancer: a randomized trial. Annals Int Med 2008; 149: 369-79.
- Lee SH, Kim JY, Yeo S, et al. Meta-Analysis of Massage Therapy on Cancer Pain. Integr Cancer Ther 2015; 14: 297-304.
- Listing M, Reisshauer A, Krohn M, et al. Massage therapy reduces physical discomfort and improves mood disturbances in women with breast cancer. Psychooncology 2009; 18(12): 12909.
- Post-White J, Kinney ME, Savik K, et al. Therapeutic massage and healing touch improve symptoms in cancer. Integr Cancer Ther 2003; 2: 332-44.
- Rosen J, Lawrence R, Bouchard M, et al. Massage for perioperative pain and anxiety in placement of vascular access devices. Adv Mind Body Med 2013; 27(1): 1223.
- Smith MC, Kemp J, Hemphill L, et al. Outcomes of therapeutic massage for hospitalized cancer patiënts. J Nurs Scholarsh 2002; 34: 257-62.
- Soden K, Vincent K, Craske S, et al. A randomized controlled trial of aromatherapy massage in a hospice setting. Palliat Med 2004; 18: 87-92.
- Taylor AG, Galper DI, Taylor P, et al. Effects of adjunctive Swedish massage and vibration therapy on short-term postoperative outcomes: a randomized, controlled trial. J Altern Complement Med 2003; 9: 77-89.
- Toth M, Marcantonio ER, Davis RB, et al. Massage therapy for patiënts with metastatic cancer: a pilot randomized controlled trial. J Altern Complement Med 2013; 19: 650-656.
- Weinrich SP, Weinrich MC. The effect of massage on pain in cancer patiënts. Appl Nurs Res 1990; 3(4): 1405.
- Wilkie DJ, Kampbell J, Cutshall S, et al. Effects of massage on pain intensity, analgesics and quality of life in patiënts with cancer pain: A pilot study of a randomized clinical trial conducted within hospice care delivery. Hosp J 2000; 15(3):3153.
- Wilkinson SM, Love SB, Westcombe AM, et al. Effectiveness of aromatherapy massage in the management of anxiety and depression in patients with cancer: a multicenter randomized controlled trial. J Clin Oncol. 2007; 25(5): 532-539
Evidence tabellen
Patiëntengroep: Patiënten met pijn en kanker
Intervention: Massage
Comparison: Geen massage
Outcome: Pijn en kwaliteit van leven
Primary studies
|
I Study ID |
II Method |
III Patient characteristics |
IV Intervention(s) |
V Results
|
VII Critical appraisal of study quality |
GRADE assessment |
|
|
|
versus
|
Pain (reported as score on present pain intensity-VAS at the fourth day.
Quality of life
|
|
|
|
|
|
versus
|
Pain (reported as mean change from baseline with the MPCA questionnaire).
Quality of life (reported as mean change from baseline with the overall quality of life MQOL instrument).
|
|
|
|
|
|
versus
|
Pain (reported as mean change from baseline with a VAS score)
Quality of life Not reported |
|
|
|
|
|
versus
|
Pain (reported as mean change from baseline with a VAS score)
Quality of life Not reported |
|
|
|
|
|
versus
|
Pain (reported as median change from baseline with a VAS score)
Quality of life (reported as median change from baseline with a McGill total score)
|
|
|
|
|
|
versus
|
Pain (reported as mean score on VAS scale)
Quality of life (reported as mean FACT-B total score)
|
|
|
* self-calculated
Systematic reviews
|
I Study ID |
II Method |
III Patient characteristics |
IV Intervention(s) |
V Results
|
VII Critical appraisal of study quality |
GRADE assessment |
|
|
|
versus
|
Pain (reported as pain intensity / severity)
Quality of life
|
|
|
|
|
|
versus
|
Pain (reported as pain reduction)
Quality of life
|
|
|
|
|
|
versus
|
Pain (reported as VAS score) (8 studies included)
Quality of life
|
|
|
Referenties
[1-9]
[1] Jane SW, Chen SL, Wilkie DJ, et al. Effects of massage on pain, mood status, relaxation, and sleep in Taiwanese patients with metastatic bone pain: a randomized clinical trial. Pain. 2011; 152: 2432-42. 10.1016/j.pain.2011.06.021.
[2] Kutner JS, Smith MC, Corbin L, et al. Massage therapy versus simple touch to improve pain and mood in patients with advanced cancer: a randomized trial. Annals of internal medicine. 2008; 149: 369-79.
[3] Soden K, Vincent K, Craske S, et al. A randomized controlled trial of aromatherapy massage in a hospice setting. 2004:87-92.
[4] Stephenson NL, Swanson M, Dalton J, et al. Partner-delivered reflexology: effects on cancer pain and anxiety. Oncology nursing forum. 2007; 34: 127-32. 10.1188/07.onf.127-132.
[5] Toth M, Marcantonio ER, Davis RB, et al. Massage therapy for patients with metastatic cancer: a pilot randomized controlled trial. Journal of alternative and complementary medicine (New York, NY). 2013; 19: 650-6. 10.1089/acm.2012.0466.
[6] Wyatt G, Sikorskii A, Rahbar MH, et al. Health-related quality-of-life outcomes: a reflexology trial with patients with advanced-stage breast cancer. Oncology nursing forum. 2012; 39: 568-77. PMC3576031.
[7] Boyd C, Crawford C, Paat CF, et al. The Impact of Massage Therapy on Function in Pain Populations-A Systematic Review and Meta-Analysis of Randomized Controlled Trials: Part II, Cancer Pain Populations. Pain medicine (Malden, Mass). 2016, 10.1093/pm/pnw100.
[8] Chen TH, Tung TH, Chen PS, et al. The Clinical Effects of Aromatherapy Massage on Reducing Pain for the Cancer Patients: Meta-Analysis of Randomized Controlled Trials. Evidence-based complementary and alternative medicine : eCAM. 2016; 2016: 9147974. 10.1155/2016/9147974.
[9] Lee SH, Kim JY, Yeo S, et al. Meta-Analysis of Massage Therapy on Cancer Pain. Integrative cancer therapies. 2015; 14: 297-304. 10.1177/1534735415572885.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-02-2020
Beoordeeld op geldigheid : 01-11-2023
Actualisatie
Deze richtlijn is goedgekeurd op 6 december 2019. De Nederlandse Vereniging voor Anesthesiologie (NVA) bewaakt samen met betrokken verenigingen de houdbaarheid van deze (modules van de) richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. De geldigheidstermijn van de richtlijn is maximaal 5 jaar na vaststelling. Indien de richtlijn dan nog actueel wordt bevonden, wordt de geldigheidsduur van de richtlijn verlengd.
Houderschap richtlijn
De houder van de richtlijn (NVA) moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen.
IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
Een richtlijn is een kwaliteitsstandaard. Een kwaliteitsstandaard beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een kwaliteitsstandaard in het Register van Zorginstituut Nederland betekent dus niet noodzakelijkerwijs dat de in de kwaliteitsstandaard beschreven zorg verzekerde zorg is.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Algemene gegevens
Autoriserende/instemmende en bij de werkgroep betrokken verenigingen:
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Anesthesiologie
- Nederlandse Vereniging voor Klinische Geriatrie
- Nederlandse Vereniging voor Neurologie
- Vereniging voor Specialisten Ouderengeneeskunde
- Verpleegkundigen en Verzorgenden Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse vereniging voor professionele palliatieve zorg
Financiering
Deze richtlijn c.q. module is gefinancierd door IKNL. De inhoud van de richtlijn c.q. module is niet beïnvloed door de financierende instantie.
Procesbegeleiding
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence-based richtlijnen voor de oncologische en palliatieve zorg tot een van haar primaire taken. IKNL werkt hierbij conform de daarvoor geldende (inter)nationale kwaliteitscriteria. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen.
Doel en doelgroep
Doel
Een richtlijn geeft aanbevelingen ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek en consensus. De richtlijn 'Pijn’ geeft aanbevelingen over begeleiding en behandeling van patiënten met pijn bij kanker (zowel in de curatieve als de palliatieve fase) en beoogt hiermee de kwaliteit van de zorgverlening te verbeteren.
Hoewel de evidentie alleen is verzameld voor de diagnostiek en behandeling van pijn bij patiënten met kanker zijn de aanbevelingen ook grotendeels van toepassing voor patiënten met andere levensbedreigende aandoeningen.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de zorg voor patiënten met pijn zoals huisartsen, specialisten ouderengeneeskunde, medisch specialisten, apothekers, verpleegkundigen, verzorgenden, verpleegkundig specialisten, physician assistants, fysiotherapeuten, medisch maatschappelijk werkers, geestelijk verzorgers, GZ- en klinisch psychologen.
Indien in de richtlijn wordt gesproken over zorgverleners rondom de patiënt met pijn, worden, afhankelijk van de specifieke situatie van de patiënt, alle bovengenoemde professionals bedoeld.
De richtlijn is ook relevant voor zorgverleners van andere disciplines en vrijwilligers die werkzaam zijn in de palliatieve fase. De multidimensionele benadering van de patiënt in de palliatieve fase vergt immers een gezamenlijke, interdisciplinaire verantwoordelijkheid, zoals ook in het Kwaliteitskader palliatieve zorg Nederland is beschreven.
Samenstelling werkgroep
Alle werkgroepleden en klankbordleden zijn afgevaardigd namens wetenschappelijke, beroeps- en patiëntenverenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
Het patiëntenperspectief is vertegenwoordigd door Patiëntenfederatie Nederland.
Bij de uitvoering van het evidence-based literatuuronderzoek is de kaderopleiding Palliatieve Zorg en een literatuuronderzoeker van IKNL en de voorzitter van de richtlijnwerkgroep betrokken geweest.
Werkgroepleden
- Mw. prof. dr. M.H.J. van den Beuken-van Everdingen, internist, NIV
- Dhr. dr. M.J.M.M. Giezeman †, anesthesioloog, NVA
- Dhr. dr. A. de Graeff (voorzitter), internist-oncoloog en hospice-arts, Palliactief
- Mw. drs. H. Klaren, klinisch geriater, NVKG
- Mw. B. Kramp, verpleegkundig specialist, V&VN
- Dhr. drs. M. Martens, specialist ouderengeneeskunde en consulent palliatieve zorg, Verenso
- Mw. drs. M.J. Oortman, huisarts, SCEN-arts, palliatief consulent en hospice-arts, NHG
- Dhr. drs. P. Oosterhof, poliklinisch apotheker, NVZA
- Mw. prof.dr. A.K.L. Reyners, internist, NIV
- Mw. M. Schielke, verpleegkundig pijnspecialist, V&VN
- Mw. drs. M.C. Sieders, huisarts (waarnemend), SCEN-arts, palliatief consulent, NHG
- Dhr. dr. M.F.M. Wagemans, anesthesioloog, NVA
Klankbordleden
- Dhr. prof. dr. K.C.P. Vissers, anesthesioloog, NVA
- Mw. drs. L. Bellersen, cardioloog, NVVC
- Mw. drs. B.A. Brouwer, neuroloog/pijnspecialist NVN/pijnspecialist
- Mw. M. Geerts, verpleegkundig specialist, V&VN
- Dhr. drs. S.M. de Hosson, longarts, NVALT
- Mw. drs. S. Visser, apotheker, KNMP
- Mw. drs. R. Lammers, beleidsmedewerker, Patiëntenfederatie Nederland
Ondersteuning
- Mw. T.T.M. Bluemink-Holkenborg, secretaresse, IKNL
- Mw. drs. M.G. Gilsing, adviseur (richtlijnen) palliatieve zorg, IKNL
- Mw. dr. O.L. van der Hel, literatuuronderzoeker, IKNL
- Prof.dr. J Kleijnen, epidemioloog, literatuuronderzoeker MUMC Maastricht/York
- Mw. L.K. Liu, secretaresse, IKNL
- Dhr. dr. R. Vernooij (i.s.m. de kaderopleiding Palliatieve Zorg), literatuuronderzoeker, IKNL
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke en beroepsverenigingen.
Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld. De bevindingen zijn schriftelijk vastgelegd in de belangenverklaring en opvraagbaar via info@iknl.nl.
Inbreng patiëntenperspectief
De input van patiëntvertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt. Patiëntenfederatie Nederland is in het gehele richtlijntraject meegenomen en heeft plaats gehad in de klankbordgroep (zie ook de Samenstelling van de werkgroep).
Tijdens de landelijke consultatiefase heeft Patiëntenfederatie Nederland commentaar gegeven op de conceptrichtlijn en patiënten/naasten geraadpleegd via een referentenpanel voor onderzoeksaanvragen op het gebied van palliatieve zorg. Ook heeft de Patiëntenfederatie Nederland - naast NFK, nog andere patiëntenorganisaties benaderd voor het leveren van commentaar.
Patiëntenfederatie Nederland heeft tot slot de richtlijn goedgekeurd.
Patiënteninformatie gebaseerd op de richtlijn is opgesteld en gepubliceerd op de daarvoor relevante sites (o.a. zie link https://www.kanker.nl/gevolgen-van-kanker/pijn/wat-is/pijn-bij-kanker#show-menu).
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de zorgpraktijk, inclusief borging daarvan.
Als onderdeel van elke richtlijn stelt IKNL samen met de richtlijnwerkgroep een implementatieplan op en ondersteunt een aantal basis-activiteiten voor de implementatie. De verantwoordelijkheid voor verdere implementatie-activiteiten ligt bij de eigenaar van de richtlijn (en het veld).
Activiteiten en interventies voor verspreiding en implementatie kunnen zowel op landelijk als regionaal niveau plaatsvinden. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor en door de verschillende disciplines.
Werkwijze
In de huidige richtlijn zijn de NVA-richtlijn van 2015 en de richtlijn 'Pijn' van Pallialine samengevoegd. Daarbij zijn de onderdelen van de NVA-richtlijn, die in 2015 niet zijn herzien (en waarbij de teksten van de NVA-versie van 2008 onveranderd zijn gehandhaafd) grotendeels evidence-based (op basis van aanvullend literatuuronderzoek) aangepast en aangevuld met evidence-based en consensus-based teksten over de diagnostiek en behandeling van pijn bij patiënten met gevorderde stadia van COPD of hartfalen. De onderdelen van de NVA-richtlijn die in 2015 zijn herzien zijn onveranderd overgenomen (zie ook de Algemene inleiding).
De bedoeling is om te komen tot een integrale en actuele richtlijn over de diagnostiek en behandeling van pijn bij zowel patiënten met kanker (in de curatieve én de palliatieve fase) als bij patiënten met COPD of hartfalen.
Voor de evidence-based (herzieningen van) modules zijn de aanbevelingen voorzien van een gradering met cijfers en letters om de verhouding tussen de sterkte van de aanbeveling en de kwaliteit van de evidence weer te geven (zie onderstaande tabel). Deze werkwijze is gebaseerd op de methodiek zoals voorgesteld door de GRADE working group (zie http://www.gradeworkinggroup.org).
|
Gradering van aanbevelingen |
|
|
Sterkte van de aanbeveling |
Cijfer |
|
Sterke aanbeveling |
1 |
|
Zwakke aanbeveling |
2 |
|
Kwaliteit van de evidence |
Letter |
|
Hoog |
A |
|
Matig |
B |
|
Laag |
C |
|
Zeer laag |
D |
De richtlijnteksten die gebaseerd zijn op uitgangsvragen, zijn opgebouwd volgens het volgende vaste stramien: uitgangsvraag en aanbevelingen, literatuur, conclusies, overwegingen en referenties. De evidence tabellen staan bij de desbetreffende modules. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
De uitgangsvragen zijn óf evidence-based (via de GRADE methodiek) óf consensus-based (zonder systematisch literatuuronderzoek) uitgewerkt.
De GRADE-methodiek
Selectie
Naast de selectie van studies op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- Gerandomiseerde gecontroleerde studies (RCT's)
- Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
- De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
- De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen’
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.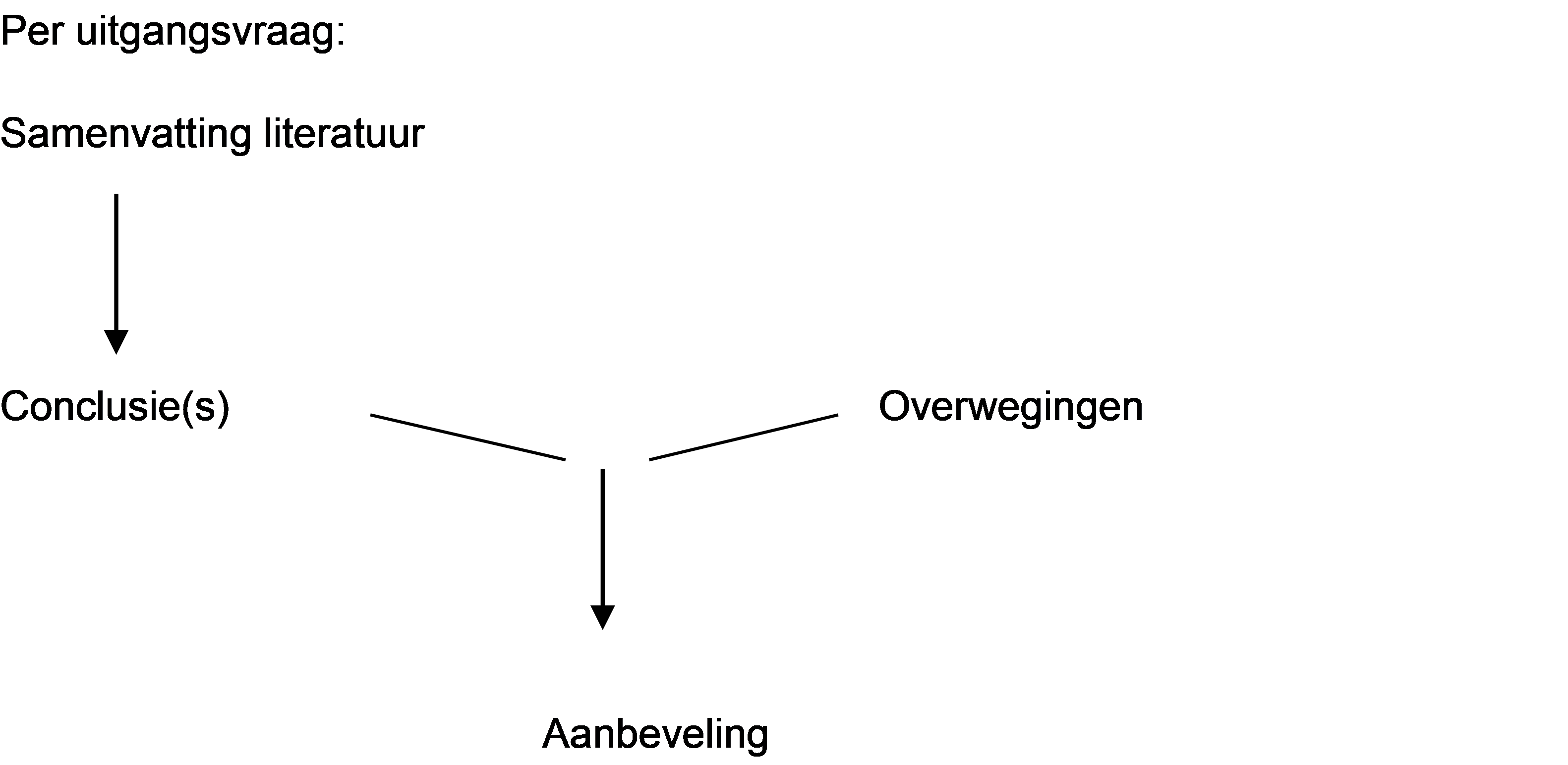
Figuur 1. Van bewijs naar aanbeveling
Bij het schrijven van de overwegingen zijn onderstaande zaken in acht genomen.
- Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
Toelichting:
- Kennis en ervaring met technieken/therapieën.
- Risico’s die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient’ plaats te vinden (sterk) of wel ‘kan worden overwogen’ (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
- Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling. - Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Maatschappelijk perspectief
(Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties)
Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
- Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin – voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Doe/geef etc. (of er dient…. te worden gegeven/gedaan)
- Zwakke/conditionele aanbevelingen: Overweeg….. te geven/te doen.
Consensus-based methodiek
Naast de evidence-based uitwerking (GRADE) zijn er ook uitgangsvragen via de consensus-based methodiek uitgewerkt. Hierbij zijn de richtlijnteksten ook gebaseerd op evidence, maar is er geen systematisch literatuuronderzoek gedaan en zijn de gevonden studies niet methodologisch beoordeeld.
Zoekverantwoording
Patiëntengroep: Patiënten met pijn en kanker
Intervention: Massage
Comparison: Geen massage
Outcome: Pijn en kwaliteit van leven
Search strategies
|
MEDLINE (13-06-2016) |
|
|
# |
Keywords |
|
1 |
Pain[tiab] OR (physica*[tiab] AND suffer*[tiab]) OR ache*[tiab] |
|
2 |
"Pain"[Mesh] |
|
3 |
#1 OR #2 |
|
4 |
("Neoplasms"[Mesh]) OR (neoplas*[tiab]) OR (cancer*[tiab]) OR (carcin*[tiab]) OR (tumo*[tiab]) OR (metasta*[tiab]) OR (malig*[tiab]) OR (oncolog*[tiab]) |
|
5 |
Massage[tiab] OR (zone[tiab] AND therap*[tiab]) OR "Massage"[Mesh] |
|
6 |
#3 AND #4 AND #5 |
|
7 |
(randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized[tiab] OR placebo[tiab] OR drug therapy[sh] OR randomly[tiab] OR trial[tiab] OR groups[tiab]) |
|
8 |
((review[tiab] OR "Review"[Publication Type] OR "Meta-Analysis as Topic"[Mesh] OR meta-analysis[tiab] OR "Meta-Analysis "[Publication Type]) NOT ("Letter"[Publication Type] OR "Editorial"[Publication Type] OR "Comment"[Publication Type])) NOT ("Animals"[Mesh] NOT ("Animals"[Mesh] AND "Humans"[Mesh])) |
|
9 |
#7 OR #8 |
|
8 |
#6 AND #9 |
|
9 |
(#6 AND #9) Filters: Publication date from 2007/01/01 to 2016/12/31 |
|
EMBASE (13-06-2016) |
|
|
# |
Keywords |
|
1 |
Pain:ti,ab OR (physica*:ti,ab AND suffer*:ti,ab) OR ache*:ti,ab |
|
2 |
'pain'/exp |
|
3 |
#1 OR #2 |
|
4 |
('neoplasm'/exp) OR (neoplas*:ti,ab) OR (cancer*:ti,ab) OR (carcin*:ti,ab) OR (tumo*:ti,ab) OR (metasta*:ti,ab) OR (malig*:ti,ab) |
|
5 |
Massage:ti,ab OR (zone:ti,ab AND therap*:ti,ab) OR 'massage'/exp |
|
6 |
#3 AND #4 AND #5 |
|
7 |
([cochrane review]/lim OR [meta analysis]/lim OR [systematic review]/lim) OR ([article]/lim OR [article in press]/lim OR [review]/lim) OR ([controlled clinical trial]/lim OR [randomized controlled trial]/lim) AND ([article]/lim OR [article in press]/lim) |
|
8 |
#6 AND #7 |
|
9 |
(#8 AND #11) Filters: Publication date from 2007/01/01 to 2016/12/31 |
|
Cochrane Library (13-06-2016) |
|
|
# |
Keywords |
|
1 |
Pain:ti,ab OR (physica*:ti,ab AND suffer*:ti,ab) OR ache*:ti,ab |
|
2 |
MeSH descriptor: [Pain] explode all trees |
|
3 |
#1 OR #2 |
|
4 |
MeSH descriptor: [Neoplasms] explode all trees |
|
5 |
(neoplas*:ti,ab) OR (cancer*:ti,ab) OR (carcin*:ti,ab) OR (tumo*:ti,ab) OR (metasta*:ti,ab) OR (malig*:ti,ab) |
|
6 |
#4 OR #5 |
|
7 |
Massage:ti,ab OR (zone:ti,ab AND therap*:ti,ab) |
|
8 |
MeSH descriptor: [Massage] explode all trees |
|
9 |
#7 OR #8 |
|
10 |
#3 AND #6 AND #9 |
|
11 |
#3 AND #6 AND #9Filters: Publication date from 2007/01/01 to 2016/12/31 |
