Zwakwerkende opioïden bij pijn bij kanker
Uitgangsvraag
Wat is het effect van zwakwerkende opioïden (codeïne of tramadol) op pijn bij patiënten met kanker?
Aanbeveling
Bij nociceptieve pijn:
- Het gebruik van zwakwerkende opioïden (codeïne of tramadol) wordt niet aanbevolen (1C).
Overwegingen
2008
De WHO-pijnladder is ontstaan om wereldwijd een handvat te bieden voor de aanpak van pijn bij patiënten met kanker. In die landen waar beperkingen bestaan om sterkwerkende opioïden voor te schrijven, is stap 2 een soms noodzakelijke keuze na stap 1. In Nederland, de West-Europese landen en de Verenigde Staten zijn sterkwerkende opioïden in ruime mate beschikbaar en kunnen gemakkelijk op recept worden verkregen. Al jaren wordt in deze landen stap 2 van de WHO-ladder meestal overgeslagen. De argumentatie hiervoor is dat stap 2 als tussenstap geen meerwaarde heeft boven stap 3, omdat de zwak werkende opioïden dezelfde bijwerkingen hebben als de sterkwerkende opioïden en nogal eens vaker per dag moeten worden toegediend.
De enige argumentatie die wellicht zou kunnen worden aangevoerd voor het gebruik van zwak werkende opioïden, is dat het patiënten die deze middelen gebruiken wettelijk is toegestaan (in tegenstelling tot patiënten die sterkwerkende opioïden gebruiken) om auto te rijden (zie de module Bijwerkingen); de patiënt is echter wel aansprakelijk indien hij of zij een ongeluk veroorzaakt. Hoewel dit argument een rol kan spelen bij de keuze bij een individuele patiënt, vindt de werkgroep dit geen overwegende argumentatie voor het gebruik van zwak werkende opioïden.
2019
De bevindingen van de studie van Bandieri zijn in lijn met die van Maltoni en Mariangeli (Bandieri 2016, Maltoni 2005, Mariangeli 2004). De studie van Nunes heeft betrekking op een andere vraagstelling omdat daarbij het overslaan van zowel stap 1 als stap 2 van de WHO-ladder wordt onderzocht (Nunes 2016). De hogere frequentie van bijwerkingen van de morfinegroep in deze studie kan worden verklaard door de relatief hoge startdosering van de morfine (6dd 10 mg).
Een argument om codeïne niet in te zetten is ook het feit dat codeïne pas actief is na omzetting in het lichaam in morfine en dat 10% van de Nederlandse bevolking het enzym mist dat daarvoor noodzakelijk is. Het in de NVA-richtlijn van 2008 genoemde voordeel van codeïne t.o.v. sterkwerkende opioïden t.a.v. het autorijden is inmiddels niet meer van toepassing i.v.m. veranderde regelgeving t.a.v. rijvaardigheid bij gebruik van opioïden.
In een systematische review van 2011 werd op basis van methodologische tekortkomingen van de studies van Maltoni en Mariangeli er onvoldoende bewijs aanwezig geacht om te adviseren om stap 2 van de WHO-ladder routinematig over te slaan (Tassinari 2011). Met de studie van Bandieri lijkt dit argument te zijn vervallen.
De systematische reviews van Straube (2014) en Wiffen (2017) geven evenmin aanleiding om het gebruik van codeïne of tramadol als stap 2 aan te raden.
Er is derhalve geen reden om de aanbeveling van de NVA-richtlijn van 2008 te veranderen t.a.v. de behandeling van nociceptieve pijn.
Onderbouwing
Achtergrond
Sinds 1986 wordt door de Wereld Gezondheidsorganisatie de WHO-ladder aanbevolen voor de behandeling van nociceptieve pijn. Deze pijnladder propageert een stapsgewijze behandeling van pijn bij patiënten met kanker. De zwakwerkende opioïden (van oudsher codeïne; tramadol wordt tegenwoordig ook tot deze groep gerekend) staan benoemd bij stap 2, de sterkwerkende opioïden (morfine, fentanyl, oxycodon, hydromorfon, buprenorfine, tapentadol, methadon) bij stap 3.
De module van 2019 is een evidence-based update van de module van de NVA-richtlijn van 2008. Het literatuuronderzoek en de overwegingen worden gescheiden beschreven.
In 2008 kwam de werkgroep tot de volgende aanbeveling:
- Het toepassen van zwakwerkende opioïden voor de behandeling van pijn bij patiënten met kanker wordt niet aanbevolen.
Conclusies / Summary of Findings
2008
Het is aannemelijk dat het overslaan van stap 2 van de WHO-pijnladder leidt tot betere pijnstilling bij patiënten met kanker (niveau 2).
(B: Maltoni 2005, Mariangeli 2004)
2019
Codeine is effectiever dan placebo bij de behandeling van pijn bij patiënten met kanker (zeer laag GRADE).
(Straube 2014)
Tramadol is minder effectief dan morfine bij de behandeling van pijn bij patiënten met kanker (zeer laag GRADE).
Wiffen 2017
Behandeling met lage doseringen morfine (tot 30 mg dd) gedurende vier weken leidt bij patiënten met kanker vaker tot een afname van de pijnscore met 20-50% dan behandeling met codeïne (tot 240 mg dd) of tramadol (tot 400 mg dd), al dan niet in combinatie met paracetamol (laag GRADE).
(Bandieri 2016)
Er is geen verschil in pijnscore, tevredenheid over de behandeling of kwaliteit van leven tussen patiënten met kanker en pijn, die starten met paracetamol en behandeld worden conform de WHO-ladder, en patiënten, die starten met 6dd 10 mg morfine. Behandeling met morfine leidt significant vaker tot bijwerkingen (misselijkheid, obstipatie, duizeligheid en sufheid) na twee weken (laag GRADE).
(Nunes 2016)
Samenvatting literatuur
Tot 2007
Het literatuuronderzoek leverde twee onderzoeken op (Marinangeli, 2004; Maltoni 2005).
In een gerandomiseerd klinisch onderzoek werden 44 patiënten met kanker en pijn, die als eerstelijnsbehandeling sterkwerkende opioïden voorgeschreven kregen, vergeleken met een controlegroep (48 patiënten) die werd behandeld volgens de stappen 1 en 2 van de WHO-pijnladder (Marinangeli, 2004). De groep die direct werd behandeld met sterkwerkende opioïden, gaf een betere pijnstilling aan, hoefde minder veranderingen in de therapie te ondergaan en was tevredener. De controlegroep gaf bovendien significant vaker misselijkheid als bijwerking van de behandeling aan.
Bij een ander onderzoek werden 54 patiënten met viscerale of botmetastasen met onvoldoende pijnstilling na stap 1 gerandomiseerd tussen stap 2 (controlegroep) of stap 3 volgens de WHO-ladder (experimentele groep). De patiënten in de experimentele groep gaven een significant betere pijnstilling aan, maar hadden ook meer last van obstipatie en anorexie (Maltoni, 2005).
2007-2016
Een systematische review vond 15 gerandomiseerde dubbelblinde studies (waarbij bovengenoemde studies van Maltoni en Marinangeli niet waren opgenomen) bij in totaal 721 patiënten met kanker waarbij oraal codeïne (n=12) of codeïne + paracetamol (n=3) vergeleken werden met placebo (n=10), intramusculair toegediend codeïne (n=1) of andere medicatie (NSAID’s, cannabinoiden, tramadol, morfine/oxycodon i.m., n=13) (Straube 2014). Tien studies onderzochten het effect van een eenmalige dosis en vijf studies het effect van behandeling gedurende resp. 1, 7 of 21 dagen. Alle studies hadden methodologische tekortkomingen. Een meta-analyse was niet mogelijk. De studies lieten zien dat codeïne effectiever is dan placebo en gepaard gaat met meer bijwerkingen (misselijkheid, braken en obstipatie) dan placebo.
Een andere review vond tien gerandomiseerde studies van slechte kwaliteit bij in totaal 958 patiënten met kanker waarbij tramadol (met of zonder paracetamol) vergeleken werd met placebo, NSAID’s, zwak werkende opioiden, buprenorfine of morfine (Wiffen 2017). De auteurs concludeerden dat er beperkte evidentie van zeer lage kwaliteit is voor het effect van tramadol en beperkte evidentie van zeer lage kwaliteit dat tramadol minder effectief is dan morfine.
Bij het literatuuronderzoek werden twee gerandomiseerde studies gevonden, waarbij behandeling met codeïne of tramadol werd vergeleken met direct starten met sterkwerkende opioïden (Bandieri 2016, Nunes 2016).
Bandieri verrichtte een gerandomiseerde open-label studie gedurende 28 dagen bij 240 opioïdnaïeve patiënten met kanker met matig ernstige pijn (pijnscore 4-6) (Bandieri 2016). 92% van de patiënten had nociceptieve pijn. 118 patiënten startten met een titratiefase met immediate release morfine (tot 30 mg dd), waarna overgegaan werd op slow release morfine; 122 patiënten startten met een zwak opioïd (codeïne of tramadol), al dan niet in combinatie met paracetamol, tot een maximale dosering van 240 mg codeïne of 400 mg tramadol per dag. Het primaire eindpunt was het percentage patiënten met een reductie van tenminste 20% van de pijnscore t.o.v. de uitgangsmeting. Dit percentage bedroeg 88% in de morfinegroep en 57% in de codeïne/tramadolgroep (odds risk 6,18; 95% betrouwbaarheidsinterval 3,13-12,24 p<0,001). Vanaf de eerste week was er een hoger percentage responders in de morfinegroep. Een afname met 30% (83% vs 47%, p<0,001) resp. 50% (75,5% vs 42%) van de pijnscore trad eveneens significant vaker op in de morfinegroep. 35% van de patiënten die een zwak opioïd gebruikten switchten in de studieperiode naar een sterkwerkend opioïd versus 15% van de morfinegroep die switchte naar een ander sterkwerkend opioïd (p=0.001). Er waren geen verschillen in bijwerkingen tussen beide groepen.
Nunes verrichte een gerandomiseerde open-label studie gedurende drie maanden bij 60 opioïdnaïeve patiënten met kanker, waarvan 48 met een hoofd-hals-tumor (Nunes 2016). Bij 57 patiënten was er sprake van nociceptieve pijn. Zeven patiënten waren eerder behandeld met paracetamol. Dertig patiënten startten met paracetamol 4 dd 1000 mg (stap 1 van de WHO-ladder), bij onvoldoende effect gecombineerd met codeïne 6 dd 30 mg (opgehoogd tot maximaal 6 dd 40 mg); dertig patiënten startten met 6 dd 10 mg immediate release morfine. Elke week werden metingen verricht. Op geen van de meetmomenten was er een significant verschil in pijnscore, tevredenheid over de behandeling of kwaliteit van leven. Patiënten in de morfinegroep hadden na twee weken significant meer last van misselijkheid, obstipatie, duizeligheid en sufheid.
Kwaliteit van bewijs
Straube 2014, Wiffen 2017
De bewijskracht voor de uitkomstmaat pijnstilling (codeïne of tramadol) is met 3 niveaus verlaagd tot zeer laag gezien de hoge risico op bias (niet altijd blindering, allocation concealment niet beschreven), hoge heterogeniteit en laag aantal patiënten voor de verschillende vergelijkingen. Daarbij waren de studiemethoden ook erg verschillend. Bovendien rapporteerden niet alle studies de uitkomstmaten op dezelfde manier.
Nunes 2016
De bewijskracht voor de uitkomstmaat pijnscore is met 2 niveaus verlaagd tot laag gezien de methode van blinderen, onduidelijk randomisatieproces (risk of bias) laag aantal events (imprecisie).
De bewijskracht voor de uitkomstmaat tevredenheid over de behandeling is met 2 niveaus verlaagd tot laag gezien de onduidelijk beschreven methode van blinderen en randomisatieproces (risk of bias) en laag aantal events (imprecisie).
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met 2 niveaus verlaagd tot laag gezien de onduidelijk beschreven methode van blinderen en randomisatieproces (risk of bias) en laag aantal events (imprecisie).
De bewijskracht voor de uitkomstmaat bijwerkingen is met 2 niveaus verlaagd tot laag gezien de onduidelijk beschreven methode van blinderen en randomisatieproces (risk of bias) en laag aantal events (imprecisie).
Referenties
- Bandieri E, Romero M, Ripamonti C, et al. Randomized trial of low-dose morphine versus weak opioids in moderate cancer pain. J Clin Oncol 2016; 34: 436-442.
- Maltoni M, Scarpi E, Modonesi C et al. A validation study of the WHO analgesic ladder : a two-step vs three-step strategy. Supp Care Cancer 2005; 13: 888-894.
- Marinangeli F, Ciccozzi A, Leonardis M, Aloisio L, Mazzei A, Paladini A, Porzio G, Marchetti P, Varrassi G. Use of strong opioids in advanced cancer pain: a randomized trial. J Pain Symptom Manage 2004; 27: 409-16.
- Nunes BC, dos Santos Garcia JB, Sakata RK. Morphine as first medication for treatment of cancer pain. Rev Bras Anesthesiol 2014; 64: 236-240.
- Straube C, Derry D, Jackson, et al. Codeine, alone and with paracetamol (acetaminophen), for cancer pain (Review). Cochrane Database Syst Rev 2014; 9: CD006601.
- Tassinari D, Drudi F, Rosati M, et al. The second step of the analgesic ladder and oral tramadol in de treatment of mild to moderate cancer pain: a systematic review. Palliat Med 2011; 25: 410-423.
- Wiffen PJ, Derry S, Moore RA. Tramadol with or without paracetamol (acetaminophen) for cancer pain. Cochrane Database Syst Rev 2017; 5: CD012508.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: Wat is het effect van zwakwerkende opioïden (codeïne of tramadol) op pijn bij patiënten met kanker?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Nunes, 2014 |
Type of study: RCT Setting: Hospital Country: Brazil Source of funding: not reported |
Inclusion criteria: Patients with locally advanced and/or metastatic cancer.
Exclusion criteria: Patients with difficultly in maintaining clinical follow-up, cognitive impairment and previous treatment with opioids. N total at baseline: Intervention: 30 Control:30
Important prognostic factors2: age ± SD: I: 58.7 ± 12.4 C: 57.5 ± 12.7
Sex: I: M:F 25:5 C: M:F 27:3
Groups comparable at baseline? yes
|
Treated according to the guidelines of the WHO analgesic ladder and started on the first step with paracetamol 1 g every six hours (maximum dose 4g/day); in the second step, codeine (30 mg ) every four hours (maximum dose of 360 mg /day) and morphine 10 mg four hours in the third step
|
Morphine 10 mg every four hours
|
Length of follow-up: 3 months
Loss-to-follow-up: Intervention:1 Control: 6
|
Pain intensity by visual analogue scale: 12th week I: 2.3±2.1 C: 2.9 ±2.5 p=0.3400
Satisfaction with treatment I: 20 C: 24 p=0.5275
Quality of life I: 92.2±11.7 C:93.0 ± 10.5 p=0.7816
Nausea I: 5 C: 20 p=0.0088
Constipation I: 14 C: 25 p=0.0071
Dizziness I: 6 C: 14 p=0.0376
Drowsiness I: 13 C: 27 p=0.0005 |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is het effect van zwakwerkende opioïden (codeïne of tramadol) op pijn bij patiënten met kanker?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Wiffen 2017
10 RCTs |
SR and no meta-analysis
Literature search up to Nov 2016 Study design: RCT Setting and country: UK Source of funding: Not reported
|
Inclusion criteria SR: 1) RCT’s of any duration
2) adults and children of any age who expierenced cancer-related pain
3) tramadol with or without paracematol for cancer pain
Exclusion criteria SR: 1) quasi-randomized studies
2) studies with <10 participants
3) non cancer related pain
4) no assessment of pain as outcome
10 studies included
|
Intervention: Oral tramadol with or without paracematol for cancer pain |
Comparison: Placebo or any active comparator |
End-point of follow-up: One day to six months |
Tramadol versus morphine:
Participants with pain reduction of 30% or greater from baseline(1 study): not calculated
Participants with pain reduction of 50% or greater from baseline (1 study): not calculated
Participants with pain no worse than mild (1 study): no data
Participants with Patient Global impression of Change (PGIC) of much improved or very much imporved (1 study): no data
Serious adverse events (death) (2 studies): not calculated Other adverse events: no analysis possible
For all comparisons: no firm conclusions could be drawn for any outcome in any comparison.
|
Pooling of results was not possible due to heterogeneity of studies |
|
Straube, 2014
15 studies |
SR
Literature search up to March 2014 Study design: RCT Setting and country: UK Source of funding: Not reported
|
Inclusion criteria SR:
1) RCT’s of any duration
2) adults and children of any age who expierenced cancer-related pain
3) codeine, alone or in combination with paracetamol, using any formulation, dosage regimen, and route of administration for cancer pain
Exclusion criteria SR: 1) quasi-randomized studies
2) studies with <10 participants
3) non cancer related pain
4) no assessment of pain as outcome
Exclusion criteria SR:
15 studies included
|
Intervention:
codeine, alone or in combination with paracetamol, using any formulation, dosage regimen, and route of administration for cancer pain |
Comparison: Placebo or an alternative active treatment |
End-point of follow-up: |
Codeine +/- paracetamol compared with placebo for cancer pain
At least 50% reduction in pain or equivalent: not calculated
“moderate”benefit; at least 30% reducation in pain: no data.
Proportion below 30/100 mm on VAS: no data
Patient Global Impression of Change much or very much improved : no data
Adverse event withdrawals: no usable data
Serious adverse events: non reported Death: not calculated
|
Although a number of different drugs or combinations of drugs were compared with codeine, no two studies made the same comparison, and the numbers involved were too small to draw any firm conclusion. |
Author(s): Jos Kleijnen
Date: 2016-11-14
Question: Should neurolytic plexus hypogastricus block be used for pain due to cancer?
Settings: Treatment by anesthetists
Bibliography: Mishra S, Bhatnagar S, Rana SP, Khurana D, Thulkar S. Efficacy of the anterior ultrasound-guided superior hypogastric plexus neurolysis in pelvic cancer pain in advanced gynecological cancer patients. Pain Med. 2013;14(6):837-42. doi: 10.1111/pme.12106.
|
Quality assessment |
No of patients |
Effect |
Quality |
Importance |
||||||||
|
No of studies |
Design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Neurolytic plexus hypogastricus block |
Control |
Relative (95% CI) |
Absolute |
||
|
Global pain intensity1 (follow-up 1-13 weeks; assessed with: 10cm VAS) |
||||||||||||
|
1 |
randomized trials |
serious2 |
no serious inconsistency |
no serious indirectness |
serious3 |
none |
- |
- |
- |
- |
EBEBOO LOW |
CRITICAL |
|
|
0% |
- |
||||||||||
1 The VAS-scores in the hypogastric-block-group had decreased significantly after 1 week, 1 and 2 months (about 20 at all times vs. 55, 45 and 35 respectively in the control group). At 3 months, there was no difference in pain scores. No numeric results were given, the data have to be estimated from a figure.
2 Doubts about adequate blinding
3 Small trail with 25 patients per group
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-02-2020
Beoordeeld op geldigheid : 01-11-2023
Actualisatie
Deze richtlijn is goedgekeurd op 6 december 2019. De Nederlandse Vereniging voor Anesthesiologie (NVA) bewaakt samen met betrokken verenigingen de houdbaarheid van deze (modules van de) richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. De geldigheidstermijn van de richtlijn is maximaal 5 jaar na vaststelling. Indien de richtlijn dan nog actueel wordt bevonden, wordt de geldigheidsduur van de richtlijn verlengd.
Houderschap richtlijn
De houder van de richtlijn (NVA) moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen.
IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
Een richtlijn is een kwaliteitsstandaard. Een kwaliteitsstandaard beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een kwaliteitsstandaard in het Register van Zorginstituut Nederland betekent dus niet noodzakelijkerwijs dat de in de kwaliteitsstandaard beschreven zorg verzekerde zorg is.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Algemene gegevens
Autoriserende/instemmende en bij de werkgroep betrokken verenigingen:
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Anesthesiologie
- Nederlandse Vereniging voor Klinische Geriatrie
- Nederlandse Vereniging voor Neurologie
- Vereniging voor Specialisten Ouderengeneeskunde
- Verpleegkundigen en Verzorgenden Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse vereniging voor professionele palliatieve zorg
Financiering
Deze richtlijn c.q. module is gefinancierd door IKNL. De inhoud van de richtlijn c.q. module is niet beïnvloed door de financierende instantie.
Procesbegeleiding
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence-based richtlijnen voor de oncologische en palliatieve zorg tot een van haar primaire taken. IKNL werkt hierbij conform de daarvoor geldende (inter)nationale kwaliteitscriteria. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen.
Doel en doelgroep
Doel
Een richtlijn geeft aanbevelingen ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek en consensus. De richtlijn 'Pijn’ geeft aanbevelingen over begeleiding en behandeling van patiënten met pijn bij kanker (zowel in de curatieve als de palliatieve fase) en beoogt hiermee de kwaliteit van de zorgverlening te verbeteren.
Hoewel de evidentie alleen is verzameld voor de diagnostiek en behandeling van pijn bij patiënten met kanker zijn de aanbevelingen ook grotendeels van toepassing voor patiënten met andere levensbedreigende aandoeningen.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de zorg voor patiënten met pijn zoals huisartsen, specialisten ouderengeneeskunde, medisch specialisten, apothekers, verpleegkundigen, verzorgenden, verpleegkundig specialisten, physician assistants, fysiotherapeuten, medisch maatschappelijk werkers, geestelijk verzorgers, GZ- en klinisch psychologen.
Indien in de richtlijn wordt gesproken over zorgverleners rondom de patiënt met pijn, worden, afhankelijk van de specifieke situatie van de patiënt, alle bovengenoemde professionals bedoeld.
De richtlijn is ook relevant voor zorgverleners van andere disciplines en vrijwilligers die werkzaam zijn in de palliatieve fase. De multidimensionele benadering van de patiënt in de palliatieve fase vergt immers een gezamenlijke, interdisciplinaire verantwoordelijkheid, zoals ook in het Kwaliteitskader palliatieve zorg Nederland is beschreven.
Samenstelling werkgroep
Alle werkgroepleden en klankbordleden zijn afgevaardigd namens wetenschappelijke, beroeps- en patiëntenverenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
Het patiëntenperspectief is vertegenwoordigd door Patiëntenfederatie Nederland.
Bij de uitvoering van het evidence-based literatuuronderzoek is de kaderopleiding Palliatieve Zorg en een literatuuronderzoeker van IKNL en de voorzitter van de richtlijnwerkgroep betrokken geweest.
Werkgroepleden
- Mw. prof. dr. M.H.J. van den Beuken-van Everdingen, internist, NIV
- Dhr. dr. M.J.M.M. Giezeman †, anesthesioloog, NVA
- Dhr. dr. A. de Graeff (voorzitter), internist-oncoloog en hospice-arts, Palliactief
- Mw. drs. H. Klaren, klinisch geriater, NVKG
- Mw. B. Kramp, verpleegkundig specialist, V&VN
- Dhr. drs. M. Martens, specialist ouderengeneeskunde en consulent palliatieve zorg, Verenso
- Mw. drs. M.J. Oortman, huisarts, SCEN-arts, palliatief consulent en hospice-arts, NHG
- Dhr. drs. P. Oosterhof, poliklinisch apotheker, NVZA
- Mw. prof.dr. A.K.L. Reyners, internist, NIV
- Mw. M. Schielke, verpleegkundig pijnspecialist, V&VN
- Mw. drs. M.C. Sieders, huisarts (waarnemend), SCEN-arts, palliatief consulent, NHG
- Dhr. dr. M.F.M. Wagemans, anesthesioloog, NVA
Klankbordleden
- Dhr. prof. dr. K.C.P. Vissers, anesthesioloog, NVA
- Mw. drs. L. Bellersen, cardioloog, NVVC
- Mw. drs. B.A. Brouwer, neuroloog/pijnspecialist NVN/pijnspecialist
- Mw. M. Geerts, verpleegkundig specialist, V&VN
- Dhr. drs. S.M. de Hosson, longarts, NVALT
- Mw. drs. S. Visser, apotheker, KNMP
- Mw. drs. R. Lammers, beleidsmedewerker, Patiëntenfederatie Nederland
Ondersteuning
- Mw. T.T.M. Bluemink-Holkenborg, secretaresse, IKNL
- Mw. drs. M.G. Gilsing, adviseur (richtlijnen) palliatieve zorg, IKNL
- Mw. dr. O.L. van der Hel, literatuuronderzoeker, IKNL
- Prof.dr. J Kleijnen, epidemioloog, literatuuronderzoeker MUMC Maastricht/York
- Mw. L.K. Liu, secretaresse, IKNL
- Dhr. dr. R. Vernooij (i.s.m. de kaderopleiding Palliatieve Zorg), literatuuronderzoeker, IKNL
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke en beroepsverenigingen.
Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld. De bevindingen zijn schriftelijk vastgelegd in de belangenverklaring en opvraagbaar via info@iknl.nl.
Inbreng patiëntenperspectief
De input van patiëntvertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt. Patiëntenfederatie Nederland is in het gehele richtlijntraject meegenomen en heeft plaats gehad in de klankbordgroep (zie ook de Samenstelling van de werkgroep).
Tijdens de landelijke consultatiefase heeft Patiëntenfederatie Nederland commentaar gegeven op de conceptrichtlijn en patiënten/naasten geraadpleegd via een referentenpanel voor onderzoeksaanvragen op het gebied van palliatieve zorg. Ook heeft de Patiëntenfederatie Nederland - naast NFK, nog andere patiëntenorganisaties benaderd voor het leveren van commentaar.
Patiëntenfederatie Nederland heeft tot slot de richtlijn goedgekeurd.
Patiënteninformatie gebaseerd op de richtlijn is opgesteld en gepubliceerd op de daarvoor relevante sites (o.a. zie link https://www.kanker.nl/gevolgen-van-kanker/pijn/wat-is/pijn-bij-kanker#show-menu).
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de zorgpraktijk, inclusief borging daarvan.
Als onderdeel van elke richtlijn stelt IKNL samen met de richtlijnwerkgroep een implementatieplan op en ondersteunt een aantal basis-activiteiten voor de implementatie. De verantwoordelijkheid voor verdere implementatie-activiteiten ligt bij de eigenaar van de richtlijn (en het veld).
Activiteiten en interventies voor verspreiding en implementatie kunnen zowel op landelijk als regionaal niveau plaatsvinden. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor en door de verschillende disciplines.
Werkwijze
In de huidige richtlijn zijn de NVA-richtlijn van 2015 en de richtlijn 'Pijn' van Pallialine samengevoegd. Daarbij zijn de onderdelen van de NVA-richtlijn, die in 2015 niet zijn herzien (en waarbij de teksten van de NVA-versie van 2008 onveranderd zijn gehandhaafd) grotendeels evidence-based (op basis van aanvullend literatuuronderzoek) aangepast en aangevuld met evidence-based en consensus-based teksten over de diagnostiek en behandeling van pijn bij patiënten met gevorderde stadia van COPD of hartfalen. De onderdelen van de NVA-richtlijn die in 2015 zijn herzien zijn onveranderd overgenomen (zie ook de Algemene inleiding).
De bedoeling is om te komen tot een integrale en actuele richtlijn over de diagnostiek en behandeling van pijn bij zowel patiënten met kanker (in de curatieve én de palliatieve fase) als bij patiënten met COPD of hartfalen.
Voor de evidence-based (herzieningen van) modules zijn de aanbevelingen voorzien van een gradering met cijfers en letters om de verhouding tussen de sterkte van de aanbeveling en de kwaliteit van de evidence weer te geven (zie onderstaande tabel). Deze werkwijze is gebaseerd op de methodiek zoals voorgesteld door de GRADE working group (zie http://www.gradeworkinggroup.org).
|
Gradering van aanbevelingen |
|
|
Sterkte van de aanbeveling |
Cijfer |
|
Sterke aanbeveling |
1 |
|
Zwakke aanbeveling |
2 |
|
Kwaliteit van de evidence |
Letter |
|
Hoog |
A |
|
Matig |
B |
|
Laag |
C |
|
Zeer laag |
D |
De richtlijnteksten die gebaseerd zijn op uitgangsvragen, zijn opgebouwd volgens het volgende vaste stramien: uitgangsvraag en aanbevelingen, literatuur, conclusies, overwegingen en referenties. De evidence tabellen staan bij de desbetreffende modules. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
De uitgangsvragen zijn óf evidence-based (via de GRADE methodiek) óf consensus-based (zonder systematisch literatuuronderzoek) uitgewerkt.
De GRADE-methodiek
Selectie
Naast de selectie van studies op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- Gerandomiseerde gecontroleerde studies (RCT's)
- Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
- De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
- De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen’
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.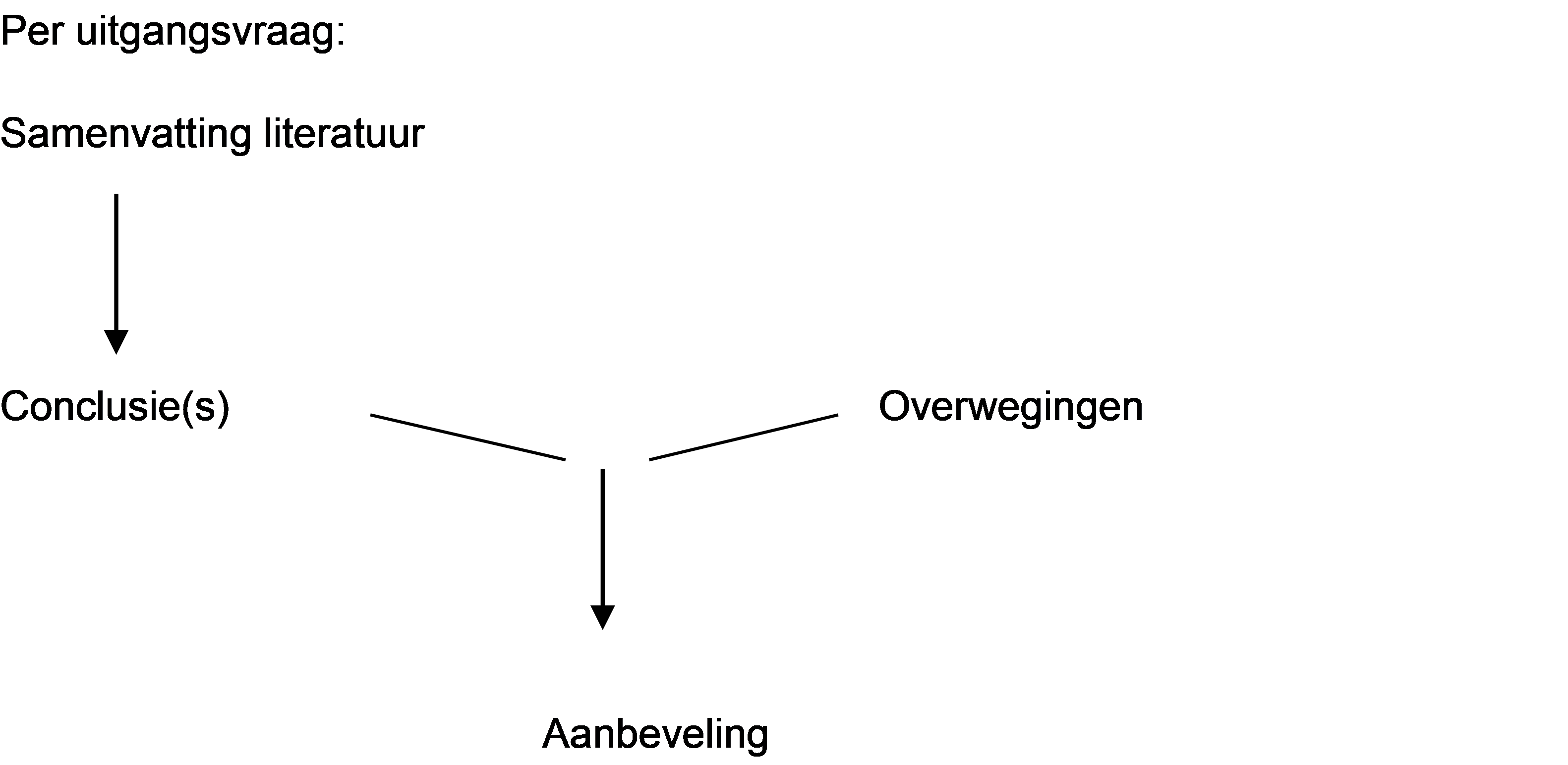
Figuur 1. Van bewijs naar aanbeveling
Bij het schrijven van de overwegingen zijn onderstaande zaken in acht genomen.
- Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
Toelichting:
- Kennis en ervaring met technieken/therapieën.
- Risico’s die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient’ plaats te vinden (sterk) of wel ‘kan worden overwogen’ (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
- Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling. - Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Maatschappelijk perspectief
(Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties)
Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
- Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin – voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Doe/geef etc. (of er dient…. te worden gegeven/gedaan)
- Zwakke/conditionele aanbevelingen: Overweeg….. te geven/te doen.
Consensus-based methodiek
Naast de evidence-based uitwerking (GRADE) zijn er ook uitgangsvragen via de consensus-based methodiek uitgewerkt. Hierbij zijn de richtlijnteksten ook gebaseerd op evidence, maar is er geen systematisch literatuuronderzoek gedaan en zijn de gevonden studies niet methodologisch beoordeeld.
Zoekverantwoording
Search strategie
Zoektermen “Zwak werkende opioïden (codeine, dihydrocodeine en tramadol) bij kanker” in Medline via OVID
Zoekdatum 7 maart 2019
Kanker
exp Neoplasms/ or exp Neoplasm Metastasis/ OR (cancer* or tumor* or tumour* or oncolog* or carcinoma* or malignan* or metastas?s or neoplasm*).ti,ab 4000401
Pijn
Pain.ti,ab OR Exp Pain/ OR Pain measurement/ OR Pain management/ OR Palliative Care/ 766024
Zwak werkende opioïden
codeine.ti,ab. OR exp codeine/ OR exp Tramadol/ OR tramadol.ti,ab. OR dihydrocodeine.ti,ab. OR (weak and opioids).ti,ab. 13693
Systematische review
(meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) 384415
RCTs
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase I or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) 1834655
limit to yr="2006 -Current"
Overzicht:
Kanker EN pijn EN zwakke opioïden
- Sys rev OF RCT
- Limiet 2006-nu
N=283
Search strategie
Zoektermen “Zwak werkende opioïden (codeine, dihydrocodeine en tramadol) bij kanker” in Embase
Zoekdatum 7 maart 2019
Kanker
'neoplasm'/exp/mj OR 'neoplasm' OR cancer*:ab,ti OR tumor*:ab,ti OR tumour*:ab,ti OR oncolog*:ab,ti OR carcinoma*:ab,ti OR malignan*:ab,ti OR metastasis:ab,ti OR metastases:ab,ti OR neoplasm*:ab,ti OR 'cancer palliative therapy'/exp/mj OR palliative:ab,ti 5009046
Pijn
('pain'/de OR pain:ab,ti OR 'analgesia'/de OR analgesia:ab,ti OR 'cancer palliative therapy'/de) OR ('cancer’/de AND ‘pain’/de) 978304
Zwak werkende opioïden
'codeine'/de OR 'dihydrocodeine'/de OR 'tramadol'/de OR codeine:ab,ti OR dihydrocodeine:ab,ti OR tramadol:ab,ti OR (weak AND opioid):ab,ti 39757
Systematische review
'meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) 411348
RCTs
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it 2207448
AND [2006-2019]/py
Overzicht:
Kanker EN pijn EN zwakke opioïden
- Sys rev of RCT
- Limiet 2006-nu
N=592
