Toediening van opioïden, dosering en dosistitratie bij pijn bij kanker
Uitgangsvraag
Op welke wijze dient te worden omgegaan met de toedieningsweg, de dosis en het doseerinterval van sterkwerkende opioïden bij patiënten met kanker?
Aanbeveling
- Start bij toepassing van opioïden bij de behandeling van pijn bij patiënten met kanker met een oraal of transdermaal toegediend opioïd.
- Indien wordt gekozen voor de orale toedieningsweg: start met morfine, oxycodon, hydromorfon of tapentadol met vertraagde afgifte, aangevuld met een snel werkend opioïd voor doorbraakpijn (zie de uitgangsvraag Doorbraakpijn). Gebruikelijke startdoses bij opioïdnaïeve patiënten zijn: 2 dd 20 mg (2 dd 10 mg bij patiënten > 70 jaar) slow release morfine of 2 dd 10 mg slow release oxycodon (2 dd 5 mg bij patiënten > 70 jaar). Voor slow release hydromorfon is de laagst mogelijke startdosis 2 dd 4 mg, overeenkomend met 2 dd 30 mg slow release morfine. Bij tapentadol wordt gestart met 2dd 50 mg.
- Indien wordt gekozen voor de transdermale toedieningsweg: start met fentanyl, aangevuld met een snel werkend opioïd voor doorbraakpijn (zie de uitgangsvraag Doorbraakpijn). De gebruikelijke startdosis bij opioïdnaïeve patiënten is één pleister van 12 μg/uur om de drie dagen.
- Start met subcutane of intraveneuze toediening van morfine, oxycodon of hydromorfon indien een snel effect gewenst is of als de pijn onvoldoende onder controle is met oraal of transdermaal toegediende opioïd. Maak in het ziekenhuis gebruik van Patient Controlled Anesthesia (PCA) bij patiënten die controle willen en kunnen hebben over toediening van doorbraakmedicatie.
- Rectale toediening van slow release morfine of oxycodon wordt niet aangeraden als onderhoudsbehandeling. In voorkomende gevallen kan slow release morfine of oxycodon tijdelijk rectaal worden toegediend indien de tabletten niet oraal kunnen worden ingenomen en de fentanylpleister niet kan worden toegepast.
- Beoordeel het effect van de behandeling met slow release opioïden na 24 uur. Hoog bij onvoldoende effect de dosering op in stappen van 50%.
Overwegingen
2008
Bij het maken van een keuze voor middelen, doseringen, doseringsinterval en toedieningsweg spelen de volgende factoren mede een rol:
- gebruiksgemak en praktische toepasbaarheid;
- ervaring met het middel en met de toedieningsweg ervan;
- farmacokinetische overwegingen;
- beschikbaarheid;
- kosten en vergoeding door de ziektekostenverzekering.
2019
In 2012 zijn aanbevelingen van de EAPC (Caraceni 2012) gepubliceerd over de behandeling van pijn bij patiënten met kanker, o.a. gebaseerd op de bovengenoemde reviews van Klepstad (2011) en Radbruch (2011).
De EAPC-richtlijn formuleert een zwakke aanbeveling dat zowel IR als SR opioïden kunnen worden gebruikt voor dosistitratie, aangevuld met IR opioïden zo nodig. Morfine, fentanyl, oxycodon of hydromorfon worden aanbevolen als eerste keuze opioïd (zwakke aanbeveling).
Klepstad (2011) adviseert een startdosis van 30 mg morfine/24 uur bij opioïdnaïeve patiënten. Hij geeft aan dat er geen onderbouwing is voor specifieke schema’s voor het ophogen van de dosis bij onvoldoende effect van opioïden.
De EAPC formuleerde de volgende aanbevelingen t.a.v. toedieningsweg:
- Rectale toediening van opioïden heeft niet de voorkeur (zwakke aanbeveling).
- Subcutane toediening van morfine, diamorfine (heroïne) en hydromorfon is de eerste keuze als orale of transdermale toediening niet mogelijk is (sterke aanbeveling).
- Intraveneuze toediening van opioïden is aangewezen bij contra-indicatie voor subcutane toediening, bijv. bij oedeem, slechte perifere circulatie of hoge volumina (sterke aanbeveling).
- Intraveneuze toediening van opioïden is aangewezen als een snel effect gewenst is (sterke aanbeveling).
- Maak gebruik van subcutane of intraveneuze toediening van opioïden als er onvoldoende controle wordt bereikt met orale of transdermale toediening (zwakke aanbeveling).
- Maak gebruik van Patient Controlled Anesthesia (PCA) bij patiënten die controle willen en kunnen hebben over toediening van doorbraakmedicatie (zwakke aanbeveling).
Op basis van de bovengenoemde reviews en de aanbevelingen van de EAPC hoeven de aanbevelingen uit 2008 niet gewijzigd te worden. De laatste twee aanbevelingen van de EAPC zijn toegevoegd.
In de richtlijn van 2008 werd aanbevolen om het effect van fentanyl transdermaal na 48 uur te beoordelen. Dit is niet in overeenstemming met de SmPC van fentanyl (https://www.geneesmiddeleninformatiebank.nl/smpc/h109417_smpc.pdf), waarin wordt aanbevolen om het effect van fentanyl transdermaal al na 24 uur te beoordelen. Mede gezien het feit dat binnen 24 uur een stabiele plasmaspiegel wordt bereikt (Oosten 2016; https://kennisbank.knmp.nl/article/Informatorium_Medicamentorum/S1374.html) is de aanbeveling voor het tijdstip van evaluatie van het effect van fentanyl transdermaal aangepast van 48 naar 24 uur.
In de praktijk wordt bij onvoldoende effect de dosering van sterkwerkende opioïden in stappen van 50% opgehoogd. Hoewel er geen evidentie voor is, is de werkgroep van mening dat dit in de praktijk goed voldoet. Hierover is een aanbeveling toegevoegd.
T.a.v. parenterale toediening van opioïden zijn inmiddels naast morfine ook oxycodon en hydromorfon ter beschikking gekomen. Deze middelen zijn toegevoegd bij de desbetreffende aanbeveling. Zie voor de keuze bij nierfunctiestoornissen (5.1) de desbetreffende uitgangsvraag.
Zie voor intrathecale en epidurale toediening van opioïden (4.5.3) de desbetreffende uitgangsvraag.
Onderbouwing
Achtergrond
Voor het behandelingsplan zijn keuze van het analgeticum, de toedieningsweg, de dosis en het doseerinterval van belang (Enting, 2001; De Graeff, 2006; Hanks, 2001; Levy, 2005; Quigley, 2006).
Morfine, oxycodon en hydromorfon zijn beschikbaar als orale 4 uur werkende preparaten en als 12 uur werkende preparaten met gereguleerde afgifte. Fentanyl is beschikbaar voor transdermale toediening (fentanylpleister). Bij de parenterale (subcutane of intraveneuze) toediening bestaat de meeste ervaring met morfine. De parenterale toedieningsvorm daarvan wordt veel gebruikt: het middel is goedkoop en is geregistreerd voor deze indicatie. Fentanyl, oxycodon, hydromorfon en methadon worden wel subcutaan of intraveneus toegediend, maar de ervaring hiermee is beperkt. Voor methadon geldt bovendien dat de parenterale toedieningsvorm moeilijk verkrijgbaar is en subcutane infusie nogal eens lokale irritatie geeft.
Voor de belangrijkste opioïden, morfine, hydromorfon, oxycodon en fentanyl, kan geen optimale en ook geen maximale dosis (ontbreken van plafondeffect) worden aangegeven. De vereiste dagdosering voor een voldoende analgesie kan tussen patiënten significant verschillen. Hoewel voor de meeste patiënten minder dan 240 mg oraal toegediende morfine per dag volstaat voor adequate pijncontrole, kunnen patiënten met kanker en ernstige pijn soms duizenden milligrammen morfine per dag nodig hebben.
Een adequate doortastende doseerstrategie is belangrijk om snelle analgesie te bereiken bij patiënten met pijn bij kanker (Davis, 2004; Enting, 2001; Levy, 2005). Titratie vindt in eerste instantie plaats door geplande dosisescalatie in vaste of variabele doseerintervallen, al dan niet voorafgegaan door een oplaaddosis van oraal of parenteraal toegediende opioïden. De dosis wordt opwaarts getitreerd totdat een voldoende analgetisch effect is bereikt of onacceptabele bijwerkingen optreden. Vanwege dit laatste kan soms in tweede instantie een dosisvermindering noodzakelijk zijn.
Bij het vaststellen van de doseerstrategie moet rekening worden gehouden met de halfwaardetijd (t1/2) van het opioïd (Enting, 2001; Levy, 2004). Het effect van een verandering van de dosering zal na vier- tot vijfmaal de t1/2 in de nieuwe evenwichtssituatie (‘steady state’) worden bereikt. Voor bijvoorbeeld morfine met t1/2 = 4 uur van de actieve metaboliet, zal dit na 16-20 uur optreden, maar voor methadon met t1/2 = 25 uur gemiddeld pas na vier tot vijf dagen.
Het analgetische effect van orale kortwerkende opioïden start binnen 30 minuten en houdt 4 uur aan. Wanneer bij gebruik hiervan de pijn binnen 4 uur terugkeert, gaat de voorkeur uit naar dosisverhoging. Verlaging van het doseerinterval tot 3 of 2 uur is onpraktisch en belastend.
Ook voor 12 uur werkende orale opioïden met gereguleerde afgifte wordt om deze reden dosisverhoging geprefereerd boven verlaging van het doseerinterval. Voor toepassing van 24 uur werkende preparaten met gereguleerde afgifte kan een analoge werkwijze worden gevolgd, dat wil zeggen dosisverhoging en niet verlagen van doseerinterval. Ook voor transdermaal fentanyl geldt dat bij onvoldoende analgesie gedurende 72 uur de dosis moet worden verhoogd.
Voor de intermitterende parenterale toediening van morfine en oxycodon geldt een doseerinterval van 3 tot 4 uur voor subcutane toediening en 2 tot 3 uur voor intraveneuze toediening.
De module van 2019 is een consensus-based update van de module van de NVA-richtlijn van 2008. Het literatuuronderzoek en de overwegingen worden gescheiden beschreven.
In 2008 kwam de werkgroep tot de volgende aanbevelingen:
- Bij toepassing van opioïden bij de behandeling van pijn bij patiënten met kanker moet worden gestart met een oraal of transdermaal toegediend opioïd. Indien een snel effect gewenst is, wordt gestart met subcutane of intraveneuze toediening van morfine.
- Indien wordt gekozen voor de orale toedieningsweg, wordt gestart met morfine, oxycodon of hydromorfon met vertraagde afgifte, aangevuld met een kortwerkend opioïd voor doorbraakpijn. Gebruikelijke startdoses bij opioïdnaïeve patiënten zijn: 2 dd 20 mg (2 dd 10 mg bij patiënten > 70 jaar) slow release morfine of 2 dd 10 mg slow release oxycodon (2 dd 5 mg bij patiënten > 70 jaar). Voor slow release hydromorfon is de laagst mogelijke startdosis 2 dd 4 mg, overeenkomend met 2 dd 30 mg slow release morfine.
- Indien wordt gekozen voor de transdermale toedieningsweg, wordt gestart met fentanyl, aangevuld met een kortwerkend opioïd voor doorbraakpijn. De gebruikelijke startdosis bij opioïdnaïeve patiënten is één pleister van 12 μg/ uur om de drie dagen.
- Rectale toediening van slow release morfine wordt niet aangeraden als onderhoudsbehandeling. In voorkomende gevallen kan slow release morfine tijdelijk rectaal worden toegediend indien de tabletten niet oraal kunnen worden ingenomen en de fentanylpleister niet kan worden toegepast.
- Het effect van de behandeling met opioïden kan worden beoordeeld bij het bereiken van de evenwichtssituatie na vier- tot vijfmaal de halfwaardetijd van het opioïd of de actieve metaboliet(en) daarvan. Voor de praktijk betekent dit dat het effect van oraal toegediend morfine, oxycodon en hydromorfon na 24 uur kan worden beoordeeld en van transdermaal toegediend fentanyl na 48 uur.
Conclusies / Summary of Findings
Deskundigen zijn van mening dat bij de medicamenteuze behandeling van pijn bij patiënten met kanker de orale of transdermale toedieningsweg voordelen heeft boven andere toedieningswegen (niveau 4).
(D: Enting 2001, De Graeff 2006, Hanks 2001, Levy 2005, Quigley 2006)
Het is aannemelijk dat de rectale toediening van slow release morfine even effectief is als orale toediening bij de behandeling van pijn bij patiënten met kanker (niveau 2).
(B: Babul 1998, Wilkinson 1992)
Er zijn aanwijzingen dat bij optimale dosistitratie van opioïden verbetering van de pijnklachten bij patiënten met kanker meestal binnen 24 uur wordt bereikt iniveau 3).
(C: Davis 2004)
Het is aannemelijk dat parenterale toediening van opioïden sneller tot adequate pijnstilling leidt dan orale toediening (niveau 2).
(A2: Harris 2003)
Het is aannemelijk dat dosistitratie met immediate release morfine niet tot snellere pijnstilling leidt bij patiënten met kanker dan dosistitratie met slow release morfine
(A2: Klepstad 2003)
Deskundigen zijn van mening dat het effect van opioïden op de pijn, het optreden van bijwerkingen en de hoeveelheid benodigde doorbraakmedicatie bepalend zijn voor optimale dosistitratie en snelheid ervan (niveau 4).
(D: Enting 2001, De Graeff 2006, Hanks 2001, Levy 2005, Quigley 2006)
Er zijn aanwijzingen dat het gebruik van opioïden bij patiënten met kanker en pijn niet leidt tot verslaving.
(C: Aronoff 2000, Porter 1980, Schug 1992)
Er is geen verschil in effectiviteit of bijwerkingen tussen rectale, subcutane en intraveneuze toediening van opioïden.
(Radbruch 2011)
Samenvatting literatuur
Tot 2007
Er is geen systematisch onderzoek verricht naar de voor- en nadelen van de verschillende toedieningswegen (oraal, rectaal, transdermaal, subcutaan, intramusculair, intraveneus, epiduraal of intrathecaal). Alle bestaande richtlijnen geven op basis van het gebruiksgemak in zijn algemeenheid de voorkeur aan de orale of transdermale toedieningsweg (Enting, 2001; De Graeff, 2006; Hanks, 2001; Levy, 2005; Quigley, 2006).
In twee onderzoeken (bij 10 respectievelijk 27 patiënten) werd orale toediening van slow release morfine vergeleken met rectale toediening van slow release morfine (Babul, 1998; Wilkinson, 1992). Bij geen van beide onderzoeken werd een verschil in pijnscores of gebruik van rescuemedicatie gevonden. Om praktische redenen heeft de rectale toedieningsweg niet de voorkeur bij chronisch gebruik.
Evenmin zijn er ’evidence-based’ richtlijnen voorhanden voor dosering en dosistitratie met optimaal klinisch effect en minimaal risico op bijwerkingen. In een systematische review over dosistitratie van oraal en parenteraal toegediende opioïden bij patiënten met kanker en pijn (Davis, 2004) zijn acht prospectieve onderzoeken geïncludeerd (waarvan twee gerandomiseerd (Harris, 2003; Klepstad, 2003)) en één retrospectief onderzoek.
De belangrijkste conclusie van deze review is dat de doseerfrequentie bepalend is voor de snelheid waarmee het analgetisch effect optreedt, onafhankelijk van de startdosis van het opioïd. In geen van de onderzoeken werd respiratoire depressie door opioïdgebruik gerapporteerd. De kwaliteit van de geïncludeerde onderzoeken liet echter te wensen over. Bij de meerderheid van de patiënten in de onderzoeken trad binnen 24 uur verbe-tering van de pijnklachten op. Verlichting van pijn werd het snelst bereikt met parente-rale (subcutane of intraveneuze) doseerschema’s (Harris, 2003). Er werd geen verschil gevonden in tijd tot adequate verlichting van pijn bij titratie met kortwerkende morfine versus titratie met morfine met gereguleerde afgifte (Klepstad, 2003).
Het enige recente onderzoek (niet opgenomen in de genoemde review) naar dosistitratie van opioïden bij kankerpijn biedt door methodologische beperkingen evenmin voldoende basis om een concreet protocol aan te bevelen (Wells, 2004).
Ondanks het ontbreken van eenduidige literatuurgegevens over dosistitratie geven diverse richtlijnen enkele vuistregels (Enting, 2001; De Graeff, 2006; Hanks, 2001; Levy, 2005; Quigley, 2006). Daarin wordt aanbevolen om bij drie of meer keer per dag gebruik van doorbraakmedicatie de onderhoudsdosering per dag te verhogen met ten minste de gebruikte dosering van de doorbraakmedicatie per dag. Verder wordt bij toepassing van oraal toegediende morfine voor ernstige pijn een dosisverhoging van 50-100% per dag en voor matige pijn een dosisverhoging van 25-50% per dag geadviseerd. Bij het optreden van bijwerkingen van een opioïd wordt gesuggereerd om een of twee doseringen van de onderhoudsbehandeling over te slaan, gevolgd door een 25-50% dosisreductie per dag. Er zijn aanwijzingen dat het gebruik van opioïden bij patiënten met kanker en pijn geen risico op verslaving met zich meebrengt, mits er geen sprake is van andere risicofactoren voor verslaving (Aronoff, 2000). Twee prospectieve onderzoeken bij 11.882 en 550 patiënten met kanker die werden behandeld met opioïden, lieten slechts vier respectievelijk één geval van verslaving zien (Porter, 1980; Schug, 1992).
Het ontbreken van een risico op verslaving impliceert echter niet dat er geen sprake is van lichamelijke afhankelijkheid bij langer gebruik van opioïden. Dit betekent dat het plotseling staken van opioïden gepaard kan gaan met onthoudingsverschijnselen. Om die reden geven enkele richtlijnen aan dat bij het effectief wegnemen van de oorzaak van de pijn of succesvolle blokkade van de pijntransmissie de dagdosering met 25-50% moet worden verlaagd op geleide van pijn, toepassing van doorbraakmedicatie en bijwerkingen van het opioïd om een onthoudingssyndroom te vermijden.
2007-2016
In 2011 verscheen een review van Klepstad met een review van methodes voor dosistitratie van opioïden (Klepstad 2011). Deze beschrijft 13 beschrijvende studies en 2 gerandomiseerde studies.
In 2010 verscheen eveneens een review van Radbruch over alternatieve toedieningswegen van opioïden (Radbruch 2011). Er werden 18 vergelijkende studies gevonden, waarbij geen verschillen in effectiviteit of bijwerkingen werden gevonden tussen rectale, subcutane en intraveneuze toediening van opioïden. Intraveneuze toediening van opioïden had een sneller effect dan rectale toediening.
Referenties
- Aronoff GM. Opioids in chronic pain management: is there a significant risk of addiction? Curr Rev Pain 2000; 6: 305-314.
- Babul N, Provencher L, Laberge F, Harsanyi Z, Moulin D. Comparative efficacy and safety of controlled-release morphine suppositories and tablets in cancer pain. J Clin Pharmacol 1998; 38: 74-81.
- Caraceni A, Hanks G, Kaasa S, et al. Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC. Lancet Oncol. 2012; 13: e58-68. doi: 10.1016/S1470-2045(12)70040-2.
- Davis MP, Weissman DE, Arnold RM. Opioid dose titration for severe cancer pain: a systematic evidence-based review. J Palliat Med 2004;7:462-468
- Davis MP, Walsh D, Lgman R, et al. Controverses in pharmacotherapy of pain management, Lancet Oncol 2005; 6: 696-704.
- De Graeff A, Verhagen EH, Besse TC, Crul BJP, Krol RJA. Richtlijn pijn. In: De Graeff A, Hesselmann GM, Krol RJA, Kuyper MB, Verhagen EH, Vollaard EJ. Palliatieve zorg. Richtlijnen voor de praktijk. Utrecht: Vereniging van Integrale Kankercentra, 2006, pp 565-621).
- Enting RH, Van der Rijt CCD, Wilms EB, Lieverse PJ, De Wit R, Sillevis Smitt PAE. Behandeling van pijn bij kanker met systemisch toegediende opioïden. Ned Tijdschr Geneesk 2001;145: 950-954.
- Hanks GW, De Conno F, Cherny N, Hanna M, Kalso E, McQuay HJ, et al. Morphine and alternative opioids in cancer pain: the EAPC recommendations. Br J Cancer 2001 84: 587-593.
- Harris JT, Suresh Kumar K, Rajagopal MR. Intravenous morphine for rapid control of severe cancer pain. Palliat Med 2003; 17: 248-256.
- Klepstad P, Kaasa S, Jystad A, Hval B, Borchgrevink PC. Immediate- or sustained-release morphine for dose finding during start of morphine to cancer patients: a randomized, double-blind trial. Pain 2003; 101: 193-198.
- Klepstad P, Kaasa S, Borchgrevink PC. Starting step III opioids for moderate to severe pain in cancer patients: dose titration: a systematic review. Palliat Med 2011; 25(5): 424-30.
- Levy MH, Samuel TA. Management of cancer pain. Semin Oncol 2005;32:179-193.
- Porter J, Jick H. Addiction rare in patients treated with narcotics. New Engl J Med 1980; 302:123.
- Oosten AW, Abrantes JA, Jonsson J, et al. Treatment with subcutaneous and transdermal fentanyl: results from a population oharmacokinetic study in cancer patients. Br J Pharmacol 2016; 72: 459-467.
- Quigley C. The role of opioids in cancer pain. BMJ 2005; 331: 825-829.
- Radbruch R, Trottenberg P, Elsner F, Kaasa S, Caraceni A. Systematic review on the role of alternative application routes for opioid treatment for moderate to severe cancer pain: An EAPC opioid guidelines project. Palliat Med 2011; 25: 578-596.
- Schug SA, Zech D, Grond S, Jung H, Meuser T, Stobbe B. A long-term survey of morphine in cancer pain patients. J Pain Stmptom Manage 1992; 7: 259-266.
- Wells N, Murphy B, Douglas S, et al. Establishing the safety and efficacy of an opioid titration protocol. Am J Hosp Palliat Care 2004;21:373-80.
- Wilkinson TJ, Robinson BA, Begg EJ, Duffull SB, Ravenscroft PJ, Schneider JJ. Pharmocokinetics and efficacy of rectal versus oral sustained-release morphine in cancer patients. Cancer Chemother Pharmacol 1992; 31: 251-254.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-11-2023
Actualisatie
Deze richtlijn is goedgekeurd op 6 december 2019. De Nederlandse Vereniging voor Anesthesiologie (NVA) bewaakt samen met betrokken verenigingen de houdbaarheid van deze (modules van de) richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. De geldigheidstermijn van de richtlijn is maximaal 5 jaar na vaststelling. Indien de richtlijn dan nog actueel wordt bevonden, wordt de geldigheidsduur van de richtlijn verlengd.
Houderschap richtlijn
De houder van de richtlijn (NVA) moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen.
IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
Een richtlijn is een kwaliteitsstandaard. Een kwaliteitsstandaard beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een kwaliteitsstandaard in het Register van Zorginstituut Nederland betekent dus niet noodzakelijkerwijs dat de in de kwaliteitsstandaard beschreven zorg verzekerde zorg is.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Algemene gegevens
Autoriserende/instemmende en bij de werkgroep betrokken verenigingen:
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Anesthesiologie
- Nederlandse Vereniging voor Klinische Geriatrie
- Nederlandse Vereniging voor Neurologie
- Vereniging voor Specialisten Ouderengeneeskunde
- Verpleegkundigen en Verzorgenden Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse vereniging voor professionele palliatieve zorg
Financiering
Deze richtlijn c.q. module is gefinancierd door IKNL. De inhoud van de richtlijn c.q. module is niet beïnvloed door de financierende instantie.
Procesbegeleiding
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence-based richtlijnen voor de oncologische en palliatieve zorg tot een van haar primaire taken. IKNL werkt hierbij conform de daarvoor geldende (inter)nationale kwaliteitscriteria. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen.
Doel en doelgroep
Doel
Een richtlijn geeft aanbevelingen ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek en consensus. De richtlijn 'Pijn’ geeft aanbevelingen over begeleiding en behandeling van patiënten met pijn bij kanker (zowel in de curatieve als de palliatieve fase) en beoogt hiermee de kwaliteit van de zorgverlening te verbeteren.
Hoewel de evidentie alleen is verzameld voor de diagnostiek en behandeling van pijn bij patiënten met kanker zijn de aanbevelingen ook grotendeels van toepassing voor patiënten met andere levensbedreigende aandoeningen.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de zorg voor patiënten met pijn zoals huisartsen, specialisten ouderengeneeskunde, medisch specialisten, apothekers, verpleegkundigen, verzorgenden, verpleegkundig specialisten, physician assistants, fysiotherapeuten, medisch maatschappelijk werkers, geestelijk verzorgers, GZ- en klinisch psychologen.
Indien in de richtlijn wordt gesproken over zorgverleners rondom de patiënt met pijn, worden, afhankelijk van de specifieke situatie van de patiënt, alle bovengenoemde professionals bedoeld.
De richtlijn is ook relevant voor zorgverleners van andere disciplines en vrijwilligers die werkzaam zijn in de palliatieve fase. De multidimensionele benadering van de patiënt in de palliatieve fase vergt immers een gezamenlijke, interdisciplinaire verantwoordelijkheid, zoals ook in het Kwaliteitskader palliatieve zorg Nederland is beschreven.
Samenstelling werkgroep
Alle werkgroepleden en klankbordleden zijn afgevaardigd namens wetenschappelijke, beroeps- en patiëntenverenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
Het patiëntenperspectief is vertegenwoordigd door Patiëntenfederatie Nederland.
Bij de uitvoering van het evidence-based literatuuronderzoek is de kaderopleiding Palliatieve Zorg en een literatuuronderzoeker van IKNL en de voorzitter van de richtlijnwerkgroep betrokken geweest.
Werkgroepleden
- Mw. prof. dr. M.H.J. van den Beuken-van Everdingen, internist, NIV
- Dhr. dr. M.J.M.M. Giezeman †, anesthesioloog, NVA
- Dhr. dr. A. de Graeff (voorzitter), internist-oncoloog en hospice-arts, Palliactief
- Mw. drs. H. Klaren, klinisch geriater, NVKG
- Mw. B. Kramp, verpleegkundig specialist, V&VN
- Dhr. drs. M. Martens, specialist ouderengeneeskunde en consulent palliatieve zorg, Verenso
- Mw. drs. M.J. Oortman, huisarts, SCEN-arts, palliatief consulent en hospice-arts, NHG
- Dhr. drs. P. Oosterhof, poliklinisch apotheker, NVZA
- Mw. prof.dr. A.K.L. Reyners, internist, NIV
- Mw. M. Schielke, verpleegkundig pijnspecialist, V&VN
- Mw. drs. M.C. Sieders, huisarts (waarnemend), SCEN-arts, palliatief consulent, NHG
- Dhr. dr. M.F.M. Wagemans, anesthesioloog, NVA
Klankbordleden
- Dhr. prof. dr. K.C.P. Vissers, anesthesioloog, NVA
- Mw. drs. L. Bellersen, cardioloog, NVVC
- Mw. drs. B.A. Brouwer, neuroloog/pijnspecialist NVN/pijnspecialist
- Mw. M. Geerts, verpleegkundig specialist, V&VN
- Dhr. drs. S.M. de Hosson, longarts, NVALT
- Mw. drs. S. Visser, apotheker, KNMP
- Mw. drs. R. Lammers, beleidsmedewerker, Patiëntenfederatie Nederland
Ondersteuning
- Mw. T.T.M. Bluemink-Holkenborg, secretaresse, IKNL
- Mw. drs. M.G. Gilsing, adviseur (richtlijnen) palliatieve zorg, IKNL
- Mw. dr. O.L. van der Hel, literatuuronderzoeker, IKNL
- Prof.dr. J Kleijnen, epidemioloog, literatuuronderzoeker MUMC Maastricht/York
- Mw. L.K. Liu, secretaresse, IKNL
- Dhr. dr. R. Vernooij (i.s.m. de kaderopleiding Palliatieve Zorg), literatuuronderzoeker, IKNL
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke en beroepsverenigingen.
Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld. De bevindingen zijn schriftelijk vastgelegd in de belangenverklaring en opvraagbaar via info@iknl.nl.
Inbreng patiëntenperspectief
De input van patiëntvertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt. Patiëntenfederatie Nederland is in het gehele richtlijntraject meegenomen en heeft plaats gehad in de klankbordgroep (zie ook de Samenstelling van de werkgroep).
Tijdens de landelijke consultatiefase heeft Patiëntenfederatie Nederland commentaar gegeven op de conceptrichtlijn en patiënten/naasten geraadpleegd via een referentenpanel voor onderzoeksaanvragen op het gebied van palliatieve zorg. Ook heeft de Patiëntenfederatie Nederland - naast NFK, nog andere patiëntenorganisaties benaderd voor het leveren van commentaar.
Patiëntenfederatie Nederland heeft tot slot de richtlijn goedgekeurd.
Patiënteninformatie gebaseerd op de richtlijn is opgesteld en gepubliceerd op de daarvoor relevante sites (o.a. zie link https://www.kanker.nl/gevolgen-van-kanker/pijn/wat-is/pijn-bij-kanker#show-menu).
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de zorgpraktijk, inclusief borging daarvan.
Als onderdeel van elke richtlijn stelt IKNL samen met de richtlijnwerkgroep een implementatieplan op en ondersteunt een aantal basis-activiteiten voor de implementatie. De verantwoordelijkheid voor verdere implementatie-activiteiten ligt bij de eigenaar van de richtlijn (en het veld).
Activiteiten en interventies voor verspreiding en implementatie kunnen zowel op landelijk als regionaal niveau plaatsvinden. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor en door de verschillende disciplines.
Werkwijze
In de huidige richtlijn zijn de NVA-richtlijn van 2015 en de richtlijn 'Pijn' van Pallialine samengevoegd. Daarbij zijn de onderdelen van de NVA-richtlijn, die in 2015 niet zijn herzien (en waarbij de teksten van de NVA-versie van 2008 onveranderd zijn gehandhaafd) grotendeels evidence-based (op basis van aanvullend literatuuronderzoek) aangepast en aangevuld met evidence-based en consensus-based teksten over de diagnostiek en behandeling van pijn bij patiënten met gevorderde stadia van COPD of hartfalen. De onderdelen van de NVA-richtlijn die in 2015 zijn herzien zijn onveranderd overgenomen (zie ook de Algemene inleiding).
De bedoeling is om te komen tot een integrale en actuele richtlijn over de diagnostiek en behandeling van pijn bij zowel patiënten met kanker (in de curatieve én de palliatieve fase) als bij patiënten met COPD of hartfalen.
Voor de evidence-based (herzieningen van) modules zijn de aanbevelingen voorzien van een gradering met cijfers en letters om de verhouding tussen de sterkte van de aanbeveling en de kwaliteit van de evidence weer te geven (zie onderstaande tabel). Deze werkwijze is gebaseerd op de methodiek zoals voorgesteld door de GRADE working group (zie http://www.gradeworkinggroup.org).
|
Gradering van aanbevelingen |
|
|
Sterkte van de aanbeveling |
Cijfer |
|
Sterke aanbeveling |
1 |
|
Zwakke aanbeveling |
2 |
|
Kwaliteit van de evidence |
Letter |
|
Hoog |
A |
|
Matig |
B |
|
Laag |
C |
|
Zeer laag |
D |
De richtlijnteksten die gebaseerd zijn op uitgangsvragen, zijn opgebouwd volgens het volgende vaste stramien: uitgangsvraag en aanbevelingen, literatuur, conclusies, overwegingen en referenties. De evidence tabellen staan bij de desbetreffende modules. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
De uitgangsvragen zijn óf evidence-based (via de GRADE methodiek) óf consensus-based (zonder systematisch literatuuronderzoek) uitgewerkt.
De GRADE-methodiek
Selectie
Naast de selectie van studies op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- Gerandomiseerde gecontroleerde studies (RCT's)
- Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
- De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
- De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen’
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.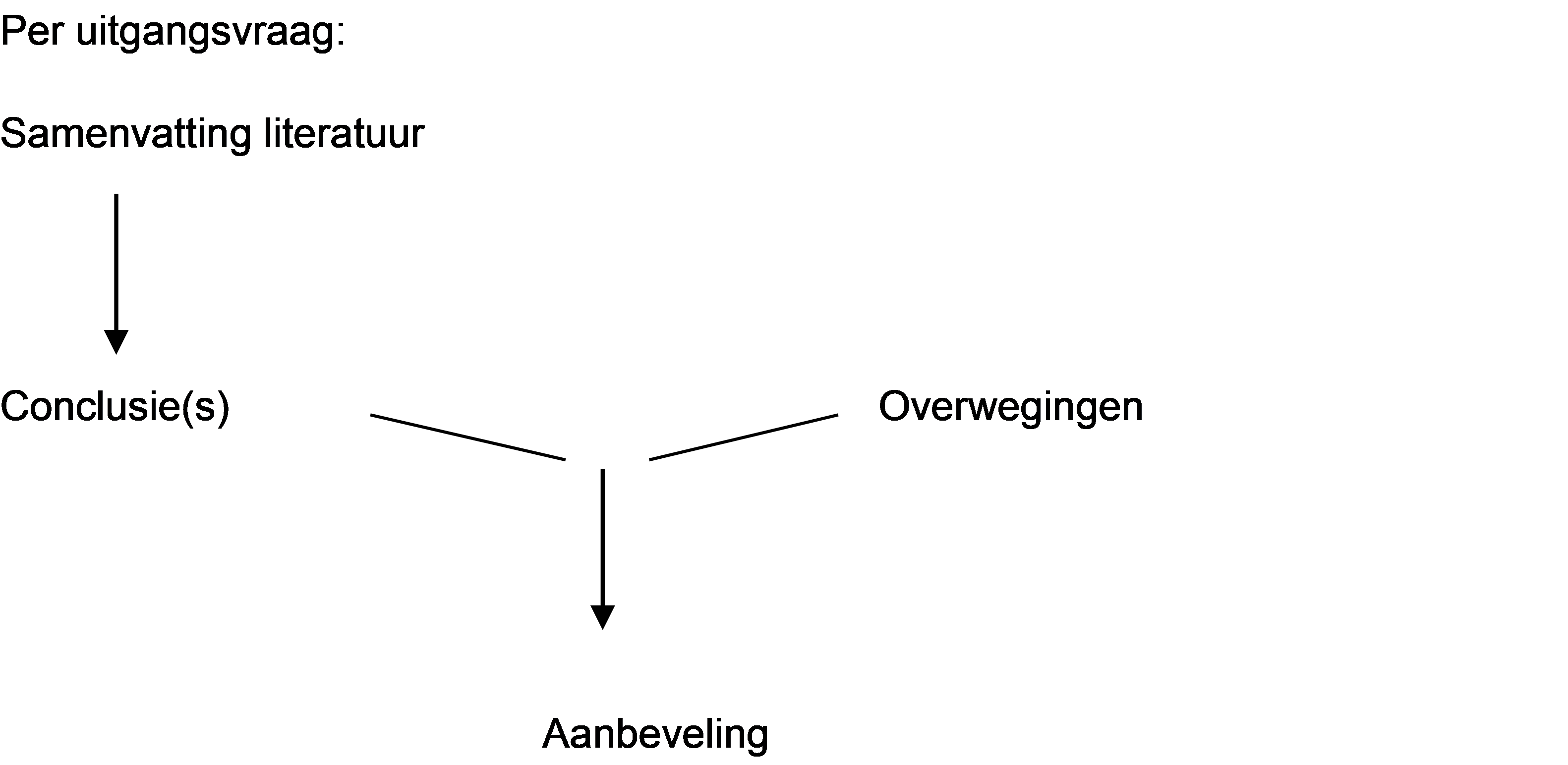
Figuur 1. Van bewijs naar aanbeveling
Bij het schrijven van de overwegingen zijn onderstaande zaken in acht genomen.
- Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
Toelichting:
- Kennis en ervaring met technieken/therapieën.
- Risico’s die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient’ plaats te vinden (sterk) of wel ‘kan worden overwogen’ (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
- Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling. - Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Maatschappelijk perspectief
(Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties)
Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
- Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin – voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Doe/geef etc. (of er dient…. te worden gegeven/gedaan)
- Zwakke/conditionele aanbevelingen: Overweeg….. te geven/te doen.
Consensus-based methodiek
Naast de evidence-based uitwerking (GRADE) zijn er ook uitgangsvragen via de consensus-based methodiek uitgewerkt. Hierbij zijn de richtlijnteksten ook gebaseerd op evidence, maar is er geen systematisch literatuuronderzoek gedaan en zijn de gevonden studies niet methodologisch beoordeeld.
