Doorbraakpijn bij pijn bij kanker
Uitgangsvraag
Op welke wijze dient doorbraakpijn bij patiënten met kanker met opioïden te worden behandeld?
Aanbeveling
Bij doorbraakpijn bij patiënten met kanker:
- Zorg voor goede controle van de achtergrondpijn. Documenteer de reden, de soort, de dosering en de frequentie van de doorbraakmedicatie. Pas in principe de dosering van de onderhoudsmedicatie aan als er meer dan 3x per 24 uur doorbraakmedicatie voor onvoorspelbare doorbraakpijn noodzakelijk is (1C).
- Behandel (indien mogelijk) de oorzaak van de doorbraakpijn (bijvoorbeeld met radiotherapie of systemische therapie) (1C).
- Vermijd of behandel (indien mogelijk) uitlokkende factoren van de doorbraakpijn (1C).
- Combineer de medicamenteuze behandeling van doorbraakpijn met niet-medicamenteuze behandeling en/of (indien mogelijk en zinvol) invasieve technieken (1C).
- Start bij onvoorspelbare doorbraakpijn met een snelwerkend fentanylpreparaat (Rapid Onset Opioid, ROO). Schrijf een immediate release (IR) opioïd voor als het effect van het snelwerkend fentanylpreparaat onvoldoende lang aanhoudt (1B).
- Kies bij voorspelbare doorbraakpijn voor een IR opioïd of een snelwerkend fentanylpreparaat; houd bij het tijdstip van toediening rekening met de tijd die nodig is voor het optreden van het pijnstillende effect (1C).
- Laat u bij de keuze van het soort snelwerkende fentanylpreparaat of van het soort IR opioïd primair leiden door de voorkeur, mogelijkheden en beperkingen van de patiënt; weeg zo nodig de kosten mee bij de keuze (1B).
- Start bij een snelwerkend fentanylpreparaat met de laagste dosering (met uitzondering van het sublinguale tablet van 67 microgram) en titreer de dosis aan de hand van het effect op de doorbraakpijn (1B).
- Start bij een IR opioïd met 1/6 van de (equivalente) dagdosering van het opioïd (1C).
Overwegingen
Bij de keuze van medicatie voor doorbraakpijn spelen de volgende factoren een rol:
- effectiviteit;
- farmacokinetisch profiel van het middel (vooral snelheid en duur van werking) in relatie tot het type en de duur van de doorbraakpijn bij de individuele patiënt;
- bijwerkingen en risico's;
- gebruiksgemak, tevredenheid en voorkeur van de patiënt;
- kosten.
Effectiviteit
De ROO's zijn bewezen effectiever (in de zin van een sterkere en snellere afname van pijn) dan placebo en leiden tot een klinisch relevante afname van de pijnintensiteit. Hoewel de IR opioïden niet direct vergeleken zijn met placebo is er geen twijfel over de effectiviteit van deze middelen. IR opioïden leiden (uiteindelijk) ook tot een klinisch relevante afname van de pijnintensiteit.
De interpretatie van de pijnscores na toediening van de ROO's en de IR opioïden wordt bemoeilijkt door a) een mogelijk placebo-effect van deze middelen, en b) het spontane beloop van doorbraakpijn, waardoor een daling van de pijnintensiteit niet noodzakelijk wijst op een therapeutisch effect van het gegeven middel (immers, ook zonder medicatie had de pijnintensiteit op het desbetreffende tijdstip kunnen afnemen door het spontane beloop van de doorbraakpijn).
Vijf studies (zie eerder voor de beschrijving) onderzochten de effectiviteit van een snelwerkend fentanylpreparaat op een termijn van weken tot maanden (Nalamanchu, 2011; Payne, 2001; Portenoy, 2010; Taylor, 2013; Weinstein, 2009). Alle studies waren open-label, multicentre studies. In de studie van Payne (2001) traden 38.595 episodes met doorbraakpijn op, waarvan ongeveer 92% succesvol behandeld werden met de buccale stick. Er was geen trend voor afname van de effectiviteit in de loop van de tijd. In bovengenoemde studies staakte 2 tot 4% van de patiënten het snelwerkende fentanylpreparaat vanwege onvoldoende of geen effect.
Voor de ROOs geldt evenzeer als voor de oraal toegediende immediate release opioiden dat in principe de onderhoudsdosering moet worden aangepast als er meer dan 3x/24 uur een ROO gebruikt wordt voor onvoorspelbare doorbraakpijn.
Farmacokinetisch profiel
Hoewel de direct vergelijkende studies een minder uitgesproken verschil laten zien, suggereert indirecte vergelijking sterk dat de ROOs significant sneller werker dan de IR opioïden. Het verschil zit in de orde van grootte van 15 minuten. Ervan uitgaande dat patiënten prijs stellen op een snel effect van doorbraakmedicatie is dit een voordeel van ROO's ten opzichte van IR opioïden bij onvoorspelbare doorbraakpijn. Voor voorspelbare doorbraakpijn geldt dit voordeel niet, omdat de IR opioïden ruim tevoren gegeven kunnen worden (bijvoorbeeld 30 tot 40 minuten voor de verzorging).
De kortere duur van de werking van de ROOs kan zowel een voordeel zijn als een nadeel ten opzichte van de IR opioïden, afhankelijk van de duur van de doorbraakpijn. Bij kortdurende (<1 uur) doorbraakpijn is de kortere werkingsduur van de ROO's een voordeel omdat de patiënt niet onnodig lang wordt blootgesteld aan het opioïd (waarbij hij of zij bijwerkingen kan ervaren op een moment dat er geen therapeutisch effect meer noodzakelijk is). Anderzijds kan het bij langdurige doorbraakpijn voorkomen dat een ROO al is uitgewerkt terwijl de doorbraakpijn nog niet is verdwenen.
De kenmerken van de doorbraakpijn bij de individuele patiënt zijn derhalve een belangrijke overweging bij de keuze tussen een ROO of een IR opioïd.
Bijwerkingen en risico's
Hoewel er geen goede directe vergelijkende studies zijn, is er op basis van niet- vergelijkend onderzoek geen reden om te veronderstellen dat de ROO's en de IR opioïden verschillen in frequentie, type of ernst van bijwerkingen. Minder dan 5% van de patiënten staakt een snelwerkend fentanylpreparaat vanwege bijwerkingen (Nalamachu, 2011; Payne, 2001; Portenoy, 2010; Taylor, 2013; Weinstein, 2009).
De werkgroep hoort geluiden op de werkvloer dat er soms sprake is van misbruik van ROO's. Het snelle effect ervan zou hieraan kunnen bijdragen. In de literatuur zijn er incidentele meldingen van misbruik en aberrant medicatiegedrag bij gebruik van ROO's door patiënten met kanker (Granata, 2014; Passik, 2010; Nunez-Olarte, 2011). Dit is echter niet structureel onderzocht. In de studies met lange follow-up (Payne, 2001; Taylor, 2013; Weinstein, 2009) wordt geen melding gemaakt van misbruik.
De werkgroep vindt de kans op misbruik geen overweging bij de keuze van een middel voor doorbraakpijn, maar benadrukt wel het belang van goede informatie en controle van het juiste gebruik ervan.
Gebruiksgemak, tevredenheid en voorkeur van de patiënt
Een aantal studies heeft het gebruiksgemak van snelwerkende opioïden en de voorkeur van patiënten voor een specifiek middel onderzocht.
Mercadante (2009) verrichtte een gerandomiseerde, open-label crossover studie waarbij de fentanyl neusspray werd vergeleken met de buccale stick. 77,4% van de 86 patiënten, die de studie voltooiden had een voorkeur voor de neusspray en 22,6% een voorkeur voor de stick. 90,1% van de patiënten vond de neusspray (erg) gemakkelijk in het gebruik en 39,8% vond de stick (erg) gemakkelijk.
England (2011) onderzocht het gebruiksgemak van een sublinguale tablet, buccale tablet en neusspray zonder werkzame stof in een cross-over design bij 30 patiënten met kanker, die doorbraakmedicatie gebruikten (22 IR morfine, 7 IR oxycodon en 1 s.c. morfine). De toegankelijkheid van de verpakking, het gebruiksgemak, de smaak en het algemene oordeel werden gescoord op een schaal van 1 (zeer positief) tot 7 (zeer negatief). Zie tabel 4. Beperkingen van deze studie waren het kleine aantal patiënten, het ontbreken van blindering en het feit dat de beoordeling van de eigen medicatie gebaseerd was op herinnering.
Tabel 4. Aspecten van verschillende toedieningsvormen van ROO's
|
Aspect |
Eigen medicatie |
Sublinguaal tablet |
Buccaal tablet |
Neusspray |
p-waarde |
|
Toegankelijkheid verpakking |
3(2-6)1 |
5 (2-7) |
5 (3-7) |
7 (7-7) |
<0.01 |
|
Gebruiksgemak |
1 (1-2) |
1 (1-2) |
2 (1-4) |
2 (2-3) |
<0.01 |
|
Smaak |
4 (2-4) |
2 (2-3) |
4 (2-6) |
4 (2-4) |
0.01 |
|
Algemeen oordeel |
2 (1-2) |
3 (1-4) |
4 (4-6) |
4 (2-6) |
<0.01 |
1 Mediane score (range); een lage score impliceert een betere beoordeling
Walker onderzocht door middel van een vragenlijst bij 100 patiënten met kanker in Engeland welke toedieningsweg ze acceptabel vonden voor milde tot matige pijn en voor ernstige pijn (Walker, 2003). Zie tabel 5.
Tabel 5. Bezwaren van patiënten tegen toedieningswegen van snelwerkende opioïden
|
Toedieningsweg |
Ervaring met toedieninsweg |
Aanvaardbaar milde/matige pijn |
Aanvaardbaar voor ernstige pijn? |
|||||
|
Ja |
Mogelijk |
Nee |
Ja |
Mogelijk |
Nee |
|||
|
Oraal |
1001 |
97 |
1 |
2 |
88 |
4 |
8 |
|
|
Rectaal |
58 |
24 |
19 |
57 |
48 |
10 |
42 |
|
|
Intranasaal |
16 |
50 |
18 |
32 |
68 |
14 |
18 |
|
|
Sublinguaal |
32 |
63 |
19 |
18 |
75 |
11 |
14 |
|
|
Buccaal |
2 |
44 |
21 |
35 |
63 |
12 |
25 |
|
|
Inhalatie |
39 |
60 |
19 |
21 |
75 |
9 |
16 |
|
|
Subcutaan |
66 |
52 |
20 |
28 |
87 |
8 |
5 |
|
|
Intramusculair |
63 |
33 |
22 |
45 |
76 |
12 |
12 |
|
|
Intraveneus |
73 |
38 |
23 |
39 |
83 |
8 |
9 |
|
1 Alle getallen in procenten
In twee studies werd aan patiënten met kanker en doorbraakpijn gevraagd of ze behandeld zouden willen worden met oromucosaal of intranasaal toegediende middelen voor doorbraakpijn (Davies, 2011; Bedard, 2013). Een deel van de patiënten gaf aan dat graag te willen, maar een ander deel gaf bezwaren aan, vooral op grond van eerdere ervaringen. In de studie van Nalamachu (2011) was 77% van de patiënten (zeer) tevreden over het sublinguale fentanyltablet.
Op grond van de literatuur kan (vanwege het beperkte aantal studies en de zeer lage kwaliteit ervan) geen voorkeur worden uitgesproken voor een specifieke toedieningsvorm van de ROO’s. De voorkeur, eerdere ervaringen, en mogelijkheden en beperkingen van patiënten dienen leidend te zijn bij een keuze.
Velasquez Rivera vergeleek de fentanyl sublinguale tablet met IR morfine in een dubbelblinde, vergelijkende (maar niet gerandomiseerde) studie bij patiënten met kanker (N=40). Op de 3e, 7e, 15e en 30e dag hielden de patiënten een dagboek bij, waarin ze aangaven hoe snel het pijnstillend effect van de doorbraakmedicatie optrad. Ze gaven tevens aan hoe tevreden ze waren over de doorbraakmedicatie. 65% van de patiënten was zeer tevreden over de sublinguale tablet en 35% tevreden. Voor IR morfine bedroegen de percentages 10% en 55%.
Kosten
In de keuze voor een middel van doorbraakpijn zal het kostenaspect meegewogen (moeten) worden. De kosten van de IR opioïden zijn immers beduidend lager dan die van de ROO's. De kosten per toediening voor de goedkoopste vormen van IR morfine en oxycodon (de in Nederland meest gebruikte IR opioïden voor doorbraakpijn) bedragen (september 2014) minder dan €0,30 per toediening, terwijl de kosten van de ROO's (afhankelijk van soort en soms van dosering) in de orde van grootte van €3,- tot €6,- per toediening bedragen.
Het is denkbaar dat een betere controle van doorbraakpijn leidt tot minder bezoek aan huisarts en polikliniek en minder ziekenhuisopnames. Als de ROO's een beter effect hebben op doorbraakpijn, zouden ze indirect kunnen leiden tot kostenbesparing. Een studie in de Zweedse setting suggereert een positieve kosteneffectiviteitsratio van fentanyl neusspray vergeleken met fentanyl buccale tablet en fentanyl buccale stick (Vissers, 2011). Er is echter onvoldoende evidentie om definitieve conclusies over de voorkeur voor ROO’s te kunnen trekken op basis van kosteneffectiviteitsdata (Kuo, 2013).
Aanbevelingen in bestaande richtlijnen
Verschillende richtlijnen geven aanbevelingen voor de behandeling van doorbraakpijn bij patiënten met kanker (Davies, 2009;, Caraceni, 2012 en 2013;, European Oncology Nursing Society, 2013).
In deze richtlijnen worden de volgende aanbevelingen geformuleerd:
- zorg voor goede controle van de achtergrondpijn;
- doe bij iedere patiënt een zorgvuldige analyse van de kenmerken van zijn of haar doorbraakpijn;
- documenteer de reden, de soort, de dosering en de frequentie van de doorbraakmedicatie;
- hoog de dosering van de onderhoudsbehandeling op als er meer dan drie keer per dag doorbraakmedicatie wordt ingenomen voor onvoorspelbare doorbraakpijn;
- behandel, indien mogelijk, de oorzaak van de doorbraakpijn (bijv. door middel van radiotherapie of systeemtherapie);
- vermijd of behandel uitlokkende factoren voor doorbraakpijn;
- maak gebruik van niet-medicamenteuze maatregelen (massage, warmte, koude, afleiding, ontspanningsoefeningen);
- overweeg het gebruik van invasieve technieken, zoals zenuwblokkades of neuromodulatie;
- start met de laagste dosering van de ROOs en titreer de dosering aan de hand van het effect;
- geef bij gebruik van een IR opioïd per keer 1/6e van de (equivalente) dagdosering;
- geef bij voorspelbare doorbraakpijn een ROO of een IR opioïd en houd daarbij rekening met de tijd die nodig is voor een effect op de pijn;
- kies bij onvoorspelbare doorbraakpijn voor een ROO als een snel en kortdurend effect is gewenst en voor een IR opioïd als dat niet het geval is;
- kies voor intraveneuze toediening (mits haalbaar en gewenst) van een opioïd als een zeer snel effect gewenst is.
Onderbouwing
Achtergrond
Doorbraakpijn kan worden gedefinieerd als 'een voorbijgaande toename van pijn, die spontaan optreedt of optreedt als gevolg van een specifieke, voorspelbare of onvoorspelbare factor, ondanks relatief stabiele en voldoende gereguleerde achtergrondpijn' (Davies, 2009).
Doorbraakpijn wordt gezien bij 59% (range 40 tot 80%) van de patiënten met pijn bij kanker en heeft een grote impact op de kwaliteit van leven (Deandrea, 2014). Er wordt onderscheid gemaakt tussen spontane doorbraakpijn (42 tot 44% van alle gevallen van doorbraakpijn bij kanker), incidente doorbraakpijn (gerelateerd aan een aanwijsbare uitlokkende factor, 39 tot 44%) en mengvormen (15 tot 17%) (Davies, 2011). Bij incidente doorbraakpijn wordt onderscheid gemaakt tussen voorspelbare en onvoorspelbare doorbraakpijn.
De behandeling van doorbraakpijn bestaat uit (European Oncology Nursing Society, 2013):
- behandeling of vermijden van oorzakelijke en uitlokkende factoren;
- niet-medicamenteuze symptomatische behandeling;
- medicamenteuze symptomatische behandeling.
Bij deze uitgangsvraag wordt specifiek ingegaan op de medicamenteuze behandeling van doorbraakpijn met behulp van snelwerkende opioïden. Daarbij wordt onderscheid gemaakt tussen oraal (immediate release (IR)), subcutaan of intraveneus toegediend morfine, oxycodon en hydromorfon en sublinguaal toegediend buprenorfine enerzijds en snelwerkende fentanylpreparaten (rapid onset opioids, ROO’s) anderzijds. ROO's worden toegediend via het slijmvlies van de mond (als buccale stick, buccaal tablet, buccale film of sublinguaal tablet) of als neusspray. ROO's werken sneller dan oraal toegediende opioïden, omdat ze niet via het maagdarmkanaal in het bloed hoeven te worden opgenomen.
Het doel van deze uitgangsvraag is om vast te stellen of er bij de behandeling van doorbraakpijn bij patiënten met kanker een voorkeur is voor één van bovengenoemde (soort) geneesmiddelen op basis van effectiviteit, snelheid van werking, bijwerkingen en/of gebruiksgemak.
Conclusies
Vraagstelling A: Snelwerkend fentanylpreparaat versus placebo of ander snelwerkend opioïd of niet-gerandomiseerde studies met follow-up van minimaal een maand.
Verschil in PID: fentanyl neusspray versus placebo.
Er is bewijs van hoge kwaliteit dat fentanyl neusspray op 10, 15, 20, 30, 40 en 60 minuten na toediening een sterkere reductie van de pijnintensiteit geeft dan een placebo (hoog GRADE).
(Kress, 2009; Zeppetella, 2013; Zeppetella, 2014)
Verschil in PID: fentanyl pectine neusspray versus placebo.
Er is bewijs van matige kwaliteit dat fentanyl pectine neusspray op 15, 30, 45 en 60 minuten na toediening een sterkere reductie van de pijnintensiteit geeft dan een placebo (matig GRADE).
(Portenoy, 2010; Zeppetella, 2013; Zeppetella, 2014)
Verschil in PID: fentanyl sublinguale tabletten versus placebo.
Er is bewijs van matige kwaliteit dat fentanyl sublinguale tabletten op 30, 45 en 60 minuten na toediening een sterkere reductie van de pijnintensiteit geven dan een placebo (matig GRADE).
(Novotna, 2014; Rauck, 2009; Zeppetella, 2013; Zeppetella, 2014)
Verschil in PID: fentanyl buccale oplosbare film versus placebo.
Er is bewijs van matige kwaliteit dat fentanyl buccale oplosbare film op 30, 45 en 60 minuten na toediening een sterkere reductie van de pijnintensiteit geeft dan een placebo (mtig GRADE).
(Rauck, 2010; Zeppetella, 2013; Zeppetella, 2014)
Verschil in PID; fentanyl buccale tabletten versus placebo.
Er is bewijs van matige kwaliteit dat fentanyl buccale tabletten op 10, 15, 30, 45 en 60 minuten na toediening een sterkere reductie van de pijnintensiteit geven dan een placebo (matig GRADE).
(Kosugi, 2013; Slatkin, 2007; Zeppetella, 2013; Zeppetella, 2014)
Verschil in PID; fentanyl buccale stick (OTFC) versus placebo.
Er is bewijs van matige kwaliteit dat fentanyl buccale stick (OTFC) op 15, 30, 45 en 60 minuten na toediening een sterkere reductie van de pijnintensiteit geeft dan een placebo (matig GRADE).
(Farrar, 1998; Zeppetella, 2013; Zeppetella, 2014)
Verschil in PID; IR morfine versus placebo.
Er is bewijs van zeer lage kwaliteit dat IR morfine op 45 en 60 minuten na toediening een sterkere reductie van de pijnintensiteit geeft dan een placebo (zeer laag GRADE).
(Zeppetella, 2014)
Verschil in PID; fentanyl neusspray versus fentanyl buccale stick.
Er is bewijs van zeer lage kwaliteit dat fentanyl neusspray op 5, 10, 15, 20, 30 en 60 minuten na toediening een sterkere reductie van de pijnintensiteit geeft dan de fentanyl buccale stick (zeer laag GRADE).
(Mercadante, 2009)
Verschil in PID; fentanyl buccale stick (OTFC) versus oraal toegediend IR morfine.
Er is bewijs van matige kwaliteit dat de fentanyl buccale stick (OTFC) op 15, 30, 45 en 60 minuten na toediening een sterkere reductie van de pijnintensiteit geven dan oraal toegediend IR morfine (matig GRADE).
(Coluzzi, 2001; Zeppetella, 2013; Zeppetella, 2014)
Verschil in PID; fentanyl pectine neusspray versus oraal toegediend IR morfine.
Er is bewijs van zeer lage kwaliteit dat de fentanyl pectine neusspray op 15, 30, 45 en 60 minuten na toediening een sterkere reductie van de pijnintensiteit geven dan oraal toegediend IR morfine (zeer laag GRADE).
(Fallon, 2011; Zeppetella, 2013; Zeppetella, 2014)
Verschil in PID: fentanyl buccale stick (OTFC) versus intraveneus toegediend morfine.
Er is bewijs van zeer lage kwaliteit dat de fentanyl buccale stick op 15 minuten na toediening een minder sterkere reductie van de pijnintensiteit geeft dan intraveneus toegediend morfine (zeer laag GRADE).
(Mercadante, 2007)
Snelheid van werking: snelwerkende fentanylpreparaten versus placebo.
Er is bewijs van matige kwaliteit dat de snelwerkende fentanylpreparaten sneller een klinisch relevante pijnverlichting geven dan placebo (matig GRADE).
(Farrar, 1998; Kosugi, 2013; Kress, 2009; Novotna, 2014; Portenoy, 2009 en 2010; Rauck, 2009 en 2010; Slatkin, 2007)
Snelheid van werking: fentanyl neusspray versus fentanyl buccale stick (OTFC).
Er is bewijs van zeer lage kwaliteit dat de fentanyl neusspray sneller een klinisch relevante pijnverlichting geeft dan de fentanyl buccale stick (zeer laag GRADE).
(Mercadante, 2009)
Snelheid van werking: fentanyl buccale stick versus IR morfine.
Er is bewijs van matige kwaliteit dat de fentanyl buccale stick sneller een klinisch relevante pijnverlichting geeft dan IR morfine (matig GRADE).
(Coluzzi, 2001; Zeppetella, 2013; Zeppetella, 2014)
Snelheid van werking: fentanyl pectine neusspray versus IR morfine.
Er is bewijs van zeer lage kwaliteit dat de fentanyl buccale stick en de fentanyl pectine neusspray sneller een klinisch relevante pijnverlichting geeft dan IR morfine (zeer laag GRADE).
(Fallon, 2011; Zeppetella, 2013; Zeppetella, 2014)
Vraagstelling B: Bijwerkingen van de snelwerkende opioïden
Er is bewijs van zeer lage kwaliteit dat sufheid, misselijkheid, braken en obstipatie als bijwerkingen optreden bij >5% van de patiënten, die behandeld worden met snelwerkende fentanylpreparaten (zeer laag GRADE).
(Fallon, 2011; Farrar, 1998; Kosugi, 2013; Kress, 2009; Mercadante, 2009; Nalamachu, 2011; Novotna, 2014; Payne ,2001; Portenoy, 2006, 2010-1 en 2010-2; Rauck, 2009 en 2010; Slatkin, 2007; Weinstein, 2013)
Samenvatting literatuur
Twee systematische reviews, waarin tien vergelijkende studies worden beschreven, twee na de reviews verschenen vergelijkende studies en vijf observationele studies zijn de basis voor de beoordeling van de effectiviteit van snelwerkende opioïden en de beschrijving van bijwerkingen. Zie ook de evidence tabellen.
Vraagstelling A: Snelwerkend fentanylpreparaat versus placebo of ander snelwerkend opioïd of niet-gerandomiseerde studies met follow-up van minimaal een maand.
Beschrijving studies
Negen studies vergeleken verschillende soorten snelwerkende fentanylpreparaten met een placebo (Farrar, 1998; Kosugi, 2013; Kress, 2009; Novotna, 2014; Portenoy, 2006 en 2010; Rauck, 2009 en 2010; Slatkin 2007), één studie de fentanyl neusspray met de fentanyl buccale stick (Mercadante, 2009), twee studies een snelwerkend fentanylpreparaat met IR morfine (Coluzzi, 2001; Fallon, 2011), en één studie een snelwerkend fentanylpreparaat met intraveneus toegediend morfine (Mercadante, 2007). Zie tabellen 1 en 2. Tien van deze twaalf studies zijn opgenomen in twee recente systematische reviews (Zeppetella, 2013 en 2014). Alle studies werden verricht bij patiënten met kanker.
Twee studies zijn gepubliceerd na de systematische reviews en derhalve niet daarin opgenomen (Kosugi, 2013; Novotna, 2014). Kosugi (2013) vergeleek fentanyl buccale tablet met een placebo bij patiënten met kanker (N=136). Novotna (2014) vergeleek fentanyl als sublinguaal tablet met een placebo bij patiënten met kanker (N=91). De pijnintensiteit werd in beide studies gemeten op het moment van toedienen van het snelwerkende opioïd (baseline score). Op 10 (niet in de studie van Kosugi), 15, 30, 45 en 60 minuten na toediening werd vervolgens de pijntensiteit opnieuw gemeten en vergeleken met de baseline score.
Resultaten
Pijnintensiteit
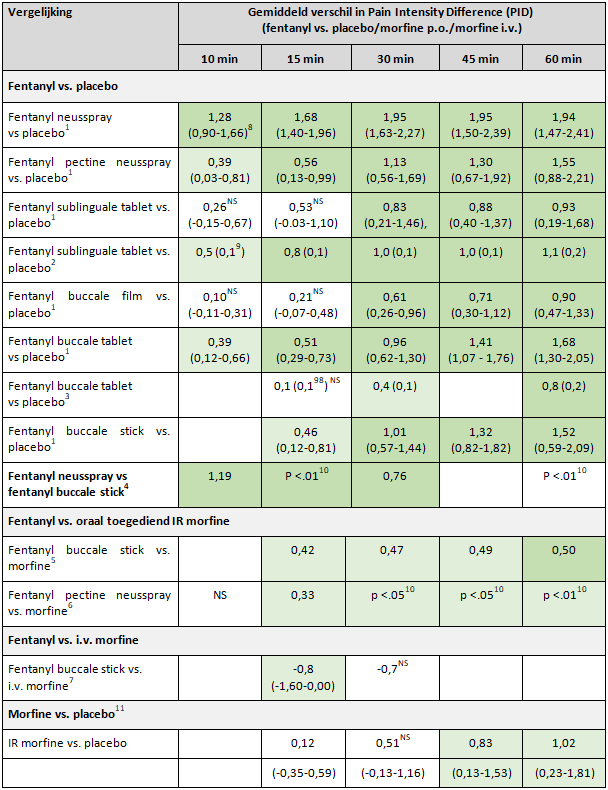
De resultaten van de vergelijkende studies staan weergegeven in tabellen 1 en 2.
Bij de vergelijkingen van snelwerkend fentanyl met placebo werd 10 en 15 minuten na toediening een statistisch significant verschil in gemiddelde PID ten voordele van fentanyl gevonden bij respectievelijk vier van zes vergelijkingen en vijf van acht vergelijkingen (tabel 1). Na 30, 45 en 60 minuten werd in alle gevallen een statistisch significant verschil ten voordele van fentanyl gevonden.
De verschillen in gemiddelde PIDs tussen fentanyl en placebo varieerden van 0,10 tot 1,95. Het verschil in de gemiddelde PID na 10 en 15 minuten tussen het snelwerkende fentanylpreparaat en placebo was in respectievelijk 1 van de 6 en 4 van de 8 vergelijkingen statistisch significant en >0,5, en dus klinisch relevant. Vanaf 30 minuten waren de verschillen klinisch relevant in vrijwel alle vergelijkingen.
De PIDs van de afzonderlijke studies staan nader uitgewerkt in tabel 2. De fentanyl neusspray en een van de twee sublinguale tabletten gaven al na 10 resp. 15 minuten een klinisch relevante daling van de gemiddelde pijnintensiteit (PID >2). Vanaf 30 minuten was er bij alle snelwerkende fentanylpreparaten sprake van een klinisch relevante afname van de pijn. Vanaf 30 minuten werd in toenemende mate ook bij gebruik van een placebo een klinisch relevante afname van de pijn gezien. Mogelijke verklaringen hiervoor zijn: 1) een verlaat placebo-effect, of 2) het spontane beloop van doorbraakpijn, waarbij ook zonder behandeling de pijn na 30 tot 45 minuten kan afzakken.
Uit tabel 2 blijkt dat het eerste meetmoment met een gemiddelde PID >2 bij gebruik van placebo 15 tot meer dan ->30 minuten (mediaan 15 minuten) later was dan bij gebruik van een snelwerkend fentanylpreparaat.
Bij een indirecte vergelijking tussen IR morfine en placebo (Zeppetella, 2013) was er pas na 45 minuten een significant verschil ten voordele van IR morfine (zie tabel 1).
Een gerandomiseerde open-label studie vergeleek de fentanyl neusspray met de buccale stick (Mercadante, 2009). Na 5, 10, 15, 20, 30 en 60 minuten waren er significante verschillen in de gemiddelde PID ten voordele van de neusspray. De PIDs na 10 en na 30 minuten bedroegen resp. 2,27 vs 1.08 (p <0,001) en 4.15 versus 3.39 (p <0,001).
Twee studies vergeleken een snelwerkend fentanylpreparaat met oraal toegediend IR morfine (Coluzzi, 2001; Fallon, 2011). 15 minuten na toediening waren er in beide studies statistische significante (maar niet klinisch relevante) verschillen in de gemiddelde PID ten voordele van het snelwerkende fentanylpreparaat (respectievelijk 0,42 en 0,33, zie tabel 1).
Bij de studie van Coluzzi was na 15 minuten de pijnintensiteit ten opzichte van de baseline in beide groepen significant afgenomen, maar de daling was niet klinisch relevant (PID <2). Vanaf 30 minuten was de PID in beide groepen >2. De verschillen in gemiddelde PID na 30, 45 en 60 minuten bedroegen resp. 0,47, 0,49 en 0,50 ten voordele van de fentanyl buccale stick.
Fallon (2011) rapporteerde na 15 minuten een statistisch significante en klinisch relevante PID in beide groepen. Het verschil in gemiddelde PID bedroeg 0,33. De grootte van de verschillen op andere tijdstippen werden niet gespecificeerd. Wanneer de resultaten van de twee studies die de buccale stick (Coluzzi, 2001) en de pectine neusspray (Fallon, 2011) vergeleken met IR morfine gepoold worden (Zeppetella, 2013), wordt een significant (p=0,048) verschil gevonden in de PID op 15 minuten ten voordele van het snelwerkend fentanylpreparaat (gemiddeld verschil in PID 0,37 (95% betrouwbaarheidsinterval 0,00 tot 0,73).
In de studie van Coluzzi (2004) werd een klinisch relevant verschil (in die studie gedefinieerd als een afname van 33% van de baseline pijnscore) na 15 minuten gevonden bij 42,3% van de patiënten die behandeld werden met de buccale stick en bij 31,8% van de patiënten die IR morfine kregen.
In de studie van Fallon (2011) werd een klinisch relevant verschil (gedefinieerd als een PID van >2) gevonden:
- na 10 minuten bij 52,4% van alle episodes met doorbraakpijn bij patiënten die de pectine neusspray kregen en bij 45,4% van alle episodes bij de patiënten die IR morfine kregen; na 15 minuten bij resp. 75,5% en 69,3%.
- Eén studie vergeleek de fentanyl buccale stick met intraveneus toegediend morfine (Mercadante, 2007). Bij gebruik van de buccale stick was de PID na 15 minuten 2,8 en na 30 minuten 4,5. Na intraveneuze toediening van morfine waren de PIDs na 15 en 30 minuten respectievelijk 3,6 en 5,2. De p-waardes bedroegen 0,013 na 15 minuten en 0,059 na 30 minuten (ANOVA). Na 15 minuten was er dus een klinisch relevant verschil (0,8) in afname van de pijn ten voordele van intraveneus toegediend morfine.
Tabel 1. Verschillen in gemiddelde Pain Intensity Difference tussen snelwerkende fentanylpreparaten en placebo, oraal toegediende IR opioïden of intraveneus toegediend morfine en tussen IR morfine en placebo
NS= verschil niet statistisch significant (p>.05)
Lichtgroen: verschil statistisch significant (p<.05)
Donkergroen: verschil statistisch significant en klinisch significant (verschil in gemiddelde PID >0,5)
- Gepoolde resultaten uit Zeppetella 2013 en 2014
- Novotna 2014
- Kosugi 2013
- Mercadante 2009
- Coluzzi 2001
- Fallon 2011
- Mercadante 2007
- 95% betrouwbaarheidsinterval van het verschil
- Standaarddeviatie
- PIDs alleen in figuur weergegeven met significantie
- Indirecte vergelijking (Zeppetella 2013)
Tabel 2. Klinische relevantie van gemiddelde Pain Intensity Differences (PIDs) bij gebruik van snelwerkende fentanylpreparaten, placebo, oraal toegediende IR opioïden of intraveneus toegediend morfine
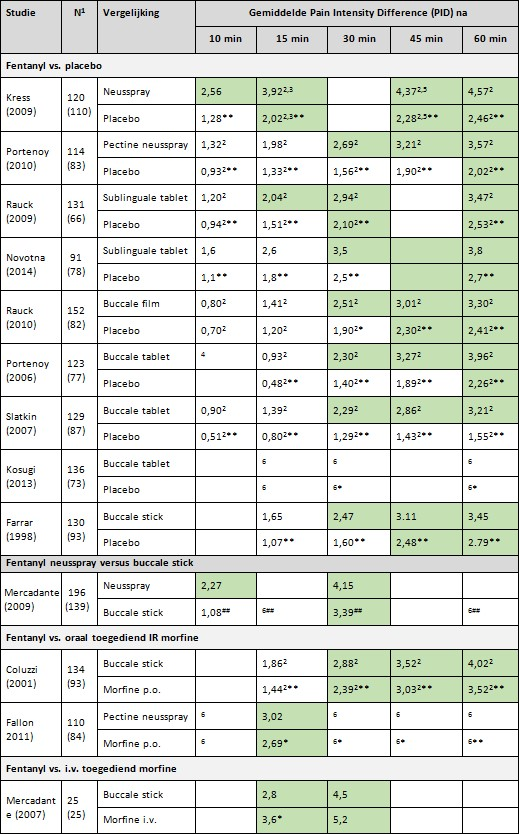
Donkergroen: Klinisch relevante gemiddelde PID (>2)
- Aantal patiënten in titratiefase (aantal gerandomiseerd)
- Geschat op basis van figuur (Zeppetella 2014)
- 20 min in plaats van 15 min
- lege cel = Geen meting
- 40 min in plaats van 45 min
- Geen (schatting van) PID beschikbaar; alleen figuur met significanties
* p <.05 ten opzichte van fentanyl
** p <.001 ten opzichte van fentanyl
## p <.01 t.o.v.fentanyl neusspray
Bewijskracht van de literatuur
De meta-analyse van Zeppetella (2014) is bekritiseerd vanwege (Meijler, 2014):
- het niet includeren van drie studies die in de Cochrane analyse wel waren opgenomen;
- het includeren van een studie (Mercadante, 2009) waarvan de kwaliteit van de data in twijfel zijn getrokken (European Medicines Agency, 2009);
- twijfel over de nauwkeurigheid van de weergave van de PIDs;
- onduidelijkheid over een aantal statistische bewerkingen.
Om deze reden zijn alle studies afzonderlijk beoordeeld. Omdat de studie van Mercadante (2009) uiteindelijk toch meegenomen is in het rapport van de EMEA is de studie toch opgenomen in deze richtlijn.
De bewijskracht voor de uitkomstmaat pijnintensiteit bij fentanyl pectine neusspray versus placebo is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet vanwege imprecisie.
De bewijskracht voor de uitkomstmaat pijnintensiteit bij fentanyl sublinguale tabletten versus placebo is met één niveau verlaagd vanwege imprecisie.
De bewijskracht voor de uitkomstmaat pijnintensiteit bij fentanyl buccale oplosbare film versus placebo is met één niveau verlaagd vanwege imprecisie.
De bewijskracht voor de uitkomstmaat pijnintensiteit bij fentanyl buccale tablet versus placebo is met één niveau verlaagd vanwege een discrepantie in bevindingen tussen de drie studies.
De bewijskracht voor de uitkomstmaat pijnintensiteit bij de fentanyl buccale stick (OTFC) versus placebo is met één niveau verlaagd vanwege imprecisie.
De bewijskracht voor de uitkomstmaat pijnintensiteit bij de fentanyl neusspray versus de fentanyl buccale stick (OTFC) is met drie niveaus verlaagd vanwege beperkingen in de onderzoeksopzet en een kleine onderzoekspopulatie.
De bewijskracht voor de uitkomstmaat pijnintensiteit bij oraal toegediend IR morfine versus placebo is met drie niveaus verlaagd vanwege het ontbreken van direct vergelijkende studies.
De bewijskracht voor de uitkomstmaat pijnintensiteit bij de fentanyl buccale stick (OTFC) versus oraal toegediend IR morfine is met één niveau verlaagd vanwege imprecisie.
De bewijskracht voor de uitkomstmaat pijnintensiteit bij fentanyl pectine neusspray versus oraal toegediend IR morfine is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (het ontbreken van blindering, hoge loss-to-follow-up) en een kleine onderzoekspopulatie (imprecisie).
De bewijskracht voor de uitkomstmaat pijnintensiteit bij de fentanyl buccale stick (OTFC) versus intraveneus toegediend morfine is met 3 niveaus verlaagd vanwege imprecisie, ontbreken van blinderen en zeer kleine onderzoekspopulatie.
Vraagstelling B: Bijwerkingen van de snelwerkende opioïden
Beschrijving studies
Naast de vergelijkende studies die zijn opgenomen in de reviews van Zeppetella zijn vijf prospectieve studies geselecteerd met een follow-up van enkele maanden (Nalamachu, 2011; Payne, 2001; Portenoy, 2010; Taylor, 2013; Weinstein, 2009). Alle vijf studies waren open-label, multicentre studies. Nalamachu (2011) onderzocht het gebruik van de fentanyl sublinguale tablet bij 96 patiënten met een mediane follow-up van 149 dagen. Evaluatie vond maandelijks plaats. Payne (2001) onderzocht het gebruik van de fentanyl buccale stick (OTFC) (N=155) gedurende 1 tot 423 dagen (mediaan 91 dagen). Portenoy (2010) onderzocht het effect van de fentanyl pectine neusspray bij 356 patiënten gedurende vier maanden. Taylor (2013) onderzocht het gebruik van de pectine neusspray bij 401 patiënten met een mediane follow-up van 325 dagen. Weinstein (2009) heeft het gebruik onderzocht van fentanyl buccale tabletten (N=197) met een follow-up van minimaal 12 maanden. De mediane behandelingsduur was 122 dagen.
In het artikel van Coluzzi (2001) was geen onderscheid mogelijk tussen de bijwerkingen van OTFC en de bijwerkingen van IR morfine. Daarom is deze studie niet in de analyse opgenomen.
Resultaten
In tabel 3 staan de meest voorkomende bijwerkingen (sufheid, duizeligheid, misselijkheid, braken en obstipatie) weergegeven per preparaat en per studie. Sufheid komt voor bij 1,3 tot 27,2% (mediaan 5,3%), duizeligheid bij 0 tot 22% (4,6%), misselijkheid bij 1,3 tot 22% (8,2%), braken bij 2,2 tot 13,6% (5,4%), en obstipatie bij 1,3 tot 10% (6,3%).
Tabel 3 Bijwerkingen van snelwerkende fentanylpreparaten (ROO’s)
|
|
N |
Sufheid |
Duizelig- heid |
Misselijk- heid |
Braken |
Obstipatie |
|
Fentanyl neusspray (Kress, 2009) |
120 |
Niet vermeld |
7,5% |
13,3% |
6,7% |
10% |
|
Fentanyl neusspray (Mercadante 2009) |
122 |
1,6% |
3,3% |
8,2% |
4,9% |
4,1% |
|
Fentanyl pectine neusspray (Portenoy, 2010-1) |
113 |
3,5% |
8,0% |
8,8% |
10,6% |
Niet vermeld |
|
Fentanyl pectine neusspray (Portenoy, 2010-2) |
356 |
3,5% |
5,2% |
2,5% |
3,7% |
3,5% |
|
Fentanyl pectine neusspray (Fallon, 2011) |
80 |
1,3% |
0% |
1,3% |
3,8% |
1,3% |
|
Fentanyl pectine neusspray (Taylor, 2013) |
171 |
Niet vermeld |
3,5% |
9,4% |
9,4% |
8,8% |
|
Fentanyl sublinguale tablet (Rauck, 2009) |
131 |
4,6% |
Niet vermeld |
12,2% |
5,3% |
Niet vermeld |
|
Fentanyl sublinguale tablet (Nalamachu, 2011) |
139 |
5,8% |
2,9% |
8,6% |
2,2% |
5,8% |
|
Fentanyl sublinguale tablet (Novotna, 2014) |
93 |
2,2% |
Niet vermeld |
4,4% |
5,5% |
Niet vermeld |
|
Fentanyl buccale film (Rauck, 2010) |
151 |
6,0% |
4,6% |
9,3% |
9,3% |
Niet vermeld |
|
Fentanyl buccale tablet (Portenoy, 2006) |
123 |
10% |
22% |
22% |
11% |
8% |
|
Fentanyl buccale tablet (Slatkin, 2007) |
125 |
Niet vermeld |
11% |
13% |
6% |
6% |
|
Fentanyl buccale tablet (Weinstein, 2009) |
232 |
10% |
Niet vermeld |
6% |
Niet vermeld |
8% |
|
Fentanyl buccale tablet (Kosugi, 2013) |
103 |
27,2% |
Niet vermeld |
10,7% |
13,6% |
Niet vermeld |
|
Fentanyl buccale stick (Farrar, 1998) |
130 |
8% |
17% |
14% |
3% |
5% |
|
Fentanyl buccale stick (Mercadante 2009) |
118 |
2,5% |
1,7% |
7,6% |
3,4% |
3,4% |
|
Fentanyl buccale stick (Payne, 2001) |
155 |
9% |
8% |
8% |
5% |
8% |
|
Mediane frequentie |
5,3% |
4,6% |
8,2% |
5,4% |
6,3% |
|
|
(range) |
(1,3-27,2) |
(0-17) |
(1,3-22) |
(2,2-13,6) |
(1,3-10) |
|
Bewijskracht van de literatuur
De bewijskracht van de studies over bijwerkingen van snelwerkende fentanylpreparaten is met drie niveaus verlaagd naar zeer laag, wegens beperkingen in studieopzet (onduidelijkheid over of afwezigheid van randomisatieprocedure en blindering), imprecisie en heterogeniteit van de geïncludeerde studies.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstellingen:
A. Wat is de effectiviteit van snelwerkende opioïden bij de behandeling van doorbraakpijn bij patiënten met kanker?
B. Wat zijn de bijwerkingen van snelwerkende opioïden bij de behandeling van doorbraakpijn bij patiënten met kanker?
Voor de literatuursearch werd de volgende PICO opgesteld:
P: patiënten met kanker en doorbraakpijn;
I: snelwerkende opioïden (morfine, fentanyl, oxycodon, hydromorphone of buprenorfine);
C: placebo, andere opioiden, andere toedieningsvorm (tablet, film, spray) en/of andere toedieningsweg (buccaal, oro- of transmucosaal, (intra)nasaal, sublinguaal, subcutaan of intraveneus);
O: pijnintensiteit; optreden van bijwerkingen.
Relevante uitkomstmaten
De werkgroep achtte effectiviteit een kritieke uitkomstmaat en bijwerkingen een belangrijke uitkomstmaat. De werkgroep hanteerde verschil in pijnintensiteit en snelheid van werking als uitkomstmaten voor de effectiviteit. In veel vergelijkende onderzoeken wordt de Pain Intensity Difference (PID) als primaire uitkomstmaat gebruikt. De PID is het verschil tussen de pijnscore op het moment van de toediening (baseline) en de pijnscore op een bepaald tijdstip na toediening. Bij de pijnscore wordt gebruik gemaakt van een Numeric Rating Scale (NRS) op een schaal van 0 tot 10, waarbij 0 geen pijn impliceert en 10 de ergst denkbare pijn. Een PID van >2 of een afname van de baseline pijnscore met minimaal 33% worden als klinisch relevant beschouwd (Farrar, 2000). Voor de klinische relevantie van een verschil in gemiddelde PID tussen twee verschillende middelen of tussen een middel en placebo wordt een waarde van ≥0,5 aangehouden (Farrar, 1998; Kress, 2009).
In de databases Medline (OVID), Embase en Cochrane is met relevante zoektermen gezocht naar doorbraakpijn, patiënten met kanker, snel werkende opioïden (morfine, fentanyl, oxycodon, hydromorfon of buprenorfine), placebo, andere opioïden en andere toedieningsvormen. De zoekverantwoording is weergegeven onder het tabblad verantwoording. De literatuurzoekactie leverde 486 treffers op.
Studies werden geselecteerd op grond van de volgende selectiecriteria:
Vraagstelling A
- (systematische review van) vergelijkend onderzoek; prospectieve fase IV- studies met een follow-up van een maand of langer;
- snelwerkende opioïden versus placebo of andere snelwerkende opioïden;
- uitkomstmaat: PID.
Vraagstelling B
- (systematische review van) vergelijkend onderzoek; prospectieve fase IV- studies met een follow-up van minimaal een maand;
- snelwerkende opioïden versus placebo of andere snelwerkende opioïden;
- minimaal één van de volgende uitkomstmaten: misselijkheid, obstipatie, sufheid, droge mond, verwardheid/delier.
Op basis van titel en abstract werden in eerste instantie 36 artikelen geselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 17 artikelen geëxcludeerd (zie exclusietabel); 19 artikelen zijn definitief geselecteerd voor vraagstelling A en/of vraagstelling B.
Referenties
- Bedard G, Hawley P, Zhang L, et al. A survey of Canadian cancer patients' perspectives on the characteristics and treatment of breakthrough pain. Supportive Care Cancer 2013;21(9):2557-63.
- Caraceni A, Hanks G, Kaasa S, et al. Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC.Lancet Oncol 2012;13:e58-68.
- Caraceni A, Davies A, Poulain P, et al. Guidelines for the management of breakthrough pain in patients with cancer. JNCCN J Nat Compr Cancer Netw 2013;11(SUPPL.1):S29-S36.
- Coluzzi PH, Schwartzberg L, Conroy JD, et al. Breakthrough cancer pain: a randomized trial comparing oral transmucosal fentanyl citrate (OTFC) and morphine sulfate immediate release (MSIR). Pain 2001;91(1- 2):123-30.
- Davies AN, Dickman A, Reid C, et al. The management of cancer-related breakthrough pain: Recommendations of a task group of the Science Committee of the Association for Palliative Medicine of Great Britain and Ireland. European Journal of Pain 2009;13(4):331-8.
- Davies A, Zeppetella G, Andersen S, et al. Multi-centre European study of breakthrough cancer pain: pain characteristics and patient perceptions of current and potential management strategies. Eur J Pain 2011;13:756-763.
- Davies A, Zeppetella G, Rios C, et al. The efficacy of opioids for the treatment of breakthrough cancer pain: A network meta-analysis. Palliative Med 2012;26(4):428.
- Deandrea S, Corli O, Consonni D, et al. Prevalence of breakthrough cancer pain: a systematic review and a pooled analysis of published literature. J Pain Symptom Manage 2014;47:57-76.
- England R, Maddocks M, Manderson C, et al. How practical are transmucosal products for breakthrough cancer pain? Novel use of placebo formulations to survey user opinion. BMJ Supp & Palliat Care 2011;1:349-351.
- European Medicines Agency. Assessment report for Instanyl. Procedure No. EMEA/H/C/959. London, 2009. European Oncology Nursing Society. EONS breakthrough pain guidelines (2013): http://www.cancernurse.eu/documents/EONSBreakthroughCancerPainGuidelines.pdf
- Fallon M, Reale C, Davies A, et al. Efficacy and safety of fentanyl pectin nasal spray compared with immediate- release morphine sulfate tablets in the treatment of breakthrough cancer pain: a multicenter, randomized, controlled, double-blind, double-dummy multiple-crossover study. The Journal of Supportive Oncology 2011;9(6):224-31.
- Farrar JT, Cleary J, Rauck R, et al. Oral transmucosal fentanyl citrate: randomized, double-blinded, placebo- controlled trial for treatment of breakthrough pain in cancer patients. J Natl Cancer Inst 1998;90(8):611- 6.
- Farrar JT, Portenoy RK, Berlin JA, et al. Defining the clinically important difference in pain outcome measures. Pain 2000;88(3):287-94.
- Granata R, Bossi P, Bertulli R, et al. Rapid-onset opioids for the treatment of breakthrough cancer pain: two cases of drug abuse. Pain Med 2014;15:758-761.
- Jandhyala R, Fullarton J. Various formulations of oral transmucosal fentanyl for breakthrough cancer pain: an indirect mixed treatment comparison meta-analysis. BMJ supportive & palliative care 2012;2(2):156-62.
- Jandhyala R, Fullarton JR, Bennett MI. Efficacy of rapid-onset oral fentanyl formulations vs. oral morphine for cancer-related breakthrough pain: a meta-analysis of comparative trials. Journal of Pain & Symptom Management 2013;46(4):573-80.
- Kosugi T, Hamada S, Takigawa C, et al. A randomized, double-blind, placebo-controlled study of fentanyl buccal tablets for breakthrough pain: efficacy and safety in Japanese cancer patients. J Pain Symptom Manage. 2013 Oct 5. [Epub ahead of print]
- Kress HG, Oronska A, Kaczmarek Z, et al. Efficacy and tolerability of intranasal fentanyl spray 50 to 200 microg for breakthrough pain in patients with cancer: a phase III, multinational, randomized, double-blind, placebo- controlled, crossover trial with a 10-month, open-label extension treatment period. Clin Ther 2009;31(6):1177-91.
- Kuo KL, Saokaew S, Stenehjem DD. The pharmacoeconomics of breakthrough cancer pain. [Review]. Journal of Pain & Palliative Care Pharmacotherapy 2013;27(2):167-75.
- Meijler WJ. Reply: a network meta-analysis of the efficacy of opioid analgesics for the management of breakthrough cancer pain episodes. J Pain Symptom Manage 2014;46:e9-10.
- Mercadante S, Villari P, Ferrera P, et al. Transmucosal fentanyl vs. intravenous morphine in doses proportional to basal opioid regimen for episodic-breakthrough pain. Br J Cancer 2007;96(12):1828-33.
- Mercadante S, Radbruch L, Davies A, et al. A comparison of intranasal fentanyl spray with oral transmucosal fentanyl citrate for the treatment of breakthrough cancer pain: an open-label, randomised, crossover trial. Current Medical Research & Opinion 2009;25(11):2805-15.
- Nalamachu S, Hassman D, Wallace MS, et al. Long-term effectiveness and tolerability of sublingual fentanyl orally disintegrating tablet for the treatment of breakthrough cancer pain. Current Medical Research & Opinion 2011;27(3):519-30.
- Nalamachu SR, Rauck RL, Wallace MS, et al. Successful dose finding with sublingual fentanyl tablet: combined results from 2 open-label titration studies. Pain Pract 2012;12(6):449-56.
- Novotna S, Valentova K, Fricova J, et al. A randomized, placebo-controlled study of a new sublingual formulation of a fentanyl citrate (fentanyl etypharm) for breakthrough pain in opioid-treated patients with cancer. Clin Ther 2014;36:357-367.
- Nunez-Olarte JM, Alvarez-Jimenez P. Emerging opioid abuse in terminal cancer patients taking oral transmucosal fentanyl citrate for breakthrough pain. J Pain Symptom Manage 2011;42:e6-8.
- Passik SD, Messina J, Golsorkhi A, et al. Aberrant drug-related behavior observed during clinical studies involving taking chronic opioid therapy for persistent pain and fentanyl buccal tablet for breakthrough pain. J Pain Symptom Manage 2010; June 24 [Epub ahead of print].
- Payne R, Coluzzi P, Hart L, et al. Long-term safety of oral transmucosal fentanyl citrate for breakthrough cancer pain. Journal of Pain & Symptom Management 2001;22(1):575-83.
- Portenoy RK, Taylor D, Messina J, et al. A randomized, placebo-controlled study of fentanyl buccal tablet for breakthrough pain in opioid-treated patients with cancer. Clin J Pain 2006;22(9):805-11.
- Portenoy RK, Burton AW, Gabrail N, et al. A multicenter, placebo-controlled, double-blind, multiple-crossover study of Fentanyl Pectin Nasal Spray (FPNS) in the treatment of breakthrough cancer pain. Pain 2010;151(3):617-24.
- Portenoy RK, Raffaeli W, Torres LM, et al. Long-term safety, tolerability, and consistency of effect of fentanyl pectin nasal spray for breakthrough cancer pain in opioid-tolerant patients. J Opioid Manage 2010;6(5):319-28.
- Rauck RL, Tark M, Reyes E, et al. Efficacy and long-term tolerability of sublingual fentanyl orally disintegrating tablet in the treatment of breakthrough cancer pain. Current Medical Research & Opinion 2009;25(12):2877-85.
- Rauck R, North J, Gever LN, et al. Fentanyl buccal soluble film (FBSF) for breakthrough pain in patients with cancer: a randomized, double-blind, placebo-controlled study. Ann Oncol 2010;21(6):1308-14.
- Slatkin NE, Xie F, Messina J, et al. Fentanyl buccal tablet for relief of breakthrough pain in opioid-tolerant patients with cancer-related chronic pain. The Journal of Supportive Oncology 2007;5(7):327-34.
- Smith H. A comprehensive review of rapid-onset opioids for breakthrough pain. [Review]. CNS Drugs 2012;26(6):509-35.
- Smith HS. Considerations in selecting rapid-onset opioids for the management of breakthrough pain. J Pain Res 2013;6:189-200.
- Taylor D, Radbruch L, Revnic J, et al. A Report on the Long-term Use of Fentanyl Pectin Nasal Spray in Patients With Recurrent Breakthrough Pain. J Pain Symptom Manage 2013.
- Velasquez Rivera I, Munos Garrido J, Garcia Velasco P, et al. Efficazcy of sublingul fentanyl vs. oral morphine for cancer-related breakthrough pain. Adv Ther 2014;31:107-117.
- Vissers DC, Lenre M, Tolley K, et al. An economic evaluation of short-acting opioids for treatment of breakthrough pain in patients with cancer. Value Health 2011;14:274-281.
- Walker G, Wilcock A, Manderson C, et al. The acceptability of different routes of administration of analgesia for breakthrough pain. Palliative Med 2003;17(2):219-21.
- Weinstein SM, Messina J, Xie F. Fentanyl buccal tablet for the treatment of breakthrough pain in opioid-tolerant patients with chronic cancer pain: A long-term, open-label safety study. Cancer 2009;115(11):2571-9.
- Zeppetella G, Davies AN. Opioids for the management of breakthrough pain in cancer patients. Cochrane Database Syst Rev 2013;10:CD004311.
- Zeppetella G, Davies A, Eijgelshoven I, et al. A network meta-analysis of the efficacy of opioid analgesics for the management of breakthrough cancer pain episodes. J Pain Symptom Manage 2014;47(4):772-85
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-11-2023
Laatst geautoriseerd : 06-12-2019
Geplande herbeoordeling : 01-02-2024
Actualisatie
Deze richtlijn is goedgekeurd op 6 december 2019. De Nederlandse Vereniging voor Anesthesiologie (NVA) bewaakt samen met betrokken verenigingen de houdbaarheid van deze (modules van de) richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. De geldigheidstermijn van de richtlijn is maximaal 5 jaar na vaststelling. Indien de richtlijn dan nog actueel wordt bevonden, wordt de geldigheidsduur van de richtlijn verlengd.
Houderschap richtlijn
De houder van de richtlijn (NVA) moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen.
IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
Een richtlijn is een kwaliteitsstandaard. Een kwaliteitsstandaard beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een kwaliteitsstandaard in het Register van Zorginstituut Nederland betekent dus niet noodzakelijkerwijs dat de in de kwaliteitsstandaard beschreven zorg verzekerde zorg is.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Algemene gegevens
Autoriserende/instemmende en bij de werkgroep betrokken verenigingen:
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Anesthesiologie
- Nederlandse Vereniging voor Klinische Geriatrie
- Nederlandse Vereniging voor Neurologie
- Vereniging voor Specialisten Ouderengeneeskunde
- Verpleegkundigen en Verzorgenden Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse vereniging voor professionele palliatieve zorg
Financiering
Deze richtlijn c.q. module is gefinancierd door IKNL. De inhoud van de richtlijn c.q. module is niet beïnvloed door de financierende instantie.
Procesbegeleiding
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence-based richtlijnen voor de oncologische en palliatieve zorg tot een van haar primaire taken. IKNL werkt hierbij conform de daarvoor geldende (inter)nationale kwaliteitscriteria. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen.
Doel en doelgroep
Doel
Een richtlijn geeft aanbevelingen ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek en consensus. De richtlijn 'Pijn’ geeft aanbevelingen over begeleiding en behandeling van patiënten met pijn bij kanker (zowel in de curatieve als de palliatieve fase) en beoogt hiermee de kwaliteit van de zorgverlening te verbeteren.
Hoewel de evidentie alleen is verzameld voor de diagnostiek en behandeling van pijn bij patiënten met kanker zijn de aanbevelingen ook grotendeels van toepassing voor patiënten met andere levensbedreigende aandoeningen.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de zorg voor patiënten met pijn zoals huisartsen, specialisten ouderengeneeskunde, medisch specialisten, apothekers, verpleegkundigen, verzorgenden, verpleegkundig specialisten, physician assistants, fysiotherapeuten, medisch maatschappelijk werkers, geestelijk verzorgers, GZ- en klinisch psychologen.
Indien in de richtlijn wordt gesproken over zorgverleners rondom de patiënt met pijn, worden, afhankelijk van de specifieke situatie van de patiënt, alle bovengenoemde professionals bedoeld.
De richtlijn is ook relevant voor zorgverleners van andere disciplines en vrijwilligers die werkzaam zijn in de palliatieve fase. De multidimensionele benadering van de patiënt in de palliatieve fase vergt immers een gezamenlijke, interdisciplinaire verantwoordelijkheid, zoals ook in het Kwaliteitskader palliatieve zorg Nederland is beschreven.
Samenstelling werkgroep
Alle werkgroepleden en klankbordleden zijn afgevaardigd namens wetenschappelijke, beroeps- en patiëntenverenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
Het patiëntenperspectief is vertegenwoordigd door Patiëntenfederatie Nederland.
Bij de uitvoering van het evidence-based literatuuronderzoek is de kaderopleiding Palliatieve Zorg en een literatuuronderzoeker van IKNL en de voorzitter van de richtlijnwerkgroep betrokken geweest.
Werkgroepleden
- Mw. prof. dr. M.H.J. van den Beuken-van Everdingen, internist, NIV
- Dhr. dr. M.J.M.M. Giezeman †, anesthesioloog, NVA
- Dhr. dr. A. de Graeff (voorzitter), internist-oncoloog en hospice-arts, Palliactief
- Mw. drs. H. Klaren, klinisch geriater, NVKG
- Mw. B. Kramp, verpleegkundig specialist, V&VN
- Dhr. drs. M. Martens, specialist ouderengeneeskunde en consulent palliatieve zorg, Verenso
- Mw. drs. M.J. Oortman, huisarts, SCEN-arts, palliatief consulent en hospice-arts, NHG
- Dhr. drs. P. Oosterhof, poliklinisch apotheker, NVZA
- Mw. prof.dr. A.K.L. Reyners, internist, NIV
- Mw. M. Schielke, verpleegkundig pijnspecialist, V&VN
- Mw. drs. M.C. Sieders, huisarts (waarnemend), SCEN-arts, palliatief consulent, NHG
- Dhr. dr. M.F.M. Wagemans, anesthesioloog, NVA
Klankbordleden
- Dhr. prof. dr. K.C.P. Vissers, anesthesioloog, NVA
- Mw. drs. L. Bellersen, cardioloog, NVVC
- Mw. drs. B.A. Brouwer, neuroloog/pijnspecialist NVN/pijnspecialist
- Mw. M. Geerts, verpleegkundig specialist, V&VN
- Dhr. drs. S.M. de Hosson, longarts, NVALT
- Mw. drs. S. Visser, apotheker, KNMP
- Mw. drs. R. Lammers, beleidsmedewerker, Patiëntenfederatie Nederland
Ondersteuning
- Mw. T.T.M. Bluemink-Holkenborg, secretaresse, IKNL
- Mw. drs. M.G. Gilsing, adviseur (richtlijnen) palliatieve zorg, IKNL
- Mw. dr. O.L. van der Hel, literatuuronderzoeker, IKNL
- Prof.dr. J Kleijnen, epidemioloog, literatuuronderzoeker MUMC Maastricht/York
- Mw. L.K. Liu, secretaresse, IKNL
- Dhr. dr. R. Vernooij (i.s.m. de kaderopleiding Palliatieve Zorg), literatuuronderzoeker, IKNL
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke en beroepsverenigingen.
Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld. De bevindingen zijn schriftelijk vastgelegd in de belangenverklaring en opvraagbaar via info@iknl.nl.
Inbreng patiëntenperspectief
De input van patiëntvertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt. Patiëntenfederatie Nederland is in het gehele richtlijntraject meegenomen en heeft plaats gehad in de klankbordgroep (zie ook de Samenstelling van de werkgroep).
Tijdens de landelijke consultatiefase heeft Patiëntenfederatie Nederland commentaar gegeven op de conceptrichtlijn en patiënten/naasten geraadpleegd via een referentenpanel voor onderzoeksaanvragen op het gebied van palliatieve zorg. Ook heeft de Patiëntenfederatie Nederland - naast NFK, nog andere patiëntenorganisaties benaderd voor het leveren van commentaar.
Patiëntenfederatie Nederland heeft tot slot de richtlijn goedgekeurd.
Patiënteninformatie gebaseerd op de richtlijn is opgesteld en gepubliceerd op de daarvoor relevante sites (o.a. zie link https://www.kanker.nl/gevolgen-van-kanker/pijn/wat-is/pijn-bij-kanker#show-menu).
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de zorgpraktijk, inclusief borging daarvan.
Als onderdeel van elke richtlijn stelt IKNL samen met de richtlijnwerkgroep een implementatieplan op en ondersteunt een aantal basis-activiteiten voor de implementatie. De verantwoordelijkheid voor verdere implementatie-activiteiten ligt bij de eigenaar van de richtlijn (en het veld).
Activiteiten en interventies voor verspreiding en implementatie kunnen zowel op landelijk als regionaal niveau plaatsvinden. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor en door de verschillende disciplines.
Werkwijze
In de huidige richtlijn zijn de NVA-richtlijn van 2015 en de richtlijn 'Pijn' van Pallialine samengevoegd. Daarbij zijn de onderdelen van de NVA-richtlijn, die in 2015 niet zijn herzien (en waarbij de teksten van de NVA-versie van 2008 onveranderd zijn gehandhaafd) grotendeels evidence-based (op basis van aanvullend literatuuronderzoek) aangepast en aangevuld met evidence-based en consensus-based teksten over de diagnostiek en behandeling van pijn bij patiënten met gevorderde stadia van COPD of hartfalen. De onderdelen van de NVA-richtlijn die in 2015 zijn herzien zijn onveranderd overgenomen (zie ook de Algemene inleiding).
De bedoeling is om te komen tot een integrale en actuele richtlijn over de diagnostiek en behandeling van pijn bij zowel patiënten met kanker (in de curatieve én de palliatieve fase) als bij patiënten met COPD of hartfalen.
Voor de evidence-based (herzieningen van) modules zijn de aanbevelingen voorzien van een gradering met cijfers en letters om de verhouding tussen de sterkte van de aanbeveling en de kwaliteit van de evidence weer te geven (zie onderstaande tabel). Deze werkwijze is gebaseerd op de methodiek zoals voorgesteld door de GRADE working group (zie http://www.gradeworkinggroup.org).
|
Gradering van aanbevelingen |
|
|
Sterkte van de aanbeveling |
Cijfer |
|
Sterke aanbeveling |
1 |
|
Zwakke aanbeveling |
2 |
|
Kwaliteit van de evidence |
Letter |
|
Hoog |
A |
|
Matig |
B |
|
Laag |
C |
|
Zeer laag |
D |
De richtlijnteksten die gebaseerd zijn op uitgangsvragen, zijn opgebouwd volgens het volgende vaste stramien: uitgangsvraag en aanbevelingen, literatuur, conclusies, overwegingen en referenties. De evidence tabellen staan bij de desbetreffende modules. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
De uitgangsvragen zijn óf evidence-based (via de GRADE methodiek) óf consensus-based (zonder systematisch literatuuronderzoek) uitgewerkt.
De GRADE-methodiek
Selectie
Naast de selectie van studies op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- Gerandomiseerde gecontroleerde studies (RCT's)
- Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
- De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
- De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen’
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.
Figuur 1. Van bewijs naar aanbeveling
Bij het schrijven van de overwegingen zijn onderstaande zaken in acht genomen.
- Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
Toelichting:
- Kennis en ervaring met technieken/therapieën.
- Risico’s die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient’ plaats te vinden (sterk) of wel ‘kan worden overwogen’ (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
- Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling. - Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Maatschappelijk perspectief
(Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties)
Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
- Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin – voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Doe/geef etc. (of er dient…. te worden gegeven/gedaan)
- Zwakke/conditionele aanbevelingen: Overweeg….. te geven/te doen.
Consensus-based methodiek
Naast de evidence-based uitwerking (GRADE) zijn er ook uitgangsvragen via de consensus-based methodiek uitgewerkt. Hierbij zijn de richtlijnteksten ook gebaseerd op evidence, maar is er geen systematisch literatuuronderzoek gedaan en zijn de gevonden studies niet methodologisch beoordeeld.
