Obstipatie bij pijn bij kanker
Uitgangsvraag
Op welke wijze dienen bijwerkingen van opioïden behandeld te worden bij patiënten met kanker?
Aanbeveling
Bij patiënten met kanker met obstipatie door gebruik van opioïden:
- Schrijf standaard laxantia voor bij de behandeling met een opioïd (1D).
- Schrijf een osmotisch laxans (macrogol/elektrolyten, magnesiumhydroxide, evt. lactulose of lactitol) voor bij de behandeling van obstipatie, zo nodig gecombineerd met een contactlaxans (senna of bisacodyl) (1C).
- Overweeg opioïdrotatie, bij voorkeur naar transdermaal toegediend fentanyl. Het gebruik van laxantia dient dan wel te worden gecontinueerd (1D).
- Bij obstipatie ondanks adequaat laxansgebruik: dien methylnaltrexon s.c. toe (1B).
- Overweeg onderhoudsbehandeling met naloxegol bij obstipatie ondanks adequaat laxantiagebruik, niet reagerend op opioïdrotatie (2D).
Overwegingen
2008
De beschikbare literatuur over obstipatie ten gevolge van opioïden is beperkt en niet eensluidend. Meerdere laxantia zijn getest en zijn over het algemeen effectief. Mede op grond van ervaringen in de praktijk lijkt een osmotisch laxans (macrogol/elektrolyten, magnesium(hydr)oxide) of lactulose) de voorkeur te hebben, zo nodig gecombineerd met een contactlaxans (senna of bisacodyl) (De Graeff, 2006b). Opioïdantagonisten lijken op grond van het werkingsmechanisme een goede keus, maar hiermee bestaat nog te weinig ervaring en er is te weinig literatuur over. Op dit moment vindt wetenschappelijk onderzoek plaats naar combinatiepreparaten van opioïden en opioïdantagonisten.
2019
Zodra een patiënt opioïden gebruikt, is laxeren obligaat. Fentanyl leidt minder vaak tot obstipatie. Toch moet, net als bij de andere opioïden, ook bij toediening van fentanyl standaard een laxans worden voorgeschreven.
Lactulose, macrogol/elektrolyten, magnesiumhydroxide, bisacodyl,en senna worden in de dagelijkse praktijk in Nederland vaak voorgeschreven. De werkgroep ziet geen reden om op basis van gebrek aan evidentie het gebruik van magnesiumhydroxide, bisacodyl en fosfaatklysmata te ontraden.
De volgende laxantia kunnen als eerste keuze worden toegepast (zie de richtlijn Obstipatie):
- macrogol/elektrolyten 1-2 sachets per dag, in water opgelost (voordelen: vloeibare toedieningsvorm; verschillende smaken);
- MgOH 3-4 dd 722-1448 mg (voordeel: lage kosten; nadeel: grote tabletten). NB Voor de laxerende werking hoeven de tabletten niet gekauwd te worden.
Alternatieven zijn:
- lactulose 1-2 dd 15-30 ml stroop of 12-24 g granulaat (voordelen: vloeibare toedieningsvorm, goedkoop; nadelen: zoete smaak, flatulentie);
- lactitol 1-2 dd 20-30 ml of 10-20 g granulaat (minder uitgesproken smaak dan lactulose).
Bij onvoldoende effect wordt één van bovengenoemde middelen gecombineerd met een peristaltiekbevorderend middel, bijv. bisacodyl 10-20 mg p.o. a.n. of sennosiden A+B 1 dd 10-20 ml. Belangrijk is daarnaast om te zorgen voor voldoende inname van vocht.
Zwelmiddelen, zoals psylliumzaad, zijn bij onvoldoende vochtinname gecontra-indiceerd, omdat juist een viskeuze massa ontstaat die een dreigende ileus manifest kan maken.
Bij persisterende obstipatie ondanks adequate behandeling met laxantia kan opioïdrotatie worden overwogen of start met methylnaltrexon (een perifere opioïdantagonist, die subcutaan wordt toegediend), geregistreerd voor de behandeling van door opioïden geïnduceerde obstipatie. Methylnaltrexon in een dosering van 8 mg (bij een gewicht van minder dan 62 kg) of 12 mg (bij een gewicht van 62 kg of meer) s.c. om de dag kan worden toegepast. In 48-61% van de gevallen treedt binnen vier uur een defecatie op, meestal binnen 30-60 minuten. De belangrijkste bijwerking is krampende buikpijn, die meestal verdwijnt na defecatie. Wanneer methylnaltrexon gecontra-indiceerd is (fecale impactie), ineffectief is of niet verdragen wordt: geef dan een hoogopgaand (fosfaat)klysma.
Naloxegol (een oraal toegediende opioïd-antagonist) is onderzocht in twee gerandomiseerde placebo-gecontroleerde studies bij in totaal 1352 patiënten met niet-kankergerelateerde pijn en opioid-gerelateerde obstipatie (Chey 2013). Het primaire eindpunt was response na 12 weken behandeling, gedefinieerd als een defecatiefrequente .>3 x per week en een toename van de defecatiefrequentie van tenminste 1x in tenminste 9/12 weken. De responsepercentages waren 44% voor 1dd 25 mg naloxegol versus 29% voor placebo in studie 1 en 40% versus 29% in studie 2; bij patiënten met onvoldoende response op laxantia bedroegen de percentages 49% versus 29% en 47% versus 31%. Mede gelet op het ontbreken van onderzoek bij patiënten met kanker, is de werkgroep van mening dat er alleen een plaats is voor onderhoudsbehandeling met naloxegol in het geval van patiënten met opioïd-geinduceerde obstipatie die niet reageert op optimale behandeling met laxantia en opioïdrotatie.
Onderbouwing
Achtergrond
Obstipatie treedt op bij 25-50% van de patiënten met kanker en bij 15-40% bij patiënten met niet-oncologische pijn. Zowel in de darmwand als in het ruggenmerg zijn opioïdreceptoren aanwezig, waardoor bij toediening van opioïden de peristaltiek vermindert, de intestinale secretie afneemt en de sfincterspanning van de anus toeneemt met als gevolg obstipatie (zie ook de richtlijn Obstipatie). Dit effect is sterker bij oraal toegediende opioïden dan bij parenterale toediening. Transdermaal toegediend fentanyl geeft minder obstipatie geeft dan morfine (Clark 2004). Tolerantie voor obstipatie ontstaat langzaam, laxeren blijft nodig.
Bij de behandeling van obstipatie t.g.v. opioïden kan gebruik gemaakt worden van opioïdantagonisten (naloxon, methylnaltrexon, alvimopan, naloxegol). Alvimopan is niet geregistreerd in Nederland. Een combinatie van oxycodon en naloxon is in Nederland geregistreerd, maar wordt niet vergoed. Bij het literatuuronderzoek is alleen gezocht naar studies met methylnaltrexon en naloxegol.
Deze module is niet herzien in de NVA-richtlijn ‘Diagnostiek en behandeling van pijn bij patiënten met kanker’ van 2015. Het literatuuronderzoek en de overwegingen worden gescheiden beschreven.
In 2008 kwam de werkgroep tot de volgende aanbevelingen:
- Bij de behandeling van patiënten met pijn bij kanker met een opioïd moeten laxantia standaard worden voorgeschreven.
- Voor de behandeling van patiënten met obstipatie ten gevolge van opioïden heeft een osmotisch laxans (macrogol/elektrolyten, magnesium(hydr)oxide of lactulose) de voorkeur, zo nodig gecombineerd met een contactlaxans (senna of bisacodyl).
- Voor de behandeling van patiënten met chronische obstipatie door gebruik van morfine is rotatie naar transdermaal toegediend fentanyl aan te bevelen. Het gebruik van laxantia dient dan wel te worden gecontinueerd.
Conclusies / Summary of Findings
2008
Er zijn aanwijzingen dat macrogol/elektrolyten, lactulose, senna en naloxon effectief zijn bij de behandeling van obstipatie ten gevolge van opioïden (niveau 3).
(Cherney 2001, McNicol 2003, Wirz 2005)
Het is aangetoond dat transdermaal toegediend fentanyl minder obstipatie geeft dan morfine (niveau 1).
(Clark 2004)
2019
Er is bewijs van lage kwaliteit dat lactulose, macrogol/elektrolyten en senna effectief zijn bij opioïd-geïnduceerde obstipatie (laag GRADE). Over de effectiviteit van magnesiumzouten, bisacodyl, natriumpicosulfaat en fosfaatklysmata kan op basis van gerandomiseerd onderzoek geen uitspraak worden gedaan.
(Ahmedzai 2009)
Er kan geen uitspraak worden gedaan over verschillen in effectiviteit tussen lactulose, senna en macrogol/elektrolyten.
(Ruston 2013)
Er is bewijs van hoge kwaliteit dat methylnaltrexon effectief is bij opioïd-geïnduceerde obstipatie (hoog GRADE).
(Ahmedzai 2010, Mehta 2016)
Er is bewijs van zeer lage kwaliteit dat opioïdrotatie vermindering van obstipatie geeft (zeer laag GRADE).
(Dale 2010)
Samenvatting literatuur
2008
De prevalentie van obstipatie bij opioïdgebruik ligt tussen 15 en 41% (Kalso, 2004; Moore, 2005). Ook bij obstipatie geldt dat comorbiditeit van de patiënt en het gebruik van andere medicatie kunnen leiden tot obstipatie. Verminderde voedselinname, dehydratie en inactiviteit dragen vaak mede bij aan de obstipatie.
In een meta-analyse konden 17 onderzoeken worden beoordeeld (McNicol, 2003). De volgende medicatie werd beoordeeld: polyethyleenglycol, lactulose, senna, methylnaltrexon en naloxon. Alle medicijnen waren effectief. Polyethyleenglycol (macrogol) en senna lijken even effectief te zijn als lactulose, maar zijn meer kosteneffectief. Magnesiumhydroxide, in de praktijk een veel gebruikt laxans, is niet systematisch onderzocht. Opioïdantagonisten (naloxon en methylnaltrexon) geven een dosisafhankelijke vermindering van de obstipatie. Het voordeel van methylnaltrexon is dat het als opioïdantagonist niet de bloedhersenbarrière passeert en alleen in de periferie (onder meer darmen) werkzaam is. Een vermindering van het pijnstillende effect of het optreden van ontwenningsverschijnselen werd niet waargenomen (Yuan, 1999; Yuan 2000). Het middel is echter niet verkrijgbaar in Nederland. In een recent retrospectief onderzoek was het gebruik van macrogol/elektrolyten effectief bij chronische obstipatie bij patiënten met kanker (Wirz, 2005).
Een systematische review laat zien dat obstipatie minder vaak optreedt bij gebruik van fentanyl dan bij gebruik van morfine (Clark, 2004). Opioïdrotatie van morfine naar methadon bij vier patiënten gaf een lagere incidentie van obstipatie (Daeninck, 1999).
Er zijn geen aanwijzingen dat verandering van toedieningsroute leidt tot minder obstipatie (Cherny, 2001).
2019
Twee systematische reviews onderzochten het effect van laxantia op obstipatie t.g.v. opioïden (Ahmedzai 2010, Ruston 2013).
De review van Ahmedzai (2010) concludeerde dat er enig bewijs is op basis van gerandomiseerde studies en systematische reviews dat lactulose, macrogol/elektrolyten, en methylnaltrexon effectieve middelen zijn bij de behandeling van obstipatie t.g.v. opioïden. Er zijn geen gerandomiseerde studies t.a.v.magnesiumzouten, bisacodyl, natriumpicosulfaat en fosfaatklysmata.
De review van Ruston (2013) concludeerde dat er geen uitspraak kan worden gedaan over verschillen in effectiviteit tussen lactulose, senna en macrogol/elektrolyten.
In hun meta-analyse naar het effect van methylnaltrexon op opioïd geïnduceerde obstipatie beschrijven Mehta et al. (Mehta 2016) 6 RCT’s met totaal 1239 patiënten. Voor de primaire uitkomstmaat, rescue-free bowel movement (RFBM) was er een zeer significant (verschil (Risk Difference 0,33, 95% BI 0,27-0,39, p < 0.0001) in het voordeel van de behandelde groep.
In de systematische review van Dale (2010) werden bij meerdere (niet-gerandomiseerde) studies zwakke evidentie gevonden voor een gunstig effect van opioïdrotatie op het optreden van obstipatie.
Kwaliteit van het bewijs
De uitkomstmaat obstipatie bij opioïdrotatie is met 1 niveau gedaald tot zeer laag gezien de imprecisie van het laag aantal events. De geïncludeerde studies waren observationele studies (Dale 2010).
De uitkomstmaat opioïd-geïnduceerde obstipatie bij lactulose, macrogel/elektrolyten en senna is met 2 niveaus verlaagd gezien het hoge risico op bias vanwege de incomplete rapportage van de resultaten en de imprecisie door het lage event aantal (Ahmedzai 2009).
De uitkomstmaat opioïd-geïnduceerde obstipatie bij methylnaltrexon is niet van niveau gedaald en blijft hoog (Ahmedzai 2010 en Mehta 2016).
De systematische review van Ruston (2013) heeft geen studies geïncludeerd en er kan geen kwaliteit van bewijs van worden bepaald.
Referenties
- Acalovschi I, Bodolea C, Slabu. Therapeutic effect of ondansetron and propofol on neuroaxial opioid-induced pruritus. Anesthesiology 1994;81:591-601.
- Ahmedzai S, Brooks D. Transdermal fentanyl versus sustained-release oral morphine in cancer pain: preference, efficacy, and quality of life. J Pain Symptom Manage 1997;13:254-61.
- Ahmedzai SH, Boland J. Constipation in people prescribed opioids. BMJ Clin Evid. 2010; 2010. pii: 2407.
- Borgeat A, Stirnemann HR. Ondansetron is effective to treat spinal or epidural morphine-induced pruritus. Anesthesiology 1999;90:432-6.
- Bruera E, Fainsinger R, MacEachern, et al. The use of methylphenidate in patients with incident cancer pain receiving regular opiates: A preliminary report. Pain 1992;50:75-7.
- CBO Richtlijn Delirium 2005. www.cbo.nl/product/richtlijnen.
- Centeno C, Sanz A, Bruera E. Delirium in advanced cancer patients. Palliative Medicine 2004;18:184-94.
- Charuluxananan S, Somboonviboon W, Kyokong O, et al. Ondansetron for treatment of intrathecal morphine- induced pruritus after cesarean delivery. Regional Anesthesia and Pain Medicine 2000;25:535-9.
- Cherny N, Ripamonti C, Pereira J, et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol 2001;19:2542-54.
- Chey WD, Webster L, Sostek M, Lappalainen J, Barker PN, Tack J. Naloxegol for opioid-induced constipation in patients with noncancer pain.N Engl J Med. 2014; 370: 2387-2396.
- Clark AJ, Ahmedzai SH, Allan LG, et al. Efficacy and safety of transdermal fentanyl and sustained-release oralmorphine in patients with cancer and chronic non-cancer pain. Curr Med Res Opin 2004;20:1419-28.
- Daeninck PJ, Bruera. Reduction in constipation and laxative requirements following opioid rotation to methadone: A report of four cases. J Pain Symptom Manage 1999;18:303-9.
- Dale O, Moksnes K, Kaasa S. European Palliatieve Care Research collaborative pain guidelines. Opioid switching to improve analgesia or seduce side effcts. A systematic review. Palliat med 2010; 25: 494-503.Davies AN, Vriens J. Oral transmucosal fentanyl citrate and xerostomia. J Pain Symptom Manage 2005;30:496-7.
- Dimitriou V, Voyagis GS. Opioid-induced pruritus: repeated vs single dose ondansetron administration in preventing pruritus after intrathecal morphine. Br J Anaesthesiol 1999;83:822-3.
- Donner B, Zenz M, Tryba M, et al. Direct conversion from oral morphine to transdermal fentanyl: A multicenter study in patients with cancer pain. Pain 1996;64:527-34.
- Drexel H, Dzien A, Spiegel RW, et al. Treatment of severe cancer pain by low-dose continuous subcutaneous morphine. Pain 1989;36:169-71.
- Fjellner B, Hagermark O. The influence of the opiate antagonist naloxone on experimental pruritus. Acta Derm Venerol 1984;64:73-5.
- Götrick B, Akerman S, Ericson D, et al. Oral pilocarpine for treatment of opioid-induced oral dryness in healthy adults. J Dent Res 2004;83:393-7.
- Graeff A de, Kuyper MB, Hesselmann GM. Richtlijn misselijkheid en braken. In: Graeff A de, Hesselmann GM, Krol RJA, et al (red). Palliatieve zorg. Richtlijnen voor de praktijk. Utrecht: Vereniging voor Integrale Kankercentra, 2006;a:461-85.
- Graeff A de, Krol RJA. Richtlijn obstipatie. In: Graeff A de, Hesselmann GM, Krol RJA, et al. Richtlijnen voor de praktijk. Utrecht: Vereniging voor Integrale Kankercentra, 2006;b:521-36.
- Gurkan Y, Toker K. Prophylactic ondansetron reduces the incidence of intrathecal fentanyl-induced pruritus. Anesthesia Analgesia 2002;95:1763-6.
- Hagen N, Swanson R. Strychnine-like multifocal myoclonus and seizures in extremely high-dose opioid admini-stration: Treatment strategies. J Pain Symptom Manage 1997;14:51-8.
- Hardy J, Daly S, McQuade B, et al. A double-blind, randomised, parallel group, multinational, multicentre study comparing a single dose of ondansetron 24 mg p.o. with placebo and metoclopramide 10 mg t.d.s. p.o. in the treatment of opioid-induced nausea and emesis in cancer patients. Supp Care Cancer 2002;10:231-6.
- Harris JD, Kotob F. Management of opioid-related side effects. In: Leon-Casasola O de (ed). Cancer pain: Pharmacological, interventional and palliative care approaches 1st ed. 2006:207-30.
- Hermens JM, Ebertz JM, Hanifin JM. Comparison of histamine release in human skin mast cells induced by morphine, fentanyl, and oxymorphone. Anesthesiology 1985;62:124-9.
- Kalso E, Edwards JE, Moore A, et al. Opioids in chronic non-cancer pain: Systematic review of efficacy and safety. Pain 2004;112:372-80.
- Katcher J, Walsh D. Opioid-induced itching: morphine sulfate and hydromorphone hydrochloride. J Pain Symptom Manage 1999;17:70-2.
- Kjellberg F, Tramer MR. Pharmacological control of opioid-induced pruritis: a quantitative systematic review of randomized trials. Eur J Anaesthesiol 2001;18:346-57.
- Kyriakides K, Hussain SK, Hobbs GJ, Management of opioid-induced pruritus: a role for 5-HT3 antagonists? Br J Anesthesiol 1999;82:439-41.
- Laugsand EA, Kaasa S, Klepstad P. Management of opioid-induced nausea and vomiting in cancer patients: systematic review and evidence-based recommendations. Palliat Med. 2011;25(5):442-53.
- Lawlor PG, Gagnon B, Mancini IL, et al. Occurrence, causes, and outcome of delirium in patients with advanced cancer: a prospective study. Arch Intern Med 2000;160:786-94.
- Lopez/Saca JM, Lopez Guzman J, Centena C. A systematic review of the influence of opioids on advanced cancer patient survival. Curr opinion 2013; 7 ; 424/439.
- Maddocks I, Somogyi A, Abbott F, et al. Attenuation of morphine-induced delirium in palliative care by substitution with infusion of oxycodone. J Pain Symptom Manage 1996;12:182-9.
- McDonald P, Graham P, Clayton M, et al. Regular subcutaneous bolus morphine via an indwelling cannula for pain from advanced cancer. Palliat Med 1991;5:323-9.
- McNicol E, Horowicz-Mehler N, Fisk R, et al. Management of opioid side effects in cancer-related and chronic noncancer pain: a systematic review. J Pain 2003;4:231-56.
- McNicol E. Opioid side effects and their treatment in patients with chronic cancer and noncancer pain. J Pain Palliat Care Pharmacotherapy. 2008; 22(4): 270-81
- Mehta N, O'Connell K, Giambrone GP, Baqai A, Diwan S. Efficacy of methylnaltrexone for the treatment of opiod-induced constipation: a meta-analysis and systematic review. Postgrad Med. 2016;128(3):282-9.
- Mercadante S, Casuccio A, Fulfaro F, et al. Switching from morphine to methadone to improve analgesia and tolerability in cancer patients. A prospective study. J Clin Oncol 2001;19:2898-904.
- Moore RA, McQuay H. Prevalence of opioid adverse events in chronic non-malignant pain: a systematic review of randomised trials of oral opioids. Arthritis Res Therapy 2005;7:1046-51.
- Morita T, Takigawa C, Onishi H, et al. Opioid rotation from morphine to fentanyl in delirious cancer patients: an open-label trial. J Pain Symptom Manage 2005;30:96-103.
- Nijs EJM de, Verhagen EH. Richtlijn Klachten van de mond. In: Graeff A de, Hesselmann GM, Krol RJA, et al (red).Palliatieve zorg. Richtlijnen voor de praktijk. Utrecht: Vereniging voor Integrale Kankercentra, 2006:485- 520/www.pallialine.nl.
- Payne R, Mathias SD, Pasta DJ, et al. Quality of life and cancer pain: Satisfaction and side effects with transdermal fentanyl versus oral morphine. J Clin Oncol 1998;16:1588-93.
- Reissig JE, Rybarczyk AM. Pharmacological treatment of opioid-induced sedation in chronic pain. Ann Pharmacother 2005;39:727-31.
- Ruston T, Hunter K, Cummings G, Lazarescu L. Efficacy and side-effect profiles of lactulose, docusate sodium and sennosides compared to PEG in opioid-induced constipation: a systematic review. Can Oncol Nurs J. 2013; 23(4): 236-46.
- Sande TA, Laird BJA, Fallon MT. The management of opioid-induced nausea and vomiting in patients with cancer: a systematic review. J Palliat Med 2019; 22: 9097.
- Sivanesan E, Gitlin MC, Candiotti KA. Opioid-induced Hallucinations: A Review of the Literature, Pathophysiology, Diagnosis, and Treatment. Anesthesia and analgesia. 2016;123(4):836-43.
- Sjogren P, Banning A. Pain, sedation and reaction tim during long-term treatment of cancer patients with oral and epidural opioids. Pain 1989;39:5-11.
- Sjogren P, Thunedborg LP, Christup L, et al. Is development of hyperalgesia, allodynia and myoclonus related to morphine metabolism during long-term adminstration? Six case histories. Acta Anaesthesiol Scand 1998;42:1070-5.
- Stone P. Minton O. European Palliative Care Research collaborative pain guidelines. Central side-effects management: what is the evidence to support best practice in the management of sedation, cognitive impairment and myoclonus? Palliat Med 2011; 25: 431-441.
- Stoutz ND de, Bruera E, Suarez-Almazor M. Opioid rotation for toxicity reduction in terminal cancer patients. J Pain Symptom Manage 1995;10:378-84.
- Stoutz ND de, Tapper M, Fainsinger RL. Reversibel delirium in terminally ill patients. J Pain Symptom Manage 1995;10:249-53.
- Sussman G, Shurman J, Creed MR, et al. Intravenous ondansetron for the control of opioid-induced nausea and vomiting. International S3AA3013 Study Group. Clin Ther 1999;21:1216-27.
- Vella-Brincat V, MacLeod AD. Haloperidol in palliative care. Palliative Med 2004;18:195-201.
- Verberkt CA, van den Beuken-van Everdingen MHJ, Schols JMGA, et al. Respiratory adverse effects of opioids for breathlessness: a systematic review and meta-analysis. Eur Respir J 2017; 50: 1701153.
- Verhagen EH, Bannink M, Krol RJA. Richtlijn delier. In: Graeff A de, Hesselmann GM, Krol RJA, et al (red). Palliatieve zorg. Richtlijnen voor de praktijk. Utrecht: Vereniging voor Integrale Kankercentra, 2006:167-94.
- Warner MA, Hosking MP, Gray JR, et al. Narcotic-induced histamine release: A comparison of morphine, oxymorphone, and fentanyl infusions. J Cardiothorac Vasc Anesth 1991;5:481-4.
- Webster L, Andrews M, Stoddard G. Modafinil treatment of opioid-induced sedation. Pain Med 2003;4:135-40.
- Wiffen PJ, Wee B, Derry S, Bell RF, Moore RA. Opioids for cancer pain - an overview of Cochrane reviews. Cochrane Database Syst Rev. 2017;7:CD012592
- Wilwerding MB, Loprinzi CL, Mailliard JA, et al. A randomized, crossover evaluation of methylphenidate in cancer patients receiving strong narcotics. Support Care Cancer 1995;3:135-8.
- Wirz S, Klaschik E. Management of constipation in palliative care patients undergoing opioid therapy: is polyethy- lene glycol an option? Am J Hosp Palliat Care 2005;22:375-81.
- Yuan CS, Foss JF, OConnor M, et al. Effects of intravenous methylnaltrexone on opioid-induced gut motility and transit time changes in subjects receiving chronic methadone therapy: a pilot study. Pain 1999;83:631-5.
- Yuan CS, Foss JF, OConnor M, et al. Methylnaltexone for reversal of constipation due to chronic methadone use:A randomized controlled trial. JAMA 2000;283:367-72.
- Zylicz Z, Smits C, Krajnik M. Paroxetine for pruritus in advanced cancer. J Pain Symptom Manage 1998;16:121-4.
- Zylicz Z, Krajnik M, Sorge AA, et al. Paroxetine in the treatment of severe non-dermatological pruritus: a randomized, controlled trial. J Pain Symptom Manage 2003;26:1105-12.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-11-2023
Actualisatie
Deze richtlijn is goedgekeurd op 6 december 2019. De Nederlandse Vereniging voor Anesthesiologie (NVA) bewaakt samen met betrokken verenigingen de houdbaarheid van deze (modules van de) richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. De geldigheidstermijn van de richtlijn is maximaal 5 jaar na vaststelling. Indien de richtlijn dan nog actueel wordt bevonden, wordt de geldigheidsduur van de richtlijn verlengd.
Houderschap richtlijn
De houder van de richtlijn (NVA) moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen.
IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
Een richtlijn is een kwaliteitsstandaard. Een kwaliteitsstandaard beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een kwaliteitsstandaard in het Register van Zorginstituut Nederland betekent dus niet noodzakelijkerwijs dat de in de kwaliteitsstandaard beschreven zorg verzekerde zorg is.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Algemene gegevens
Autoriserende/instemmende en bij de werkgroep betrokken verenigingen:
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Anesthesiologie
- Nederlandse Vereniging voor Klinische Geriatrie
- Nederlandse Vereniging voor Neurologie
- Vereniging voor Specialisten Ouderengeneeskunde
- Verpleegkundigen en Verzorgenden Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse vereniging voor professionele palliatieve zorg
Financiering
Deze richtlijn c.q. module is gefinancierd door IKNL. De inhoud van de richtlijn c.q. module is niet beïnvloed door de financierende instantie.
Procesbegeleiding
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence-based richtlijnen voor de oncologische en palliatieve zorg tot een van haar primaire taken. IKNL werkt hierbij conform de daarvoor geldende (inter)nationale kwaliteitscriteria. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen.
Doel en doelgroep
Doel
Een richtlijn geeft aanbevelingen ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek en consensus. De richtlijn 'Pijn’ geeft aanbevelingen over begeleiding en behandeling van patiënten met pijn bij kanker (zowel in de curatieve als de palliatieve fase) en beoogt hiermee de kwaliteit van de zorgverlening te verbeteren.
Hoewel de evidentie alleen is verzameld voor de diagnostiek en behandeling van pijn bij patiënten met kanker zijn de aanbevelingen ook grotendeels van toepassing voor patiënten met andere levensbedreigende aandoeningen.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de zorg voor patiënten met pijn zoals huisartsen, specialisten ouderengeneeskunde, medisch specialisten, apothekers, verpleegkundigen, verzorgenden, verpleegkundig specialisten, physician assistants, fysiotherapeuten, medisch maatschappelijk werkers, geestelijk verzorgers, GZ- en klinisch psychologen.
Indien in de richtlijn wordt gesproken over zorgverleners rondom de patiënt met pijn, worden, afhankelijk van de specifieke situatie van de patiënt, alle bovengenoemde professionals bedoeld.
De richtlijn is ook relevant voor zorgverleners van andere disciplines en vrijwilligers die werkzaam zijn in de palliatieve fase. De multidimensionele benadering van de patiënt in de palliatieve fase vergt immers een gezamenlijke, interdisciplinaire verantwoordelijkheid, zoals ook in het Kwaliteitskader palliatieve zorg Nederland is beschreven.
Samenstelling werkgroep
Alle werkgroepleden en klankbordleden zijn afgevaardigd namens wetenschappelijke, beroeps- en patiëntenverenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
Het patiëntenperspectief is vertegenwoordigd door Patiëntenfederatie Nederland.
Bij de uitvoering van het evidence-based literatuuronderzoek is de kaderopleiding Palliatieve Zorg en een literatuuronderzoeker van IKNL en de voorzitter van de richtlijnwerkgroep betrokken geweest.
Werkgroepleden
- Mw. prof. dr. M.H.J. van den Beuken-van Everdingen, internist, NIV
- Dhr. dr. M.J.M.M. Giezeman †, anesthesioloog, NVA
- Dhr. dr. A. de Graeff (voorzitter), internist-oncoloog en hospice-arts, Palliactief
- Mw. drs. H. Klaren, klinisch geriater, NVKG
- Mw. B. Kramp, verpleegkundig specialist, V&VN
- Dhr. drs. M. Martens, specialist ouderengeneeskunde en consulent palliatieve zorg, Verenso
- Mw. drs. M.J. Oortman, huisarts, SCEN-arts, palliatief consulent en hospice-arts, NHG
- Dhr. drs. P. Oosterhof, poliklinisch apotheker, NVZA
- Mw. prof.dr. A.K.L. Reyners, internist, NIV
- Mw. M. Schielke, verpleegkundig pijnspecialist, V&VN
- Mw. drs. M.C. Sieders, huisarts (waarnemend), SCEN-arts, palliatief consulent, NHG
- Dhr. dr. M.F.M. Wagemans, anesthesioloog, NVA
Klankbordleden
- Dhr. prof. dr. K.C.P. Vissers, anesthesioloog, NVA
- Mw. drs. L. Bellersen, cardioloog, NVVC
- Mw. drs. B.A. Brouwer, neuroloog/pijnspecialist NVN/pijnspecialist
- Mw. M. Geerts, verpleegkundig specialist, V&VN
- Dhr. drs. S.M. de Hosson, longarts, NVALT
- Mw. drs. S. Visser, apotheker, KNMP
- Mw. drs. R. Lammers, beleidsmedewerker, Patiëntenfederatie Nederland
Ondersteuning
- Mw. T.T.M. Bluemink-Holkenborg, secretaresse, IKNL
- Mw. drs. M.G. Gilsing, adviseur (richtlijnen) palliatieve zorg, IKNL
- Mw. dr. O.L. van der Hel, literatuuronderzoeker, IKNL
- Prof.dr. J Kleijnen, epidemioloog, literatuuronderzoeker MUMC Maastricht/York
- Mw. L.K. Liu, secretaresse, IKNL
- Dhr. dr. R. Vernooij (i.s.m. de kaderopleiding Palliatieve Zorg), literatuuronderzoeker, IKNL
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke en beroepsverenigingen.
Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld. De bevindingen zijn schriftelijk vastgelegd in de belangenverklaring en opvraagbaar via info@iknl.nl.
Inbreng patiëntenperspectief
De input van patiëntvertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt. Patiëntenfederatie Nederland is in het gehele richtlijntraject meegenomen en heeft plaats gehad in de klankbordgroep (zie ook de Samenstelling van de werkgroep).
Tijdens de landelijke consultatiefase heeft Patiëntenfederatie Nederland commentaar gegeven op de conceptrichtlijn en patiënten/naasten geraadpleegd via een referentenpanel voor onderzoeksaanvragen op het gebied van palliatieve zorg. Ook heeft de Patiëntenfederatie Nederland - naast NFK, nog andere patiëntenorganisaties benaderd voor het leveren van commentaar.
Patiëntenfederatie Nederland heeft tot slot de richtlijn goedgekeurd.
Patiënteninformatie gebaseerd op de richtlijn is opgesteld en gepubliceerd op de daarvoor relevante sites (o.a. zie link https://www.kanker.nl/gevolgen-van-kanker/pijn/wat-is/pijn-bij-kanker#show-menu).
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de zorgpraktijk, inclusief borging daarvan.
Als onderdeel van elke richtlijn stelt IKNL samen met de richtlijnwerkgroep een implementatieplan op en ondersteunt een aantal basis-activiteiten voor de implementatie. De verantwoordelijkheid voor verdere implementatie-activiteiten ligt bij de eigenaar van de richtlijn (en het veld).
Activiteiten en interventies voor verspreiding en implementatie kunnen zowel op landelijk als regionaal niveau plaatsvinden. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor en door de verschillende disciplines.
Werkwijze
In de huidige richtlijn zijn de NVA-richtlijn van 2015 en de richtlijn 'Pijn' van Pallialine samengevoegd. Daarbij zijn de onderdelen van de NVA-richtlijn, die in 2015 niet zijn herzien (en waarbij de teksten van de NVA-versie van 2008 onveranderd zijn gehandhaafd) grotendeels evidence-based (op basis van aanvullend literatuuronderzoek) aangepast en aangevuld met evidence-based en consensus-based teksten over de diagnostiek en behandeling van pijn bij patiënten met gevorderde stadia van COPD of hartfalen. De onderdelen van de NVA-richtlijn die in 2015 zijn herzien zijn onveranderd overgenomen (zie ook de Algemene inleiding).
De bedoeling is om te komen tot een integrale en actuele richtlijn over de diagnostiek en behandeling van pijn bij zowel patiënten met kanker (in de curatieve én de palliatieve fase) als bij patiënten met COPD of hartfalen.
Voor de evidence-based (herzieningen van) modules zijn de aanbevelingen voorzien van een gradering met cijfers en letters om de verhouding tussen de sterkte van de aanbeveling en de kwaliteit van de evidence weer te geven (zie onderstaande tabel). Deze werkwijze is gebaseerd op de methodiek zoals voorgesteld door de GRADE working group (zie http://www.gradeworkinggroup.org).
|
Gradering van aanbevelingen |
|
|
Sterkte van de aanbeveling |
Cijfer |
|
Sterke aanbeveling |
1 |
|
Zwakke aanbeveling |
2 |
|
Kwaliteit van de evidence |
Letter |
|
Hoog |
A |
|
Matig |
B |
|
Laag |
C |
|
Zeer laag |
D |
De richtlijnteksten die gebaseerd zijn op uitgangsvragen, zijn opgebouwd volgens het volgende vaste stramien: uitgangsvraag en aanbevelingen, literatuur, conclusies, overwegingen en referenties. De evidence tabellen staan bij de desbetreffende modules. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
De uitgangsvragen zijn óf evidence-based (via de GRADE methodiek) óf consensus-based (zonder systematisch literatuuronderzoek) uitgewerkt.
De GRADE-methodiek
Selectie
Naast de selectie van studies op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- Gerandomiseerde gecontroleerde studies (RCT's)
- Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
- De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
- De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen’
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.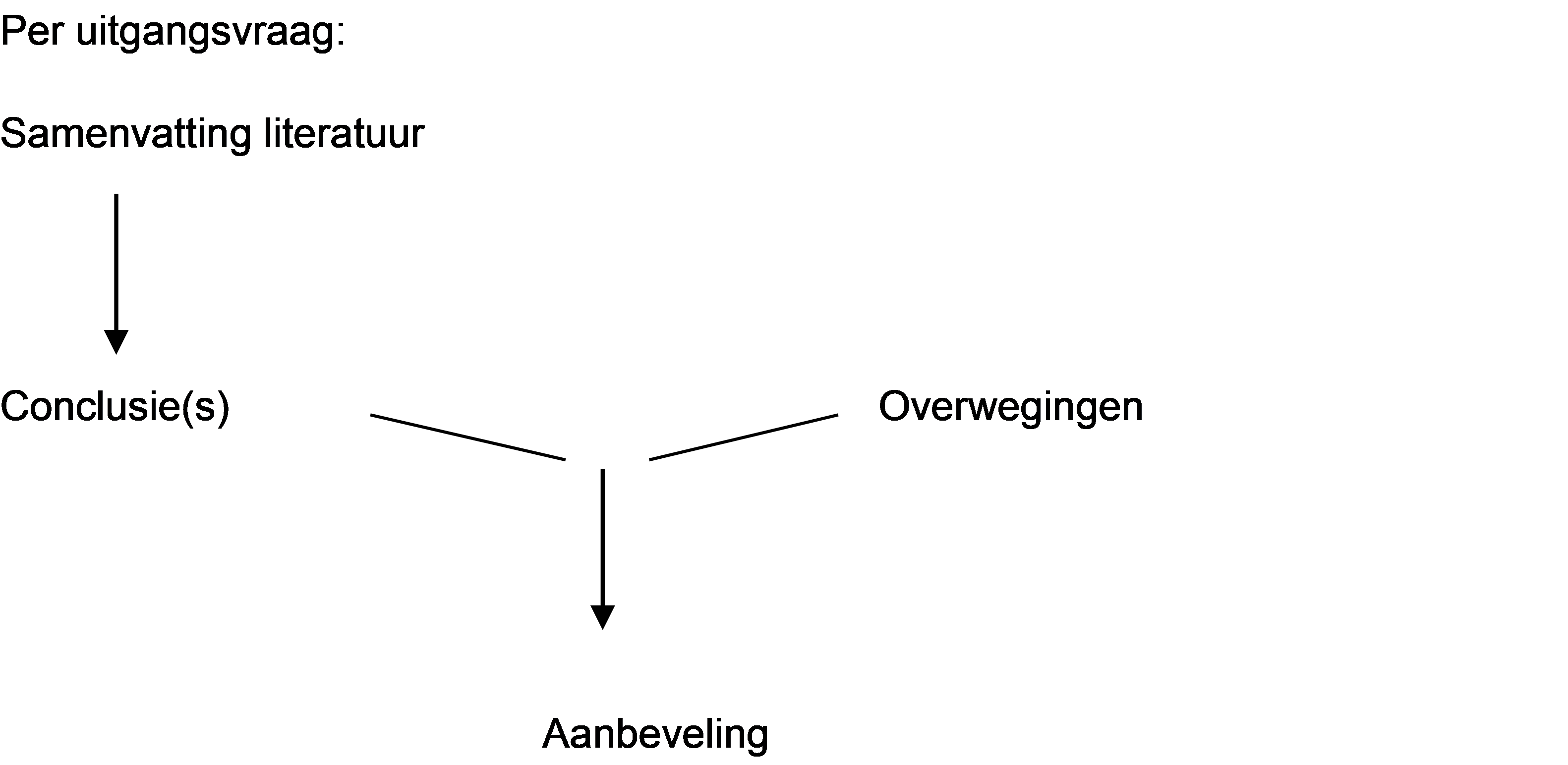
Figuur 1. Van bewijs naar aanbeveling
Bij het schrijven van de overwegingen zijn onderstaande zaken in acht genomen.
- Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
Toelichting:
- Kennis en ervaring met technieken/therapieën.
- Risico’s die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient’ plaats te vinden (sterk) of wel ‘kan worden overwogen’ (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
- Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling. - Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Maatschappelijk perspectief
(Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties)
Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
- Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin – voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Doe/geef etc. (of er dient…. te worden gegeven/gedaan)
- Zwakke/conditionele aanbevelingen: Overweeg….. te geven/te doen.
Consensus-based methodiek
Naast de evidence-based uitwerking (GRADE) zijn er ook uitgangsvragen via de consensus-based methodiek uitgewerkt. Hierbij zijn de richtlijnteksten ook gebaseerd op evidence, maar is er geen systematisch literatuuronderzoek gedaan en zijn de gevonden studies niet methodologisch beoordeeld.
