Medicamenteuze behandeling bij kinderen met obesitas
Uitgangsvraag
Wat is de rol van medicamenteuze behandeling als aanvulling op een gecombineerde lifestyle interventie bij kinderen met obesitas?
Aanbeveling
Schrijf metformine niet protocollair voor als anti-obesitas medicatie aan kinderen/ adolescenten met obesitas en bij onvoldoende effect van GLI.
Overweeg een proefbehandeling. Bespreek de te verwachten effecten van behandeling met metformine en eventuele bijwerkingen om tot een gezamenlijk besluit over een proefbehandeling te komen van 6 tot 9 maanden.
Overweeg EMA-approved medicatie als de maximale GLI interventie niet effectief is.
Deze medicatie kan alleen worden voorgeschreven in combinatie met een intensieve GLI en door kinderartsen met ervaring met deze medicatie.
Staak de medicatie als de BMI of BMI z-score met niet meer dan 4% afneemt binnen 12 weken op een volwaardige dosis.
Overwegingen
De onderstaande overwegingen en aanbevelingen zijn gebaseerd op een beperkt aantal studies, die additionele medicamenteuze behandeling met GLI vergeleken hebben met GLI alleen. In de studies zijn slechts kleine aantallen patiënten geïncludeerd en daarenboven was het uitval percentage hoog. Tenslotte was de follow up relatief kort.
In totaal zijn drie verschillende geneesmiddelen bestudeerd: metformine, orlistat en sibutramine. Geen van de onderzochte medicamenten zorgde voor minimaal 5% reductie danwel minder toename in overgewicht ten opzichte van placebo, een waarde die door de werkgroep als klinisch relevant beschouwd is.
Cruciale uitkomstmaten:
Gewichtsdaling, reductie in BMI, BMI- SDS of BMI z-score en ernstige bijwerkingen
- De cruciale uitkomstmaten Gewichtsdaling, reductie in BMI, BMI- SDS of BMI z-score zijn niet beschreven in de geïncludeerde studies.
- Het is onduidelijk wat het effect is van additionele medicamenteuze behandeling bij een GLI ten opzichte van alleen een GLI op ernstige bijwerkingen bij kinderen met obesitas. De bewijskracht is beoordeeld als zeer laag. Er werd geen significant verschil waargenomen in het aantal ernstige bijwerkingen in de groep patiënten die behandeld werden met een medicamenteuze behandeling en GLI (n= 858) ten opzichte van patiënten die behandeld werden met een GLI (n=449) (RR: 1,38; 95% BI: 0,54 tot 3,52; P = 0,36).
- Conclusie: op basis van de cruciale uitkomstmaten kan niet beoordeeld worden of er sprake is van een klinisch relevant effect zowel positief als negatief van de bestudeerde additionele medicatie (metformine, orlistat en sibutramine).
Belangrijke uitkomstmaten:
Gewichtsverandering (kg), verandering in BMI, BMI- SDS of BMI z-score
- De bewijskracht dat additionele medicamenteuze behandeling bij een GLI ten opzichte van alleen een GLI leidt tot een grotere afname danwel mindere toename in gewicht bij kinderen met obesitas is redelijk. Het gemiddelde gewicht nam significant meer af in deelnemers die een additionele medicamenteuze behandeling kreeg bij een GLI ten opzichte van deelnemers die behandeld werden met alleen een GLI (MD: -3,99; 95% BI: -5,72 tot -2,27; p-value = 0,0002).
- De bewijskracht dat additionele medicamenteuze behandeling bij een GLI ten opzichte van alleen een GLI leidt tot een grotere afname danwel mindere toename in BMI bij kinderen met obesitas is redelijk. Het gemiddelde BMI van de deelnemers (in BMI) nam significant meer af in de groep die een additionele medicamenteuze behandeling kreeg dan in de GLI-groep (MD: -1,25; 95% BI: -1,68 tot -0,81; P < 0,0001).
- De bewijskracht voor de uitkomstmaat BMI Z-score werd niet bepaald, omdat er geen studies voor deze uitkomstmaat werden geïncludeerd.
- Conclusie: Op basis van bovenstaande bevindingen kan niet bepaald worden of er sprake is van een klinisch relevant effect zoals gedefinieerd door de werkgroep. De bewijskracht van het effect op gewichtsverandering en verandering in BMI van metformin en orlistat mag redelijk genoemd worden, de beperking zit vooral in de duur van de studies en het hoge uitval percentage.
Belangrijke uitkomstmaten:
Percentage uitvallers vanwege bijwerkingen, remissie van risicofactoren op co-morbiditeit/ remissie van co-morbiditeit(en)
- Het is onduidelijk wat het effect is van additionele medicamenteuze behandeling bij een GLI ten opzichte van alleen een GLI op het aantal uitvallers vanwege bijwerkingen bij kinderen met obesitas. Bewijskracht zeer laag. Er werd geen significant verschil waargenomen in het aantal ernstige bijwerkingen in de groep patiënten die behandeld werden met een medicamenteuze behandeling en GLI (n= 858) ten opzichte van patiënten die behandeld werden met een GLI (n=449) (RR: 1,38; 95% BI: 0,54 tot 3,52; P = 0,36).
- Het is onduidelijk wat het effect is van additionele medicamenteuze behandeling bij een GLI ten opzichte van alleen een GLI op de remissie van risicofactoren op co-morbiditeit/remissie van co-morbiditeit(en). Bewijskracht zeer laag.
- Conclusie: Op basis van bovenstaande bevindingen kan geen uitspraak gedaan worden met betrekking tot het aantal uitvallers ten gevolge van bijwerkingen en het effect op remissie van risicofactoren op co-morbiditeit/remissie van co-morbiditeit(en) .
Nadelen: beperkt aantal studies verricht bij kinderen met een beperkt aantal geneesmiddelen
In verband met het beperkt aantal studies is ook gekeken naar de resultaten van studies gedaan bij volwassenen, beschreven in een systematische review door Lentferink, om tot een advies te komen ten aanzien van de additionele medicamenteuze behandeling van obesitas (Lentferink, 2018).
Ten aanzien van de cruciale uitkomstmaten: Gewichtsdaling, reductie in BMI, BMI- SDS of BMI z-score, en d belangrijke uitkomstmaten: Gewichtsverandering (kg), verandering in BMI, BMI- SDS of BMI z-score.
Het effect van metformine op de BMI varieerde. In kinderen/adolescenten werd een geringere afname gezien ten opzichte van volwassenen. In de pediatrische studies werd een maximale afname van de BMI geobserveerd na ongeveer 9 maanden (Srinivasan, 2006; Yanovski, 2011; Wiegand, 2010; Warnakulasuriya, 2018; Wilson, 2010). Daarna werd een toename van de BMI gezien. Echter aan het eind van de interventie/studie was de BMI over het algemeen lager in de metformine groep ten opzichte van de placebo-groep. In de studies bij volwassenen daarentegen werd de afname van de BMI behouden ook na het stoppen van de interventie/studie (Knowler, 2002; Diabetes Prevention Program Research Group; Iqbal Hydrie, 2012; Li, 1999; Worsley, 2015; O’Brien, 2017). Verschillende factoren zijn mogelijk van invloed op dit verschil.
Op de eerste plaatst is het belangrijk om te vermelden dat de BMI bij kinderen toeneemt met de leeftijd. Ten gevolge van deze fysiologische toename van de BMI kan het effect van metformine bij kinderen in de groei onderschat worden. Een meer directe maat voor het observeren van het effect op de BMI, is de leeftijd- en geslacht specifieke BMI: de BMI-z-score of de BMI-SDS. Vanuit systematische literatuur analyse werden geen studies geïncludeerd met de uitkomstmaat BMI-z-score, welke was gedefinieerd als cruciale uitkomstmaat.
Op de tweede plaats kan de dagelijkse dosering van metformine invloed hebben op het geobserveerde effect op de BMI. In farmacokinetische studies is aangetoond dat de klaring van metformine in zowel kinderen als volwassenen met obesitas hoger is dan in eenzelfde populatie met gezond gewicht, (McDonagh, 2014; Van Rongen, 2018). Dit kan geleid hebben tot een inadequate dagelijkse dosering. In de pediatrische studies werd een relatie gezien tussen de dosering van metformine en de afname van de BMI. Deze relatie werd niet duidelijk waargenomen in de studies bij volwassenen. De dagelijkse dosering werd niet gedefinieerd als uitkomstmaat in de systematische literatuur analyse.
Ten slotte is therapietrouw geassocieerd met afname van het gewicht en de tijdsduur van de gewichtsafname (Clarson, 2014; Diabetes Prevention Program Research Group, 2009; Van Rongen, 2018). Therapietrouw is mogelijk gerelateerd aan de puberteit, wat bekend staat als een turbulente levensfase en kan een verklaring zijn waarom bij kinderen/adolescenten na de initiële afname van het gewicht weer een toename van het gewicht wordt gezien. Therapietrouw werd niet gedefinieerd als uitkomstmaat in de systematische literatuur analyse.
Op basis van de gegevens van de systematische literatuur analyse waar de bewijskracht van de belangrijke uitkomstmaat verandering gewicht/BMI redelijk is en met de kennis van de systematische review van Lentferink kan metformine aanbevolen worden als additionele behandeling in kinderen/adolescenten, mits zij goed gemotiveerd zijn en een adequate dosering op basis van de toegenomen klaring in deze patiënten populatie wordt voorgeschreven.
Ten aanzien van de belangrijke uitkomstmaten: remissie van risicofactoren op co-morbiditeit/ remissie van co-morbiditeit(en)
In de hierboven beschreven systematische review (Lentferink, 2018) is ook gekeken naar het effect van metformine op risicofactoren en co-morbiditeit. In de pediatrische studies werd een wisselend effect gezien op de insuline resistentie. Daarentegen werd in de studies bij volwassenen een significante reductie gezien van de progressie naar diabetes mellitus type 2 (Knowler, 2002). Opgemerkt dient te worden dat de volwassenen over het algemeen een gestoorde glucose tolerantie hadden terwijl bij de kinderen /adolescenten slechts sprake was van insuline resistentie. Waarschijnlijk bevinden de volwassenen zich verder in het natuurlijk beloop van de ontwikkeling naar diabetes mellitus type 2 door toename in insuline resistentie en afname in insuline secretie capaciteit waardoor het effect van de interventie eerder duidelijk wordt.
Alhoewel op basis van het verrichte systematisch onderzoek de bewijskracht voor remissie van risicofactoren op co-morbiditeit/remissie van co-morbiditeit(en) zeer laag is, kan op basis van de bevindingen bij volwassenen in de hierboven beschreven systematische review metformine overwogen worden als additionele medicamenteuze behandeling van obesitas bij kinderen/adolescenten met insuline resistentie/gestoorde glucose tolerantie.
In 2017 is door de European Society of Endocrinology, de Pediatric Endocrine Society en de Endocrine Society gezamenlijk de Clinical Practise Guideline: Pediatric Obesity gepubliceerd (Styne, 2017). Men adviseert om geen anti-obesitas medicatie voor te schrijven bij kinderen < 16 jaar, tenzij in trialverband. Men stelt voor met de laagste mate van bewijs om FDA-approved medicatie voor te schrijven als GLI niet helpt waarbij dit alleen gedaan moet worden door mensen met ervaring met deze medicatie. Een behandeling moet worden gestaakt als de BMI of BMI z-score minder dan 4% afneemt na 12 weken. Metformin wordt niet geadviseerd in verband met beperkte effect. Orlistat wordt slecht verdragen.
In verband met het beperkt aantal afgeronde geneesmiddelen studies hebben we de zoekvraag(en) van de systematische literatuur analyse ook verricht (tot juli 2019) op het Amerikaanse trialregister CinicalTrials.gov en het trialregister van de WHO. Op basis van het aantal lopende trials, die nieuwe medicinale producten bestuderen en die mogelijk een klinisch relevant effect kunnen hebben is het van belang om deze module van de richtlijn op korte termijn te herzien.
De medicamenten hebben mogelijke bijwerkingen. De te verwachte bijwerkingen van metformin zijn met name maagdarmklachten (misselijkheid en diarree) en vitamine B12 te kort. Bijwerkingen van orlistat zijn voornamelijk vetdiarree met als gevolg deficiënties van vet oplosbare vitamines. Sibutramine is op basis van bijwerkingen van de markt is gehaald.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten zullen de opgave van voortdurende dagelijkse inname van pillen en de eventueel optredende bijwerkingen van misselijkheid en diarree als grootste bezwaar zien.
Kosten (middelenbeslag)
De kosten van metformin zijn laag, gemiddelde dagprijs bij gebruik 2000 mg: 0,07-0,24 euro.
Het gebruikt van metformine brengt gezien de lage gemiddelde dagprijs (0,07-0,24 €) geen extra kosten voor de maatschappij en heeft geen negatief impact op het ziekenhuis/afdelingsbudget. De kosten van het geneesmiddel, de positieve effecten op gewicht/BMI, mogelijk geringe bijwerkingen, en mogelijk vermindering van complicaties op lange termijn kan metformine kosten besparend zijn (Herman, 2013).
Aanvaardbaarheid voor de overige relevante stakeholders
Het effect van metformine is onder andere afhankelijk van therapie trouw, dosering en insuline status. Het advies is om metformine alleen voor de schrijven aan kinderen/adolescenten, die goed gemotiveerd zijn, bij voorkeur bij diegene met aanwijzingen voor insuline resistentie/gestoorde glucose tolerantie en in een adequate dosering in verband met de toegenomen klaring bij obesitas van metformine.
Haalbaarheid en implementatie
Op dit moment is geen medicatie voor de behandeling van obesitas bij kinderen/adolescenten geregistreerd.
Metformine is in Nederland geregistreerd voor de behandeling van diabetes mellitus type 2 vanaf de leeftijd van 10 jaar. Door het gebruik van metformine in adolescenten met diabetes mellitus type 2 is er ervaring met het voorschrijven van dit geneesmiddel bij kinderen/ adolescenten. Daarnaast wordt metformine frequent off label voorgeschreven voor insuline resistentie in diabetes mellitus type 1, overgewicht/obesitas en polycysteus ovarium syndroom (Farsani, 2015).
Orlistat geregistreerd voor de behandeling van obesitas bij volwassenen. Orlistat is naast op recept ook vrij verkrijgbaar. Er is echter geen ervaring met het voorschrijven orlistat in kinderen/ adolescenten.
Sibutramine is niet meer beschikbaar als geneesmiddel.
Totdat nieuwe middelen met bewezen effectiviteit geregistreerd zijn moeten behandelaren op de hoogte zijn dat bij het falen van GLI eventueel metformine als additionele behandeling kan worden ingezet bij gemotiveerde kinderen/adolescenten.
Rationale/ balans tussen de argumenten voor en tegen de interventie
De werkgroep beveelt, gebaseerd op de beperkte literatuur en de overwegingen hierboven, gelet op het onvoldoende klinisch relevante effect op gewicht, ondanks de overall beperkte bijwerkingen en lage kosten, niet aan om metformin protocollair voor te schrijven voor kinderen/adolescenten met obesitas en onvoldoende effect van GLI.
Het valt te overwegen om aan individuele patiënten na goede gezamenlijke afweging van de te verwachten effecten en eventuele bijwerkingen een proefbehandeling van 6 tot 9 maanden voor te stellen om bij een voor patiënt relevant effect metformin te continueren.
Onderbouwing
Achtergrond
In Nederland is voor de behandeling van obesitas bij kinderen/ adolescenten geen medicatie geregistreerd. Door het ontbreken van geregistreerde medicatie voor de behandeling van obesitas kan geen additionele medicamenteuze behandeling gegeven worden bij gecombineerde leefstijl interventie (GLI), als GLI onvoldoende effect heeft gehad bij kinderen/adolescenten. Bij onvoldoende effect van GLI zou additionele medicamenteuze behandeling mogelijk kunnen leiden tot afname van gewicht/ BMI en daarmee remissie van risicofactoren op co-morbiditeit dan wel remissie van co-morbiditeit(en).
Conclusies / Summary of Findings
|
Redelijk GRADE |
Additionele medicamenteuze behandeling bij een GLI ten opzichte van alleen een GLI leidt waarschijnlijk tot een grotere afname danwel mindere toename in overgewicht bij kinderen met obesitas.
Bronnen: Berkowitz, 2003; Berkowitz, 2006; Garcia-Morales, 2006; Mauras, 2012; NCT00001723; van der AA, 2016; Warnakulasuriya, 2018; Yanovski, 2011 |
|
Redelijk GRADE |
Additionele medicamenteuze behandeling bij een GLI ten opzichte van alleen een GLI leidt waarschijnlijk tot een grotere afname danwel mindere toename in BMI-SDS bij kinderen met obesitas
Bronnen: Berkowitz, 2003; Chanoine, 2005; Clarson, 2009; Garcia-Morales, 2006; Love-Osborne, 2008; Mauras, 2012; NCT00001723; Berkowitz, 2006; van der AA, 2016; Warnakulasuriya, 2018; Wiegand, 2010; Wilson, 2010; Yanovski, 2011; |
|
- GRADE |
De bewijskracht voor de uitkomstmaat BMI z-score werd niet bepaald, omdat er geen studies voor deze uitkomstmaat werden geïncludeerd. |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van additionele medicamenteuze behandeling bij een GLI ten opzichte van alleen een GLI op ernstige bijwerkingen bij kinderen met obesitas.
Bronnen: Berkowitz, 2006; Chanoine, 2005; Clarson, 2009; Garcia-Morales; 2006; Mauras, 2012; NCT001723; Wilson, 2010; Van der AA, 2016; Warnakulasuriya, 2018; Yanaovski, 2011 |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van additionele medicamenteuze behandeling bij een GLI ten opzichte van alleen een GLI op het aantal uitvallers vanwege bijwerkingen bij kinderen met obesitas.
Bronnen: Berkowitz, 2003; Berkowitz, 2006; Chanoine, 2005; Love-Osborne, 2008; NCT00001723; van der AA, 2016; Wiegand, 2010; Wilson, 2010; Yanovski, 2011; |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van additionele medicamenteuze behandeling bij een GLI ten opzichte van alleen een GLI op de remissie van risicofactoren op co-morbiditeit/remissie van co-morbiditeit(en).
Bronnen: Love-Osborne, 2008; van der AA, 2016; Warnakulasuriya, 2018 |
Samenvatting literatuur
Beschrijving studies
De systematische review van Mead (2016) werd als uitgangspunt genomen. Mead (2016) verrichte systematisch onderzoek naar de effectiviteit van medicatie ten behoeve van obesitas bij kinderen en adolescenten. Er werd systematisch gezocht in CENTRAL, MEDLINE, Embase, PubMed, LILACS, ICTRP (WHO) en ClinicalTrials.gov tot Maart 2016. RCT’s over de effectiviteit van medicatie voor obesitas (zowel met als zonder licentie voor deze indicatie) bij kinderen en adolescenten (gemiddelde leeftijd onder de 18 jaar) met een minimale behandeling van 3 maanden en 6 maanden follow-up vanaf baseline werden geïncludeerd. Interventies specifiek gericht op de behandeling van eetstoornissen of type 2-diabetes mellitus, en studies die patiënten met een secundaire of genetische vorm van obesitas of zwangeren includeerden werden geëxcludeerd. Tevens werden studies over de effectiviteit van groeihormonen voor de behandeling van obesitas geëxcludeerd. De primaire uitkomstmaten waren BMI, lichaamsgewicht en bijwerkingen. Secundaire uitkomstmaten waren gezondheid gerelateerde kwaliteit van leven en zelfvertrouwen, lichaamsvetverdeling, verandering in gedrag, de mening van de deelnemers over de interventie, morbiditeit, all-cause mortaliteit en sociaaleconomische effecten. De definitie van de uitkomstmaten is beschreven in Mead (2016).
De systematische review van Mead (2016) includeerde 21 RCTs (Atabek, 2008; Berkowitz, 2003; Berkowitz, 2006; Chanoine, 2005; Clarson, 2009; Franco, 2014; Freemark, 2001; García-Morales, 2006; Godoy-Matos, 2005; Kendall, 2013; Maahs, 2006; Mauras, 2012; NCT00001723; Ozkan, 2004; Prado, 2012; Rezvanian, 2010; Srinivasan, 2006; van Mill, 2007; Wiegand, 2010; Wilson, 2010; Yanovski, 2011). Voor deze richtlijnmodule werden negen studies geëxcludeerd omdat ze niet voldeden aan de PICO (Atabek, 2008; Freemark, 2010; Franco, 2014; Godoy-Matos, 2005; Kendall, 2013; Maahs, 2006; Rezvanain, 2010; Srinivasan, 2006; van Mil, 2007). Tevens werden twee studies vanwege methodologische beperkingen geëxcludeerd (Ozkan, 2004; Prado, 2012). Uit de systematische review van Mead (2016) werden uiteindelijk tien RCTs geselecteerd die voldeden aan de PICO (Berkowitz, 2003; Berkowitz, 2006; Chanoine, 2005; Clarson, 2009; Garcia-Morales; 2006; Mauras, 2012; Condarco, 2013; Wiegand, 2010; Wilson, 2010; Yanaovski, 2011). De resultaten van Condarco (2013) zijn niet gepubliceerd.
In de RCT van Warnakulasuriya (2018) werd onderzoek verricht naar de effectiviteit van metformine (n = 166) ten opzichte van een placebo (n = 173) bij kinderen met obesitas (BMI/Age-SDS≥+2SD, WHO 2007) tussen de 8 en 16 jaar in het Gampaha district (Sri Lanka). Volgens de Aziatische BMI definitie (BMI ≥ 25) hadden alle geïncludeerde kinderen obesitas. Allebei de groepen ontvingen een gecombineerde lifestyle interventie. Evenals de dosering van de medicatie werd de gecombineerde lifestyle interventie beschreven in de evidence-tabel. Tijdens de studie vielen 189 kinderen uit vanwege verschillende redenen (n interventie = 98; n controle = 91) (zie evidence-tabel). Er werden 140 kinderen (n interventie = 68; n controle = 82) geïncludeerd in de analyse. In de controlegroep (46% vrouw) was tijdens baseline de gemiddelde leeftijd van de deelnemers 12,25 (SD: 2,27) en gemiddelde BMI 27,44 (SD: 2,7). In de interventie groep (41% vrouw) was de gemiddelde leeftijd van de deelnemers 11,94 (SD: 2,17) en gemiddelde BMI 27,44 (SD:2,96). De follow-up duur was 12 maanden (Warnakulasuriya, 2018).
Van der AA (2016) verrichte een RCT naar de effectiviteit van metformine (2000 mg) ten opzichte van een placebo in adolescenten (10 tot 16 jaar) met obesitas (BMI-SDS > 2,3) en insuline resistentie (HOMA-IR ≥ 3,4). Tevens ontvingen beide groepen een gecombineerde lifestyle interventie. De beschrijving hiervan werd weergegeven in de evidence-tabel. In respectievelijk de interventie en controlegroep werden 32 en 30 deelnemers geïncludeerd. Tijdens de studie vielen 18 deelnemers (n interventie = 8; n controle = 10) uit vanwege verschillende redenen (zie evidence-tabel). In de analyse werden alleen de deelnemers meegenomen die met de behandeling begonnen (tenminste één tablet per dag van metformine of placebo) en follow-up duur voltooide geïncludeerd (n interventie = 23; n controle = 19). In de interventiegroep (74% vrouw) was de gemiddelde leeftijd tijdens baseline 13,6 (95%BI: 12,6 tot 15,3) en de mediane BMI 29,8 (IQR: 28,1 tot 34,5). In de controlegroep (58% vrouw) was de gemiddelde leeftijd van de deelnemers 12,0 (95% BI: 11,3 tot 14,0) en de mediane BMI 30.5 (IQR: 28,7 tot 38,6). De follow-up duur was 18 maanden (Van der AA, 2016).
In de RCT van Love-Osborne (2008) werd onderzoek verricht naar de effectiviteit van metformine ten opzichte van een placebo in adolescenten (12 tot 19 jaar). Deelnemers met een nuchtere insuline gehalte > 25 µmol/ml of Homeostatic Model Assessment for Insulin Resistance (HOMA-IR) > 3,5 en 2 van 3 risicofactoren: acanthosis nigricans, BMI > 95e percentiel, familieleden met diabetes mellitus 2 (HOMA-IR; zie exclusietabel) werden uitgenodigd voor de studie. Hierdoor hadden mogelijk niet alle deelnemers obesitas. De dosering van de medicatie is beschreven in de evidence-tabel. De deelnemers mochten zelf drie streefdoelen kiezen op het gebied van dieet en/of lichaamsbeweging, waardoor de GLI mogelijk niet bij alle deelnemers bestond uit tenminste twee componenten. Ondanks de beperkingen heeft de werkgroep er toch voor gekozen om de studie te includeren. Er werden 85 deelnemers gerandomiseerd (n interventie = 60; n controle = 25). In de interventie groep (72% vrouw) was de gemiddelde leeftijd 15,5 (SD: 1,7) en gemiddelde BMI 39,4 (SD:6,5) tijdens baseline. In de controlegroep (68% vrouw) was de gemiddelde leeftijd 14,2 (SD: 14,6) en de gemiddelde BMI 39,3 (SD: 7,2) tijdens baseline. Tijdens de studie vielen 21 deelnemers uit (n interventie = 12; n controle = 9). In de analyse van de uitkomstmaten werden 64 deelnemers geïncludeerd (n interventie = 48; n controle = 16). De follow-up duur van de studie was 6 maanden (Love-Osborne, 2008).
Uiteindelijk werden 10 RCTs uit de systematische review en 3 RCT’s die gepubliceerd zijn na de zoekdatum van Mead (2016) opgenomen in de literatuuranalyse.
Resultaten
1.1 Gewicht
Acht studies vergeleken het effect van een additionele medicamenteuze behandeling bij een GLI (n = 604) ten opzichte van een GLI (n=408) op gewichtsverandering (kg) (Yanovski, 2011; Mauras, 2012; Warnakulasuriya, 2018; Berkowitz, 2003; Berkowitz, 2006; Garcia-Morales, 2006; NCT00001723; van der AA, 2016). Het gemiddelde gewicht nam significant meer af in deelnemers die behandeld werden met een additionele medicamenteuze bij een GLI ten opzichte van deelnemers die behandeld werden met een GLI (MD: -3,99; 95% BI: -5,72 tot -2,27; p = 0,0002).
Van der AA (2016) werd niet gepoold vanwege heterogene rapportage van de publicatie (mediaan en interquartile range (IQR)). De gewichtsverandering (kg) na 18 maanden was 1,6 (IQR: -4,2 tot 5,9) in de metforminegroep (n=23) en 12,0 (IQR: 2,7 tot 17,0) in de controlegroep (n=19) (p = niet weergegeven). In Love-Osborne (2008) werd de uitkomstmaat niet beschreven.
Figuur 1 Additionele medicamenteuze behandeling bij GLI versus GLI - gewichtsverandering (kg)
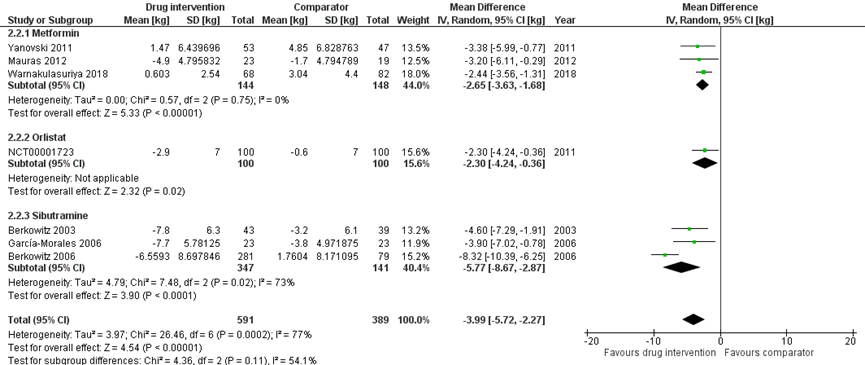
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
1.1 Gewicht
De bewijskracht voor RCT’s start hoog. De bewijskracht voor de uitkomstmaat gewicht is met 1 niveau verlaagd gezien de hoge uitval en mogelijke overige beperkingen in studieopzet (risk of bias wegens een relevante loss to follow-up). Derhalve komt de bewijskracht voor de uitkomstmaat uit op redelijk.
1.2 Verandering in BMI
Dertien studies vergeleken het effect van een additionele medicamenteuze behandeling bij een GLI (n = 1086) ten opzichte van een GLI (n=675) op de verandering in BMI (Clarson, 2009; Wiegand, 2010; Wilson, 2010; Yanovski, 2011; Mauras, 2012; Love-Osborne, 2008; Warnakulasuriya, 2018; Chanoine, 2005; NCT00001723; Berkowitz, 2003; Garcia-Morales, 2006; Berkowitz, 2006; van der AA, 2016). Het gemiddelde BMI van de deelnemers (in BMI) nam significant meer af in de groep die een additionele medicamenteuze behandeling kreeg dan in de GLI-groep (MD: -1,25; 95% BI: -1,68 tot -0,81; P < 0,0001).
Van der AA (2016) werd niet gepoold vanwege heterogene rapportage van de publicatie (mediaan en interquartile range (IQR)). De verandering in BMI na 18 maanden was significant kleiner (mediaan, IQR: 0,2, -2,9 tot 1,3) in de metforminegroep (n=23) ten opzichte van de controlegroep (n=19) (mediaan, IQR: 1,2, -0,3 tot 2,4) (p- = 0,02).
Figuur 2 Additionele medicamenteuze behandeling bij GLI versus GLI - verandering in BMI
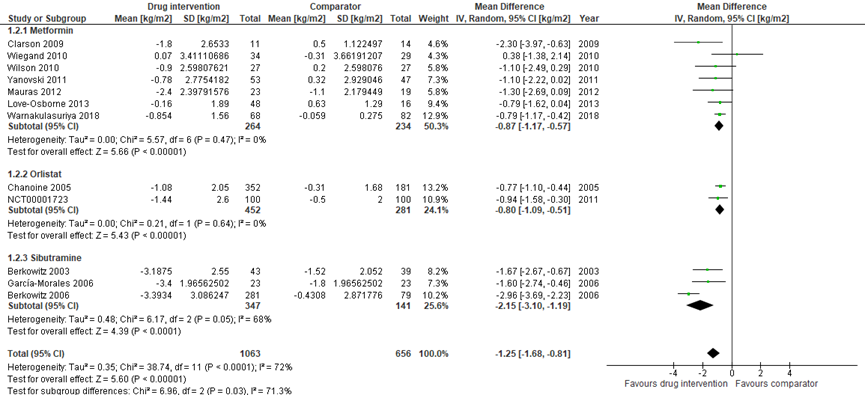
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
1.2 Verandering in BMI
De bewijskracht voor RCT’s start hoog. De bewijskracht voor de uitkomstmaat verandering in BMI is met 1 niveau verlaagd gezien beperkingen in studieopzet (risk of bias; ongeveer de helft van de trials had een hoog risico op bias in één of meerdere domeinen, zoals selectief rapporteren). Derhalve komt de bewijskracht voor de uitkomstmaat uit op redelijk.
1.3 BMI z-score
De BMI z-score werd niet gerapporteerd in de geïncludeerde studies (Mead, 2016; Warnakulasuriya, 2018; Van der AA, 2016; Love-Osborne, 2008).
1.3 BMI z-score
De bewijskracht voor de uitkomstmaat BMI z-score werd niet bepaald, omdat er geen studies voor deze uitkomstmaat werden geïncludeerd.
1.4 Ernstige bijwerkingen
Drie studies rapporteerden dat er ernstige bijwerkingen hadden plaatsvonden tijdens de studieperiode (Berkowitz, 2006; Chanoine, 2005; NCT001723; Wilson, 2010). Er werd geen significant verschil waargenomen in het aantal ernstige bijwerkingen in de groep patiënten die behandeld werden met een medicamenteuze behandeling en GLI (n= 858) ten opzichte van patiënten die behandeld werden met een GLI (n=449) (RR: 1,38; 95% BI: 0,54 tot 3,52; P = 0,36).
In zes studies werd de uitkomstmaat ernstige bijwerkingen niet gerapporteerd (Berkowitz, 2003; Wiegand, 2010; Love-Osborne, 2008). In de studie van Love-Osborne (2008) rapporteerden 17 deelnemers gastro-intestinale bijwerkingen (metforminegroep = 14; controlegroep = 3).
De overige zeven studies rapporteerden dat er geen ernstige bijwerkingen hadden plaatsgevonden tijdens de studieperiode (Clarson, 2009; Garcia-Morales; 2006; Mauras, 2012; Yanaovski, 2011; Van der AA, 2016; Warnakulasuriya, 2018).
Figuur 3 Additionele medicamenteuze behandeling bij GLI versus GLI – ernstige bijwerkingen
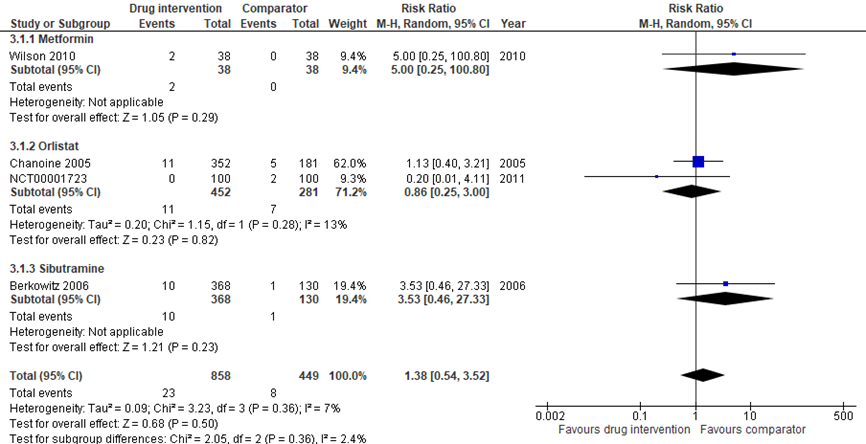
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
1.4 Ernstige bijwerkingen
De bewijskracht voor de RCT’s start hoog. De bewijskracht voor de uitkomstmaat ernstige bijwerkingen is met 1 niveau verlaagd gezien de hoge uitval en mogelijke overige beperkingen in studieopzet (risk of bias, ongeveer de helft van de trials had een hoog risico op bias in één of meerdere domeinen, zoals selectief rapporteren), met 1 niveau verlaagd omdat in de systematische review van Mead (2016) de in de studie gehanteerde definitie voor ernstige bijwerkingen is gebruikt en met 1 niveau verlaagd gezien het geringe aantal events (imprecisie). Daarom komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
1.5 Aantal uitvallers
Negen studies rapporteerde het aantal uitvallers vanwege bijwerkingen (Wiegand, 2010; Wilson, 2010; Yanovski, 2011; Chanoine, 2005; NCT00001723, Berkowitz, 2003; Berkowitz, 2006; Love-Osborne, 2008; van der AA, 2016). Love-Osborne (2008) rapporteerde dat er gedurende de studieperiode; drie patiënten vanwege gastro-intestinale bijwerkingen (metforminegroep = 2; controlegroep = 1) waren uitgevallen. Van der AA (2016) rapporteerde twee uitvallers vanwege bijwerkingen in de metforminegroep; één patiënt vanwege ernstige misselijkheid (ondanks dosisverlaging) en één patiënt vanwege buikpijn (patiënt was niet bereid om de dosis te verlagen en stopte voortijdig met de studie). In de controlegroep was er geen sprake van uitval vanwege bijwerkingen (Van der AA, 2016). Er werd geen significant verschil waargenomen in het aantal uitvallers vanwege bijwerkingen in de groep patiënten die behandeld werden met een additionele medicamenteuze behandeling bij een GLI (n= 1085) ten opzichte van patiënten die behandeld werden met een GLI (n=620) (RR: 1,22; 95% BI: 0,69 tot 2,13; P = 0,73).
In de studie van Warnakulasuriya (2018) werd niet gerapporteerd dat er deelnemers waren gestopt vanwege bijwerkingen. In de metforminegroep waren 98 (62 = vonden de studie niet leuk; 4 = afgewezen door de huisarts; 4 = verhuisd; 28 = lost to follow-up) en in de placebogroep 91 (58 = vonden de studie niet leuk; 5 = afgewezen door de huisarts; 3 = verhuisd; 25 = lost to follow-up) deelnemers gestopt.
Figuur 4 Additionele medicamenteuze behandeling bij GLI versus GLI - aantal uitvallers
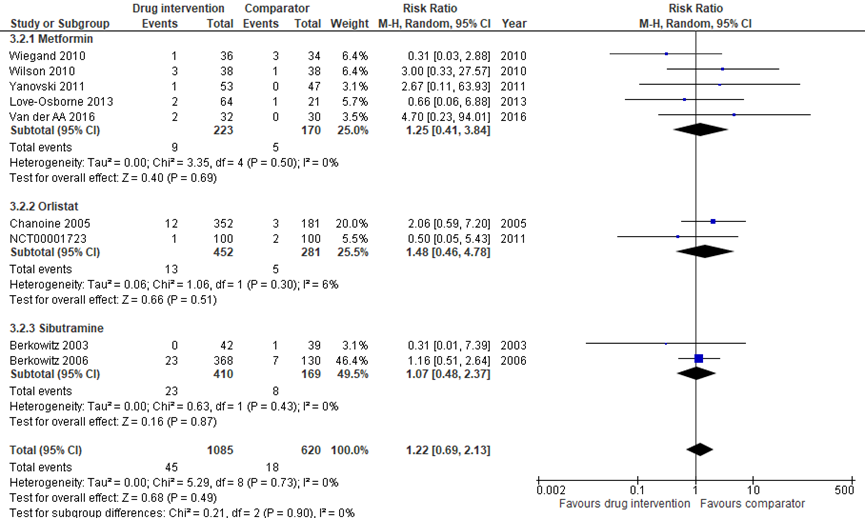
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
1.5 Aantal uitvallers
De bewijskracht voor de RCT’s start hoog. De bewijskracht voor de uitkomstmaat aantal uitvallers is met 1 niveau verlaagd gezien de hoge uitval en mogelijke overige beperkingen in de onderzoeksopzet (risk of bias wegens een relevante loss to follow-up) en 2 punten afgetrokken vanwege het geringe aantal events (imprecisie). Daarom komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
1.6 Remissie van riscofactoren op co-morbiditeit, remissie van co-morbiditeit(en)
In de systematische review van Mead (2016) werd de uitkomstmaat remissie van risicofactoren op co-morbiditeit/remissie van comorbiditeit(en) niet beschreven.
Diabetes mellitus type 2 (nuchter bloedglucose, en gestoorde glucose tolerantie)
Love-Osborne (2008) rapporteerde een verbetering of remissie van gestoord nuchter glucose (IFG) of gestoorde glucose tolerantie (IGT) bij 6 deelnemers. Er werd niet gerapporteerd of de patiënten deel uit maakte van de metformine- of controlegroep en wat de bijbehorende effectmaten waren.
Van der AA (2016) rapporteerde de uitkomstmaat Homeostatic Model Assessment for Insulin Resistance (ΔHOMA-IR) en HbA1c. Er werd geen significant verschil waargenomen in ΔHOMA-IR na 18 maanden in deelnemers behandeld met metformine en GLI ten opzichte van de controlegroep (mediaan (IQR): metformine: -1,00 (-3,17 tot 2,25); controle: -0,16 (-0,71 tot 1,48); p-value = 0,28). Er was een significant verschil in toename van HbA1c na 18 maanden tussen de metformine- en controlegroep (mediaan (IQR): metformine: 1,0 (-1,0 tot 2,3); controle: 3,0 (0,0 tot 5,0); p-value = 0.02). Van der AA (2016) rapporteerde dat er geen deelnemers waren met HbA1c waarden boven de normaalwaarden na 18 maanden (Van der AA, 2016).
In Warnakulasuriya (2018) werd geen significant verschil in verandering van nuchtere plasma glucose (FPG), nuchtere plasma insuline (FPI)of 2-hour insuline na zowel 6 als 12 maanden tussen de metformine- en controlegroep waargenomen. Tevens werd er geen significant verschil in verandering van HOMA-IR na 12 maanden tussen de metformine- en controlegroep gerapporteerd (gemiddelde afname, 95% BI: metformine: -1,779 (-2,577 tot -0,980); controle: -0,792 (-1,549 tot -0,035); p-value = 0,078).
Hypertensie (systolische, diastolische bloeddruk en hartfrequentie)
Warnakulasuriya (2018) rapporteerde de verandering van systolische en diastolische bloeddruk over tijd. Er werd een grotere afname in systolische bloeddruk/Age-Standard Deviation Score (SDS) gerapporteerd in de metformine- ten opzichte van de controlegroep na 6 maanden (gemiddelde afname, 95%BI: metformine: -0,415 (-0,651 tot -0,178); controle: -0,015 (-0,232 tot 0,201); p-value = 0,015) en 12 maanden (gemiddelde afname, 95% BI: metformine: -0,834 (-1,060 tot -0,608); controle: -0,477 (-0,684 tot 0,270); p-value = 0,023). Er werd geen significant verschil in verandering van diastolische bloeddruk over tijd tussen de metformine en controlegroep waargenomen.
In Love-Osborne (2008) en Van der AA (2016) werd er geen data gerapporteerd over de verandering van systolische en diastolische bloeddruk over tijd.
Dyslipidemie (Triglyceride, Cholesterol en LDL)
Warnakulasuriya (2018) vond een grotere significante verandering in zowel het totale serumcholesterol als LDL-cholesterol na 6 maanden in de metforminegroep ten opzichte van de controlegroep ((Totale serumcholesterol, gemiddelde afname (95% BI): metformine -0,95 (-1,05 tot -0,84); controle: -0,67 (-0,78 tot -0,58); p-value = 0,001) (LDL cholesterol gemiddelde afname, (95% BI): metformine -0,67 (-0,78 tot -0,58); controle: -0,45 (-0,54 tot -0,35); p-value = 0,001)). Na 12 maanden was het verschil in verandering van het totale serumcholesterol en LDL-cholesterol tussen de metformine- en controlegroep niet meer significant. Na 12 maanden werd er wel een significant verschil in verandering van triglyceriden tussen de metformine- en controlegroep waargenomen (gemiddelde afname (95% BI): metformine: -0,33 (-0,45 tot -0,22); controle: -0,14 (-0,25 tot -0,04); p-value = 0,019). Er werd geen significant verschil waargenomen in verandering van serum HDL-cholesterol levels na 6 en 12 maanden tussen de metformine- en controlegroep.
Overig
Er werd geen significant verschil in verandering van ALAT en ASAT na 6 en 12 maanden waargenomen.
In Love-Osborne (2008) en Van der AA (2016) werden geen data gerapporteerd over de verandering in de parameters voor dyslipidemie over tijd.
1.6 Remissie van risicofactoren op co-morbiditeit, remissie van co-morbiditeit(en)
De bewijskracht voor de RCT’s start hoog. De bewijskracht voor de uitkomstmaat remissie van risicofactoren op co-morbiditeit, remissie van co-morbiditeit(en) is met 1 niveaus verlaagd gezien de hoge uitval en het ontbreken van een intention to treat analysis (risk of bias wegens, ongeveer de helft van de trials had een hoog risico op bias in één of meerdere domeinen, zoals selectief rapporteren), met 1 niveau verlaagd vanwege de inclusie van studies die niet voldoen aan de selectiecriteria (inconsistentie) en met 1 niveau verlaagd gezien het geringe aantal deelnemers (imprecisie). Derhalve komt de bewijskracht voor de uitkomstmaat uit op zeer laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat zijn de (on)gunstige effecten van een additionele medicamenteuze behandeling bij een gecombineerde lifestyle interventie, vergeleken met een gecombineerde lifestyle interventie, bij kinderen/adolescenten met obesitas?
P: kinderen met obesitas;
I: additionele medicamenteuze behandeling primair gericht op afname van overgewicht bij een gecombineerde lifestyle interventie[1];
C: gecombineerde lifestyle interventie1;
O: gewicht, ernstige bijwerkingen, aantal uitvallers vanwege bijwerkingen en remissie van risicofactoren op co-morbiditeit/ remissie van co-morbiditeit(en).
Relevante uitkomstmaten
De werkgroep achtte gewicht een voor de besluitvorming cruciale uitkomstmaat en ernstige bijwerkingen, aantal uitvallers vanwege bijwerkingen en remissie van risicofactoren op co-morbiditeit/ remissie van co-morbiditeit(en) voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep volgt voor de definitie van een succesvolle interventie m.b.t. de uitkomstmaat gewicht de criteria zoals die eerder zijn geformuleerd in de ‘Zorgstandaard Obesitas’:
- Er zijn geen evidence-based criteria voor succes bij kinderen in de groei. Vandaar dat bij kinderen naar gewichtsstabilisatie gestreefd wordt na één jaar behandeling en handhaving hiervan in de fase van onderhoud, tenzij dat tijdens de groeispurt van het kind onhaalbaar is.
- Voor uitgegroeide kinderen met een matig verhoogd GGR wordt gestreefd naar een gewichtsverlies van ≥ 5% na één jaar behandeling en handhaving hiervan in de fase van onderhoud.
- Voor uitgegroeide kinderen met een sterk of extreem verhoogd GGR wordt gestreefd naar een gewichtsverlies van ≥ 10% na één jaar behandeling en handhaving hiervan in de fase van onderhoud.
De uitkomstmaat gezondheid werd gedefinieerd als het afnemen van co-morbiditeit of risicofactoren van co-morbiditeit, zoals reductie van prevalentie van diabetes mellitus type 2, metabool syndroom, hypertensie, hypercholesterolemie, non-alcholic fatty liver disease, insuline resistentie, impaired glucose tolerance, impaired fasting glucose. Voor de uitkomstmaat kwaliteit van leven bepaalde de werkgroep niet a priori de definitie, maar werden de in de studie gebruikte definities gehanteerd.
De werkgroep definieerde niet a priori de overige uitkomstmaten, maar hanteerde de in studies gebruikte definities:
- Ernstige bijwerkingen: een ernstige bijwerking tijdens of na de interventie, maar niet per definitie veroorzaakt door de interventie.
- Uitvallers vanwege bijwerkingen: het percentage deelnemers dat voortijdig met de studie is gestopt vanwege bijwerkingen.
- Remissie van risicofactoren op co-morbiditeit, remissie van co-morbiditeit(en): co-morbiditeit(risicofactoren) zoals (1) diabetes mellitus type 2 (nuchter bloedglucose en gestoorde glucose tolerantie); (2) hypertensie (systolische, diastolische bloeddruk en hartfrequentie); en (3) dyslipidemie (Triglyceride, Cholesterol en LDL).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is vanaf 2005 tot november 2018 met relevante zoektermen gezocht naar systematische reviews, randomized controlled trials (RCT’s) en observationele studies over de effectiviteit van een medicamenteuze behandeling gericht op afname van overgewicht bij kinderen met obesitas. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 429 treffers op.
In eerste instantie werden systematische reviews over de effecten van een additionele medicamenteuze behandeling bij een gecombineerde lifestyle interventie ten opzichte van een gecombineerde lifestyle interventie bij kinderen met obesitas geselecteerd. Op basis van titel en abstract werden 16 systematische reviews geselecteerd.
Na raadpleging van de volledige tekst, werden vervolgens 15 studies geëxcludeerd (zie exclusietabel onder het tabblad verantwoording, en 1 studie geselecteerd (Mead, 2016).
Hierna werden studies geselecteerd die voldeden aan de PICO en na de zoekdatum van de studie van Mead werden gepubliceerd. Op basis van titel en abstract werden in eerste instantie 9 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 7 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 2 studies geselecteerd (Van der AA, 2016; Warnakulasuriya, 2018). Eén additionele studie werd geselecteerd op basis van screening van systematische reviews (Love-Osborne, 2008). In totaal werden 4 studies definitief geselecteerd (Mead, 2016; Van der AA, 2016; Warnakulasuriya, 2018; Love-Osborne, 2008).
Resultaten
Eén systematische review en 3 aanvullende RCT’s werden opgenomen in de literatuuranalyse (Mead, 2016; Van der AA, 2016; Warnakulasuriya, 2018; Love-Osborne, 2008). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
[1] Tenminste bestaande uit twee van de volgende onderdelen: leefstijl, voeding en gedrag.
Referenties
- Achterkamp, R. (2019) towards a balanced and active lifestyle. https://ris.utwente.nl/ws/portalfiles/portal/120920988/Thesis_Achterkamp_Final.pdf
- Armstrong, S., Mendelsohn, A., Bennett, G., Taveras, E. M., Kimberg, A., & Kemper, A. R. (2018). Texting motivational interviewing: A randomized controlled trial of motivational interviewing text messages designed to augment childhood obesity treatment. Childhood Obesity, 14(1), 4-10.
- E -mental Health en de client, https://www.digitalezorgkompas.nl/sites/default/files/theme_pdf/theme5_0.pdf.
- Fleischman, A., Hourigan, S. E., Lyon, H. N., Landry, M. G., Reynolds, J., Steltz, S. K., ... & Ludwig, D. S. (2016). Creating an integrated care model for childhood obesity: a randomized pilot study utilizing telehealth in a community primary care setting. Clinical obesity, 6(6), 380-388.
- Hermsen, A. S. (2019). Now You Know: Using Feedback from Digital Technology to Disrupt and Change Habitual Behaviour.http://dare.ubvu.vu.nl/handle/1871/55898.
- Koning, J., Kok, R. (2015). EHealth in ggz niet per definitie doelmatig. Medisch contact, 3 juni. Mameli, C., Brunetti, D., Colombo, V., Bedogni, G., Schneider, L., Penagini, F., & Zuccotti, G. V. (2018). Combined use of a wristband and a smartphone to reduce body weight in obese children: randomized controlled trial. Pediatric obesity, 13(2), 81-87.
- Nguyen, B., Shrewsbury, V. A., O'connor, J., Steinbeck, K. S., Hill, A. J., Shah, S., ... & Baur, L. A. (2013). Two-year outcomes of an adjunctive telephone coaching and electronic contact intervention for adolescent weight-loss maintenance: the Loozit randomized controlled trial. International Journal of Obesity, 37(3), 468.
- Stil, B., Bellenge, N., Snoeren, R. (2016). De werkzame principes van blended care in het sociaal domein. https://www.kwadraad.nl/wp-content/uploads/2016/04/25-03-2016-SROIBlendedCareVerslag.pdf.
- Trost, S. G., Sundal, D., Foster, G. D., Lent, M. R., & Vojta, D. (2014). Effects of a pediatric weight management program with and without active video games: a randomized trial. JAMA pediatrics, 168(5), 407-413.
- Wislo, V. M., McGaffey, A., Scopaz, K. A., D’Amico, F. J., Jewell, I. K., Bridges, M. W., & Hughes, K. (2013). Fitwits: preparing residency-based physicians to discuss childhood obesity with preteens. Clinical pediatrics, 52(12), 1107-1117.
- Wouter, M., Swinkels, I., Sinnige, J., de Jong, J., Brabers, A., van Lettow, B., Friele, R., van Gennip, L. (2018). EHealth-monitor 2018. https://www.nictiz.nl/rapporten/ehealth-monitor-2018/.
- Berkowitz, R. I., Wadden, T. A., Tershakovec, A. M., & Cronquist, J. L. (2003). Behavior therapy and sibutramine for the treatment of adolescent obesity: a randomized controlled trial. Jama, 289(14), 1805-1812.
- Berkowitz, R. I., Fujioka, K., Daniels, S. R., Hoppin, A. G., Owen, S., Perry, A. C., ... & Jasinsky, O. (2006). Effects of sibutramine treatment in obese adolescents: a randomized trial. Annals of internal medicine, 145(2), 81-90.
- Chanoine, J. P., Hampl, S., Jensen, C., Boldrin, M., & Hauptman, J. (2005). Effect of orlistat on weight and body composition in obese adolescents: a randomized controlled trial. Jama, 293(23), 2873-2883.
- Clarson, C. L., Brown, H. K., De Jesus, S., Jackman, M., Mahmud, F. H., Prapavessis, H., ... & Hill, D. J. (2014). Effects of a comprehensive, intensive lifestyle intervention combined with metformin extended release in obese adolescents. International scholarly research notices, 2014.
- Clarson, C. L., Mahmud, F. H., Baker, J. E., Clark, H. E., Mckay, W. M., Schauteet, V. D., & Hill, D. J. (2009). Metformin in combination with structured lifestyle intervention improved body mass index in obese adolescents, but did not improve insulin resistance. Endocrine, 36(1), 141-146.
- Condarco TA,Sherafat-Kazemzadeh R,McDuffie JR,Brady S, Salaita C, Sebring NG, et al. Long-term follow-up of a randomized, placebo-controlled trial of orlistat in AfricanAmerican and Caucasian adolescents with obesity-related comorbid conditions. Endocrine Reviews 2013. Radin RM, Tanofsky-Kraff M, Shomaker LB, Kelly NR, Pickworth CK, Shank LM, et al. Metabolic characteristics of youth with loss of control eating. Eating Behaviors 2015; 19:86–9.
- Diabetes Prevention Program Research Group. (2009). 10-year follow-up of diabetes incidence and weight loss in the Diabetes Prevention Program Outcomes Study. The Lancet, 374(9702), 1677-1686.
- Diabetes Prevention Program Research Group. (2015). Long-term effects of lifestyle intervention or metformin on diabetes development and microvascular complications over 15-year follow-up: the Diabetes Prevention Program Outcomes Study. The lancet Diabetes & endocrinology, 3(11), 866-875.
- Farsani, S., Souverein, P., Overbeek, J., van der Vorst, M., Knibbe, C., Herings, R., ... & Mantel-Teeuwisse, A. (2015). Increased Use of Oral Anti-diabetic Medications in Dutch Children Mainly Driven By (Off-label) Metformin Use: 491. Pharmacoepidemiology and Drug Safety, 24, 280-281.
- García-Morales, L. M., Berber, A., Macias-Lara, C. C., Lucio-Ortiz, C., Del-Rio-Navarro, B. E., & Dorantes-Alvárez, L. M. (2006). Use of sibutramine in obese mexican adolescents: a 6-month, randomized, double-blind, placebo-controlled, parallel-group trial. Clinical therapeutics, 28(5), 770-782.
- Herman, W. H., Edelstein, S. L., Ratner, R. E., Montez, M. G., Ackermann, R. T., Orchard, T. J., ... & Diabetes Prevention Program Research Group. (2013). Effectiveness and cost-effectiveness of diabetes prevention among adherent participants. The American journal of managed care, 19(3), 194.
- Iqbal Hydrie, M. Z., Basit, A., Shera, A. S., & Hussain, A. (2012). Effect of intervention in subjects with high risk of diabetes mellitus in Pakistan. Journal of nutrition and metabolism, 2012.
- Li, C. L., Pan, C. Y., Lu, J. M., Zhu, Y., Wang, J. H., Deng, X. X., ... & Wang, H. Y. (1999). Effect of metformin on patients with impaired glucose tolerance. Diabetic medicine, 16(6), 477-481.
- Knowler, W. C., Barrett-Connor, E., Fowler, S. E., Hamman, R. F., Lachin, J. M., Walker, E. A., & Nathan, D. M. (2002). Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. The New England journal of medicine, 346(6), 393-403.
- Lentferink, Y. E., Knibbe, C. A. J., & van der Vorst, M. M. J. (2018). Efficacy of Metformin Treatment with Respect to Weight Reduction in Children and Adults with Obesity: A Systematic Review. Drugs, 78(18), 1887-1901.
- Love-Osborne, K., Sheeder, J., & Zeitler, P. (2008). Addition of metformin to a lifestyle modification program in adolescents with insulin resistance. The Journal of pediatrics, 152(6), 817-822.
- Mauras, N., DelGiorno, C., Hossain, J., Bird, K., Killen, K., Merinbaum, D., ... & Balagopal, P. (2012). Metformin use in children with obesity and normal glucose tolerance–effects on cardiovascular markers and intrahepatic fat. Journal of Pediatric Endocrinology and Metabolism, 25(1-2), 33-40.
- McDonagh, M. S., Selph, S., Ozpinar, A., & Foley, C. (2014). Systematic review of the benefits and risks of metformin in treating obesity in children aged 18 years and younger. JAMA pediatrics, 168(2), 178-184.
- Mead, E., Atkinson, G., Richter, B., Metzendorf, M. I., Baur, L., Finer, N., ... & Ells, L. J. (2016). Drug interventions for the treatment of obesity in children and adolescents. Cochrane Database of Systematic Reviews, (11).
- O’Brien, M. J., Perez, A., Scanlan, A. B., Alos, V. A., Whitaker, R. C., Foster, G. D., ... & Homko, C. (2017). PREVENT-DM comparative effectiveness trial of lifestyle intervention and metformin. American journal of preventive medicine, 52(6), 788-797.
- Srinivasan, S., Ambler, G. R., Baur, L. A., Garnett, S. P., Tepsa, M., Yap, F., ... & Cowell, C. T. (2006). Randomized, controlled trial of metformin for obesity and insulin resistance in children and adolescents: improvement in body composition and fasting insulin. The Journal of Clinical Endocrinology & Metabolism, 91(6), 2074-2080.
- Van der Aa, M. P., Elst, M. A. J., Van De Garde, E. M. W., Van Mil, E. G. A. H., Knibbe, C. A. J., & Van der Vorst, M. M. J. (2016). Long-term treatment with metformin in obese, insulin-resistant adolescents: results of a randomized double-blinded placebo-controlled trial. Nutrition & diabetes, 6(8), e228.
- Styne DM, Arslanian SA, Connor EL, Farooqi IS, Murad MH, Silverstein JH, Yanovski JA. Pediatric Obesity-Assessment, Treatment, and Prevention: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2017 Mar 1;102(3):709-757. doi: 10.1210/jc.2016-2573. PubMed PMID: 28359099; PubMed Central PMCID: PMC6283429.
- Van Rongen, A., van der Aa, M. P., Matic, M., van Schaik, R. H., Deneer, V. H., van der Vorst, M. M., & Knibbe, C. A. (2018). Increased metformin clearance in overweight and obese adolescents: a pharmacokinetic substudy of a randomized controlled trial. Pediatric Drugs, 20(4), 365-374.
- Warnakulasuriya, L. S., Fernando, M. M., Adikaram, A. V., Thawfeek, A. R., Anurasiri, W. M. L., Silva, R. R., ... & Wickramasinghe, V. P. (2018). Metformin in the management of childhood obesity: a randomized control trial. Childhood Obesity, 14(8), 553-565.
- Wiegand, S., l'Allemand, D., Hübel, H., Krude, H., Bürmann, M., Martus, P., ... & Holl, R. W. (2010). Metformin and placebo therapy both improve weight management and fasting insulin in obese insulin-resistant adolescents: a prospective, placebo-controlled, randomized study. European journal of endocrinology, 163(4), 585-592.
- Wilson, D. M., Abrams, S. H., Aye, T., Lee, P. D., Lenders, C., Lustig, R. H., ... & Feldman, H. A. (2010). Metformin extended release treatment of adolescent obesity: a 48-week randomized, double-blind, placebo-controlled trial with 48-week follow-up. Archives of pediatrics & adolescent medicine, 164(2), 116-123.
- Worsley, R., Jane, F., Robinson, P. J., Bell, R. J., & Davis, S. R. (2015). Metformin for overweight women at midlife: a double-blind, randomized, controlled trial. Climacteric, 18(2), 270-277.
- Yanovski, J. A., Krakoff, J., Salaita, C. G., McDuffie, J. R., Kozlosky, M., Sebring, N. G., ... & Calis, K. A. (2011). Effects of metformin on body weight and body composition in obese insulin-resistant children: a randomized clinical trial. Diabetes, 60(2), 477-485.
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Mead, 2016 |
Yes |
Yes |
Yes |
Yes (no description of the potential confounders per study, but not applicable for RCTs) |
Not applicable |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat zijn de (on)gunstige effecten van een medicamenteuze behandeling als aanvulling op een gecombineerde lifestyle interventie, vergeleken met een gecombineerde lifestyle interventie, bij kinderen met overgewicht?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
vd AA (2016) |
The randomization schedule (in blocks of 20 per study centre) was generated by the department of Clinical Pharmacy of the St Antionius Hospital, using PASW Statistics 18.0 |
Unlikely (Quote: “Both subjects and study staff were blinded during the 18-month treatment period. The randomization code was kept secured in the department of Clinical Pharmacy.”) |
Unlikely (Quote: “Both subjects and study staff were blinded during the 18-month treatment period.”) |
Unlikely (Quote: “Both subjects and study staff were blinded during the 18-month treatment period.”) |
Unlikely (Quote: “Both subjects and study staff were blinded during the 18-month treatment period.”) |
Unlikely (Caloric intake listed as outcome in the methods, however not described in the results – Quote “Dietary diaries were not completed and returned adequately, and therefore the caloric intake could not be calculated and analysed”) |
Unlikely |
Likely (Quote: “One patient in the placebo group was excluded from the analysis, because this patient was an outlier with a change in BMI-SDS of -4.47.“ AND: “All participants who started treatment (that is, they used at least one tablet of metformin or placebo) and finished follow-up of 18 months were analysed.”) |
|
Love-Osborn (2013) |
Generation of allocation sequences is not described |
Unclear (allocation concealment not described) |
Unclear (not described in the study – only stated that it is a randomized double-blind placebo controlled trial) |
Unclear (not described in the study – only stated that it is a randomized double-blind placebo controlled trial) |
Unclear (not described in the study – only stated that it is a randomized double-blind placebo controlled trial) |
Likely (blood pressure listed as outcome in the methods, but is not described in the results) |
Unclear (only the number of patients dropped out is described, but not per group and only for a few people reasons for lost to follow-up were given) |
Likely (not all randomized participants were included in the analysis) |
|
Warnakulasuriya (2018) |
Random numbers generated by the principal investigator using Microsoft Excel 2010 |
Unclear |
Unlikely (Except for the dispenser and principal investigator, the whole study team, children, and their caregivers were blinded to the treatment protocol.) |
Unlikely (Except for the dispenser and principal investigator, the whole study team, children, and their caregivers were blinded to the treatment protocol.) |
Unlikely (Except for the dispenser and principal investigator, the whole study team, children, and their caregivers were blinded to the treatment protocol.) |
Unlikely |
Likely (percentage patients lost follow-up in both the intervention and control group is large) |
Likely (not all randomized participants were included in the analysis) |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat zijn de (on)gunstige effecten van een medicamenteuze behandeling als aanvulling op een gecombineerde lifestyle interventie, vergeleken met een gecombineerde lifestyle interventie, bij kinderen met overgewicht?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Mead, 2016
[individual study characteristics deduced from Mead, 2016]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to March 2016
A: Berkowitz, 2003 B: Berkowitz, 2006 C: Chanoine, 2005 D: Clarson, 2009 E: Garcia-Morales, 2006 F: Mauras, 2012 G: NCT00001723 H: Wiegand, 2010 I: Wilson, 2010 J: Yanaovski, 2011
Study design: A-J: All studies included in this module are RCTs [parallel]
Country and setting: A: USA, University of Pennsylvania School of Medicine B: USA, 33 weight loss clinics and outpatient clinic based in a University School of Medicine C: USA and Canada, 32 clinical centres D: Canada, Participants assessed in community clinic and there were monthly visits to clinic during intervention. Intervention carried out in community - at adolescent’s home - unclear where group sessions took place E: Mexico, Outpatients attending the endocrinology department of the Federico Gomez Children’s Hospital of Mexico F: USA, Not described G: USA, National Institutes of Health Clinical Center H: Germany and Switzerland, Paediatric obesity centre I: USA, 6 Glaser paediatric research centres J: USA, Trial took place at the NIH clinical research entre
Source of funding and conflicts of interest: [commercial / non-commercial / industrial co-authorship] B: Commercial funding D: Noncommerical funding E: Commercial funding F: Noncommerical funding G: Not described H: Commercial funding and noncommercial funding
|
Inclusion criteria SR: intervention and comparator groups. Exclusion criteria SR: - Trials which included participants who were critically ill. - Trials in which the aim was not treat obesity in children or adolescents. - Duration of intervention less than three months. - Duration of follow-up less than six months. Studies included: 21 completed trials (33 publications) included in qualitative synthesis. 16 trials included in quantitative synthesis (meta-analysis).
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
Number of patients (screened / eligible – (randomized)): C: 588 (I: 357; C: 182) D: 65 (I: 14; C: 17) E: 70 (I: 26; C: 25) F: / (I: 35; C: 31) G: / (I: 100; C: 100) H: 278; (I: 36; C: 34)
Sex (female %): A: I: 72; C: 62
Groups comparable at baseline? |
Describe intervention:
A: behavioural programme (in phase 1 (drug-placebo phase) participants attended 13 weekly group sessions while in phase 2 (drug, open label) group sessions were held biweekly then monthly. Parents met separately from participants. Instructed to consume 1200 kcal/d to 1500 kcal/d and to engage in 120min of walking or similar activity per week. Eating and activity logs kept daily. Length = 12 months) + sibutramine (oral, 1 dose per day, placebo (week 1) 5 mg/d sibutramine (week 2) 10 mg/d (weeks 3 to 6) 15 mg/d (week 7 to month 6), length = 6 months (plus an open-label phase for additional 6 months) B: behavioural programme + sibutramine (oral, 1 dose per day, 10 mg/d (baseline to month 6), 15 mg/d from month 6 in participants who had not lost more than 10%of their initial BMI, 12 months) C: orlistat (oral, dose 3 times per day, 120 mg x 3 (360 mg)/d, 1 year) + behavioural therapy (participants were prescribed a nutritionally balanced, hypocaloric diet and at each trial visit the dietitian spoke about compliance. Behavioural modification involved techniques to limit calorie and fat intake, eating more slowly, avoiding snacks and avoiding overeating. Guidelines were given to encourage regular physical activity and reduce sedentary behaviour; compliance was monitored by a behavioural psychologist at each visit. Length = 54 weeks) D: metformin (oral, 3 times daily, 500 mg x 3 (1.5 g), 6 months) + behaviour changing intervention (monthly individual visits and 2 group sessions. Fitness specialist supervised participants in an individual 30-min exercise sessions every 2 months. Diet advice and physical activity advice given. Progress monitored by weekly telephone calls and monthly visits. Length = 6 months) E: sibutramine (oral, 1 dose per day, 10 mg/d, 6 months) + diet and exercise (diet and exercise advice was tailored to each participant. Advice was given on recommended food portions and possible combinations, and all participants were advised to perform at least 30 min of aerobic physical activity per day. Each participant also attended individual consultation sessions with a registered paediatric nutritionist. A detailed food consumption questionnaire was completed at the beginning and end of trial medication period. Length = 6 months) F: metformin (oral, twice daily, 500 mg or 1000 mg (dependent on age), 6 months) + diet/exercise intervention (dietary counselling provided with recommended decrease of 250 calories/ d to 500 calories/d. Intense follow-up provided by dietitian. Participants given free membership to YMCA or gym. Encouraged to exercise at least 3 times per week for 30min per sessions. Activity diary kept and pedometer worn. Length = 6 months) G: orlistat (120 mg 3 times daily for 6 months) + behavioural weight loss programme (12-week intensive programme) H: metformin (oral, twice daily, 2 x 500 mg (1 g)/d, 6 Months) + lifestyle intervention (an interview was performed before randomisation to determine 1 to 3 individually chosen tasks (goals). Multiprofessional reinforcement sessions took place every 4 to 8 weeks. Regarding physical activity, participants and their families attended specialised sport classes (2 sport classes per week, 45 min each, was recommended) in addition to regular sport classes at school. Length = 6 months) 48 weeks) + lifestyle intervention (used the Weigh of Life LITE programme developed at Texas Children’s Hospital, Houston. There were 10 individualised ”intensive“ sessions at weekly intervals and monthly follow-up sessions for the reminder of the trial. Sessions led by trained health specialist and parent/ guardians were invited. Length = 48 weeks) /d, 6 months) + dietitian administered weight reduction programme (each participant and parent/guardian met with a dietitian monthly, who promoted a reduced-energy diet, increased physical activity and decreased inactivity. Participants trained to completed a 7-day food diary which was used to prescribe a ”traffic light“ style 500 kcal/d deficit diet, and exercisewas encouraged for 30min/d,monitored by pedometers readings. Length = 6 months)
|
Describe control:
A: behavioural programme (same as intervention group) + placebo (oral, 1 dose per day, (months 1 to 6), 6 months) B: behavioural programme (same as intervention group) + placebo (oral, 1 dose per day, placebo (baseline to month 6), uptitrated after 6 months in participants who had not lostmore than 10%of their initial BMI, 12 months) C: placebo (oral, dose 3 times per day, 1 year) + behavioural therapy (same as intervention group) D: Behaviour changing intervention only (same as intervention group) E: placebo (oral, 1 dose per day, 6 months) + diet and exercise (same as intervention group) F: diet/exercise intervention only (same as the intervention group) G: placebo (120 mg 3 times daily for 6 months) + behavioural weight loss programme (same as intervention group) H: placebo (oral, twice daily, 6 months) + lifestyle intervention (same as intervention group) group) |
End-point of follow-up (duration of intervention and follow-up under randomised conditions until end of trial):
A: 6 months (not including the 6-month open-label period where all participants received sibutramine B: 12 months C: 54 weeks D: 6 months E: 6 months F: 6 months G: 6 months H: 6 months
For how many participants were no complete outcome data available? (intervention/control)
|
Outcome measure-1 Defined as change in BMI
Effect measure: mean difference [95% CI]: A: -1.67 (-2.67, -0.67) B: -2.96 (-3.69, -2.23) C: -0.77 (-1.10, -0.44)
Outcome measure-2 Defined as change in weight
Effect measure: mean difference [95% CI]: A: -4.60 (-7.29, -1.91)
Outcome measure-3 Defined as serious adverse events
Effect measure: risk ratio [95% CI]: A: /
Outcome measure-4 Discontinued trial because of adverse events
Effect measure: risk ratio [95% CI]: A: 0.31 (0.01, 7.39)
|
The following studies were selected from the systematic review (Berkowitz, 2003; Berkowitz, 2006; Chanoine, 2005; Clarson, 2009; Garcia-Morales; 2006; Mauras, 2012; NCT00001723; Wiegand, 2010; Wilson, 2010; Yanaovski, 2011).
The other studies were excludeded because of the following reasons: - methodological concerns. |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Van der AA (2016) |
Type of study: Randomized placebo-controlled double-blinded trial Setting and country: Hospital based study; the Netherlands Funding and conflicts of interest: |
Inclusion criteria: - Age 10-16 years - BMI-SDS > 2.3 - Caucasian descent - Written informed consent Exclusion criteria: - T2DM - Height < 1.3 SD from target height - Syndromal disorders - Pregnancy N total at baseline: Intervention: 32 Control: 30
Age (years; median (IQR)): I: 13.6 (12.6 to 15.3) C: 12.0 (11.3 to 14.0)
Sex (girls; n, %): I: 17; 73.9% C: 11; 57.9%
Groups comparable at baseline? Not described. Only stated that more girls than boys were included. |
Describe intervention (treatment/procedure/test): All participants received immediate-release metformin 500 mg tablets (Centrapharm, Etten-Leur, The Netherlands) in an increasing dosing regimen, with a maximum dose of two tablets twice daily in the fourth study week.
|
Describe control (treatment/procedure/test): All participants received identical placebo tablets (Apotheek Haagse Ziekenhuizen, Den Haag, The Netherlands) in an increasing dosing regimen, with a maximum dose of two tablets twice daily in the fourth study week.
|
Length of follow-up: 18 months
Loss-to-follow-up: Intervention (n (%)): 2 (6.25%) Reasons:
Control (n (%)): 3 (10%) Reasons:
Incomplete outcome data: Intervention (n (%)): 6 (19%) Reasons (discontinued intervention): - Other treatment started (n=1) - Adverse events (n=2) Control (n (%)): 8 (27%) Reasons (discontinued intervention): - Other treatment started (n=1) - Declined use of medication, not because of adverse events (n=1) Excluded from analysis: - Outlier (n=1)
|
Outcome measures and effect size (include 95%CI and p-value if available):
T=18: 29.9(26.3 to 33.6) |
|
|
Love-Osborn (2013 |
Type of study: Randomized double-blind placebo controlled trial Setting and country: participants were recruited through posted advertisements or through contact with primary care providers, United States
Funding and conflicts of interest: The research was supported by Grant #MO1 RR00069, General Clinical Research Centers Program, National Center for Research Resources, NIH. Additional funding was provided by the Barbara Davis Center for Childhood Diabetes, The Children’s Hospital Research Institute, and The Kettering Family Foundation.
The authors disclose no conflicts of interest. The sponsors of the study were not involved in the study design, data analysis or writing of the manuscript. |
Inclusion criteria: Participants who had fasting insulin level >25 microunits/ml or HOMA (Homeostasis model assessment: fasting insulin in microunits/ml × fasting glucose in millimoles/liter/22.5) > 3.5 and 2 out of 3 risk factors (presence of acanthosis nigricans, obesity (BMI >95% for age), or family history of T2DM) were invited to participate in the study. Exclusion criteria: - pregnancy; - heart disease; - serum gamma-glutamyl transferase (GGT) over 1.5 time the upper limit of normal; - creatinine > 1.5 mg/dL.
N total at baseline: Intervention: 60 Control: 25
Important prognostic factors2: Age (mean ± SD): I: 15.5 ± 1.7 C: 14.2 ± 4.6
Sex (female; n, %): I: 43 (72%) C: 17 (68%) P-value = 0.74 Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
All subjects completed a food frequency questionnaire and received written information about symptoms of diabetes from a study physician. They watched a video that emphasized modest calorie reduction, decreased fat and simple sugar consumption, increased fiber, fruit and vegetable intake, and regular aerobic exercise. Subjects then worked with a dietician or study investigator to choose 3 goals for themselves, related to dietary or exercise changes. They were assisted in choosing very specific goals that were attainable in a 1-month period, for example decreasing soda intake from 3 daily to 1 daily. All subjects were encouraged to choose at least one goal related to exercise. They were given a calendar and instructed to record progress on their goals and record if they took the medication.
Subjects were started on Metformin 500 mg once daily. At one month, the dose increased to 500 mg twice daily, followed by an increase to 850 mg twice daily at 2 months. If gastrointestinal side effects persisted for more than 2 weeks, the dose was lowered to the previously tolerated dose. |
Describe control (treatment/procedure/test):
All subjects completed a food frequency questionnaire and received written information about symptoms of diabetes from a study physician. They watched a video that emphasized modest calorie reduction, decreased fat and simple sugar consumption, increased fiber, fruit and vegetable intake, and regular aerobic exercise. Subjects then worked with a dietician or study investigator to choose 3 goals for themselves, related to dietary or exercise changes. They were assisted in choosing very specific goals that were attainable in a 1-month period, for example decreasing soda intake from 3 daily to 1 daily. All subjects were encouraged to choose at least one goal related to exercise. They were given a calendar and instructed to record progress on their goals and record if they took the medication.
|
Length of follow-up: 6-month
Loss-to-follow-up: 21 subjects dropped out; 3 reported gastrointestinal side effects as the reason; 2 on metformin and 1 on placebo. (although not statistically significant) in placebo subjects, which led to lower numbers of placebo subjects in the final analysis.
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
|
|
|
Warnakulasuriya, 2018 |
Type of study: randomized controlled trial
Setting and country: Negombo educational zone in the Gampaha District of Sri Lanka
Funding and conflicts of interest: |
Inclusion criteria: Obese (BMI/Age-SDS ‡+2SD, WHO 2007)22 8- to 16- year-old children were identified through a separate screening program carried out in schools in the Negombo educational zone and invited to participate. Exclusion criteria: Children of non-Sri Lankan origin, planning to migrate within a year, or having a secondary cause for obesity were excluded. N total at baseline: Intervention: 166 Control: 173
Important prognostic factors2: Age (mean ± SD): I: 11.94 (2.17) C: 12.25 (2.27)
Sex (female; n, %): I: 28, 41.2% C: 38, 46.3%
Groups comparable at baseline? There was no significant difference between the two groups. |
Describe intervention (treatment/procedure/test): Children, 8 -10.99 years received metformin 250mg daily for a week and increased to 250mg twice daily for a week and thereafter 500mg twice daily. Eleven- to 16-year-old children received 500mg of metformin daily for 1 week and increased to 500mg twice daily for a week and thereafter 1 g twice daily. Children were asked to take metformin with their morning and evening meals to reduce gastrointestinal side effects and risk of hypoglycemia. size guide was provided to parents and children to guide them on the variety and volume they should be eating. Physical activity training was conducted by a qualified physical activity instructor. A daily physical activity routine of 20–30 minutes was given to each child. The workout program was changed to one of four workout plans every month to break the monotony. Weekly physical activity sessions of 1-hour duration were conducted for the participants of both groups. Participants were given a physical activity diary to maintain and to ensure adherence to the physical activity plan at home. During the weekly sessions, the adherence to physical activity plan was assessed and ensured.
|
Describe control (treatment/procedure/test): The State Pharmaceutical Manufacturing Corporation, Sri Lanka, manufactured metformin and placebo and both tablets look similar except for the active pharmacological compound in one.
size guide was provided to parents and children to guide them on the variety and volume they should be eating. Physical activity training was conducted by a qualified physical activity instructor. A daily physical activity routine of 20–30 minutes was given to each child. The workout program was changed to one of four workout plans every month to break the monotony. Weekly physical activity sessions of 1-hour duration were conducted for the participants of both groups. Participants were given a physical activity diary to maintain and to ensure adherence to the physical activity plan at home. During the weekly sessions, the adherence to physical activity plan was assessed and ensured.
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: 98 (59%) Reasons - rejected by family GP (n=4)
Control: 91 (53%) Reasons (describe) - did not like (n=58) - rejected by family GP (n=5) Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
p-value = 0.000 I: 0.603 (0.443 to 1.649)
p-value = 0.002
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Systematische reviews |
|
|
Narrative review |
|
|
White, 2015 |
Kwalitatief onderzoek naar eigen ervaringen |
|
Peirson, 2015 |
Systematische review gezocht tot augustus 2013 |
|
Boland, 2015 |
Narrative review |
|
Zhang, 2014 |
Systematische review naar de behandeling van type 2 diabetes in patiënten > 18 jaar |
|
McDonagh, 2014 |
Systematische review gezocht tot september 2012 |
|
Brufani, 2013 |
Systematische review gezocht tot maart 2013 |
|
Lakshman, 2012 |
Narrative review |
|
Garcia Diaz, 2011 |
Systematische review naar de effectiviteit en veiligheid van anti-obesitas middelen in adolescenten. |
|
Viner, 2010 |
Systematische review gezocht tot 2008 |
|
Czernichow, 2010 |
Alleen adolescenten geïncludeerd |
|
Min, 2009 |
Systematische review gezocht tot 2008 |
|
Luttikhuis, 2009 |
Systematische review gezocht tot 2008 |
|
McGovern, 2008 |
Systematische review gezocht tot 2006 |
|
McGovern, 2008 |
Dezelfde studie als bovenstaand |
|
Dunican, 2007 |
Review gezocht tot 2007 |
|
RCTs |
|
|
Lentferink, 2018 |
Open label studie |
|
Pastor-Villaescusa, 2017 |
Geen GLI |
|
Danne, 2017 |
Studieduur 5 weken |
|
Pastor-Villaescusa, 2017 |
Erratum |
|
Pastor-Villaescusa, 2017 |
Dezelfde studie als bovenstaand |
|
Vd Aa, 2016 |
Dagelijkse praktijk versus RCT |
|
Nathan, 2016 |
Gepoolde data van Kelly (2013) |
|
Kelly, 2016 |
Narrative review |
|
Observationele studies |
|
|
Ryder, 2017 |
Retrospective chart review |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 13-11-2020
Beoordeeld op geldigheid : 09-11-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Kindergeneeskunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Medicamenteuze behandeling |
NVK |
2020 |
2022 |
2 jaar |
NVK |
EMA registratie Vergoeding door ziektekostenverzekering |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijn is goedgekeurd door de Patiëntenfederatie Nederland.
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van het project is het ontwikkelen van de evidence-based richtlijn Behandeling van kinderen met obesitas; en daarmee een richtlijn volgens Medische Specialistische Richtlijnen 2.0 opleveren, waarin de huidige stand van wetenschappelijke kennis aangaande het onderwerp is meegenomen.
Doelgroep
Deze richtlijn is primair bedoeld voor kinderartsen, maar daarnaast is de richtlijn relevant voor huisartsen, verpleegkundigen/verpleegkundig specialisten kindergeneeskunde, diëtisten, psychologen, (kinder)fysiotherapeuten, jeugdartsen, jeugdverpleegkundigen, chirurgen en internisten.
Tevens is het waardevol voor leden van andere beroepsgroepen die betrokken zijn bij de zorg voor patiënten met obesitas van 0 tot 18 jaar om kennis te nemen van de richtlijn. Te denken valt aan beroepsgroepen zoals opvoedkundig adviseurs, maatschappelijk werkers, jeugdhulpverleners, combinatiefunctionarissen, buurtsportcoaches, onderwijsprofessionals en aanbieders van interventies en van reguliere voorzieningen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor kinderen met obesitas.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. E.L.T. (Erica) van den Akker, kinderarts endocrinoloog, universitair hoofddocent, Erasmus MC- Sophia Kinderziekenhuis en Centrum Gezond Gewicht, Rotterdam, Nederlandse Vereniging voor Kindergeneeskunde (voorzitter)
- Prof. dr. E. (Edgar) van Mil, kinderarts-endocrinoloog, Jeroen Bosch Ziekenhuis, ‘s-Hertogenbosch, expertise centrum voor kinderen met obesitas, Nederlandse Vereniging voor Kindergeneeskunde (vice-voorzitter)
- Dr. C.J. (Corjan) de Groot, AIOS kindergeneeskunde, Leids Universitair Medisch Centrum/ Groene Hart Ziekenhuis, Leiden/ Gouda, Nederlandse Vereniging voor Kindergeneeskunde
- Dr A. (Anita) Vreugdenhil, kinderarts, Maastricht Universitair Medisch Centrum, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. S. (Saskia) Bouma -De Jongh, kinderarts, De Kinderartsenpraktijk, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. M. (Marja) van der Vorst, kinderarts-klinisch farmacoloog, St Antonius, Utrecht/ Nieuwegein, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.J. (Arieke) Janse, kinderarts, Ziekenhuis Gelderse Vallei, Ede, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. M. (Malika) Chegary, kinderarts, Onze Lieve Vrouwe Gasthuis, Amsterdam, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. F.M.H. (François) van Dielen, chirurg, Maxima MC, Eindhoven, Nederlandse Vereniging voor Heelkunde
- Prof. dr. L.W.E. (Ernst) van Heurn, (kinder)chirurg, Amsterdam UMC, Amsterdam, Nederlandse Vereniging voor Heelkunde
- Dr. L.J.M. (Loek) de Heide, internist-endocrinoloog, Medisch Centrum Leeuwarden, Leeuwarden, De Nederlandse Internisten Vereniging
- Drs. J.W.J. (Willy) Jubels-Hatenboer, Nederlandse Stichting Over Gewicht, Haarlem
- Drs. R. (Ramona) Leysner, diëtist, Behandelcentrum Merem, Hilversum, Nederlandse Vereniging van Diëtisten
- Dr. E. (Eveliene) Dera-de Bie, docent Verpleegkunde, Zuyd Hogeschool, Heerlen, Beroepsvereniging Verpleegkundigen & Verzorgenden Nederland
- Drs. S. (Sanne) Laurijssen, GZ-psycholoog, Elisabeth-TweeSteden Ziekenhuis, Tilburg, het Nederlands Instituut van Psychologen
- Drs. M.G.M. (Margreet) van den Berg, GZ-psycholoog, Jeroen Bosch ziekenhuis, Den Bosch, het Nederlands Instituut van Psychologen
- Dr. I. (Irene) Peters, Arts M&G, Jeugdarts GGDrU, Utrecht, AJN Jeugdartsen Nederland
- Drs. M. (Marloes) Meurs, kinderfysiotherapeut, Bewegingscentrum Junior, Groningen, Koninklijk Nederlands Genootschap voor Fysiotherapie en Nederlandse Vereniging voor Kinderfysiotherapie
Klankbordgroep
- Dr. J. (Jutka) Halberstadt, universitair docent kinderobesitas, landelijk projectmanager Care for Obesity, Vrije Universiteit Amsterdam
- Drs. R. (René) Glijsteen, huisarts, Huisartsenpraktijk Kloppenborg&Glijsteen, Rotterdam, Nederlandse Huisartsen Genootschap
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. (Stefanie) Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van den Akker (voorzitter) |
Kinderarts Erasmus MC |
Geen |
Clinical trial fase III setmelatonide (Rhythm) voor patiënten met monogenetische obesitas Europees verband, gefinancierd door Rhythm Pharmaceuticals, Inc. |
Geen |
|
Van Mil (vice-voorzitter) |
Kinderarts-endocrinoloog Jeroen Bosch ziekenhuis Bijzonder hoogleraar Jeugd, Voeding en Gezondheid aan de Universiteit Maastricht |
Behandeld arts en initiatiefnemer Expertise Centrum Kinderen met Obesitas in het Jeroen Bosch ziekenhuis, dat tevens fungeert als 'best practise' voor het VWS proeftuinen project 'ketenaanpak voor kinderen met overgewicht'. Vakgroep Kindergeneeskunde wordt vergoed voor de uren die dit project worden gemaakt |
Mede auteur van het boek 'Overgewicht en Obesitas bij Kinderen. Verder kijken dan de kilo's (ISBN 9789089534262), dat de basis vormt van het landelijk model voor ketenaanpak voor kinderen met overgewicht.
Betrokken bij de BASIC trial, gefinancieerd door MUMC.
Deelnemer aan de onderzoeksgroep van een wetenschappelijk studie naar het effect van bariatrische chirurgie bij adolescenten met overgewicht. De studie is genaamd: Laparoscopie Roux-en-Y Gastric Bypass Equipoise Laparoscopie Sleeve Gastrectomy for Severe Obesity in Teenagers: a Randomized Controlled Trial.
Deelnemer aan de onderzoeksgroep van een wetenschappelijk studie naar het effect van metformine bij adolescenten met overgewicht. De studie is genaamd: An efficacy, safety and pharmacokinetic study on the short-term and long-term use of METFORMIN in obese children and adolescents.
|
Geen |
|
De Groot |
AIOS kindergeneeskunde LUMC/Groene Hart Ziekenhuis |
Binnen het GHZ betrokken bij onderwijscommissie van de afdeling kindergeneeskunde |
Promotieonderzoek werd deels gefinancieerd door Nutricia Early Life Nutrition. Dit betrof een 'unrestricted grant'. Dat wil zeggen dat Nutricia Early Life Nutrition geen invloed had op het onderzoek dat ik verrichte, of zeggenschap had over het al dan niet publiceren van de resultaten. Mijn onderzoek richtte zich op neuroradiologische aspecten van obesitas. Er was derhalve ook geen direct financieel belang voor Nutricia bij de resultaten van mijn onderzoek. Er is geen nog lopend onderzoek van mij wat gefinancierd wordt door Nutricia. Er is momenteel geen enkele financiële afhankelijkheid van hen. |
Geen |
|
Vreugdenhil |
Kinderarts MDL, vakgroep Kindergeneeskunde, Maastricht UMC+ , Oprichter Centre for Overweight Adolescent and Childrens Healthcare van het Maastricht UMC+ |
Geen |
Mede onderzoeker in de BASIC trial en de TEENBEST studie |
Geen |
|
Bouma-de Jongh |
Kinderarts Van Weel Bethesda ziekenhuis |
Richtlijn bacterie NVVIT |
Geen |
Geen |
|
Van der Vorst |
Kinderarts-klinisch farmacoloog St. Antonius ziekenhuis Utrecht/Nieuwegein |
Geen |
Hoofdonderzoeker: M.M.J. van der Vorst. studienummer: NL34811.100.11. 'Metformin' wetenschappelijke studie naar het effect van metformine bij adolescenten met overgewicht. De studie is genaamd: An efficacy, safety and pharmacokinetic study on the short-term and long-term use of METFORMIN in obese children and adolescents. |
Geen |
|
Janse |
Kinderarts en klinische epidemioloog B. Werkgever: Ziekenhuis Gelderse Vallei |
Geen |
Hoofdonderzoeker A.J.Janse studienummer NL50601.029.14. Randomized Controlled Trial Solid food in preterm infants and the effect on obesity in the Netherlands (SPOON). Gefinancieerd middels samenwerkingsbijdrage Nutricia. Geen belang bij uitkomst onderzoek |
Geen |
|
Chegary |
Kinderarts OLVG Amsterdam |
Geen |
Geen |
Geen |
|
Van Dielen |
Bariatrisch chirurg |
0.0 fte aanstelling in het Mumc+ als gastoperateur voor de BASIC trial. Betaald |
Gastroperateur van de BASIC trial en derhalve hierbij actief betrokken. - Principal investigator van een internationale multicenter prospectief gerandomiseerde studie gastric sleeve versus. gastric bypass in adolescenten. (TEEN-Best). |
Geen |
|
Van Heurn |
Kinderchirurg, hoogleraar kinderchirurgie AMC en VUMC |
Geen |
Hoofdonderzoeker BASIC trial: onderzoek naar bariatrische Chirurgie/ leefstijlinterventies bij adolescenten gefinancierd door MUMC. Geen belang bij de uitkomst van het onderzoek. |
Geen |
|
De Heide |
Internist-Endocrinoloog, Medisch Centrum Leeuwarden, in dienst van MSB-VCL, 50% |
1 dagdeel per week in dienst van CON, Centrum Obesitas Nederland, Leeuwarden, onbetaald, protocollering postoperatieve zorg na bariatrie, wetenschappelijk onderzoek |
Geen |
Geen |
|
Jubels-Hatenboer |
Part-time werkzaam bij marketing in de & communicatie bij Jubels B.V. |
Sinds sept 2014 actief lid van de Technische Commissie bij de Zandvoortsche Hockeyclub. En sinds 2018 bestuurslid bij de Nederlandse Stichting Over Gewicht. |
Dochter met genetische obesitas (leptinereceptor deficiëntie) maar zij zal niet gebaat zijn bij een bariatrisch chirurgische ingreep. |
Geen |
|
Leysner |
Dietist behandelcentrum Merem Hilversum |
Lid landelijk netwerk van diëtisten die gespecialiseerd zijn in de behandeling van overgewicht en (morbide) obesitas met bijbehorende co-morbiditeit (KDOO) (onbetaald) |
Geen |
Geen |
|
Dera-de Bie |
Docent Verpleegkunde (0,8) en lid lectoraat wijkgerichte zorg (0,2) Zuyd Hogeschool Heerlen |
Redactielid Tijdschrift JGZ Lid V&VN, maatschappij en gezondheid |
Geen |
Geen |
|
Laurijssen |
GZ-psycholoog en cognitief gedragstherapeut Elisabeth Tweesteden ziekenhuis Tilburg |
Gastdocent Tilburg University |
Geen |
Geen |
|
Van den Berg |
Gz-psycholoog, RVE Kindergeneeskunde, Jeroen Bosch Ziekenhuis GGZ-Oostbrabant afdeling eetstoornissen |
Geen |
Als Gz-psycholoog verbonden aan het zorgpad overgewicht binnen het Jeroen Bosch Ziekenhuis. Betrokken bij indicatiestelling voor behandeling. |
Geen |
|
Peters |
Arts Maatschappij en Gezondheid, jeugdarts bij GGDrU. |
Geen |
Geen |
Geen |
|
Meurs
|
Kinderfysiotherapeut, voorzitter Nederlandse Vereniging voor Kinderfysiotherapie, eigen kinderpraktijk, begeleidt en behandelt kinderen met obesitas in een eerstelijns GLI. |
Geen |
Geen |
Geen |
|
Halberstadt |
Universitair docent kinderobesitas/ Landelijk projectmanager Care for Obesity, Vrije Universiteit Amsterdam |
Geen |
Care for Obesity leverde in 2018 met financiering van het ministerie van VWS het landelijk model ketenaanpak voor kinderen met overgewicht en obesitas op. Vanaf 2019 vormt Care for Obesity /de Vrije Universiteit Amsterdam met vier andere landelijke partijen de coalitie voor de ketenaanpak voor kinderen met overgewicht en obesitas. Deze coalitie werkt met financiering van het ministerie van VWS aan de borging, implementatie, doorontwikkeling en evaluatie van het landelijk model. |
Geen |
|
Glijsteen |
Huisarts zelfstandig in maatschap 3-3,5 dag NAP Kloppenberg& Glijsteen en Huisarts docent staflid Huisartsopleiding UMC 1,5 dag |
Wedstijdsecretaris V.O.C. incident Rotterdam Onbetaald Lid raad van toezicht van PRIMEUR database (onbetaald) |
Geen |
Geen |
|
Mostovaya |
Senior adviseur |
Geen |
Geen |
Geen |
|
Hofstede |
Senior adviseur |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Nederlandse Stichting Over Gewicht.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn-(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse vereniging voor Heelkunde, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Obstetrie en Gynaecologie, Care for Obesity, Jeugdartsen Nederland, Verpleegkundigen & Verzorgenden Nederland, Koninklijk Nederlands Genootschap voor Fysiotherapie, Nederlandse Vereniging voor Kinderfysiotherapie, Kind & Ziekenhuis, Inspectie Gezondheidszorg en Jeugd, Partnerschap Overgewicht Nederland, Nederlandse Obesitas Kliniek, Zelfstandige Klinieken Nederland, Zorginstituut Nederland en RA-Medical via een Invitational conference. Dit was een gecombineerde Invitational conference voor twee richtlijnen; (1) behandeling van kinderen met obesitas en (2) chirurgische behandeling van obesitas. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk
te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties, waaronder de partijen die zijn uitgenodigd voor de invitational conference, voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., et al. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Link: http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., et al. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2005 – november 2018
|
1 exp *PEDIATRIC OBESITY/ (5058) 2 (obese or obesity or overweight* or excess weight*).ti. (115091) 3 (child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).ti. (1405670) 4 2 and 3 (20964) 5 1 or 4 (22764) 6 exp *Drug Therapy/ or exp Metformin/ or exp Lactones/ or exp Cyclobutanes/ or exp PIPERIDINES/ or exp PYRAZOLES/ or exp FRUCTOSE/ or exp PHENTERMINE/ or exp NALTREXONE/ or exp Glucagon-Like Peptide 1/ or exp Bupropion/ or drug*.ti. or pharmacologic*.ti. or medication*.ti. or metformin*.ti,ab,kw. or orlistat*.ti,ab,kw. or sibutramin*.ti,ab,kw. or topiramat*.ti,ab,kw. or fructos*.ti,ab,kw. or phentermin*.ti,ab,kw. or rimonabant*.ti,ab,kw. or lorcaserin*.ti,ab,kw. or naltrexon*.ti,ab,kw. or bupropion*.ti,ab,kw. or pramlintid*.ti,ab,kw. or zonisamid*.ti,ab,kw. or glp*.ti,ab,kw. or dpp*.ti,ab,kw. or slgt*.ti,ab,kw. or mc4r*.ti,ab,kw. or cyclobutan*.ti,ab,kw. or lacton*.ti,ab,kw. or piperidin*.ti,ab,kw. or pyrazol*.ti,ab,kw. or bupropin*.ti,ab,kw. or amfebutamon*.ti,ab,kw. or tetrahydrolipstatin*.ti,ab,kw. (1194685) 7 5 and 6 (485) 8 limit 7 to (english language and yr="2005 -Current") (412) 9 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (373647) 10 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3067948) 11 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1802233) 12 8 and 9 (36) 13 8 and 11 (141) 14 13 not 12 (118) 15 8 and 10 (129) 16 15 not 12 not 14 (93) 17 12 or 14 or 16 (247)
= 247 |
429 |
|
Embase (Elsevier) |
('childhood obesity'/exp/mj OR ((obese:ti OR obesity:ti OR overweight*:ti OR 'excess weight*':ti) AND (infan*:ti OR newborn*:ti OR 'new born*':ti OR perinat*:ti OR neonat*:ti OR 'baby'/exp/mj OR baby*:ti OR babies:ti OR toddler*:ti OR 'minors'/exp/mj OR minors*:ti OR 'boy'/exp/mj OR boy:ti OR boys:ti OR boyfriend:ti OR boyhood:ti OR girl*:ti OR kid:ti OR kids:ti OR 'child'/exp/mj OR child*:ti OR children*:ti OR schoolchild*:ti OR 'schoolchild'/exp/mj OR adolescen*:ti OR juvenil*:ti OR youth*:ti OR teen*:ti OR pubescen*:ti OR pediatric*:ti OR paediatric*:ti OR peadiatric*:ti OR school:ti OR school*:ti OR prematur*:ti OR preterm*:ti OR 'pediatrics'/exp/mj))) AND ('drug therapy'/exp/mj OR 'metformin'/exp OR 'tetrahydrolipstatin'/exp OR 'sibutramine'/exp OR 'topiramate'/exp OR 'fructose'/exp OR 'phentermine'/exp OR 'rimonabant'/exp OR 'lorcaserin'/exp OR 'naltrexone'/exp OR 'amfebutamone'/exp OR 'pramlintide'/exp OR 'zonisamide'/exp OR 'glucagon like peptide 1 receptor agonist'/exp OR 'dipeptidyl peptidase iv inhibitor'/exp OR 'mc4r gene'/exp OR 'cyclobutane derivative'/exp OR 'lactone'/exp OR 'piperidine derivative'/exp OR 'pyrazole derivative'/exp OR drug*:ti OR pharmacologic*:ti OR medication*:ti OR metformin*:ti,ab OR orlistat*:ti,ab OR sibutramin*:ti,ab OR topiramat*:ti,ab OR fructos*:ti,ab OR phentermin*:ti,ab OR rimonabant*:ti,ab OR lorcaserin*:ti,ab OR naltrexon*:ti,ab OR bupropion*:ti,ab OR pramlintid*:ti,ab OR zonisamid*:ti,ab OR glp*:ti,ab OR dpp*:ti,ab OR slgt*:ti,ab OR mc4r*:ti,ab OR cyclobutan*:ti,ab OR lacton*:ti,ab OR piperidin*:ti,ab OR pyrazol*:ti,ab OR bupropin*:ti,ab OR amfebutamon*:ti,ab OR tetrahydrolipstatin*:ti,ab) AND [2005-2018]/py AND [english]/lim NOT 'conference abstract':it
Gebruikte filters: Systematic Reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 60
Randomized Clinical Trials: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 206
Observationele studies: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 77
= 343 |

