Indicatiestelling bariatrische chirurgie bij kinderen met obesitas
Uitgangsvraag
Wat is de indicatiestelling voor bariatrische chirurgie bij kinderen met obesitas bij wie GLI onvoldoende succes oplevert?
Aanbeveling
Verricht alleen bariatrische chirurgie bij adolescenten als voldaan wordt aan de volgende criteria:
- Eerst moet goed begrepen worden wat de oorzakelijke en onderhoudende factoren van de obesitas bij een individu zijn en in welke mate deze beïnvloedbaar zijn.
- De adolescent heeft een voor leeftijd en geslacht gecorrigeerde BMI van ≥ 40 kg/m2, of van 35 tot 40 kg/m2 in combinatie met ernstige co-morbiditeit(en).
- De adolescent is gedurende een lange periode (>1 jaar) begeleid met gecombineerde leefstijl-interventies onder leiding van een expertise centrum met onvoldoende resultaat.
De adolescent is individueel besproken in een lokaal multidisciplinair team en daarna door een landelijk expertiseplatform van onafhankelijke experts. Zowel lokaal multidisciplinair team als landelijk expertiseplatform staan achter bariatrische interventie.
Indien geconcludeerd wordt dat bariatrie noodzakelijk is, zijn er de volgende vereisten:
- Als minimale leeftijd geldt de eind-pubertaire adolescenten (Tanner stadium 4).
- De adolescent is bereid te participeren in een postoperatief multidisciplinair behandelprogramma, mee te werken aan zorgevaluatie en levenslange follow-up.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De veiligheid van een bariatrische operatie is zeer groot en de kans op sterfte of ernstige direct postoperatie complicaties is, onafhankelijk van de hedendaags veel gebruikte operatietechnieken extreem laag. Lange termijn uitkomsten en de aard van late complicaties zijn bij adolescenten onvoldoende bekend en variëren per operatietechniek. Hiervoor is een separate richtlijn.
De overall bewijskracht van de superioriteit van bariatrische chirurgie vergeleken met gecombineerde leefstijlinterventies is zeer laag. Er is nog onvoldoende onderzoek gedaan bij adolescenten om definitief vast te stellen dat bariatrische chirurgie een grotere afname van overgewicht geeft met reductie van co-morbiditeit. Er ligt hier een kennislacune en meer gerandomiseerd onderzoek is nodig bij adolescenten om deze vraag te kunnen beantwoorden.
Echter, niet-vergelijkende onderzoeken bij adolescenten en onderzoeken bij volwassenen laten zien dat bariatrische chirurgie resulteert in een sterke afname van overgewicht en een afname in co-morbiditeiten als diabetes, hypertensie, OSAS en Dyslipidemie vergeleken met gecombineerde leefstijlinterventies. Een vergelijkbaar resultaat is zeer waarschijnlijk te verwachten bij adolescenten.
Ondanks deze veelbelovende eerste korte termijn resultaten van studies uit de VS en Zweden werd in een recent editorial (Adams et al) gepleit voor terughoudendheid. Uit de eerste resultaten bleek ook dat de kans op voedingsdeficiënties en heroperaties verhoogd was ten opzichte van de groep volwassenen die dergelijke ingrepen ondergingen. Geadviseerd werd enkel casus specifiek af te wegen of bariatrische chirurgie geïndiceerd is omdat nog te weinig bekend is van de lange termijn resultaten
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Obesitas gaat vaak gepaard met co-morbiditeiten zoals diabetes mellitus type 2, hypertensie, OSAS en Dyslipedemie. De behandeling zal vooral ten doel hebben afname van overgewicht te bewerkstelligen waarbij dit leidt tot het voorkomen van of een sterke afname of volledige remissie van verschillende co-morbiditeiten. Vroege behandeling van DM leidt hierbij tot een grotere remissiekans van diabetes dan late behandeling met uiteindelijk minder insuline gebruik.
Naast verbetering van co-morbiditeiten leidt substantiële afname van overgewicht zeer waarschijnlijk tot een toename van kwaliteit van leven.
Kosten (middelenbeslag)
Bij volwassen is dat aangetoond dat bariatrische chirurgie kosteneffectief. Bij adolescenten is hier nog nagenoeg geen onderzoek naar gedaan.
Aanvaardbaarheid voor de overige relevante stakeholders
Recentelijk is door de NVK een standpunt ingenomen ten aanzien van bariatrie bij adolescenten. De werkgroep sluit zich aan bij dit standpunt. In het standpunt worden de volgende criteria en kaders gegeven:
- Primaire terughoudendheid: de houding van de kinderarts bij bariatrie is primair terughoudend. Eerst moet goed begrepen worden wat de oorzakelijke en onderhoudende factoren van de obesitas bij een individu zijn en in welke mate deze beïnvloedbaar zijn. Deze analyse dient multidisciplinair uitgewerkt te worden volgens de reeds bestaande richtlijnen.
- Er dient sprake te zijn van ernstig psychisch lijden als gevolg van de ernstige mate van overgewicht.
- Pas indien alle relevante interventies zijn geprobeerd én pas als onthouding van een bariatrische ingreep een gerede kans zou geven op lichamelijke of geestelijke schade.
- Indien de conclusie is dat bariatrie inderdaad noodzakelijk is, ontstaat daarmee tevens de verantwoordelijkheid om de uitvoering van het beleid niet langer uit te stellen. Een potentieel effectieve interventie zou dan niet langer onthouden moeten worden.
- Bariatrie vindt uitsluitend plaats als onderdeel van een levenslange leefstijl-begeleiding.
- De zorgstandaard blijft de basis. De aanpak volgt de Piramide van gewichtsgerelateerd gezondheidsrisico. In de top van die Piramide zijn er opties zoals klinische opname en/óf bariatrie. Leeftijdsgrens: vanaf volledig eind-pubertaire kinderen (dus minimaal Tanner-stadium 4).
- Inclusie- en exclusiecriteria zoals in de internationale guidelines, maar wel aangepast aan de kaders van de Nederlandse situatie. Denk hierbij aan het GLI voor/na-traject, zoals hieronder nader uitgewerkt.
- Het informed consent van de adolescent moet zorgvuldig worden doorlopen. Hiertoe dient een protocol te worden gevolgd dat is opgesteld door mensen met specifieke expertise op dit gebied, waaronder: kinderartsen (stuurgroep), psycholoog, kinderchirurg, bariatrisch chirurg en een medisch ethicus.
- De operatie vindt plaats in een expertisecentrum met multidisciplinair team (zie internationale guidelines). De kinderarts heeft de regie in voor en nazorg en de verwijzing.
- In het multidisciplinaire team moeten ook vertegenwoordigd zijn: specialisten met bariatrische, kinderchirurgische én kinder-intensive-care-compententies.
- Landelijk platform voor casuïstiek-bespreking: elke patiënt die voor inclusie in aanmerking komt, wordt besproken in het lokaal multidisciplinair behandelteam van het expertisecentrum en daarna door een landelijk expertiseplatform van onafhankelijke experts.
- De operaties worden alleen uitgevoerd in wetenschappelijk studieverband.
- Indicatiestelling: wat wordt verstaan onder een kwalitatief goed voor/na-traject? Ter verduidelijking, hiermee wordt bedoeld: de lange termijn-brede aanpak gericht op leefstijlinterventie. Hiermee wordt niet bedoeld: het voor/na-traject van de bariatrische interventie. Wanneer vinden we dat ‘alles’ is gedaan en conservatieve behandeling niet effectief is gebleken?
Haalbaarheid en implementatie
Bariatrische chirurgie wordt uitgevoerd in een zeer beperkt aantal ‘full facility’ ziekenhuizen.
De behandeling vindt plaats in een multidisciplinair team van een gespecialiseerde kinderarts, diëtist, psycholoog, kinderchirurg, bariatrisch chirurg, anesthesioloog.
Er zijn afspraken met een naburige kinder-IC.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Bariatrische chirurgie is geen onderdeel van protocollaire behandeling kinderen met obesitas. In uitzonderingsgevallen kan bariatrische chirurgie overwogen worden adolescenten met extreme obesitas. Op korte termijn kan dit leiden tot significante daling in overgewicht en/of vermindering van co-morbiditeit. Er is echter is terughoudendheid geboden omdat met name de lange termijn resultaten van de verschillende operaties bij adolescenten niet goed bekend zijn. Bariatrische chirurgie kan worden overwogen indien de adolescent eerst langdurig gecombineerde leefstijlinterventies onder leiding van een expertisecentrum heeft ondergaan met onvoldoende resultaat.
Langdurige follow-up na bariatrische chirurgie en specifieke zorgevaluatie zijn essentieel. Bariatrische chirurgie moet in wetenschappelijk kader uitgevoerd worden. Kwaliteitsuitkomsten moeten worden geregistreerd en gebruikt worden voor wetenschappelijk onderzoek.
Onderbouwing
Achtergrond
Op dit moment is er geen behandeloptie voor kinderen met ernstige obesitas of (extreem verhoogd gewichtsgerelateerd gezondheids risico die niet responsief zijn op multidisciplinaire behandeling. Zelfs bij de meest succesvolle interventies in specialistische centra lukt het niet alle kinderen te helpen. Deze kinderen hebben een sterk verhoogd risico op het ontwikkelen van chronische ziekten zoals diabetes mellitus type 2, cardiovasculaire aandoeningen, slaapapneu, depressie, niet-alcoholische leververvetting en vroegtijdig overlijden. Daarnaast zijn de kansen van deze kinderen in de maatschappij beperkt. Bariatrische chirurgie bij kinderen als behandeloptie na falende conventionele therapie is in Nederland nog geen mogelijkheid. Echter, internationaal wordt metabole chirurgie bij adolescenten in toenemende mate als een waardevolle behandelingsmogelijkheid gezien bij patiënten met onvoldoende gewichtsverlies met gecombineerde leefstijl interventies.
Recentelijk is door de NVK een standpunt hierover ingenomen waarbij bariatrische chirurgie bij wijze van uitzondering als optie beschikbaar moet komen, indien is voldaan aan specifieke criteria.
Zowel een maagband, gastric sleeve resectie alsook een gastric bypass, zijn hiervoor mogelijk en leiden allen in verschillende mate tot afname van overgewicht en vermindering van co-morbiditeiten.
Het is echter onduidelijk wat de lange termijn effecten zijn van bariatrische chirurgie bij adolescenten
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt tot een grotere afname in overgewicht dan leefstijlinterventies bij kinderen met obesitas.
Bronnen: Hunsaker, 2018; Manco, 2017; O’Brien, 2010; Olbers, 2012 |
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt tot een verschil in prevalentie van diabetes ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Bron: Olbers, 2017 |
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt tot een verschil in prevalentie van hypertensie ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Bronnen: Manco, 2017; Olbers, 2017 |
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt tot een verschil in prevalentie van dyslipidemie ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Bronnen: Manco, 2017; Olbers, 2017 |
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt tot een verschil in prevalentie van metabool syndroom ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Bron: O’Brien, 2010 |
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt tot een verschil in HbA1c of glucose ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Bronnen: Manco, 2017; Olbers, 2017 |
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt tot een verschil in insuline ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Bronnen: Manco, 2017; O’Brien, 2010; Olbers, 2017 |
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt een verschil in prevalentie van glucoseintolerantie/insuline sensitiviteit ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Bronnen: O’Brien, 2010; Olbers, 2017 |
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt tot een verschil in systolische en diastolische bloeddruk ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Bronnen: Manco, 2017; O’Brien, 2010; Olbers, 2017 |
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt tot een verschil in LDL en HDL cholesterol gehaltes in het bloed ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Het is onduidelijk of bariatrische chirurgie leidt tot verschil in triglyceriden gehalte in het bloed ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Bronnen: Manco, 2017; O’Brien, 2010; Olbers, 2017 |
|
Zeer laag GRADE |
Het is onzeker of bariatrische chirurgie leidt tot een verschil in kwaliteit van leven ten opzichte van leefstijlinterventies bij kinderen met obesitas.
Bronnen: Manco, 2017; O’Brien, 2010 |
Samenvatting literatuur
Beschrijving studies
Slechts één studie betrof een gerandomiseerde trial. In de RCT van O'Brien (2010) werd de effectiviteit geëvalueerd van een maagband (laproscopic adjustable gastric banding (LAGB)) ten opzichte van een leefstijl interventie bij kinderen met een BMI van 35 of hoger. De 50 deelnemers waren tussen de 14 en 18 jaar oud. In de LAGB-groep (n=25) werd binnen een maand na randomisatie de maagbandgeplaatst. Deelnemers kregen ook verbale en geschreven instructies met betrekking tot eten (3 of minder kleine, proteïnerijke maaltijden per dag, langzaam eten en goed kauwen) en bewegen (ten minste 30 minuten/dag sporten en een hoge mate van activiteit gedurende de dag). De leefstijl interventie (n=25) was gericht op het verminderen van energie-inname (geïndividualiseerd dieet van 800 tot 2000 kcal/dag afhankelijk van leeftijd en gewicht), meer bewegen (> 10000 stappen/dag gemeten met stappenteller, gestructureerd oefenschema van 30 minuten/dag) en gedragsmodificatie. Het gezin werd betrokken bij de instructies en het bewegen. Daarnaast was er gedurende 6 weken een personal trainer beschikbaar De deelnemers werden gedurende 2 jaar gevolgd op gewichtsveranderingen, gezondheidsstatus (metabool syndroom en insulineresistentie vastgesteld met klinisch onderzoek) en kwaliteit van leven (gemeten met de Child Health Questionnaire (CHQ CF-50)).
De twee publicaties van Olbers (2012; 2017) beschreven de vergelijking van Roux-en-Y gastric bypass chirurgie (RYGB) met een conventionele leefstijl interventie. De sample bestond uit 81 patiënten die RYGB ondergingen en 81 gematchte patiënten geselecteerd van de Swedisch Childhood Obesity Treatment Register. Alle deelnemers waren 13 tot 18 jaar oud, voorbij de piek in de groeispurt (minimaal Tanner 4) en hadden minimaal één jaar een conventioneel gewichtsverliesprogramma gevolgd. Allen hadden een BMI van ≥ 40 of een BMI van ≥ 35 in combinatie met co-morbiditeit (diabetes mellitus type 2 , dyslipidemie of metabool syndroom). De leefstijl groep kreeg een geïndividualiseerde of gezinsgerichte behandeling van een multidisciplinair team gericht op gedragsverandering rondom dieet en fysieke activiteit. Laagcalorische diëten en medicatie werden voorgeschreven door de kinderarts indien klinisch geïndiceerd. Na twee jaar werden de groepen vergeleken op veranderingen in gewicht, co-morbiditeit en cardiovasculaire risicofactoren (Olbers, 2012). Na vijf jaar werden de groepen vergeleken op veranderingen in gewicht, metabole risicofactoren en kwaliteit van leven gemeten met de SF-36 (Olbers, 2017).
Manco (2017) beschreef een niet-gerandomiseerde trial waarin deelnemers de keuze kregen tussen laparoscopische sleeve gastrectomie (LSG), combinatie van intragastrische ballon gedurende 3 maanden (IGB) en leefstijl interventie, of enkel een leefstijl interventie. Alle deelnemers waren 13 tot 17 jaar oud met een BMI van ≥ 35. Allen hadden niet-alcoholische leververvetting aangetoond met biopsie en waren niet in staat om 10% gewichtsverlies te bereiken tijdens een leefstijlinterventie van 6 maanden. Alle deelnemers ontvingen voedingsconsultaties van een diëtist gedurende de studie, waarbij een gebalanceerd dieet (40 kcal/kg/dag, 55% koolhydraten, 15% proteïnen, 30% lipiden) en aerobe fysieke activiteit (30 minuten/dag) voorgeschreven werden. Deelnemers met BMI>40 kregen LSG als eerste optie en IGB als tweede optie aangeboden. Deelnemers met een BMI tussen de 35 en 40 of met BMI<35 en metabole co-morbiditeiten kregen als eerste optie IGB aangeboden. Degenen die LSG of IGB weigerden kregen een leefstijlinterventie aangeboden. Twintig deelnemers kozen voor LSG; 20 deelnemers kozen voor IGB en 53 deelnemers kozen voor de leefstijlinterventie. Deelnemers werden gedurende een jaar gevolgd op gewicht, metabole symptomen (onder andere glucose intolerantie, hypertensie, dyslipidemie) en kwaliteit van leven (instrument werd niet vermeld).
Hunsaker (2018) beschreef een cohort studie waarin patiënten die RYGB, LSG of LAGB ondergingen (n=127) gevolgd werden en vergeleken met deelnemers aan een leefstijlinterventie gematcht op leeftijd, geslacht en ras (n=75). Alle deelnemers waren 13 tot 18 jaar oud, hadden ernstige obesitas op baseline en werden gedurende 2 jaar gevolgd op veranderingen in gewicht en psychopathologie.
Resultaten
Gewicht
Drie studies vergeleken bariatrische chirurgie (n=232) met een leefstijlinterventie (n=174) op percentage gewichtsverlies na 2 jaar ten opzichte van baseline (O'Brien, 2010; Olbers, 2012; Hunsaker, 2018). Gemiddeld over de drie studies nam het gewicht 32,4% (95% BI 25,3 tot 39,6) meer af in de bariatrische chirurgie-groep dan in de leefstijlgroep (Figuur 1).
Daarnaast rapporteerden twee studies gewichtsverlies na 1 jaar (Olbers, 2012; Manco, 2017) en één studie rapporteerde gewichtsverlies na 5 jaar (Olbers, 2017). Zowel Olbers (2012) als
Manco (2017) rapporteerden een groter gemiddeld gewichtsverlies na 1 jaar in de bariatrische chirurgie-groep (respectievelijk -21,5%; 95% BI: niet vermeld en -31%; 95% BI -33, 29) dan in de leefstijlgroep (respectievelijk +1,7%; 95% BI niet vermeld en -1%; 95% BI -3 tot 2). De verschillen tussen de groepen werden niet getoetst op significantie. In de studie van (Olbers, 2017) bleef dat verschil tussen de twee groepen vijf jaar na baseline behouden (gemiddeld verschil: -37,2, 95% BI: -46,4 tot -28,0, p<0,001).
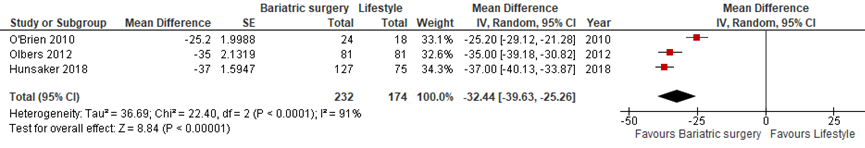
Figuur 1 Bariatrische chirurgie versus leefstijlinterventie - percentage gewichtsverlies na 2 jaar
Co-morbiditeiten (diabetes)
Slechts één studie vergleek bariatrische chirurgie met leefstijlinterventie op de prevalentie van diabetes mellitus type 2 (Olbers, 2017). De prevalentie van diabetes nam na vijf jaar af van 3,7% (95% BI: 0,8 tot 10,4) tot 0% (95% BI: 0 tot 4,6) in de bariatrische chirurgiegroep (p=0,25). De prevalentie van diabetes op baseline in de leefstijlgroep werd niet gerapporteerd, maar na vijf jaar had 2,3% (95% BI: 0,1 tot 12,0) diabetes. Het verschil in prevalentie tussen de groepen na vijf jaar was niet statistisch significant (p=0,37).
Co-morbiditeiten (hypertensie)
Manco (2017) rapporteerde veranderingen in prevalentie van hypertensie. In de bariatrische chirurgie-groep nam de prevalentie van hypertensie af van 60% op baseline tot 0% na één jaar (p=0,005). In de leefstijlgroep nam de prevalentie af van 39,6% op baseline tot 22,7% na één jaar (p=0,25). Het verschil tussen de groepen werd niet getoetst op significantie.
Olbers (2017) rapporteerde veranderingen in prevalentie van hypertensie. In de bariatrische chirurgiegroep nam de prevalentie na vijf jaar af van 15,4% (95% BI: 8,2 tot 25,3) tot 2,8% (95% BI: 0,3 tot 9,7). De prevalentie van hoge bloeddruk op baseline in de leefstijlgroep werd niet gerapporteerd, maar na vijf jaar had 10,3% (95% BI: 2,9 tot 24,2) hoge bloeddruk. Het verschil in prevalentie tussen de groepen na vijf jaar was niet statistisch significant (p=0,18).
Co-morbiditeiten (dyslipidemie)
Twee studies vergeleken bariatrische chirurgie met leefstijlinterventie op prevalentie van dyslipidemie (Manco, 2017; Olbers, 2017). In de studie van Olbers (2017) daalde de prevalentie van 69,1% op baseline naar 14,5% na vijf jaar in de bariatrische chirurgiegroep. De prevalentie van dyslipidemie op baseline in de leefstijlgroep werd niet gerapporteerd, maar na vijf jaar was de prevalentie 73,2%. Het verschil in prevalentie tussen de groepen na vijf jaar was statistisch significant (p<0,001). In de studie van Manco (2017) daalde de prevalentie na één jaar van 60% naar 5% in de bariatrische chirurgiegroep (p=0,001) en van 41,5% naar 36,3% in de leefstijlgroep (p=0,50). Het verschil tussen de groepen werd echter niet getoetst.
Co-morbiditeiten (metabool syndroom)
In de RCT van O'Brien (2010) werd de bariatrische chirurgiegroep vergeleken met de leefstijlgroep op prevalentie van metabool syndroom. Het aantal deelnemers met metabool syndroom nam af van 9 (36%, n=25) op baseline tot 0 (0%, n=24) na twee jaar en van 9 (40%, n=25) tot 4 (22%, n=18) in de leefstijlgroep (p-waarde voor het verschil tussen de groepen=0,03).
Risicofactoren voor co-morbiditeit (HbA1c, glucose, insuline)
Twee studies vergeleken bariatrische chirurgie met leefstijlinterventie op verandering in HbA1c waarden uitgedrukt in mmol/mol (Manco, 2017; Olbers, 2017). In de niet-gerandomiseerde trial van Manco (2017) werd na één jaar geen significant verschil gevonden in HbA1c tussen de bariatrische chirurgiegroep dan in de leefstijlgroep (gemiddelde: 34,2 ±2,9 mmol/mol versus 32,5 ±0,8 mmol/mol, p=0,84). In de observationele studie van Olbers (2017) werd na vijf jaar eveneens geen significant verschil gevonden in HbA1c tussen de twee groepen (gemiddeld verschil: -1,8, 95% BI -5,4 tot 1,8, p=0,32).
Drie studies vergeleken bariatrische chirurgie met leefstijlinterventie op verandering in glucosewaarden. Daarbij keken twee studies naar verandering in plasma glucosewaarden uitgedrukt in mg/dL na één of twee jaar en vonden een statistisch significant grotere afname in de bariatrische chirurgie-groep dan in de leefstijlgroep (gemiddeld verschil: -9,3, 95% BI: -15,8 tot -2,8) Figuur 2) (O'Brien, 2010; Manco, 2017). Eén studie keek naar verandering in plasma glucosewaarden uitgedrukt in mmol/L en vond eveneens een statistisch significant grotere afname in de bariatrische chirurgie-groep dan in de leefstijlgroep (gemiddeld verschil: -0,5, 95% BI: -,8 tot -0,1, p=0,009) (Olbers, 2017). Manco (2017) keek ook naar prevalentie van beperkte glucosetolerantie en vond dat in deze afname van 25% naar 0% in de bariatrische chirurgiegroep (p=0,05) en van 15,1% naar 13,6% in de leefstijlgroep (p=0,98) (verschillen tussen groepen werden niet getoetst).
Drie studies vergeleken bariatrische chirurgie met leefstijlinterventie op verandering in insulinewaarden (O'Brien, 2010; Manco, 2017; Olbers, 2017), echter elke studie drukte de waarden uit in verschillende eenheden, waardoor een meta-analyse niet mogelijk was. In de RCT van O'Brien (2010) werd na twee jaar geen significant verschil gevonden in afname in insulinewaarden tussen de twee groepen (gemiddeld verschil: -0,4; 95% BI: -10,8 tot 2,8, p=0,24). In de niet-gerandomiseerde trial van Manco (2017) werd na één jaar een gemiddeld lagere insulinewaarde gevonden in de bariatrische chirurgiegroep dan in de leefstijlgroep (gemiddelde: 16 ±7 mU/L versus 24 ±8 mU/L, p=0,05). In de observationele studie van Olbers (2017) werd na twee jaar een significant grotere afname in de bariatrische chirurgiegroep gevonden dan in de leefstijlgroep (gemiddeld verschil: -117,8; 95% BI -158,3 tot -77,3, p<0,001).
O'Brien (2010) vergeleek de groepen op verandering in insuline sensitiviteit (gemeten met de homeostatis model assessment (HOMA)) en vond na twee jaar een grotere toename in de bariatrische chirurgiegroep dan in de leefstijlgroep (gemiddeld verschil 74,6%, 95% BI: 33 tot 116, p=0,001). Manco (2017) vergeleek de groepen op verandering in insuline resistentie (gemeten met de HOMA) en vond na één jaar tevens een statistisch significant verschil tussen de groepen (gemiddelde 3,1 ±1,4 versus 5,5 ±1,6, p=0,04).
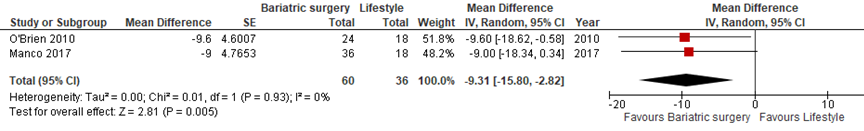
Figuur 2 Bariatrische chirurgie versus leefstijlinterventie – plasma glucose (mg/dL) na 12 (Manco) and 24 maanden (O’Brien) follow-up
Risicofactoren voor co-morbiditeit (systolische en diastolische bloeddruk)
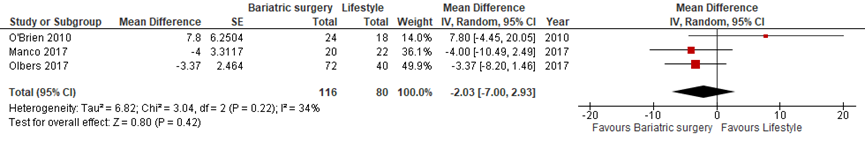
Drie studies vergeleken bariatrische chirurgie en leefstijlinterventie op veranderingen in systolische en diastolische bloeddruk (O'Brien, 2010; Manco, 2017; Olbers, 2017). Gepoold over de drie studies werd geen significant verschil gevonden tussen de groepen in zowel veranderingen in systolische bloeddruk (gemiddeld verschil -2,0; 95% BI -7,0 tot 2,9, Figuur 3A) als diastolische bloeddruk (gemiddeld verschil -1,5; 95% BI -9,7 tot 6,8, Figuur 3B).
A.
B.
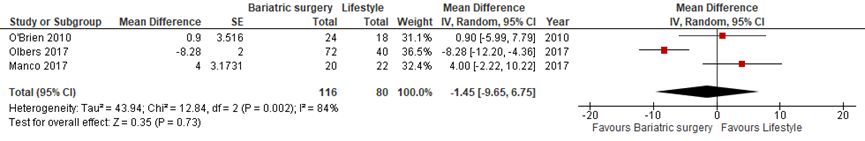
Figuur 3 Bariatrische chirurgie versus leefstijlinterventie – (A) systolische bloeddruk (mmHg) en (B) diastolische bloeddruk (mmHg)
Risicofactoren voor co-morbiditeit (LDL, HDL, triglyceriden)
Twee studies vergeleken bariatrische chirurgie met leefstijlinterventie op LDL cholesterol (Manco, 2017; Olbers, 2017). Olbers (2017) rapporteerde een significant grotere afname in LDL cholesterol in de bariatrische chirurgiegroep dan in de leefstijlgroep (gemiddeld verschil: -0,9 mmol/L, 95% BI: -1,2 tot -0,6). Manco (2017) rapporteerde geen significant verschil tussen de groepen na één jaar (gemiddelde 92 ±21 mg/dL versus 94 ±30 mg/dL, p=0,35).
Drie studies vergeleken bariatrische chirurgie met leefstijlinterventie op HDL cholesterol (O'Brien, 2010; Manco, 2017; Olbers, 2017). O'Brien (2010) rapporteerde geen significant verschil in verandering in HDL cholesterol tussen de groepen (gemiddeld verschil: 5,4 mg/dL, 95% BI: -3,5 tot 14). Olbers (2017) rapporteerde een significant grotere toename in HDL cholesterol in de bariatrische chirurgie groep dan in de leefstijlgroep (gemiddeld verschil 0,55 mmol/L; 95% BI 0,4 tot 0,7). Manco (2017) rapporteerde geen significant verschil tussen de groepen na één jaar (gemiddelde 40 ±10 mg/dL versus 40 ±14 mg/dL, p=0,47), maar toetste niet het verschil tussen de groepen in veranderingen over tijd.
Dezelfde drie studies vergeleken bariatrische chirurgie met leefstijlinterventie op triglyceriden (O'Brien, 2010; Manco, 2017; Olbers, 2017). O'Brien (2010) rapporteerde geen significant verschil in verandering in triglyceriden tussen de groepen (gemiddeld verschil: -20 mg/dL, 95% BI: -59 tot 18). Olbers (2017) rapporteerde een significant grotere afname in triglyceriden in de bariatrische chirurgie groep dan in de leefstijlgroep (gemiddeld verschil -0,47 mmol/L; 95% BI -0,7 tot -0,2). Manco (2017) rapporteerde geen significant verschil tussen de groepen na één jaar (gemiddelde 95 ±31 mg/dL versus 105 ±51 mg/dL, p=0,16), maar toetste niet het verschil tussen de groepen in veranderingen over tijd.
Kwaliteit van leven
Twee studies vergeleken bariatrische chirurgie met leefstijlinterventie op kwaliteit van leven (O'Brien, 2010; Manco, 2017). In de RCT van O'Brien (2010) werd kwaliteit van leven gemeten met de Child Health Questionnaire (CHQ CF-50). Significante verschillen tussen de groepen werden gevonden voor twee van de acht subschalen: fysiek functioneren (gemiddelde na 2 jaar 94,4 ±6,6 versus 78,1 ±24,0, p=0,002) en verandering in gezondheid (gemiddelde na 2 jaar 4,4 ±0,8 versus 3,6 ±1,2, p=0,006). In de niet-gerandomiseerde trial van Manco (2017) werd niet beschreven welk instrument werd gebruikt om kwaliteit van leven te meten. De kwaliteit van leven verbeterde in de bariatrische chirurgiegroep (baseline: 74,1 ±12,7, 2 jaar 86,2 ±11,7, p=0,05), maar niet in de leefstijlgroep (geen data beschikbaar).
Bewijskracht van de literatuur
De bewijskracht is grotendeels gebaseerd op observationele studies en start laag en is verlaagd naar zeer laag vanwege risico op bias (selectiebias verschillen tussen interventie- en controlegroep, in de enige RCT: gebrek aan blindering, hoge uitval in de controlegroep, geen intention to treat analyses behalve voor afname van overgewicht) en wegens imprecisie (kleine studies).
Derhalve komt voor alle uitkomstmaten de bewijskracht uit op zeer Laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat zijn de gunstige en ongunstige effecten van het uitvoeren van een bariatrische ingreep bij een adolescent met obesitas, vergeleken met een niet-operatieve behandeling?
P: adolescent met obesitas;
I: bariatrische chirurgie;
C: gecombineerde leefstijl interventie;
O: gewicht, kwaliteit van leven, gezondheid (co-morbiditeit, risicofactoren van co-morbiditeit)
Relevante uitkomstmaten
De werkgroep achtte gewicht een voor de besluitvorming cruciale uitkomstmaten; en gezondheid en kwaliteit van leven voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep volgt voor de definitie van een succesvolle interventie m.b.t. de uitkomstmaat gewicht de criteria zoals die eerder zijn geformuleerd in de ‘Zorgstandaard Obesitas’:
- Er zijn geen evidence-based criteria voor succes bij kinderen in de groei. Vandaar dat bij kinderen naar gewichtsstabilisatie gestreefd wordt na één jaar behandeling en handhaving hiervan in de fase van onderhoud, tenzij dat tijdens de groeispurt van het kind onhaalbaar is.
- Voor uitgegroeide kinderen met een matig verhoogd GGR wordt gestreefd naar een gewichtsverlies van ≥ 5% na één jaar behandeling en handhaving hiervan in de fase van onderhoud.
- Voor uitgegroeide kinderen met een sterk of extreem verhoogd GGR wordt gestreefd naar een gewichtsverlies van ≥ 10% na één jaar behandeling en handhaving hiervan in de fase van onderhoud.
De uitkomstmaat gezondheid werd gedefinieerd als het afnemen van co-morbiditeit of risicofactoren van co-morbiditeit, zoals reductie van prevalentie van diabetes mellitus type 2, metabool syndroom, hypertensie, hypercholesterolemie, non-alcholic fatty liver disease, insuline resistentie, impaired glucose tolerance, impaired fasting glucose. Voor de uitkomstmaat kwaliteit van leven bepaalde de werkgroep niet a priori de definitie, maar werden de in de studie gebruikte definities gehanteerd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley)) is vanaf 1998 tot december 2018 gezocht met relevante zoektermen. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 596 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: (1) kinderen/adolescenten jonger dan 19 jaar met obesitas; (2) betreft vergelijking van bariatrische chirurgie met leefstijl interventie; (3) relevante uitkomstmaten zijn gewichtsverandering, gezondheid (co-morbiditeiten of risicofactoren van co-morbiditeit) en kwaliteit van leven; (4) systematische reviews met meta-analyse of originele gerandomiseerde trials, niet-gerandomiseerde trials of observationele studies met controlegroep. Narratieve reviews en systematische reviews zonder meta-analyse werden geëxcludeerd, maar wel werden de literatuurlijsten gescreend op mogelijk relevante studies Op basis van titel en abstract werden in eerste instantie 47 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 43 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 4 studies geselecteerd. Eén additionele studie werd geselecteerd op basis van screening van de systematische reviews. In totaal werden dus 5 studies definitief geselecteerd.
Resultaten
Vier onderzoeken beschreven in vijf publicaties zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Adams, T. In Teens with Severe Obesity, Can Bariatric Surgery Wait until Adulthood? NEJM. 2019; 380: 2175-2177
- Hunsaker SL, Garland BH, Rofey D, Reiter-Purtill J, Mitchell J, Courcoulas A, Jenkins TM, Zeller MH. A multisite 2-year follow up of psychopathology prevalence, predictors, and correlates among adolescents who did or did not undergo weight loss surgery. J Adolesc Health. 2018;63(2):142-50. Doi: 10.1016/j.jadohealth.2017.12.021.
- Manco M, Mosca A, De Peppo F, Caccamo R, Cutrera R, Giordano U, De Stefanis C, Alisi A, Baumann U, Silecchia G, Nobili V. The benefit of sleeve gastrectomy in obese adolescents on nonalcoholic steatohepatitis and hepatic fibrosis. J Pediatr. 2017;180:31-7.e2. Doi: 10.1016/j.jpeds.2016.08.101.
- O'Brien PE, Sawyer SM, Laurie C, Brown WA, Skinner S, Veit F, Paul E, Burton PR, McGrice M, Anderson M, Dixon JB. Laparoscopic adjustable gastric banding in severely obese adolescents: A randomized trial. Jama. 2010;303(6):519-26. Doi: 10.1001/jama.2010.81.
- Olbers T, Beamish AJ, Gronowitz E, Flodmark CE, Dahlgren J, Bruze G, Ekbom K, Friberg P, Gothberg G, Jarvholm K, Karlsson J, Marild S, Neovius M, Peltonen M, Marcus C. Laparoscopic roux-en-y gastric bypass in adolescents with severe obesity (amos): A prospective, 5-year, swedish nationwide study. Lancet Diabetes Endocrinol. 2017;5(3):174-83. Doi: 10.1016/s2213-8587(16)30424-7.
- Olbers T, Gronowitz E, Werling M, Marlid S, Flodmark CE, Peltonen M, Gothberg G, Karlsson J, Ekbom K, Sjostrom LV, Dahlgren J, Lonroth H, Friberg P, Marcus C. Two-year outcome of laparoscopic roux-en-y gastric bypass in adolescents with severe obesity: Results from a swedish nationwide study (amos). Int J Obes (Lond). 2012;36(11):1388-95. Doi: 10.1038/ijo.2012.160.
Evidence tabellen
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Comparison of Bariatric surgery with lifestyle intervention in children and adolescents with obesity.
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
O’Brien, 2010 |
randomization was performed using a computer-derived random allocation sequence to allow orderly admission into both programs. There was no stratification or blocking, |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Likely |
Likely (ITT analyses was applied for the primary outcome, weight loss but not for the other outcomes). |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
Research question: Comparison of bariatric surgery with lifestyle intervention in children and adolescents with obesity
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Olbers, 2012 and 2017 |
Likely (Exposed and non-exposed selected from different samples and differences in baseline characteristics) |
Unlikely |
Unlikely |
Likely (no adjustment was made for prognostic factors) |
|
Manco, 2017 |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Hunsaker, 2018 |
Unclear (Baseline characteristics were not presented) |
Unlikely |
Unlikely |
Unclear |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
O’Brien, 2010 |
Type of study: RCT
Setting and country: Hospital, Australia
Funding and conflicts of interest: Funded by grant NHMRC-GA05-384215 from the National Health and Medical Research Council. The laparoscopic adjustable gastric bands were provided by the manufacturer, Allergan. The Centre for Obesity Research and Education receives an unrestricted research support grant from Allergan. |
Inclusion criteria: -aged between 14 and 18 years; -BMI>35; -identifiable medical complications such as hypertension, metabolic syndrome, asthma, back pain; -physical limitations such as an inability to play a sport, difficulties with activities of daily living; -psychosocial difficulties such as isolation or low self-esteem, subject to bullying that stems from obesity and evidence of attempts to lose weight by lifestyle means for more than 3 years.
Exclusion criteria: -intellectual disability -Prader Willi syndrome.
N total at baseline: Intervention: 25 Control: 25
Important prognostic factors2: For example age ± SD: I: 16.5 ±1.4 C: 16.6 ±1.2
Sex: I: 36% M C: 28% M
Groups comparable at baseline? No, significant difference in systolic blood pressure and β-Cell function. |
Participants in the gastric banding group had the procedure performed within a month of randomization. The LAP-BAND Adjustable Gastric Banding system (Allergan, Irvine, California) was used in all cases. Detailed instructions on the requirements for correct eating and exercise after gastric banding were provided by discussion as well as in written form before the procedure. Eating rules centered on having 3 or fewer small (approximately 125 mL), protein-containing meals per day, eaten slowly (1 min/bite) and chewed well. Each participant was encouraged to undertake at least 30 minutes of formal exercise per day and to maintain a high level of activity through the day. Clinical reviews were conducted approximately every 6 weeks for 2 years by experienced medical staff. Adjustments to the volume of fluid in the band were conducted in the office, without use of x-ray imaging, based on weight loss, sense of satiety, and eating pattern and symptoms.
|
This program centered on reduced energy intake (individualized diet plans ranging between 800 and 2000 kcal/d, depending on age and weight status), increased activity (target of _10 000 steps per day on pedometer) with a structured exercise schedule of at least 30 minutes a day and behavioural modification. Compliance was monitored intermittently with food diaries and step counts. Consultation occurred approximately every 6 weeks throughout the 24-month study period by an adolescent physician and a dietitian or exercise consultant, the study nurse coordinator, and a sports medicine physician. The participant’s family was included in activities and education where appropriate. Exercise and activity recommendations included decrease of sedentary activities with a limit of 2-hour computer or television screen time, increase of formal exercise including bicycle riding, walking, and swimming plus informal individual and group activities. Group outings to fun parks, bike rides, hiking trips, walking, jogging, kickboxing, indoor bowling, and outdoor reunions were scheduled. A personal trainer was provided to each participant for a 6-week period. Parents were invited to participate in a specific educational program that included sports motivational talks, nutritional education, and discussions of the psychological aspects of adolescence. |
Length of follow-up: 24 months
Loss-to-follow-up: Intervention: N (%): 1 (4) Reasons (describe): -refused to turn up for follow-up
Control: N (%): 7 (28) Reasons (describe) -Family problems (1) -unhappy with progress (4) -refused to return for follow-up (1) -had difficulty attending follow-up (1) |
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome: Weight loss Absolute weight loss in kg at 24 months relative to baseline: I: 34.6 kg (95%CI: 30.2-39.0) C: 3.0 kg (95% CI, 2.1-8.1) P<0.001
Relative weight loss in percentage at 24 months relative to baseline: I: 28.3% (95% CI, 24.9%-31.7%) C: 3.1% (95% CI, 0.7%-6.8%) P<0.001
Outcome: blood pressure 24-month change in Systolic blood pressure (mmHg) I: -12.5 ±17.6 C: -20.3 ±21.7 Between-group difference, mean: 7.8, 95%CI: -4.5 to 20.1
24-month change in diastolic blood pressure (mmHg) I: -6.0 ±9.4 C: -20.3 ±12.5 Between-group difference, mean: 0.9, 95%CI: -5.9 to 7.7
Outcome: glucose 24-month change (mg/dL) I: -6.8 ±20 C: 2.8 ±9 Between-group difference, mean: -9.6, 95%CI: -18.6 to 2.3
Outcome: insulin 24-month change (µU/mL) I: -15.2 ±10.1 C: -11.2 ±11.0 Between-group difference, mean: -4.0, 95%CI: -10.8 to 2.8
Outcome: triglycerides 24-month change (mg/dL) I: -52 ±38 C: -32 ±83 Between-group difference, mean: -20, 95%CI: -59 to -18
Outcome: HDL cholesterol 24-month change (mg/dL) I: 9.3 ±14.7 C: 3.9 ±6 Between-group difference, mean: 5.4, 95%CI: 3.5 to 14
Outcome: Metabolic syndrome 24-month changes in number of participants with syndrome: I: 0 C: 4 Between-group difference, p=0.03
Outcome: quality of life Child Health Questionnaire (CHQ CF-50). Significant differences found for 2 of the 8 subscales at 2 years:
I: 94,4 ±6,6 C: 78,1 ±24,0 p=0.002
I: 4,4 ±0,8 C: 3,6 ±1,2 p=0,006 |
|
|
Olbers, 2012 and Olbers 2017 |
Type of study: Matched observational cohort study
Setting and country: Hospital, Sweden
Funding and conflicts of interest: The primary funding source was from Vastra-Gotalands-regionen and Stockholm County Councils, Swedish Board of Health and Wellfare |
Inclusion criteria: - Age 13–18 years. - BMIX40 or X35 kgm2 with comorbidity (type 2 diabetes, sleep apnea, joint pain and high blood lipids). - Pubertal Tanner stage 4III and passed peak height growth velocity. -participated for at least 1 year in a comprehensive weight loss program.
Exclusion criteria: -Insufficiently treated psychiatric disorder. - Ongoing drug abuse. - Obesity due to syndromes or monogenic disease as clinically assessed or brain injury.
N total at baseline: Intervention: 81 Control: 81
Important prognostic factors2: For example age ± SD: I: 16.5 ±1.2 C: 15.8 ±1.2
Sex: I: 34.6% M C: 43.2% M
Groups comparable at baseline? Not tested |
Surgical patients were instructed to remain on a low-calorie diet (commercially available LCD 800–1200 Kcal daily) for the 3 weeks before surgery. The laparoscopic Roux-en-Y gastric bypass consisted of a small (o20 ml) gastric pouch and an ante-colic, ante-gastric Roux-en-Y construction with a 80 cm long Roux limb and without closure of mesenteric windows as described in detail elsewhere.16 The gastrojejunostomy was constructed by linear stapling and complementary hand suturing. All subjects were operated at Sahlgrenska University Hospital, Gothenburg, by either of two experienced bariatric surgeons assisted by a pediatric surgeon.
|
We identified a matched adolescent group from the Swedish Childhood Obesity Treatment Register (BORIS)6 This treatment mainly consists of individualized or family-based counseling and cognitive behavior therapy concerning diet and physical activity.6 Low-calorie diets and drugs (metformin, orlistat or sibutramin) were prescribed if found clinically indicated by the treating pediatrician. This treatment continued in the conventional treatment group. Thus, these adolescents were not treated according to a prospective protocol. |
Length of follow-up: 2012: 24 months 2017: 5 years
Loss-to-follow-up: Intervention: 2012: N (%): 0 2015: N (%): 0 Reasons (describe)
Control: 2012: N (%): 22 (27%) 2017: N (%): 9 (11.1%) Reasons (describe): -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome: Weight loss Relative weight loss in percentage at 2 years relative to baseline: I: -32% (CI -35 to -30%), C: +3% (CI 0 to 7%)
Outcome: HbA1c Mean change at 5 years (mmol/mol): I: -1.6 (CI: -2.5 to -0.6) C: ? Mean difference: -1.8 (CI: -5.4 to 1.8)
Outcome: glucose Mean change at 5 years (mg/dL): I: -0.33 (CI: -0.5 to -0.22) C: ? Mean difference: -0.6 (CI: -1.8 to 0.6)
Outcome: insulin Mean change at 5 years (pmol/L): I: -151.42 (CI: -173.3 to -129.5) C: ? Mean difference: -117.81 (CI: −158.3 to –77.3)
Outcome: triglycerides Mean change at 5 years (mmol/L): I: -0.39 (CI: -0.5 to -0.3) C: ? Mean difference: -0.47 (CI: -0.7 to -0.2)
Outcome: LDL Mean change at 5 years (mmol/L): I: -0.46 (CI: -0.6 to -0.3) C: ? Mean difference: -0.88 (CI: -1.2 to -0.6)
Outcome: HDL Mean change at 5 years (mmol/L): I: 0.49 (CI: -0.4 to 0.6) C: ? Mean difference: 0.55 (CI: 0.4 to 0.7)
Outcome: blood pressure Mean change at 5 years (mmHg): *systolic: I: -11.6 (CI: -14.0 to -9.1) C: ? Mean difference: -8.18 (CI: -12.5 to -3.8)
*diastolic I: -7.4 (CI: -10.2 to -4.6) C: ? Mean difference: -8.28 (CI: -12.2 to -4.4)
Outcome: diabetes Prevalence at 5 years I: 0/79 C: 1/44 P=0.37
Outcome: dyslipedemia Prevalence at 5 years I: 11/76 C: 30/41 P<0.001
Outcome: elevated blood pressure Prevalence at 5 years: I: 2/72 C: 4/39 P=0.18 |
|
|
Manco, 2017 |
Type of study: Non-randomised controlled trial
Setting and country: Hospital, Italy
Funding and conflicts of interest: No conflicts of interest; funding not reported. |
Inclusion criteria: -age 13-17 years; -BMI ≥35 kg/m2; -biopsy-proven NAFLD; -failure to achieve 10% weight loss using lifestyle intervention alone during the prior 6 months; -willingness and motivation to adhere to treatment recommendations; -clear understanding of risks and benefits deriving from medical treatment and surgery, including lifestyle commitment in case of LSG; -dedicated family relatives willing to serve as caregivers.
Exclusion criteria: -genetic obesity; -any endocrine or systemic disease, except metabolic abnormalities related to obesity; severe gastroesophageal reflux disease and/ or esophagitis; -large sliding hiatal hernia (>5 cm)or paraesophageal hernia type III; -psychiatric disorder; previous gastrointestinal surgery; -use of recreational drugs and/or alcohol abuse (>140 g/wk).
N total at baseline: Intervention: 20 Control: 53
Important prognostic factors2: For example age ± SD: I: 16.7 ±1.4 C: 14.7 ±1.9
Sex: I: 35% M C: 53% M
Groups comparable at baseline? No, I group had higher weight, and insulin levels |
Patients underwent nutritional counseling with registered dieticians at T0, T1, and throughout the follow-up period. Total calories, micronutrient and macronutrient intake, and alcohol consumption were estimated by 7-day dietary diary recall for all patients. A balanced diet (40 kcal/kg/d, carbohydrates 55%, proteins 15%, and lipids 30%) and aerobic physical activity (30 min/d) were prescribed. Laparoscopic Sleeve Gastrectomy (LSG) was performed with a 5-trocar approach under general anesthesia with endotracheal intubation. To greatly reduce surgical risk, an optical trocar was used for the first access, avoiding a blind access with a Veress needle. Complete dissection of the greater curvature, 6 cm from the pylorus up to the gastroesophageal junction, was obtained using a radiofrequency device (Ligasure; Medtronic, Minneapolis, Minnesota). The gastric sleeve was calibrated with a 40F bougie using 60 mm sequential firing (TristapleEndoGia;Medtronic). An intraoperative blue methylene test was performed to evaluate suture line integrity and gastric pouch volume. A semiliquid diet was prescribed for the first month after surgery, then a solid diet was reintroduced at the end of month 1 after performing a barium meal to evaluate both the gastric outlet and residual gastric volume.
|
Patients underwent nutritional counseling with registered dieticians at T0, T1, and throughout the follow-up period. Total calories, micronutrient and macronutrient intake, and alcohol consumption were estimated by 7-day dietary diary recall for all patients. A balanced diet (40 kcal/kg/d, carbohydrates 55%, proteins 15%, and lipids 30%) and aerobic physical activity (30 min/d) were prescribed.
|
Length of follow-up: 1 year
Loss-to-follow-up: Intervention: N (%): - Reasons (describe)
Control: N (%): 31 (58.5%) Reasons (describe): -not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome: Weight loss Relative weight loss in percentage at 1 yr relative to baseline: I: -21.5% C: +1.7%
Outcome: Blood pressure *systolic (mmHg) at 1 yr: I: 116 ±8.0 C: 114 ±6.4 P=0.44
*diastolic (mmHg) at 1 yr: I: 71 ±9.0 C: 64 ±1.4 P=0.56
Outcome: Cholesterol *total cholesterol (mg/dL) I: 145 ±20 C:141 ±26 P=0.12
*LDL cholesterol (mg/dL) I: 92 ±21 C: 94 ±30 P=0.35
*HDL cholesterol (mg/dL) I: 40 ±10 C: 40 ±14 P=0.47
Outcome: triglycerides (mg/dL) I: 95 ±31 C:105 ±51 P=0.16
Outcome: HbA1c (mmol/mol) I: 34.2 ±2.9 C:32.5 ±0.8 P=0.84
Outcome: glucose (mg/dL) I: 78 ±8 C:84 ±11 P=0.78
Outcome: insulin (mU/L) I: 16 ±7 C:24 ±8 P=0.05
|
Group allocation was based on a set of criteria and participant’s preferences: -Participants with BMI>40 were offered LSG as the first option and intragastric balloon with lifestyle intervention as the second option. -Participants with BMI=35-40 or BMI<35 and metabolic comorbidities were offered intragastric balloon and lifestyle intervention as the first option. -Those who refused LSG or intragastric balloon, were offered lifestyle intervention.
Note that the Intragastric balloon group was not considered in the current analysis. |
|
Hunsaker, 2018 |
Type of study: Cohort study with matched group comparison
Setting and country: Academic medical centers, USA
Funding and conflicts of interest: Funded by cooperative agreements with the National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK). The study was also supported by grants UL1 TR000077-04 (Cincinnati Children’s Hospital Medical Center), UL1RR025755 (Nationwide Children’s Hospital), M01-RR00188 (Texas Children’s Hospital/Baylor College of Medicine), UL1 RR024153 and UL1TR000005 (University of Pittsburgh), UL1 TR000165 (University of Alabama at Birmingham). Teen-View was supported by grant R01DK080020 (PI: Zeller). Dr. Hunsaker’s effort was supported by an NIH postdoctoral training grant (T32 DK063929). One co-author received research grants from Allergan, Pfizer, Covidien, EndoGastric Solutions, and Nutrisystem. She has served on the Scientific Advisory Board of Ethicon J & J Healthcare System. |
Inclusion criteria: -BMI>=40 -13-18 yrs -no developmental delay -caregiver willing to participate -English proficiency
Exclusion criteria: -
N total at baseline: Intervention: 139 Control: 83
Important prognostic factors2: Age at 2-years ±SD: I: 19.1 ±1.3 C:18.3 ±1.4
Sex: I: 20.5% M C: 18.7% M
Groups comparable at baseline? Not reported, but there were significant differences at 2 years in age and living situation. |
Participants in the cohort of the Teen Longitudinal Assessment of Bariatric Surgery Consortium who underwent RYGB, VSG, or LAGB.
|
TeenView comparator adolescents were drawn from a registry of study eligible youth from nonsurgical lifestyle intervention programs who were willing to participate if they were demographically similar (i.e., gender, race, <}6 months in age) to WLS subjects. |
Length of follow-up: 2 years
Loss-to-follow-up: Intervention: N (%): 12 (8.6%) Reasons (describe) -declined follow-up (6) -unable to locate (6)
Control: N (%): 8 (9.6%) Reasons (describe) -declined follow-up (3) -unable to locate (5)
Incomplete outcome data: Intervention: N (%): 8 (5.7%) Reasons (describe) Not reported
Control: N (%): 5 (6.0%) Reasons (describe) Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome: weight loss Mean relative weight loss at 2 years as percentage of weight at baseline: I: -30% ±11.2 C: +7% ±10.8 P<0.001
Outcome: psychopathology Mean standardized total score of the Youth Self-Report (YSR): I: 49.5 ±10.3 C: 53.7 ±8.6 P=0.13 |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Acosta, 2008 |
Narrative review |
|
Aikenhead, 2011 |
Voldoet niet aan selectiecriteria |
|
Ashem, 2013 |
Verkeerde patiëntpopulatie, Praeder-Willi syndroom |
|
Beamish, 2015 |
Narrative review |
|
Black, 2013 |
Voldoet niet aan selectiecriteria |
|
Bondada, 2011 |
Narrative review |
|
Cairo, 2018 |
Narrative review |
|
Canoy, 2015 |
Review van 2 reviews |
|
Childerhose, 2017 |
Narrative review van position statements en richtlijnen |
|
Christison, 2017 |
Narrative review |
|
Coutant, 2017 |
Narrative review |
|
Dixon, 2009 |
Narrative review |
|
Ells, 2015 |
Review van 1 randomized controlled trial |
|
Fitzgerald, 2014 |
Voldoet niet aan selectiecriteria |
|
Gogakos, 2009 |
Narrative review |
|
Grandone, 2018 |
Narrative review |
|
Heamshaw, 2010 |
Voldoet niet aan selectiecriteria |
|
Herget, 2014 |
Voldoet niet aan selectiecriteria |
|
Hunsaker, 2018 |
Voldoet niet aan selectiecriteria |
|
Inge, 2007 |
Voldoet niet aan selectiecriteria |
|
Inge, 2009 |
Voldoet niet aan selectiecriteria |
|
Karasko, 2019 |
Voldoet niet aan selectiecriteria |
|
Karlsen, 2013 |
Verkeerde patiëntpopulatie, patiënten >20 jaar oud |
|
Kassir, 2018 |
Commentaar op Cairo, 2018 |
|
Lu, 2015 |
Voldoet niet aan selectiecriteria |
|
Manco, 2017 |
Voldoet niet aan selectiecriteria |
|
Matsuo, 2013 |
Voldoet niet aan selectiecriteria |
|
O’, 2010 |
Dubbel met O’Brien, 2010 |
|
O'Brien, 2010 |
Voldoet niet aan selectiecriteria |
|
Olbers, 2017 |
Voldoet niet aan selectiecriteria |
|
Pedroso, 2018 |
Voldoet niet aan selectiecriteria |
|
Paulus, 2015 |
Voldoet niet aan selectiecriteria |
|
Pratt, 2009 |
Voldoet niet aan selectiecriteria |
|
Qi, 2017 |
Voldoet niet aan selectiecriteria |
|
Rajjo, 2017 |
Voldoet niet aan selectiecriteria |
|
Reece, 2017 |
Geen controlegroep |
|
Riquin, 2018 |
Semi-structured interviews, geen originele patiëntdata |
|
Ruiz-Cota, 2018 |
Voldoet niet aan selectiecriteria |
|
Shoar, 2017 |
Voldoet niet aan selectiecriteria |
|
Thakkar, 2015 |
Narrative review |
|
Treadwell, 2008 |
Voldoet niet aan selectiecriteria |
|
Wang, 2016 |
Voldoet niet aan selectiecriteria |
|
Wang, 2017 |
Verkeerde patiëntpopulatie, overlevers van hersentumoren |
|
White, 2015 |
Voldoet niet aan selectiecriteria |
|
Willcox, 2014 |
Voldoet niet aan selectiecriteria |
|
Wulkan, 2005 |
Voldoet niet aan selectiecriteria |
|
Zitsman, 2014 |
Symposium summary |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 13-11-2020
Beoordeeld op geldigheid : 09-11-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Kindergeneeskunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
bariatrische chirurgie |
NVK |
2020 |
2022 |
2-jaarlijks |
NVK |
|
Algemene gegevens
De richtlijn is goedgekeurd door de Patiëntenfederatie Nederland.
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van het project is het ontwikkelen van de evidence-based richtlijn Behandeling van kinderen met obesitas; en daarmee een richtlijn volgens Medische Specialistische Richtlijnen 2.0 opleveren, waarin de huidige stand van wetenschappelijke kennis aangaande het onderwerp is meegenomen.
Doelgroep
Deze richtlijn is primair bedoeld voor kinderartsen, maar daarnaast is de richtlijn relevant voor huisartsen, verpleegkundigen/verpleegkundig specialisten kindergeneeskunde, diëtisten, psychologen, (kinder)fysiotherapeuten, jeugdartsen, jeugdverpleegkundigen, chirurgen en internisten.
Tevens is het waardevol voor leden van andere beroepsgroepen die betrokken zijn bij de zorg voor patiënten met obesitas van 0 tot 18 jaar om kennis te nemen van de richtlijn. Te denken valt aan beroepsgroepen zoals opvoedkundig adviseurs, maatschappelijk werkers, jeugdhulpverleners, combinatiefunctionarissen, buurtsportcoaches, onderwijsprofessionals en aanbieders van interventies en van reguliere voorzieningen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor kinderen met obesitas.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. E.L.T. (Erica) van den Akker, kinderarts endocrinoloog, universitair hoofddocent, Erasmus MC- Sophia Kinderziekenhuis en Centrum Gezond Gewicht, Rotterdam, Nederlandse Vereniging voor Kindergeneeskunde (voorzitter)
- Prof. dr. E. (Edgar) van Mil, kinderarts-endocrinoloog, Jeroen Bosch Ziekenhuis, ‘s-Hertogenbosch, expertise centrum voor kinderen met obesitas, Nederlandse Vereniging voor Kindergeneeskunde (vice-voorzitter)
- Dr. C.J. (Corjan) de Groot, AIOS kindergeneeskunde, Leids Universitair Medisch Centrum/ Groene Hart Ziekenhuis, Leiden/ Gouda, Nederlandse Vereniging voor Kindergeneeskunde
- Dr A. (Anita) Vreugdenhil, kinderarts, Maastricht Universitair Medisch Centrum, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. S. (Saskia) Bouma -De Jongh, kinderarts, De Kinderartsenpraktijk, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. M. (Marja) van der Vorst, kinderarts-klinisch farmacoloog, St Antonius, Utrecht/ Nieuwegein, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.J. (Arieke) Janse, kinderarts, Ziekenhuis Gelderse Vallei, Ede, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. M. (Malika) Chegary, kinderarts, Onze Lieve Vrouwe Gasthuis, Amsterdam, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. F.M.H. (François) van Dielen, chirurg, Maxima MC, Eindhoven, Nederlandse Vereniging voor Heelkunde
- Prof. dr. L.W.E. (Ernst) van Heurn, (kinder)chirurg, Amsterdam UMC, Amsterdam, Nederlandse Vereniging voor Heelkunde
- Dr. L.J.M. (Loek) de Heide, internist-endocrinoloog, Medisch Centrum Leeuwarden, Leeuwarden, De Nederlandse Internisten Vereniging
- Drs. J.W.J. (Willy) Jubels-Hatenboer, Nederlandse Stichting Over Gewicht, Haarlem
- Drs. R. (Ramona) Leysner, diëtist, Behandelcentrum Merem, Hilversum, Nederlandse Vereniging van Diëtisten
- Dr. E. (Eveliene) Dera-de Bie, docent Verpleegkunde, Zuyd Hogeschool, Heerlen, Beroepsvereniging Verpleegkundigen & Verzorgenden Nederland
- Drs. S. (Sanne) Laurijssen, GZ-psycholoog, Elisabeth-TweeSteden Ziekenhuis, Tilburg, het Nederlands Instituut van Psychologen
- Drs. M.G.M. (Margreet) van den Berg, GZ-psycholoog, Jeroen Bosch ziekenhuis, Den Bosch, het Nederlands Instituut van Psychologen
- Dr. I. (Irene) Peters, Arts M&G, Jeugdarts GGDrU, Utrecht, AJN Jeugdartsen Nederland
- Drs. M. (Marloes) Meurs, kinderfysiotherapeut, Bewegingscentrum Junior, Groningen, Koninklijk Nederlands Genootschap voor Fysiotherapie en Nederlandse Vereniging voor Kinderfysiotherapie
Klankbordgroep
- Dr. J. (Jutka) Halberstadt, universitair docent kinderobesitas, landelijk projectmanager Care for Obesity, Vrije Universiteit Amsterdam
- Drs. R. (René) Glijsteen, huisarts, Huisartsenpraktijk Kloppenborg&Glijsteen, Rotterdam, Nederlandse Huisartsen Genootschap
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. (Stefanie) Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van den Akker (voorzitter) |
Kinderarts Erasmus MC |
Geen |
Clinical trial fase III setmelatonide (Rhythm) voor patiënten met monogenetische obesitas Europees verband, gefinancierd door Rhythm Pharmaceuticals, Inc. |
Geen |
|
Van Mil (vice-voorzitter) |
Kinderarts-endocrinoloog Jeroen Bosch ziekenhuis Bijzonder hoogleraar Jeugd, Voeding en Gezondheid aan de Universiteit Maastricht |
Behandeld arts en initiatiefnemer Expertise Centrum Kinderen met Obesitas in het Jeroen Bosch ziekenhuis, dat tevens fungeert als 'best practise' voor het VWS proeftuinen project 'ketenaanpak voor kinderen met overgewicht'. Vakgroep Kindergeneeskunde wordt vergoed voor de uren die dit project worden gemaakt |
Mede auteur van het boek 'Overgewicht en Obesitas bij Kinderen. Verder kijken dan de kilo's (ISBN 9789089534262), dat de basis vormt van het landelijk model voor ketenaanpak voor kinderen met overgewicht.
Betrokken bij de BASIC trial, gefinancieerd door MUMC.
Deelnemer aan de onderzoeksgroep van een wetenschappelijk studie naar het effect van bariatrische chirurgie bij adolescenten met overgewicht. De studie is genaamd: Laparoscopie Roux-en-Y Gastric Bypass Equipoise Laparoscopie Sleeve Gastrectomy for Severe Obesity in Teenagers: a Randomized Controlled Trial.
Deelnemer aan de onderzoeksgroep van een wetenschappelijk studie naar het effect van metformine bij adolescenten met overgewicht. De studie is genaamd: An efficacy, safety and pharmacokinetic study on the short-term and long-term use of METFORMIN in obese children and adolescents.
|
Geen |
|
De Groot |
AIOS kindergeneeskunde LUMC/Groene Hart Ziekenhuis |
Binnen het GHZ betrokken bij onderwijscommissie van de afdeling kindergeneeskunde |
Promotieonderzoek werd deels gefinancieerd door Nutricia Early Life Nutrition. Dit betrof een 'unrestricted grant'. Dat wil zeggen dat Nutricia Early Life Nutrition geen invloed had op het onderzoek dat ik verrichte, of zeggenschap had over het al dan niet publiceren van de resultaten. Mijn onderzoek richtte zich op neuroradiologische aspecten van obesitas. Er was derhalve ook geen direct financieel belang voor Nutricia bij de resultaten van mijn onderzoek. Er is geen nog lopend onderzoek van mij wat gefinancierd wordt door Nutricia. Er is momenteel geen enkele financiële afhankelijkheid van hen. |
Geen |
|
Vreugdenhil |
Kinderarts MDL, vakgroep Kindergeneeskunde, Maastricht UMC+ , Oprichter Centre for Overweight Adolescent and Childrens Healthcare van het Maastricht UMC+ |
Geen |
Mede onderzoeker in de BASIC trial en de TEENBEST studie |
Geen |
|
Bouma-de Jongh |
Kinderarts Van Weel Bethesda ziekenhuis |
Richtlijn bacterie NVVIT |
Geen |
Geen |
|
Van der Vorst |
Kinderarts-klinisch farmacoloog St. Antonius ziekenhuis Utrecht/Nieuwegein |
Geen |
Hoofdonderzoeker: M.M.J. van der Vorst. studienummer: NL34811.100.11. 'Metformin' wetenschappelijke studie naar het effect van metformine bij adolescenten met overgewicht. De studie is genaamd: An efficacy, safety and pharmacokinetic study on the short-term and long-term use of METFORMIN in obese children and adolescents. |
Geen |
|
Janse |
Kinderarts en klinische epidemioloog B. Werkgever: Ziekenhuis Gelderse Vallei |
Geen |
Hoofdonderzoeker A.J.Janse studienummer NL50601.029.14. Randomized Controlled Trial Solid food in preterm infants and the effect on obesity in the Netherlands (SPOON). Gefinancieerd middels samenwerkingsbijdrage Nutricia. Geen belang bij uitkomst onderzoek |
Geen |
|
Chegary |
Kinderarts OLVG Amsterdam |
Geen |
Geen |
Geen |
|
Van Dielen |
Bariatrisch chirurg |
0.0 fte aanstelling in het Mumc+ als gastoperateur voor de BASIC trial. Betaald |
Gastroperateur van de BASIC trial en derhalve hierbij actief betrokken. - Principal investigator van een internationale multicenter prospectief gerandomiseerde studie gastric sleeve versus. gastric bypass in adolescenten. (TEEN-Best). |
Geen |
|
Van Heurn |
Kinderchirurg, hoogleraar kinderchirurgie AMC en VUMC |
Geen |
Hoofdonderzoeker BASIC trial: onderzoek naar bariatrische Chirurgie/ leefstijlinterventies bij adolescenten gefinancierd door MUMC. Geen belang bij de uitkomst van het onderzoek. |
Geen |
|
De Heide |
Internist-Endocrinoloog, Medisch Centrum Leeuwarden, in dienst van MSB-VCL, 50% |
1 dagdeel per week in dienst van CON, Centrum Obesitas Nederland, Leeuwarden, onbetaald, protocollering postoperatieve zorg na bariatrie, wetenschappelijk onderzoek |
Geen |
Geen |
|
Jubels-Hatenboer |
Part-time werkzaam bij marketing in de & communicatie bij Jubels B.V. |
Sinds sept 2014 actief lid van de Technische Commissie bij de Zandvoortsche Hockeyclub. En sinds 2018 bestuurslid bij de Nederlandse Stichting Over Gewicht. |
Dochter met genetische obesitas (leptinereceptor deficiëntie) maar zij zal niet gebaat zijn bij een bariatrisch chirurgische ingreep. |
Geen |
|
Leysner |
Dietist behandelcentrum Merem Hilversum |
Lid landelijk netwerk van diëtisten die gespecialiseerd zijn in de behandeling van overgewicht en (morbide) obesitas met bijbehorende co-morbiditeit (KDOO) (onbetaald) |
Geen |
Geen |
|
Dera-de Bie |
Docent Verpleegkunde (0,8) en lid lectoraat wijkgerichte zorg (0,2) Zuyd Hogeschool Heerlen |
Redactielid Tijdschrift JGZ Lid V&VN, maatschappij en gezondheid |
Geen |
Geen |
|
Laurijssen |
GZ-psycholoog en cognitief gedragstherapeut Elisabeth Tweesteden ziekenhuis Tilburg |
Gastdocent Tilburg University |
Geen |
Geen |
|
Van den Berg |
Gz-psycholoog, RVE Kindergeneeskunde, Jeroen Bosch Ziekenhuis GGZ-Oostbrabant afdeling eetstoornissen |
Geen |
Als Gz-psycholoog verbonden aan het zorgpad overgewicht binnen het Jeroen Bosch Ziekenhuis. Betrokken bij indicatiestelling voor behandeling. |
Geen |
|
Peters |
Arts Maatschappij en Gezondheid, jeugdarts bij GGDrU. |
Geen |
Geen |
Geen |
|
Meurs
|
Kinderfysiotherapeut, voorzitter Nederlandse Vereniging voor Kinderfysiotherapie, eigen kinderpraktijk, begeleidt en behandelt kinderen met obesitas in een eerstelijns GLI. |
Geen |
Geen |
Geen |
|
Halberstadt |
Universitair docent kinderobesitas/ Landelijk projectmanager Care for Obesity, Vrije Universiteit Amsterdam |
Geen |
Care for Obesity leverde in 2018 met financiering van het ministerie van VWS het landelijk model ketenaanpak voor kinderen met overgewicht en obesitas op. Vanaf 2019 vormt Care for Obesity /de Vrije Universiteit Amsterdam met vier andere landelijke partijen de coalitie voor de ketenaanpak voor kinderen met overgewicht en obesitas. Deze coalitie werkt met financiering van het ministerie van VWS aan de borging, implementatie, doorontwikkeling en evaluatie van het landelijk model. |
Geen |
|
Glijsteen |
Huisarts zelfstandig in maatschap 3-3,5 dag NAP Kloppenberg& Glijsteen en Huisarts docent staflid Huisartsopleiding UMC 1,5 dag |
Wedstijdsecretaris V.O.C. incident Rotterdam Onbetaald Lid raad van toezicht van PRIMEUR database (onbetaald) |
Geen |
Geen |
|
Mostovaya |
Senior adviseur |
Geen |
Geen |
Geen |
|
Hofstede |
Senior adviseur |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Nederlandse Stichting Over Gewicht.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn-(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse vereniging voor Heelkunde, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Obstetrie en Gynaecologie, Care for Obesity, Jeugdartsen Nederland, Verpleegkundigen & Verzorgenden Nederland, Koninklijk Nederlands Genootschap voor Fysiotherapie, Nederlandse Vereniging voor Kinderfysiotherapie, Kind & Ziekenhuis, Inspectie Gezondheidszorg en Jeugd, Partnerschap Overgewicht Nederland, Nederlandse Obesitas Kliniek, Zelfstandige Klinieken Nederland, Zorginstituut Nederland en RA-Medical via een Invitational conference. Dit was een gecombineerde Invitational conference voor twee richtlijnen; (1) behandeling van kinderen met obesitas en (2) chirurgische behandeling van obesitas. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk
te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties, waaronder de partijen die zijn uitgenodigd voor de invitational conference, voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., et al. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Link: http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., et al. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1998 – december 2018
|
1 exp *PEDIATRIC OBESITY/ (5177) 2 (obese or obesity or overweight* or weight*).ti,ab. (1102801) 3 (child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).ti. (1413484) 4 2 and 3 (117837) 5 1 or 4 (118667) 6 exp *Bariatric Surgery/ or (bariatric or obesity surgery or bypass or gastric or gastrectom* or sleeve or weight loss surger* or weight reduction surger*).ti. (202970) 7 5 and 6 (946) 8 limit 7 to (english language and yr="1998 -Current") (794) 9 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (378622) 10 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1814170) 11 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3093089) 12 8 and 9 (48) 13 8 and 10 (148) 14 13 not 12 (132) 15 8 and 11 (391) 16 15 not 12 not 14 (304) 17 12 or 14 or 16 (484)
= 484 |
596 |
|
Embase (Elsevier) |
('childhood obesity'/exp/mj OR ((obese:ti,ab OR obesity:ti,ab OR overweight*:ti,ab OR weight*:ti,ab) AND (infan*:ti OR newborn*:ti OR 'new born*':ti OR perinat*:ti OR neonat*:ti OR 'baby'/exp/mj OR baby*:ti OR babies:ti OR toddler*:ti OR 'minors'/exp/mj OR minors*:ti OR 'boy'/exp/mj OR boy:ti OR boys:ti OR boyfriend:ti OR boyhood:ti OR girl*:ti OR kid:ti OR kids:ti OR 'child'/exp OR child*:ti OR children*:ti OR schoolchild*:ti OR 'schoolchild'/exp/mj OR adolescen*:ti OR juvenil*:ti OR youth*:ti OR teen*:ti OR pubescen*:ti OR pediatric*:ti OR paediatric*:ti OR peadiatric*:ti OR school:ti OR school*:ti OR prematur*:ti OR preterm*:ti OR 'pediatrics'/exp/mj))) AND ('bariatric surgery'/exp/mj OR bariatric:ti OR 'obesity surgery':ti OR bypass:ti OR gastric:ti OR gastrectom*:ti OR sleeve:ti OR 'weight loss surger*':ti OR 'weight reduction surger*':ti) AND [1998-2018]/py AND [english]/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 45
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 196
Observationeel onderzoek: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 169
= 410 |
