Eigenschappen van een goede GLI
Uitgangsvraag
Welke eigenschappen dient een effectieve gecombineerde leefstijlinterventie (GLI) te bevatten bij kinderen met obesitas?
Aanbeveling
Richt een gecombineerde leefstijlinterventie (GLI) op het systeem (gezinsgericht) en niet alleen op het individuele kind.
Onderzoek de doelen en verwachtingen van het kind en de ouder(s) en sluit daarbij aan.
Streef naar een interventie waarbij in samenwerking met de patiënt de regie gedurende behandeling verschuift van de zorgverlener naar de patiënt en het systeem waarin de patiënt leeft.
Monitor de motivatie voor de behandeling bij zowel het kind als de ouder(s).
Geef een gecombineerde leefstijlinterventie die ten minste bestaat uit het bevorderen van gezond gedrag op drie gebieden:
- voeding;
- bewegen;
- slapen.
Bepaal de intensiteit van de GLI op basis van het gewicht gerelateerd gezondheidsrisico.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De werkgroep heeft als uitgangspunt genomen dat de basis van een effectieve gecombineerde leefstijlinterventie bestaat uit een component diëtaire interventie en een component gericht op het verhogen van de fysieke activiteit (CBO richtlijn). Dit toegevoegde effect is reeds uitgebreid beschreven in de literatuur (Luttikhuis, 2009). De uitgangsvraag was er op gericht om te onderzoeken of er:
- evidence was dat een specifiek type eet- of beweeginterventie significant beter was dan andere eet- of beweeginterventies als het gaat om gewichtsverandering, gezondheidswinst of kwaliteit van leven.
- evidence is voor additionele behandelcomponenten van een gecombineerde leefstijlinterventie die van toegevoegde waarde zijn als het gaat om gewichtsverandering, gezondheidswinst of kwaliteit van leven.
Bij het beoordelen van de literatuur is gekeken naar de leeftijdsgroepen 6 tot 13 jaar en 13 tot 17 jaar. Voor de 6 tot 13-jarigen was een meta-analyse beschikbaar (Mead, 2017), waaruit bleek dat er geen statistisch significant effect is op BMI z-score van het toevoegen van additionele componenten aan een gecombineerde leefstijlinterventie. Daarbij moet worden opgemerkt dat de gezamenlijk gepoolde data erg heterogeen waren qua type interventie. Uit de beperkte literatuur die er is over 13 tot 17-jarigen bleek dat er geen blijvend effect is van variatie in type dieet of beweeginterventie op de uitkomstmaat BMI z-score. Wel was er voor deze groep een kortdurend effect van maaltijdvervangers ten faveure van conventionele dieetadviezen bij een tussenanalyse 4 maanden na start van de interventie. Dit verschil was er echter bij 12 maanden niet meer. Voor zowel effecten op co-morbiditeit als op kwaliteit van leven waren in beide leeftijdsgroepen geen gegevens bekend als het gaat over individuele componenten van, of extra toegevoegde componenten aan een gecombineerde leefstijlinterventie.
De bewijskracht om binnen een gecombineerde leefstijlinterventie te kiezen voor een bepaalde diëtaire of beweeginterventie met als doel BMI z-score reductie is zeer laag. Dit komt door een aantal factoren. Allereerst is het aantal studies waarbij twee gecombineerde leefstijlinterventies die maar op één punt verschillen klein. Daarnaast is de heterogeniteit binnen de beschikbare studies groot en gaat het vaak om studies met een beperkt aantal geïncludeerde kinderen. Ook wordt in veel studies niet gerapporteerd of er gekeken is naar subgroepen qua gedrag omtrent eten (bijvoorbeeld of er gekeken is naar de aanwezigheid van binge-eating), terwijl dit wel relevant kan zijn voor de keuze van behandeling. Op al deze punten is er sprake van een kennislacune. Dit geldt ook voor co-morbiditeit en kwaliteit van leven, waarvoor geen literatuur bekend is.
Op basis van de nu beschikbare literatuur blijft het advies om kinderen met obesitas te behandelen met een gecombineerde leefstijlinterventie bestaande uit een interventie gericht op verandering van eetgedrag gecombineerd met een interventie gericht op het verhogen van de fysieke activiteit (Luttikhuis, 2009). Op basis van de nu beschikbare literatuur kunnen geen aanbevelingen gedaan worden omtrent het type dieet of beweeginterventie. Ook kunnen op basis van de nu beschikbare literatuur geen aanbevelingen gedaan worden omtrent additionele componenten van GLI. Literatuur buiten het obesitasveld biedt wel enkele aanknopingspunten voor eventuele toekomstige toevoegingen aan bestaande behandelprogramma’s. Zo wordt in de verslavingszorg in toenemende mate gebruik gemaakt van training van de executieve functies, met hoopgevende resultaten. Bij patiënten met alcoholproblematiek leidt het trainen van executieve functies middels serious gaming onder andere tot minder alcoholconsumptie (Black, 2015). Bij kinderen met overgewicht en obesitas is executieve dysfunctie een welbekend probleem (Nederkoorn, 2006). Binnen het obesitasveld is hierover nog beperkte literatuur bekend. Bij kinderen die opgenomen waren voor behandeling van obesitas, liet een pilot studie zien dat executieve functietraining kan leiden tot het behoud van gewichtsverlies (Verbeken, 2013). Momenteel worden grotere studies, met langere termijn follow up uitgevoerd (Naets, 2018).
Zoals bij iedere behandeling moeten de baten van een behandelprogramma gewogen worden tegen de potentiële nadelige neveneffecten daarvan. In de recente literatuur is steeds meer aandacht voor eventuele nadelige effecten van behandelprogramma’s voor kinderen met obesitas. Wanneer deelname aan een behandelprogramma leidt tot een toegenomen fixatie op gewicht, zonder daadwerkelijk effect, kan dit uiteindelijk tot resultaat hebben dat het zelfbeeld lager wordt. Daarnaast suggereert de literatuur dat onsuccesvolle programma’s en/of onvoldoende begeleiding en verwachtingsmanagement soms kan leiden tot een vlucht naar ongezonde vormen van gewichtscontrole, zoals laxantia gebruik en bewust braken (Cinelli, 2016). Daarom is het belangrijk om bij de behandeling van kinderen met obesitas bewust te zijn van één van de basisbeginselen van de geneeskunde: ‘Do no harm’. Dit is de reden waarom in het landelijk model ketenaanpak is opgenomen dat een voorwaarde voor goede obesitasbehandeling is dat zorgprofessionals “naast kind en ouders staan om vanuit hun perspectief op zoek te gaan naar wat belangrijk voor hen is, wat nodig is, wat voorhanden is en wie wat te doen heeft” (Sijben, 2018b).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Voor een succesvolle behandeling van obesitas is het van belang om te weten wat het doel is van het programma. Daarbij dient niet alleen aandacht te zijn voor de doelen die de zorgverlener stelt, maar vooral de doelen die de patiënt heeft. Zo blijkt uit onderzoek dat kinderen met obesitas vooral bezorgd zijn om de sociale impact die obesitas in hun leven heeft en minder bezig zijn met het effect dat obesitas heeft op de gezondheid (Rees, 2011). Ook blijkt dat de motivatie van kinderen gelinkt is aan de behandelresultaten van een obesitasinterventie (Braden, 2014). Het niet kennen van en niet aansluiten bij de doelen die kinderen hebben om af te vallen kan dus mogelijk leiden tot slechtere behandelresultaten. Daarnaast kan het voorkomen dat kinderen hun vertrouwen verliezen in de reguliere behandelprogramma’s en onbegeleid ongezonde afname van overgewicht technieken gaan toepassen, zoals extreme calorische restrictie en laxantiagebruik (Cinelli, 2016). Het kennen en bespreken van de doelen en verwachting van de patiënt en het monitoren van motivatie zijn daarom essentiële onderdelen van obesitasbehandeling bij kinderen.
Vanuit de patiëntenvereniging wordt het bovenstaande onderschreven. Er moet vanuit hulpverlening aandacht zijn voor de individuele doelen van de patiënt. Een belangrijk deel van de patiënten geeft aan dat er vaak te weinig aandacht is voor hun specifieke zorgen en doelen. Daarnaast geven zij aan dat het van essentieel belang is dat zorg die frequent is (i.e. het intensieve deel van een GLI) dicht bij huis wordt aangeboden. Vanuit de ouders wordt aangegeven dat motiveren en gemotiveerd houden van de patiënt een van de grootste uitdagingen is binnen een behandelprogramma en dus een prominente plaats verdient.
Kosten (middelenbeslag)
De totale zorgkosten gerelateerd aan overgewicht in Nederland werden in 2012 geraamd op €1.600.000.000,- (RIVM, 2012). Dit laat zien dat een effectieve obesitasbehandeling vanuit economisch standpunt cruciaal is. Daar kinderen en adolescenten met overgewicht en obesitas een sterk verhoogde kans hebben om obesitas te krijgen op de volwassen leeftijd lijkt vroege interventie cruciaal. Met betrekking tot de kosteneffectiviteit van obesitasbehandeling middels gecombineerde leefstijlinterventie bij kinderen zijn geen data beschikbaar voor de Nederlandse situatie.
Aanvaardbaarheid voor de overige relevante stakeholders
Een van de belangrijkste uitdagingen met betrekking tot gecombineerde leefstijlinterventies is de bekostiging. De verantwoordelijkheden en financiele aansprakelijkheid is versnipperd en afstemming tussen partijen noodzakelijk. De zorg valt deels onder de zorgverzekeringswet (geïndiceerde begeleiding door een arts, dietist of fysiotherapeut) en deels onder de jeugdwet (2015) (versterken van jongeren en ouders, bevordering opvoedcapaciteit, preventie en vroegsignalering, effectieve samenwerking rond gezinnen). Gemeenten zijn verantwoordelijk voor de invulling van deze jeugdwet. De mate waarin overgewicht en obesitaszorg geïmplementeerd wordt is zeer wisselend van gemeente tot gemeente. Daarom kan de zorg voor kinderen met obesitas erg verschillend zijn tussen gemeenten. Dit leidt momenteel tot ongelijkheid van zorg. Vanuit de praktijk wordt gerapporteerd dat de betrokkenheid van lokale bestuurders bij het onderwerp en de prioritering wisselend is. Ook was er op het gebied van obesitas behoefte aan een leidraad voor gemeenten hoe zorg voor kinderen met overgewicht en obesitas geïmplementeerd zou moeten worden. Die is er nu in de vorm van het landelijk model ketenaanpak voor kinderen met overgewicht en obesitas (Sijben, 2018). Deze gaat gepaard met een handreiking voor de lokale realisatie van deze aanpak. Deze handreiking ondersteunt stapsgewijs de praktische realisatie van de lokale variant van een ketenaanpak conform het landelijk model en is bedoeld voor initiatiefnemers en projectleiders (Sijben, 2018).
Haalbaarheid en implementatie
Het implementeren van gecombineerde leefstijlinterventies is op veel plekken in Nederland en in de wereld gedaan en succesvol gebleken (Luttikhuis, 2009). Er zijn een aantal belemmerende factoren als het gaat over implementatie en ook continuatie van deze interventies. Daarbij is continuïteit van de bekostiging één van de belangrijkste uitdagingen gebleken. In het verleden zijn programma’s enkele jaren na starten gestopt omdat de bekostiging gestaakt werd. Resultaten van behandelprogramma’s zijn daarin als argument gebruikt om behandelprogramma’s al dan niet te continueren. Goede monitoring van behandelresultaten is daarom cruciaal.
Daarnaast kan logistiek een belemmering zijn. In dit opzicht is de logistiek met betrekking tot verwijzing naar een programma een belangrijke randvoorwaarde. Daarom moeten potentiële verwijzers (o.a. huisartsen, jeugdartsen en kinderartsen) goed geïnformeerd worden over verwijsroute en verwijscriteria.
Vanuit het perspectief van de patiënt is een voorwaarde dat de behandelaar op de hoogte is van de behandeldoelen van de patiënt en dat wordt aangesloten bij diens motivatie. Dit kan leiden tot een hogere acceptatie van de behandeling en een beter behandelresultaat (Braden, 2014).
Met betrekking tot de specifieke kennis en kunde op het gebied van overgewicht/obesitas behandeling worden op dit moment geen meetbare eisen gesteld aan de medewerkers van een leefstijlinterventie. Dat wil zeggen, er zijn geen specifieke afstudeerrichtingen binnen bijvoorbeeld diëtetiek, fysiotherapie, of bepaalde certificering alvorens patiënten met obesitas te mogen begeleiden. Binnen de opleidingen diëtetiek en fysiotherapie is hier wel uitgebreid aandacht voor en kan een aantekening in het beroepsregister worden verkregen. Het is wenselijk dat in de toekomst deze kwaliteitseisen verder worden aangescherpt om de obesitaszorg verder te professionaliseren.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Op basis van de beschikbare literatuur onderschrijft de eerdere aanbeveling in de CBO-richtlijn dat een gecombineerde leefstijlinterventie tenminste moet bestaan uit een interventie gericht op verandering van het eetgedrag gecombineerd met een interventie gericht op het verhogen van fysieke activiteit (sterke aanbeveling). Het effect ten opzichte van monotherapie is evident bij kinderen met obesitas (Luttikhuis, 2009). Er is onvoldoende bewijs in de literatuur om een aanbeveling te doen omtrent het type eetgedrag- of beweeg interventie. Reden hiervoor is dat er weinig studies zijn die het effect van gecombineerde leefstijlinterventies die op één specifieke interventie verschillen bekijken. De studies die wel beschikbaar zijn laten geen klinisch relevant verschil tussen verschillende interventies zien als het gaat om verandering in BMI z-score. Voor de uitkomstmaten co-morbiditeit en kwaliteit van leven zijn geen vergelijkende data beschikbaar. Er is onvoldoende bewijs om een aanbeveling te doen met betrekking tot het toevoegen van extra componenten aan gecombineerde leefstijlinterventies als gekeken wordt naar de uitkomst maat verandering in BMI z-score. De heterogeniteit van de geïncludeerde interventies was daarnaast groot. Voor de uitkomstmaten co-morbiditeit en kwaliteit van leven zijn geen vergelijkende data beschikbaar betreffende verschillende componenten van GLI. Let wel, dit betekent niet dat er geen evidence is dat GLI’s effect hebben op kwaliteit van leven en co-morbiditeit. Er is echter geen data om een advies omtrent een specifieke invulling van een GLI te geven.
Betreffende verandering van eetgedrag adviseert de werkgroep daarom dat een interventie erop gericht moet zijn om een interventie te doen op eetgedrag met als streven een voedingspatroon volgens de richtlijnen zoals ze geadviseerd zijn door de gezondheidsraad (Richtlijnen goede voeding, 2015) te bewerkstelligen. De werkgroep doet geen aanbevelingen over het type interventie op eetgedrag. Betreffende verandering in beweeggedrag adviseert de werkgroep dat een interventie erop gericht moet zijn om te gaan bewegen volgens de richtlijn bewegen van de gezondheidsraad (2017). De werkgroep doet geen aanbevelingen over het type interventie op beweeggedrag. De werkgroep adviseert wel om de intensiteit van het programma te bepalen aan de hand van de bepaling van het gewicht gerelateerd gezondheidsrisico (GGR), zoals beschreven in de zorgstandaard (Partnerschap Overgewicht Nederland, 2010).
Verder adviseert de werkgroep, conform de CBO-richtlijn en het model landelijke ketenaanpak voor kinderen met overgewicht en obesitas (Kwaliteitsinstituut voor de Gezondheidszorg CBO, 2008; Sijben, 2018), dat een gecombineerde leefstijl interventie gericht zou moeten zijn op het systeem waarin het kind met obesitas zich bevindt en niet alleen op het kind zelf. Een belangrijk doel is dat zowel het systeem, als het kind regie krijgen over de leefstijl. Hierbij moeten de belemmerende factoren voor een succesvolle interventie binnen het systeem worden geïnventariseerd voor aanvang van de GLI (zie Module Barriéres en bevorderende factoren voor een GLI), gemonitord worden gedurende de behandelfase en indien nodig geadresseerd. Dit laatste is van extra groot belang als er sprake is van onvoldoende effect van de GLI. Belemmerende factoren voor een succesvolle interventie dienen voor aanvang GLI bekend en aangepakt te zijn.
De werkgroep vindt het adresseren van slaapproblematiek bij kinderen met obesitas cruciaal als onderdeel van de gecombineerde leefstijlinterventie. Hoewel de huidige methode van selecteren van literatuur geen studies opleverde die een toegevoegd effect lieten zien van het adresseren van slaapgedrag, zijn er wel degelijk aanwijzingen in de literatuur dat er een direct verband is tussen slaapkwaliteit en de resultaten van GLI (Valrie, 2015). Daarom adviseert de werkgroep om een gezond slaappatroon na te streven als onderdeel van de GLI, waarbij de bestaande JGZ richtlijn als hulpmiddel wordt aanbevolen (AJN, 2016).
Onderbouwing
Achtergrond
De resultaten van behandeling van obesitas bij kinderen zijn beperkt. Vooral het (lange termijn) effect van met name enkelvoudige interventies (bijvoorbeeld alleen diëtetiek of een beweeginterventie) is teleurstellend. Het combineren van interventies gericht op voeding, beweging en gedrag lijkt een beter resultaat te geven (langduriger gewichtsverlies van zo'n 5%). Inmiddels is het breed geaccepteerd dat de gecombineerde leefstijl interventie (GLI) een waardevolle interventie is voor het bereiken van gewichtsdaling en gezondheidswinst. Het is echter niet duidelijk wat voor type interventie het meest effectief is en of het wellicht zinvol is daar nog componenten (bijvoorbeeld systeemtherapie) aan toe te voegen.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Het is vanuit de literatuur onduidelijk wat de waarde is van verschillende typen eet-, beweeg- en gedrag interventies bij een gecombineerde leefstijlinterventie (GLI) op overgewicht en daarvan afgeleide meeteenheden bij het behandelen van kinderen (6 tot 13 jaar) met obesitas. Ook is het onduidelijk wat de toegevoegde waarde is van het toevoegen van diverse extra componenten bij een gecombineerde leefstijlinterventie (GLI) op overgewicht en daarvan afgeleide meeteenheden bij het behandelen van kinderen (6 tot 13 jaar) met obesitas.
Bronnen: Forsell, 2018; Kokkvoll, 2014; Mead, 2017 |
|
Zeer laag GRADE |
Het is vanuit de literatuur onduidelijk wat waarde is van verschillende typen eet-, beweeg- en gedrag interventies bij een gecombineerde leefstijlinterventie (GLI) op gewicht en daarvan afgeleide meeteenheden bij het behandelen van kinderen (6 tot 13 jaar) met obesitas. Ook is het onduidelijk wat de toegevoegde waarde van het toevoegen van diverse extra componenten bij een gecombineerde leefstijlinterventie (GLI) op gewicht en daarvan afgeleide meeteenheden bij het behandelen van adolescenten (13 tot 17 jaar) met obesitas.
Bronnen: Berkowitz, 2011; Lloyd-Richardson, 2012 |
|
- GRADE |
Het effect van verschillende typen eet-, beweeg- en gedrag interventies binnen een GLI en het toevoegen van extra componenten aan een GLI op de uitkomstmaten gezondheid en kwaliteit van leven is onbekend. Geen van de studies rapporteert deze uitkomstmaten. |
Samenvatting literatuur
Beschrijving studies
De effectiviteit van de behandeling van kinderen met obesitas werd onderzocht in een reeks van zes Cochrane reviews. Drie van deze reviews gaan over behandeling met medicatie, operatie en interventies voor ouders. De andere drie reviews gaan over het effect van gecombineerde leefstijlinterventies bij: kinderen van 0 tot 6 jaar (Colquitt, 2016), kinderen van 6 tot 11 jaar (Mead, 2017) en kinderen van 12 tot 17 jaar (Al-Khudairy, 2017). De primaire analyses van deze reviews konden niet gebruikt worden om de uitgangsvraag te beantwoorden, omdat de effectiviteit van GLI werd vergeleken met een controlegroep/gebruikelijke zorg, waarbij dus niet de toegevoegde waarde van bepaalde componenten werd onderzocht. Alleen de review van Mead (2017) werd geïncludeerd in de literatuuranalyse, omdat hierin subgroepanalyses werden verricht om het effect van verschillende eigenschappen van de interventies te testen.
Kinderen 6 tot 13 jaar
Mead (2017) verrichtte een systematische Cochrane review naar de effectiviteit van gecombineerde leefstijlinterventies bij kinderen van 6 tot 11 jaar met overgewicht of obesitas. Er werd systematisch gezocht in Medline, Embase, Cochrane Central Register of Controlled Trials (CENTRAL), PsycINFO, CINAHL, LILACS, ClinicalTrials.gov en ICTRP tot juli 2016. Alleen RCT’s en cluster RCT’s bij kinderen met overgewicht of obesitas met een minimale follow-up van 6 maanden werden geïncludeerd. Interventies die alleen op de ouders gericht waren (zonder betrekken van kinderen) werden geëxcludeerd. Alle gedragsveranderende interventies met één of een combinatie van gedrag, voeding en fysieke activiteit en aangeboden als een enkele of multicomponent interventie werden geïncludeerd, met als vergelijking geen behandeling, gebruikelijke zorg of een gelijktijdige interventie (andere gedragsveranderende interventie). De primaire uitkomstmaten waren verandering in BMI, BMI z-score en gewicht. Als secundaire uitkomstmaat werd onder andere kwaliteit van leven meegenomen. In totaal werden 70 trials geïncludeerd, en 55 opgenomen in de meta-analyse. In 20 studies daarvan kon de additionele waarde van een bepaald component onderzocht worden. Hiervan rapporteerden acht studies gewichtsverandering en/of BMI-z score en konden meegenomen worden in de subgroep meta-analyse. De onderzochte componenten die werden toegevoegd in de interventiegroep liepen erg uiteen. Zo werd in de studie van Davis (2013) de toevoeging van teleconsulten vergeleken met standaard artsbezoeken. Duffy (1993) onderzocht de toegevoegde waarde van cognitief zelfmanagement bij een gedragsinterventie. Epstein (1985a) vergeleek een dieet met twee verschillende beweegprogramma’s (geprogrammeerd aerobic en leefstijl beweegprogramma) met dieet en laag intensiteit gymnastiek beweegprogramma. Een latere studie van Epstein (2000a) vergeleek een gedrag beweegprogramma plus therapie gericht op het vergroten van het probleemoplossend vermogen van (ouders en) kind met een standaardbehandeling zonder toevoeging van deze therapie. In een studie van Epstein uit 2005 werd een gestandaardiseerd gezinsprogramma voor gewichtsbeheersing plus extra diëtetaire interventie gericht op het vergroten van voedingsalternatieven met alleen een gestandaardiseerd familieprogramma voor gewichtsbeheersing. In een ongepubliceerde studie (NCT02436330) werd de toegevoegde waarde van exergaming onderzocht bij didactisch gezond onderwijs.
Kokkvoll (2014) vergeleek een meervoudige gezinsgerichte interventie met een enkelvoudige gezinsgerichte interventie. In de meervoudige interventie ondergingen gezinnen met kinderen (6 tot 12 jaar) met overgewicht of obesitas in groepsverband en individueel een behandeling inclusief wekelijks groep sessies en een familiekamp van 4 dagen. In de enkelvoudige interventie werd elk gezin individueel begeleid, en waren er evenveel contactmomenten. In totaal werden 91 kinderen gerandomiseerd naar de meervoudige (N=45, gemiddelde leeftijd 10,1 (SD 1,7)) of enkelvoudige (N=46, gemiddelde leeftijd 10,5 (SD 1,7)) interventie. De follow-up duur was 12 maanden. De uitkomstmaat verandering in BMI-SDS werd gemeten na 3 en 12 maanden, waarbij de uitkomst van 12 maanden werd opgenomen in de analyse.
Forsell (2018) verrichtte een RCT onder kinderen (8 tot 13 jaar) met obesitas, en vergeleek een behandelprogramma uitgevoerd door een verpleegkundige, diëtist en een fysiotherapeut met hetzelfde programma uitgevoerd door alleen een verpleegkundige en een diëtist. In totaal werden 56 kinderen met obesitas gerandomiseerd naar de interventiegroep (N=27, gemiddelde leeftijd 15,1 (SD 1,4)) of controlegroep (N=29; gemiddelde leeftijd 15,5 (SD 1,0)). De gemiddelde follow-up duur was 4,5 jaar. Verandering in BMI-SDS werd als uitkomstmaat gemeten na 4 jaar.
Adolescenten 13 tot 17 jaar
Lloyd-Richardson (2012) verrichtte een RCT bij kinderen met obesitas waarbij adolescenten (13 tot 16 jaar) werden gerandomiseerd naar een groepsinterventie van 16 weken bestaande uit GLI met aerobics oefeningen (N=56, gemiddelde leeftijd niet gerapporteerd) of GLI met een op groepsdynamiek gebaseerd beweegprogramma gericht op sociale vaardigheden, teamwork en zelfredzaamheid (N=62). Beide groepen ondergingen een intensief 16-weken durende behandeling gericht op voedingsinterventie, verhogen van fysieke activiteit en gedragsverandering. De groepen verschilden alleen op het vlak van het fysieke activiteitenprogramma. De follow up duur was 2 jaar.
Berkowitz (2011) verrichtte een RCT onder adolescenten (13 tot 17 jaar) met obesitas naar het verschil tussen een conventioneel dieet en maaltijdvervangers toegevoegd aan een gecombineerd leefstijlprogramma. Er werden 37 kinderen gerandomiseerd naar de groep die 12 maanden een conventioneel dieet kregen toegevoegd aan GLI (gemiddelde leeftijd 15,2 (SD 1,2)), en 65 kinderen (gemiddelde leeftijd 14,9 (SD 1,3)) die eerst 4 maanden maaltijdvervangers kregen en daarna gerandomiseerd werden naar nog eens 8 maanden maaltijdvervangers (N=26) of alsnog conventioneel dieet kregen (N=23). BMI z-score werd na 4 maanden en na 12 maanden gemeten. De verandering in BMI z-score na 4 maanden werd meegenomen in de meta-analyse.
Resultaten
1. GewichtKinderen tot 6 jaar
Er is geen onderzoek waarin GLI’s die op componenten verschillen worden vergeleken voor kinderen 0 tot 6 jaar.
Kinderen 6 tot 13 jaar
Mead (2017) verrichtte een meta-analyse naar het effect van het toevoegen van bepaalde componenten aan GLI in de interventiegroep met een controlegroep die GLI zonder deze componenten ontving. Voor gewichtsverlies werden de uitkomstmaten verandering in BMI z-score en verandering in gewicht geanalyseerd. De resultaten van Kokkvoll (2014) en Forsell (2018) werden toegevoegd aan de meta-analyse van Mead (2017). Er was geen verschil tussen de groep GLI met extra componenten en de groep met alleen GLI, het gepoolde gemiddelde verschil in BMI z-score van 7 studies met een follow-up variërend tussen 6 maanden en 4 jaar was -0,03 (95% BI -0,17 tot 0.10) ten gunste van GLI met een extra component (figuur 1).
Figuur 1 Uitkomstmaat verandering in BMI z-score voor GLI plus component versus GLI
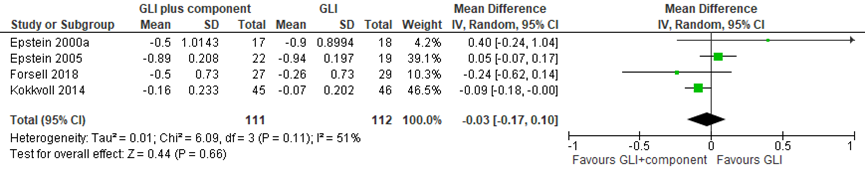
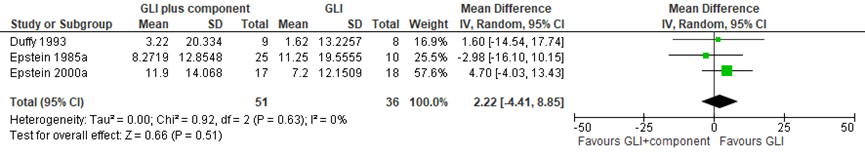
In de systematische review van Mead (2017)was er geen statistisch significant verschil in verandering in lichaamsgewicht tussen de 2 groepen. Het gepoolde gemiddelde verschil in lichaamsgewicht van 4 studies was 1,59 (95% BI -4,58 tot 7,77) ten gunste van de controlegroep (figuur 2).
Figuur 2 Uitkomstmaat verandering in lichaamsgewicht voor GLI plus component versus GLI
Adolescenten 13 tot 17 jaar
In de studie van Berkowitz (2011) was er na 4 maanden een statistisch significant verschil in BMI z-score, waarbij de groep die maaltijdvervangers kreeg een grotere afname in BMI z-score had (-0,2; SD 0,02) dan de groep die een conventioneel dieet kreeg (-0,1; SD 0,02) bovenop een GLI. Echter, na 12 maanden was er geen verschil meer in de afname in BMI z-score tussen de 2 groepen. Na 12 maanden had de groep die maaltijdvervangers kreeg een gemiddeld verschil van -0,10 (SD 0,04) en de groep met een conventioneel dieet -0,09 (SD 0,04 gemiddeld verschil wordt niet gerapporteerd).
Lloyd-Richardson (2012) rapporteerde geen verandering over tijd in BMI z-score tussen de groepen, maar alleen de gemiddelde van de groepen op baseline en follow-up metingen. De gemiddelde BMI z-scores op baseline, 12 maanden en 24 maanden waren 2.05 (SD 0,27), 1,85 (SD 0,43) en 1,88 (SD 0,45) in de gesuperviseerde aerobic trainingen en 2,02 (SD 0,34), 1,78 (SD 0,49) en 1,77 (SD 0.52) in de groep met een beweeg interventie gericht op sociale vaardigheden, teamwork en zelfredzaamheid. Gerapporteerd werd dat er geen statistisch significant verschil over tijd tussen de groepen was.
2. Gezondheid
Deze uitkomstmaat werd niet gerapporteerd in de geïncludeerde studies.
3. Kwaliteit van leven
Deze uitkomstmaat werd niet gerapporteerd in de geïncludeerde studies.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat gewicht is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege onduidelijke of geen blindering); extrapoleerbaarheid (bias ten gevolge van indirectheid vanwege verschillende componenten als interventie) en het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Welke componenten van GLI hebben toegevoegde waarde bij kinderen en adolescenten met overgewicht en obesitas?
P: kinderen en adolescenten (0 tot 18 jaar) met overgewicht en obesitas;
I: gecombineerde leefstijl interventie: duur, frequentie van interventies, betrokkenheid bepaalde disciplines;
C: andere GLI die op een component verschilt (andere duur, frequentie, competenties van begeleiders);
O: gewicht, gezondheid, kwaliteit van leven.
Relevante uitkomstmaten
De werkgroep achtte gewicht een voor de besluitvorming cruciale uitkomstmaat; en gezondheid en kwaliteit van leven voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep volgt voor de definitie van een succesvolle interventie m.b.t. de uitkomstmaat gewicht de criteria zoals die eerder zijn geformuleerd in de ‘Zorgstandaard Obesitas’:
- Er zijn geen evidence-based criteria voor succes bij kinderen in de groei. Vandaar dat bij kinderen naar gewichtsstabilisatie gestreefd wordt na één jaar behandeling en handhaving hiervan in de fase van onderhoud, tenzij dat tijdens de groeispurt van het kind onhaalbaar is.
- Voor uitgegroeide kinderen met een matig verhoogd GGR wordt gestreefd naar een gewichtsverlies van ≥ 5% na één jaar behandeling en handhaving hiervan in de fase van onderhoud.
- Voor uitgegroeide kinderen met een sterk of extreem verhoogd GGR wordt gestreefd naar een gewichtsverlies van ≥ 10% na één jaar behandeling en handhaving hiervan in de fase van onderhoud.
De uitkomstmaat gezondheid wordt gedefinieerd als het afnemen van co-morbiditeit of risicofactoren van co-morbiditeit, zoals reductie van prevalentie van diabetes mellitus type 2, metabool syndroom, hypertensie, hypercholesterolemie, non-alcholic fatty liver disease, insuline resistentie, impaired glucose tolerance, impaired fasting glucose. Voor de uitkomstmaat kwaliteit van leven bepaalde de werkgroep niet a priori de definitie, maar werden de in de studie gebruikte definities gehanteerd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 28 november 2018 met relevante zoektermen gezocht naar systematische reviews, randomised controlled trials (RCT’s) en observationele studies die de effectiviteit van componenten in een GLI vergeleken met een andere GLI bij kinderen met obesitas. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 822 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: kinderen (0 tot 18 jaar) met overgewicht of obesitas of gezinnen met een kind met overgewicht of obesitas, waarbij het effect van componenten van een GLI onderzocht door deze toe te vergelijken met een andere GLI. Op basis van titel en abstract werden in eerste instantie 111 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 106 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 5 studies definitief geselecteerd.
Resultaten
Er werd 1 systematische review en 4 aanvullende RCT’s opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- AJN (2016) JGZ richtlijn Gezonde slaap en slaapproblemen Preventie, signalering, diagnostiek en interventie bij slaapproblemen in de JGZ. (cited 2019 Aug 28) Available from: https://assets.ncj.nl/docs/57848d02-2590-4e7c-b22e-dba76db0e209.pdf
- Berkowitz, R. I., Wadden, T. A., Gehrman, C. A., Bishop‐Gilyard, C. T., Moore, R. H., Womble, L. G., ... & Xanthopoulos, M. S. (2011). Meal replacements in the treatment of adolescent obesity: a randomized controlled trial. Obesity, 19(6), 1193-1199.
- Black, N., & Mullan, B. (2015). An intervention to decrease heavy episodic drinking in college students: The effect of executive function training. Journal of American college health, 63(4), 280-284.
- Braden, A. L., Crow, S., & Boutelle, K. (2015). Child self-reported motivations for weight loss: impact of personal versus. social/familial motives on family-based behavioral weight loss treatment outcomes. Eating and Weight Disorders-Studies on Anorexia, Bulimia and Obesity, 20(2), 205-213.
- Cinelli, R. L., & O’Dea, J. A. (2016). Obesity prevention programs in children: impact on weight, shape and food Concern. Current obesity reports, 5(1), 88-96.
- Forsell, C., Gronowitz, E., Larsson, Y., Kjellberg, B. M., Friberg, P., & Mårild, S. (2018). Four‐year outcome of randomly assigned lifestyle treatments in primary care of children with obesity. Acta Paediatrica.
- Gezondheidsraad (2017) (cited 2019 Aug 28) Beweegrichtlijnen. Available from: https://www.gezondheidsraad.nl/documenten/adviezen/2017/08/22/beweegrichtlijnen-2017
- Gezondheidsraad (2014) (cited 2019 Aug 28) Richtlijnen goede voeding 2015. Available from: https://www.gezondheidsraad.nl/documenten/adviezen/2015/11/04/richtlijnen-goede-voeding-2015
- Kokkvoll, A., Grimsgaard, S., Ødegaard, R., Flægstad, T., & Njølstad, I. (2014). Single versus multiple-family intervention in childhood overweight—Finnmark Activity School: a randomised trial. Archives of disease in childhood, 99(3), 225-231.
- Kwaliteitsinstituut voor de Gezondheidszorg CBO. (2008) Richtlijn Diagnostiek en behandeling van obesitas bij volwassenen en kinderen. Van Zuiden Communications B.V., Alphen aan den Rijn.
- Lloyd-Richardson, E. E., Jelalian, E., Sato, A. F., Hart, C. N., Mehlenbeck, R., & Wing, R. R. (2012). Two-year follow-up of an adolescent behavioral weight control intervention. Pediatrics, 130(2), e281-e288.
- Luttikhuis, H. O., Baur, L., Jansen, H., Shrewsbury, V. A., O'Malley, C., Stolk, R. P., & Summerbell, C. D. (2009). Interventions for treating obesity in children. Cochrane database of systematic reviews, (1).
- Makkes, S., Halberstadt, J., Renders, C. M., Bosmans, J. E., van der Baan-Slootweg, O. H., & Seidell, J. C. (2011). Cost-effectiveness of intensive inpatient treatments for severely obese children and adolescents in the Netherlands; a randomized controlled trial (HELIOS). BMC Public Health, 11(1), 518.
- Mead, E., Brown, T., Rees, K., Azevedo, L. B., Whittaker, V., Jones, D., ... & Beardsmore, E. (2017). Diet, physical activity and behavioural interventions for the treatment of overweight or obese children from the age of 6 to 11 years. Cochrane Database of Systematic Reviews, (6).
- Naets, T., Vervoort, L., Ysebaert, M., Van Eyck, A., Verhulst, S., Bruyndonckx, L., ... & Braet, C. (2018). WELCOME: improving WEight controL and CO-Morbidities in children with obesity via Executive function training: study protocol for a randomized controlled trial. BMC public health, 18(1), 1075.
- Nederkoorn, C., Braet, C., Van Eijs, Y., Tanghe, A., & Jansen, A. (2006). Why obese children cannot resist food: the role of impulsivity. Eating behaviors, 7(4), 315-322.
- Partnerschap Overgewicht Nederland (2010) Zorgstandaard Obesitas. (cited 2019 Aug 28) Available from: https://beta.vu.nl/nl/Images/PON_Zorgstandaard_Obesitas_definitief_2011_tcm235-928603.pdf.
- Rees, R., Oliver, K., Woodman, J., & Thomas, J. (2011). The views of young children in the UK about obesity, body size, shape and weight: a systematic review. BMC public health, 11(1), 188.
- RIVM (2012). Zorgkosten van ongezond gedrag. (cited 2019 Aug 28) Available from: https://www.volksgezondheidenzorg.info/sites/default/files/rapport_kvz_2012_2_zorgkosten_van_ongezondgedrag.pdf.
- Sijben, M. Van der Velde, E. Van Mil, J. Stroo en J. Halberstadt: Landelijk model ketenaanpak voor kinderen met overgewicht en obesitas. Amsterdam: Care for Obesity, december 2018. Link: https://beta.vu.nl/nl/Images/PON_Zorgstandaard_Obesitas_definitief_2011_tcm235-928603.pdf.
- Valrie, C. R., Bond, K., Lutes, L. D., Carraway, M., & Collier, D. N. (2015). Relationship of sleep quality, baseline weight status, and weight-loss responsiveness in obese adolescents in an immersion treatment program. Sleep medicine, 16(3), 432-434.
- Verbeken, S., Braet, C., Goossens, L., & Van der Oord, S. (2013). Executive function training with game elements for obese children: a novel treatment to enhance self-regulatory abilities for weight-control. Behaviour research and therapy, 51(6), 290-299.
- Voedingscentrum (2019) Mijn kind en ik. Alles over gezond eten van zwangerschap tot 18 jaar (cited 2019 Aug 28) Available from: https://www.voedingscentrum.nl/nl/mijn-kind-en-ik.aspx
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
|
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Mead, 2017 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
No |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Berkowitz, 2011 |
No method of randomisation described |
Unclear |
Unclear |
Impossible |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Forsell, 2018 |
No method of randomisation described |
Unclear |
Unclear |
Impossible |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Kokkvoll, 2014 |
Computer generated (random block size) randomisation lists were used. |
Unlikely |
Unclear |
Impossible |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Lloyd-Richardson, 2012 |
An urn randomization procedure with percent overBMI and gender as covariates was used to assign participants |
Unlikely |
Unclear |
Impossible |
Unclear |
Unlikely |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question:
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Mead, 2017 |
SR and meta-analysis of (cluster) RCTs
Literature search up to July 2016
A: Bathrellou, 2010 B: Berry, 2007 C: Davis, 2013 D: Duffy, 1993 E: Duggins, 2010 F: Epstein, 1984a G: Epstein, 1985a H: Epstein, 1985b I: Epstein, 2000a J: Epstein, 2001 K: Epstein, 2005 L: Epstein, 2015 M: Flodmark, 1993 N: Larsen, 2015 O: Looney 2014 P: NCT02436330 Q: Schwingshandl, 1999 R: Taveras, 2015 S: Vann, 2013 T: Woo, 2004
Study design: RCT Parallel RCT: A, C, D, E, F, G, H, I, J, K, O, Q, S, T Cluster RCT: B, R
Setting and Country: not reported
Source of funding: [commercial / non-commercial / industrial co-authorship]
|
Inclusion criteria SR: RCTs or cluster RCTs, minimum of 6 month observation period, overweight or obese participants aged 6 to 12 yrs at the commencement of the intervention. Any behaviour-changing intervention (with any one or any combination of behavioural, nutritional and physical activity component) delivered as a single or multicomponent intervention, in any setting, using any delivery method, which aimed to treat paediatric obesity using any of the following intervention versus control sequences.
Exclusion criteria SR: Interventions focused solely on the parents (with no child involvement). Studies with pregnant participants, studies that included critically ill participants, interventions that specifically dealt with the treatment of eating disorders or type 2 diabetes, studies that included participants with a secondary or syndromic cause of obesity.
70 studies included in total, 15 studies in subgroupanalysis effect component.
N, mean age±SD I/C A: 47 patients, 9.4±0.3 / 9.1±0.3 yrs B: 80 patients, 11.9±2.3 / 11.9±2.5 C: 58 patients, 8.5±1.7 / 8.7±1.8 yrs D: 27 patients, 9.9±1.7 yrs E: 83 patients, 10.6±3.9 / 10.6±3.4 yrs F: 53 patients, 10.5±1.3 / 10.3±1.2 yrs G: 41 patients, age not reported H: 23 patients, age not reported I: 67 patients, 10.7±0.9/ 10.3±1.2/ 10.0±1.2 yrs J: 67 patients, 10.4 (boys), 9.9 (girls) / 10.8 (boys), 10.2 (girls) yrs K: 44 patients, 10.2±1.1 / 10.1±1.3 yrs L: 24 patients, 10.5±1.4 yrs M: 44 patients, age not reported N: 80 patients, 6.1±1.1 / 6.3±1.3 yrs O: 22 patients, 8.2±1.8 / 8.6±1.8/ 7.3±1.8 yrs P: 84 patients, 10 yrs Q: 30 patients, 11.0±2.5 / 12.2±2.7 yrs R: 549 patients, 9.8±1.8/ 9.8±2.0/ 9.8±1.9 yrs S: 28 patients, 11.2 yrs T: 82 patients, 10.0±1.0 / 9.9±0.9 yrs
Sex, I/C: A: 24% Male B: 40% / 43% Male C: 71% / 70% Male D: 22% Male E: 58% / 40% Male F: not reported G: 40% Male H: 0% Male I: 47% / 50% / 47% Male J: 52% / 52% Male K: 41% / 37% Male L: 38% / 55% Male M: 44% / 53% Male N: 33% / 37% Male O: 14% / 14% / 62% Male P: 38% / 50% Male Q: 43% / 44% Male R: 53% / 53%/ 54% Male S: 21% Male T: 66% / 66% Male
Groups comparable at baseline? Not reported |
A: behavioural intervention with parental involvement B: nutrition and exercise education programme (NEEP) plus coping skills training (CPT) C: Telemedicine intervention D: cognitive self-management training plus behaviour therapy E: nutrition classes and family YMCA membership F1: dietplus-exercise group F2: diet only G1: diet plus programmed aerobic exercise programme G2: diet plus exercise programme H: diet and exercise education I1: behavioural weight control programme plus parent and child problem solving I2: behavioural weight control programme plus child problem solving only J: a combination of reducing sedentary behaviour and increasing physical activity K: standardised family-based behavioural weight control programme plus reinforcement for increasing alternatives to eating L: familybased treatment + variety of high energy-dense foods M: family therapy N: education programme In addition to health consultations O1: newsletter and growth monitoring plus behavioural counselling O2: newsletter and growth monitoring P: exergaming and didactic healthy teaching Q: physical activity programme and dietary advice R1: computorised point-of care alerts plus direct to parent outreach and support R2: computerised point-of care alerts S1: pedometer + DVD group S2: pedometer group S3: DVD groups N1: diet plus supervised Structured exercise Programme with continuing training N2: diet plus supervised Structured exercise programme with detraining
|
A: behavioural intervention without parental involvement B: nutrition and exercise education programme (NEEP) only C: physician visit intervention D: behaviour therapy plus attention placebo control methods E: nutrition classes only F: waiting list control G: diet plus low intensity Calisthenic exercise programme H: diet education only I: standard treatment with no additional problem solving J: targeting increasing physical activity only K: standardised family-based behavioural weight control programme only L: familybased treatment only M: conventional treatment N: health consultations only O: newsletter only P: didactic healthy teaching Q: dietary advice only R: usual care S: control group N: diet modification only
|
A: 18 months B: 6 months C: 8 months D: 6 months E: 12 months F: 6 months G: 24 months H: 12 months I: 24 months J: 12 months K: 24 months L: 25 weeks M: 2 years N: 2 years O: 6 months P: 6 months Q: 1 year R: 1 year S: 6 months T: 1 year
For how many participants were no complete outcome data available? (intervention/control) A: 4% / 17% B: 25% C: 29% / 19% D: 37% E: 18% / 23% F: 17% / 0% / 18% G: 15% H: 17% I: 22% J: 10% K: 7% L: 0% M: 20% / 0% N: 11% / 3% O: 0% P: Not reported Q: 29% / 38% R: 0.3% S: 50% T: 0%
|
1. Weight loss Defined as change in BMI z-score
Effect measure: mean difference [95% CI]: I: 0.40 [-0.24 to 1.04] K: 0.05 [-0.07 to 1.04] N: -0.06 [-0.31 to 0.19] O: -0.08 [-0.50 to 0.34] P: -0.06 [-0.13 to 0.00]
Pooled effect (random effects model): -0.03 [95% CI -0.10 to 0.04] favoring behavior changing interventions plus component versus intervention without component Heterogeneity (I2): 8%
Defined as change in body weight
Effect measure: mean difference [95% CI]: D: 1.60 [-14.54 to 17.74] G: -2.98 [-16.10 to 10.15] H: -2.50 [19.44 to 14.44] I: 4.70 [-4.03 to 13.43]
Pooled effect (random effects model): 1.59 [95% CI -4.58 to 7.77] favoring intervention without component Heterogeneity (I2): 0%
|
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: 1. Weight loss: VERY LOW Due to risk of bias (unclear (D, N) or no blinding (G, H, I, K, O, P), indirectness (different components compared as intervention), imprecision (small number of patients)
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Mogelijke systematische reviews |
|
|
Solmi 2018 |
Not restricted to children, only obesity, environmental risk factors for obesity |
|
Parrott 2018 |
Describing the method of meta-analysis used for pediatric weight management |
|
Militello 2018 |
Focus on quality of SRs targeting prevention and treatment of overweight and obesity in adolescents |
|
Martin 2018 |
Other outcomes (school achievement, cognitive function, success), control no GLI |
|
Elinder 2018 |
Study protocol |
|
Bleich 2018 |
Obesity prevention |
|
Ward 2017 |
Obesity prevention |
|
Rajjo 2017 |
SR of SR's on all type of interventions. Less specific information about GLI |
|
Al-Khudairy 2017 |
Cochrane review (6 parts): 12-17 year. No GLI in control group |
|
Azevedo 2016 |
Sedentary behaviour interventions |
|
Sigman-Grant 2015 |
Review about mediating or moderating protective mechanism in family context |
|
Peirson 2015 |
no intervention, usual care, placebo or minimal component (e.g., single newsletter or information session on general health) comparison group |
|
Pappas 2015 |
No systematic review or RCT |
|
Foster 2015 |
Adiposity as outcome, no GLI |
|
Bhuyan 2015 |
Primary care physician mediated interventions |
|
Van Hoek 2014 |
Control groups no GLI. Effect of multicomponent treatment (vs no treatment). Subgroup analysis for type and intensity of treatment program. |
|
Martin 2014 |
No comparison GLI |
|
Liao 2014 |
Sedentary behaviour intervention |
|
Kelishadi 2014 |
Experiences on school based interventions |
|
Van der Kruk 2013 |
Description of parental involvement in weight control interventions |
|
Martin 2013 |
Effective behaviour change techniques |
|
Collins 2013 |
Parent-centred intervention to prevent or treat overweight and obesity: all study designs included |
|
Bleich 2013 |
Prevention studies |
|
Kuhl 2012 |
Behavioral correlates of obesity in preschoolers and the developmental context for lifestyle modification in this age group |
|
Taylor 2011 |
RCT to prevent overweight |
|
Sargent 2011 |
All primary care intervention included, not only multi-component |
|
Luttikhuis 2009 |
Updated by Mead 2017 |
|
Tsiros 2008 |
All behavioral, pharmacological and surgical weight management interventions |
|
McGovern 2008 |
Focussed on all nonsurgical interventions |
|
Kelly 2008 |
Old SR. No meta-analysis for weight change |
|
Summerbell 2005 |
Prevention studies |
|
Campbell 2002 |
Prevention studies |
|
O'Meara 1998 |
All kinds of treatments for prevention and management of obesity |
|
Mogelijke RCT’s |
|
|
Wong 2018 |
combined resistance and aerobic exercise training in girls |
|
Lanigan 2018 |
No primary research |
|
Gonzalez 2018 |
Study protocol for RCT |
|
Eno 2018 |
Control group no GLI |
|
Brown 2018 |
Feasibility study |
|
Barkin 2018 |
Intervention to prevent obesity |
|
Robertson 2017 |
Control group no GLI |
|
Iaia 2017 |
Prevention study |
|
Handel 2017 |
Prevention study |
|
Arlinghaus 2017 |
Z-BMI or weight loss not reported for the 2 groups, only difference between the groups |
|
Arenaza 2017 |
Study protocol for RCT |
|
Warschburger 2016 |
Inpatient. Intervention focussed on parents |
|
Stanley 2016 |
Study protocol for RCT |
|
Skjakodegard 2016 |
Study protocol |
|
Reinehr 2016 |
Effect of drugs in lifestyle interventions |
|
Makkes 2016 |
Inpatient. Effect of different length of stay |
|
Kugler 2016 |
16 different interventions testing separate components. Focus on mothers with depressive symptoms with obese children |
|
Gallotta 2016 |
Prevention study |
|
Bhave 2016 |
Prevention study |
|
Xu 2015 |
Prevention study |
|
Wang 2015 |
Prevention study |
|
Taylor 2015 |
Control group no GLI |
|
Seburg 2015 |
SR with both prevention and management studies. Interventions and controls not described for separate studies |
|
Hartlieb 2015 |
Baseline pilot study with only 6 participants |
|
Gerards 2015 |
Control group no GLI |
|
Da Silva 2015 |
Predictors analysed within intervention study |
|
Xu 2014 |
Control group no GLI |
|
Savoye 2014 |
Control group no GLI |
|
Nemet 2014 |
Control group no GLI |
|
Martinez-Andrade 2014 |
Prevention study |
|
Holland 2014 |
Predictors analysed within intervention study |
|
Endevelt 2014 |
Control group no GLI |
|
Bocca 2014a |
Control group no GLI |
|
Bocca 2014b |
Control group no GLI |
|
Abu-Kishk 2014 |
Control group are non-overweight children |
|
Patrick 2013 |
Control group no GLI |
|
Nemet 2013 |
Control group no GLI |
|
Hofsteenge 2013 |
Control group no GLI |
|
De Miguel-Etayo 2013 |
Non-systematic review focussed on all types of treatment |
|
Dalton 2013 |
Control group no GLI |
|
Vos 2012 |
Control group no GLI |
|
Raynor 2012 |
No control group. Effect analysed within intervention group |
|
Kalavainen 2012 |
Control group no GLI |
|
Vos 2011 |
Control group no GLI |
|
Reinehr 2009 |
No intervention study |
|
Pedrosa 2011 |
Changes over time not reported, only means at baseline and follow-up. Predictive study for metabolic syndrome |
|
Jelalian 2011 |
No overweight or obese children |
|
De Mello 2011 |
Only physical training (no diet or behavior) |
|
Coppins 2011 |
Control group no GLI |
|
Collins 2011 |
Activity+diet vs diet-only vs activity only |
|
West 2010 |
Control group no GLI |
|
Sola 2010 |
No control group |
|
Jelalian 2010 |
Is same study as Lloyd-Richardson. Change in z-BMI not reported (only means at baseline and follow-up) |
|
Haire-Joshu 2010 |
Prevention study |
|
Burrows 2010 |
3 study arms: diet, physical activity or both |
|
Nowicka 2008 |
Control group no GLI |
|
Nemet 2008 |
Control group no GLI |
|
Munsch 2008 |
Cognitive behavioral therapy, no GLI |
|
Hofsteenge 2008 |
Study protocol |
|
Goldfield 2008 |
Control group no GLI |
|
August CP 2008 |
Endocrine Society clinical practice guideline based on expert opinion |
|
Golley 2007 |
Control group no GLI |
|
DeMattia 2007 |
Focussed on interventions to limit sedentary behavior (non-systematic review) |
|
Jelalian 2006 |
Cognitive behavioral therapy, no GLI |
|
JADA 2006 |
|
|
Saelens 2002 |
Control group no GLI |
|
Mitchell 2002 |
No weight change as outcome (left ventricular parameters are outcome) |
|
Kang 2002 |
Outcome: insulin resistance syndrome markers |
|
Gutin 2002 |
Body composition as outcome (no weight change measured) |
|
Warschburger 2001 |
Cognitive-behavioural training programme |
|
Mogelijke overige studies |
|
|
Van Rinsum 2018 |
No RCT |
|
Kirk 2015 |
Obervational study |
|
Obert 2013 |
Healty adolescents as control (no GLI) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 13-11-2020
Beoordeeld op geldigheid : 09-11-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Kindergeneeskunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Eigenschappen goede GLI |
NVK |
2020 |
2025 |
5 jaarlijks |
NVK |
|
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijn is goedgekeurd door de Patiëntenfederatie Nederland.
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van het project is het ontwikkelen van de evidence-based richtlijn Behandeling van kinderen met obesitas; en daarmee een richtlijn volgens Medische Specialistische Richtlijnen 2.0 opleveren, waarin de huidige stand van wetenschappelijke kennis aangaande het onderwerp is meegenomen.
Doelgroep
Deze richtlijn is primair bedoeld voor kinderartsen, maar daarnaast is de richtlijn relevant voor huisartsen, verpleegkundigen/verpleegkundig specialisten kindergeneeskunde, diëtisten, psychologen, (kinder)fysiotherapeuten, jeugdartsen, jeugdverpleegkundigen, chirurgen en internisten.
Tevens is het waardevol voor leden van andere beroepsgroepen die betrokken zijn bij de zorg voor patiënten met obesitas van 0 tot 18 jaar om kennis te nemen van de richtlijn. Te denken valt aan beroepsgroepen zoals opvoedkundig adviseurs, maatschappelijk werkers, jeugdhulpverleners, combinatiefunctionarissen, buurtsportcoaches, onderwijsprofessionals en aanbieders van interventies en van reguliere voorzieningen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor kinderen met obesitas.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. E.L.T. (Erica) van den Akker, kinderarts endocrinoloog, universitair hoofddocent, Erasmus MC- Sophia Kinderziekenhuis en Centrum Gezond Gewicht, Rotterdam, Nederlandse Vereniging voor Kindergeneeskunde (voorzitter)
- Prof. dr. E. (Edgar) van Mil, kinderarts-endocrinoloog, Jeroen Bosch Ziekenhuis, ‘s-Hertogenbosch, expertise centrum voor kinderen met obesitas, Nederlandse Vereniging voor Kindergeneeskunde (vice-voorzitter)
- Dr. C.J. (Corjan) de Groot, AIOS kindergeneeskunde, Leids Universitair Medisch Centrum/ Groene Hart Ziekenhuis, Leiden/ Gouda, Nederlandse Vereniging voor Kindergeneeskunde
- Dr A. (Anita) Vreugdenhil, kinderarts, Maastricht Universitair Medisch Centrum, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. S. (Saskia) Bouma -De Jongh, kinderarts, De Kinderartsenpraktijk, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. M. (Marja) van der Vorst, kinderarts-klinisch farmacoloog, St Antonius, Utrecht/ Nieuwegein, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.J. (Arieke) Janse, kinderarts, Ziekenhuis Gelderse Vallei, Ede, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. M. (Malika) Chegary, kinderarts, Onze Lieve Vrouwe Gasthuis, Amsterdam, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. F.M.H. (François) van Dielen, chirurg, Maxima MC, Eindhoven, Nederlandse Vereniging voor Heelkunde
- Prof. dr. L.W.E. (Ernst) van Heurn, (kinder)chirurg, Amsterdam UMC, Amsterdam, Nederlandse Vereniging voor Heelkunde
- Dr. L.J.M. (Loek) de Heide, internist-endocrinoloog, Medisch Centrum Leeuwarden, Leeuwarden, De Nederlandse Internisten Vereniging
- Drs. J.W.J. (Willy) Jubels-Hatenboer, Nederlandse Stichting Over Gewicht, Haarlem
- Drs. R. (Ramona) Leysner, diëtist, Behandelcentrum Merem, Hilversum, Nederlandse Vereniging van Diëtisten
- Dr. E. (Eveliene) Dera-de Bie, docent Verpleegkunde, Zuyd Hogeschool, Heerlen, Beroepsvereniging Verpleegkundigen & Verzorgenden Nederland
- Drs. S. (Sanne) Laurijssen, GZ-psycholoog, Elisabeth-TweeSteden Ziekenhuis, Tilburg, het Nederlands Instituut van Psychologen
- Drs. M.G.M. (Margreet) van den Berg, GZ-psycholoog, Jeroen Bosch ziekenhuis, Den Bosch, het Nederlands Instituut van Psychologen
- Dr. I. (Irene) Peters, Arts M&G, Jeugdarts GGDrU, Utrecht, AJN Jeugdartsen Nederland
- Drs. M. (Marloes) Meurs, kinderfysiotherapeut, Bewegingscentrum Junior, Groningen, Koninklijk Nederlands Genootschap voor Fysiotherapie en Nederlandse Vereniging voor Kinderfysiotherapie
Klankbordgroep
- Dr. J. (Jutka) Halberstadt, universitair docent kinderobesitas, landelijk projectmanager Care for Obesity, Vrije Universiteit Amsterdam
- Drs. R. (René) Glijsteen, huisarts, Huisartsenpraktijk Kloppenborg&Glijsteen, Rotterdam, Nederlandse Huisartsen Genootschap
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. (Stefanie) Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van den Akker (voorzitter) |
Kinderarts Erasmus MC |
Geen |
Clinical trial fase III setmelatonide (Rhythm) voor patiënten met monogenetische obesitas Europees verband, gefinancierd door Rhythm Pharmaceuticals, Inc. |
Geen |
|
Van Mil (vice-voorzitter) |
Kinderarts-endocrinoloog Jeroen Bosch ziekenhuis Bijzonder hoogleraar Jeugd, Voeding en Gezondheid aan de Universiteit Maastricht |
Behandeld arts en initiatiefnemer Expertise Centrum Kinderen met Obesitas in het Jeroen Bosch ziekenhuis, dat tevens fungeert als 'best practise' voor het VWS proeftuinen project 'ketenaanpak voor kinderen met overgewicht'. Vakgroep Kindergeneeskunde wordt vergoed voor de uren die dit project worden gemaakt |
Mede auteur van het boek 'Overgewicht en Obesitas bij Kinderen. Verder kijken dan de kilo's (ISBN 9789089534262), dat de basis vormt van het landelijk model voor ketenaanpak voor kinderen met overgewicht.
Betrokken bij de BASIC trial, gefinancieerd door MUMC.
Deelnemer aan de onderzoeksgroep van een wetenschappelijk studie naar het effect van bariatrische chirurgie bij adolescenten met overgewicht. De studie is genaamd: Laparoscopie Roux-en-Y Gastric Bypass Equipoise Laparoscopie Sleeve Gastrectomy for Severe Obesity in Teenagers: a Randomized Controlled Trial.
Deelnemer aan de onderzoeksgroep van een wetenschappelijk studie naar het effect van metformine bij adolescenten met overgewicht. De studie is genaamd: An efficacy, safety and pharmacokinetic study on the short-term and long-term use of METFORMIN in obese children and adolescents.
|
Geen |
|
De Groot |
AIOS kindergeneeskunde LUMC/Groene Hart Ziekenhuis |
Binnen het GHZ betrokken bij onderwijscommissie van de afdeling kindergeneeskunde |
Promotieonderzoek werd deels gefinancieerd door Nutricia Early Life Nutrition. Dit betrof een 'unrestricted grant'. Dat wil zeggen dat Nutricia Early Life Nutrition geen invloed had op het onderzoek dat ik verrichte, of zeggenschap had over het al dan niet publiceren van de resultaten. Mijn onderzoek richtte zich op neuroradiologische aspecten van obesitas. Er was derhalve ook geen direct financieel belang voor Nutricia bij de resultaten van mijn onderzoek. Er is geen nog lopend onderzoek van mij wat gefinancierd wordt door Nutricia. Er is momenteel geen enkele financiële afhankelijkheid van hen. |
Geen |
|
Vreugdenhil |
Kinderarts MDL, vakgroep Kindergeneeskunde, Maastricht UMC+ , Oprichter Centre for Overweight Adolescent and Childrens Healthcare van het Maastricht UMC+ |
Geen |
Mede onderzoeker in de BASIC trial en de TEENBEST studie |
Geen |
|
Bouma-de Jongh |
Kinderarts Van Weel Bethesda ziekenhuis |
Richtlijn bacterie NVVIT |
Geen |
Geen |
|
Van der Vorst |
Kinderarts-klinisch farmacoloog St. Antonius ziekenhuis Utrecht/Nieuwegein |
Geen |
Hoofdonderzoeker: M.M.J. van der Vorst. studienummer: NL34811.100.11. 'Metformin' wetenschappelijke studie naar het effect van metformine bij adolescenten met overgewicht. De studie is genaamd: An efficacy, safety and pharmacokinetic study on the short-term and long-term use of METFORMIN in obese children and adolescents. |
Geen |
|
Janse |
Kinderarts en klinische epidemioloog B. Werkgever: Ziekenhuis Gelderse Vallei |
Geen |
Hoofdonderzoeker A.J.Janse studienummer NL50601.029.14. Randomized Controlled Trial Solid food in preterm infants and the effect on obesity in the Netherlands (SPOON). Gefinancieerd middels samenwerkingsbijdrage Nutricia. Geen belang bij uitkomst onderzoek |
Geen |
|
Chegary |
Kinderarts OLVG Amsterdam |
Geen |
Geen |
Geen |
|
Van Dielen |
Bariatrisch chirurg |
0.0 fte aanstelling in het Mumc+ als gastoperateur voor de BASIC trial. Betaald |
Gastroperateur van de BASIC trial en derhalve hierbij actief betrokken. - Principal investigator van een internationale multicenter prospectief gerandomiseerde studie gastric sleeve versus. gastric bypass in adolescenten. (TEEN-Best). |
Geen |
|
Van Heurn |
Kinderchirurg, hoogleraar kinderchirurgie AMC en VUMC |
Geen |
Hoofdonderzoeker BASIC trial: onderzoek naar bariatrische Chirurgie/ leefstijlinterventies bij adolescenten gefinancierd door MUMC. Geen belang bij de uitkomst van het onderzoek. |
Geen |
|
De Heide |
Internist-Endocrinoloog, Medisch Centrum Leeuwarden, in dienst van MSB-VCL, 50% |
1 dagdeel per week in dienst van CON, Centrum Obesitas Nederland, Leeuwarden, onbetaald, protocollering postoperatieve zorg na bariatrie, wetenschappelijk onderzoek |
Geen |
Geen |
|
Jubels-Hatenboer |
Part-time werkzaam bij marketing in de & communicatie bij Jubels B.V. |
Sinds sept 2014 actief lid van de Technische Commissie bij de Zandvoortsche Hockeyclub. En sinds 2018 bestuurslid bij de Nederlandse Stichting Over Gewicht. |
Dochter met genetische obesitas (leptinereceptor deficiëntie) maar zij zal niet gebaat zijn bij een bariatrisch chirurgische ingreep. |
Geen |
|
Leysner |
Dietist behandelcentrum Merem Hilversum |
Lid landelijk netwerk van diëtisten die gespecialiseerd zijn in de behandeling van overgewicht en (morbide) obesitas met bijbehorende co-morbiditeit (KDOO) (onbetaald) |
Geen |
Geen |
|
Dera-de Bie |
Docent Verpleegkunde (0,8) en lid lectoraat wijkgerichte zorg (0,2) Zuyd Hogeschool Heerlen |
Redactielid Tijdschrift JGZ Lid V&VN, maatschappij en gezondheid |
Geen |
Geen |
|
Laurijssen |
GZ-psycholoog en cognitief gedragstherapeut Elisabeth Tweesteden ziekenhuis Tilburg |
Gastdocent Tilburg University |
Geen |
Geen |
|
Van den Berg |
Gz-psycholoog, RVE Kindergeneeskunde, Jeroen Bosch Ziekenhuis GGZ-Oostbrabant afdeling eetstoornissen |
Geen |
Als Gz-psycholoog verbonden aan het zorgpad overgewicht binnen het Jeroen Bosch Ziekenhuis. Betrokken bij indicatiestelling voor behandeling. |
Geen |
|
Peters |
Arts Maatschappij en Gezondheid, jeugdarts bij GGDrU. |
Geen |
Geen |
Geen |
|
Meurs
|
Kinderfysiotherapeut, voorzitter Nederlandse Vereniging voor Kinderfysiotherapie, eigen kinderpraktijk, begeleidt en behandelt kinderen met obesitas in een eerstelijns GLI. |
Geen |
Geen |
Geen |
|
Halberstadt |
Universitair docent kinderobesitas/ Landelijk projectmanager Care for Obesity, Vrije Universiteit Amsterdam |
Geen |
Care for Obesity leverde in 2018 met financiering van het ministerie van VWS het landelijk model ketenaanpak voor kinderen met overgewicht en obesitas op. Vanaf 2019 vormt Care for Obesity /de Vrije Universiteit Amsterdam met vier andere landelijke partijen de coalitie voor de ketenaanpak voor kinderen met overgewicht en obesitas. Deze coalitie werkt met financiering van het ministerie van VWS aan de borging, implementatie, doorontwikkeling en evaluatie van het landelijk model. |
Geen |
|
Glijsteen |
Huisarts zelfstandig in maatschap 3-3,5 dag NAP Kloppenberg& Glijsteen en Huisarts docent staflid Huisartsopleiding UMC 1,5 dag |
Wedstijdsecretaris V.O.C. incident Rotterdam Onbetaald Lid raad van toezicht van PRIMEUR database (onbetaald) |
Geen |
Geen |
|
Mostovaya |
Senior adviseur |
Geen |
Geen |
Geen |
|
Hofstede |
Senior adviseur |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Nederlandse Stichting Over Gewicht.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn-(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse vereniging voor Heelkunde, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Obstetrie en Gynaecologie, Care for Obesity, Jeugdartsen Nederland, Verpleegkundigen & Verzorgenden Nederland, Koninklijk Nederlands Genootschap voor Fysiotherapie, Nederlandse Vereniging voor Kinderfysiotherapie, Kind & Ziekenhuis, Inspectie Gezondheidszorg en Jeugd, Partnerschap Overgewicht Nederland, Nederlandse Obesitas Kliniek, Zelfstandige Klinieken Nederland, Zorginstituut Nederland en RA-Medical via een Invitational conference. Dit was een gecombineerde Invitational conference voor twee richtlijnen; (1) behandeling van kinderen met obesitas en (2) chirurgische behandeling van obesitas. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk
te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties, waaronder de partijen die zijn uitgenodigd voor de invitational conference, voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., et al. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Link: http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., et al. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1998 – november 2018
|
1 exp *PEDIATRIC OBESITY/ (5105) 2 (obese or obesity or overweight* or weight*).ti,ab. (1098818) 3 (child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).ti. (1409398) 4 2 and 3 (117312) 5 1 or 4 (118124) 6 exp Life Style/ or exp Child Behavior/ or (parental counseling or lifestyle or behavioural or behavioral or motivational or personalised).ti,ab. (479741) 7 (combin* or multidisciplinary or multi-component or multi component or multiple or interdisciplinary).ti,ab. (2697539) 8 (intervention* or therap* or treatment*).ti,ab. (5930232) 9 5 and 6 and 7 and 8 (1078) 10 limit 9 to (english language and yr="1998 -Current") (978) 11 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (375961) 12 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1807938) 13 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3079681) 14 10 and 11 (130) 15 10 and 12 (429) 16 15 not 14 (345) 17 10 and 13 (341) 18 17 not 14 not 16 (193) 19 14 or 16 or 18 (668) = 668 |
822 |
|
Embase (Elsevier) |
('childhood obesity'/exp/mj OR ((obese:ti,ab OR obesity:ti,ab OR overweight*:ti,ab OR weight*:ti,ab) AND (infan*:ti OR newborn*:ti OR 'new born*':ti OR perinat*:ti OR neonat*:ti OR 'baby'/exp/mj OR baby*:ti OR babies:ti OR toddler*:ti OR 'minors'/exp/mj OR minors*:ti OR 'boy'/exp/mj OR boy:ti OR boys:ti OR boyfriend:ti OR boyhood:ti OR girl*:ti OR kid:ti OR kids:ti OR 'child'/exp OR child*:ti OR children*:ti OR schoolchild*:ti OR 'schoolchild'/exp/mj OR adolescen*:ti OR juvenil*:ti OR youth*:ti OR teen*:ti OR pubescen*:ti OR pediatric*:ti OR paediatric*:ti OR peadiatric*:ti OR school:ti OR school*:ti OR prematur*:ti OR preterm*:ti OR 'pediatrics'/exp/mj))) AND ('lifestyle intervention'/exp OR 'child behavior'/exp OR 'parental counseling':ti,ab OR lifestyle:ti,ab OR behavioural:ti,ab OR behavioral:ti,ab OR motivational:ti,ab OR personalised:ti,ab) AND (combin*:ti,ab OR multidisciplinary:ti,ab OR 'multi-component':ti,ab OR 'multi component':ti,ab OR multiple:ti,ab OR interdisciplinary:ti,ab) AND (intervention*:ti,ab OR therap*:ti,ab OR treatment*:ti,ab) AND [1998-2018]/py AND [english]/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 131
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 364
Observationeel onderzoek: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 105
= 600 |
