Prognostische factoren voor ernstig beloop influenza
Uitgangsvraag
Bij welke patiënten moet men alert zijn op een ongunstig beloop van influenza?
Met patiënten wordt bedoeld:
- Niet-opgenomen patiënt: poliklinische patiënten, patiënten op de SEH, patiënten in het verpleegtehuis. De patiëntenpopulatie in de huisartsenpraktijk valt vooralsnog buiten deze richtlijn.
- Opgenomen patiënt: patiënt opgenomen in een ziekenhuis.
Aanbeveling
Overweging ziekenhuisopname bij bepaalde risicogroepen
Een opname kan overwogen worden bij patiënten met onderstaande risicofactoren bij verdenking op influenza:
- oudere patiënten (≥ 60 jaar);
- volwassen patiënten met immuunsuppressie, maligniteit, chronische longziekten, neuromusculaire aandoeningen of obesitas;
- kinderen met neuromusculaire aandoeningen of diabetes.
Voor de volgende risicogroepen is onvoldoende dan wel te beperkt bewijs gevonden voor een slecht beloop:
- zwangeren;
- kinderen < 2 jaar in het bijzonder zuigelingen.
Overweeg diagnostiek en eventueel behandeling bij bepaalde risicogroepen
Overweeg diagnostiek, en in afwachting van de uitslag overweeg therapie bij de onderstaande patiëntengroepen met influenza-like-ilness:
- Oudere patiënten (≥ 60 jaar).
- Volwassen patiënten met immuunsuppressie, maligniteit, chronische longziekten, neuromusculaire aandoeningen of obesitas.
- Kinderen met neuromusculaire aandoeningen of diabetes.
Voor de volgende risicogroepen is onvoldoende dan wel te beperkt bewijs gevonden voor een slecht beloop:
- zwangeren;
- kinderen < 2 jaar in het bijzonder zuigelingen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De huidige literatuuranalyse wordt ernstig gehinderd door methodologische tekortkomingen. Veel studies zijn verricht in centra met een specifieke populatie; Bijvoorbeeld oncologische centra, centra met kinderen met een neurologische ziekte. Deze centra hebben geen vergelijk gemaakt met de normale populatie in de samenleving en daarom is moeilijk te achterhalen of mortaliteit of complicaties echt hoger zijn dan in de gemiddelde populatie. Een ander probleem is selectieve rapportage over patienten uit surveillancedata, waarbij onbekend is waarom bij die personen diagnostiek gedaan is en waarbij lijkt dat ernst van ziekte of langere duur van symptomen bepaalden dat een patient niet naar de eerstelijnszorg ging maar naar het ziekenhuis (Dimitreijevic, 2017). Welke bijdrage een onderliggende aandoening bij het besluit tot eerste hulpbezoek, of –verwijzing, of opname in het ziekenhuis speelde en in welke kwantitatieve mate, is dan moeilijk te bepalen.
In de huidige literatuuranalyse werd mortaliteit daarom als primaire uitkomstmaat gekozen, omdat deze minder onderhevig is aan variatie dan bijvoorbeeld indicatiestelling voor ziekenhuisopname bij ILI of IC-opname bij ILI of influenza. Deze indicatiestellingen zijn vaak subjectief en regionaal bepaald.
Consistent blijkt dat hogere leeftijd als onafhankelijke variabele is geassocieerd met een verhoogd risico op IC-opname en/of mortaliteit. Omdat de onderzoeken verschillende leeftijdsgroepen met elkaar vergeleken (jonger of ouder dan 50 jaar of 65 jaar) of vaststelden dat de leeftijdgroep 55-65 jaar het meest risico had op ernstig beloop van influenza, kan geen minimum leeftijd worden gedefinieerd waaronder er geen risico bestaat. Wel blijkt dat toename van leeftijd meer risico’s geeft op complicaties. De werkgroep concludeert daarom praktisch dat vanaf een leeftijd van 60 jaar er een toegenomen risico is op gecompliceerd beloop van influenza.
Mortaliteit
Mortaliteit varieerde in de verschillende onderzoeken en was voor de totale groep opgenomen kinderen (zowel ziekenhuis- als IC-opname) 0,2 tot 10,0% en bij opgenomen volwassenen 5,3 tot 11,2%. In drie onderzoeken werd de mortaliteit bij op de IC opgenomen patiënten gemeld tussen 2,6 tot -26,6%. Deze variatie geeft al aan hoe divers de onderzoeken en patiëntenpopulaties lijken te zijn.
Om te bepalen of een onderliggende aandoening het risico op overlijden ten gevolge van een influenza-infectie vergroot, is onderzoek bij in het ziekenhuis opgenomen patiënten met een bewezen influenza-infectie het meest verhelderend. Immers, alleen binnen de groep van influenza-geïnfecteerde patiënten wordt dan gekeken wat het beloop is bij patiënten die onderling verschillen in co-morbiditeit of leeftijd.
Bij kinderen is hier geen onderzoek naar gedaan. Wel is onderzocht of er aandoeningen zijn die statistisch geassocieerd zijn met een gecombineerd eindpunt namelijk; IC-opname en/of dood (Labeaud, 2013; Chaves, 2013). In beide onderzoeken was de mortaliteit zeer laag: respectievelijk 1,5% en 0,2%). Feitelijk is dit dus een onderzoek naar de associatie tussen IC-opname en onderliggende aandoeningen. Dit bleek voor neuromusculaire aandoeningen en chronisch metabole ziekte (onder andere diabetes) in één onderzoek het geval te zijn. Beide aandoeningen kwamen bij de groep met gecompliceerd beloop ruim driemaal vaker voor dan in patiënten met gunstiger beloop.
Bij volwassenen die opgenomen waren met een bewezen influenza-infectie bleek dat co-morbiditeit geassocieerd was met mortaliteit in drie onderzoeken. In één onderzoek was co-morbiditeit gedefinieerd als de aanwezigheid van één van de aandoeningen waarvoor de jaarlijkse influenzavaccinatie geïndiceerd is, dus dat geeft geen inzicht in welke van die specifieke onderliggende aandoeningen. In twee andere onderzoeken is er wel gekeken naar afzonderlijke aandoeningen; naast leeftijd boven 50 of 65 jaar waren immuunsuppressie en maligniteit geassocieerd met mortaliteit.
De bewijskracht voor associatie is laag, maar dit zijn de enige bevindingen uit deze literatuuranalyse waarmee een risicoschatting gemaakt kan worden voor mortaliteit ten gevolge van influenza. Voor zowel de categorie immuunsuppressie als voor de categorie maligniteit is onduidelijk of de verhoogde mortaliteit bepaald wordt door specifieke subgroepen daarbinnen of dat het diffuus in deze twee brede ziektecategorieën aanwezig is.
Als er gekeken wordt naar de associatie tussen mortaliteit en aanwezigheid van aandoeningen bij ILI, dan is dit een minder betrouwbare maat om de bijdrage van influenza daarbij te bepalen, omdat maar een deel van de ILI patiënten uiteindelijk influenza heeft. Slechts één onderzoek vergeleek volwassen patiënten uit de eerstelijnszorg met patiënten die zich in het ziekenhuis presenteerden (Dimitreijev, 2017). Mortaliteit werd in dit onderzoek echter niet vermeld, maar alleen ziekenhuis- of IC-opname en de factoren die daarmee geassocieerd waren (leeftijd, chronische luchtwegaandoeningen, astma, diabetes, chronische hartziekten, nieraandoeningen en immuunsuppressie. In hoeverre deze Servische studie, die gebaseerd is op surveillance-data van een selectie van eerste en tweedelijns centra, vertaalbaar is naar de Nederlandse situatie is onduidelijk.
IC-opname
Een secundaire uitkomstmaat is IC-opname, die een indicatie is van de ernst van infectie. Deze werd als belangrijk gekwalificeerd in onze analyse. Zoals boven uitgelegd, bleken in één onderzoek bij opgenomen kinderen met een bewezen influenza-infectie neuromusculaire aandoeningen en chronisch metabole ziekte (onder andere diabetes) significant geassocieerd met IC-opname (Chaves, 2013). In het onderzoek van Dimtreijev was IC opname significant geassocieerd met aanwezigheid van COPD, astma, DM, CVD, nierziekte, neurologische aandoeningen, immuunsuppressie en obesitas, onafhankelijk van de leeftijd van de patiënten. Hierbij werden IC-patiënten vergeleken met patiënten die zich alleen op in de eerste lijn hadden gepresenteerd, maar patienten op de IC waren al veel langer ziek en onbekend is hoeveel patienten vanuit de eerste lijn tenslotte in het ziekenhuis waren opgenomen vanwege verslechtering van klinische conditie.
Bij twee andere onderzoeken was de uitkomstmaat voor ernstige ziekte een gecombineerd eindpunt van IC-opname en/of dood, maar beiden rapporteerden een lage mortaliteit: 3.9% (Chaves, 2013) en 5.3% (Myles, 2012). Feitelijk is dus ook hier IC-opname de belangrijkste uitkomst. Die was significant geassocieerd met aanwezigheid van chronische longziekten en neuromusculaire aandoeningen (Chaves, 2013) en met longaandoeningen anders dan astma of COPD, neurologische aandoeningen en obesitas (Myles, 2012).
Ook al is de bewijslast hiervan laag, bij de afweging om een patiënt met ILI op te nemen zou de aanwezigheid van deze onderliggende aandoeningen kunnen meespelen gezien het risico op een ernstiger beloop, danwel IC-opname, bij patiënten met dit brede spectrum van aandoeningen.
In geen van deze onderzoeken werd gemeld dat zwangerschap een risicofactor was voor IC-opname.
Ziekenhuisopname
Tenslotte is ook onderzocht of ziekenhuisopname geassocieerd is met onderliggende aandoeningen. Helder is dat hierbij niet alleen de aanwezigheid van aandoeningen die mogelijk geassocieerd zijn met een ernstiger beloop van influenza een rol speelt. Immers, ook andere factoren die wijzen op een ernstiger infectie hadden een significante associatie met opname: klinische symptomen zoals dyspnoe of tachycardie, de duur van symptomen van meer dan 3 dagen en radiologische aanwijzingen voor pneumonie.
Beperkingen
De resultaten uit het literatuuronderzoek vanuit de PICO wijken af van de standaard influenzavaccinatie-indicaties of komen daar maar deels overeen. Dat komt omdat de gehanteerde zoekvraag niet uitging van de vraag of influenzavaccinatie gecompliceerd beloop bij specifieke patientengroepen kan voorkomen, maar alleen beoordeelde of er onderzoeken zijn waarmee kan worden vastgesteld of er factoren zijn die bijdragen aan een gecompliceerd beloop van influenza.
De wisselende uitkomsten voor de verschillende aandoeningen per onderzoek uit dit literatuuronderzoek en de verschillen met de indicaties voor jaarlijkse influenzavaccinatie ontstaan, omdat er een interactie is tussen een onderliggende aandoening, ernst van ziekte c.q. symptomatologie, leeftijd, toegang tot zorg, verschillende vaccinatiepercentages tussen populaties per land, verschillen in virusstrains qua virulentie en (empirisch) gebruik van antivirale therapie.
Methodologisch zijn er daarnaast beperkingen bij de data uit deze onderzoeken. Geen van de studies heeft het predictiemodel voor ongunstig beloop intern gevalideerd of in een externe setting. Daarom werd de bewijskracht verlaagd vanwege de fase van het onderzoek omdat de resultaten moeilijk te extrapoleren zijn: de prognostische factoren zijn allemaal in een specifieke studiesetting onderzocht (multivariate modellen zonder validatie). Daarnaast werden er nauwelijks confounders van tevoren gedefinieerd. Het meeste onderzoek werd retrospectief uitgevoerd, wat het beantwoorden van de uitgangsvraag bemoeilijkt.
Er zijn beperkingen in de definitie van onderliggende aandoeningen, omdat er subgroepen bestaan in de ziektecategorieën die een sterk afwijkend risico kunnen hebben, die nu niet goed geïdentificeerd zijn. Bijvoorbeeld hematologische maligniteiten binnen de ziektecategorie kanker.
Een andere factor die bij de risicoschatting nu niet goed is geadresseerd is zijn de secundaire consequenties van een virale luchtweginfectie. Nu blijkt bijvoorbeeld dat aanwezigheid van onderliggende cardiovasculaire aandoeningen niet leidt tot een verhoogd risico op mortaliteit of IC-opname. Echter, virale luchtweginfecties en vooral influenza geven in de eerste week na de infectie een verhoogd risico op myocardinfarct bij patiënten met pre-existent coronair lijden (Kwong, 2018). Dat werd in deze cohorten niet afzonderlijk onderzocht.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Op basis van de bovenstaande gegevens dienen volwassen patiënten en verzorgers van patiënten geattendeerd te worden op een mogelijk ernstig beloop van influenza als er sprake is van immuunsuppressie of maligniteit, met daarbij een verhoogd risico op ernstig beloop en/ of overlijden. Ook als er sprake is van chronische longziekten, neuromusculaire aandoeningen en obesitas is er een verhoogd risico op ernstig beloop en/ of IC-opname. Het belang van jaarlijkse influenzavaccinatie kan hiermee beter worden gewogen in patiënten of hun verzorgers met deze aandoeningen, vooral als dit ook nog patiënten op leeftijd zijn. Vanwege afgenomen vaccin effectiviteit op hogere leeftijd of na toediening tijdens immuunsuppressie of chemotherapie, blijft er een verhoogd risico op gecompliceerd beloop van infectie bij deze patiënten.
Tijdige presentatie in de eerstelijn of eerste hulp voor diagnostiek en zo mogelijk vroege start van antivirale therapie is bij deze patiënten van belang.
Bij verzorgers van kinderen met neuromusculaire aandoeningen, waaronder cerebrale parese, en chronisch metabole ziekte (onder andere diabetes) gelden overeenkomstige afwegingen om zo het risico op een gecompliceerd beloop van influenza te verminderen.
Kosten (middelenbeslag)
Niet relevant.
Aanvaardbaarheid, haalbaarheid en implementatie
Niet relevant.
Zwangerschap en risico op gecompliceerd beloop van influenza
Het literatuuronderzoek gaf met de gebruikte zoekcriteria zeer beperkte data over het beloop van influenza bij zwangeren. Dat kwam omdat bij de meerderheid van de onderzoeken zwangeren niet waren geïncludeerd of zwangerschap maar sporadisch voorkwam in de beschreven cohorten. Alleen in het onderzoek van Lynfield (2014) bleek dat ziekenhuisopname was geassocieerd met aanwezigheid van zwangerschap bij patiënten. De auteurs gaven aan dat dit kon wijzen op een lagere drempel tot opname. Bij de opgenomen zwangere patiënten met A(H1N1)pdm09 infectie was er geen significant verhoogd risico op ‘ziekteprogressie’ (gedefinieerd als dood, IC opname en/of mechanische ventilatie of ziekenhuisopname langer dan 28 dagen). Hierbij werd niet duidelijk of influenza infectie bij zwangerschap vaker leidt tot negatieve zwangerschapsuitkomsten, zoals vroeggeboorte.
Sinds 2012 beveelt de WHO influenzavaccinatie aan bij zwangere vrouwen (https://www.who.int/wer/2012/wer8747.pdf?ua=1). Zij baseren zich op surveillancedata uit de VS waaruit bleek dat influenzavaccinatie de kans vroeggeboorte bij zwangere vrouwen vermindert (Omer, 2011) en op observationele ziekenhuisdata uit de VS waarbij zwangere vrouwen met influenza (n=62) vaker opgenomen werden en er bij ernstige influenza-infecties veel risico was op complicaties voor de neonaat (Creanga, 2010). In dat onderzoek bleek ook dat hoe later na start van symptomen werd begonnen met behandeling met oseltamivir hoe meer risico er was op een ernstiger beloop (IC-opname of dood). Ook wordt er in het WHO-document gerefereerd aan een systematische review over uitkomsten specifiek van pandemische influenza A (H1N1, 2009) bij zwangerschap (Mosby, 2011). Daarin werden uit 120 publicaties data over 3110 zwangere vrouwen gevonden, waarvan 52% werden opgenomen in het ziekenhuis, 23% op de IC en 8% overleed. De prevalentie van zwangerschap in de volwassenen bevolking is ongeveer 1%. Echter, onder alle opgenomen patiënten met influenza was 6% zwanger en ook 6% van de IC-opnames vanwege gecompliceerde influenza was een zwangere vrouw 6% van aan influenza overleden patiënten was een zwangere vrouw. Of dit veroorzaakt wordt door de zwangerschap of door additionele risicofactoren (astma, diabetes, obesitas) is niet bekend. Echter, in die systematische review bleek uit 3 observationele onderzoeken alleen dat zwangerschap consistent significant was geassocieerd met opname in het ziekenhuis, conform onze bevindingen. Zwangerschap was slechts significant geassocieerd met IC-opname in 4 van 7 observationele onderzoeken en in géén enkel onderzoek met overlijden. Mogelijk is dit een gevolg van onderzoek bij relatief kleine cohorten, waarbij vrouwen van 20 tot 45 jaar met of zonder zwangerschap maar een klein deel van uitmaakten, zodat de risico’s op ernstig beloop bij zwangerschap niet goed te bepalen zijn. In deze systematische review was ook surveillancedata opgenomen uit de VS waarin 788 zwangere vrouwen met influenza (Siston, 2010). Hieruit bleek dat behandeling met oseltamivir later dan 2 dagen na start van symptomen vaker leidde tot IC-opname en overlijden.
Over de uitkomst van de zwangerschap bij optreden van een influenza-infectie leverden slechts drie van de vier onderzoeken voldoende data, omdat er in de database van die onderzoeken meer dan 50 zwangerschapsuitkomsten per cohort waren opgenomen. Normaal is de prevalentie van preterme geboorte 9.6% wereldwijd, maar in deze cohorten was dat door de influenza-infectie verhoogd tot > 30% (zowel spontaan als iatrogeen).
Een tweede, latere meta-analyse van observationele onderzoeken naar de uitkomsten bij zwangerschap en influenza-infectie vond 142 onderzoeken, waarvan de meerderheid (n=125) weer over pandemische influenza A 2009 H1N1 (Mertz, 2017). Hier bleek uit de observationele data in cohorten in de ambulante setting en bij presentatie op de eerste hulp, dat zwangerschap ook weer significant geassocieerd was met opname in het ziekenhuis. Echter, niet bepaald kon worden of dat kwam omdat deze vrouwen ernstiger ziek waren of dat deze vrouwen uit voorzorg werden opgenomen. Zwangerschap was niet significant geassocieerd met IC-opname of overlijden. Mogelijkerwijs hebben die zwangere vrouwen ook nog andere risicofactoren (astma, diabetes of obesitas), waardoor zwangerschap zelf beperkt of geheel niet bijdraagt aan een verhoogd risico op IC-opname of overlijden.
In deze meta-analyse werd niet gerapporteerd over de uitkomsten van de zwangerschap.
Geconcludeerd kan worden dat op basis van cohortonderzoek niet kan worden aangetoond dat zwangerschap geassocieerd is met IC-opname of overlijden, maar wel met ziekenhuisopname. Onbekend is of dat gerelateerd is met ernst van infectie, of omdat zwangere vrouwen uit voorzorg eerder worden opgenomen. Traditionele risicofactoren (astma, diabetes, obesitas) bij zwangere vrouwen verhogen ook het risico op een gecompliceerd beloop. Deze uitkomsten zijn vastgesteld voor pandemische influenza, terwijl voor seizoensinfluenza met andere virusstrains die data ontbreekt. Uit surveillance lijkt wel dat influenza vaker leidt tot IC-opname en overlijden bij zwangere vrouwen, maar deze surveillancedata zijn methodologisch minder sterk dan vergelijkende cohortonderzoeken met daarin individuele data van patiënten. Ook al lijkt er geen of beperkt verhoogd risico op gecompliceerd beloop bij de zwangeren zelf, er lijkt wel een verhoogd risico op preterme bevalling ten gevolge van influenza-infectie bij zwangerschap (zowel spontaan als iatrogeen).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Overweeg ziekenhuisopname bij bepaalde risicogroepen
Bij de overweging een patiënt met ILI in het influenza-seizoen op te nemen, dient te worden meegenomen dat volwassen patiënten op oudere leeftijd en patiënten met immuunsuppressie, maligniteit, chronische longziekten, neuromusculaire aandoeningen en obesitas een ernstiger beloop kennen van influenza-infectie. Dat geldt ook voor kinderen met neuromusculaire aandoeningen, waaronder cerebrale parese, en chronisch metabole ziekte, zoals diabetes. Een lagere drempel tot opname, verrichten van diagnostiek en starten van antivirale therapie zou bij hen kunnen worden gehanteerd, totdat helder is wat de verwekker is van ILI en er sprake is van klinische verbetering.
Overweeg diagnostiek en eventueel behandeling bij bepaalde risicogroepen
Bij volwassen patiënten op oudere leeftijd en patiënten met immuunsuppressie, maligniteit, chronische longziekten, neuromusculaire aandoeningen en obesitas die zich presenteren met ILI in het influenza-seizoen kan in afwachting van diagnostiek alvast antivirale therapie worden gestart. Deze kan bij verkrijgen van een negatieve uitslag en/of een alternatieve diagnose worden gestaakt. Zo kunnen vooral bij deze groep kwetsbare patiënten antivirale middelen rationeel worden gebruikt, omdat bij hen de ziektelast van influenza zonder behandeling of bij late start van behandeling het hoogst is. Dezelfde overwegingen gelden bij kinderen met neuromusculaire aandoeningen, waaronder cerebrale parese, en chronisch metabole ziekte (onder andere diabetes). Ondanks dat deze aanbeveling tot vroeg gebruik van antivirale middelen bij een patiënt met één of meerdere van deze onderliggende aandoeningen beperkte bewijskracht heeft in de literatuur, is er gezien het relatief milde bijwerkingenpatroon van de huidige generatie antivirale middelen geen zwaarwegende contra-indicatie hierbij.
Onderbouwing
Achtergrond
Influenza kan ernstig verlopen. Daarom worden personen gevaccineerd tegen influenza boven een bepaalde leeftijd en als er specifieke medische aandoeningen zijn. De onderbouwing hiervoor is niet de insteek van dit hoofdstuk, want dan zou moeten worden onderzocht of vaccinatie bij specifieke patientengroepen het risico op een gecompliceerd beloop vermindert. In dit hoofdstuk onderzoeken we alleen of er bepaalde patiëntgebonden risicofactoren zijn die een verhoogd risico geven op een ernstig beloop van de infectie. Deze risicofactoren kunnen zijn leeftijd, onderliggende aandoeningen, gebruik van immuunsuppressiva of zwangerschap. Een ernstig beloop wordt door ons gedefinieerd als ziekenhuisopname, IC-opname en mortaliteit ten gevolge van de influenza infectie. De aanname is dat het vooral bij deze personen noodzakelijk is diagnostiek te verrichten en zo vroeg mogelijk behandeling te initiëren om een ongunstig beloop te voorkomen. Deze module geeft richting aan de te ondernemen stappen in aanloop naar een bewezen influenza diagnose.
Conclusies / Summary of Findings
Prognostische factoren voor slechte uitkomst (zie uitkomstmaat) bij personen met ILI of influenza die zich in de algemene populatie, het verpleeghuis of eerste hulp presenteerden:
Kinderen - mortaliteit (1.1.1 - cruciaal)
|
Zeer laag GRADE |
De aanwezigheid van cerebrale parese/ontwikkelingsachterstand lijkt geassocieerd met toegenomen mortaliteit bij kinderen met ILI die zich op de eerste hulp presenteerden, maar de bewijskracht daarvoor is beperkt.
Bronnen: (Dalziel, 2013) |
Kinderen - ziekenhuisopname (1.1.2 - belangrijk)
|
Laag GRADE |
De aanwezigheid van ontwikkelingsachterstand lijkt niet geassocieerd met ziekenhuisopname bij kinderen met bewezen influenza die zich bij de eerste hulp presenteerden.
Bronnen: (Bender, 2009; Garcia, 2015) |
Kinderen - mortaliteit en/of IC-opname (1.1.3 - cruciaal)
|
Zeer laag GRADE |
De aanwezigheid van een chronische longaandoening of cerebrale parese-ontwikkelingsachterstand lijkt geassocieerd met toegenomen mortaliteit en/of IC-opname bij kinderen met ILI die zich op de eerste hulp presenteerden, maar de bewijskracht daarvoor is beperkt.
Bronnen: (Dalziel, 2013) |
Volwassenen - mortaliteit (1.2.1 - cruciaal)
|
- GRADE |
Er werd géén van de in deze PICO gedefinieerde prognostische factoren (leeftijd, comorbiditeit, immuungecompromitteerd) geïdentificeerd voor de uitkomstmaat mortaliteit bij volwassenen. |
Volwassenen - ziekenhuisopname en/of IC-opname (1.2.2 - belangrijk)
|
Laag GRADE |
Aanwezigheid van de factoren leeftijd vanaf 65 jaar, chronische luchtwegaandoeningen inclusief astma, chronische hartaandoeningen, diabetes mellitus, chronische nieraandoeningen of immuungecompromitteerd lijkt geassocieerd met ziekenhuisopname en/of IC-opname bij volwassenen met bewezen influenza die zich bij de huisartsenpraktijk of eerste hulp presenteerden.
De prognostische factor zwangerschap was geassocieerd met ziekenhuisopname (Lynfield, 2014).
Bronnen: (Dimitreijevic, 2017) |
|
Zeer laag GRADE |
Aanwezigheid van de factoren chronische luchtwegaandoeningen inclusief astma, chronische hartaandoeningen, chronische neurologische aandoeningen, diabetes mellitus, chronische nieraandoeningen, obesitas of immuungecompromitteerd lijkt geassocieerd met IC-opname bij volwassenen met bewezen influenza die zich bij de huisartsenpraktijk of eerste hulp presenteerden, maar de bewijskracht daarvoor is beperkt.
Bronnen: (Dimitreijevic, 2017) |
|
- GRADE |
Er werd géén van de in deze PICO gedefinieerde prognostische factoren (leeftijd, comorbiditeit, immuungecompromitteerd) geïdentificeerd voor de uitkomstmaten complicaties en opnameduur, voor zowel kinderen als volwassenen.
In de studies werd zeer beperkt over uitkomsten bij zwangere vrouwen gerapporteerd, alleen ziekenhuisopname was geassocieerd met aanwezigheid van zwangerschap bij vrouwelijke patiënten. |
Prognostische factoren voor slechte uitkomst (zie uitkomstmaat) bij opgenomen patiënten met een laboratorium-bevestigde influenza infectie:
Kinderen - mortaliteit en/of IC-opname (2.1.3 - cruciaal)
|
Zeer laag GRADE |
Bij opgenomen kinderen met een laboratorium-bevestigde influenza infectie lijkt aanwezigheid van de factoren leeftijd (diverse categorieën), astma, chronische longziekten of chronische vasculaire ziekte en chronische metabole ziekte of neuromusculaire aandoening geassocieerd met toegenomen mortaliteit en/of IC-opname, maar de bewijskracht daarvoor is beperkt.
De prognostische factor ‘immuungecompromitteerd’ werd niet gerapporteerd.
Bronnen: (Chaves, 2013; Labeaud, 2013) |
Volwassenen - mortaliteit (2.2.1 - cruciaal)
|
Zeer laag GRADE |
De aanwezigheid van de factoren leeftijd boven de 50 jaar en de aanwezigheid van een van de onderliggende aandoeningen waarbij influenzavaccinatie wordt geadviseerd, of de afzonderlijke risicofactoren HIV/immuunsuppressie, chronische longziekten, diabetes, chronische vasculaire/lever/nierziekten of neuromusculaire aandoeningen lijken geassocieerd met toegenomen mortaliteit bij opgenomen volwassenen met een laboratorium-bevestigde influenza infectie maar de bewijskracht daarvoor is beperkt.
De prognostische factor zwangerschap lijkt niet geassocieerd met ziekteprogressie tijdens opname.
Bronnen: (Huang, 2014, Li, 2009, Tekin, 2019, Lynfield, 2014) |
Volwassenen - mortaliteit en/of IC-opname (2.2.3 - cruciaal)
|
Zeer laag GRADE |
De aanwezigheid van obesitas lijkt geassocieerd met toegenomen mortaliteit en/of IC-opname bij opgenomen volwassenen met een laboratorium-bevestigde influenza infectie, maar de bewijskracht hiervoor is beperkt.
De prognostische factoren leeftijd en immuungecompromitteerd werden niet gerapporteerd.
Bronnen: (Chaves, 2013; Myles, 2012) |
|
- GRADE |
Er werd géén van de in deze PICO gedefinieerde prognostische factoren (leeftijd, comorbiditeit, immuungecompromitteerd) geïdentificeerd voor de uitkomstmaat opnameduur voor zowel kinderen als volwassenen. |
Samenvatting literatuur
Beschrijving studies
Er is onderscheid gemaakt op twee niveaus van binnenkomst: personen die zich met ILI of influenza presenteerden in de algemene populatie, het verpleeghuis of Eerste Hulp en patiënten met een laboratorium-bevestigde influenza infectie die opgenomen werden in een ziekenhuis. De uitkomstmaten van de PICO (mortaliteit, ziekenhuisopname, IC-opname en opnameduur) werden als ongunstig beloop van ILI/ influenza gedefinieerd. De prognostische factoren zoals in onze PICO zijn als volgt omschreven, tenzij anders benoemd bij de specifieke studie:
- Zwangerschap: aan/afwezigheid zoals gedefinieerd in de studie.
- Leeftijd: leeftijdscategorieën zoals gedefinieerd in de studie.
- Comorbiditeit: aan/afwezigheid van de genoemde onderliggende aandoeningen in de studie.
- Immuungecompromitteerd: aan/afwezigheid zoals gedefinieerd in de studie.
Vaak werd niet duidelijk beschreven hoelang de patiënten al ziek waren ten tijde van inclusie in de studie; indien gerapporteerd is dit weergegeven in de evidencetabellen.
De prognostische factor zwangere vrouwen werd geëxcludeerd in de studies van Dalziel, (2013) en Chaves (2013). In de andere geïncludeerde studies werden zwangere vrouwen niet gerapporteerd, behalve in het onderzoek van Lynfield (2014), waarbij in totaal 31 zwangere vrouwen in een cohort van 982 bewezen influenza-patiënten waren geïncludeerd.
Resultaten
De resultaten in tabel 1 betreffen de vooraf in de PICO gedefinieerde prognostische factoren die in de studies in een multivariaat model werden gerapporteerd. De prognostische factoren zijn gerelateerd aan de uitkomstmaten (die het ongunstige beloop van influenza definiëren), onderverdeeld in kinderen/volwassenen en twee niveaus van binnenkomst: personen die zich met ILI of influenza presenteerden in de algemene populatie, het verpleeghuis of Eerste Hulp en patiënten met een laboratorium-bevestigde influenza infectie die opgenomen werden in een ziekenhuis. De prognostische factoren zoals gedefinieerd in deze PICO zijn: zwangerschap, leeftijd, comorbiditeit en immuungecompromitteerd. De resultaten konden niet gepoold worden vanwege de prognostische opzet, het gebruik van verschillende multivariate modellen en verschillen in onderzochte populaties. Per studie is aangegeven waarvoor is gecorrigeerd in het betreffende multivariate model (zie laatste kolom van tabel 1).
Tabel 1 uitkomsten van geïncludeerde studies
|
|
Uitkomstmaat |
Studie |
Aantal patiënten, ILI of influenza? |
Prognostische factor |
OR (95% BI) |
Gecorrigeerd voor: |
Opmerkingen |
|
Patiënten die zich bij eerste hulp, in de algemene populatie, het verpleeghuis presenteerden met ILI of influenza |
|
||||||
|
Kinderen |
Mortaliteit (1.1.1) |
Dalziel, 2013 |
N=265 kinderen met ILI, gunstig beloop) N=265 kinderen met ILI op basis van lab-bevestigde influenza infectie met ongunstig beloop) Periode: Inclusie tussen 16 april en 31 december 2009 (H1N1 pandemie) Inclusie: kinderen die zich bij eerste hulp presenteerden met ILI: koorts (thuis of in ziekenhuis gemeten: ≥37,8°C) met hoesten of zere keel
Ongunstig beloop: kinderen met influenza na pH1N1 lab-bevestiging die waren opgenomen in een IC-bed met beademing, of met inotropie/vasopressor ondersteuning of met beide interventies, of die stierven. Gunstig beloop: kinderen die wel konden zijn opgenomen of met een lab-bevestigde influenza-infectie, maar zonder de bovengenoemde ernstige uitkomsten. |
Cerebrale parese/ ontwikkelingsachterstand |
2,6 (1,2 tot 5,5) *† |
Chronic lung disease, cerebral palsy / developmental delay, heart disease, asthma, dyspnoea, increased/purulent sputum irritable/drowsy, rhinorrhoea |
Lab- en radiologie bevindingen warden niet meegenomen in het multivariate model vanwege een te lage prevalentie in de controlegroep. Dit beperkt het hier gepresenteerde model.
Mortaliteit 27/265 (10%) |
|
Ziekenhuisopname en/of IC-opname (1.1.2) |
Bender, 2009 |
Periode: Kinderen met laboratorium-bevestigde influenza infectie (griepseizoen juli 2001 tot en met juni 2004).
N=689 (niet-opgenomen, ontslagen van Eerste Hulp = gunstig beloop) N=541 (opgenomen op kinderafdeling, 24u observatie of IC-afdeling = ongunstig beloop) |
High risk medical condition (all children and adolescents 6 months and older with underlying medical conditions, including asthma or other chronic pulmonary disease, hemodynamically significant cardiac disease, immunosuppression, human immunodeficiency virus infection, sickle cell anemia or other hemoglobinopathy, diseases requiring long-term salicylate therapy, chronic renal disease, metabolic diseases including diabetes mellitus, and any other condition that compromises respiratory clearance such as neuromuscular disorders. |
4,06 (2,91 tot 5,68)* |
Radiographic evidence of pneumonia, high risk medical condition, respiratory distress on examination, influenza B infection |
Selectie van 1230 laboratorium-bevestigde influenza patiënten uit een onbekend aantal kinderen met koorts en respiratoire symptomen
Gestuurde selectie van prognostische factoren: doel was 1 historische factor, 1 klinisch symptoom, 1 radiologisch en 1 laboratorium factor te selecteren op basis van significantie uit de multivariaat analyse voor ontwikkeling van een predictiescore.
Mortaliteit niet vermeld. |
|
|
Radiographic evidence of pneumonia |
7.82 (3,62 tot 16,92)*† |
||||||
|
Respiratory distress on examination |
2,33 (1,61 tot 3,38)* |
||||||
|
Influenza B infection |
3,99 (2,57 tot 6,21)* |
||||||
|
Garcia, 2015 |
N=316 (binnen 24u ontslagen van eerste hulp afdeling, gunstig beloop) N=379 (opgenomen (inclusief ICU-opnames), ongunstig beloop)
Periode: Inclusie tussen 1 april 2009 en 30 juni 2010. Kinderen (0-18) die bij eerste hulp verschenen en laboratorium bevestigde influenza A(H1N1) infectie bleken te hebben.
Patiënten die als controles werden geselecteerd waren patiënten met ILI die ook konden zijn opgenomen of een lab-bevestigde pH1N1 infectie konden hebben. |
Ontwikkelingsachterstand (comorbiditeit) |
2,2 (0,99 tot 4,87)*† |
Co-morbidities: -cardiovascular conditio -developmental delay-haemotological disease -lung condition -neurocognitive disorder -neurological disorder -neuromuscular disorder -obesity -premature birth -renal condition -seizure disorder. Cardiovasculaire conditie, neurocognitieve stoornis, neurologische conditie en neuromusculaire stoornis niet significant in de multivariate analyse (p>0,1) en de auteurs rapporteerden geen OR’s hiervan. Cough and wheezing: niet significant in multivariate analyse (p<0,1) en de auteurs rapporteerden geen OR’s hiervan |
Selectie van 695 laboratorium-bevestigde influenza patiënten uit een onbekend aantal kinderen met koorts en respiratoire symptomen.
Gerapporteerde OR’s betreffen geadjusteerde OR’s voor verzekeringsstatus en etniciteit
Symptomen die geassocieerd waren met ziekenhuis- of IC opname: tachycardie, dyspnoe en vermoeidheid waren significant geassocieerd met opname, de andere symptomen met niet-opname, dus ontslag < 24 uur van SEH.
Mortaliteit kwam alleen voor op de IC: 3/116 (2.6%) |
||
|
Haematologische ziekte (comorbiditeit) |
2,22; (1,22 tot 4,05)*† |
||||||
|
Chronische longziekte (comorbiditeit) |
2,84 (1,05 tot 10,21)*† |
||||||
|
Obesitas (comorbiditeit) |
3,28 (1,05 tot 10,21)*† |
||||||
|
Epilepsie (comorbiditeit) |
4,71 (2,11 tot 10,52)*† |
||||||
|
Premature birth (comorbiditeit) |
2,53 (1,34 tot 4,77)* |
||||||
|
Chills |
0,44 (0,21 tot 0,93) |
||||||
|
Congestion |
0,68 (0,49 tot 0,93) |
||||||
|
Dyspnoea |
5,82 (3,94 tot 8,59) |
||||||
|
Fatigue |
1,96 (1,19 tot 3,24) |
||||||
|
Fever |
0,41 (0,22 tot 0,76) |
||||||
|
Headache |
0,51 (0,32 tot 0,83) |
||||||
|
Myalgia |
0,44 (0,26 tot 0,75) |
||||||
|
Sore throat |
0,72 (0,45 tot 1,13) |
||||||
|
Tachycardia |
2,61 (1,38 tot 4,92) |
||||||
|
IC-opname en/of dood (1.1.3) |
Dalziel, 2013 |
N= 265 (niet opgenomen, gunstig beloop) N=265 (opgenomen, ongunstig beloop) Inclusie tussen 16 april en 31 december 2009 (H1N1 pandemie) Inclusie: kinderen die zich bij eerste hulp presenteerden met ILI: koorts (thuis of in ziekenhuis gemeten: ≥37,8°C) met hoesten of zere keel
Ongunstig beloop: kinderen met influenza na pH1N1 lab-bevestiging die waren opgenomen in een IC-bed met beademing, of met inotropie/vasopressor ondersteuning of met beide interventies, of die stierven.
Ongunstig beloop: kinderen zonder de bovengenoemde ernstige uitkomsten |
Chronische longaandoening (comorbidity) |
8,5 (1,6 tot 45,1)*†
|
Chronic lung disease, cerebral palsy / developmental delay, heart disease, asthma, dyspnoea, increased/purulent sputum irritable/drowsy, rhinorrhoea, heart rate linear, heart rate quadratic, on oxygen or saturation <93%, chest retractions, signs of dehydration, accessory muscle use.
Astma, hartaandoening, dyspnoea, increased/purulent sputum, irritable/drowsy en rhinorrhoea waren niet-significante factoren in het multivariate model en er werden geen OR’s weergegeven.
Accessory muscle use was niet significant in het multivariate model en er werd geen OR gerapporteerd door de auteurs. |
Lab- en radiologie bevindingen werden niet meegenomen in het multivariate model vanwege een te lage prevalentie in de controlegroep. Dit beperkt het hier gepresenteerde model. Zwangerschap werd niet meegenomen in het definitieve model vanwege prevalentie ≤2% in cases en controls.
(age matched controls: geadjusteerd voor leeftijd en locatie ziekenhuis) |
|
|
Cerebral palsy / developmental delay (comorbidity) |
65,9 (8,6 tot 506)*† |
||||||
|
Heart rate linear (physical examination) |
-0,085 (-0,016 tot -0,0079) |
||||||
|
On oxygen or saturation <93% (physical examination) |
12,9 (3,8 tot 44,2) |
||||||
|
Chest retractions (physical examination) |
12,9 (4,2 tot 38,9) |
||||||
|
Signs of dehydration (physical examination) |
10,7 (2,0 tot 57,8) |
||||||
|
Opnameduur (1.1.4) |
Werd niet gerapporteerd |
||||||
|
Volwassenen |
Mortaliteit (1.2.1) |
Werd niet gerapporteerd |
|||||
|
Ziekenhuisopname en/of IC-opname (1.2.2) |
Dimitreijevic, 2017 |
N=322 (patiënten behandeld in primary healthcare) = gunstig beloop. N=455 (opgenomen in ziekenhuis inclusief IC-opname) = ongunstig beloop. Van de beschreven resultaten in de studie past de vergelijking van patienten die werden opgenomen in het ziekenhuis- en/of IC met patienten in de eerstelijnsgezondheidzorg het beste bij deze PICO.
Uitgangspunt: onderdeel van surveillance waarin patiënten met laboratorium-bevestigde influenza uit een groter onbekend aantal patiënten met ILI die zich meldden in een aantal praktijken en ziekenhuizen.
|
Leeftijd vanaf 65 jaar |
3.85 (1.57- 9.45)*† |
Age (adults ≥ 65 year) Comorbidities (chronic respiratory diseases, asthma, diabetes mellitus, chronic heart diseases, chronic kidney diseases, immune compromised status, obesity) Type and sub-type of the virus (virus A, A(H1)pdm09, A(H3)) More than 3 days from the onset of the symptoms to visiting a physician |
Model I werd gekozen omdat de variabelen hier de factoren als losse variabelen werden gerapporteerd, i.t.t. model II en III waarbij variabelen werden geaggregeerd.
Mortaliteit niet vermeld. |
|
|
Virus subtype |
A (H1) pdm09: 2,26 (1,47 tot 3,48)* A (H3) 0,46 (0,29 tot 0,73)* |
||||||
|
Chronische luchtwegaandoeningen |
6,68 (2,68 tot 16,65)*† |
||||||
|
Astma |
6,82 (1,94 tot 23,95)*† |
||||||
|
Diabetes mellitus |
4,75 (1,53 tot 14,72) *† |
||||||
|
Chronische hartaandoeningen |
4,29 (2,02 tot 9,08)*† |
||||||
|
Chronische nieraandoeningen |
4,23 (1,35 tot 13,28)*† |
||||||
|
Immuungecompromitteerd |
4,31 (1,9 tot 9,74)*† |
||||||
|
Meer dan 3 dagen tussen begin symptomen en bezoek arts |
2,69 (1,68 tot 4,31)* |
||||||
|
IC-opname (1.2.3) |
Dimitreijevic, 2017 |
N=322 (= patiënten behandeld in primary healthcare, gunstig beloop) N=126 (IC-opname) = ongunstig beloop
Uitgangspunt: onderdeel van surveillance waarin patiënten met laboratorium-bevestigde influenza uit een groter onbekend aantal patiënten met ILI die zich meldden in een aantal praktijken en ziekenhuizen. |
Virus subtype |
A 9,67 (2,06 tot 45,39)* A H1) pdm09: 7,79 (4,04 tot 15,02)* |
Age (adults ≥ 65 year) Comorbidities (chronic respiratory diseases, asthma, diabetes mellitus, chronic heart diseases, chronic kidney diseases, chronic neurological diseases, immune compromised status, obesity) Type and sub-type of the virus (virus A, A(H1)pdm09, A(H3)) More than 3 days from the onset of the symptoms to visiting a physician |
Model I werd gekozen omdat de variabelen hier de factoren als losse variabelen werden gerapporteerd, i.t.t. model II en III waarbij variabelen werden geaggregeerd.
Mortaliteit niet vermeld. |
|
|
Chronische luchtwegaandoeningen |
17,94 (6,17 tot 52,15)*† |
||||||
|
Astma |
16,75 (3,55 tot 79,05)*† |
||||||
|
Diabetes mellitus |
20,63 (5,48 tot 77,67)*† |
||||||
|
Chronische hartaandoeningen |
9,82 (3,86 tot 25,02)*† |
||||||
|
Chronische nieraandoeningen |
10,96 (2,63 tot 45,63)*† |
||||||
|
Chronische neurologische aandoeningen |
6,43 (2,27 tot 18,21)*† |
||||||
|
Immuungecompromitteerd |
3,86 (1,68 tot 8,56)*† |
||||||
|
Obesitas |
9,8 (3,01 tot 31,93)*† |
||||||
|
Meer dan 3 dagen tussen begin symptomen en bezoek arts |
4,01 (1,9 tot 8,48)* |
||||||
|
Opnameduur (1.2.4) |
Werd niet gerapporteerd |
||||||
|
Opgenomen patiënten met een laboratorium-bevestigde influenza infectie |
|
||||||
|
Kinderen |
Mortaliteit (2.1.1) |
Werd niet gerapporteerd |
|||||
|
Ziekenhuisopname (2.1.2) |
Niet van toepassing (uitgangspunt is opgenomen patiënten) |
||||||
|
Mortaliteit en/of IC-opname (2.1.3) |
Labeaud, 2013 |
N=90 (opgenomen, gunstig beloop) N=47 (opgenomen, ongunstig beloop: kinder IC opname, intubatie of dood)
Periode: Lab-bevestigde H1N1 influenza, opgenomen kinderen (0-18 jr) tussen april 2009 en februari 2010 |
Leeftijd |
0,94 (0,83 tot 1,05)† |
|
Mortaliteit 2/137 (1.5%) |
|
|
Geslacht vrouw (man: referentiecategorie) |
0,67 (0,21 tot 2,21) |
||||||
|
Etniciteit (blank: referentiecategorie) |
Black: 0,48 (0,07 to 3,28) Hispanic: 0,35 (0,06 to 2,00) Other: 1,2 (0,21 to 6,89) |
||||||
|
Neuromusculaire aandoeningen (afwezig: referentiecategorie) |
Yes: 2,03 (0,43 tot 9,63) |
||||||
|
Zuurstofbehoefte (geen: referentiecategorie) |
Yes: 7,36 (2,16 tot 25,07)* |
||||||
|
Hyponatremie, mmmol/L >130: referentiecategorie |
<130: 27,81 (1,84-420) |
||||||
|
Witte bloedcellen telling |
1,18 (1,05 tot 1,32)* |
||||||
|
Bloedplaatjes telling |
0,99 (0,98 tot 1,00) |
||||||
|
Chaves, 2013 |
N=689 (opgenomen, gunstig beloop) N=141 (opgenomen, ongunstig beloop: mortaliteit en/of IC-opname gedurende ziekenhuisopname)
Periode: Oktober 1010 tot April 2011 (lab-bevestigde influenza type: pH1N1 / B; H3N2 influenza A); patiënten werden behandeld met antivirale middelen Kinderen: 0 tot en met 17 jaar |
Leeftijd: 5-17 jr is referentiecategorie |
<2: 1,17 (0,61 tot 2,22) 2-4: 1,25 (0,64 tot 2,44) |
Virustype, age, underlying medical conditions, selected medical conditions (asthma, chronic lung disease, chronic vascular disease, chronic metabolic disease, neuromuscular disorders) antiviral started <3d from admission. |
Patiënten die influenza >3 dagen na opname ontwikkelden, werden geëxcludeerd;
Mortaliteit 2/830 (0.2%) |
||
|
Virustype (H3N2 is referentiecategorie) |
pH1N1: 2,19 (1,11 tot 4,33)* B: 0,99 (0,55 tot 1,77) |
||||||
|
Antivirale behandeling <3 dagen na opname |
Yes: 0,5 (0,2 tot 1,25) |
||||||
|
Chronische longziekten |
2,11 (0,97 tot 4,57)† |
||||||
|
Astma |
1,26 (0,66 tot 2,39)† |
||||||
|
Chronische vasculaire ziekte (niet hypertensie) |
1,15 (0,35 tot 3,74)† |
||||||
|
Chronische metabole ziekte |
5,23 (1,74 tot 15,69)*† |
||||||
|
Neuromusculaire aandoening |
4,84 (2,02 tot 11,56)*† |
||||||
|
Opnameduur (2.1.4) |
Werd niet gerapporteerd |
||||||
|
Volwassenen |
Mortaliteit (2.2.1) |
Huang, 2014 |
N=4126 (opgenomen, gunstig beloop) N=399 (opgenomen, ongunstig beloop = mortaliteit)
Opgenomen patiënten werden gedefinieerd als: patiënten met ILI en bewijs van pneumonie, neurologische symptomen, myopericarditis of invasieve bacteriële infecties met een bewezen real-time reverse transcriptie PCR van influenza.
Periode: Zieke personen vanaf week 26 2009 tot en met week 25 2012 |
Leeftijd (< 50 jaar: referentiecategorie) |
≥50 year: 2,05 (p<0.001, geen 95%BI beschreven)*† |
Age**, high-risk medical condition**, age group (over/under 50 years), sex, oseltamivir treatment withing 48 hours after illness onset |
High risk medical condition: chronic pulmonary (including asthma), cardiovascular (except hypertension), renal, hepatic, neurologic, neurodevelopment, hematologic or metabolic (including diabetes mellitus) disorders; •immunosuppressed (including immunosuppression caused by medications or by HIV); •pregnant; •severely obese (body mass index ≥35).
Mortaliteit 413/4735 (8.7%) |
|
Geslacht man (vrouw is referentiecategorie |
1,31 (p=0,014, geen 95%BI beschreven) |
||||||
|
Oseltamivir behandeling binnen 48 u na start ziekte. Nee is referentiecategorie |
2,4 (p<0,001; geen 95%BI beschreven) |
||||||
|
High-risk medical conditions (nee is referentiecategorie) |
3,38 (p<0.001, geen 95%BI beschreven)*† |
||||||
|
Li, 2009 |
Alleen 111 IC patiënten N=90 (opgenomen, gunstig beloop) N=21 (opgenomen, ongunstig beloop: mortaliteit)
Laboratorium bewezen influenza; periode 1999 tot 2006
Mortaliteit 21/111 (18.9%) |
Acute respiratory distress symptom |
7,7 (2,3 tot 20)*† |
Acute Physiology and Chronic Health Evaluation (APACHE) III ARDS, history of immunosuppression
|
De significant geassocieerde factoren uit het univariate model werden meegenomen in het multivariate model. Oseltamivir werd gegeven binnen 24u na opname en voordat PCR-resultaten binnen waren. Patiënten met negatieve PCR stopten met oseltamivir; bij een positief resultaat werd voor tenminste 5 dagen doorgegaan met oseltamivir. |
||
|
Acute Physiology and Chronic Health Evaluation (APACHE) III, 10% increase |
1,49 (1,1 tot 2,1)* |
||||||
|
Immuunsuppressie: gebruik immuunsuppressiva inclusief hoge doses corticosteroiden, chemotherapie, bestraling, leukemia, lymfoom of AIDS |
7,19 (1,9 tot 28)*† |
||||||
|
Tekin, 2019 |
N=197 (opgenomen, gunstig beloop) N=25(opgenomen, ongunstig beloop: mortaliteit)
Influenza seizoen 2015-2016, influenza A infectie Influenza-geassocieerde ziekenhuisopname: een persoon opgenomen met ILI en die ten minste één symptoom had op basis van de IDSA condities inclusief een positieve PCR-test
Mortaliteit 25/222 (11.2%) |
Leeftijd > 65 jaar |
6,0 (2,07 tot 23,08)*† |
Age>65 years, H2N2 versus H1N1, one day delay for oseltamivir, secondary bacterial infection, presence of malignancy |
|
||
|
H3N2 versus. H1N1 |
4,2 (1,27 tot 13,38)* |
||||||
|
1 dag vertraging met oseltamivir behandeling |
1,3 (1,01 tot 1,63)* |
||||||
|
Secundaire bacteriële infectie |
2,8 (0,4 tot 20,55) |
||||||
|
Maligniteit aanwezig |
1,25 (0,19 tot 8,22) |
||||||
|
Bilaterale pulmonaire infiltratie |
1,09 (0,92 tot 1,001)† |
||||||
|
Tijd tot start antivirale behandeling (dagen) |
5,31 (1,19 tot 23,64)* |
||||||
|
C-reactive proteïne |
1,178 (0,99 tot 1,39) |
||||||
|
Albumine |
0,107 (0,01 tot 1,37) |
||||||
|
Lynfield, 2014 |
N=290 (opgenomen patiënten met complicaties geassocieerd met influenza, gunstig beloop) N=80 (opgenomen patiënten met complicaties geassocieerd met influenza die binnen 60 dagen zijn overleden, ongunstig beloop) We beschrijven het FLU 003 cohort omdat hier mortaliteit-data van beschikbaar zijn. In FLU003 had van 749 patiënten met ILI een ernstige infectie die opname behoefde, 392 (52%) een lab-bevestigde influenza A(H1n1) infectie
Periode: Inclusie tussen oktober 2009 en december 2012; A(H1N1)pdm09 virus infectie, met ILI of Influenza |
Leeftijd (mediaan, IQR), 10 jaar ouder |
1,31 (0,95 tot 1,8)† |
Age, sex, race, BMI, onset to enrollment, season of enrollment, status at enrolment, Co-morbidities/medical history: Asthma/COPD, Diabetes, CVD/liver/renal HIV/other immune, smoker). |
Mortaliteit werd gemeten gedurende 60 dagen. We beschrijven het FLU 003 cohort omdat hier mortaliteit-data van beschikbaar zijn.
Mortaliteit FLU002 1/590 (0.2%), FLU003 32/392 (8.7%) |
||
|
Etniciteit |
Asian: 5,18 (1,48 tot 18,2)* Black: 1,82 (0,2 tot 16,7) White / other: ref |
||||||
|
Vrouw |
1,69 (0,65 tot 4,44) |
||||||
|
BMI % |
<30: ref 30-39.90: 0,29 (0,06 tot 1,49) BMI≥40: 0,45 (0,05 tot 4,14) |
||||||
|
Dagen tot inclusie % |
0-3 days: ref 4-5 days: 2,77 (0,45 tot 16,9) 6+ days: 6,2 (1,17 tot 32,8)* |
||||||
|
Seizoen |
Oct 2009-Sept 2010: 3,8 (1,38 tot 10,5)* Oct 2012 tot Dec 2012 ref |
||||||
|
Roken |
1,03 (0,32 tot 3,38) |
||||||
|
Status bij inclusie % |
Standaard opname (ref) ICU 8,97 (3,38 tot 23,8)* |
||||||
|
HIV/immuunsuppressie % (medische geschiedenis) |
3,55 (1,1 tot 11,5)*† |
||||||
|
Astma/COPD % (medische geschiedenis) |
0,49 (0,13 tot 1,79)† |
||||||
|
CVD/lever/nieraandoeningen % (medische geschiedenis) |
1,15 (0,37 tot 3,61)† |
||||||
|
Diabetes % (medische geschiedenis) |
3,33 (0,97 tot 11,4)† |
||||||
|
Ziekenhuisopname (2.2.2) |
Niet van toepassing (uitgangspunt is opgenomen patiënten) |
||||||
|
Mortaliteit en/of IC-opname (2.2.3) |
Chaves, 2013 |
N=2255 (opgenomen, gunstig beloop) N=536 (opgenomen, ongunstig beloop: mortaliteit en/of IC-opname gedurende ziekenhuisopname)
Oktober 1010 tot April 2011 (lab-bevestigde influenza type: pH1N1 / B; H3N2 influenza A); patiënten werden behandeld met antivirale middelen |
Leeftijd (18-49 referentiecategorie) |
50-64jr: 1,2 (0,88 tot 1,64)† ≥65jr: 0,94 (0,67 tot 1,32)† |
Virustype, age, underlying medical conditions, selected medical conditions (chronic lung disease, chronic vascular disease, chronic metabolic disease, neuromuscular disorders) antiviral started <3d from admission. |
Patiënten die influenza >3 dagen na opname ontwikkelden, werden geëxcludeerd; Zwangere vrouwen werden geëxcludeerd;
Mortaliteit 109/2791 (3.9%)
|
|
|
Virustype (type B is referentiecategorie) |
pH1N1: 2,21 (1,66 tot 2,94)* H3N2: 1,1 (0,79 tot 1,53) |
||||||
|
Chronische longziekten |
1,46 (1,12 tot 1,89)*† |
||||||
|
Chronische vasculaire ziekte |
1,19 (0,92 tot 1,54)† |
||||||
|
Chronische metabole ziekte |
1,11 (0,87 tot 1,42)† |
||||||
|
Neuromusculaire aandoening |
1,68 (1,11 tot 2,52)*† |
||||||
|
Morbide obesitas (BMI>40) |
1,17 (0,87 tot 1,42)† |
||||||
|
Antivirale therapie <3 dagen na opname |
0,47 (0,33 tot 0,68)* |
||||||
|
Myles, 2012 |
N=1252 (opgenomen, gunstig beloop) N=268 (ongunstig beloop: opname in ‘high dependency unit’ of IC-opname en/of dood)
Influenza A/H1N1 pandemie 2009-2010 |
Leeftijd 55-64 jaar (16-24: referentiecategorie (model I) |
55-64jr: 2,08 (1,16 tot 3,74)*† ≥65: 1,45 (0,71 tot 2,93) |
Model I: Age (categories: >1; 1-4; 5-15; 16-24 (reference); 25-34; 35-44; 45-54; 55-64; ≥65), asthma, chronic pulmonary conditions, neurological disorders, cardiovascular disease.
|
Model I: socio-demografische en comorbiditeiten
Model II: klinische parameters
Mortaliteit 81/1520 (5.3%) |
||
|
Astma (model I) |
0,49 (0,34 tot 0,70)*† |
||||||
|
Longaandoeningen anders dan astma of COPD (model I) |
2,4 (1,17 tot 4,93)*† |
||||||
|
Neurologische aandoeningen (model I) |
2,59 (1,62 tot 4,15)*† |
||||||
|
Obesitas (model I) |
2,22 (1,18 tot 4,18)*† |
||||||
|
cardiovasculaire ziekte (model I) |
1.43 (0.96 tot 2.13) |
||||||
|
Radiologisch bevestigde pneumonie (model II) |
1,83 (1,27 tot 2,64)*† |
Model II: radiological pneumonia, C-reative protein, recorded obsese, altered 16onsciousness, dyspnoe, pre-admission antibiotics, required supplemental oxygen on admission, intravenous fluid replacement on admission, delayed admission, Length of hospital stay, in-hospital antibiotic therapy. |
|||||
|
Vertraagde opname (model II) |
1,67 (1,09 tot 2,56)* |
||||||
|
Dyspnoe (model II) |
1,22 (0,88 tot 1,67) |
||||||
|
Veranderd bewustzijn (model II) |
6,53 (3,73 to 11,41)* |
||||||
|
Zuurstoftoediening bij opname (model II) |
4,43 (3,09 tot 6,08)* |
||||||
|
Intraveneuze vloeistoftoediening bij opname (model II) |
1,86 (1,3 tot 2,66)* |
||||||
|
C-reactive protein, mg/dl; ≥100 versus <100 (model II) |
3,78 (2,41 tot 5,94)* |
||||||
|
Opnameduur (2.2.4) |
Werd niet gerapporteerd |
||||||
* Statistisch significante associatie in multivariate model van geïncludeerde studie
† Prognostische factoren die in de PICO van deze uitgangsvraag werden gedefinieerd
De studies Cvetanoversuska (2016) (geen prognostische factoren relevant voor deze PICO in multivariate model) en Angelo (2004) (geen significante factoren in univariate analyse beschikbaar om multivariate model te vullen) worden niet weergegeven in bovenstaande tabel.
1. Personen die zich met ILI of influenza presenteerden in de algemene populatie, het verpleeghuis of Eerste Hulp
In tabel 1 is te zien welke odds ratio’s (breder dan de PICO, want ook klinische parameters werden in sommige onderzoeken meegenomen) werden gerapporteerd en welke variabelen in de multivariate modellen werden meegenomen. Hieronder worden enkel de odds ratio’s gerapporteerd gerelateerd aan de PICO van deze uitgangsvraag.
1.1 Kinderen
1.1.1 Mortaliteit
Dalziel (2013) identificeerde één factor geassocieerd met mortaliteit: de aanwezigheid van cerebrale parese/ontwikkelingsachterstand had een OR van 2,6 (95%BI: 1,2 tot 5,5) in relatie tot mortaliteit.
1.1.2 Ziekenhuisopname en/of IC-opname
In de studie van Bender (2009) werd ziekenhuisopname in deze studie gedefinieerd als: opgenomen op de kinderafdeling, 24u observatie of opname op IC-afdeling. Ziekenhuis- en/of IC-opname waren in het multivariate model geassocieerd met een groep van meerdere medische condities met hoog risico dat als verzamelde term ‘hoog risico aandoeningen’ bij 33% van de opgenomen patiënten voorkwam versus bij 9% bij de niet-opgenomen patiënten (zie tabel 1) en verder ademhalingsproblemen bij lichamelijk onderzoek, influenza B infectie en radiologische bewijs van pneumonie.
Garcia (2015) rapporteerde de aanwezigheid van een aantal onderliggende aandoeningen als prognostische factoren voor ziekenhuisopname inclusief IC-opname. De aanwezigheid van de factoren ontwikkelingsachterstand (OR: 2,2; 95% BI 0,99 tot 4,87), hematologische ziekte (OR: 2,22; 95% BI 1,22 tot 4,05), chronische longziekte (OR: 2,84; 95% BI 1,55 tot 5,21), obesitas (OR: 3,28; 95% BI 1,05 tot 10,21) en aanwezigheid of geschiedenis van epileptisch insult (OR: 4,71; 95% BI 2,11 tot 10,52) waren geassocieerd met ziekenhuisopnames. Het multivariate model werd daarnaast gecorrigeerd voor de factoren: premature geboorte, neurologische stoornissen, neuromusculaire stoornissen, neurocognitieve stoornissen en conditie van de nieren. Onduidelijk blijft of de onderliggende co-morbiditeit bijdroeg aan het klinisch ziek zijn of dat comorbiditeit een reden is om versneld tot opname over te gaan.
In een tweede multivariaat model werden factoren meegenomen die niet aan onze PICO waren gerelateerd, maar gerelateerd waren aan opname, zoals: zere keel, tachycardie, myalgie, hoofdpijn, koorts, moeheid, dyspnoe, rillingen en congestie. Symptomen die mogelijk wezen op een ernstiger influenza-infectie, tachycardie, dyspnoe en vermoeidheid, waren geassocieerd met opname. De overige symptomen waren juist geassocieerd met niet-opname.
1.1.3 IC-opname en/of mortaliteit
Dalziel (2013) onderzocht onderliggende aandoeningen als prognostische factor voor de gecombineerde uitkomstmaat mortaliteit en/of IC-opname. Aanwezigheid van chronische longaandoening had een OR van 8,5 (95% BI 1,6 tot 45,1) en cerebrale parese/ ontwikkelingsachterstand gaf een OR van 65,9 (95% BI 8,6 tot 506). Het laatste kwam bij 27% van de patiënten voor met ongunstig beloop en slechts in 3% bij kinderen die niet op de IC werden opgenomen of overleden. De odds op IC-opname of dood is veel hoger bij kinderen met een chronische longaandoening of ontwikkelingsachterstand dan bij kinderen zonder deze onderliggende aandoeningen. De factoren in het multivariate model waren: astma, dyspnoe, toename van/purulent sputum, slaperigheid, rinorroe, hartaandoening. In een tweede multivariaat model werd hartritme, zuurstofsaturatie, borstcontracties en signalen van dehydratatie meegenomen, maar deze factoren waren niet relevant voor het beantwoorden van de uitgangsvraag.
Zwangerschap werd uit het model gelaten omdat dit een onderzoek was bij kinderen beneden de 16 jaar en er slechts één zwangere tiener was.
1.1.4 Opnameduur
Werd niet gerapporteerd.
1.2 Volwassenen
1.2.1 Mortaliteit
Werd niet gerapporteerd.
1.2.2 Ziekenhuisopname en/of IC-opname
Dimitreijevic, 2017 vergeleek patienten die moesten worden opgenomen in het ziekenhuis of de IC(n=455) met patiënten die in de eerstelijn gezien werden (n=322).
Leeftijd vanaf 65 jaar gaf een OR van 3,85 (95% BI 1,57 tot 9,45). Aanwezigheid van onderliggende aandoeningen werden ook gerapporteerd, zie tabel 1. Het gaat om chronische luchtwegaandoeningen, astma, diabetes, chronische hart- en nieraandoeningen en immuungecompromitteerde patiënten. Alle OR’s lagen boven de 4,23, er was dus (meer dan) vier keer zo hoge odds op ziekenhuisopname/IC opname bij de betreffende factoren. Naast de genoemde factoren werd ook virustype en < 3 dagen tussen begin symptomen en bezoek arts meegenomen in het multivariate model.
Lynfield (2014) rapporteerde dat zwangerschap geassocieerd was met slechte uitkomst (ziekenhuisopname) bij 5 vrouwen onder de 45 jaar met ILI ten gevolge van een bewezen influenza infectie, met een OR van 30,01 (P = 0,015; geen betrouwbaarheidsinterval gerapporteerd). Bij 26 zwangere vrouwen die waren opgenomen vanwege een ernstige influenza infectie (waarvan 11/26 op de IC) was zwangerschap niet significant geassocieerd met ziekteprogressie (OR = 0.88; geen betrouwbaarheidsinterval gerapporteerd, p = 0.89). Ziekteprogressie was gedefinieerd als dood, IC-opname en/of mechanische ventilatie of ziekenhuisopname van meer dan 28 dagen.
1.2.3 IC-opname
Dimitreijevic (2017) rapporteerde ook IC-opname als maat voor slechte uitkomsten, maar dan voor een kleinere groep (n=126 IC-opname) ten opzichte van patiënten in de eerstelijn (n=322).
Aanwezigheid van onderliggende aandoeningen werd gerapporteerd, zie tabel 1. Het gaat om chronische luchtwegaandoeningen, neurologische aandoeningen, astma, diabetes, chronische hart- en nieraandoeningen, obesitas en immuungecompromitteerde patiënten. Alle OR’s voor IC-opname bij deze aandoeningen lagen boven de 3,86, dat was (meer dan) drie keer zo hoog als bij afwezigheid hiervan. Naast de genoemde factoren werd ook virustype en < 3 dagen tussen begin symptomen en bezoek arts meegenomen in het multivariate model.
1.2.4 Opnameduur
Werd niet gerapporteerd.
2. Patiënten met een laboratorium-bevestigde influenza infectie die opgenomen werden in een ziekenhuis
Tabel 1 geeft een overzicht van de prognostische factoren die zijn onderzocht en zijn opgenomen in de multivariate modellen met daarbij de odds ratio’s.
2.1 Kinderen
2.1.1 Mortaliteit
Werd niet gerapporteerd.
2.1.2 Ziekenhuisopname
Niet van toepassing (uitgangspunt is opgenomen patiënten).
2.1.3 IC-opname
Labeaud (2013) rapporteerde als ongunstige uitkomst een gecombineerde uitkomstmaat van IC-opname, intubatie of mortaliteit. Voor deze uitkomst werden geen significante factoren geïdentificeerd. Ook leeftijd werd als mogelijke prognostische factor meegenomen, met een OR van 0,94 (95% BI 0,83 tot 1,05) was deze factor niet significant. De andere factoren in het multivariate model waren: geslacht, etniciteit, neuromusculaire aandoeningen j/n, zuurstofbehoefte j/n (significant), hyponatremie (beneden of boven 130 mmol/l) (significant), telling witte bloedcellen en telling bloedplaatjes (significant).
Chaves (2013) rapporteerde als ongunstige uitkomst een gecombineerde maat voor IC-opname of mortaliteit. Leeftijd werd als een prognostische factor meegenomen in meerdere categorieën (referentiecategorie: 5 tot 17 jaar), maar ook hier was er was geen significante associatie tussen deze leeftijdscategorieën en IC opname/mortaliteit.
Daarnaast benoemde Chaves (2013) een aantal onderliggende ziekten (astma, chronische longziekten, chronische vasculaire ziekte, chronische metabole ziekte (onder andere diabetes), neuromusculaire aandoening). Hiervan bleek de aanwezigheid van chronische metabole aandoening een significante prognostische factor met een adjusted OR van 5,23 (95% BI 1,74 tot 15,69) en neuromusculaire aandoening met een adjusted OR van 4,84 (95% BI 2,02 tot 11,56). Overige factoren in het multivariate model waren: virustype, neuromusculaire aandoening en antivirale behandeling < 3 dagen na opname. Zwangere meisjes werden geëxcludeerd.
2.1.4 Opnameduur
Werd niet gerapporteerd.
2.2 Volwassenen
2.2.1 Mortaliteit
Huang (2014) rapporteerde leeftijd (vanaf 50 jaar ten opzichte van jonger dan 50 jaar) als prognostische factor met een OR van 2,05 (p<0.001, geen 95%BI beschreven). Daarnaast werd aanwezigheid van ‘high-risk medical condition’ als prognostische factor geïdentificeerd met een OR van 3,38 (p<0.001, geen 95%BI beschreven). High-risk medical condition werd gedefinieerd als personen met één van de volgende aandoeningen/eigenschappen: chronische luchtwegaandoening (inclusief astma), cardiovasculaire- (met uitzondering van hypertensie) aandoeningen, nier-, lever-, neuro-ontwikkelings-, metabole (diabetes) aandoeningen; immuungecomprommitteerden, zwangerschap en ernstige obesitas (BMI van 35 kg/m2 of hoger. In deze samengestelde maat zitten dus meerdere prognostische factoren die in deze PICO van toepassing zijn. Daarnaast werd gecorrigeerd voor geslacht en oseltamivirbehandeling binnen 48u na start ziekte in het multivariate model.
Li (2009) rapporteerde de aanwezigheid van acute respiratoir distress symptom score als factor voor mortaliteit met een OR van 7,7 (95%BI 2,3 tot 20) bij een groep van 111 IC-patiënten. Ook de factor immuunsuppressie (gebruik immuunsuppressiva inclusief hoge doses corticosteroïden, chemotherapie, leukemie, lymfoom of aids) werd significant bevonden in het multivariate model, met een OR van 7,19 (95% BI 1,9 tot 28). Daarnaast werd nog gecorrigeerd voor de APACHE III (acute physiology and chronic health evaluation) score in het multivariate model.
Lynfield (2014) rapporteerde dat na correctie alleen de aanwezigheid van HIV/immuunsuppressie als significante factor werd gevonden voor mortaliteit (OR 3,55; 95% BI 1,1 tot 11,5). Binnen deze groep had 14/53 (26%) hiv-infectie. De aandoeningen of medicatie die leiden tot andere vormen van immuunsuppressie werden niet geëxpliciteerd. Leeftijd en de aanwezigheid van onderliggende aandoeningen astma, diabetes en lever/nierziekten en obesitas hadden geen significante associatie met mortaliteit. Ander factoren in het multivariate model waren: geslacht, etniciteit, tijd tot inclusie, status tijdens inclusie, roker j/n, griepseizoen. De gecorrigeerde OR’s staan genoemd in tabel 1.
Tekin (2019) rapporteerde de prognostische factor leeftijd. Een leeftijd van > 65 jaar (ten opzichte van ≤ 65 jaar) had een significante associatie met mortaliteit: OR 6,0 (95% BI 2,07 tot 23,08). In het multivariate model werden verder de volgende factoren meegenomen: virustype, 1 dag vertraging met oseltamivir behandeling, secundaire bacteriële infectie, aanwezigheid maligniteit, bilaterale pulmonaire infiltratie, tijd tot start antivirale behandeling, C-reactief proteïne, albumine.
Cvetanovska (2016) onderzocht demografische factoren (leeftijd, geslacht et cetera), comorbiditeiten, klinische variabelen en biochemische variabelen in het univariate model; er werden géén prognostische factoren opgenomen in het uiteindelijke multivariate model gerelateerd aan deze PICO.
Angelo (2004) vergeleek 27 mensen uit de slechte uitkomstgroep (mortaliteit, respiratoire insufficiëntie, inotropie gedurende opname) met 105 mensen uit de groep die in het ziekenhuis werden opgenomen (groep met ‘goede uitkomst’). Er werden geen multivariaat model gebouwd omdat er geen significante factoren uit de univariate analyse kwamen.
2.2.2 Ziekenhuisopname
Niet van toepassing (uitgangspunt is opgenomen patiënten).
2.2.3 IC-opname en/of mortaliteit
Chaves (2013) rapporteerde als ongunstige uitkomst een gecombineerde maat voor IC-opname of mortaliteit. Leeftijd werd als een prognostische factor meegenomen in meerdere categorieën (referentiecategorie: 18 tot 49 jaar), maar deze uitkomsten waren niet significant.
Daarnaast benoemde Chaves (2013) een aantal onderliggende ziekten (chronische longziekten, chronische vasculaire ziekte, chronische metabole ziekte (onder andere diabetes), neuromusculaire aandoening en morbide obesitas). Hiervan bleek de aanwezigheid van chronische longaandoening een significante prognostische factor met een adjusted OR van 1,46 (95%BI: 1,12 tot 1,89) en neuromusculaire aandoening met een adjusted OR van 1,68 (95%BI: 1,11 tot 2,52). Overige factoren in het multivariate model waren: virustype en antivirale behandeling < 3 dagen na opname. Zwangere vrouwen werden geëxcludeerd.
Myles (2012) gebruikte een gecombineerde uitkomstmaat voor ernstige uitkomsten met de volgende samenstelling: opname op ‘high dependancy unit’ of IC-opname of mortaliteit. De resultaten bevatten gegevens van kinderen en volwassenen gecombineerd.
Vervolgens werden er twee multivariate modellen opgesteld. Het eerste model bevatte de prognostische patiëntfactoren zoals leeftijd (9 categorieën, 0 tot ≥ 65 jaar). Hierbij was één categorie significant: de leeftijd 55 tot 64 jaar: adjusted OR 2,08 (95% BI 1,16 tot 3,74). In ditzelfde model werd ook naar onderliggende comorbiditeiten gekeken (astma, cardiovasculaire ziekte, longziekten anders dan astma of COPD, neurologische aandoeningen, obesitas). De volgende prognostische factoren geassocieerd met onderliggende aandoeningen van deze PICO waren significant: astma (OR 0,49; 95% BI 0,34 tot 0,70), longaandoeningen anders dan astma of COPD (OR 2,4; 95% BI 1,17 tot 4,93), neurologische aandoeningen (OR 2,59; 95% BI 1,62 tot 4,15); obesitas (OR 2,22; 95% BI 1,18 tot 4,18).
Het andere multivariate model bevatte klinische parameters (zie tabel 1), namelijk: verlate opname, symptomen bij presentatie, C-reactive protein en radiologisch bevestigde pneumonie. Deze laatste factor was onderdeel van deze PICO. De OR van radiologisch bevestigde pneumonie was 1,83 (95% BI 1,27 tot 2,64, significant).
2.2.4 Opnameduur
Werd niet gerapporteerd.
Bewijskracht van de literatuur
Personen die zich met ILI of influenza presenteerden in de algemene populatie, het verpleeghuis of Eerste Hulp
1.1.1 Mortaliteit - kinderen
De bewijskracht voor de cruciale uitkomstmaat mortaliteit - kinderen is met drie niveaus verlaagd vanwege fase van onderzoek (multivariaat model zonder validatie -2 niveaus verlaagd) en het geringe aantal patiënten (imprecisie).
1.1.2 Ziekenhuisopname en/of IC-opname - kinderen
De bewijskracht voor de belangrijke gecombineerde uitkomstmaat ziekenhuisopname en/of IC-opname - kinderen is met twee niveaus verlaagd gezien beperkingen in de fase van onderzoek (multivariaat model zonder validatie).
1.1.3 IC-opname en/of dood - kinderen
De bewijskracht voor de belangrijke gecombineerde uitkomstmaat ziekenhuisopname en/of IC-opname - kinderen is met drie niveaus verlaagd vanwege fase van onderzoek (multivariaat model zonder validatie - 2 niveaus verlaagd) en het geringe aantal patiënten (imprecisie).
1.2.2 Ziekenhuisopname en/of IC-opname - volwassenen
De bewijskracht belangrijke gecombineerde uitkomstmaat ziekenhuisopname en/of IC-opname - volwassenen is met twee niveaus verlaagd vanwege de fase van onderzoek (multivariaat model zonder validatie).
1.2.3 IC-opname - volwassenen
De bewijskracht belangrijke gecombineerde uitkomstmaat ziekenhuisopname en/of IC-opname - volwassenen is met twee niveaus verlaagd vanwege de fase van onderzoek (multivariaat model zonder validatie) en het geringe aantal patiënten (imprecisie).
Opgenomen patiënten met een laboratorium-bevestigde influenza infectie
2.1.3 Mortaliteit en/of IC-opname - kinderen
De bewijskracht voor de belangrijke gecombineerde uitkomstmaat mortaliteit en/of IC-opname - kinderen is met drie niveaus verlaagd vanwege fase van onderzoek (multivariaat model zonder validatie - 2 niveaus verlaagd) en beperkingen in de onderzoeksopzet (risk of bias: veel data geëxcludeerd).
2.2.1 Mortaliteit - volwassenen
De bewijskracht voor de cruciale uitkomstmaat mortaliteit - volwassenen is met drie niveaus verlaagd vanwege fase van onderzoek (multivariaat model zonder validatie - 2 niveaus verlaagd) en beperkingen in de onderzoeksopzet (risk of bias: veel data geëxcludeerd).
2.2.3 Mortaliteit en/of IC-opname - volwassenen
De bewijskracht voor de belangrijke gecombineerde uitkomstmaat mortaliteit en/of IC-opname - volwassenen is met drie niveaus verlaagd vanwege fase van onderzoek (multivariaat model zonder validatie - 2 niveaus verlaagd) en beperkingen in de onderzoeksopzet (risk of bias: veel data geëxcludeerd).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Welke van de volgende factoren (zwangerschap, leeftijd, comorbiditeit, immuungecompromitteerd) voorspellen een ongunstig beloop van influenza (gedefinieerd als: ziekenhuisopname, mortaliteit, IC-opname en opnameduur)?
P: patiënten met influenza-like-illness (ILI) en/of influenza;
I: aanwezigheid van één van de volgende factoren: zwangerschap, leeftijd, comorbiditeit, immuungecompromitteerd;
C: afwezigheid van prognostische factoren;
O: mortaliteit, ziekenhuisopname, IC-opname en opnameduur.
Bij een prognostische uitgangsvraag moet van tevoren een minimale set van confounders gedefinieerd worden waarvoor gecorrigeerd moet zijn in de geïncludeerde studies. Echter, de werkgroep heeft deze vooraf niet gedefinieerd, omdat dit lastig vooraf te bepalen was voor deze populatie en prognostische factoren.
Bij ‘patiënten’ werd gekozen voor twee groepen:
- personen met ILI die zich presenteren in algemene populatie, verpleeghuis of op een Eerste Hulp. De reden hiervoor is dat ILI het presenterende syndroom is, wat voor een arts de aanzet is om diagnostiek in te zetten en/of empirische antivirale therapie te overwegen. Hierbij werd gekeken naar zowel prospectief onderzoek als retrospectief onderzoek.
- Personen met een laboratorium-bevestigde influenza infectie die opgenomen werden in een ziekenhuis. Dit betreft retrospectief onderzoek waarbij al eerder in het zorgproces een selectie is gemaakt uit een initieel cohort met of zonder ILI of een luchtweginfectie, waarbij besloten was tot het verrichten van influenza-diagnostiek.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit een voor de besluitvorming cruciale uitkomstmaat; en ziekenhuisopname, IC-opname en opnameduur voor de besluitvorming belangrijke uitkomstmaten.
Hierbij realiseert de werkgroep zich dat opname in het ziekenhuis of op de IC en opnameduur deels wordt bepaald door andere factoren dan de ernst van ziekte. Niet-medische factoren zoals beschikbaarheid van een step-down bed, de lokale logistiek en afspraken tussen afdelingen in een ziekenhuis bepalen mede bovenstaande uitkomsten. Om deze redenen beschouwt de werkgroep bovenstaande uitkomstmaten wel als belangrijk maar ook deels als subjectief.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. De werkgroep definieerde voor geen van de uitkomstmaten klinische (patiënt) relevante verschillen, maar sloot aan bij de door GRADE aangegeven standaardgrenzen (RR < 0,75 of > 1,25 voor dichotome uitkomstmaten en SD 0,5 voor continue uitkomstmaten).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 6 juni 2019 met relevante zoektermen gezocht naar prognostische studies waarin factoren werden onderzocht die een ongunstig beloop van influenza voorspellen. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1048 treffers op.
Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Groep gedefinieerd als ongunstig beloop bevat ten minste één van de uitkomstmaten uit de PICO.
- Ten minste één van de prognostische factoren uit de PICO werd onderzocht in de studie.
- Multivariate analyse van prognostische factoren.
Op basis van titel en abstract werden in eerste instantie 41 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 28 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 13 studies definitief geselecteerd.
Resultaten
Dertien onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- ANGELO, S. J., MARSHALL, P. S., CHRISSOHERIS, M. P., & CHAVES, A. M. (2004). Clinical Characteristics Associated with Poor Outcome in Patients Acutely Infected with Influenza A. Connecticut medicine.
- Bender, J. M., Ampofo, K., Gesteland, P., Stoddard, G. J., Nelson, D., Byington, C. L.,... & Srivastava, R. (2009). Development and validation of a risk score for predicting hospitalization in children with influenza virus infection. Pediatric emergency care, 25(6), 369-375.
- Chaves, S. S., Aragon, D., Bennett, N., Cooper, T., D'Mello, T., Farley, M.,... & Ryan, P. (2013). Patients hospitalized with laboratory-confirmed influenza during the 2010–2011 influenza season: exploring disease severity by virus type and subtype. The Journal of infectious diseases, 208(8), 1305-1314.
- Creanga, A. A., Johnson, T. F., Graitcer, S. B., Hartman, L. K., Al-Samarrai, T., Schwarz, A. G.,... & Shapiro-Mendoza, C. K. (2010). Severity of 2009 pandemic influenza A (H1N1) virus infection in pregnant women. Obstetrics & Gynecology, 115(4), 717-726.
- Cvetanovska, M., Milenkovik, Z., Uroshevik, V. K., Demiri, I., & Cvetanovski, V. (2016). Factors associated with lethal outcome in patients with severe form of influenza. prilozi, 37(2-3), 63-72.
- Dalziel, S. R., Thompson, J. M., Macias, C. G., Fernandes, R. M., Johnson, D. W., Waisman, Y.,... & Plint, A. (2013). Predictors of severe H1N1 infection in children presenting within Pediatric Emergency Research Networks (PERN): retrospective case-control study. Bmj, 347.
- Dimitrijević, D., Ilić, D., Adrović, S. R., Šuljagić, V., Pelemiš, M., Stevanović, G.,... & Grujićić, S. Š. (2016). Predictors of hospitalization and admission to intensive care units of influenza patients in Serbia through four influenza seasons from 2010/2011 to 2013/2014. Japanese journal of infectious diseases, JJID-2016.
- Garcia, M. N., Philpott, D. C., Murray, K. O., Ontiveros, A., Revell, P. A., Chandramohan, L., & Munoz, F. M. (2015). Clinical predictors of disease severity during the 2009–2010 A (HIN1) influenza virus pandemic in a paediatric population. Epidemiology & Infection, 143(14), 2939-2949.
- Huang, W. T., Chang, C. H., Hsu, Y. F., & Chuang, J. H. (2015). Prognostic factors for mortality in patients hospitalized with influenza complications, in Taiwan. International Health, 7(1), 73-75.
- Kwong, J. C., Schwartz, K. L., Campitelli, M. A., Chung, H., Crowcroft, N. S., Karnauchow, T.,... & Richardson, D. C. (2018). Acute myocardial infarction after laboratory-confirmed influenza infection. New England Journal of Medicine, 378(4), 345-353.
- LaBeaud, A. D., Wentworth, B., Gildengorin, G., Tam, K., Guardia-LaBar, L., & Petru, A. (2013). Comparison of moderate and severe hospitalized pediatric 2009 H1N1 influenza cases. The Pediatric Infectious Disease Journal, 32(2), e90-e93.
- Li, G., Yilmaz, M., Kojicic, M., Fernández-Pérez, E., Wahab, R., Huskins, W. C.,... & Gajic, O. (2009). Outcome of critically ill patients with influenza virus infection. Journal of Clinical Virology, 46(3), 275-278.
- Lynfield, R., Davey, R., Dwyer, D. E., Losso, M. H., Wentworth, D., Cozzi-Lepri, A.,... & Ternesgen, Z. (2014). Outcomes of influenza A (H1N1) pdm09 virus infection: results from two international cohort studies. PLoS One, 9(7), e101785.
- Mosby, L. G., Rasmussen, S. A., & Jamieson, D. J. (2011). 2009 pandemic influenza A (H1N1) in pregnancy: a systematic review of the literature. American journal of obstetrics and gynecology, 205(1), 10-18.
- Mertz, D., Geraci, J., Winkup, J., Gessner, B. D., Ortiz, J. R., & Loeb, M. (2017). Pregnancy as a risk factor for severe outcomes from influenza virus infection: a systematic review and meta-analysis of observational studies. Vaccine, 35(4), 521-528.
- Myles, P. R., Semple, M. G., Lim, W. S., Openshaw, P. J., Gadd, E. M., Read, R. C.,... & Armstrong, C. (2012). Predictors of clinical outcome in a national hospitalised cohort across both waves of the influenza A/H1N1 pandemic 2009–2010 in the UK. Thorax, 67(8), 709-717.
- Omer, S. B., Goodman, D., Steinhoff, M. C., Rochat, R., Klugman, K. P., Stoll, B. J., & Ramakrishnan, U. (2011). Maternal influenza immunization and reduced likelihood of prematurity and small for gestational age births: a retrospective cohort study. PLoS Med, 8(5), e1000441.
- Siston, A. M., Rasmussen, S. A., Honein, M. A., Fry, A. M., Seib, K., Callaghan, W. M.,... & Moore, Z. (2010). Pandemic 2009 influenza A (H1N1) virus illness among pregnant women in the United States. Jama, 303(15), 1517-1525.
- Tekin, S., Keske, S., Alan, S., Batirel, A., Karakoc, C., Tasdelen-Fisgin, N.,... & Yilmaz-Karadag, F. (2019). Predictors of fatality in influenza A virus subtype infections among inpatients in the 2015–2016 season. International Journal of Infectious Diseases, 81, 6-9.
Evidence tabellen
Tabel Non-hospitalized patients (favourable) versus hospitalized patients (unfavourable)
|
Author |
Study characteristics |
Patient characteristics |
Definition of favourable clinical course of influenza |
Definition of unfavourable clinical course of influenza (includes at least one of the outcomes as defined in the PICO) |
Prognostic factors studied and method of measurement (*prognostic factors included in final multivariate model) |
Prognostic factors (mentioned in our PICO**) associated with outcomes (unfavourable course of influenza) |
Estimates of prognostic effect
adjusted for all variables mentioned in former column |
Comments |
|
Bender, 2009 |
Type of study: retrospective cohort study
Setting and country: community children hospital / teriary referral center, USA
Period of data collection:July 2001 to June 2004
Funding and conflicts of interest: non-commercial funding.
|
Inclusion criteria: Children (<18 years, >6 months) presenting at emergency departments with influenza.
Exclusion criteria: Patients with coinfections of 2 or more respiratory viruses were excluded. Furthermore, patients who had the first positive influenza studies longer than 72 hours after admission, suggesting a nosocomial infection, were excluded
Potential confounders or effect modifiers: not reported
|
Non-hospitalized (discharged from the ED). N= 689
Age in months, median (IQR) 11.6 (4.4, 33.3)
Male, n (%) 362 (53%) |
Children with influenza were categorized as hospitalized (admitted to the paediatric ward, a 24-hour observation unit, or an intensive care unit) N= 541
Age in months, median (IQR) 33.3 (3.6, 36)
Male, n (%) 314 (58%) |
Demografic, historical, clinical, radiological and lab-variables
Presence/absence of: High-risk medical condition*, respiratory distress, nasal congestion, current antibiotic use, emesis, cough, fever, poor oral intake, abdominal pain, pharyngitis, diarrhea, Respiratory distress on examination*, wheeze onexamination, fever at time of examination, cough at time of examination, cough at time of examination, tititis media on time of examination.
Radiographic evidence of pneumonia* (Radiographic data was limited to presumed bacterial pneumonia. Bacterial pneumonia was diagnosed solely based on the reading of a focal infiltrate on chest radiograph by a board-certified pediatric radiologist. Radiologists were not aware of virologic testing results.)
Laboratory confirmed data: influenza B infection*, influenza A infection, C-reactive protein, alanine aminotransferase, erythrocyte sedimentation rate, white blood cell count, aspartate aminotransferase |
Radiograhpic evidence of pneumonia (related to prognostic factor in PICO: severe respiratory infection**), high risk medical condition, respiratory distress on examination, influenza B infection |
Adjusted factor-outcome associations for hospitalization, OR (95%CI):
Radiographic evidence of pneumonia, 7.82 (3.62 to 16.92)
Incremental predictive value1: not reported |
All variables were considered for inclusion for a multivariable logistic regression model. We used backwards elimination variable selection.
Variables were dropped either for being nonsignificant (p<0.1) or because of collinearity.
The model to identify predictors of hospitalization was based on nonmissing data for all variables (N = 1018). However, in a model where missing data were imputed using multiple imputation (N = 1230), the same set of predictors was identified.
Viral testing was standard of care for febrile infants younger than 90 days and in those patients with bronchiolitis. |
|
Dalziel, 2013 |
Type of study: Retrospective case-control study
Setting and country: multi-centre, multi country (USA, Canada, New Zealand, Portugal, Israel, Australia, Netherlands)
Period of data collection: between 16 April and 31 December 2009
Funding and conflicts of interest: non-commercial funding, no conflicts of interest
|
Inclusion criteria: Children presenting at emergency departments with influenza-like illness.
Exclusion criteria: We excluded patients as cases if they were admitted directly into an intensive care unit from a hospital that was not a study site (because emergency department documentation and controls were not available), did not fulfil CDC criteria for influenza-like illness in the emergency department, or had suspected pH1N1 infection that was not confirmed by laboratory testing, as defined above. Mean age ± SD:
Sex: % M / % F
Potential confounders or effect modifiers: not reported |
For each case, we identified two controls who presented with influenza-like illness to the same emergency department but who did not develop severe outcomes: one random control and one age matched control.
N=265 Mean (SD) age, years 6.6 (4.7)
Mean (SD) maximum fever at home (°C) 39.0 (0.7)
|
Cases were children who fulfilled the Centers for Disease Control and Prevention (CDC) criteria for influenza-like illness at emergency department presentation (fever measured at home or hospital (temperature ≥37.8°C or ≥100°F) and either cough or sore throat), who subsequently died or were admitted to an intensive care unit for assisted ventilation, inotropic/vasopressor support, or both (defined as severe outcomes) as a result of laboratory confirmed pH1N1 infection.
Age-matched controls n=265: Mean (SD) age, years 6.4 (4.5) Mean (SD) maximum fever at home (°C) 39.2 (0.8)
|
Gender, co-morbidities (asthma, pregnancy, chronic lung disease*, heart disease, diabetes, renal disease, malignancy/immunosuppression, cerebral palsy/developmental delay*), current illness (such as headache, nausea, diarrhoea), physical signs (such as: fever, heart rate, oxygen saturation), laboratory and radiographic investigations (such as radiograph, leukocyte count). |
Chronic lung disease**, cerebral palsy / developmental delay**, asthma**, generalised weakness, irritable/drowsy, rhinorrhoea |
Adjusted factor-outcome associations for mortality/ICU admission (compared with age-matched controls) OR (95%CI)
Comorbidities: Chronic lung disease 8.5 (1.6 to 45.1)
Cerebral palsy / developmental delay 65.9 (8.6 to 506)
Incremental predictive value1: not reported
|
Variables significant at the P=0.1 level in the univariable analysis, and with a prevalence among cases and controls of more than 2%, were included in the initial multivariable models.
OR for Asthma was not reported, since they only reported significant predictors in the multivariable model
The authors did not include variables from laboratory and radiographic investigations in the multivariable analysis owing to the low prevalence of these variables in the control groups.
We choose the age-matched group as the reference standard for the reported OR’s Imputation was used to account for missing variables in the multiavariable models
|
|
Dimitrijev, 2017 |
Type of study:
Setting and country: Cohort study, Serbia
Period of data collection: 2010-2014
Funding and conflicts of interest: none to declare |
Inclusion criteria: laboratory confirmed influenza cases reported during the 4 influenza seasons (2010 to 2014) to Institute of Public Health of Serbia
Potential confounders or effect modifiers: not reported |
Primary healthcare (n=322);
Sex (female): 157 (48.8%)
Virus: A: 4 (1.2%) A (H1) pdm09: 92 (28.9%) A (H3) 158 (49.1%) B: 67 (20.8%)
Vaccine history: 11 (3.4%)
Pregnancy in women aged 16 to 45 4 (2.5%) |
Hospitalized (H) (n=329)/ ICU patients (ICU) (n=126)
Sex (female) H: 164 (49.8) ICU: 54 (42.9)
Virus (H): A: 14 (4.3%) A (H1) pdm09: 178 (54.1%) A (H3) 77 (23.4%) B: 60 (18.2%)
Virus (ICU): A: 8 (6.3%) A (H1) pdm09: 85 (67.5%) A (H3) 17 (13.4%) B: 16 (12.7%)
Vaccine history: H: 8 (2.4%) ICU: 4 (3.2)
Pregnancy in women aged 16 to 45 H: 11 (6.7) ICU: 1 (1.9) |
Sex, adults≥65 year* Type and sub-typed of the virus Comorbidities* |
Age (adults ≥ 65 year)** Comorbidities** (chronic respiratory diseases, asthma, diabetes mellitus, chronic heart diseases, chronic kidney diseases, immune compromised status) Type and sub-type of the virus (virus A, A(H1)pdm09, A(H3), B) More than 3 days from the onset of the symptoms to visiting a physician |
Adjusted factor-outcome associations for ICU/hospital admission OR (95%CI):
Hospitalized patients versus. patient treated in public healthcare: Adults≥65 year: 3.85 (1.57 to 9.45)
Chronic respiratory diseases: 6.68 (2.68 to 16.65
Asthma: 6.82 (1.94 to 23.95
Diabetes Mellitus 4.75 (1.53 to 14.72
Chronic heart diseases 4.29 (2.02 to 9.08)
Chronic kidney diseases: 4.23 (1.35 to. 13.28 Immune compromised status: 4.31 (1.9 to. 9.74
Incremental predictive value1: not reported |
Comorbidities defined as present/absent
All test variables with statistical significance in the univariate model (p ≤ 0.10) were included in the multivariate model. Statistical testing was performed at the level of statistical significance of 0.05 |
|
Garcia, 2015 |
Type of study: Retrospective electronic medical record review study
Setting and country: Single centre, USA
Period of data collection: April 2009 to June 2010
Funding and conflicts of interest: none
|
Inclusion criteria: Cases of influenza A(H1N1) pandemic virus (A (H1N1)pdm) were defined as patients aged 0–18 years who presented to TCH between 1 April 2009 and 30 June 2010, and who were diagnosed with laboratory-confirmed A(HIN1)pdm influenza infection.
Exclusion criteria: Cases transferred from other healthcare organizations
Overall, 263 (38%) patients were hospitalized without being admitted to the ICU, and 116 (17%) were admitted to the ICU. Males were significantly more likely to be admitted to the hospital or ICU than females (P = 0·016, OR 1·42, 95% confidence interval (CI) 1·07–1·89). Compared to non-Hispanic whites, children identified as minorities were less likely to be admitted to the hospital or ICU. Black race was associated with 0·54 times lower odds (P = 0·010, 95% CI 0·34–0·87) and Hispanic with 0·43 times lower odds (P < 0·001, 95% CI 0·28–0·64). Compared to children with private insurance, children with Texas Children’s Health Plan (TCHP)/Medicaid (P = 0·004, odds ratio (OR) 0·63, 95% CI 0·46–0·86) or no insurance (P < 0·001, OR 0·21, 95% CI 0·11–0·35) were less likely to be admitted to the hospital or ICU. Because of the strength and interaction of these associations, we adjusted for race and insurance status in all multivariate models. |
N=316 Non-hospitalized cases were patients who were discharged home directly from the ED in <24 h
|
N=379 Hospitalized cases were defined as those who were admitted for 524 h but were not admitted to the ICU. ICU cases were defined as patients admitted to the ICU directly from the ED or during the course of hospitalization |
Co-morbidities: -cardiovascular condition* -developmental delay* -haemotological disease* -lung condition* -neurocognitive disorder* -neurological disorder* -neuromuscular disorder* -obesity* -premature birth -renal condition* seizure disorder* |
Co-morbidities: -cardiovascular condition** -developmental delay** -haemotological disease** -lung condition** -neurocognitive disorder** -neurological disorder** -neuromuscular disorder** -obesity** -premature birth -renal condition** seizure disorder** |
Adjusted factor-outcome associations for (ICU)-admission (Adjusted for race and insurance status)
Developmental delay: OR: 2.2 (95%CI: 0.99 to 4.87)
Haematological disease OR: 2.22 (95%CI: 1.22 to 4.05)
Lung condition: OR: 2.84 (95%CI: 1.55 to 5.21)
Obesity: OR: 3.28 (95%CI: 1.05 to 10.21)
Seizure disorder: OR: 4.71 (95%CI: 2.11 to 10.52)
Incremental predictive value1: not reported |
The following OR’s were not reported for the adjusted multivariate model: -cardiovascular condition -haemotological disease -lung condition -obesity - seizure disorder
All risk factors on univariate analysis with P≤0·25 were included in multivariate analysis. A backwards step-wise elimination of the highest non-significant value method was used. Only those factors with P≤0·10 were considered significant in final multivariate models.
Definitions of specific clinical events are as follows: Dyspnoea was defined as increased respiratory rate based on the standard respiratory rate for age, and reported laboured breathing, with or without related cyanosis, or hypoxaemia (arterial oxygen saturation below 90%). Cardiovascular diseases included electrical abnormalities, physical/structural abnormalities and congenital heart disease. Immunosuppression was defined by receipt of immunosuppressive medications or chemotherapy. Lung disease was defined by a collective grouping of chronic lung diseases, including rare lung disorders. Seizures were defined as clinical seizures with or without evidence of encephalitis or meningitis, febrile seizures, and a pre-existing seizure disorder with increased frequency of seizures. |
**pregnancy, age, comorbidity, immune-compromised
1 Incremental predictive value is the predictive value beyond standard demographic factors and the established risk factors (for example smoking, blood pressure, lipid levels, diabetes, cancer stage, et cetera), for example change in c-statistic
Table Hospitalized patients (favourable) versus ICUpatients/death (unfavourable)
|
Author |
Study characteristics |
Patient characteristics (ILI/confirmed, influenza type/period, admissiontype) |
Definition of favourable clinical course of influenza |
Definition of unfavourable clinical course of influenza (includes at least one of the outcomes as defined in the PICO) |
Prognostic factors studied and method of measurement (*prognostic factors included in multi-variate model) |
Prognostic factors (mentioned in our PICO**) associated with outcomes (unbenificial clinical course of influenza) |
Estimates of prognostic effect |
Comments |
|
Huang, 2014 |
Type of study:
Setting and country: databasestudy, Taiwan
Period of data collection: week 26 2009 through week 25 2012
Funding and conflicts of interest:
|
Hospitalized patients in Taiwan, who had onset of illness from week 26, 2009 through week 25 2012;
A confirmed case is defined as influenza-like illness and evidence of pneumonia, neurologic symptoms, myopericarditis or invasive bacterial infections, with a positive influenza real-time reverse transcription PCR.
Baseline: Of 4735 patients (413 deaths (8.7%)) who had confirmed hospitalized influenza with complications, median age was 50 years (IQR 24–69 years), and median length from illness onset to hospital discharge or mortality was 8 days (IQR 5–14 days).
Potential confounders or effect modifiers: not reported |
Non-fatal (n=4126) |
Fatal (399) |
Age*, sex*, high-risk medical condition*, vaccinated, oseltamivir treatment withing 48 hours after illness onset*, Influenza PCR result.
Definition high-risk medical condition: Persons who have chronic pulmonary (including asthma), cardiovascular (except hypertension), renal, hepatic, neurologic, neurodevelopment, hematologic or metabolic (including diabetes mellitus) disorders; are immunosuppressed (including immunosuppression caused by medications or by HIV); are pregnant; are severely obese (body mass index ≥35).
|
Age**, high-risk medical condition**, age group (over/under 50 years), sex, vaccinated y/n, oseltamivir treatment withing 48 hours after illness onset, influenza PCR result (H1N1/H3N2/B) |
Adjusted factor-outcome associations for mortality, OR (95%CI)
Age ≥50 years: 2.05 (p<0.001)
High-risk medical condition: 3,38 (p<0.001)
Incremental predictive value1: not reported |
Variables that differed between the nonfatal and fatal cases at p,0.05 were evaluated in the multivariate logistic regression models by using backward elimination procedures, retaining variables that were associated at p,0.10.
Data in the multi-variate analysis excluded 210 cases (14 deaths) for which low viral loads prevented further subtypings. |
|
LI, 2009 |
Type of study: Retrospective cohort
Setting and country: Two academic medical centers, USA
Period of data collection: 1999 to 2006
Funding and conflicts of interest: None
|
Inclusion criteria: Adult patients admitted to ICUs of academic medical centers (consecutive patients). Laboratory proven influenza virus infection was defined as follows4: one or more signs or symptoms of flu-like illness, including abrupt onset of fever, cough, headache, and myalgia accompanied by the laboratory evidence of influenza virus infection.
Exclusion criteria: Not applicable
A total of 111 patients, 54 (48.6%) male, 106 Caucasian (95.4%), with a mean age of 65.3±18.9 were admitted to the medical ICUs of two tertiary care hospitals. There was no difference in mortality between influenza A and influenza B (18.5% versus 25%, P = 0.65). Sixtyfour patients (57.7%) had pre-existing chronic pulmonary disease and 19% were immunosuppressed. Only 35 (31%) patients had received influenza vaccination before hospital admission, although the vast majorities (106, 95%) were eligible for routine vaccination based on age and/or chronic disease criteria.
Potential confounders or effect modifiers: not reported |
Survivors (n=90)
|
Non-survivors (n=21)
|
APACHE III*, ARDS*, history of immunesuprression*
No informationa available on univariate model |
APACHE III, ARDS**, history of immunesuppression** |
Adjusted factor-outcome associations for mortality, OR (95%CI)
ARDS (acute respiratory distress symptom): 7.7, 2.3–29.
History of immunosuppression 7.19 (1.9–28).
Incremental predictive value1: not reported |
Immunosuppression was defined as therapy with immunosuppressants, chemotherapy, radiation or long term/recent high dose of steroids; or active leukemia, lymphoma or AIDS.5 Acute lung injury (ALI) and ARDS were defined according to the American–European Consensus Conference.Primary and secondary bacterial infections were defined according to Center for Disease Control (CDC) criteria |
|
Tekin, 2019 |
Type of study: Cohort study
Setting and country: Multicentre (11 hospitals); Turkey
Period of data collection: 2015-2016
Funding and conflicts of interest: No funding of any kind was received. The data were generated as part of routine work. Conflicts of Interest: none to declare.
|
Inclusion criteria: Patients who were hospitalized for an influenza-like illness (ILI) in Istanbul during the 2015–2016 influenza season and who were positive for influenza A by PCR were included.
Exclusion criteria: Patients who were diagnosed with influenza B and influenza A by rapid antigen test (ELISA) were excluded.
The mean age of the 222 patients hospitalized with influenza A was 39 years (standard deviation (SD) 27 years); 47 patients (21%) were older than 65 years. One hundred and twenty-six patients (57%) were female. Among the hospitalized patients, 25 (11.2%) died. Thirteen of the 25 fatal cases (54%) had influenza A(H3N2) and 11 (45%) had influenza A(H1N1); the virus was untyped for one patient (p < 0.001). There were no deaths under age 16 years. The mean age of the patients who died was 65 years; the mean age of those who survived was 36 years (p < 0.001). The fatality rate was significantly higher among patients with chronic heart and kidney diseases (p < 0.001), chronic neurological diseases (p = 0.009), and malignancies (p = 0.021)
Potential confounders or effect modifiers: not reported |
Survivors (n=197)
|
Non-suvrivors (n=25)
|
Age>65 years*
H2N2 versus H1N1*
One day delay for oseltamivir*
Secondary bacterial infection*
Presence of malignancy* |
Age>65 years**, H2N2 versus H1N1, one day delay for oseltamivir secondary bacterial infection, presence of malignancy |
Adjusted factor-outcome associations for mortality, OR (95%CI)
Age>65 year: OR 6.0 (95%CI: 2.07 to 23.08)
Incremental predictive value1: not reported
|
Parameters found to be statistically significant in the univariate analysis were tested by logistic regression to predict the risk of fatality.
The independent variables included in the model were age >65 years, detection of influenza A(H3N2) versus influenza A(H1N1), early use of neuraminidase inhibitors, secondary bacterial infection, and having a malignant disease Statistical significance was set at p < 0.05. |
|
Lynfield, 2014 |
Type of study: Prospective cohort study
Setting and country:
Period of data collection: October 2009 and December 2012
Funding and conflicts of interest: Leidos Prime Contract HHSN261200800001E, NCI/NIAID. The funders had no role in study design, data collection and analysis, decision to publish, or preparation of the manuscript. No conflicts of interest.
|
Inclusion criteria: A(H1N1)pdm09 virus infection in adults (≥18 years of age), ranging from outpatients presenting with mild ILI symptoms (FLU 002) to those with more serious disease requiring hospitalization (FLU 003), and both studies included follow-up periods. Initially, sites were not open to enrollment until A(H1N1)pdm09 virus was circulating in their geographic areas. Laboratory confirmed A(H1N1)pdm09 virus infection
Exclusion criteria: not applicable
Three hundred and seven (78.3%) of the 392 A(H1N1)pdm09 patients were enrolled from a general hospital ward and 85 (21.7%) were enrolled from an ICU. The median age of hospitalized patients with A(H1N1)pdm09 was 48 years; Fifty-one percent of patients were female; 11% were Asian, 4% were black, and 85% were white/other; the median BMI was 26 kg/m2; 5.3% had a BMI of ≤40 kg/m2; 30% reported smoking; and 25% of the women aged ≥45 years were pregnant.
Potential confounders or effect modifiers: not reported |
Outpatients n=80;
N=22 with unknown disease status |
ICU admission / Hospitalization (FLU003 cohort) N=290
749 hospitalized patients were enrolled of whom 392 (52%) had laboratory-confirmed A(H1N1)pdm09 virus infection.
Enrolled outpatients with ILI were followed for 14 days for hospitalization or death. Henceforth for FLU 002 patients, this composite outcome is referred to as ‘‘disease progression’’.
Enrolled hospitalized patients were followed for 60 days. For general ward patients, outcomes assessed included death, ICU admission and/or mechanical ventilation, or prolonged hospitalization; the latter was defined as an inpatient stay exceeding 28 days of the 60-day follow-up period, not necessarily consecutively. For patients enrolled after ICU admission, death or prolonged hospitalization for.28 days were the primary outcomes. For FLU003 patients, this composite outcome, stratified according to whether patients were enrolled from a general ward or ICU, is referred to as ‘‘disease progression’’. |
Race (Asian, black, white/other)*; Age, female*; BMI*; onset to enrolment*; season of enrolment*; medical history (smoker, Asthma/COPD, Diabetes, CVD/liver/renal, HIV/other immune)*; enrolment status (general ward; ICU)* |
Age**, Co-morbidities** (Asthma/COPD, Diabetes, CVD/liver/renal); HIV/other immune. |
Adjusted OR associated with mortality in FLU003 cohort OR (95%CI)
Age: 1.31 (0.95 to 1.8)
Co-morbidities: Asthma/COPD: 0.49 (0.13 to 1.79)
Diabetes 3.33 (0.97 to 11.4)
CVD/liver/renal: 1.15 (0.37 to 3.61)
Immune-diseases: 3.55 (1.1- 11.5)
Incremental predictive value1: not reported |
enrolled outpatients with ILI were followed up for 14 days for hospitalization or death. Enrolled hospitalized patients were followed for 60 days (outcomes assessed: death, ICU admission, mechanical ventilation, prolonged hospitalization); for patients enrolled after ICU admission: death and prolonged hospitalization were assessed. Length of hospitalization, resolution of symptoms and resumption of normal activities were assesses at 28 and 60 days after enrolment. Multiple imputation was used for incomplete outcome data
In our analysis we present the FLU 003 cohort since mortality data were available
Among women aged ≤ 45 years, pregnancy was associated with an increased risk of progression in FLU 002 (OR =30.1; p = 0.015) and was not associated with disease progression in FLU 003 (OR =0.88; p = 0.89) (p= 0.07 for difference in ORs). |
|
Labeaud, 2013 |
Type of study: Retrospective cohort
Setting and country: Children hospital single centre, USA
Period of data collection: April 2009 to April 2010
Funding and conflicts of interest: not described
|
Inclusion criteria: Medical records of all children hospitalized between April 2009 and February 2010, with laboratory-confirmed H1N1
Exclusion criteria: - There was no significant difference in H1N1 severity between age groups or by gender. Race differed among groups, with those self-reported as “white” more likely to have severe cases than African Americans or Hispanics (P = 0.02). There was no difference in average body mass index between groups; obesity defined as >25.0 kg/m2 was not associated with more severe dis ease
Potential confounders or effect modifiers: adjusted for age, gender, ethnicity |
Hospitalization on general wards (n=90)
|
paediatric intensive care unit admission, intubation, or death
N=47
|
Chronic comorbid conditions Advisory Committee on Immunization Practices risk factors Cardiac Pulmonary Immunosuppression Metabolic Neuromuscular Hemoglobinopathy Genetic Non-Advisory Committee on Immunization Practices risk factors Gastrointestinal Obesity, Prematurity |
Age**, sex, race, neuromuscular disorders, O2 requirement, hyponatremia, white blood cell count, platelet count. |
Adjusted factor-outcome associations for mortality, ICU-admission or intubation, OR (95%CI)
Age (OR): 0.94 (0.83 to 1.05)
Incremental predictive value1: not reported
|
A multivariate logistic regression model adjusted for age, gender and ethnicity was constructed based on those factors that approached significance (P < 0.15) to predict severity of H1N1 |
|
Chaves, 2013 |
Type of study: database study.
Setting and country: surveillance data, USA
Period of data collection: October 2010 through April 2011
Funding and conflicts of interest: Financial support. The Influenza Hospitalizations Surveillance Network (FluSurv-NET) is a collaboration of state health departments, academic institutions, and local partners and is funded by the Centers for Disease Control and Prevention (CDC). This publication was supported in part by Cooperative Agreement number CDC-RFA-CK12–1202 and 5U38HM000414 from the CDC. Its contents are solely the responsibility of the authors and do not necessarily represent the official views of CDC. Potential conflicts of interest. W. S. is a member of data safety monitoring boards for Merck and Sanofi-Pasteur and occasionally consults for Pfizer, GlasoSmithKline, and Dynavax.All other authors report no potential conflicts.
|
Inclusion criteria: A person residing in the surveillance area who was admitted to 1 of the surveillance hospitals ≤14 days after or ≤3 days before a positive influenza test (children / adults) -October 2010 through April 2011. Patients treated with antivirals Virus type: pH1N1 / B; H3N2 influenza A
Exclusion criteria: hospital acquired influenza cases (defined as those with onset >3 days after hospitalization), pregnant women
Demographic characteristics in hospitalized children were similar by virus type and subtype, although the age distribution of children with H3N2 was slightly shifted toward children aged <5 years (P =.02). Among adults, distribution of cases by virus type and subtype varied significantly by age (P <.0001). Among those with H3N2, 60.8% of hospitalizations were in those aged ≥65 years, compared with 42.4% and 14.2% among influenza B and pH1N1 respectively. Hospitalizations associated with pH1N1 were highest among those aged 18–49 years (45.7%) and 50–64 years (40.1%). Morbid obesity was more common among patients hospitalized with pH1N1 (18.2%) than among those with H3N2 (9%) or influenza B (9.6%; P <.0001).
Potential confounders or effect modifiers: not reported |
Non-severe: admission to hospital. Children: n=689; adults: n=2255 |
Patient was classified as having severe influenza if admitted to an ICU or if the patient died during hospitalization. Children: n=141; adults: n=536 |
Virustype*, Age*, sex, underlying medical conditions, selected medical conditions (asthma*, chronic lung disease*, chronic vascular disease*, chronic metabolic disease*, neuromuscular disorders*, immunosuppressive status, developmental delay, renal disease, morbid obese), antiviral started <3d from admission, vaccination≥14 days prior to hospitalization.
For adults: morbid obesity and ntiviral started <d from admission were also included in multivariate model, in addition to * (children)
|
Children: Virustype, Age**, underlying medical conditions, selected medical conditions (asthma**, chronic lung disease**, chronic vascular disease**, chronic metabolic disease**, neuromuscular disorders**) antiviral started <3d from admission. For adults: Virustype, Age**, underlying medical conditions, selected medical conditions (chronic lung disease**, chronic vascular disease**, chronic metabolic disease**, neuromuscular disorders**) antiviral started <3d from admission.
|
Adjusted factor-outcome associations for mortality or ICU admission, OR (95%CI)
Children: Age: <2 years: 1.17 (95%CI: 0.61 to 2.22)
2-4 years: 1.25 (.064 to 2.44)
5-17 years: reference.
Selected underlying medical conditions Asthma: 1.26 (0.66 to 2.39) Chronic lung disease: 2.11 (0.97 to 4.57) Chronic vascular disease: 1.15 (.35 to 3.74) Chronic metabolic disease: 5.23 (1.74 to 15.69)
Neuromuscular disorder: 4.84 (2.02 to 11.56)
Adults: Age: 18-49 years: Reference
50-64 years: 1.2 (95%CI: 0.88 to 1.64)
≥65 years: 0.94 (0.67 to 1.32).
Selected underlying medical conditions Chronic lung disease: 1.46 (1.12 to 1.89) Chronic vascular disease: 1.19 (.92 to 1.54) Chronic metabolic disease: 1.11 (0.87 to 1.42)
Neuromuscular disorder: 1.68 (1.11 to 2.52) Morbid obesity: 1.17 (0.82 to 1.68)
Incremental predictive value1: not reported
|
Loss to follow up: After excluding 2169 cases with incomplete information on virus subtype and 494 cases that were either hospital-acquired cases or cases that occurred in pregnant women, 3621 were further analysed
Variables known as potential confounders or that were associated with disease severity in the univariable analysis (P <.10) were included in the multivariable regression models; |
|
Myles, 2012 |
Type of study: Cohort study
Setting and country: 75 hospitals in the UK
Period of data collection: 25 April 2009 to 26 January 2010
Funding and conflicts of interest: Funding:FLU-CIN was supported by the Department of Health, England (principal funder), and the Scottish government Chief Medical Officer and Public Health Directorate in Scotland. Chairmanship of the FLU-CIN Strategy Group that includes JSN-V-T, WSL, MGS, PJMO, RCR, BLT, SJB, JMcM, JEE and KGN as members was provided by the Department of Health, England. The report was approved for publication by the Department of Health, England. All authors had full access to all data in the study. The FLU-CIN Strategy Group had final responsibility for the interpretation of findings and decision to submit for publication.
Conflicts of interest: several authors received funding of pharmaceutical companies. |
Inclusion criteria: Patients with pandemic influenza A/H1N1 2009 infection (‘pandemic H1N1’) confirmed by real-time reverse transcribed PCR
Exclusion criteria: Not applicable
N= 1520
The median length of hospital stay was 3 days (IQR 2e6). One in six (16.5%) patients needed admission to high dependency (4.1%) or intensive care (12.4%) units (respectively level 2 and level 3 care) and the in-hospital case death rate was 5.3% (children 0e15 years: 3.8%; adults 16e64 years: 5.6%; older people >65 years: 10.7%; first wave: 5.0%; second wave: 5.4%). Potential confounders or effect modifiers: not mentioned
|
N= 1252 Controls (admitted patients) |
N= 268 ‘Severe outcome’ was defined as admission to level 2 (high dependency unit) or level 3 (intensive care unit) facilities,ii and/or death
|
Age*, asthma*, chronic pulmonary conditions*, neurological disorders*, cardiovascular disease*, radiological pneumonia*, C-reative protein*, recorded obsese*, altered consciousness*, dyspnoea*, pre-admission antibiotics, required supplemental oxygen on admission*, intravenous fluid replacement on admission*, delayed admission*, Length of hospital stay, in-hospital antibiotic therapy. |
Model I: Age**, asthma**, chronic pulmonary conditions**, neurological disorders**, cardiovascular disease**, recorded obsesity**,
Model II: radiological pneumonia**, C-reative protein, altered consciousnes, dyspnoe, pre-admission antibiotics, required supplemental oxygen on admission, intravenous fluid replacement on admission, delayed admission, Length of hospital stay, in-hospital antibiotic therapy. |
Adjusted factor-outcome associations for mortality and/or ICU admission and/or high dependency unit, OR (95%CI)
Model 1: † see below this table
Model 2: Radiologically confirmed pneumonia: 1.83 (1.27 to 2.64)
Other variables in model 2 (not related to this PICO) Delayed admission Presenting symptoms (dyspnoea, altered conscousness, required supplemental oxygen on admission, intravenous fluid replacement on admission, C-reactive protein.
Incremental predictive value1: not reported
|
A multivariable regression analysis was conducted for statistically significant variables (p≤0.05) identified during univariate analyses; each variable within model 1 or 2 has been adjusted for all other variables in that model.
Two separate models were constructed to examine potential predictors of severe outcome: model 1 included patient characteristics (demographic characteristics and pre-existing comorbidities) while model 2 included clinical characteristics (symptoms, findings of clinical examination and investigations). Both models were then restricted to include only the variables that were significantly associated with an increased risk
|
|
Angelo, 2004 |
Type of study: Retrospective chart review
Setting and country: Single centre, USA
Period of data collection: 1998 - 1999
Funding and conflicts of interest: Not reported
|
Inclusion criteria: Adult inpatients whose nasopharyngeal swabs were positive within 48 hours of presentations to the hospital and with charts available (influenza A).
Exclusion criteria: Influenza B
N= 132
Mean age ± SD: 77 years
Sex: 58% M / 42% F
Smoking history: 14 % current smoker; 30% past smoker, 36% never smoked, 20% not documented. Average length of stay: 7.4 days; Race: 92% white; 5% black, 2% Asian, 1% Hispanic.
Potential confounders or effect modifiers: not mentioned |
N= 105 usual outcome group: all other patients not included in the poor outcome group.
|
N= 27 poor outcome group: patients who died, experienced respiratory failure requiring aggressive therapy (intubation, biPAP, nonrebreather or facemask oxygen delivery, or aggressive blood pressure support (vasopressors) during hospitalization |
COPD*, coronary artery disease*, congestive heart failure*, stroke or transient ischemic attack*, chronic renal insuffiency, dialysis*, chief complaint of shortness of breath*, mean respiratory rate, mean saturation*, mean creatinine*, CHF/vascular congestion Chest X-ray pattern*, ineterstitial Chest X-ray pattern* |
COPD**, coronary artery disease**, congestive heart failure**, stroke** or transient ischemic attack**, chronic renal insuffiency**, dialysis, chief complaint of shortness of breath, mean respiratory rate, mean saturation, mean creatinine, CHF/vascular congestion Chest X-ray pattern, ineterstitial Chest X-ray pattern |
Adjusted factor-outcome associations for mortality or respiratory failure, OR (95%CI)
Not reported, no multivariate model was developed because of non-significant factors in univariate analysis
Incremental predictive value1: not reported |
Multivariate analysis using backward stepwise logistic regression was performed on the variables identified as significant by the univariate analysis |
**pregnancy, age, comorbidity, immune-compromised, sepsis, shock, severe respiratory infection
1 Incremental predictive value is the predictive value beyond standard demographic factors and the established risk factors (for example smoking, blood pressure, lipid levels, diabetes, cancer stage, et cetera), for example change in c-statistic
†Outcomes Model 1 Myles (2012)
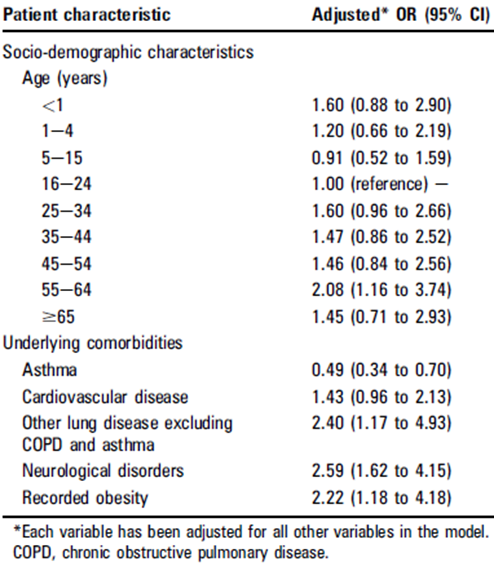
Table of quality assessment - prognostic factor (PF) studies - Based on: QUIPSA (Haydn, 2006; Haydn 2013)
Research question: which prognostic factors are associated with worse outcomes for patients with influenza
|
Study reference
(first author, year of publication) |
Study participation1
Study sample represents the population of interest on key characteristics?
(high/moderate/low risk of selection bias) |
Study Attrition2
Loss to follow-up not associated with key characteristics (i.e., the study data adequately represent the sample)?
(high/moderate/low risk of attrition bias) |
Prognostic factor measurement3
Was the PF of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to PF) |
Outcome measurement3
Was the outcome of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to outcome) |
Study confounding4
Important potential confounders are appropriately accounted for?
(high/moderate/low risk of bias due to confounding) |
Statistical Analysis and Reporting5
Statistical analysis appropriate for the design of the study?
(high/moderate/low risk of bias due to statistical analysis) |
|
Bender, 2009 |
Low |
Moderate (not reported) |
Moderate (radiographic data without virologic testing results) |
Low |
Moderate |
Low |
|
Dalziel, 2013 |
Low |
Low (imputation for missing data) |
Low |
Low |
Moderate |
Low |
|
Dimitrijev, 2017 |
Low |
Moderate (respons rate questionnaire 85%; no info on missing data) |
Low |
Low |
Moderate |
Low |
|
Garcia, 2015 |
Low |
Moderate (not reported) |
Low |
Low |
Low (accounted for race and insurance status) |
Low |
|
Lynfield, 2014 |
Low |
Low (multiple imputation for missing data) |
Low |
Low |
Moderate |
Low |
|
Hong, 2014 |
Low |
Moderate (not reported) |
Low |
Moderate |
Moderate |
Low |
|
Huang, 2014 |
Low |
High (214 cases with low viral loads were excluded) |
Moderate (compound measure for co-morbidity) |
Low |
Moderate |
Low |
|
LI, 2009 |
Low |
Moderate (not reported) |
Moderate |
Low |
Moderate |
Moderate (no info on univariate analysis) |
|
Tekin, 2019 |
Low |
Moderate (not reported) |
Low |
Low |
Moderate |
Low |
|
Cvetanosvska, 2016 |
Not applicable for outcome, no prognostic factors related to our PICO in their multivariate model |
|||||
|
Labeaud, 2013 |
Low |
Moderate (not reported) |
Low |
Low |
Moderate |
Low |
|
Chaves, 2013 |
Low |
High (many cases excluded) |
Low |
Low |
Moderate |
Low |
|
Myles, 2012 |
Low |
Moderate (not reported) |
Moderate |
Moderate (compound measure) |
Moderate |
Moderate |
|
Angelo, 2004 |
Not applicable for outcome, no multivariate model available because of non-significant factors in univariate model |
|||||
A https://methods.cochrane.org/sites/methods.cochrane.org.prognosis/files/public/uploads/QUIPS%20tool.pdf.
1 Adequate description of: source population or population of interest, sampling and recruitment, period and place of recruitment, in- and exclusion criteria, study participation, baseline characteristics.
2 Adequate response rate, information on drop-outs and loss to follow-up, no differences between participants who completed the study and those lost to follow-up.
3 Method of measurement is valid, reliable, setting of measurement is the same for all participants.
4 Important confounders are listed (including treatments), method of measurement is valid, reliable, setting of measurement is the same for all participants, important confounders are accounted for in the design (matching, stratification, initial assembly of comparable groups), or analysis (appropriate adjustment).
5 Enough data are presented to assess adequacy of the analysis, strategy of model building is appropriate and based on conceptual framework, no selective reporting.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Callaghan, 2015 |
Geen analyse naar prognostische factoren |
|
Chang, 2019 |
Study on prediction tool for geriatric patients with Influenza; geen prognostische factoren uit de PICO aanwezig |
|
Coleman, 2018 |
Vergelijkt high income countries versus. middle/low income countries, voldoet niet aan PICO |
|
Cordero, 2012 |
Geen multivariate analyse toegepast |
|
Durani, 2017 |
Geen multivariate analyse van de factoren toegepast |
|
Gabriel, 2014 |
Geen systematische review (geen search / selectie / criteria) |
|
Garnacho-Montero, 2013 |
Vergelijkt jongere met oudere groep, voldoet niet aan PICO |
|
Gogia, 2017 |
Geen vergelijking met groep die gunstig beloop had; geen informatie over factoren meegenomen in regressieanalyses |
|
Gutierrez-Cuadra, 2012 |
Geen vergelijking met groep die gunstig beloop had, vergelijking tussen ziekenhuizen. Voldoet niet aan PICO |
|
Gutierrez-Gonzalez, 2019 |
Multivariate analyse naar effect vaccinatie, voldoet niet aan PICO |
|
Hak, 2001 |
High risk comorbidity populatie, voldoet niet aan PICO |
|
Hak, 2002 |
Geen primaire studie-data; betreft vaccinatie-vraagstuk. |
|
Hong, 2014 |
Rapporteert enkel de uitkomstmaat complicaties, voldoet niet aan PICO |
|
Jansen, 2014 |
Geen analyse naar prognostische factoren |
|
Kaya, 2012 |
Geen multivariate analyse van de factoren toegepast |
|
Khandaker, 2014 |
Geen vergelijking met groep die gunstig beloop had. |
|
Kute, 2011 |
Geen multivariate analyse van de factoren toegepast |
|
Lenzi, 2012 |
Geen multivariate analyse van de factoren toegepast |
|
Madhi, 2002 |
Geen multivariate analyse toegepast |
|
Martinez, 2011 |
HIV-infected adults, voldoet niet aan PICO |
|
Meijer, 2015 |
Geen inclusie van prognostische studies in de review |
|
Nguyen, 2016 |
Onderzoekt de timing van influenza in het griepseizoen op mortaliteit vanwege cardiovasculaire ziekte; voldoet niet aan PICO. |
|
Ramos, 2016 |
Vergelijkt twee leeftijdsgroepen, voldoet niet aan PICO |
|
Segaloff, 2018 |
Geen vergelijking met groep die gunstig beloop influenza had |
|
Torres, 2012 |
Geen vergelijking met groep die gunstig beloop influenza had |
|
Wada, 2010 |
Geen multivariate analyse toegepast |
|
Wu, 2018 |
Geen vergelijking met groep die gunstig beloop had; voldoet niet aan PICO |
|
Yang, 2010 |
Geen vergelijking tussen groep met ziekenhuisopname en geen ziekenhuisopname (voldoet niet aan outcome van de PICO). |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-10-2021
Beoordeeld op geldigheid : 01-07-2021
|
Module[1] |
Regie-houder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Prognos-tische factoren |
NVMM |
2021 |
2026 |
Elke 5 jaar |
NVMM |
Niet van toepassing |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) kerngroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
De richtlijn is ontwikkeld in samenwerking met:
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Kindergeneeskunde
- Nederlandse Vereniging voor Klinische Geriatrie
- Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Nederlandse Vereniging voor Intensive Care
- Vereniging van specialisten ouderengeneeskunde
- Nederlands Huisartsen Genootschap
- Rijksinstituut voor Volksgezondheid en Milieu
- Patiëntenfederatie Nederland
Doel en doelgroep
Doel
Het project was het herzien en uitbreiden van de richtlijn klinische behandeling met antivirale therapie van opgenomen patiënt met influenza. Bij de oorspronkelijke richtlijn waren niet alle betrokken wetenschappelijke verenigingen en patiënten meegenomen in het opstellen hiervan en misten aanbevelingen voor specifieke patiëntengroepen. Verder is bij de herziening de inhoud uitgebreid met de behandeling van niet-opgenomen patiënten, de nieuwste ontwikkelingen in diagnostiek en wijzigingen. Hierdoor zal de patiëntenzorg in overeenstemming gebracht worden met de laatste stand van zaken.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met Influenza.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor de behandeling van patiënten met (verdenking) op influenza.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
Werkgroep
- Dr. A. (Annelies) Riezebos-Brilman, arts-microbioloog, werkzaam in het UMC Utrecht (NVMM), t/m april 2021 werkzaam in het UMC Utrecht, sinds mei 2021 werkzaam in LabMicta, Hengelo (NVMM) (voorzitter)
- Prof. dr. Menno de Jong, hoogleraar/afdelingshoofd Medische Microbiologie & Infectiepreventie, werkzaam in het Amsterdam UMC te Amsterdam (NVMM)
- Drs. K.A.S. (Karen) Couderé, AIOS Medische microbiologie, werkzaam in Elisabeth TweeSteden ziekenhuis Tilburg (NVMM)
- Dr. F.L. (Frank) van de Veerdonk, internist-infectioloog, werkzaam in het Radboudumc te Nijmegen (NIV)
- Dr. A.W.J. (Aik) Bossink, longarts, werkzaam in het Diakonessenhuis te Utrecht (NVALT)
- Dr. P.L.A. (Pieter) Fraaij, kinderarts-infectioloog/immunoloog, werkzaam in het Erasmus MC-Sophia te Rotterdam (NVK)
- Drs. M. (Marieke) Zeeman, internist-ouderengeneeskunde en klinisch farmacoloog, werkzaam in Deventer ziekenhuis te Deventer (NVKG)
- Dr. W.J. (Wouter) Meijer, gynaecoloog, werkzaam in Gelre Ziekenhuizen te Zutphen (NVOG)
- Dr. L.P.G. (Lennie) Derde, infectioloog-intensivist, werkzaam in het UMC Utrecht (NVIC)
- Dr. P. (Paul) van Houten, specialist ouderengeneeskunde, werkzaam bij Zonnehuisgroep Amstelland te Amstelveen (Verenso)
- Mevr. K. (Klaartje) Spijkers (Patiëntenfederatie Nederland)
- Dr. G.A. (Ted) van Essen, huisarts, niet praktiserend (NHG)
- Dr. A.M. (Albert) Vollaard, infectioloog, werkzaam bij het RIVM te Bilthoven (RIVM)
Meelezer
- Stichting Kind en Ziekenhuis
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- E.A (Ester) Rake, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Actie |
|
Riezebos-Brilman (voorzitter) |
Arts-microbioloog met aandachtsgebied virologie, UMCU |
Counsilmember ESCV (European Society of Clinical Virology) |
geen |
Geen actie |
|
Meijer |
Gynaecoloog, Coöperatie medische Specialisten Gelre u.a. werkzaam in Gelre ziekenhuis locatie Zutphen |
geen |
geen |
Geen actie |
|
Bossink |
Longarts, vrijgevestigd medisch specialist Diakonessenhuis Utrecht |
geen |
Patent crossspot |
Geen actie |
|
Van Essen |
Huisarts, gepensioneerd |
Onbezoldigd voorzitter Nederlandse Influenza Stichting (https://influenzastichting.nl/) |
Een paar keer een vergoeding als spreker, van Sanofi Pasteur en van MSD. |
Geen actie |
|
Van de Veerdonk |
Internist-infectioloog werkzaam Radboudumc |
Onderzoeker betaald vanuit subsidies. |
Ik heb een VIDI subsidie gekregen waarbij uitgezocht wordt of neuraminidase remmers de kans op dodelijke schimmelinfecties kunnen verhogen. Ik heb geen baat bij welke uitkomst dan ook van de richtlijn. |
Geen actie |
|
De Jong |
Hoogleraar/afdelingshoofd Medische Microbiologie & Infectiepreventie, Amsterdam UMC, |
geen |
In afgelopen 5 jaar lid (ad-hoc) geweest van Scientific Advisory Boards voor Janssen, Crucell, Shionogi, MedImmune, Celltrion; allen op gebied van preklinisch en klinisch onderzoek van nieuwe antivirale middelen tegen influenza. Momenteel geen actief adviseurschap. |
Geen actie, want momenteel geen actief adviseurschap, en onafhankelijke beoordelen van nieuwe middelen (dus geen belangenverstrengeling) |
|
Derde |
Intensivist UMC Utrecht (0.45 FTE) |
Voorzitter taskforce NVIC: Draaiboek (influenza-) pandemie (onbetaald) |
Coördinerend onderzoeker Europa voor REMAP-CAP studie. Deze studie is een internationale 'adaptive platform trial' naar de beste behandeling van CAP op de IC, waarbij in het seizoen of tijdens een pandemie de behandeling van influenza daar deel van zou kunnen uitmaken. Coördinerend onderzoeker Europa voor REMAP-CAP studie. |
Geen actie, want de uitkomst van het genoemde onderzoek en de richtlijn hebben geen invloed op elkaar |
|
Zeeman |
Internist ouderengeneeskunde Deventer Ziekenhuis |
Klinisch Farmacoloog Deventer Ziekenhuis (binnen functie internist-og) |
geen |
Geen actie |
|
Vollaard |
Internist-infectioloog, Landelijke Coördinatie Infectieziektebestrijding (LCI) |
Arts-vrijwilliger bij Dokters van de Wereld: consultatie van ongedocumenteerde migranten |
geen |
Geen actie |
|
Fraaij |
Kinderarts Infectioloog en immunoloog, hoofd subspecialisme Kinderimmunologie en infectieziekten, ErasmusMC-Sophie, Rotterdam |
geen |
PREPARE Europe (EU FP? grant no. 602525) Ik ben bestuurslid bij Stichting Infecties bij Kinderen (INKI) Ik organiseer de cursus 'Antibiotica bij kinderen' |
Geen actie, want de uitkomst van het genoemde onderzoek en de richtlijn hebben geen invloed op elkaar |
|
Spijkers |
Senior adviseur patiëntenbelang |
Voorzitter Stichting Samen voor Duchenne (onbetaald) |
geen |
Geen actie |
|
Coudere |
AIOS Medische microbiologie, LMMI, ETZ, Tilburg |
Consulent dienst Gastro-enterologie en Hepatologie, UZA, Antwerpen: medewerker onderzoeksproject Hepatitis B en C screening bij sub-Saharaans Afrikaanse Migranten (funding Gilead) - betaald - einde 31 me 2019 |
geen |
Geen actie |
|
Van Houten |
Specialist ouderengeneeskunde, hoofd medische dienst Zonnehuisgroep Amstelland |
Lid Goed gebruik Hulpmiddelen bij ZonMw |
Voorzitter werkgroep Handreiking hygiëne en infectiepreventie voor specialisten ouderengeneeskunde bij Verenso. Adviseur Behandeladvies COVID-19 acute fase en nazorg bij Verenso |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een werkgroeplid af te vaardigen namens de Patiëntenfederatie Nederland. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen. In het licht van de bevindingen van de Kwaliteits- & Doelmatigheidsagenda over aantallen beschikbare indicatoren en de moeilijkheid van het ontwikkelen van toepasselijke indicatoren, is er besloten (vooralsnog) geen indicatoren te ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door afgevaardigden van de Nederlandse Vereniging voor Medische Microbiologie, Inspectie Gezondheidszorg & Jeugd, de Nederlandse Associatie Physician Assistants, het Nederlands Huisartsen Genootschap, de Nederlandse Vereniging voor Klinische Geriatrie, Rijksinstituut van Volksgezondheid en Milieu, Verpleegkundigen en Verzorgenden Nederland, Verenso, Vereniging Innovatieve Geneesmiddelen, Zorginstituut Nederland, en de Nederlandse Vereniging Artsen voor Longziekten en Tuberculose tijdens de invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen in de zoekverantwoording.
Gedurende het zoekproces, heeft de werkgroep de internationale richtlijn van de Infectious Diseases Society of America (IDSA) beoordeeld op geschiktheid (Uyeki, 2019). Daarbij werd het adviesrapport ‘Adapteren van internationale richtlijnen naar de Nederlandse praktijk’ gevolgd van de Federatie Medisch Specialisten, welke is vastgesteld in de Raad Kwaliteit in 2017 (NVALT, NVU 2016). Er werd besloten om de IDSA Guideline niet als uitgangspunt te nemen om de richtlijn te updaten. Enerzijds zijn er geen transparante zoekstrategie en selectiecriteria in de IDSA Guideline beschikbaar; anderzijds is er geen duidelijke scheiding weergegeven tussen literatuuranalyse en Overwegingen in de IDSA Guideline. Daarmee voldoet de IDSA Guideline niet aan afspraken die wv-en onderling hebben afgesproken met betrekking tot het gebruiken en adapteren van internationale richtlijnen.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Commentaar- en autorisatiefase [na autorisatiefase definitief maken]
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
- Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
- Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
- Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
- Nederlandse Vereniging voor Urologie en de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose. Adapteren van internationale richtlijnen naar de Nederlandse praktijk. Utrecht, 2016
- Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
- Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
- Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
- Uyeki, T. M., Bernstein, H. H., Bradley, J. S., Englund, J. A., File Jr, T. M., Fry, A. M.,... & Ison, M. G. (2019). Clinical practice guidelines by the Infectious Diseases Society of America: 2018 update on diagnosis, treatment, chemoprophylaxis, and institutional outbreak management of seasonal influenza. Clinical Infectious Diseases, 68(6), e1-e47.
Zoekverantwoording
|
Uitgangsvraag: Welke van de volgende prognostische factoren (zwangerschap, leeftijd, comorbiditeit, immuungecompromitteerd, sepsis, shock, ernstige luchtweginfectie) voorspellen een ongunstig beloop van influenza (gedefinieerd als: complicaties, ziekenhuisopname, mortaliteit, IC-opname en opnameduur)? |
|
|
Database(s): Medline, Embase |
Datum: 6 juni 2019 |
|
Periode: > 1996 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1996 – juni 2019 |
1 exp *Influenza, Human/ or exp influenzavirus a/ or exp influenzavirus b/ or exp influenza b virus/ or influenza*.ti. or flu.ti. or flue.ti. or h1n1*.ti. or h2n3*.ti. (89645) 2 exp Immunocompromised Host/ or exp *Pregnancy/ or exp *Aged/ or (immunocompromi* or immunosupress* or immunotherap* or pregnan* or aged or elder* or eldest or frail* or geriatri* or old age* or senior* or older or neonate* or newborn* or suckling* or baby or babies or postneonat* or postnat* or infant* or child* or chronic or comorbid*).ti,ab,kw. (4222311) 3 exp Prognosis/ or (prognos* or predict* or future or 'follow up').ti,ab,kw. (4029494) 4 exp "Sensitivity and Specificity"/ or (Sensitiv* or Specific*).ti,ab. or (predict* or ROC-curve or receiver-operator*).ti,ab. or (likelihood or LR*).ti,ab. or exp Diagnostic Errors/ or (inter-observer or intra-observer or interobserver or intraobserver or validity or kappa or reliability).ti,ab. or reproducibility.ti,ab. or (test adj2 (re-test or retest)).ti,ab. or "Reproducibility of Results"/ or accuracy.ti,ab. or Diagnosis, Differential/ or Validation Studies.pt. (6136810) 5 1 and 2 and 3 and 4 (1434) 6 limit 5 to (english language and yr="1996 - 2019") (1296) 7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (399073) 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1865657) 9 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3198906) 10 6 and 7 (45) 11 (6 and 8) not 10 (248) 12 (6 and 9) not (10 or 11) (439) 13 10 or 11 or 12 (732)
= 732 (728 uniek) |
1048 |
|
Embase (Elsevier) |
('influenza'/exp/mj OR influenza*:ti OR flu:ti OR flue:ti OR h1n1*:ti OR h2n3*:ti OR 'influenza virus'/exp/mj)
AND ('immunocompromised patient'/exp OR 'immune deficiency'/exp OR 'pregnancy'/exp/mj OR 'aged'/exp/mj OR ((reduce* NEAR/3 immunit*):ab,ti) OR immunocompromi*:ab,ti OR immunosupress*:ab,ti OR immunotherap*:ab,ti OR pregnan*:ab,ti OR aged:ab,ti OR elder*:ab,ti OR eldest:ab,ti OR frail*:ab,ti OR geriatri*:ab,ti OR 'old age':ab,ti OR senior*:ab,ti OR older:ab,ti OR neonate*:ab,ti OR newborn*:ab,ti OR suckling*:ab,ti OR baby:ab,ti OR babies:ab,ti OR postneonate*:ab,ti OR postnat*:ab,ti OR infant*:ab,ti OR child*:ab,ti OR chronic:ab,ti OR comorbid*:ab,ti)
AND (('prognostic value'/exp OR prognos*:ab,ti OR predict*:ab,ti OR future:ab,ti OR 'follow up':ab,ti)
AND (('sensitivity and specificity'/de OR sensitiv*:ab,ti OR specific*:ab,ti OR diagnos*:ab,ti OR predict*:ab,ti OR 'roc curve':ab,ti OR 'receiver operator':ab,ti OR 'receiver operators':ab,ti OR likelihood:ab,ti OR 'diagnostic error'/exp OR 'diagnostic accuracy'/exp OR 'diagnostic test accuracy study'/exp OR 'inter observer':ab,ti OR 'intra observer':ab,ti OR interobserver:ab,ti OR intraobserver:ab,ti OR validity:ab,ti OR kappa:ab,ti OR reliability:ab,ti OR reproducibility:ab,ti OR ((test NEAR/2 're-test'):ab,ti) OR ((test NEAR/2 'retest'):ab,ti) OR 'reproducibility'/exp OR accuracy:ab,ti OR 'differential diagnosis'/exp OR 'validation study'/de OR 'measurement precision'/exp OR 'diagnostic value'/exp OR 'reliability'/exp))
AND (english)/lim AND (1996-2019)/py NOT 'conference abstract':it
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 811 (802 uniek) |
