Antipsychotica bij ASS bij volwassenen
Uitgangsvraag
Wat is de effectiviteit van farmacotherapie (zoals antipsychotica) voor volwassenen met een ASS?
Aanbeveling
De werkgroep beveelt risperidon in lage dosering aan ter vermindering van prikkelbaarheid en gedragsproblematiek bij patiënten bij wie sprake is van een ASS en een verstandelijke beperking.
Onduidelijk is nog in hoeverre de effecten van risperidon gegeneraliseerd kunnen worden naar patiënten met ASS zonder verstandelijke beperking. Op basis van praktijkervaringen ziet de werkgroep ook in deze normaal begaafde groep een indicatie voor het gebruik van risperidon in lage dosering: om overmatige prikkelbaarheid te verminderen.
De werkgroep ziet geen plaats voor risperidon in de behandeling van de kernsymptomen van een ASS, met uitzondering van ernstig stereotiep repetitief gedrag: indien dat niet te doorbreken is met andere interventies, is gebruik van risperidon te overwegen.
Er is thans nog te weinig evidence beschikbaar om krachtige aanbevelingen te kunnen doen over het gebruik van andere antipsychotica dan risperidon ter vermindering van prikkelbaarheid en gedragsproblematiek bij mensen met een ASS.
De werkgroep beveelt aan om het gebruik van risperidon bij volwassenen met een ASS gepaard te laten gaan met een beleid ter herkenning en preventie van het metabool syndroom. De Werkgroep Somatische Complicaties bij Antipsychoticagebruik heeft hiervoor een schema voor systematische monitoring opgesteld (Cahn e.a., 2008).
Als er bij gebruik van risperidon sprake is van een sterke gewichtstoename of andere kenmerken van het metabool syndroom en een medicamenteuze interventie klinisch noodzakelijk geacht wordt, dan kan op grond van een gunstiger bijwerkingenprofiel uitgeweken worden naar aripiprazol (zie de Multidisciplinaire richtlijn schizofrenie).
Omdat er weinig bekend is over de meerwaarde van dosisverhoging en er sprake kan zijn van grote individuele farmacokinetische verschillen bij volwassenen met een ASS, dienen zowel de effecten als de bijwerkingen van risperidon en aripiprazol systematisch geëvalueerd te worden. Na iedere wijziging van de dosering dient dit herhaald te worden.
De ASS vormt bij een comorbide psychotische stoornis geen contra-indicatie voor gebruik van antipsychotica.
Onderzoeksaanbeveling
De werkgroep beveelt aan (meer) onderzoek te doen naar de effecten op korte en lange termijn van risperidon en andere antipsychotica bij volwassenen met een ASS wat betreft kernsymptomen, geas-socieerde symptomen, comorbiditeit en bijwerkingen.
Overwegingen
- Antipsychotica worden zowel in de beschikbare onderzoeken als in de praktijk bij mensen met een ASS doorgaans in lagere dosering toegediend dan bij mensen met schizofrenie of andere psychosen (in het geval van risperidon meestal niet meer dan 2 mg). Naar verwachting zou dit minder bijwerkingen kunnen geven, maar een grotere gevoeligheid voor bijwerkingen in deze groep is op grond van de beschikbare literatuur niet uit te sluiten.
- In de praktijk blijkt dat antipsychotica vooral goed werken bij de subgroep mensen met een ASS die last hebben van een overmatige prikkelbaarheid. Bij sommige volwassenen met een ASS die risperidon gebruiken, vindt gewichtstoename plaats. Het verschilt erg per persoon of dit voorkomt en in welke mate. Het is aangetoond dat gebruik van risperidon of andere atypische antipsychotica kan leiden tot het metabool syndroom. Het metabool syndroom is een combinatie van ten minste drie van de volgende vijf somatische afwijkingen:
- verhoogde glucosewaarde;
- verhoogde triglyceridewaarde;
- verlaagde concentratie high-densitylipoproteïne-(HDL-)cholesterol;
- toegenomen intra-abdominaal vetweefsel;
- hypertensie.
- Wanneer gewichtstoename bij gebruik van risperidon optreedt, zou op grond van de evidence over de bijwerkingen van atypische antipsychotica bij schizofrenie verwezen kunnen worden naar alternatieve antipsychotische medicatie. Aripiprazol blijkt het gunstigste bijwerkingenprofiel te hebben (Cahn e.a., 2008).
Onderbouwing
Achtergrond
Volwassenen met een ASS vertonen regelmatig ernstige symptomen van prikkelbaarheid (irritability), niet zelden in de vorm van (aanvalsgewijs) driftig, agressief en zelfbeschadigend gedrag (Stigler & McDougle, 2008). Deze vormen van ‘appelerend probleemgedrag' (challenging behaviour) kunnen de kwaliteit van leven van de betrokkenen met ASS en hun directe naasten, alsmede hun mogelijkheden om sociaal te functioneren, sterk beperken.
Antipsychotica (oftewel neuroleptica) worden gebruikt om dergelijk appelerend probleemgedrag van personen met een ASS te verminderen. Antipsychotica zijn psychotrope geneesmiddelen die receptoren blokkeren in de dopaminerge zenuwbanen van het brein. Er wordt een onderscheid gemaakt in klassieke en atypische antipsychotica. Klassieke antipsychotica, zoals haloperidol, chloorpromazine, en flufenazine, zijn al lang in gebruik in de psychiatrie. De meeste atypische antipsychotica, zoals risperidon, olanzapine, quetiapine en aripiprazol, zijn recenter beschikbaar gekomen. Clozapine bestond al langer, maar kan als ernstige complicatie agranulocytose veroorzaken. Atypische antipsychotica oefenen, in aanvulling op de blokkerende werking op dopaminereceptoren van de klassieke antipsychotica, ook een antagonerende werking uit op de serotonine- (5-hydroxytryptamine [5-HT]) type 2A-receptoren (Posey e.a., 2008).
Omdat appelerend probleemgedrag ook vaak voorkomt bij personen met een verstandelijke beperking (Murphy e.a., 2005), werd voor deze richtlijn de wetenschappelijke literatuur geraadpleegd over autismespectrumstoornissen en/of verstandelijke beperkingen. In de psychiatrische behandeling van personen met een verstandelijke beperking worden antipsychotica vaak gebruikt om appelerend probleemgedrag te verminderen (Matson & Neal, 2009).
Een overzicht van de effecten van het gebruik van antipsychotica bij personen met een ASS (of met een verstandelijke beperking, als er onvoldoende gegevens beschikbaar zijn met betrekking tot de ASS), is belangrijk omdat antipsychotica veelvuldig voorgeschreven worden om appelerend probleemgedrag te verminderen. Het is echter de vraag in hoeverre er wetenschappelijke evidentie bestaat over de effecten van antipsychoticagebruik in deze patiëntenpopulatie. Verder is er weinig bekend over idiosyncratische reacties op gebruik van antipsychotica in personen met een ASS. Algemeen bekende bijwerkingen van antipsychotica zijn onder andere gewichtstoename, diabetes mellitus, hyperprolactinemie, acathisie, extrapyramidale symptomen, tardieve dyskinesieën en een verlaging van de insultdrempel (Matson & Hess, 2011).
Actuele situatie in de klinische praktijk
Behandelingen met antipsychotica bij personen met een ASS zijn gericht op gedragsregulatie, doorgaans in aanvulling op en ter facilitering van psychologische gedragsmatige interventies gericht op de kernsymptomen van ASS. Antipsychotica worden veel voorgeschreven aan personen met een ASS. In een longitudinaal onderzoek bij 286 adolescenten en volwassenen in de Verenigde Staten werd vastgesteld dat antipsychotica in de subgroep van personen die ouder waren dan 20 jaar, na de antidepressiva (44%) het meest werden voorgeschreven (38%) (Esbensen e.a., 2009). Momenteel zijn risperidon and aripiprazol de enige geneesmiddelen die door de us Food and Drugs Administration (FDA) zijn goedgekeurd voor de behandeling van problematische symptomen, vooral prikkelbaarheid, bij een ASS-diagnose. Deze geneesmiddelen zijn echter alleen geïndiceerd voor kinderen met ASS en niet voor volwassenen met ASS.
Er is geen eensgezindheid over antipsychoticagebruik voor het reguleren van appelerend probleemgedrag bij volwassenen met een ASS en verstandelijke beperkingen. Spreat en Conroy (1998) rapporteerden bijvoorbeeld dat meer dan 90% van de antipsychotica in intramurale voorzieningen aan personen met een verstandelijke beperking werden voorgeschreven voor gedragsregulatie. Dit staat op gespannen voet met het gegeven dat langdurige behandeling van appelerend probleemgedrag met antipsychotica in het algemeen niet wordt aanbevolen aangezien dit kan leiden tot de eerdergenoemde ernstige bijwerkingen en complicaties.
Beoogde doelen van behandeling met antipsychotica
Antipsychotica inzetten bij mensen met een ASS heeft twee mogelijke doelen.
- Effectieve reductie van prikkelbaarheid en appelerend probleemgedrag.
- Effectieve reductie van de ASS-kernsymptomen.
Conclusies / Summary of Findings
De meeste onderzoeken naar antipsychotica voor gedragsmanagement van volwassenen met ASS vergeleken risperidon met placebo.
Er is beperkt bewijs voor een bescheiden behandelingseffect van risperidon voor prikkelbaarheid en agressie. Daarnaast is er enig bewijs dat behandeling met risperidon een gunstige invloed kan hebben op autistisch gedrag, repetitief gedrag als kernsymptoom voor autisme en de globale ernst van de symptomen. Maar de gegevens van de placebogecontroleerde onderzoeken en observationele onderzoeken naar het gebruik van risperidon door volwassenen met een verstandelijke beperking zijn inconsistent. Bovendien rapporteren de meeste onderzoeken bij populaties met ASS of een verstandelijke beperking gegevens die wijzen op bijwerkingen van risperidon, in het bijzonder sedatie en gewichtstoename (merk op dat dit overeenkomt met de bewijzen voor nadelige effecten van deze middelen bij schizofrenie). Ook belangrijk is dat deze onder-zoeken binnen korte perioden werden uitgevoerd en er heel weinig bekend is over de langetermijneffecten van antipsychoticagebruik bij volwassenen met ASS.
De gegevens over haloperidol waren beperkt en inconsistent. Er waren geen bewijzen voor significante behandelingseffecten bij volwassenen met ASS. Voor clopenthixol is er beperkt bewijs (lage kwaliteit bij gradering) voor een gunstig effect op het management van appelerend probleemgedrag bij volwassenen met een verstandelijke beperking. De bewijzen voor olanzapine bij gedragsmanagement zijn zeer beperkt (zeer lage kwaliteit bij gradering) met slechts één open-labelonderzoek.
Samenvatting literatuur
Selectie van onderzoeken
Drie RCT'S (N = 107) die relevante klinische bewijzen opleverden bij volwassenen met ASS, voldeden aan de criteria voor deze review. Deze drie onderzoeken verschenen tussen 1998 en 2006 in peer-reviewed tijdschriften. Omdat primaire gegevens ontbraken, werd er op basis van consensus van de richtlijnwerkgroep apart gezocht naar antipsychotica voor gedragsmanagement bij verstandelijk beperkten. Negen RCT'S (N = 564) leverden relevant klinisch bewijs op, voldeden aan de criteria en werden geïncludeerd. Alle 9 onderzoeken verschenen tussen 1966 en 2008 in peer-reviewed tijdschriften. Uit 4 van deze RCT'S konden echter geen gegevens worden geëxtraheerd voor de berekening van de effecten en blijft de analyse van deze onderzoeken dus beperkt tot een samenvatting. Bij 5 RCT'S (N = 308) onder populaties verstandelijk gehandicapten konden data over de werkzaamheid worden overgenomen. Twee observationele onderzoeken bij groepen verstandelijk gehandicapten (N = 40) worden in een verhalende samenvatting weergegeven. Deze onderzoeken werden tussen 2006 en 2007 gepubliceerd in peer-reviewed tijdschriften.
Negentien onderzoeken werden geëxcludeerd (Advokat e.a., 2000; Amore e.a., 2011; Boachie & Mcginnity, 1997; Breuning, 1982; Buitelaar, 2000; Craft & Schiff, 1980; Drmic & Franic, 2008; Hellings, 2010; Lott e.a., 1996; Lynch e.a., 1985; Malt e.a., 1995; Romeo e.a., 2009; Ruedrich e.a., 2008; Thalayasingam e.a., 2004; Troost e.a., 2005; Tyrer, 2009; Valicenti- McDermott & Demp, 2006; Weir e.a., 1968; Zarcone e.a., 2001). De meest voorkomende redenen voor exclusie waren dat de artikelen geen gegevens over de werkzaamheid bevatten die in een meta-analyse of in een verhalende samenvatting konden worden opgenomen, of dat de deelnemers aan een comorbide psychotische stoornis leden. Een overzicht van de geëxcludeerde onderzoeken is te vinden in bijlage 11.
Van de drie geïncludeerde onderzoeken bij populaties mensen met ASS (zie tabel 5.3) betroffen twee een vergelijking van risperidon en placebo (Hellings e.a., 2006; McDougle e.a., 1998b) en één een vergelijking van haloperidol met placebo (Remington e.a., 2001).
Van de negen geïncludeerde RCT'S in een populatie verstandelijk beperkten (zie tabel 5.5) betroffen er drie een vergelijking tussen risperidon en placebo (Gagiano e.a., 2005; Tyrer e.a., 2008; Vanden Borre e.a., 1993). In een van deze onderzoeken werd haloperidol vergeleken met placebo of risperidon (Tyrer e.a., 2008). In drie onderzoeken werd zuclopenthixol met placebo vergeleken (Haessler e.a., 2007; Izmeth e.a., 1988; Singh & Owino, 1992), in één werd prothipendyl met placebo vergeleken (McKenzie & Roswell-Harris, 1966), in nog een ander onderzoek werden de resultaten van pipamperon en placebo naast elkaar gelegd (Van Hemert, 1975), en er was een onderzoek waarbij twee antipsychotica werden vergeleken: cis(z)-clopenthixol met haloperidol (Karsten e.a., 1981).
Van de twee meegeleverde observationele onderzoeken bij een populatie verstandelijk beperkten (zie tabel 5.4) betrof het ene een open-labelonderzoek naar olanzapine (Handen & Hardan, 2006) en de ander een open-labelonderzoek naar risperidon (Read & Rendall, 2007).
Risperidon versus placebo voor het gedragsmanagement
In twee van de drie RCT'S bij volwassenen met ASS werd risperidon met placebo vergeleken (zie tabel 5.6). Een meta-analyse waarin resultaten van Hellings e.a. (2006) en McDougle e.a. (1998b) werden gecombineerd, leverde statistisch significante positieve behandelingseffecten op van risperidon voor appelerend probleemgedrag (test voor het totale effect: Z = 3,06; p = 0,002).
Daarnaast onderzochten McDougle e.a. (1998b) het effect van risperidon op autistisch gedrag (zoals gemeten door de Ritvo-Freeman Real-life Rating Scale, RLRS), repetitief gedrag, het kernsymptoom van autisme (zoals gemeten door de Yale-Brown Obsessive Compulsive Scale, Y-Bocs) en de ernst en/of verbetering van de symptomen (gemeten met de Clinical Global Impression, CGI, de subschaal voor globale verbetering) en vond significante behandelingseffecten (test voor het totale effect respectievelijk: Z = 1,95; p = 0,05; Z = 2,47; p = 0,01; en Z = 3,48; p = 0,0005).
McDougle e.a. (1998b) rapporteerden observationele data voor bijwerkingen en vond een aantal aanwijzingen voor milde, voorbijgaande sedatie, maar concludeerden dat risperidon goed werd verdragen, zonder bewijs van extrapiramidale bijwerkingen, cardiale gebeurtenissen of epileptische aanvallen. Ook Hellings e.a. (2006) presenteerden alleen observationele data over bijwerkingen. Maar de resultaten in Hellings e.a. (2006) wijzen op bijwerkingen als toegenomen eetlust en gewichtstoename. Er was bijvoorbeeld bij 70% van de deelnemers sprake van een gewichtstoename van meer dan 3 kg; de gemiddelde gewichtstoename gedurende de 46 weken bedroeg 7,9 kg voor kinderen, 8,3 kg voor adolescenten en 6,0 kg voor volwassenen.
Samenvattend kan worden gezegd dat risperidon volgens de literatuur een bescheiden effect kan hebben op de behandeling en beheersing van appelerend probleemgedrag bij volwassenen met ASS. Er dient echter rekening te worden gehouden met de methodologische beperkingen van de onderzoeken, vooral de kleine steekproefomvang, zoals blijkt uit de matige GRADE-rating voor kwaliteit. Ook dient te worden opgemerkt dat hoewel risperidon volgens de onderzoeksresultaten bijwerkingen kan veroorzaken, in de onderzoeken alleen naar bijwerkingen op korte termijn werd gekeken en er alleen observationele data voor de bijwerkingprofielen werden gerapporteerd. Daarom is meer langetermijnonderzoek nodig. De bestaande NICE-richtlijnen voor het gebruik van antipsychotica bij schizofrenie (NICE, 2009c) leveren echter bewijzen op voor bijwerkingen die kunnen optreden bij antipsychotica en deze bewijzen kunnen worden geëxtrapoleerd naar volwassenen met ASS.
Naar aanleiding van het expertoordeel van de richtlijnwerkgroep werden gegevens van volwassenen met een verstandelijke beperking geïncludeerd om te extrapoleren naar volwassenen met ASS. In drie van de negen geïncludeerde RCT'S bij een populatie verstandelijke beperkten werd risperidon vergeleken met placebo; bij een van deze onderzoeken kreeg een vergelijkingsgroep haloperidol. Data over de werkzaamheid konden slechts uit twee van deze onderzoeken worden overgenomen (zie tabel 5.7).
In beide onderzoeken waaruit gegevens over de werkzaamheid konden worden overgenomen (Gagiano e.a., 2005 en Tyrer e.a., 2008), werden de effecten van risperidon op de ernst/verbetering van de symptomen onderzocht. Uit meta-analyse bleek een trend voor een statistisch significant positief behandelingseffect van risperidon op de ernst/verbetering van de symptomen (test voor het totale effect: Z = 1,71; p = 0,09). Maar de bewijzen waren in strijd met Gagiano e.a. (2005), die een statistisch significant verschil rapporteren tussen deelnemers die risperidon en deelnemers die een placebo kregen (test voor het totale effect: Z = 1,95; p = 0,05), en met die van Tyrer e.a. (2008), die geen significant verschil tussen de twee groepen rapporteerden (test voor de algemene werking: Z = 0,38; p = 0,70). Daarbij moet worden opgemerkt dat de kwaliteit van de gegevens uit Gagiano e.a. (2005) lager werd gedegradeerd: vanwege de indirectheid van het bewijs, omdat de deelnemers niet alleen een verstandelijke beperking (geen autisme) hadden, maar ook bijkomende psychiatrische aandoeningen waaronder gedragsstoornissen, disruptieve gedragsstoornissen, periodieke explosieve stoornissen, oppositioneel opstandige gedragsstoornissen en antisociale persoonlijkheidsstoornissen. Belangrijk is dat de toevoeging van de data uit Tyrer e.a., 2008 aan de meta-analyse wellicht niet legitiem is, omdat de data scheef verdeeld zijn, en hoewel medianen en interkwartielafstand werden vermeld, werden de gemiddelde en de standaarddeviatie- scores opgevraagd om te worden ingevoerd in de huidige meta-analyse. Tyrer e.a. (2008) onderzochten ook het effect van risperidon op appelerend probleemgedrag, agressie en de kwaliteit van leven, en vonden geen bewijzen voor significante verschillen tussen deelnemers die risperidon kregen en deelnemers die een placebo kregen (test voor de totale effecten respectievelijk: Z = 0,69; p = 0,49; Z = 0,21; p = 0,84 en Z = 1,04; p = 0,30). Tyrer e.a. (2008) komen tot de conclusie dat antipsychotica niet langer beschouwd mogen worden als aanvaardbare routinebehandeling voor agressief appelerend probleemgedrag bij mensen met een verstandelijke beperking. Gagiano e.a. (2005) komen echter tot de conclusie dat risperidon effectief is voor het beheersen van disruptieve gedragsstoornissen bij volwassenen met een verstandelijke beperking.
Er werden geen bijwerkingen gemeld in Tyrer e.a. (2008) en Gagiano e.a. (2005) concludeerden dat risperidon goed werd verdragen. Belangrijk is dat hoewel er in Gagiano e.a. (2005) in de dubbelblinde fase bijwerkingen werden gemeld voor groepen die risperidon en groepen die een placebo namen, uit de observationele data voor de open-labelfase een hoge incidentie bleek van slaperigheid en statistisch significante gewichtstoename, met een globale gemiddelde gewichtstoename van 3,8 kg (p < 0,001) in 48 weken.
Gegevens over de werkzaamheid konden niet worden overgenomen uit de overige geïncludeerde RCT'S bij volwassenen met een verstandelijke beperking. Vanden Borre e.a. (1993) geven geen scores voor gemiddelde en standaarddeviatie. De auteurs rapporteren statistisch significante (p = 0,01) verschillen in appelerend probleemgedrag (zoals gemeten door de Aberrant Behaviour Checklist, ABC) met een grotere verandering vanaf de baselinescore in de risperidongroep in vergelijking met de controlegroep. Het artikel meldt ook een significant verschil tussen risperidon- en placebogroepen wat betreft de nametingscores voor ernst/verbetering van de symptomen (p < 0,01). Deze resultaten lijken dus op werkzaamheid te wijzen. Maar de auteurs melden ook dat er meer bijwerkingen waren tijdens behandeling met risperidon, met tien keer zoveel meldingen van sedatie en zes keer zoveel meldingen van slaperigheid tijdens de behandeling.
Samenvattend geldt dat de RCT'S bij volwassenen met een verstandelijke beperking inconsistente bewijzen opleveren voor de werkzaamheid en verdraagbaarheid van risperidon bij de behandeling en beheersing van appelerend probleemgedrag. De resultaten van Gagiano e.a. (2005) die werden opgenomen in de meta-analyse en de narratief beschreven resultaten van Vanden Borre e.a. (1993) bevestigen de resultaten die zijn gevonden in een populatie mensen met ASS en doen vermoeden dat risperidon een positief effect heeft op de ernst/verbetering van symptomen en appelerend probleemgedrag, maar een negatief effect op de bijwerkingen, in dit geval de toename van sedatie en de gewichtstoename die worden gerapporteerd in de autismeonderzoeken. Maar Tyrer e.a. (2008) vonden in de onderzochte resultaten geen significante verschillen tussen deelnemers die risperidon kregen en deelnemers die een placebo kregen voor appelerend probleemgedrag, agressie, ernst/verbetering van de symptomen, en kwaliteit van leven. Vanwege deze inconsistentie werd de kwaliteit van de bewijzen gedegradeerd tot ‘zeer laag’.
Open-labelonderzoek naar risperidon voor gedragsmanagement
In een observationeel open-labelonderzoek zonder controlegroep werden de effecten van risperidon onderzocht bij volwassenen met een verstandelijke beperking (Read e.a., 2007; tabel 5.4). Gegevens over de werkzaamheid konden niet worden overgenomen, maar de auteurs rapporteren voor risperidon significante veranderingen ten opzichte van de baselinescores bij appelerend probleemgedrag (gemeten met de Aberrant Behaviour Checklist, ABC), ernst van de symptomen (p < 0,001) en de kwaliteit van leven (voor de drie subschalen van thuissituatie, activiteiten en vaardighedenchecklist: bereik p < 0,001-p = 0,014). De auteurs concluderen dat de risperidon werkte en goed verdragen werd voor beheersing van gewelddadig en zelfbeschadigend gedrag, en voor de verbetering van de kwaliteit van leven bij volwassenen met een verstandelijke beperking. Er was echter een trend voor statistisch significante gewichtstoename (p = 0,061) met een gemiddelde van 1,74 kg tijdens het 12 weken durende onderzoek. Dit onderzoek ondersteunt dus tot op zekere hoogte de in het voorafgaande vermelde bevindingen van Gagiano e.a. (2005) en Vanden Borre e.a. (1993).
Haloperidol versus placebo voor gedragsmanagement
Een van de drie geïncludeerde RCT'S voor volwassenen met ASS betrof een vergelijking van haloperidol met placebo (zie tabel 5.8). Remington e.a. (2001) deden een onderzoek met drie armen waarin haloperidol werd vergeleken met clomipramine en placebo. De gegevens over clomipramine worden niet hier gepresenteerd, maar in het deel over antidepressiva (zie paragraaf 9, tabel 5.15). Remington e.a. (2001) ontdekten geen significant behandelingseffect van haloperidol in vergelijking met placebo bij autistisch gedrag (test voor het totale effect: Z = 1,18; p = 0,24) of algemene bijwerkingen (test voor het totale effect: Z = 1,66; p = 0,10). Er werden weliswaar geen statistisch significante verschillen waargenomen op de schalen voor bijwerkingen, maar er was een opmerkelijk verloop tijdens het onderzoek, met 21% uitval gedurende de haloperidolgroep ten gevolge van bijwerkingen (N = 5 vermoeidheid, N = 1 dystonie; en N = 1 depressie), vergeleken met 3% uitval in de placebogroep als gevolg van bijwerkingen (in dit geval neusbloedingen).
In een van de geïncludeerde RCT'S werden de behandelingseffecten van haloperidol bij een volwassen populatie met een verstandelijke beperking onderzocht door een vergelijking van haloperidol met risperidon en placebo (Tyrer e.a., 2008, zie het voorafgaande). De resultaten van de vergelijking van haloperidol met placebo zijn weergegeven in tabel 5.9. Tyrer (2008) vond geen bewijzen voor significante behandelingseffecten van haloperidol voor appelerend probleemgedrag of de kwaliteit van leven (test voor het totale effect respectievelijk: Z = 0,56; p = 0,57; Z = 0,67; p = 0,51). Er was wel een trend voor een statistisch significant verschil tussen deelnemers die haloperidol en deelnemers die een placebo kregen tegen agressie (test voor het totale effect: Z = 1,83; p = 0,07), en een statistisch significant groepsverschil voor ernst/verbetering van de symptomen (test voor het totale effect: Z = 2,50; p = 0,01) waarbij deelnemers die haloperidol kregen, hoger scoorden. Daarnaast werden er consistente resultaten gevonden bij vergelijking van haloperidol met risperidon, met een trend voor een positief behandelingseffect van haloperidol voor agressie (test voor het totale effect: Z = 1,90; p = 0,06) en een statistisch significant verschil tussen de twee antipsychotica voor ernst/verbetering van de symptomen (test voor de totale effecten: Z = 2,08; p = 0,04), met hogere scores voor deelnemers die haloperidol kregen vergeleken bij deelnemers die risperidon kregen.
Samenvattend geldt dat Tyrer e.a. (2008) met haloperidol (in vergelijking met placebo of risperidon) positieve behandelingseffecten vonden wat betreft agressie en ernst/verbetering van de symptomen. Wel dient te worden opgemerkt dat deze analyse onzeker is omdat de data scheef verdeeld waren. De medianen en interkwartielafstanden die in het oorspronkelijke onderzoeksrapport werden vermeld, vertegenwoordigen de te verwachten effecten van de proef wellicht beter. De kwaliteit van dit bewijsmateriaal werd ook gedegradeerd vanwege de indirectheid van het bewijs.
Zuclopenthixol versus placebo voor gedragsmanagement
Er waren geen RCT'S, semi-experimentele of observationele onderzoeken bij volwassenen met ASS waarin gebruik van zuclopenthixol met dat van placebo werd vergeleken. Op basis van het expertoordeel van de richtlijnwerkgroep werden gegevens geïncludeerd van een volwassen populatie met een verstandelijke beperking. Van de negen geïncludeerde RCT'S waarin antipsychotica voor gedragsmanagement bij volwassenen met een verstandelijke beperking werden onderzocht, betroffen drie vergelijkingen van zuclopenthixol met placebo (zie tabel 5.10). Haessler e.a. (2007) vergeleken deelnemers die na een zes weken durende open-labelonderzoek stopten met zuclopenthixol en overstapten op placebo met deelnemers die behandeling met zuclopenthixol nog 12 weken voortzetten in een dubbelblinde fase. Er werden dichotome uitkomstmaten gemeld, met een afkappunt bij een verslechtering van ten minste drie punten op de Modified Overt Agression Scale bij twee vervolgbezoeken. Deelnemers met een verslechtering van ten minste drie punten werden aangemerkt als non-responders en deelnemers zonder verslechtering als responders. Er werd een significant verschil waargenomen tussen zuclopenthixol en placebo (test voor het totale effect: Z = 1,96; p = 0,05) en de risicoratio gaf aan dat deelnemers die zuclopenthixol kregen, meer dan zeven keer zo vaak op deze behandeling tegen agressief, appelerend probleemgedrag reageerden dan deelnemers die een placebo kregen. De auteurs concluderen dat het stopzetten van zuclopenthixol bij volwassenen met een verstandelijke beperking leidt tot een toename van agressief gedrag.
Ook Singh en Owino (1992) onderzochten de gevolgen van het staken van de behandeling met zuclopenthixol (na een zes weken durende open-labelfase) bij volwassenen met een verstandelijke beperking. Dichotome gegevens werden overgenomen voor ‘ernst van de gedragsstoornis, zoals gemeten door de Clinical Global Assessment, die is afgeleid van de schaal voor Clinical Global Impressions (CGI). Deelnemers die minder beheersbaarheidsproblemen veroorzaakten, werden als responders aangemerkt, en de groep deelnemers die ongewijzigd reageerde of meer problemen veroorzaakte, werd ingedeeld als non-responders. De risicoratio gaf aan dat volwassenen met een verstandelijke beperking die zuclopenthixol bleven nemen, bijna vier keer meer kans hadden om te reageren op behandeling ter vermindering van de ernst van de gedragsstoornis dan deelnemers die stopten en overstapten op placebo. Maar deze behandelingseffecten waren niet statistisch significant (test voor het totale effect: Z = 1,31; p = 0,19). Ten slotte onderzochten Izmeth e.a. (1988) de effecten van stopzetting van injecties zuclopenthixoldecanoaat na een vier weken durend open-label-onderzoek. De gegevens voor een eindvergelijking tussen groepen konden niet worden overgenomen. Maar in gegevens die werden overgenomen voor het analyseren van de verandering vanaf baselinescores voor de ernst van de symptomen (van gedragsstoornissen), werden bewijzen gevonden voor een significant behandelingseffect (test voor het totale effect: Z = 3,04; p = 0,002). Hierbij was in week 12 (nameting) sprake van een significant grotere afname van de ernst van de ziekte bij de groep die zuclopenthixoldecanoaat kreeg vergeleken bij de placebogroep. Ook werden statistisch significante verschillen waargenomen in nameting ten opzichte van base-linescores voor prikkelbaarheid (gemeten door de Nurse's Observation Scale for In-patient Evaluation) (test voor het totale effect: Z = 2,60; p = 0,009) en was er bij patiënten die behandeling met zuclopenthixodecanoaat voortzetten, een grotere klinische verbetering merkbaar dan bij deelnemers die stopten en overstapten op placebo.
Prothipendyl versus placebo voor gedragsmanagement
In geen van de RCT'S, semi-experimentele of observationele onderzoeken werd prothipendyl met placebo vergeleken bij volwassenen met ASS.
Zoals in het voorafgaande beschreven, werden geëxtrapoleerde gegevens bekeken van een volwassen populatie met een verstandelijke beperking. Van de negen geïncludeerde RCT'S naar antipsychotica voor gedragsmanagement bij volwassenen met een verstandelijke beperking, betrof er één een vergelijking van prothipendyl met placebo (zie tabel 5.11). Dichotome uitkomstgegevens werden overgenomen uit McKenzie en Roswell-Harris (1966) voor klinische evaluatie van de ernst/verbetering van de symptomen, en de deelnemers werden ingedeeld in responderscategorieën die een lichte verbetering, een goede verbetering, een zeer goede verbetering of een uitstekende verbetering vertoonden. Deelnemers die geen verandering of verslechtering lieten zien, werden ingedeeld in de categorie non-responders.
Er werd een belangrijk behandelingseffect waargenomen (test voor het totale effect: Z = 1,97; = 0,05); de risicoratio gaf aan dat bij deelnemers die prothipendyl kregen, de kans dat ze op de behandeling van gedragsstoornissen reageerden meer dan anderhalf keer zo groot was als bij deelnemers die een placebo kregen. Toch dient men rekening te houden met de bescheiden omvang van dit effect en de zeer lage kwaliteit van deze bewijzen, doordat ze indirect zijn, er verschillen in IQ tussen de groepen bestonden, de onderzoeken oud waren en de steekproef klein was. Ook moet worden opgemerkt dat prothipendyl in Groot-Brittannië en Nederland voor geen enkele toepassing geregistreerd is. (Prothipendyl wordt ook in het Nederlandse Farmacotherapeutisch Kompas niet vermeld. In Belgie is een fenothiazinepreparaat beschikbaar, bekend onder de merknaam Dominal.)
Pipamperon versus placebo voor gedragsmanagement
Er waren geen RCT'S, semi-experimentele of observationele onderzoeken die pipamperon met placebo vergeleken bij volwassenen met ASS. Zoals in het voorafgaande beschreven, werden geëxtrapoleerde data bekeken van een volwassen populatie met een verstandelijke beperking. Van de negen geïncludeerde RCT'S naar antipsychotica voor gedragsmanagement bij volwassenen met een verstandelijke beperking betrof er één een vergelijking van pipamperon met placebo (Vanhemert, 1975). De gegevens die in Vanhemert (1975) werden gerapporteerd, konden niet worden opgenomen in een meta-analyse omdat er noch continue (gemiddelde en standaard- deviatiewaarden) noch dichotome gegevens werden gepresenteerd. Hierdoor was het niet mogelijk om gegevens over de werkzaamheid over te nemen. De auteurs melden echter dat deelnemers die pipamperon kregen, op zes van de tien items voor appelerend probleemgedrag op de checklist (woedeaanvallen, feitelijke agressiviteit, zenuwachtigheid, impulsiviteit, slaapstoornissen en beheersbaarheid) beter reageerden dan deelnemers die werden behandeld met placebo (p < 0,05; bereik van p = 0,004 tot p = 0,041). Maar zonder gegevens over de werkzaamheid is het moeilijk deze bevindingen te kwantificeren. Bovendien zijn de conclusies die uit deze gegevens kunnen worden getrokken, ernstig beperkt doordat de bewijzen indirect zijn, er verschillen in IQ waren tussen de groepen, de onderzoeken oud waren en de steekproef klein was.
Cis (z)-clopenthixol versus haloperidol voor gedragsmanagement
In de laatste geïncludeerde RCT over antipsychotica in een geëxtrapoleerde populatie volwassenen met een verstandelijke beperking werden twee actieve antipsychotische geneesmiddelen vergeleken: cis (z)-clopenthixol en haloperidol (zie tabel 5.12). Dichotome gegevens werden overgenomen (zoals gemeld); deelnemers met verbeterde symptomen werden ingedeeld als responders, en deelnemers met onveranderde of verslechterde symptomen als non-responders.
Karsten (1981) vond een statistisch significant verschil voor de ernst/ verbetering van de symptomen (test voor het totale effect: Z = 3,25; p = 0,001), met een risicoratio die aangeeft dat de kans dat met cis (z)-clopenthixol behandelde deelnemers op de behandeling reageerden, drie keer zo groot was als bij deelnemers die haloperidol kregen. Dichotome data werden ook berekend op basis van de gerapporteerde gegevens in Karsten (1981) voor de klinische globale indruk van de bijwerkingen. Geen enkele bijwerking werd aangemerkt als event en alle categorieën bijwerkingen (bijwerkingen die het functioneren een klein beetje beïnvloeden, bijwerkingen die het functioneren matig beïnvloeden en bijwerkingen die het functioneren duidelijk beïnvloeden) werden opgeteld tot een totaalscore no event. Marginale, statistisch niet significante verschillen werden waargenomen voor bijwerkingen (test voor het totale effect: Z = 1,36; p = 0,17), met een risicoratio die aangeeft dat deelnemers die cis (z)-clopenthixol kregen, 15% meer kans op bijwerkingen hadden dan deelnemers die haloperidol kregen.
Samenvattend kan men zeggen dat van de twee antipsychoticabehandelingen cis (z)-clopenthixol waarschijnlijk beter is dan haloperidol wat betreft het verminderen van de ernst van de symptomen. Belangrijk is dat de bewijzen voor deze gegevens, net als voor veel van de antipsychotische literatuur, van lage kwaliteit worden geacht en zijn gedegradeerd, omdat het onderzoek indirect en oud was.
Open-labelonderzoek naar olanzapine voor gedragsmanagement
Tot slot was er een observationeel open-labelonderzoek zonder controlegroep naar de werking van olanzapine bij adolescenten met een verstandelijke beperking (Handen e.a., 2006). Gegevens over de werkzaamheid konden niet worden geëxtraheerd. Maar de auteurs rapporteren statistisch significante veranderingen ten opzichte van de uitgangswaarde voor prikkelbaarheid en hyperactiviteit, en voor de ernst/verbetering van de symptomen (p < 0,002). De auteurs concluderen dat olanzapine nuttig kan zijn bij de behandeling van storend gedrag bij jongeren met een verstandelijke beperking. Maar ze vermelden ook dat de bijwerkingen, vooral gewichtstoename, problematisch zijn, met een gemiddelde gewichtstoename van 5,8 kg tijdens het 8 weken durende onderzoek, terwijl 67% van de deelnemers > 4,5 kg zwaarder werd. Dit onderzoek wijst dus op positieve behandelingseffecten voor appelerend probleemgedrag, maar met een ernstige bijwerking wat betreft gewichtstoename.
Kosteneffectiviteit
Voor deze richtlijn werd de economische literatuur systematisch doorzocht op onderzoeken naar de kosteneffectiviteit van antipsychotica, maar deze werden niet gevonden.
Zoeken en selecteren
Klinisch reviewprotocol
Tabel 5.1 geeft een samenvatting van het reviewprotocol, met uitsluitend de klinische uitgangsvragen (review questions), de informatie over doorzochte databases, en de selectiecriteria die voor dit deel van de richtlijn zijn gebruikt. (Verdere informatie over de zoekstrategie staat in bijlage 6.) Over de biomedische behandelingen heeft de richtlijnwerkgroep besloten dat er geëxtrapoleerd kon worden vanuit literatuur over kinderen met een Ass en, voor zover het gedragsmanagement door middel van farmacotherapie betrof, vanuit literatuur over populaties met een verstandelijke beperking. Een uitzondering hierop werd gemaakt voor de werking van antidepressiva, waarbij duidelijke aanwijzingen bestaan dat er beter niet geëxtrapoleerd kan worden op basis van onderzoeksresultaten bij kinderen met ASS.
Tabel 5.1 Reviewprotocol biomedische interventies
|
Component |
Description |
|
Review question |
(CQ-C4) For adults with autism, what is the effectiveness of biomedical interventions (e.g. dietary interventions, pharmacotherapy, and physical-environmental adaptations)? |
|
Sub-question |
|
|
Objectives |
To evaluate the clinical effectiveness of biomedical interventions for autism. |
|
Population |
|
|
Interventions |
|
|
Comparison |
Placebo-controlled, other active interventions. |
|
Critical outcomes |
Outcomes involving core features of autism (social interaction, communication, repetitive interests/activities); overall autistic behaviour; symptom severity/improvement; management of challenging behaviour; outcomes involving treatment of coexisting conditions; side effects. |
|
Electronic databases |
AMED, Australian Education Index, BIOSIS previews, British Education Index, CDSR, CENTRAL, CINAHL, DARE, Embase, ERIC, IBSS, Medline, PsycINFO, Sociological Abstracts, Social Services Abstracts. |
|
Date searched |
Generic, RCT, QE, OS. Inception of DB up to 09/09/2011. Generic, SR. 1995 up to 09/09/2011. |
|
Study design |
RCTs. The GDG agreed by consensus that where there were no RCTs found in the evidence search, or the results from the RCTs were inconclusive, that the following studies would be included in the review of evidence:
|
|
Review strategy |
|
Samenvatting kinisch reviewprotocol voor de beoordeling van biomedische interventies BIOSIS: BioSciences Information Service of Biological Abstracts; CDSR: Cochrane Database of Systematic Reviews; CENTRAL: Cochrane Central Register of ControlLed Trials; DB: data¬base; CINAHL: Cumulative Index to Nursing and Allied Health Literature; DARE: Database of Abstracts of Reviews of Effectiveness (Cochrane Library); DSM: Diagnostic and Statistical Manual; ERIC: Education Resources Information Center; GDG: Guideline Development Group; IBSS: International Bibliography of the Social Sciences; ICD: International Classifica- tion of Diseases; RCT: randomised controlled trial; QE: quasi-experiemental; OS: observational study; SR: systematic review
Referenties
- Adams, J.B., Baral, M., Geis, E., Mitchell, J., Ingram, J., Hensley, A., e.a. (2009a). Safety and efficacy of oral DMSA therapy for children with autism spec¬trum disorders, part A: Medical results. BMC Clinical Pharmacology, 9, 16. Raadpleegbaar via: http://www.biomedcentral.com/content/pdf/1472-6904- 9-16.pdf.
- Adams, J.B., Baral, M., Geis, E., Mitchell, J., Ingram, J., Hensley, A., e.a. (2009b). Safety and efficacy of oral DMSA therapy for children with autism spectrum disorders, part B: Behavioral results. BMC Clinical Pharmacology, 9, 17. Raadpleegbaar via: http://www.biomedcentral.com/content/pdf/1472-6904- 9-17.pdf.
- Allen, A. (2007, May 28). Thiomersal on trial: The theory that vaccines cause autism goes to court. Retrieved from: http://www.slate.com/articles/health_and_science/medical_examiner/2007/05/thimerosal_on_trial.html.
- Aman, M.G., Burrow, W.H., & Wolford, P.L. (1995a). The Aberrant Behavior Checklist-Community: Factor validity and effect of subject variables for adults in group homes. American Journal of Mental Retardation, 100, 283-292.
- Aman, M.G., Lam, K.S., & Collier-Crespin, A. (2003). Prevalence and patterns of use of psychoactive medicines among individuals with autism in the Autism Society of Ohio. Journal of Autism and Developmental Disorders, 33, 527-534.
- Aman, M.G., Singh, N.N., Stewart, A.W., & Field, C.J. (1985). The Aberrant Behavior Checklist. American Journal of Mental Deficiency, 89, 492-502.
- Aman, M.G., Van Bourgondien, M.E., Wolford, P.L., Wolford, P.L., & Sarphare, G. (1995b). Psychotropic and anticonvulsant drugs in subjects with autism: Prevalence and patterns of use. Journal of the American Academy of Child and Adolescent Psychiatry, 34, 1672-1681.
- Aman, M.G., Lam, K.S., & Van Bourgondien, M.E. (2005). Medication patterns in patients with autism: Temporal, regional, and demographic influences. Journal of Child & Adolescent Psychopharmacology, 15, 116-26.
- Andari E, Duhamel JR, Zalla T, Herbrecht E, Leboyer M, Sirigu A. (2010). Promoting social behavior with oxytocin in high-functioning autism spectrum disorders. Proceedings of the National Academy of Sciences of the USA, 107, 4389-94.
- Antochi, R., Stavrakaki, C., & Emery, P.C. (2003). Psychopharmacological treatments in persons with dual diagnosis of psychiatric disorders and developmental disabilities. Postgraduate Medicine Journal, 9, 139-146.
- Arendt, J. (1997). Safety of melatonin in long-term use (?). Journal of Biological Rhythms, 12, 673-681.
- Arendt, J. (2003). Importance and relevance of melatonin to human biological rhythms. Journal of Neuroendocrinology, 15, 427-431.
- Bailey, A., Le Couteur, A., Gottesman, I., Bolton, P., Simonoff, E., Yuzda, E., & Rutter M. (1995). Autism as a strongly genetic disorder: Evidence from a British twin study. Psychological Medicine, 25, 63-77.
- Balkom, A.L.J.M van, Vliet, I.M. van, Emmelkamp, P.M.G., Bockting, C.L.H., Spijker, J., Hermens, M.L.M., & Meeuwissen, J.A.C.; namens de Werkgroep Multidisciplinaire richtlijnontwikkeling Angststoornissen/Depressie. (2012). Multidisciplinaire richtlijn Angststoornissen (Tweede revisie). Richtlijn voor de diagnostiek, behandeling en begeleiding van volwassen patiënten met een angststoornis. Utrecht: Trimbos-instituut.
- Baron-Cohen, S. (1991). The development of a theory of mind in autism: deviance and delay? Psychiatrie Clinics of North America, 14, 33-51.
- Baron-Cohen, S., Ring, H.A., Bullmore, E.T., Wheelwright, S., Ashwin, C., & Williams, S.C. (2000). The amydala theory of autism. Neuroscience Biobehavioral Reviews, 24, 355-361.
- Baron-Cohen, S., Wheelwright, S., Hill, J., Raste, Y., & Plumb, I. (2001). The 'Reading the Mind in the Eyes' test, revised version: A study with normal adults, and adults with Asperger's syndrome or high-functioning autism. Journal of Child Psychology and Psychiatry, 42, 241-251.
- Barthelemy, C., Adrien, J.L., Tanguay, P., Garreau, B., Fermanian, J., Roux, S., e.a. (1990). The Behavioral Summarized Evaluation: Validity and reliability of a scale for the assessment of autistic behaviours. Journal of Autism and Developmental Disorders, 20, 189-203.
- Bellini, S. (2004). Social skill deficits and anxiety in high-functioning adolescents with autism spectrum disorders. Focus on Autism and Other Developmental Disabilities, 19, 78-86.
- Belsito, K.M., Law, P.A., Kirk, K.S., Landa, R.J., & Zimmerman, A.W. (2001). Lamotrigine therapy for autistic disorder: a randomized, double-blind, placebo-controlled trial. Journal of Autism and Developmental Disorders, 31, 175-181.
- Bent, S., Bertoglio, K., Ashwood, P, Nemeth, E., & Hendren, R.L. (2012). Brief report: Hyperbaric oxygen therapy (HBOT) in children with autism spectrum disorder: A clinical trial. Journal of Autism and Developmental Disor-ders, 42, 1127-1132.
- Bethea, T.C., & Sikich, L. (2007). Early pharmacological treatment of autism: A rationale for developmental treatment. Biological Psychiatry, 61, 521-37.
- Birks, J. (2006). Cholinesterase inhibitors for Alzheimer's disease. Cochrane Database of Systematic Reviews 2006(1), Article CD005593. Retrieved September 15, 2011. The Cochrane Library Database.
- Birks, J., & Harvey, R.J. (2006). Donepezil for dementia due to Alzheimer's disease. Cochrane Database Systematic Reviews 2006(1), Article CD001190. Retrieved September 15, 2011. The Cochrane Library Database.
- Birks, J., Grimley Evans, J., Iakovidou, V., Tsolaki, M., & Holt, F.E. (2009). Rivastigmine for Alzheimer's disease. Cochrane Database Systematic Reviews 2009(2), Article CD001191. Retrieved September 15, 2011. The Cochrane Library Database.
- Borre, R. Vanden, Vermote, R., Buttiëns, M., Thiry, P., Dierick, G., Geutjens, J., e.a. (1993). Risperidone as add-on therapy in behavioural disturbances in mental retardation: a double-blind placebo-controlled cross-over study. Acta Psychiatrica Scandinavica, 87, 167-171.
- Broadstock, M., Doughty, C., & Eggleston, M. (2007). Systematic review of the effectiveness of pharmacological treatments for adolescents and adults with autism spectrum disorder. Autism, 11, 335-348.
- Brodkin, E.S., McDougle, C.J., Naylor, S.T., Cohen, D.J., & Price, L.H. (1997). Clomipramine in adults with pervasive developmental disorders: A prospective open-label investigation. Journal of Child & Adolescent Psycho- pharmacology, 7, 109-21.
- Brudnak, M.A., Rimland, B., Kerry, R.E., Dailey, M., Taylor, R., Stayton, B., e.a. (2002). Enzyme-based therapy for autism spectrum disorders: Is it worth another look? Medical Hypotheses, 58, 422-428.
- Bruni O, Ottaviano S, Guidetti V, Romoli M, Innocenzi M, Cortesi F, Giannotti F. (1996). The Sleep Disturbance Scale for Children (SDSC). Construction and validation of an instrument to evaluate sleep disturbances in childhood and adolescence. Journal of Sleep Research, 5, 251-261.
- Buitelaar, J.K., Engeland, H. van, Kogel, K. de, Vries, H. de, Hooff, J. van, Ree J. van (1992). The adrenocorticotrophic hormone (4-9). analog ORG 2766 benefits autistic children: Report on a second controlled clinical trial. Journal of the American Academy of Child and Adolescent Psychiatry, 31, 1149-1156.
- Buitelaar, J.K., Dekker, M.E.M., van Ree, J.M., & Engeland, H. van. (1996). A controlled trial with ORG 2766, an ACTH-(4-9). analog, in 50 relatively able children with autism. European Neuropsychopharmacology, 6, 13-19.
- Buitelaar, J.K., Gaag, R.J. van der, & Hoeven, J. van der. (1998). Buspirone in the management of anxiety and irritability in children with pervasive developmental disorders: results of an open-label study. Journal of Clinical Psychiatry, 59, 56-59.
- Cahn W, Ramlal D, Bruggeman R, de Haan L, Scheepers FE, van Soest MM, e.a. (2008). Preventie en behandeling van somatische complicaties bij antipsychoticagebruik. Tijdschrift voor Psychiatrie, 50, 9.
- Cai, G., Edelmann, L., Goldsmith, J.E., Cohen, N., Nakamine, A., Reichert, JG, e.a. (2008). Multiplex ligation-dependent probe amplification for genetic screening in autism spectrum disorders: efficient identification of known microduplications and identification of a novel microduplication in ASMT. BMC Medical Genomics, 1, 50. Raadpleegbaar via: http://www.biomedcentral.com/content/pdf/1755-8794-1-50.pdf.
- Cajochen, C., Krauchi, K., & Wirz-Justice, A. (2003). Role of melatonin in the regulation of human circadian rhythms and sleep. Journal of Neuroendocrinology, 15, 432-437.
- Canitano, R. (2007). Epilepsy in autism spectrum disorders. European Child and Adolescent Psychiatry, 16, 61-66.
- Canitano, R., & Scandurra V. (2011). Psychopharmacology in autism: An update. Progress in Neuropsychopharmacoloy & Biological Psychiatry, 35, 18-28.
- Casanova, M.F., Buxhoeveden, D., & Gomez, J. (2003). Disruption in the inhibitory architecture of the cell minicolumn: implications for ASD. Neuroscientist, 9, 496-507.
- Charlton, C.G., Miller, R.L., Crawley, J.N., Handelmann, G.E., O'Donohue, T.L. (1983). Secretin modulation of behavioural and physiological functions in the rat. Peptides, 4, 739-742.
- Chez, M.G., Buchanan, C.P., Bagan, B.T., Hammer, M.S., McCarthy, K.S., Ovruts-kaya, I., e.a. (2000). Secretin and autism: A two-part clinical investigation. Journal of Autism and Developmental Disorders, 30, 87-94.
- Chez, M.G., Buchanan, C.P., Aimonovitch, M.C., Handelmann, G.E., & O'Donohue TL. (2002). Micronutrients versus standard medication management in autism: A naturalistic case-control study. Journal of Child and Adolescent Psychopharmacology, 17, 833-837.
- Chez, M.G., Buchanan, T.M., Becker, M., Kessler, J., Aimonovitch, M.C., & Mrazek, S.R. (2003). Donepezil hydrochloride: A double-blind study in autistic children. Journal of Pediatric Neurology, 1, 83-88.
- Chez, M.G., Burton, Q., Dowling, T., Chang, M., Khanna, P., & Kramer, C. (2007). Memantine as adjunctive therapy in children diagnosed with autistic spectrum disorders: an observation of initial clinical response and maintenance tolerability. Journal of Child Neurology, 22, 574-579.
- Chungpaibulpatana, J., Sumpatanarax, T., Thadakul, N., Chantharatreerat, C., Konkaew, M., & Aroonlimsawas, M. (2008). Hyperbaric oxygen therapy in Thai autistic children. Journal of the Medical Association of Thailand, 91, 1232-1238.
- Coben, R., & Padolsky, I. (2007). Assessment-guided neurofeedback for autistic spectrum disorder. Journal of Neurotherapy, 11, 5-23.
- Connor, J.R., Boyer, P.J., Menzies, B.S., Dellinger, B., Allen, R.P., Ondo, W.G., & Earley, C.J. (2003). Neuropathological examination suggests impaired brain iron acquisition in restless legs syndrome. Neurology, 61, 304-309.
- Constantino, J.N., Hudziak, J.J., & Todd, R.D. (2003). Deficits in reciprocal social behaviour in male twins: Evidence for a genetically independent domain of psychopharmacology. Journal of the American Academy of Child and Adolescent Psychiatry, 42, 458-467.
- Cook, E.H. Jr., Rowlett, R., Jselskis, C., & Leventhal BL. (1992). Fluoxetine treat- ment of children and adults with autistic disorder and mental retardation. Journal of the American Academy of Child and Adolescent Psychiatry, 31, 739-745.
- Cook, E.H., & Leventhal, B.L. (1996). The serotonin system in autism. Current Opinion in Pediatrics, 8, 348-354.
- Croonenberghs, J., Wauters, A., Deboutte, D., Verkerk, R., Scharpe, S., & Maes, M. (2007). Central serotonergic hypofunction in autism: Results of the 5-hydroxy-tryptophan challenge test. Neuro Endocrinology Letters, 28, 449-55.
- D'Eufemia, P., Celli, M., Finocchiaro, R., Pacifico, L., Viozzi, L., Zaccagnini, M., e.a. (1996). Abnormal intestinal permeability in children with autism. Acta Paediatrica, 85, 1076-1079.
- Damasio, A.R., & Maurer, R.G. (1978). A neurological model for childhood autism. Archives of Neurology, 35, 777-786.
- Daniels, J.L., Forssen, U., Hultman, C.M., Cnattingius, S., Savitz, D.A., Feychting, M., & Sparen, P. (2008). Parental psychiatric disorders associated with autism spectrum disorders in the offspring. Pediatrics, 121, e1357-e1362.
- DeLong, G.R., Ritch, C.R., & Burch, S. (2002). Fluoxetine response in children with autistic spectrum disorders: Correlation with familial major affective disorder and intellectual achievement. Developmental Medicine and Child Neurology, 44, 652-9.
- Dhumad, S., & Markar, D. (2007). Audit on the use of antipsychotic medication in a community sample of people with learning disability. The British Journal of Developmental Disabilities, 53, 47-51.
- Di Simplicio, M., Massey-Chase, R., Cowen, P.J., & Harmer, C.J. (2009). Oxytocin enhances processing of positive versus negative emotional information in healthy male volunteers. Journal of Psychopharmacology, 23, 241-248.
- Domes, G., Heinrichs, M., Glascherb, J., Büchel, C., Braus, D.F., & Herpertz, S.C. (2007). Oxytocin attenuates amygdala responses to emotional faces regardless of valence. Biological Psychiatry, 62, 1187-1190.
- Donaldson, Z.R., & Young, L.J. (2008). Oxytocin, vasopressin, and the neurogenetics of sociality. Science, 322, 900-904.
- Dosman, C., Drmic, I., Brian, J., Senthilselvan, A., Harford, M., Smith, R., & Roberts, S.W. (2006). Ferritin as an indicator of suspected iron deficiency in children with autism spectrum disorder: Prevalence of low serum ferritin concentration. Developmental Medicine and Child Neurology, 48, 1008-1009.
- Dosman, C.F., Brian, J.A., Drmic, I.E., Senthilselvan, A., Harford, M.M., Smith, R.W., e.a. (2007). Children with autism: effect of iron supplementation on sleep and ferritin. Pediatrie Neurology, 36, 152-158.
- Drago, F., Pedersen, C.A., Caldwell, J.D., & Prange, A.J. Jr. (1986). Oxytocin potently enhances novelty-induced grooming behaviour in the rat. Brain Research, 368, 287-295.
- Dunn-Geier, J., Ho, H.H., Auersperg, E., Doyle, D., Eaves, L., Matsuba, C., e.a. (2000). Effect of secretin on children with autism: a randomized controlled trial. Developmental Medicine and Child Neurology, 42, 796-802.
- Earley, C.J. (2003). Restless legs syndrome. New England Journal of Medicine, 348, 2103-2109.
- Earley, C.J., Connor, J.R., Beard, J.L., Malecki, E.A., Epstein, D.K., & Allen, R.P (2000). Abnormalities in CSF concentrations of ferritin and transferring in restless legs syndrome. Neurology, 54, 1698-1700.
- Edwards, D.J., Chugani, D.C., Chugani, H.T., Chehab, J., Malian, M., & Aranda, J.V. (2006). Pharmacokinetics of buspirone in autistic children. Journal of Clinical Pharmacology, 46, 508-514.
- Elia, M., Ferri, R., Musumeci, S.A., Del Gracco, S., Bottitta, M., Scuderi, C., e.a. (2000). Sleep in subjects with autistic disorder: A neurophysiological and psychological study. Brain Development, 22, 88-92.
- Erickson, C.A., Posey, D.J., Stigler, K.A., Mullett, J., Katschke, A.R., & McDougle, C.J. (2007). A retrospective study of memantine in children and adoles¬cents with pervasive developmental disorders. Psychopharmacology, 191, 141-147.
- Esbensen, A.J., Greenberg, J.S., Seltzer, M.M., & Aman, M.G. (2009). A longitudinal investigation of psychotropic and non-psychotropic medication use among adolescents and adults with autism spectrum disorders. Journal of Autism and Developmental Disorders, 39, 1339-1349.
- Evangeliou, A., Vlachonikolis, I., Mihailidou, H., Spilioti, M., Skarpalezou, A., Makaronas, N., e.a. (2003). Application of a ketogenic diet in children with autistic behavior: Pilot study. Journal of Child Neurology, 18, 113-118.
- Fatemi, S.H., Halt, A.R., Stary, J.M., Kanodia, R., Schulz, S.C., & Realmuto, G.R. (2002). Glutamic acid decarboxylase 65 and 67 kDa proteins are reduced in the autistic parietal and cerebellar cortices. Biological Psychiatry, 52, 805-810.
- Findling, R.L. (2005). Pharmacological treatment of behavioural symptoms in autism and pervasive developmental disorders. Journal of Clinical Psychiatry, 66, 26-31.
- Findling, R.L., Steiner, H., & Weller, E.B. (2005). Use of antipsychotics in children and adolescents. Journal of Clinical Psychiatry, 66, 29-40.
- Fish, B. (1985). Children's psychiatric rating scale. Psychopharmacology Bulletin, 21, 753-770.
- Fischer-Shofty, M., Shamay-Tsoory, S.G., Harari, H., & Levkovitz, Y. (2010). The effect of intranasal administration of oxytocin on fear recognition. Neuro-psychologia, 48, 179-184.
- Fombonne, E. (2008). Thimerosal disappears but autism remains. Archives of General Psychiatry, 65, 15-16.
- Francis, P.T., Palmer, A.M., Snape, M., & Wilcock, G.K. (1999). The cholinergic hypothesis of Alzheimer's disease: A review of progress. Journal of Neurology, Neurosurgery and Psychiatry, 66, 137-147.
- Freeman, J.M., Kossoff, E.H., & Hartman, A.L. (2007). The ketogenic diet: one decade later. Pediatrics, 119, 535-543.
- Freeman, B.J. , Ritvo, E.R., Yokota, A., & Ritvo, A. (1986). A scale for rating symptoms of patients with the syndrome of autism in real life settings. Journal of the American Academy of Child Psychiatry, 25, 130-136.
- Fremeau, R.T. Jr., Jensen, R.T., Charlton, C.G., Miller, R.L., O'Donohue, T.L., & Moody, T.W. (1983). Secretin: specific binding to rat brain membranes. Journal of Neuroscience, 3, 1620-1625.
- Gagiano, C., Read, S., Thorpe, L., Eerdekens, M., & Hove, I. van. (2005). Short- and long-term efficacy and safety of risperidone in adults with disruptive behaviour disorders. Psychopharmacology, 179, 629-636.
- Geier, D.A., & Geier, M.R. (2006). A clinical trial of combined anti-androgen and anti-heavy metal therapy in autistic disorders. Neuroendocrinology Letters, 27, 833-838.
- Geier, M., & Geier, D. (2005). The potential importance of steroids in the treatment of autistic spectrum disorders and other disorders involving mercury toxicity. Medical Hypotheses, 64, 946-54.
- Ghaziuddin, M., Ghaziuddin, N., & Greden, J. (2002). Depression in persons with autism: Implications for research and clinical care. Journal of Autism and Developmental Disorders, 32, 299-306.
- Ghaziuddin, M., & Greden, J. (1998). Depression in children with autism/perva- sive developmental disorders: a case-control family history study. Journal of Autism and Developmental Disorders, 28, 111-115.
- Gillberg, C., & Billstedt, E. (2000). Autism and Asperger syndrome: Co-existence with other clinical disorders. Acta Psychiatrica Scandinavica, 102, 321-330.
- Gillott, A., Furniss, F., & Walter, A. (2001). Anxiety in high-functioning children with autism. Autism, 5, 277-286.
- Gimpl, G. (2008). Oxytocin receptor ligands: a survey of the patent literature. Expert Opinion, 18, 1239-1251.
- Gispen, W.H. (1980). On the neurochemical mechanism of action of ACTH. Progress in Brain Research, 53, 193-206.
- Goodman, W. K., Price, L. H., Rasmussen, S. A., Mazure, C., Fleischmann, R.L., Hill, C.L., e.a. (1989a). The Yale-Brown Obsessive Compulsive Scale. I. development, use, and reliability. Archives of General Psychiatry, 46, 1006-1011.
- Goodman, W.K., Price, L.H., Rasmussen, S.A., Mazure, C., Delgado, P., Heninger, G.R., & Charney, D.S. (1989b). The Yale-Brown Obsessive Compulsive Scale. II. validity. Archives of General Psychiatry, 46, 1012-1016.
- Gordon N. (2000). The therapeutics of melatonin: a paediatric perspective. Brain & Development, 22, 213-7.
- Goyette, C.H., Conners, C.K., & Ulrich, R.F. (1978). Normative data on revised Conners Parent and Teacher Rating Scales. Journal of Abnormal Child Psychology, 6, 221-236.
- Granpeesheha, D., Tarboxa, J., Dixon, D.R., Wilke, A.E., Allen, M.S., & Bradstreet, J.J. (2010). Randomized trial of hyperbaric oxygen therapy for children with autism. Research in Autism Spectrum Disorders, 4, 268-275.
- Green, J., Gilchrist, A., Burton, D., & Cox, A. (2000). Social and psychiatric func- tioning in adolescents with Asperger syndrome compared with conduct disorder. Journal of Autism and Developmental Disorders, 30, 279-293.
- Green, V.A., Pituch, K.A., Itchon, J., Choi, A., O'Reilly, M., & Sigafoos, J. (2006). Internet survey of treatments used by parents of children with autism. Research in Developmental Disabilities, 27, 70-84.
- Greenhill, L.L., Swanson, J.M., Vitiello, B., Davies, M., Clevenger, W., Wu, M., e.a. (2001). Impairment and deportment responses to different methylphenidate doses in children with ADHD: The MTA titration trial. Journal of the American Academy of Child and Adolescent Psychiatry, 40, 180-187.
- Gregory, S.G., Connelly, J.J., Towers, A., Johnson, J., Biscocho, D., Markunas, C.A., e.a. (2009). Genomic and epigenetic evidence for oxytocin receptor deficiency in autism. BMC Medicine, 7, 62.
- Gualtieri, C.T. (2002). Psychopharmacology of brain injured and mentally retarded patients. Philadelphia: Lippincott Williams and Wilkins.
- Gualtieri, T., Chandler, M., Coons, T.B., & Brown, L.T. (1989). Amantadine: A new clinical profile for traumatic brain injury. Clinical Neuropharmacology, 12, 258-270.
- Guastella, A.J., Mitchell, P.B., & Dadds, M.R. (2008). Oxytocin increases gaze to the eye region of human faces. Biological Psychiatry, 63, 3-5.
- Guastella, A.J., Einfeld, S.L., Gray, K.M., Rinehart, N.J., Tonge, B.J., Lambert, T.J., & Hickie, I.B. (2010). Intranasal oxytocin improves emotion recognition for youth with autism spectrum disorders. Biological Psychiatry, 67, 692-4.
- Guénolé, F., Godbout, R., Nicolas, A., Franco, P., Claustrat, B., & Baleyte, J.M. (2011). Melatonin for disordered sleep in individuals with autism spectrum disorders: Systematic review and discussion. Sleep Medicine Reviews, 15, 379-87.
- Guy, W. (1976a). Clinical Global Impressions. In W. Guy, ECDEU Assessment Manual for Psychopharmacology, revised (DHEW Publ No ADM 76-338) (pp. 218-222). Rockville, MD: National Institute of Mental Health.
- Guy, W. (1976b). Dosage Record and Treatment Emergent Symptoms scale (DOTES). In W. Guy, ECDEU Assessment Manual for Psychopharmacology, revised (DHEW Publ No ADM 76-338) (pp. 223-244). Rockville, MD: National Institute of Mental Health.
- Haas, R.H., Rice, M.A., Trauner, D.A., & Merritt, T.A. (1986). Therapeutic effects of a ketogenic diet in Rett syndrome. American Journal of Medical Genetics, 1, 225-246.
- Haessler, F., Glaser, T., Beneke, M., Pap, A.F., Bodenschatz, R., Reis, O.; Zuclopenthixol Disruptive Behaviour Study Group. (2007). Zuclopenthixol in adults with intellectual disabilities and aggressive behaviours: Discontinuation study. The British Journal of Psychiatry, 190, 447-448.
- Hallett, V., Ronald, A., & Happe, F. (2009). Investigating the association between autistic-like and internalizing traits in a community-based twin sample. Journal of the American Academy of Child and Adolescent Psychiatry, 48, 618-627.
- Hampson, D., Gholizadeh, S., & Pacey, L. (2012). Pathways to drug development for autism spectrum disorders. Clinical Pharmacology and Therapeutics, 91, 189-200.
- Handen, B.L., Feldman, H., Gosling, A., Breaux, A.M., & McAuliffe, S. (1991). Adverse side effects of Ritalin among mentally retarded children with ADHD. Journal of the American Academy of Child and Adolescent Psychiatry, 30, 241-245.
- Handen, B.L., & Hardan, A.Y. (2006). Open-label, prospective trial of olanzapine in adolescents with subaverage intelligence and disruptive behavioral disor¬ders. Journal of the American Academy of Child and Adolescent Psychiatry, 45, 928-935.
- Haracopos, D., & Kelstrup, A. (1975). Psykotiskadfard [Psychotisch gedrag]. Kobenhavn: Samaterialer.
- Hardan, A.Y., Jou, R.J., & Handen, B.L. (2004). A retrospective assessment of topiramate in children and adolescents with pervasive developmental disorders. Journal of Child and Adolescent Psychopharmacology, 14, 426-432.
- Heinrichs, M., Baumgartner, T., Kirschbaum, C., & Ehlert, U. (2003). Social support and oxytocin interact to suppress cortisol and subjective responses to psychological stress. Biological Psychiatry, 54, 1389-1398.
- Hellings, J.A., Weckbaugh, M., Nickel, E.J., Cain, S.E., Zarcone, J.R., Reese, R.M., e.a. (2005). A double-blind, placebo-controlled study of valproate for aggression in youth with pervasive developmental disorders. Journal of Child and Adolescent Psychopharmacology, 15, 682-692.
- Hellings, J.A., Zarcone, J.R., Reese, R.M., Valdovinos, M.G., Marquis, J.G., Fleming, K.K., & Schroeder, S.R. (2006). A crossover study of risperidone in children, adolescents and adults with mental retardation. Journal of Autism and Developmental Disorders, 36, 401-411.
- Hemert, J.C.J. van. (1975). Pipamperone (Dipiperon, R3345). in troublesome mental retardates: A double-blind placebo controlled cross-over study with long-term follow-up. Acta Psychiatrica Scandinavica, 52, 237-245.
- Hen, M.H. de, & H.M. Geurts. (2008). Is neurofeedback effectief bij kinderen met ADHD? Tijdschrift voor Neuropsychologie, 2, 14-27.
- Hofvander, B., Delorme, R., Chaste, P., Nydén, A., Wentz, E., Stahlberg, O., e.a. (2009). Psychiatrie and psychosocial problems in adults with normal-intelligence autism spectrum disorders. BMC Psychiatry, 10, 9:35.
- Hollander, E., Cartwright, C., Wong, C.M., DeCaria, C. M., DelGuidice-Asch, G., Buchsbaum, M.S., e.a. (1998). A dimensional approach to the autism spectrum. CNS Spectrums, 3, 22-39.
- Hollander, E., Tracy, K., Swann, A.C., Coccaro, E.F., McElroy, S.L., Wozniak, P, e.a. (2003). Divalproex in the treatment of impulsive aggression: Efficacy in cluster B personality disorders. Neuropsychopharmacology, 28, 1186-1197.
- Hollander, E., Bartz, J., Chaplin, W., Phillips, A., Sumner, J., Soorya, L., e.a. (2007). Oxytocin increases retention of social cognition in autism. Biological Psychiatry, 61, 498-503.
- Hollander, E., Chaplin, W., Soorya, L., Wasserman, S., Novotny, S., Russoff, J., e.a. (2010). Divalproex sodium vs placebo for the treatment of irritability in children and adolescents with autism spectrum disorders. Neuropsychopharmacology, 35, 990-998.
- Hollander, E., Soorya, L., Chaplin, W., Anagnostou, E., Taylor, B.P., Ferretti, C.J., e.a. (2011). A double-blind placebo-controlled trial of fluoxetine for repetitive behaviors and global severity in adult autism spectrum disorders. American Journal of Psychiatry, 169, 292-299.
- Honigfeld, G., Gillis, R.D., & Klett, C.J. (1966). NOSIE-30: a treatment-sensitive ward behavior scale. Psychological Reports, 19, 180-182.
- Horning, M.S., Blakemore, L.J., & Trombly, P.Q. (2000). Endogenous mechanisms of neuroprotection: Role of zinc, copper, and carnosine. Brain Research, 852, 56-61.
- Horvath, K., & Perman, J.A. (2002). Autism and gastrointestinal symptoms. Current Gastroenterology Reports, 4, 251-258.
- Horvath, K., Stefanatos, G., Sokolski, K.N., Wachtel, R., Nabors, L., & Tildon, J.T. (1998). Improved social and language skills after secretin administration in patients with autistic spectrum disorders. Journal of the Association for Academie Minority Physicians, 9, 9-15.
- Howlin, P. (2000). Outcome in adult life for more able individuals with autism or Asperger Syndrome. Autism, 4, 63-83.
- Huitema, R., & Eling, P. (2008). Neurofeedback: Wat is het waard? Tijdschrift voor Neuropsychologie, 2, 3-13.
- Hyman, S.E., & Nestler, E.J. (1996). Initiation and adaptation: A paradigm for understanding psychotropic drug action. American Journal of Psychiatry, 153, 151-162.
- Insel, T.R., & Winslow, J.T. (1991). Central administration of oxytocin modulates the infant rat's response to social isolation. European Journal of Pharmacology, 203, 149-152.
- Israngkun, P.P., Newman, H.A.I., Patel, S.T., Duruibe, V.A., & Abou-Issa, H. (1986). Potential biochemical markers for infantile autism. Neurochemical Pathology, 5, 51-70.
- Izmeth, M.G.A., Khan, S.Y., Kumarajeewa, D.I., Shivanathan, S., Veall, R.M., & Wiley, Y.V. (1988). Zuclopenthixol decanoate in the management of behavioural disorders in mentally handicapped patients. Pharmatherapeutica, 5, 217-227.
- Jahromi, L.B., Kasari, C.L., McCracken, J.T., Lee, L.S., Aman, M.G., McDougle, C.J., e.a. (2009). Positive effects of methylphenidate on social communication and self-regulation in children with pervasive developmental disorders and hyperactivity. Journal of Autism and Developmental Disorders, 39, 395-404.
- Jamain, S., Betancur, C., Quach, H., Philippe, A., Fellous, M., Giros, B., e.a. (2002). Linkage and association of the glutamate receptor 6 gene with autism. Molecular Psychiatry, 7, 302-310.
- Jan, J.E., Freeman, R.D., & Fast, D.K. (1999). Melatonin treatment of sleep/wake cycle disorders in children and adolescents. Developmental Medicine and Child Neurology, 41, 491-500.
- Jan, J.E., & O'Donnel, M.E. (1996). Use of melatonin in the treatment of pediatric sleep disorders. Journal of Pineal Research, 21, 193-199.
- Jarusiewicz, B. (2002). Efficacy of Neurofeedback for Children in the Autistic Spectrum: A Pilot Study. Journal of Neurotherapy, 6, 39-49.
- Jepson, B., Granpeesheh, D., Tarbox, J., Olive, M.L., Stott, C., Braud, S., e.a. (2011). Controlled evaluation of the effects of hyperbaric oxygen therapy on the behavior of 16 children with autism spectrum disorders. Journal of Autism and Developmental Disorders, 41, 575-588.
- Jonsson, L., Ljunggren, E., Bremer, A., Pedersen, C., Landen, M., Thuresson, K. e.a. (2010). Mutation screening of melatonin-related genes in patients with autism spectrum disorders. BMC Medical Genomics, 3, 10. Raadpleegbaar via: http://www.biomedcentral.com/content/pdf/1755-8794-3-10.pdf.
- Kanner, L. (1943). Autistic disturbances of affective contact. Nervous Child, 2, 217-250.
- Karsten, D., Kivimaki, T., Linna, S.L., Pollari, L., & Turunen, S. (1981). Neuroleptic treatment of oligophrenic patients: A double-blind clinical multicentre trial of cis(Z)-clopenthixol and haloperidol. Acta Psychiatrica Scandinavica, 294, 39-45.
- Kemp, J.A., & McKernan, R.M. (2002). NMDA receptor pathways as drug targets. Nature Neuroscience, 5, 1039-1042.
- Kemper, T., & Bauman, M. (1993). The contribution of neuropathologic studies to the understanding of autism. Neurologic Clinics, 11, 175-187.
- Kendall, T. (2011). The rise and fall of the atypical antipsychotics. The British Journal of Psychiatry, 199, 266-268.
- Kim, J.A., Szatmari, P., Bryson, S.E., Streiner, D.L., & Wilson, F.J. (2000). The prevalence of anxiety and mood problems among children with autism and Asperger syndrome. Autism, 4, 117-132.
- King, B.H., Wright, D.M., Handen, B.L., Sikich, L., Zimmerman, A.W., McMahon, W., e.a. (2001). Double-blind, placebo-controlled study of amantadine hydrochloride in the treatment of children with autistic disorder. Journal of the American Academy of Child and Adolescent Psychiatry, 40, 658-665.
- Kiralp, M.Z., Yildiz, S., Vural, D., Keskin, I., Ay, H., & Dursun, H. (2004). Effectiveness of hyperbaric oxygen therapy in the treatment of complex regional pain syndrome. Journal of International Medical Research, 32, 258-262.
- Kirsch I., Deacon B.J., Huedo-Medina T.B., Scoboria A., Moore T.J., Johnson B.T. (2008). Initial severity and antidepressant benefits: a meta-analysis of data submitted to the Food and Drug Administration. PLoS Med, 5: 260-8.
- Kirsch, P, Esslinger, C., Chen, Q., Mier, D., Lis, S., Siddhanti, S., e.a. (2005). Oxytocin modulates neural circuitry for social cognition and fear in humans. Journal of Neuroscience, 25, 11489-11493.
- Klin, A., Pauls, D., Schultz, R., & Volkmar, F. (2005). Three diagnostic approaches to Asperger syndrome: implications for research. Journal of Autism and Developmental Disorders, 35, 221-34.
- Knivsberg, A-M., Reichelt, K-L., H0ien, T., & N0dland, M. (2003). Effect of dietary intervention on autistic behavior. Focus on Autism and Other Developmental Disabilities, 18, 247-256.
- Kolevzon, A., Mathewson, K.A., & Hollander, E. (2006). Selective serotonin reuptake inhibitors in autism: A review of efficacy and tolerability. Journal of Clinical Psychiatry, 67, 407-414.
- Kooij, J.J.S. (2009). ADHD bij volwassenen: Diagnostiek en behandeling. Pearson Assessment and Information.
- Korkmaz, B. (2000). Infantile autism: adult outcome. Seminars in Clinical Neuropsychiatry, 5, 164-170.
- Kornhuber, J., Weller, M., Schoppmeyer, K., & Riederer, P. (1994). Amantadine and memantine are NMDA receptor antagonists with neuroprotective properties. Journal of Neural Transmission, 43, 91-104.
- Kosfeld, M., Heinrichs, M., Zak, P.J., Fischbacher, U., & Fehr, E. (2005). Oxytocin increases trust in humans. Nature, 435, 673-676.
- Krug, D., Arick, J., & Almond, P. (1993). Autism screening instrument for educa- tionalplanning (2nd ed.). Austin, TX: PRO-ED, Inc.
- Lainhart, J.E., & Folstein, S.E. (1994). Affective disorders in people with autism: A review of published cases. Journal of Autism and Developmental Disorders, 24, 587-601.
- Langworthy-Lam, K.S., Aman, M.G., & Van Bourgondien, M.E. (2002). Prevalence and patterns of use of psychoactive medicines in individuals with autism in the Autism Society of North Carolina. Journal of Child and Adolescent Psychopharmacology, 12, 311-322.
- Larsen, F.W., & Mouridsen, S.E. (1997). The outcome in children with childhood autism and asperger syndrome originally diagnosed as psychotic: A 30-year follow-up study of subjects hospitalized as children. European Child & Adolescent Psychiatry, 6, 181-190.
- Latif, A., Heinz, P., & Cook, R. (2002). Iron deficiency in autism and Asperger syndrome. Autism, 6, 103-114.
- Leach, R.M., Rees, PJ., & Wilmshurst, P. (1998). ABC of oxygen: hyperbaric oxygen therapy. British Medical Journal, 317, 1140-1143.
- Leu, R.M., Beyderman, L., Botzolakis, E.J., Surdyka, K., Wang, L., & Malow, B.A. (2010). Relation of melatonin to sleep architecture in children with autism. Journal of Autism and Developmental Disorders, 41, 427-433.
- Levy, S.E., Souders, M.C., Wray, J., Jawad, A.F., Gallagher, P.R., Coplan, J., e.a. (2003). Children with autistic spectrum disorders I: comparison of placebo and single dose of human synthetic secretin. Archives of Disease in Childhood, 88, 731-736.
- Levy, S.E., Mandell, D.S., & Schultz, R.T. (2009). Autism. Lancet, 374, 1627-1638.
- Lipton, S.A. (2006). Paradigm shift in neuroprotection by NMDA receptor blockade: Memantine and beyond. Nature Reviews Drug Discovery, 5, 160-170.
- Lonsdale, D., Shamberger, R.J., & Audhya, T. (2002). Treatment of autism spectrum children with thiamine tetrahydrofurfuryl disulfide: A pilot study. Neuroendocrinology Letters, 23, 303-308.
- Loo, S.K., & Barkley, R.A. (2005). Clinical utility of eeg in attention deficit hyperactivity disorder. Applied Neuropsychology, 12, 64-76.
- Lubar, J.F., & Shouse, M.N. (1976). EEG and behavioral changes in a hyperkinetic child concurrent with training of the sensorimotor rhythm (SMR): A preliminary report. Biofeedback and Self Regulation, 1, 293-306.
- Lubetsky, M.J., & Handen, B.L. (2008). Medication treatment in autism spectrum disorder. Speakers Journal, 8, 97-107.
- Luteijn, E.F., Serra, M., Jackson, S., Steenhuis, M.P., Althaus, M., Volkmar, F., & Minderaa, R. (2000). How unspecified are disorders of children with a pervasive developmental disorder not otherwise specified? A study of social problems in children with PDD-NOS and ADHD. European Child and Adolescent Psychiatry, 9, 168-179.
- MacDonald, E., Dadds, M.R., Brennan, J.L., Williams, K., Levy, F., Cauchi, A.J. (2011). A review of safety, side-effects and subjective reactions to intranasal oxytocin in human research. Psychoneuroendocrinology, 36, 1114-1126.
- Maelicke, A., Samochocki, M., Jostock, R., Fehrenbacher, A., Ludwig, J., Albuquerque, E.X.,e.a. (2001). Allosteric sensitization of nicotinic receptors by galantamine, a new treatment strategy for Alzheimier's disease. Biological Psychiatry, 49, 279-288.
- Magnuson, K.M., & Constantino, J.N. (2011). Characterization of depression in children with autism spectrum disorders. Journal of Developmental and Behavioral Pediatrics, 32, 332-340.
- Malone, R.P., Gratz, S.S., Delaney, M.A., Hyman, S.B. (2005). Advances in drug treatments for children and adolescents with autism and other pervasive developmental disorders. CNS Drugs, 19, 923-934.
- Marshall, T. (2004). Audit of the use of psychotropic medication for challenging behaviour in a community learning disability service. The Psychiatrist, 28, 447-450.
- Marshall, C., & Scherer, S. (2012). Detection and characterization of copy number variation in autism spectrum disorder. Methods in Molecular Biology, 838, 115-135.
- Martin, A., Koenig, K., Anderson, G.M., & Scahill, L. (2003). Low-dose fluvox- amine treatment of children and adolescents with pervasive developmental disorders: A prospective, open-label study. Journal of Autism and Develop- mental Disorders, 33, 77-85.
- Martin, A., Scahill, L., Klin, A., & Volkmar, F.R. (1999). Higher-functioning perva¬sive developmental disorders: rates and patterns of psychotropic drug use. Journal of the American Academy of Child and Adolescent Psychiatry, 38, 923-931.
- Martineau, J., Barthelemy, C., Cheliakine, C., & Lelord, G. (1988). Brief report: An open middle-term study of combined vitamin B6-magnesium in a subgroup of autistic children selected on their sensitivity to this treatment. Journal of Autism and Developmental Disorders, 18, 435-447.
- Masters, K.J. (1997). Alternative medications for ADHD [letter]. Journal of the American Academy of Child and Adolescent Psychiatry, 36, 301.
- Matson, J.L., & Hess, J.A. (2011). Psychotropic drug efficacy and side effects for persons with autism spectrum disorders. Research in Autism Spectrum Disorders, 5, 230-236.
- Matson, J.L., & Neal, D. (2009). Psychotropic medication use for challenging behaviours in persons with intellectual disabilities: an overview. Research in Developmental Disabilities, 30, 572-586.
- Matson, J.L., & Shoemaker, M. (2009). Intellectual disability and its relationship to autism spectrum disorders. Research in Developmental Disabilities, 30, 1107-1114.
- Matson, J.L., Sipes, M., Fodstad, J.C., & Fitzgerald, M.E. (2011). Issues in the management of challenging behaviour of adults with autism spectrum disorder. CNS Drugs, 25, 597-606.
- McDougle, C.J., Naylor, S.T., Cohen, D.J., Volkmar, F.R., Heninger, G.R., & Price, L.H. (1996). A double-blind, placebo-controlled study of fluvoxamine in adults with autistic disorder. Archives of General Psychiatry, 53, 1001-1008.
- McDougle, C.J., Brodkin, E.S., Naylor, S.T., Carlson, D.C., Cohen, D.J., & Price, L.H. (1998a). Sertraline in adults with pervasive developmental disorders: A prospective open-label investigation. Journal of Clinical Psychopharmacology, 18, 62-66.
- McDougle, C.J., Holmes, J.P., Carlson, D.C., Pelton, G.H., Cohen, D.J., & Price, L.H. (1998b). A double-blind, placebo-controlled study of risperidone in adults with autistic disorder and other pervasive developmental disorders. Archives of General Psychiatry, 55, 633-641.
- McDougle, C.J., Stigler, K.A., & Posey, D.J. (2003). Treatment of aggression in children and adolescents with autism and conduct disorder. Journal of Clinical Psychiatry, 64, 16-25.
- McDougle, C.J., Erickson, C.A., Stigler, K.A., & Posey, D.J. (2005). Neurochemistry in the pathophysiology of autism. Journal of Clinical Psychiatry, 66, 9-18.
- McKenzie, M.E., & Roswell-Harris, D. (1966). A controlled trial of prothipendyl (tolnate). in mentally subnormal patients. The British Journal of Psychiatry, 112, 95-100.
- Meisenberg, G., & Simmons, W.H. (1983). Centrally mediated effects of neurohypophyseal hormones. Neuroscience Biobehavioral Reviews, 7, 263-280.
- Mehl-Madrona, L., Leung, B., Kennedy, C., Paul, S., & Kaplan, B.J. (2010). Micronutrients versus standard medication management in autism: A naturalistic case-control study. Journal of Child and Adolescent Psychopharmacology, 20, 95-103.
- Melke, J., Goubran Botros, H., Chaste, P., Betancur, C., Nygren, G., Anckarsater, H., e.a. (2008). Abnormal melatonin synthesis in autism spectrum disorders. Molecular Psychiatry, 13, 90-98.
- Miano, S., & Ferri, R. (2010). Epidemiology and management of insomnia in children with autistic spectrum disorders. Pediatric Drugs, 12, 75-84.
- Millward, C., Ferriter, M., Calver, S.J., & Connell-Jones, G. (2008). Gluten- and casein-free diets for autistic spectrum disorder. Cochrane Database of Systematic Reviews 2008(2), Article CD003498. Retrieved September 15 2011. The Cochrane Library Database.
- Miyamoto, A., Oki, J., Takahashi, S., & Okuno, A. (1999). Serum melatonin kinetics and long-term melatonin treatment for sleep disorders in Rett syndrome. Brain Development, 21, 59-62.
- Modahl, C., Green, L., Fein, D., Morris, M., Waterhouse, L., Feinstein, C.,e.a. (1998). Plasma oxytocin levels in autistic children. Biological Psychiatry, 43, 270-277.
- Moore, M.L., Eichner, S.F., & Jones, J.R. (2004). Treating functional impairment of autism with selective serotonin-reuptake inhibitors. Annals of Pharmacotherapy, 38, 1515-1519.
- Mousain-Bosc, M., Roche, M., Polge, A., Pradal-Prat, D., Rapin, J., & Bali, J.P. (2006). Improvement of neurobehavioral disorders in children supplemented with magnesium-vitamin B6. II. pervasive developmental disorder-autism. Magnesium Research, 19, 53-62.
- Munasinghe, S.A., Oliff, C., Finn, J., & Wray, J.A. (2010). Digestive enzyme supplementation for autism spectrum disorders: A double-blind randomized controlled trial. Journal of Autism and Developmental Disorders, 40, 1131-1138.
- Mundy, P. (2003). Annotation, the neural basis of social impairments in autism: The role of the dorsal medial-frontal cortex and anterior cingulate system. Journal of Child Psychology and Psychiatry, 44, 793-809.
- Mundy, P., Delgado, C., Block, J., Venezia, M., Hogan, A., & Seibert, J. (2003). A manual for the Abridged Early Social Communication Scales (ESCS). Coral Gables, FL: University of Miami.
- Munshi, K.R., Oken, T., Guild D.J., Trivedi, H.K., Wang, B.C., Ducharme, P., e.a. (2010). The use of antiepileptic drugs (AEDs). for the treatment of pediatric aggression and mood disorders. Pharmaceuticals, 3, 2986-3004.
- Murphy, G.H., Beadle-Brown, J., Wing, L., Gould, J., Shah, A., & Holmes, N. (2005). Chronicity of challenging behaviours in people with severe intellec- tual disabilities and/or autism: a total population sample. Journal of Autism and Developmental Disorders, 35, 405-418.
- Murray, M.J. (2011). Attention-deficit/hyperactivity disorder in the context of autism spectrum disorders. Current Psychiatry Reports, 5, 382-388.
- Myers, SM. (2007). The status of pharmacotherapy for autism spectrum disorders. Expert Opinion on Pharmacotherapy, 8, 1579-603.
- Nelson, E., & Alberts, J.R. (1997). Oxytocin-induced paw sucking in infant rats. Annals of the New York Academy of Sciences, 807, 543-545.
- Neubauer, R.A., Gottlieb, S.F., & Miale, A. (1992). Identification of hypometabolic areas in the brain using brain imaging and hyperbaric oxygen. Clinical Nuclear Medicine, 17, 477-481.
- NICE. (2009a). Attention deficit hyperactivity disorder [CG72]. London: National Institute for Health and Clinical Excellence.
- NICE. (2009b). Depression: The treatment and management of depression in adults (Update). [CG90]. London: National Institute for Health and Clinical Excellence.
- NICE. (2009c). Schizophrenia (Update). [CG82]. London: National Institute for Health and Clinical Excellence.
- NICE. (2011). Generalised anxiety disorder andpanic disorder (with or without agoraphobia) in adults. [CG113]. London: National Institute for Health and Clinical Excellence.
- NICE. (2008). Attention Deficit Hyperactivity Disorder: Diagnosis and Management of ADHD in children, youngpeople and Adults. NICE clinical guideline 72, 2008. London: National Institute for Health and Clinical Excellence.
- Nicolson, R., Craven-Thuss, B., & Smith, J. (2006). A prospective, open-label trial of galantamine in autistic disorder. Journal of Child and Adolescent Psychopharmacology, 16, 621-629.
- Niesink, R.J.M., & Ree, J.M. van. (1983). Normalizing effects of an ACTH 4 9 analog (ORG 2766). on 'disturbed' social behaviour of rats: Implication of endogeneous opioid systems. Science, 221, 960-962.
- Nir, I., Meir, D., Zilber, N., Knobler, H., Hadjez, J., & Lerner, Y. (1995). Brief report: circadian melatonin, thyroid-stimulating hormone, prolactin and cortisol levels in serum of young adults with autism. Journal of Autism and Developmental Disorders, 25, 641-654.
- Nolen, W.A., Kupka, R.W., Schulte, P.F.J., Knoppert-van der Klein, E.A.M., Honig, A., Reichart, C.G., e.a.; Richtlijncommissie bipolaire stoornissen van de Commissie Kwaliteitszorg van de Nederlandse Vereniging voor Psychiatrie. (2008). Richtlijn bipolaire stoornissen (2e herz. versie). Utrecht: De Tijdstroom.
- Ottaviano, S., Giannotti, F., Cortesi, F., Bruni, O., & Ottaviano, C. (1996). Sleep characteristics in healthy children from birth to 6 years of age in the urban area of Rome. Sleep, 19, 1-3.
- Owley, T., Salt, J., Guter, S., Grieve, A., Walton, L., Avuvao, N. e.a. (2006). A prospective, open-label trial of memantine in the treatment of cognitive, behavioral, and memory dysfunction in pervasive developmental disorders. Journal of Child and Adolescent Psychopharmacology, 16, 517-524.
- Ozonoff, S., Pennington, B.F., & Rogers, S.J. (1991). Executive function deficits in high-functioning autistic individuals: relationship to theory of mind. Journal of Child Psychology and Psychiatry, 32, 1081-1105.
- Paavonen, E.J., Nieminen-von Wendt, T., Vanhala, R, Aronen, E.T., & Wendt, L. (2003). Effectiveness of melatonin in the treatment of sleep disturbances in children with Asperger disorder. Journal of Child and Adolescent Psychopharmacology, 13, 83-95.
- Palm, L., Blennow, G., & Wetterberg, L. (1997). Long-term melatonin treatment in blind children and young adults with circadian sleep-wake disturbances. Developmental Medicine and Child Neurology, 39, 319-325.
- Parikh, M.S., Kolevzon, A., & Hollander, E. (2008). Psychopharmacology of aggression in children and adolescents with autism: a critical review of efficacy and tolerability. Journal of Child and Adolescent Psychopharmacology, 18, 157-178.
- Parker, S.K., Schwartz, B., Todd, J., & Pickering, L.K. (2004). Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published data. Pediatrics, 114, 793-804.
- Patisaul, H.B., Scordalakes, E.M., Young, L.J., Rissman, E.F. (2003). Oxytocin, but not oxytocin receptor, is regulated by oestrogen receptor beta in the female mouse hypothalamus. Journal of Neuroendocrinology, 15, 787-93.
- Patzold, L.M., Richdale, A.L., & Tonge, B.J. (1998). An investigation into sleep characteristics of children with autism and Asperger's disorder. Journal of Paediatric Child Health, 34, 528-533.
- Pinto, D., Pagnamenta, A., Klei, L., Anney, R., Merico, D., Regan, R., e.a. (2010). Functional impact of global rare copy number variation in autism spectrum disorders. Nature, 466, 368-372.
- Polimeni, M.A., Richdale, A.L., & Francis, A.J. (2005). A survey of sleep problems in autism, Asperger's disorder and typically developing children. Journal of Intellectual Disability Research, 49, 260-268.
- Posey, D.J., & McDougle, C.J. (2001). Pharmacotherapeutic management of autism. Expert Opinion on Pharmacotherapy, 2, 587-600.
- Posey, D.J., Puntney, J.I., Sasher, T.M., Kem, D.L., & McDougle, C.J. (2004). Guanfacine treatment of hyperactivity and inattention in pervasive developmental disorders: a retrospective analysis of 80 cases. Journal of Child and Adolescent Psychopharmacology, 14, 233-242.
- Posey, D.J., Wiegand, R.E., Wilkerson, J., Maynard, M., Stigler, K.A., & McDougle, C.J. (2006). Open-label atomoxetine for attention-deficit/hyperactivity disorder symptoms associated with high-functioning pervasive develop- mental disorders. Journal of Child and Adolescent Psychopharmacology, 16, 599-610.
- Posey, D.J., Aman, M.G., McCracken, J.T., Scahill, L., Tierney, E., Arnold, L.E.,e.a. (2007). Positive effects of methylphenidate on inattention and hyperactivity in pervasive developmental disorders: An analysis of secondary measures. Biological Psychiatry, 61, 538-544.
- Posey, D.J., Stigler, K.A., Erickson, C.A, & McDougle, C.J. (2008). Antipsychotics in the treatment of autism. The Journal of Clinical Investigation, 118, 6-14.
- Realmuto, G.M., August, G.J., & Garfinkel, B.D. (1989). Clinical effect of buspirone in autistic children. Journal of Clinical Psychopharmacology, 9, 122-125.
- Read, S.G., & Rendall, M. (2007). An open-label study of risperidone in the improvement of quality of life and treatment of symptoms of violent and self-injurious behaviour in adults with intellectual disability. Journal of Applied Research in Intellectual Disabilities, 20, 256-264.
- Reichelt, K.L., Hole, K., Hamberfer, A, Saelid, G., Edminson, P.D., Braestrup, C.B., e.a. (1981). Biologically active peptide containing fractions in schizophrenia and childhood autism. Advances in Biochemical Psychopharmacology, 28, 627-643.
- Reisberg, B., Doody, R., Stoffler, A., Schmitt, F., Ferris, S., Möbius, H.J.; Memantine Study Group. (2003). Memantine in moderate-to-severe Alzheimer's disease. New England Journal of Medicine, 348, 1333-1341.
- Remington, G., Sloman, L., Konstantareas, M., Parker, K., & Gow, R. (2001). Clomipramine versus haloperidol in the treatment of autistic disorder: a double-blind, placebo-controlled, crossover study. Journal of Clinical Psychopharmacology, 21, 440-444.
- Rescorla, L. (1989). The Language Development Survey: A screening tool for delayed language in toddlers. Journal of Speech and Hearing Disorders, 54, 587-599.
- Research Units on Pediatric Psychopharmacology (RUPP) Autism Network (2005). Randomized, controlled, crossover trial of methylphenidate in pervasive developmental disorders with hyperactivity. Archives of General Psychiatry, 62, 1266-1274.
- Richdale, A.L., Francis, A., Gavidia-Payne, S.G., & Cotton, S. (1999). Stress, behaviour and sleep problems in children with an intellectual disability. Journal of Intellectual and Developmental Disabilities, 25, 147-161.
- Richdale, A.L., & Schreck, K.A. (2009). Sleep problems in autism spectrum disorders: prevalence, nature, and possible biopsychosocial aetiologies. Sleep Medicine Reviews, 13, 403-411.
- Ritvo, E.R., Ritvo, R., Yuwiller, A., Brothers, A., Freeman, B.J. & Plotkin, S. (1993). Elevated daytime melatonin concentrations in autism: a pilot study. European Child and Adolescent Psychiatry, 2, 75-78.
- Rossignol, D.A., & Frye, R.E. (2011). Melatonin in autism spectrum disorders: a systematic review and meta-analysis. Developmental Medicine and Child Neurology, 53, 783-792.
- Rossignol, D.A., & Rossignol, L.W. (2006). Hyperbaric oxygen therapy may improve symptoms in autistic children. Medical Hypotheses, 67, 216-228.
- Rossignol, D.A., Rossignol, L.W., James, S.J., Melnyk, S. & Mumper, E. (2007). The effects of hyperbaric oxygen therapy on oxidative stress, inflammation, and symptoms in children with autism: an open-label pilot study. BMC Pediatrics, 7, 36.
- Rossignol, D.A., Rossignol, L.W., Smith, S., Schneider, C., Logerquist, S., Usman, A. e.a. (2009). Hyperbaric treatment for children with autism: a multicenter, randomized, double-blind, controlled trial. BMC Pediatrics, 9, 21.
- Ruedrich, S., Swales, T.P., Fossaceca, C., Toliver, J., & Rutkowski, A. (1999). Effect of divalproex sodium on aggression and self-injurious behaviour in adults with intellectual disability: A retrospective review. Journal of Intellectual Disability Research, 43, 105-111.
- Rumsey, J.M., Rapoport, J.L., & Sceery, W.R. (1985). Autistic children as adults: psychiatric, social, and behavioural outcomes. Journal of the American Academy of Child Psychiatry, 24, 465-473.
- Rutter, M.L. (2011). Progress in understanding autism: 2007-2010. Journal of Autism and Developmental Disorders, 41, 395-404.
- Sack, R.L., Hughes, R.J., Edgar, D.M., & Lewy, A.J. (1997). Sleep promoting effects of melatonin: at what doses, in whom, under what conditions and by what mechanisms. Sleep, 20, 192-197.
- Saebra, M.L.V., Bignotto, M., Pinto, L., Tufik, S. (2000). Randomized double-blind clinical trial, controlled with placebo, of the toxicology of chronic melatonin treatment. Journal of Pineal Research, 29, 193-200.
- Saxena, PR. (1995). Serotonin receptors: subtypes, functional responses and therapeutic relevance. Pharmacology and Therapeutics, 66, 339-368.
- Scahill, L., McDougle, C.J., Williams, S.K., Dimitropoulos, A., Aman, M.G., McCracken, J.T., e.a. (2006). Children's Yale-Brown Obsessive Compulsive Scale modified for pervasive developmental disorders. Journal of the American Academy of Child and Adolescent Psychiatry, 45, 1114-1123.
- Schneider, L.S., Dagerman, K.S., Higgins, J.P, & McShane, R. (2011). Lack of evidence for the efficacy of memantine in mild Alzheimer disease. Archives of Neurology, 68, 991-998.
- Schopler, E., Reichler, R.J., DeVellis, R.F., & Daly, K. (1980). Toward objective classification of childhood autism: Childhood Autism Rating Scale (CARS). Journal of Autism and Developmental Disorders, 10, 91-103.
- Schothorst, P.F., Engeland, H. van, Gaag, R.J. van der, Minderaa, R.B., Stockmann, A.P.A.M. , Westermann, G.M.A., & Floor-Siebelink, H.A. (2009). Richtlijn diagnostiek en behandeling autismespectrumstoornissen bij kinderen en jeugdigen. Utrecht: De Tijdstroom.
- Shuang, M., Liu, J., Jia, M.X., Yang, J.Z., Wu, S.P, Gong, X.H., e.a. (2004). Family-based association study between autism and glutamate receptor 6 gene in Chinese Han trios. American Journal of Medical Genetics, 131B, 48-50.
- Siegel, B.V. Jr., Nuechterlein, K.H., Abel, L., Wu, J.C., & Buchsbaum, M.S.(1995). Glucose metabolic correlates of continuous test performance in adults with a history of infantile autism, schizophrenics, and controls. Schizophrenia Research, 17, 85-94.
- Simonoff, E., Pickles, A., Charman, T., Chandler, S., Loucas, T., & Baird, G. (2008). Psychiatric disorders in children with autism spectrum disorders: prevalence, comorbidity, and associated factors in a population-derived sample. Journal of the American Academy of Child and Adolescent Psychiatry, 47, 921-929.
- Singh, I., & Owino, J. E. (1992). A double-blind comparison of zuclopenithixol tablets with placebo in the treatment of mentally handicapped in-patients with associated behavioural disorders. Journal of Intellectual Disability Research, 36, 541-549.
- So, E.L. (2010). Interictal epileptiform discharges in persons without a history of seizures: what do they mean? Journal of Clinical Neurophysiology, 27, 229-38.
- Somponpun, S., & Sladek, C.D. (2002). Role of estrogen receptor-beta in regulation of vasopressin and oxytocin release in vitro. Endocrinology, 143, 2899-904.
- Sorgi, P., Ratey, J., Knoedler, D.W., Markert, R.J., Reichman, M. (1991). Rating aggression in the clinical setting, a retrospective adaptation of the overt aggression scale: preliminary results. Journal of Neuropsychiatry, 3, 52-56.
- Spreat, S., & Conroy, J. (1998). Use of psychotropic medications for persons with mental retardation who live in Oklahoma nursing homes. Psychiatric Services, 49, 510-512.
- Stahl, S.M. (2000). The new cholinesterase inhibitors for Alzheimer's disease, part 2: Illustrating their mechanisms of action. Journal of Clinical Psychiatry, 61, 813-814.
- Steele, J., Matos, L.A., Lopez, E.A., Perez-Pinzon, M.A., Prado, R., Busto, R., e.a. (2004). A phase 1 safety study of hyperbaric oxygen therapy for amyotrophic lateral sclerosis. Amyotrophic Lateral Sclerosis, 5, 250-254.
- Sterling, L., Dawson, G., Estes, A., & Greenson, J. (2008). Characteristics associated with presence of depressive symptoms in adults with autism spectrum disorder. Journal of Autism and Developmental Disorders, 38, 1011-1018.
- Sterman, M.B., & Friar, L. (1972). Suppression of seizures in an epileptic following sensorimotor EEG feedback training. Electroencephalography and Clinical Neurophysiology, 33, 89-95.
- Stewart, M.E., Barnard, L., Pearson, J., Hasan, R., & O'Brien, G. (2006). Presentation of depression in autism and Asperger syndrome: A review. Autism, 10, 103-116.
- Stigler, K.A., & McDougle, C.J. (2008). Pharmacotherapy of irritability in pervasive developmental disorders. Child and adolescent psychiatric clinics of North America, 17, 739-52, vii-viii.
- Stoller, K.P. (2005). Quantification of neurocognitive changes before, during, and after hyperbaric oxygen therapy in a case of fetal alcohol syndrome. Pediat- rics, 116, 586-91.
- Stuss, D., & Knight, R. (2002). Principles of frontal lobe function. Oxford University Press.
- Suarez, G.A., Opfer-Gehrking, T.L., Offord, K.P., Atkinson, E.J., O'Brien, P.C., & Low, P.A. (1999). The Autonomic Symptom Profile: A new instrument to assess autonomic symptoms. Neurology, 52, 523-528.
- Sullivan, P.F., Neale, M.C., & Kendler, K.S. (2000). Genetic epidemiology of major depression: Review and meta-analysis. American Journal of Psychiatry, 157, 1552-1562.
- Tani, P., Lindberg, N., Nieminen-von Wendt, T., Wendt, L. von, Alanko, L, Appelberg, B. e.a. (2003). Insomnia is a frequent finding in adults with Asperger syndrome. BMC Psychiatry, 3, 12.
- Tantam, D. (2000). Psychological disorder in adolescents and adults with Asperger syndrome. Autism, 4, 47-62.
- Theoharides, T.C., Kempuraj, D., & Redwood, L. (2009). Autism: an emerging 'neuroimmune disorder' in search of therapy. Expert Opin Pharmacother, 10, 2127-2143.
- Thirumalai, S.S., Shubin, R.A., & Robinson, R. (2002). Rapid eye movement sleep behaviour disorder in children with autism. Journal of Child Neurology, 17, 173-178.
- Toma, C., Rossi, M., Sousa, I., Blasi, F., Bacchelli, E., Alen, R. e.a. (2007). Is ASMT a susceptibility gene for autism spectrum disorders? A replication study in European populations. Molecular Psychiatry, 12, 977-979.
- Tordjman, S., Anderson, G.M., Pichard, N., Charbuy, H., & Touitou, Y. (2005). Nocturnal excretion of 6-sulphatoxymelatonin in children and adolescents with autistic disorder. Journal of Biological Psychiatry, 57, 134-138.
- Tsakanikos, E., Sturmey, P, Costello, H., Holt, G., & Bouras, N. (2007). Referral trends in mental health services for adults with intellectual disability and autism spectrum disorders. Autism, 11, 9-17.
- Tulassay, Z., Bodnar, A., Farkas, I., Papp, J. & Gupta, R. (1992). Somatostatin versus secretin in the treatment of actively bleeding gastric erosions. Digestion, 51, 211-216.
- Tyrer, P., Oliver-Africano, PC., Ahmed, Z., Bouras, N., Cooray, S., Deb, S. e.a. (2008). Risperidone, haloperidol, and placebo in the treatment of aggressive challenging behaviour in patients with intellectual disability: A randomised controlled trial. The Lancet, 371, 57-63.
- Versteeg, D.H.G. (1980). Interaction of peptides related to ACTH, MSH and p-LPH with neurotransmitters in the brain. Pharmacology and Therapeu- tics, 11, 535-557.
- Vickerstaff, S., Heriot, S., Wong, M., Lopes, A., & Dossetor, D. (2007). Intellectual ability, self-perceived social competence, and depressive symptomatology in children with high-functioning autistic spectrum disorders. Journal of Autism and Developmental Disorders, 37, 1647-1664.
- Volkow, N.D., Wang, G.J., Fowler, J.S., Gatley, S.J., Logan, J., Ding, Y.S., e.a. (1998). Dopamine transporter occupancies in the human brain induced by therapeutic doses of oral methylphenidate. American Journal of Psychiatry, 155, 1325-1331.
- Walters, A.S. (1995). Toward a better definition of the restless legs syndrome. Movement Disorders, 10, 634-642.
- Watanabe, Y., Tsumura, H., & Sasaki, H. (1991). Effect of continuous intravenous infusion of secretin preparation (secrepan). in patients with hemorrhage from chronic peptic ulcer and acute gastric mucosal lesion (AGML). Gastroenterology Japan, 26, 86-89.
- Wheeler, B., Taylor, B., Simonsen, K., & Reith, D.M. (2005). Melatonin treatment in Smith-Magenis syndrome. Sleep, 28, 1609-1610.
- White, J.F. (2003). Intestinal psychopathology in autism. Experimental Biology and Medicine, 228, 639-649.
- Wied, D. de, Diamant, M., & Fodor, M. (1993). Central nervous system effects of the neurohypophyseal hormones and related peptides. Frontiers in Neuro-endocrinology, 14, 251-302.
- Wilder, R.M. (1921). The effects of ketonemia on the course of epilepsy. Mayo Clinic Proceedings, 2, 307-308.
- Williams, K., Wheeler, D.M., Silove, N., & Hazell, P. (2010). Selective serotonin reuptake inhibitors (SSRIs) for autism spectrum disorders (ASD). Cochrane Database of Systematic Reviews, 2010(8), Article CD004677. Retrieved September 15, 2011. The Cochrane Library Database.
- Wink, L.K., Plawecki, M.H., Erickson, C.A., Stigler, K.A., & McDougle, C.J. (2010). Emerging drugs for the treatment of symptoms associated with autism spectrum disorders. Expert opinion on emerging drugs, 15, 481-494.
- Yoo, J.H., Valdovinos, M.G., & Williams, D.C. (2007). Relevance of donepezil in enhancing learning and memory in special populations: a review of the literature. Journal of Autism and Developmental Disorders, 37, 1883-1901.
- Yudofsky, S. C., Silver, J. M., Jackson,W., Endicott, J., & Williams, D. (1986). The overt aggression scale for the objective rating of verbal and physical aggression. American Journal of Psychiatry, 143, 35-39.
- Zhdanova, I.V., Wurtman, R.J., & Wagstaff, J. (1999). Effects of a low dose of melatonin on sleep in children with Angelman syndrome. Journal of Pediatrie Endocrinology and Metabolism, 12, 57-67.
- Zimmerman, I.L., Steiner, V.G., & Pond, R.E. (1992). PLS-3: Preschool Language Scale-3. San Antonio, TX: The Psychological Corporation.
Evidence tabellen
Tabel 5.3 Samenvatting onderzoekskenmerken van geïncludeerde placebogecontroleerde studies naar antipsychotica voor gedragsmanagement bij volwassenen met ASS
|
|
Risperidone |
|
Haloperidol |
|
Study |
Hellings, 2006 |
McDougle e.a., 1998b |
Remington, 2001 |
|
No. trials (total participants) |
2 RCTs (71) |
|
1 RCT (36) |
|
N/% female |
17/43 |
9/29 |
6/17 |
|
Mean age |
22 |
28 |
16 |
|
IQ |
Not reported (27,5% mild ID, 22,5% moderate ID, 27,5% severe ID, & 22,5% profound ID) |
Gemiddeld 54,6 |
Not reported |
|
Axis I/II disorders |
90% autism (70% autistic disorder; 20% PDD-NOS); 100% ID |
100% autism (55% autistic disorder;45% PDD-NOS) |
100% autism |
|
Dose |
1mg/day for children and adolescents; 2mg/day for adults |
mean dose 2,9 m day |
ig/final dose 1-1,5mg/ day |
|
Comparator |
Placebo |
Placebo |
Placebo |
|
Length of treatment |
3-5 weeks per intervention |
12 weeks |
6 weeks per intervention |
|
Length of follow-up |
22 weeks (open-label continuation) |
24 weeks (open- 21 weeks label continuation) |
|
ID: intellectual disability
Tabel 5.4 Samenvatting onderzoekskenmerken van geïncludeerde open-labelobservatieonderzoeken naar antipsychotica voor gedragsmanagement bij volwassenen met een verstandelijke beperking.
|
|
Olanzapine |
Risperidone |
|
Studys |
Handen, 2006* |
Read, 2007" |
|
No. trials (total participants) |
1 Observational (16) |
1 Observational (24) |
|
N/% female |
6/38 |
5/21 |
|
Mean age |
15 |
27 |
|
IQ |
36-79 (mean 55) |
Not reported (75% with severe or profound ID) |
|
Axis I/II disorders |
100% disruptive behaviour |
33% autism, 54% epilepsy, 46% |
|
|
disorders (DBD; ADHD; ODD; |
organic behaviour disorder; |
|
|
CD); 100% ID |
100% ID |
|
Dose |
2,5-20 mg/day (mean dose 13,7 |
final dose 0,5-6 mg/day (mean |
|
|
mg/day) |
final dose 2,92 mg/day) |
|
Comparator |
No comparator |
No comparator |
|
Length of treatment |
8 weeks |
4-103 days (mean duration of treatment: 76,4 days) |
|
Length of follow-up |
8 weeks |
Mean follow-up 76,4 days |
* Efficacy data not extractable
CD: conduct disorder; ID: intellectual disability; ODD: oppositional defiant disorder
Tabel 5.5 Samenvatting onderzoekskenmerken van geïncludeerde placebogecontroleerde en door alternatieve medicatie gecontroleerde onderzoeken naar antipsychotica voor gedragsmanagement bij volwassenen met een verstandelijke beperking
|
|
Risperidone |
Risperidone or haloperidol |
Zuclopenthixol |
Prothipendyl |
Pipamperone |
Cis(z)-clopenthixol |
||
|
No. trials (total participants) |
2 ECTs (114) |
1 ECT (86) |
3 ECTs (204) |
1 ECT (40) |
1 ECT (20) |
1 ECT (100) |
||
|
Study |
(1) Gagiano e.a., 2005 (2) Vanden Borre e.a., 1993“ |
Tyrer, 2008“ |
(1) Haessler e.a., 2007 (2) Izmethl988 (3) Singh & Owino, 1992 |
McKenzie & Roswell-Harris, 1966 |
Vanhemert, 1975“ Karsten, 1981 |
|||
|
N/% female |
(1) 30/39 (2) Not reported |
33/38 |
(1) Not reported (2) 45/40 (3) 24/46 |
20/50 |
20/100 |
44/44 |
||
|
Mean age |
(1) Not reported (18-59) (2) 31 |
co CO co |
(1) Not reported (18-50) (2) 30-32 (3) 34-38 |
21-26 |
33 (median) |
25-27 |
||
|
IQ |
(1) 35-83 (mean not reported) (2) Not reported (severe or profound ID) |
Not reported (1% borderline ID; 35% mild ID; 48% moderate ID; 16% severe/profound ID) |
(1) 30-70 (mean not reported) (2) 20-80 (means 48 & 51) (3) Not reported (2% mild ID; 33% moderate ID; 65% severe ID) |
19-58 (means 25 & 34) |
Not reported (45% Not reported moderate ID; 50% severe ID; and 5% profound ID) |
|||
|
Axis I/II disorders |
(1) 100% disruptive behaviour disorder (ASPD; CD; DBD; IED; ODD); 100% ID (2) 100% ID |
16% autism; 100% ID |
(1) 100% ID (2) 21% psychiatrie disorder, 26% epilepsy; 100% ID (3) 40% physical disorders, 29% epilepsy, 17% psychiatrie disorders; 100% ID |
100% ID |
100% ID |
100% ID |
||
|
Dose |
(1) l-4mg/day (mean dose l,45mg/day) (2) 4-12mg/day (mean final dose 8,3mg/day) |
Risperidone: lmg- 2mg/day haloperidol: 2.5mg'5mg/day |
(1) 2-20mg/day (mean 11.4mg/day) (2) 119mg/week (intramuscular injection) (3) 10-150mg/day (modal dose 20mg/day) |
80mg (1 tablet) - 320mg (4 tablets) 6-hourly |
40-80mg/day |
cis(z) -clopenthixol: available as 5 & 25mg tablets haloperidol: available as 1 & 4mg tablets |
||
|
Comparator |
(1) Placebo (2) Placebo |
Risperidone, haloperidol, or placebo |
(1) Placebo (2) Placebo (3) Placebo |
Placebo |
Placebo |
Haloperidol |
||
|
Length of treatment |
(1) 4 weeks (2) 3 weeks per intervention |
12 weeks |
(1) Up to 12 weeks (discontinuation period) (2) 12 weeks (3) 12 weeks |
16 weeks |
3 weeks per intervention |
12 weeks |
||
|
Length of follow-up |
(1) 52 weeks (open-label continuation) (2) 8 weeks |
26 weeks (optional continuation) |
(1) 18 weeks (6 week open-label phase followed by discontinuation) (2) 12 weeks (3) 18 weeks (open-label continuation) |
16 weeks |
4 months (open- label continuation) |
12 weeks |
||
Tabel 5.6 Samenvatting bewijsprofiel voor risperidon versus placebo bij volwassenen met een ASS
|
Outcome |
Challenging behaviour (irritability & aggression) |
Autistic core symptom: repetitive behaviour |
Autistic behaviours |
Symptom severity/ improvement |
|
Study |
Hellings e.a., 2006; McDougle e.a., 1998b |
McDougle e.a., 1998b |
McDougle e.a., 1998b |
McDougle e.a., 1998b |
|
Effect size |
SMD = -0,79 (-1,29-0,28) |
SMD = -0,94 (-1,68-0,19) |
SMD = -0,72 (-1,45-0,01) |
SMD = -1,40 (-2,18-0,61) |
|
Quality of evidence (GRADE) |
Moderate1 |
Moderate1 |
Moderate1 |
Moderate1 |
|
Number of studies/ participants for analysis |
(K = 2; N = 66) |
(K = 1; N = 31) |
(K = 1; N = 31) |
(K = 1; N = 31) |
|
Forest plot |
Biomedical |
Biomedical |
Biomedical |
Biomedical |
Downgraded for imprecision as sample size is small
GRADE: Grading of Recommendations Assessment, Development and Evaluation; SMD: standardised mean difference
Tabel 5.7 Samenvatting bewijsprofiel voor risperidon versus placebo bij volwassenen met een verstandelijke beperking
|
Outcome |
Challenging behaviour |
Aggression |
Symptom severity/ improvement |
Quality of life |
|
Study |
Tyrer e.a., 2008 |
Tyrer E.A., 2008 Gagiano e.a., 2005; Tyrer e.a., 2008 |
Tyrer e.a, 2008 |
|
|
Effect size |
MD = -4,77 (-18,38, 8,84) |
MD = 0,58 (-4,90, 6,06) |
SMD = -0,30 (-0,64, 0,04) |
MD = 2,88 (-2,56, 8,32) |
|
Quality of evidence (GRADE) |
Low1,2 |
Low1,2 |
Very low1,2,3,4 |
Low1,2 |
|
Number of studies/ participants |
(K=1; N=58) |
(K=1; N=58) |
(K=2; N=132) |
(K=1; N=58) |
|
Forest plot |
Biomedical |
Biomedical |
Biomedical |
Biomedical |
1 Data is skewed in Tyrer e.a. (2008) and medians and interquartile ranges were reported. However, means and standard deviation values were requested in order to be entered into meta-analysis and extract efficacy data. However, because data is skewed this analysis is flawed
2 Downgraded for indirectness as extrapolating from adults with intellectual disability
3 Downgraded for indirectness as in Gagiano e.a. (2005) adults with intellectual disability also had coexisting psychiatric conditions including conduct disorder, disruptive behav- iour disorder, intermittent explosive disorder, oppositional defiant disorder, and antisocial personality disorder
4 Downgraded for inconsistency as Gagiano e.a. (2005) found significant differences whereas Tyrer e.a. (2008) did not
GRADE: Grading of Recommendations Assessment, Development and Evaluation; SMD: standardised mean difference
Tabel 5.8 Samenvatting bewijsprofiel voor haloperidol versus placebo bij volwassenen met ASS
|
Outcome |
Autistic behaviours |
Side effects (global) |
|
Study |
Remington e.a., 2001 |
Remington e.a., 2001 |
|
Effect size |
MD = -2,70 (-7,19, 1,79) |
MD = 1,50 (-0,28, 3,28) |
|
Quality of evidence (GRADE) |
Very low1,2,3 |
Very low1,2,3 |
|
Number of studies/participants |
(K = 1; N = 33) |
(K = 1; N = 33) |
|
Forest plot |
Biomedical |
Biomedical |
GRADE: Grading of Recommendations Assessment, Development and Evaluation
1 Downgraded for risk of bias as high risk of attrition bias due to higher dropout as a consequence of side effects in the haloperidol group
2 Downgraded for indirectness as this was an adolescent sample with autism
3 Downgraded for imprecision as sample size is small
Tabel 5.9 Samenvatting bewijsprofiel voor haloperidol versus placebo bij volwassenen met een verstandelijke beperking
|
Outcome |
Challenging behaviour |
Aggression |
Symptom severity/ improvement |
Quality of life |
|
Study |
Tyrer e.a., 2008 |
Tyrer e.a., 2008 |
Tyrer e.a., 2008 |
Tyrer e.a., 2008 |
|
Effect size |
MD = -4,30 (-19,30, 10,70) |
MD = -4,12 (-8,53, 0,29) |
MD = -0,88 (-1,57, -0,19) |
MD = -1,87 (-7,38, 3,64) |
|
Quality of evidence Low1,2 (GRADE) |
Low1,2 |
Low1,2 |
Low1,2 |
|
|
Number of studies/ (K = 1; N = 57) participants |
(K = 1; N = 57) |
(K = 1; N = 57) |
(K = 1; N = 57) |
|
|
Forest plot |
Biomedical |
Biomedical |
Biomedical |
Biomedical |
1 Data is skewed in Tyrer e.a. (2008) and medians and interquartile ranges were reported. However, means and standard deviation values were requested in order to be entered into meta-analysis and extract efficacy data. However, because data is skewed this analysis is flawed
2 Downgraded for indirectness as extrapolating from adults with intellectual disability
GRADE: Grading of Recommendations Assessment, Development and Evaluation
Tabel 5.10 Samenvatting bewijsprofiel voor zuclopenthixol versus placebo bij volwassenen met een verstandelijke beperking
|
Outcome |
Challenging |
Challenging |
Symptom |
Symptom |
|
|
behaviour: |
behaviour: |
severity/ |
severity/ |
|
|
aggression |
irritability |
improvement |
improvement |
|
|
(endpoint data) |
(change from |
(endpoint |
(change from |
|
|
|
baseline) |
comparison) |
baseline) |
|
Study |
Haessler e.a., |
Izmeth, 1988 |
Singh & Owino, |
Izmeth, 1988 |
|
|
2007 |
|
1992 |
|
|
Effect size |
RR = 7,37 (1,00, |
MD = -2,20 |
RR = 3,96 (0,50, |
MD = 0,70 (0,25, |
|
|
54,39) |
(-3,86-0,54) |
31,09) |
1,15) |
|
Quality of evidence Low1, 2 |
Very low1,3,4 |
Very low1,2,3,4 |
Very low1,3,4 |
|
|
(GRADE) |
|
|
|
|
|
Number of studies/ (K = 1; N = 39) |
(K = 1; N = 85) |
(K = 1; N = 43) |
(K = 1; N = 85) |
|
|
participants |
|
|
|
|
|
Forest plot |
Biomedical |
Biomedical |
Biomedical |
Biomedical |
* [irritability: zie hoofdstuk 2, paragraaf 7]
1 Downgraded for indirectness as extrapolating from adults with intellectual disability
2 Downgraded for imprecision as sample size is small
3 Downgraded for risk of bias as high risk of attrition bias because of greater dropout rate in placebo group
4 Downgraded for indirectness as the study is very old
GRADE: Grading of Recommendations Assessment, Development and Evaluation; MD: mean difference; RR: risk ratio [relatieve risico]
Tabel 5.11 Samenvatting bewijsprofiel voor prothipendyl versus placebo bij volwassenen met een verstandelijke beperking
|
Outcome |
Symptom severity/improvement |
|
Study |
McKenzie & Roswell-Harris, 1966 |
|
Effect size |
RR = 1,69 (1,00, 2,85) |
|
Quality of evidence (GRADE) |
Very low1,2,3,4 |
|
Number of studies/participants |
(K = 1; N = 39) |
|
Forest plot |
Biomedical |
1 Downgraded for risk of bias as high risk of selection bias due to pre-trial group differences in IQ
2 Downgraded for indirectness as extrapolating from adults with intellectual disability
3 Downgraded for indirectness as the study is very old
4 Downgraded for imprecision as the sample size is small
GRADE: Grading of Recommendations Assessment, Development and Evaluation; RR: risk ratio [relatieve risico]
Tabel 5.12 Samenvatting bewijsprofiel voor cis (z)-clopenthixol versus haloperidol bij volwassenen met een verstandelijke beperking
|
Outcome |
Symptom severity/ improvement Side effects |
|
|
Study |
Karsten, 1981 |
Karsten, 1981 |
|
Effect size |
RR = 3,43 (1,63, 7,21) |
RR = 0,85 (0,66, 1,08) |
|
Quality of evidence (GRADE) |
Low1,2 |
Low1,2 |
|
Number of studies/participants |
(K = 1; N = 98) |
(K = 1; N = 98) |
|
Forest plot |
Biomedical |
Biomedical |
1 Downgraded for indirectness as extrapolating from adults with intellectual disability
2 Downgraded for indirectness as the study is very old
GRADE: Grading of Recommendations Assessment, Development and Evaluation; RR: risk ratio [relatieve risico]
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-02-2013
Uiterlijk in 2019 bepaalt de Landelijk Samenwerkingsverband Kwaliteit Standaarden (LSPS) in samenspraak met de betrokken partijen of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen wanneer nieuwe ontwikkelingen aanleiding geven een vervroegd herzieningstraject te starten.
Algemene gegevens
Deze richtlijn is een initiatief van de Nederlandse Vereniging voor Psychiatrie en het Nederlands Instituut van Psychologen (NIP). De ontwikkeling werd gefinancierd vanuit het gealloceerde budget van de NVvP van de stichting Kwaliteitsgelden medisch specialisten (SKMS) en is methodologisch en organisatorisch ondersteund door het Trimbos-instituut.
Doel en doelgroep
Doel
Deze richtlijn is ontwikkeld als hulpmiddel. De richtlijn geeft aanbevelingen en handelingsinstructies voor de herkenning, diagnostiek en behandeling (behandeling in engere zin, dus uitsluitend behandeling, niet begeleiding) van volwassenen met autismespectrumstoornissen. De richtlijn geeft aanbevelingen ter ondersteuning van de praktijkvoering van alle professionals die betrokken zijn bij de zorg voor volwassenen met een autismespectrumstoornis (ASS). Op basis van de resultaten van wetenschappelijk onderzoek en overige overwegingen geeft de richtlijn een overzicht van goed (‘optimaal') handelen als waarborg voor kwalitatief hoogwaardige zorg. De richtlijn kan tevens richting geven aan de onderzoeksagenda voor wetenschappelijk onderzoek naar autismespectrumstoornissen.
Deze richtlijn heeft tot doel een leidraad te geven voor diagnostiek en behandeling van volwassenen met een ASS. Er is een multidisciplinaire ontwikkelprocedure gehanteerd om te zorgen voor een positief effect op de multidisciplinaire samenwerking in de dagelijkse praktijk. Daarnaast moet de richtlijn gezien worden als een moederrichtlijn: een vertaling kan plaatsvinden naar monodisciplinaire richtlijnen van afzonderlijke beroepsgroepen, waarin die beroepsgroepen aanknopingspunten kunnen vinden voor lokale zorgprogramma's en protocollen. Het opstellen van lokale zorgprogramma's en protocollen op basis van deze richtlijn moedigt de werkgroep aan, omdat dat bevorderlijk is voor de implementatie van de in de richtlijn beschreven optimale zorg.
Het kan zijn dat de aanbevelingen uit deze richtlijn in de concrete situatie niet aansluiten bij de wensen of behoeften van de persoon met een ASS. In dat geval moet het in principe mogelijk zijn beredeneerd af te wijken van de richtlijn, tenzij de wensen of behoeften van de persoon met een ass naar de mening van de behandelaar hem of haar kunnen schaden, dan wel geen nut hebben.
Doelgroep
De primaire doelgroep van deze richtlijn bestaat uit volwassenen en adolescenten vanaf 18 jaar waarbij sprake is van (een vermoeden van) een ASS. In de afbakening van de werkgroep valt ook de groep ouderen binnen de groep volwassenen. De groep ouderen wordt gedefinieerd als de groep mensen die 55 jaar of ouder zijn. Hierbij is gekeken naar de volgende autismespectrumstoornissen: autistische stoornis, stoornis van Asperger, en pervasieve ontwikkelingsstoornis niet anderszins omschreven.
Samenstelling werkgroep
De ‘richtlijnwerkgroep Autismespectrumstoornissen bij volwassenen’, onder voorzitterschap van dr. Cees C. Kan en vice-voorzitterschap van prof.dr. Hilde M. Geurts, bestond uit psychiaters, psychologen, verpleegkundigen’ belangenbehartigers’ en ervaringsdeskundigen die door de beroepsverenigingen werden uitgenodigd en zich op persoonlijke titel aan het project verbonden. De richtlijnwerkgroep bestond uit een kerngroep, een klankbordgroep en een adviseur. De richtlijnwerkgroep werd methodologisch en organisatorisch ondersteund door het technische team van het Trimbos-instituut.
Leden kerngroep
|
|
Naam |
Organisatie |
Functie |
|
1. |
Cornelis C. Kan, voorzitter |
Radboud Universiteit Nijmegen en CASS 18+ |
Psychiater |
|
2. |
Hilde M. Geurts, vice voorzitter |
Universiteit van Amsterdam en Dr. Leo Kannerhuis |
Psycholoog |
|
3. |
Bram B. Sizoo |
Dimence, Overijssel |
Psychiater |
|
4. |
Wim J.C. Verbeeck |
Vincent van Gogh Instituut, Centrum voor Autisme en ADHD, Venray |
Psychiater |
|
5. |
Caroline H. Schuurman |
Centrum autisme Rivierduinen, Leiden. |
Psycholoog |
|
6. |
Etienne J.M. Forceville |
Centrum Autisme, G GZ-Noord-Holland- Noord |
Psycholoog |
|
7. |
Dietske Vrijmoed |
GGz Delfland |
Verpleegkundige |
|
8. |
Evelien Veldboom |
GGNet |
Verpleegkundige |
|
9. |
Fred Stekelenburg |
Nederlandse Vereniging voor Autisme (NVA) |
Directeur NVA |
|
10. |
Jannie van Manen |
Nederlandse Vereniging voor Autisme (NVA) |
Vertegenwoordiger perspectief naasten |
|
11. |
Karin van den Bosch |
Vereniging voor Personen uit het Autisme Spectrum (PAS) |
Vertegenwoordiger perspectief van de normaal begaafde volwassenen met ASS |
Leden klankbordgroep
|
|
Naam |
Organisatie |
Functie |
|
1. |
Arnold A.J. Bartels |
Dr. Leo Kannerhuis; Forensisch Psycholoog Psychiatrisch Centrum (FPC) Dr. S. van Mesdag |
|
|
2. |
Jiska Bootsma |
Centrum Autisme Rivierduinen, Leiden |
Psycholoog |
|
3. |
Michiel Hengeveld |
Erasmus MC |
Emeritus psychiater |
|
4. |
Ernst H. Horwitz |
Universitair Medisch Centrum Groningen (UMCG) |
Psychiater |
|
5. |
Adele Jeuken |
De Waag |
Psychiater |
|
6. |
Annemiek Koster |
Nederlandse Vereniging voor Autisme (NVA) |
Vertegenwoordiger perspectief van de volwassenen met ASS |
|
7. |
Jos Mensink |
Dr. Leo Kannerhuis |
Verpleegkundige |
|
8. |
Ankie M.M. van der Reijken |
Centrum autisme, Leiden |
Psychiater |
|
9. |
Annelies A. Spek |
GGz Eindhoven |
Psycholoog |
|
10. |
Jan Pieter Teunisse |
Dr. Leo Kannerhuis |
Psycholoog |
Adviseur
|
Naam |
Organisatie |
Functie |
|
Tineke Korswagen |
Centrum Autisme, Leiden |
Advsieur richtlijnwerkgroep, ingeroepen om advies te geven over Supported Employment bij austisme en de KIRA-methode |
Methodologische ondersteuning
Het technische team van het Trimbos-instituut gaf methodologische en organisatorische ondersteuning.
|
|
Naam |
Ondersteuning |
|
1. |
Danielle van Duin |
Projectleider en richtlijnadviseur, Trimbos-instituut |
|
2. |
Annemiek van den Bosch |
Verslaglegging en reviewer, Trimbos-instituut |
|
3. |
Marleen Hermens |
Reviewer, Trimbos-instituut |
|
4. |
Angita Peters |
Informatiespecialist, Trimbos-instituut |
|
5. |
M.C. Majo (Cristina) |
Health economist, Trimbos-instituut |
|
6. |
Laura Shields |
Reviewer, Trimbos-instituut en NICE |
|
7. |
Nelleke van Zon |
Projectassistent, Trimbos-instituut |
Belangenverklaringen
Toelichting vanuit NICE
|
To minimise and manage any potential conflicts of interest, and to avoid any public concern that commercial or other financial interests have affected the work of the GDG and influenced guidance, members of the GDG must declare as a matter of public record any interests held by themselves or their families which fall under specified categories (see below). These categories include any relationships they have with the healthcare industries, professional organisations and organisations for people with autism and their families/carers. |
|
Individuals invited to join the GDG were asked to declare their interests before being appointed. To allow the management of any potential conflicts of interest that might arise during the development of the guideline, GDG members were also asked to declare their interests at each GDG meeting throughout the guideline development process. The interests of all the members of the GDG are listed below, including interests declared prior to appointment and during the guideline development process. |
GDG: Guideline Development Group
Categorieën die van belang zijn
|
Paid employment |
|
|
Personal pecuniary interest |
Financial payments or other benefits from either the manufacturer or the owner of the product or service under consideration in this guideline, or the industry or sector from which the product or service comes. This includes holding a directorship, or other paid position; carrying out consultancy or fee paid work; having shareholdings or other beneficial interests; receiving expenses and hospitality over and above what would be reasonably expected to attend meetings and conferences. |
|
Personal family interest |
Financial payments or other benefits from the healthcare industry that were received by a member of your family. |
|
Non-personal pecuniary interest |
Financial payments or other benefits received by the GDG member's organisation or department, but where the GDG member has not personally received payment, including fellowships and other support provided by the healthcare industry. This includes a grant or fellowship or other payment to sponsor a post, or contribute to the running costs of the department; commissioning of research or other work; contracts with, or grants from, NICE. |
|
Personal |
These include, but are not limited to, clear opinions or |
|
non-pecuniary interest |
public statements you have made about individuals with psychosis and substance misuse problems, holding office in a professional organisation or advocacy group with a direct interest in psychosis and substance misuse, other reputational risks relevant to psychosis and substance misuse. |
1) We are using the term ‘autistic spectrum conditions' rather than ‘autistic spectrum disorders' because this is the terminology more recently used in the Department of Health's Autism Strategy, and is preferred by many (but not all) adults on the autistic spectrum.
Inbreng patiëntenperspectief
De ontwikkeling van de multidisciplinaire richtlijnen voor de GGZ geschiedt primair vanuit een inhoudelijke invalshoek voor kwaliteitsverbetering in de zorgverlening. De gebruikers van de richtlijn zijn allen professioneel betrokken bij de zorg voor volwassenen bij er sprake is van (een vermoeden van) autisme. In de werkgroep waren ook patiënten- en familieverenigingen vertegenwoordigd. Daarmee heeft het perspectief van de volwassene met een ASS en diens familie in de richtlijn een plaats gekregen en kunnen ook niet-professionele zorgverleners en/of belangenverenigingen de richtlijn gebruiken.
Methode ontwikkeling
Evidence based
Implementatie
Recent onderzoek laat zien dat er bij richtlijntrajecten voornamelijk aandacht is voor de ontwikkeling van de richtlijn. Planmatig opgezette en onderbouwde invoering komt maar heel beperkt van de grond. Financiers dienen gericht op die invoering aan te sturen, zodat daarvoor al bij de start geld beschikbaar is. De Regieraad voor richtlijntrajecten onderschrijft dan ook een programmatische aanpak van zowel ontwikkeling als invoering en evaluatie van richtlijnen - inclusief (financiële en organisatorische) middelen om het gebruik van de richtlijnen te stimuleren, te monitoren en te evalueren. TNO, CBO en het Trimbos-instituut besloten deze opdracht samen uit te voeren, met als doel de complementaire inzichten en expertise te vertalen in een gemeenschappelijke visie op richtlijnen. Dit resulteerde in een praktisch instrument voor een analyse van richtlijntrajecten: Kwaliteit Richtlijnontwikkeling, Invoering en Evaluatie (KRIE).
Werkwijze
Uitgangsvragen
Deze richtlijn is ontwikkeld aan de hand van uitgangsvragen volgens de knelpunten die men ervaart bij diagnostiek en behandeling van volwassenen met een ass. Deze uitgangsvragen zijn vastgesteld door het National Institute for Health and Care Excellence (NICE), op basis van een knelpuntenanalyse die is uitgevoerd in Groot-Brittannië. Om nauwe samenwerking met nice mogelijk te maken, heeft de Nederlandse richtlijnwerkgroep een deel van deze uitgangsvragen overgenomen voor de huidige richtlijn. De Nederlandse werkgroep heeft één eigen uitgangsvragen geformuleerd over neurofeedback.
Een richtlijn is geen leerboek waarin zo veel mogelijk beschikbare kennis over een onderwerp wordt opgenomen, maar een document met praktische aanbevelingen voor knelpunten uit de praktijk. Dat betekent dat praktijkproblemen zo veel als mogelijk uitgangspunt zijn van de teksten in de richtlijn. Dat betekent ook dat méér aandacht is voor de wijze waarop die praktijkproblemen worden opgelost, dan aan de vraag wie (welke beroepsgroep) die problemen moet aanpakken of oplossen. De richtlijn is een document waarin staat hoe in inhoudelijk opzicht optimale diagnostiek en behandeling eruitzien. Deze richtlijn behandelt de klinische ‘uitgangsvragen' in de verschillende modules.
Werkgroep en werkwijze
De richtlijn is ontwikkeld door de richtlijnwerkgroep Autismespectrumstoornissen bij volwassenen, in opdracht van de Nederlandse Vereniging voor Psychiatrie (NVvP) en het Nederlands Instituut van Psychologen (NIP). De richtlijnwerkgroep, onder voorzitterschap van dr. Cornelis (Cees) C. Kan en vice-voorzitterschap van prof. dr. Hilde M. Geurts, bestond uit psychiaters, psychologen, verpleegkundigen, belangenbehartigers, en ervaringsdeskundigen, die door de beroepsverenigingen werden uitgenodigd en op persoonlijke titel aan het project verbonden waren.
Voorafgaande aan het ontwikkeltraject werden kennismakingsgesprekken gevoerd met verscheidene kandidaatleden voor de werkgroep. Uit deze groep belangstellenden werden de huidige werkgroepleden geselecteerd.
Naast de richtlijnwerkgroep is een klankbordgroep samengesteld die werd gevraagd voorafgaand aan de commentaarfase schriftelijk te reageren op de conceptteksten. Leden van de klankbordgroep kon tevens worden gevraagd om tijdens een werkgroepbijeenkomst mee te denken over een specifieke uitgangsvraag.
De richtlijnwerkgroep werd methodologisch en organisatorisch ondersteund door het technische team van het Trimbos-instituut. Dit technische team bestond uit een projectleider, een informatiespecialist, twee literatuurreviewers, een health economist, een notulist en een projectassistent. Zie ook aanverwant 'Geraadpleegde onderzoekers voor ongepubliceerde data of onderzoeken'.
Werkwijze
In totaal kwam de richtlijnwerkgroep voorafgaand aan de commentaarfase acht keer bijeen in een periode van twaalf maanden (januari 2011 tot en met december 2011). In deze periode doorliep de werkgroep, in samenwerking met NICE, de stappen van de methodiek voor evidence-based richtlijnontwikkeling (EBRO). De informatiespecialisten van NICE verrichtten in overleg met de werkgroepleden op systematische wijze literatuuronderzoek en maakten een selectie in de gevonden onderzoeken.
De reviewers van NICE en het Trimbos-instituut beoordeelden de kwaliteit en inhoud van de aldus verkregen literatuur en verwerkten deze in evidencetabellen, in beschrijvingen van de wetenschappelijke onderbouwing en in wetenschappelijke (gewogen) conclusies. De reviewers van NICE namen hierin voor de meeste onderwerpen het voortouw, de reviewers van het Trimbos-instituut bestudeerden de gegevens, presenteerden deze aan de
Nederlandse richtlijnwerkgroep en beantwoorden (in overleg met het technische team van NICE) zo veel mogelijk vragen. Voor drie onderwerpen (cognitieve gedragstherapie, antidepressiva, EEG-neurofeedback) was de rolverdeling omgedraaid. Leden van de richtlijnwerkgroep gingen op basis van de gevonden literatuur met elkaar in discussie over overige overwegingen en aanbevelingen.
Van een beperkt aantal onderwerpen die de Nederlandse werkgroep niet zelf behandelde, werd besloten om de resultaten van de Engelse NICE-werkgroep over te nemen. Dit ging om de onderwerpen: facilitated communication; inzetten van (informatie- en communicatie-) technologie; anxiolytica; restrictieve diëten, vitaminen, mineralen en supplementen; chelatietherapie; hyperbare-zuurstoftherapie; testosteronregulatie; ondersteuning aan families en naasten.
De werkgroepleden schreven samen met het technische team van het Trimbos-instituut de conceptrichtlijntekst, die ter becommentariëring openbaar is gemaakt. De ontvangen commentaren zijn verwerkt in een commentaartabel, die tijdens een werkgroepbijeenkomst werd besproken. Na het doorvoeren van op deze bijeenkomst voorgestelde wijzigingen is de definitieve richtlijn aan de opdrachtgever aangeboden. Hierop volgden autorisatie door de beroepsverenigingen, druk en verspreiding.
Methode: wetenschappelijke onderbouwing
De richtlijn is ontwikkeld volgens de methodiek van de evidence-based richtlijnontwikkeling (EBRO).
Zoekstrategie
Om de klinische uitgangsvragen te beantwoorden, hebben de informatiespecialisten van NICE, in overleg met de werkgroepleden, op systematische wijze literatuuronderzoek verricht en is een selectie gemaakt binnen de gevonden onderzoeken volgens vooraf vastgestelde selectiecriteria. Er is gezocht naar bestaande (buitenlandse) evidence-based richtlijnen voor de zorg aan volwassenen met een Ass, systematische reviews en oorspronkelijke onderzoeken. In de literatuur-searches is gezocht naar literatuur in de Engelse, Nederlandse, Franse en Duitse taalgebieden. Voor het zoeken naar publicaties is gebruikgemaakt van de volgende informatiebronnen:
- Applied and Complementary Medicine (amed);
- Applied Social Services Index and Abstracts (assia);
- Australian Education Index (aei);
- British Education Index (bei);
- Cochrane Central Register of Controlled Trials (central);
- Cochrane Database of Absracts of Reviews of Effects (dare);
- Cochrane Database of Systematic Reviews (cdsr);
- Cumulative Index to Nursing and AUied Health Literature (cinahl);
- Education Resources in Curriculum (eric);
- Excerpta Medica database (Embase);
- Health Management Information Consortium (hmic);
- Health Technology Assessment (hta ) database;
- International Bibliography of Social Science (i bss);
- Medline/Medline In-Process;
- PsycBOOKS;
- Psyc extra;
- Psychological Information Database (PsyciNFO);
- Social Services Abstracts;
- Sociological Abstracts.
Selectiestrategie
Bij de selectie van artikelen zijn de volgende criteria gehanteerd.
- Geeft het onderwerp van het gevonden onderzoek voldoende antwoord op de uitgangsvraag: 'Worden de binnen grade vastgestelde kritische en belangrijke uitkomstmaten in het onderzoek geëvalueerd?' (grade: Grading of Recommendations Assessment, Development and Evaluation, zie aanverwant over de GRADE-profielen).
- Sluit de doelgroep van het gevonden onderzoek voldoende aan bij de doelgroep van de richtlijn (volwassenen en adolescenten ouder dan 18 jaar bij wie men vermoedt dat er sprake is van een van de diagnosen binnen het autismespectrum)? (Literatuur gezocht vanaf > 15 jaar.)
- Is de bestudeerde groep voldoende groot (minimaal 10 deelnemers per arm)?
- Is er sprake van een randomised controlled trial (rct), cohortonderzoek, crosssectioneel onderzoek, patiëntcontroleonderzoek of goed kwalitatief onderzoek (waaronder goed observationeel onderzoek en case series)? Bij een longitudinaal onderzoek: is er sprake van een voldoende lange follow-upperiode?
Zie voor meer informatie over de zoekstrategie aanverwant 'Kwaliteitsbeoordelingformulieren voor klinisch onderzoek', en voor meer informatie over de selectiecriteria per uitgangsvraag de reviewprotocollen aan het begin van elke module.
Extrapolatie
In deze richtlijn is extrapolatie toegepast wanneer de richtlijnwerkgroep de klinische uitgangsvraag als belangrijk zag, maar er geen primaire data over volwassenen met Ass beschikbaar waren, of deze data onvoldoende werden geacht. Per klinische uitgangsvraag heeft de richtlijnwerkgroep besloten of geëxtrapoleerd kon worden vanuit literatuur over kinderen met een Ass en vanuit literatuur over een populatie met een verstandelijke beperking. Wanneer werd besloten om te extrapoleren, hield de werkgroep in de gaten of de extrapolatiepopulatie op bepaalde algemene kenmerken overeen kwam met de volwassen ASS-populatie (zoals op leeftijd, sekse, ernst van de stoornis) en dat andere aspecten van het probleem (zoals bijwerkingen) en uitkomsten (zoals verbeterde toegang tot diensten) gelijk waren. Extrapolatie werd alleen toegepast wanneer de kwaliteit van de data gelijkwaardig was. Dezelfde standaarden werden toegepast voor het beoordelen en evalueren van het bewijs over kinderen en volwassenen met een verstandelijke beperking, als voor de primaire data over volwassenen met een Ass.
Beoordelingsstrategie
De methodologische kwaliteit van de gebruikte artikelen is beoordeeld met voor het betreffende onderzoekstype relevante beoordelingsformulieren, gebaseerd op formulieren van het EBRO-platform (cbo, 2007). Daarna zijn de artikelen naar hun mate van methodologische kwaliteit gegradeerd voor de mate van evidentiekwaliteit per uitkomstmaat. Bij die gradering is is het GRADE-systeem gebruikt (grade: Grading of Recommendations Assessment, Development and Evaluation). Geëxtrapoleerde gegevens werden gemarkeerd als bewijs van lagere kwaliteit dan gegevens over volwassenen met een Ass. Wanneer utkomsten voortkwamen uit extrapolatiepopulaties, werd dit weergegeven in het GRADE-systeem.
Reviewstrategie
Het oorspronkelijk doel van de reviewers was om voor elke uitkomstmaat bij een uitgangsvraag een meta-analyse uit te voeren, om de omvang van het klinisch effect van de interventie te beoordelen. De data uit oorspronkelijke onderzoeken werden hiervoor in een boomgrafiek verwerkt (forest plot: resultaten van verschillende onderzoeken uit een meta-analyse in één grafiek), die een grafische weergave van de meta-analyse geeft.
Wanneer er onvoldoende data beschikbaar waren, hebben de reviewers van het beschikbare bewijs een narratieve (beschrijvende) review opgesteld. De waardering van de kwaliteit van het bewijs met behulp van de GRADE-methodiek is in deze narratieve reviews opgenomen. De kwaliteitsbeoordeling en de reviews van de verschillende onderzoeken worden voor elke uitgangsvraag beschreven onder het kopje ‘Wetenschappelijke onderbouwing’.
Aanbevelingen
De aanbevelingen zijn gebaseerd op enerzijds wetenschappelijk bewijs (zie de kopjes ‘Wetenschappelijke onderbouwing') en anderzijds op overige overwegingen, zoals praktijkervaringen van de werkgroepleden, ervaringen en voorkeuren van mensen met een Ass en familie, kosten, beschikbaarheid (in verschillende echelons) en organisatorische aspecten (de kopjes ‘Overige overwegingen'). Voor de formulering van de aanbevelingen volgens wetenschappelijk bewijs is gebruikgemaakt van de GRADE-indeling voor het graderen van aanbevelingen. Deze procedure verhoogt de transparantie van de richtlijn en vergroot de helderheid voor de gebruiker van de richtlijn.
|
Tabel 1.1 GRADE-systeem: redenen voor downgraden en upgraden |
|
|
We downgraden het niveau van de kwaliteit van bewijs van interventiestudies, zoals RCT's bij: |
We upgraden het niveau van de kwaliteit van bewijs van observationele studies bij: |
|
Beperkingen in de onderzoeksopzet of uitvoering (study limitations): hierbij gaat het om de methodologische kwaliteit. Voorbeelden zijn dat de randomisatieprocedure niet optimaal was, dat beoordelaars van subjectieve uitkomsten niet geblindeerd waren, dat er selectief is gerapporteerd over de uitkomsten en dat er veel uitvallers waren. |
Een groot effect (large magnitude of effect): hiervan is sprake als er in de resultaten een groot effect of een sterk bewijs van associatie gevonden wordt. Dit kan tot uitdrukking komen in de hoogte van het relatieve risico (RR). |
|
Inconsistentie van de resultaten (inconsistency): hierbij gaat het om heterogeniteit van de resultaten van verschillende studies. Er kunnen beperkingen zijn als er een grote variatie is in de schattingen van het effect van een behandeling of als er nauwelijks overlap is tussen de 95%-betrouwbaarheidsintervallen (BI's). |
Mogelijke confounders die het 'ware' effect verminderd hebben (plausible confounding): hiervan kan sprake zijn als er een achterliggende variabele is, zoals de ernst van de aandoening van de patiënten die met het onderzoek meedoen, die van invloed is op het effect van de interventie. |
|
Indirect bewijs (indirectness): er worden twee soorten indirect bewijs onderscheiden. Enerzijds gaat het om indirecte vergelijkingen, bijvoorbeeld wanneer er alleen interventies met een placebo worden vergeleken en geen interventies met elkaar worden vergeleken. Anderzijds gaat het om verschillen in patiëntenpopulatie, inhoud van de interventie of keuze van de uitkomstmaten tussen de beschikbare studies en de uitgangsvraag die in de richtlijn wordt gesteld. |
Bewijs van een verband tussen de dosering en de repons (dose-response gradient): hiervan kan sprake zijn als stijgende doseringen van een bepaald medicijn meer effect geven. |
|
Onnauwkeurigheid van de resultaten (imprecision): hierbij gaat het om de onzekerheid van de uitkomst, bijvoorbeeld als de 95%-BI's heel breed zijn vanwege kleine patiëntenaantallen. |
|
|
Kans op selectieve publicatie (publication bias) van onderzoeken of uitkomstmaten. Een voorbeeld van een beperking is wanneer niet alle studies gepubliceerd worden, bijvoorbeeld kleine studies die geen effecten ten gunste van de interventie konden aantoonden. |
|
Het niveau van de kwaliteit van het bewijs verwijst naar de mate van vertrouwen dat men heeft in de schatting van het effect van een behandeling.
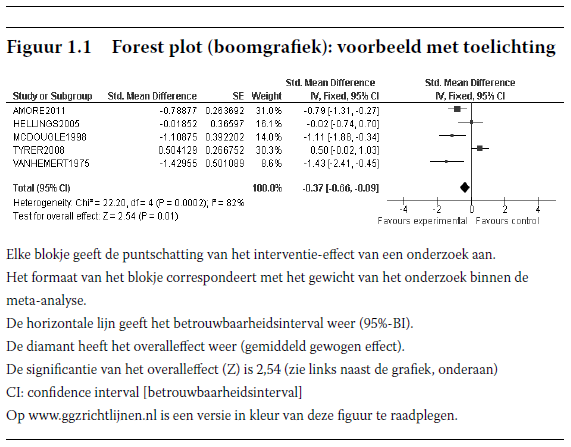
Methode: health economics (kosteneffectiviteit)
Het doel van de health economics was om bewijs te leveren over de kosteneffectiviteit van de in deze richtlijn behandelde interventies voor volwassenen met Ass, en daarmee bij te dragen aan de ontwikkeling van aanbevelingen in deze richtlijn. Dit werd bereikt door:
- systematische literatuur-search naar bestaand economisch bewijs;
- beslissings-analytisch economisch modelleren.
Systematische literatuur-searches naar economisch bewijs zijn uitgevoerd voor alle gebieden die aan bod komen in deze richtlijn. Het economisch modelleren heeft plaatsgevonden op gebieden (1) waarop belangrijke implicaties van benodigde middelen werden verwacht, (2) waarop de huidige mate van onzekerheid over de kosteneffectiviteit significant was, en (3) waarbij van een economische analyse werd verwacht dat deze de onzekerheid zou kunnen verminderen. Deze economische modellering vond plaats volgens The Guidelines Manual (nice, 2009). De rationale voor priorisering van bepaalde klinische uitgangsvragen voor het economisch modelleren was beschreven in een economisch plan dat is opgesteld in overeenstemming met nice, de richtlijnwerkgroep, de health economist en andere leden van het technische team dat deze richtlijn heeft samengesteld. Op basis hiervan is een economisch model ontwikkeld om de kosteneffectiviteit te bepalen van een Supported Employment-programma in vergelijking met gebruikelijke zorg.
|
Tabel 1.2 Gradering van de sterkte van aanbeveling (GRADE) |
|||
|
Graderen van aanbeveling |
Voordelen versus nadelen en risico's |
Methodologische kwaliteit van de onderzoeken |
Implicaties |
|
1A = sterke aanbeveling; hoge graad van evidentie |
Voordelen overtreffen duidelijk de nadelen of risico's. |
RCT's zonder beperkingen, of sterk overtuigende evidentie van observationele onderzoeken. |
Sterke aanbeveling; kan worden toegepast bij de meeste mensen met een psychiatrische diagnose en in de meeste omstandigheden. |
|
1B = sterke aanbeveling; matige graad van evidentie |
Voordelen overtreffen duidelijk de nadelen of de risico's. |
RCT's met beperkingen, of sterke evidentie vanuit observationele onderzoeken. |
Sterke aanbeveling; kan worden toegepast bij de meeste mensen met een psychiatrische diagnose en in de meeste omstandigheden. |
|
1C = sterke aanbeveling; lage of zeer lage graad van evidentie |
Voordelen overtreffen duidelijk de nadelen of de risico's. |
Observationele onderzoeken of casussen. |
Sterke aanbeveling, maar dit kan veranderen als er hogere evidentie beschikbaar komt. |
|
2A = zwakke aanbeveling; hoge graad van evidentie |
Evenwicht tussen voor- en nadelen of rsico's. |
RCT's zonder beperkingen of sterk overtuigende evidentie van observationele onderzoeken. |
Zwakke aanbeveling; de beste actie kan verschillen naargelang de omstandigheden, de patiënt, of maatschappelijke waarden. |
|
2B = zwakke aanbeveling; matige graad van evidentie |
Evenwicht tussen voor- en nadelen of risico's. |
RCT's met beperkingen of sterke evidentie vanuit observationele onderzoeken. |
Zwakke aanbeveling; de beste actie kan verschillen naargelang de omstandigheden, de patiënt, of maatschappelijke waarden. |
|
2C = zwakke aanbeveling; lage of zeer lage graad van evidentie |
Onzekerheid over voor- of nadelen; evenwicht tussen beide is mogelijk. |
Observationele onderzoeken of case studies of RCT's met majeure beperkingen. |
Zeer zwakke aanbeveling; alternatieven kunnen evengoed te verantwoorden zijn. |
GRADE: Grading of Recommendations Assessment, Development and Evaluation; RCT: randomized controlled trial
Zoekstrategie
Er werd een systematisch literatuursearch uitgevoerd om al het relevante bewijs te achterhalen. Searches werden beperkt tot economische onderzoeken en Health Technology Assessment Reports, en uitgevoerd in de volgende databases:
- EconLit (the American Economie Association's electronic bibliography);
- Health Technology Assessment- (hta-) database;
- embase;
- medline/medline In-Process;
- nhs Economic Evaluation Database (nhs eed);
- PsychINFO.
Daarnaast werden Google en Google Scholar doorzocht op onderzoeken die mogelijk waren gemist door de elektronische databases. Verder werd literatuur in eerdere autismerichtlijnen gecontroleerd (van de Nederlandse Vereniging voor Psychiatrie en van het Landelijk Netwerk Autisme) en werd de literatuurlijst van het Dr. Leo Kannerhuis geraadpleegd (inclusief reference tracking). Enig relevant bewijs vanuit de klinische literatuursearch werd in deze periode aan de health economist beschikbaar gesteld. De zoektermen voor de economische searches zijn opgenomen onder het kopje 'zoekverantwoording'.
Selectiestrategie
De volgende selectiecriteria zijn toegepast om vanuit de resultaten van economische searches onderzoeken te selecteren voor nadere evaluatie.
- Er zijn alleen onderzoeken geïncludeerd van de Organisation for Economic Co-operation and Development (oecd) en ontwikkelde landen, omdat het doel van de review was om economische informatie te achterhalen die toepasbaar is voor de Nederlandse en Britse context.
- Selectiecriteria voor soorten klinische condities, voor gebruikers van zorg, en voor interventies die worden beoordeeld, waren identiek aan die in de klinische-literatuurreviews.
- Een voorwaarde voor inclusie van onderzoeken was dat deze voldoende details beschreven over methoden en resultaten en dat de gegevens en de resultaten van het onderzoeken extraheerbaar waren. Dit om het mogelijk te maken om de methodologische kwaliteit van het onderzoeken te beoordelen. Posterpresentaties en abstracts werden geëxcludeerd.
- Zowel volledige economische evaluaties die twee of meer opties vergeleken en die kosten en consequenties beoordeelden zijn meegenomen, als eenvoudige kostenanalyses.
- Economische onderzoeken zijn meegenomen wanneer ze gegevens over klinische effectiviteit gebruikten vanuit een rct, een cohortonderzoek, een systematische review, een meta-analyse, of klinische onderzoeken.
Beoordelingsstrategie
Alle economische artikelen die voldeden aan de inclusiecriteria, werden beoordeeld op hun toepasbaarheid en kwaliteit met behulp van de methodologische checklist voor economische evaluaties van nice (nice, 2009) die is opgenomen onder aanverwant 'Methodologische checklist voor economisch onderzoek'. De methodologische checklist voor economische evaluaties werd ook toegepast op het economisch model dat specifiek voor deze richtlijn is ontwikkeld. Onderzoeken die volledig of gedeeltelijk voldeden aan criteria voor toepasbaarheid en kwaliteit zoals beschreven in de methodologische checklist, werden nader beschouwd tijdens het proces van richtlijnontwikkeling, samen met de resultaten van het economische model. De ingevulde methodologische checklists voor alle economische evaluaties die in deze richtlijn werden bestudeerd, kunt u vinden onder aanverwant.
Beschrijving van de resultaten en conclusies
Kenmerken en resultaten van alle geëvalueerde onderzoeken zijn samengevat in economische bewijsprofielen, samen met bijbehorende klinische bewijsprofielen volgens grade, in de GRADE-profielen (zie aanverwanten).
Zoekverantwoording
Zoekstrategieën klinisch onderzoek
Hier worden de vermeld zoekstrategieën die zijn gebruikt voor het achterhalen van klinisch onderzoek.
Systematic review search filters
MEDLINE, EMBASE, PsycINFO, CINAHL, AMED, BNI - Ovid interface
- exp meta analysis/ or exp systematic review/ or exp literature review/ or exp literature searching/ or exp cochrane library/ or exp review literature
- ((systematic or quantitative or methodologics) adj (overviews or reviews)).mp.
- (meta-analyse or meta analyse).mp.
- (research adj (reviews or integration)).mp.
- reference lists.ab.
- bibliographs.ab.
- published studies.ab.
- relevant journals.ab.
- selection criteria.ab.
- (data adj (extraction or synthesis)).ab.
- ((handsearchs or (hand or manual)) adj searchs).tw.
- ((mantel adj haenszel) or peto or dersimonian or der simonian). tw.
- (fixed effects or random effects).tw.
- reviews.pt,mp. and (bids or cochrane or index medicus or isi citation or medlars or psyclit or psychlit or scisearch or science citation or web adj science).mp.
- (systematics or metas).pt.
- or/1-15
Randomised controlled trial search filters (use 'subtitle 2' style)
MEDLINE, EMBASE, PsycINFO, CINAHL, AMED, BNI - Ovid interface
- exp clinical trials/ or exp clinical trial/ or exp controlled clinical trials/
- exp crossover procedure/ or exp cross over studies/ or exp crossover design/
- exp double blind procedure/ or exp double blind method/ or exp double blind studies/ or
- exp single blind procedure/ or exp single blind method/ or exp single blind studies/
- exp random allocation/ or exp randomization/ or exp random
- assignment/ or exp random
- sample/ or exp random sampling/
- exp randomized controlled trials/ or exp randomized controlled trial/
- (clinical adj trials).tw.
- (crossover or cross over).tw.
- (((singles or doubls or trebls or tripls) adj (blinds or masks or dummy)) or (singleblinds or doubleblinds or trebleblinds)).tw.
- (placebos or randoms).mp.
- (clinical trials or clinical control trial or randoms).pt,dt.
- animals/ not (animals/ and humans.mp.)
- animals/ not (animals/ and humans/)
- (animal not (animal and human)).po.
- (or/1-10) not (or/11-13)
Zoekstrategie health economics
Hier worden de zoekstrategieën vermeld die zijn gebruikt voor het achterhalen van onderzoeken naar health economics en onderzoeken naar kwaliteit van leven.
General search filters
Health economics and actuality-of-life search filters
MEDLINE, EMBASE, PsycINFO, CINAHL - Ovid interface
- exp “costs and cost analysis"/ or “health care costs”
- exp health resource allocation/ or exp health resource utilization
- exp economics/ or exp economic aspect/ or exp health economics/
- exp value of life
- (burden adj (disease or illness)).tw.
- (costs or economics or expenditures or pricesl or pricing or pharmacoeconomics).tw.
- (budgets or fiscal or funding or financial or finances).tw.
- (resource adj (allocations or utilits)).tw. or/1-8
- (value adj money).tw. exp quality of life/
- (qualitys adj (life or survival)).tw.
- (health status or QOL or well being or wellbeing).tw. or/9-13
- Details of additional searches undertaken to support the development of this guideline are available on request.
