Diagnostiek en het gebruik van vragenlijsten ter indicatie voor verder onderzoek naar autisme
Uitgangsvraag
Wat is de waarde van vragenlijsten - zoals de Autisme Quotiënt (AQ)-kind, Social Responsiveness Scale (SRS), Vragenlijst voor Inventarisatie van Sociaal gedrag van Kinderen (VISK/CSBQ), Childhood autism rating scale (CARS), de Autisme Spectrum Vragenlijst (ASV) en de Social Communication Questionnaire (SCQ) - ter indicatie voor autismediagnostiek binnen de jeugd ggz?
Aanbeveling
Gebruik instrumenten ter ondersteuning, maar nooit als vervanging van het klinisch-diagnostisch proces.
Overweeg in de beginfase van autismediagnostiek (ter ondersteuning) een vragenlijst te gebruiken om te beoordelen of (verdere) autismediagnostiek geïndiceerd is.
- Op basis van de systematisch uitgewerkte literatuur kan de CARS of SCQ worden aanbevolen.
- Op basis van ervaringen uit de praktijk kan de werkgroep ook andere gevalideerde vragenlijsten aanbevelen, zoals de AQ-child, SRS, VISK/CSBQen ASV.
Zet de waarde van de antwoorden af tegen de psychometrie van de vragenlijst en het klinisch beeld.
Voer naar aanleiding van de uitslag op de gebruikte vragenlijst altijd een verdergaand gesprek met het kind en de ouders/verzorgers.
Baseer vervolgens de beslissing om wel of geen verdere autismediagnostiek in te zetten niet louter op de resultaten van de gebruikte vragenlijst, maar bepaal dit samen met een klinische evaluatie van het functioneren van het kind en diens context.
Neem hierin ook de verschillende leefgebieden van het kind (zoals thuis en school) in overweging.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Gebaseerd op de bovenstaande literatuur kunnen slechts beperkt aanbevelingen worden gedaan met betrekking tot de waarde van autisme case identification vragenlijsten bij kinderen en jongeren. Dit komt enerzijds doordat slechts twee instrumenten, de CARS en de SCQ, grondig zijn onderzocht. Bovendien zijn de onderzoeken dusdanig opgezet dat zij aanzienlijk aan bewijskracht verliezen. Voor belangrijke vragenlijsten die veel worden gebruikt in de Nederlandse praktijk, zoals de AQ-child, SRS-2, VISK/CSBQ en ASV, ontbreken onderzoeken.
Niettemin, bij het bekijken van de beschikbare gegevens, valt op dat de CARS de beste resultaten laat zien wat betreft sensitiviteit en positieve predictieve waarde (PPV); er is minder vaak sprake van ‘loos alarm’. De SCQ vertoont de beste resultaten voor de negatief voorspellende waarde (NPV), wat betekent dat er minder ‘gemiste patiënten’ zijn.
Omdat vragenlijsten op een relatief snelle en gestandaardiseerde manier informatie opleveren, vormen ze een belangrijke bron in diagnostisch onderzoek. Het is echter essentieel om te benadrukken dat vragenlijsten slechts een ondersteunende functie in het diagnostische besluitvormingsproces hebben. Een vragenlijst biedt zicht op de problematiek vanuit het perspectief van de invuller in vergelijking met een normgroep.
Een nadeel van het gebruik van case identification vragenlijsten kan zijn dat de ggz-professional en/of de invuller te veel waarde hecht(en) aan de resultaten. Het is belangrijk zich te realiseren dat een positieve screening niet per se betekent dat het kind autisme heeft, en omgekeerd sluit een negatieve screening een autismediagnose niet per se uit. Bovendien houden vragenlijsten geen rekening met adaptieve processen. Het is van belang zich te realiseren dat ondanks de gestandaardiseerde aard van vragenlijsten, de antwoorden van een invuller toch subjectief zijn, afhankelijk van hoe de persoon de symptomen ervaart of interpreteert. Hierbij kan er sprake zijn van over- en onderrapportage, culturele bias en sociaal wenselijke antwoorden. Daarnaast bieden vragenlijsten weinig tot geen ruimte voor verduidelijkingen van antwoorden.
Er is weinig bekend over de betrouwbaarheid en validiteit van case identification vragenlijsten bij minderheidsgroepen, zoals bepaalde culturele groepen. Deze groepen worden zelden betrokken bij wetenschappelijk onderzoek. Ook is er minder bekend over het gebruik van deze vragenlijsten bij meisjes met autisme. De onderzoeken die wel gedaan zijn betreffen vooral meisjes wiens autismefenotype overeenkomt met dat van jongens. Geslachtverschillen kunnen een rol spelen bij de beoordeling van vragenlijsten, zoals geïllustreerd door ouders/verzorgers van autistische meisjes die op de SRS-2 minder restrictief en repetitief gedrag rapporteerden dan ouders/verzorgers van autistische jongens. In de adolescentie namen de problemen op dit vlak toe, evenals problemen met sociale communicatie en interactie bij meisjes met autisme (Kaat, 2021). Daarnaast is er weinig bekend over het gebruik van vragenlijsten bij sociaal achtergestelde groepen, zoals mensen die in armoede leven, geen werk hebben, hun kind zonder partner grootbrengen, en/of huisvestingsproblemen hebben.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het doel van case identification vragenlijsten is om op gestandaardiseerde wijze informatie te verzamelen. Het is belangrijk dat de ggz-professional dit benadrukt aan de ouders/verzorgers en het kind.
Het verdient de voorkeur om zowel het kind (indien mogelijk, vanaf 12 jaar), ouders/verzorgers, en de bredere omgeving (school) te vragen autismevragenlijsten in te vullen, aangezien iedereen een uniek perspectief kan hebben op de situatie. Vaak zijn er verschillende versies van dezelfde vragenlijst beschikbaar voor verschillende doelgroepen.
Voor het kind en de ouders/verzorgers kunnen case identification vragenlijsten prettig werken, omdat deze in eigen tijd en tempo in te vullen zijn. Sommige patiënten of hun systemen weigeren vragenlijsten in te vullen, zoals vanwege tijdsbeperkingen, emotionele belasting of zorgen over privacy, vooral bij online invulling.
Het omgaan met vragenlijsten bij gescheiden ouders kan uitdagend zijn, vooral als er conflicten tussen ouders spelen. Benadruk het belang van samenwerking voor het welzijn van het kind.
Kosten (middelenbeslag)
De kosteneffectiviteit van case identification vragenlijsten is niet middels systematisch literatuuronderzoek onderzocht in deze module. De kostprijs kan worden verlaagd door gebruik te maken van automatische rapportage, wat vaak beschikbaar is bij online varianten, of door gebruik te maken van open source vragenlijsten.
Merk op dat vals positieven kunnen leiden tot onnodige gespecialiseerde beoordelingen en ouderlijke bezorgdheid, terwijl valse negatieven kunnen leiden tot onder-identificatie, late diagnose en interventie (Charman, 2016). Het is daarom belangrijk om altijd de klinische evaluatie van het functioneren en de context mee te nemen
Aanvaardbaarheid, haalbaarheid en implementatie
Case identification vragenlijsten worden op grote schaal gebruikt in de klinische praktijk. Deze vragenlijsten dienen om te bepalen of onderzoek naar autisme gerechtvaardigd is en zijn in dat geval zeer waardevol. Echter, in de klinische praktijk worden ze ook wel gebruikt binnen de classificerende diagnostiek, waarvoor ze niet bedoeld zijn. Wanneer er al een sterk vermoeden van autisme bestaat en/of er een gerichte vraag is voor classificerend autisme-onderzoek, is het in principe niet nodig om een case identification vragenlijst gericht op autisme af te nemen.
Het is cruciaal om zorgvuldig te overwegen welke vragenlijsten geschikt zijn voor de specifieke patiënt. Ook dient benadrukt dat de juiste training en ervaring nodig is van de beoordelaar, niet alleen op het gebied van autisme, maar ook wat betreft het juist kunnen interpreteren van uitslagen.
Hulpverleners kunnen bezwaren hebben tegen het gebruik van case identification vragenlijsten, zoals beperkte sensitiviteit en specificiteit.
Bij het gebruik van case identification vragenlijsten ontstaat gezondheidsongelijkheid. Mensen met geringe gezondheidsvaardigheden, uit lagere sociale klassen, met een laag opleidingsniveau of een migratieachtergrond kunnen moeite hebben met het invullen van dergelijke vragenlijsten. Ondersteuning bij het invullen is mogelijk, vooral bij taalbarrières of cognitieve belasting. Het is essentieel zich daarbij te realiseren dat dit de betrouwbaarheid en de validiteit van de resultaten kan beïnvloeden. Maar ook dat cross-culturele validiteit meestal niet eens is onderzocht voor vragenlijsten. Ondanks dat er steeds meer anderstalige versies van vragenlijsten beschikbaar zijn (ook open source), wordt de impact van de culturele achtergrond daarin meestal over het hoofd gezien. Enige dan wel voldoende psychometrische gegevens over minderheidsgroepen missen (Pham, 2023).
Het gebruik van case identification vragenlijsten maakt deel uit van het diagnostisch onderzoek, dat vergoed wordt door de gemeente. Een vragenlijst kan worden aangeschaft bij een uitgeverij of worden geïntegreerd in een digitaal platform met een abonnement. Op basis van de literatuur kunnen de CARS en de SCQ worden aanbevolen. In Nederland wordt ook de SRS, VISK en ASV gebruikt. Daarnaast zijn er gratis te downloaden autismevragenlijsten beschikbaar (open source), zoals de AQ-Kind.
Minimaal één zorgverlener die bevoegd en bekwaam is voor het afnemen van vragenlijsten dient betrokken te worden. Vaak is dit een psycholoog of orthopedagoog. Over het algemeen vullen de meeste patiënten de vragenlijsten in. Er kunnen echter patiënten zijn die dit weigeren of vragenlijsten (bewust of onbewust) gekleurd invullen.
Qua belemmerende factoren kunnen de kosten en de tijd die het invullen van vragenlijsten vergt, evenals de frustratie die dit soms oplevert voor ouders/verzorgers en kinderen/jongeren, een rol spelen. Dit geldt vooral wanneer dit voor de zoveelste keer moet worden gedaan.
Randvoorwaarden zijn dat de invuller de taal waarin de vragen zijn gesteld voldoende beheerst. Bij jonge kinderen worden vaak alleen informantvragenlijsten voor ouders/verzorgers en leerkrachten gebruikt. Voor oudere kinderen zijn er ook zelfrapportagevragenlijsten beschikbaar. Het is van belang op afdelingsniveau te bespreken hoe men omgaat met het gebruik van vragenlijsten.
Rationale van de aanbeveling: weging van argumenten voor en tegen de diagnostische procedure
Op basis van de systematisch uitgewerkte literatuur kan de CARS of SCQ worden aanbevolen. Op basis van ervaringen uit de praktijk kan de werkgroep ook andere gevalideerde vragenlijsten aanbevelen, zoals de AQ-child, SRS, VISK/CSBQ en ASV.
Onderbouwing
Achtergrond
Binnen de gespecialiseerde ggz wordt autisme geclassificeerd aan de hand van gestandaardiseerde diagnostische criteria, zoals vastgelegd in de DSM-5. Dit vergt uitgebreid onderzoek. De diagnostiek bestaat uit verschillende fasen (zie verder) en wordt bij voorkeur uitgevoerd door een (team van) bevoegde en bekwame ggz-professional(s). Daarbij is ook aandacht voor co-morbiditeit.
Tijdens de beginfase van dit proces kunnen vragenlijsten worden gebruikt, waarmee kan worden beoordeeld of er mogelijk sprake is van autisme (vermoeden van autisme) en er nader diagnostisch onderzoek naar autisme is geïndiceerd. In het Engels worden dergelijke vragenlijsten aangeduid als ‘case identification’ vragenlijsten; hier is geen goede Nederlandse term voor. Case identification vragenlijsten meten de mate waarin verschillende gedragingen, kenmerken en symptomen die worden geassocieerd met autisme voorkomen. Er wordt dan gemeten in welke mate de ouders/verzorgers aangeven dat er autismekenmerken aanwezig zijn bij het kind. De resultaten van een dergelijke vragenlijst zijn enkel een aanwijzing; deze worden altijd gecombineerd met de bevindingen uit het initiële gesprek met het kind/de ouders/verzorgers en klinische observatie.
Er is praktijkvariatie in het gebruik van case identification vragenlijsten in Nederland. Er zijn diverse vragenlijsten beschikbaar, waaronder de Autism Quotiënt Child (AQ-kind), de Social Responsiveness Scale (SRS-2), de Vragenlijst voor Inventarisatie van Sociaal gedrag van Kinderen (VISK), de Childhood Autism Rating Scale (CARS), de Autisme Spectrum Vragenlijst (ASV) en de Social Communication Questionnaire (SCQ). Elk van deze vragenlijsten heeft zowel klinische en psychometrische kwaliteiten als tekortkomingen of beperkingen. Het ontbreken van duidelijke richtlijnen voor het gebruik van deze vragenlijsten leidt tot het ontbreken van een gestandaardiseerde werkwijze in de diagnostische fase van case identification.
Zo worden (bijna) alle jonge kinderen gescreend door de jeugdgezondheidszorg middels het Van Wiechen schema (zie de JGZ-richtlijn Autismespectrumstoornissen; Sinnema & van de Glind, 2015). Aan dit schema zijn een aantal items toegevoegd die meebepalen of een kind ‘at risk’ is. Indien dit het geval is, kan vervolgens, op het consultatiebureau, bij kinderen tussen 12 en 48 maanden, de Communicatieve en Sociale ontwikkelingsSignalen (CoSoS/ESAT; Dietz e.a, 2006; Dietz & Oosterling, 2017) worden afgenomen bij de ouders/verzorgers. Afname van de CoSos wordt daarnaast ook gedaan bij een niet-pluis gevoel bij ouders/verzorgers, de professional of school, indien er vermoeden is van autisme, tenzij een speciële anamnese een andere oorzaak aan het licht brengt. Wanneer er signalen worden waargenomen die mogelijk wijzen op autisme, wordt er doorverwezen naar de gespecialiseerde ggz voor verdere diagnostiek. In deze module richten we ons specifiek op de vragenlijsten die binnen de gespecialiseerde ggz worden gebruikt.
Bij kinderen en jongeren in de leeftijd van 6 tot 18 jaar wordt binnen de gespecialiseerde ggz een breed palet aan vragenlijsten gebruikt, zoals de AQ-kind, de SRS-2, de VISK, de CARS, de ASV en de SCQ. De toegevoegde waarde en de kwaliteit van deze vragenlijsten voor de diagnostiek bij deze leeftijdsgroep is nog onvoldoende bekend. Het is onbekend welke vragenlijst(en) het meest geschikt zijn om als eerste te worden ingezet om een vermoeden van autisme te onderbouwen.
Achtergrond en overige aandachtspunten
Binnen de ggz wordt er gesproken van classificeren en diagnosticeren. Classificeren van een stoornis is het koppelen van de problematiek aan een passende categorie binnen een breder diagnostisch systeem; in Nederland is dat de DSM-5-TR. Diagnosticeren is veel breder. Daarbij wordt systematisch de unieke presentatie van het autisme bij het kind onderzocht. Er wordt niet alleen gekeken naar diens symptomen, maar ook naar diens sterkten, zwakten en behoeften.
Het diagnostisch traject bij vermoeden van autisme bestaat over het algemeen uit de volgende onderdelen:
- Case identification: identificatie van kinderen en jongeren met mogelijke symptomen van autisme.
- Algehele klachtenanamnese: gericht op de huidige klachten en de hulpvraag, waarin het huidig functioneren, de familiecontext, het systeem en de somatiek worden meegenomen.
- Algehele ontwikkelingsanamnese: verzameling van informatie over de ontwikkelingsgeschiedenis en mijlpalen tot op heden, gericht op autisme en andere psychiatrische problematiek (voor differentiaaldiagnose en verdere controle op comorbiditeiten).
- Gedragsobservatie: observatie van gedrag in verschillende contexten (zoals bij de ggz, thuis en op school) middels gestructureerde observatie (zoals de ADOS-2), vrije observatie, of rapportage (bijvoorbeeld door leerkrachten; directe observatie heeft echter de voorkeur). Ook wordt er via observatie geprobeerd inzicht te krijgen in de ouder-kind-interactie.
- Afname van gestandaardiseerde instrumenten: dit omvat het gebruik van vragenlijsten (zoals met betrekking tot autismekenmerken, sensorische problematiek en executief functioneren) en testen voor taal, cognitieve en ontwikkelingsniveaus (op indicatie, om een algemeen beeld van de capaciteiten te verkrijgen). Dit is geen onderdeel op zich, maar kan ingezet worden ten behoeve van de andere onderdelen binnen het diagnostisch proces, zoals het beter zicht krijgen op klachten (2) en de ontwikkeling (3).
- Indien er sprake is van psychiatrische en/of somatische comorbiditeiten is aanvullende diagnostiek nodig (hier niet besproken, maar te vinden in de desbetreffende richtlijnen).
- Beoordelen van DSM-5-TR dan wel DC:0-5 criteria met betrekking tot autisme en eventuele andere psychiatrische problematiek (classificatie). Er wordt gekeken naar het specifieke symptomen patroon bij het kind, evenals naar de sterktes en zwaktes van het kind en zijn/haar/diens behoeften op het gebied van ondersteuning/behandeling (beschrijvende diagnose). Een klinische consensus diagnose door ervaren diagnostici wordt beschouwd als de gouden standaard (Lord, 2022), hoewel diagnostiek ook door één hiertoe opgeleide en ervaren deskundige kan worden uitgevoerd.
Het is belangrijk om verder te kijken (breder) dan alleen de classificatie ‘wel of geen autisme’. De onderzoeksresultaten moeten in hun context worden geplaatst om een volledig geïntegreerd beeld van de bevindingen te vormen. Dit stelt ons in staat om een zorgaanbod op maat te creëren dat aansluit bij de behoeften en mogelijkheden van het kind en van het systeem.
Voor de invulling van bovengenoemde is het van belang om te differentiëren op basis van leeftijdscategorie en cognitieve capaciteit, omdat dan andere vaardigheden worden verwacht: zoals 0 tot 4 jaar, 4 tot 12 jaar, 12 tot 18 jaar, en de eventuele aanwezigheid van een verstandelijke ontwikkelingsstoornis (licht, matig, ernstig of zeer ernstig) dan wel hoogbegaafdheid.
Bij jonge kinderen is het gebruikelijk om psychologische testen (zoals voor ontwikkelingsniveau en taal) standaard uit te voeren. Naarmate kinderen ouder worden, neemt de noodzaak tot het standaard afnemen van dergelijke testen vaak af.
Aan de hand van de huidige module wil de werkgroep eenduidigheid aanbrengen in de praktijk ten aanzien van het gebruik van case identification vragenlijsten.
Conclusies / Summary of Findings
Sensitivity, negative predictive value – Childhood Autism Rating Scale (CARS)
|
Low GRADE |
The evidence suggests that the sensitivity of the CARS is high for diagnosing ASD in children.
Source: Randall, 2018; Chu, 2022; Dawkins, 2016; Park, 2018; Ji, 2023 |
Negative predictive value – Childhood Autism Rating Scale (CARS)
|
Low GRADE |
The evidence suggests that the negative predictive value of the CARS is low for diagnosing ASD in children.
Source: Randall, 2018; Chu, 2022; Dawkins, 2016; Park, 2018; Ji, 2023 |
Specificity – Childhood Autism Rating Scale (CARS)
|
Very low GRADE |
The evidence is very uncertain about the specificity of the CARS in diagnosing ASD in children.
Source: Randall, 2018; Chu, 2022; Dawkins, 2016; Park, 2018; Ji, 2023 |
Positive predictive value – Childhood Autism Rating Scale (CARS)
|
Moderate GRADE |
The positive predictive value of the CARS in diagnosing ASD in children is likely high.
Source: Randall, 2018; Chu, 2022; Dawkins, 2016; Park, 2018; Ji, 2023 |
Sensitivity, specificity, positive predictive value – Social Communication Questionnaire (SCQ)
|
Very low GRADE |
The evidence is very uncertain about the sensitivity, specificity and positive predictive value of the SCQ for diagnosing ASD in children.
Source: Charman, 2016; Ung, 2016 |
Negative predictive value – Social Communication Questionnaire (SCQ)
|
Low GRADE |
The evidence suggests that the negative predictive value of the SCQ in diagnosing ASD in children is high.
Source: Charman, 2016; Ung, 2016 |
AQ-child, SRS, VISK/CSBQ and ASV
|
No GRADE |
-
Source: - |
Samenvatting literatuur
Description of studies
The Cochrane systematic review by Randall (2018) performed a systematic review on the diagnostic accuracy of test for diagnosing autism spectrum disorder (ASD) in preschool children. Diagnostic accuracy outcomes were compared with a clinical diagnosis by an experienced multi-disciplinary team. Multiple electronic databases among which CENTRAL, PubMed (including MEDLINE), Embase, CINAHL and PsycINFO were searched from inception up to July 2016. Criteria for inclusion of studies were: 1) Reporting about one of the predefined index tests, among which the CARS, children of preschool age (<6 years), suspected of having an ASD, using multi-disciplinary assessment or similar as reference standard. The Quality Assessment of Diagnostic Accuracy Studies-2 (QUADAS-2) was used to assess the risk of bias on the following domains: patient selection, index test, reference standard and flow and timing. Two studies were judged to have a high risk of bias (Chlebowski, 2010; Ventola, 2006). The study by Wiggins (2008) was judged to have an unclear risk of bias, and the study by Russel (2010) was judged to have a low risk of bias. The declarations of interest section showed no competing interests.
After publication of the systematic review by Randall (2018), four other diagnostic accuracy studies were published that matched the predefined PICROTS (Chu, 2022; Dawkins, 2016; Ji, 2023 and Park, 2018). These studies concerning the CARS are summarized below.
In the cohort study of Dawkins (2016), the diagnostic accuracy of two versions of the CARS2 was studied. Participants were asked to participate when they were referred to one of the five participating autism centers in North Carolina (USA). Either the CARS2 standard version (CARS2-ST, age <6 years or IQ <80) or the CARS2-High functioning version (CARS2-HF, age >6 years, or IQ <80) was administered. In total, 98 children were evaluated using the CARS2-ST (mean age not reported). The same clinician who administered the CARS2-ST also assessed presence of ASD using a rating form to indicate whether ASD conform DSM-5 criteria was present.
In the retrospective chart review by Park (2018), outcomes from the CARS were compared with the ADOS-2 (module 1 and 2). Scores of the ADOS and CARS were extracted from medical charts of children who visited the psychiatric outpatient clinic at Seoul National University Children’s Hospital between January 2013 and December 2014. Referred children were suspected to have a developmental delay. The CARS and ADOS were administered on the same day (by examiners with either a master or a doctoral in special education). In total, scores from 78 children were extracted and analysed. The authors declared no competing interests.
The prospective diagnostic study by Chu (2022) tested diagnostic accuracy of the CARS and screened 591 children from the ASD unit at Beijing Children’s Hospital between June and November 2019. Criteria for inclusion of participants were: 1) suspected ASD based on the Clancy autism behavior scale (CABS), thus scoring above the cut-off point of 14. A Chinese version of the CARS, translated for purpose of this study, was carried out by two specialists, using a cut-off score of 30 points. After scoring the CARS, the reference test was performed by at least two attending physicians based on a detailed description of the child’s development history by the parents, observed behaviour, and DSM-5 criteria for autism. After screening 591 individuals, 474 participants were included in the study, and no missings were reported. The authors declared no competing interests.
In a retrospective chart review, the authors of Ji (2023) compared the outcomes of the CARS2-ST with the ADOS-2 (module 1 and 2). Children who visited the child and adolescent psychiatry outpatient clinic at Seoul National University Hospital between January 2019 and July 2020 were included in the study. ADOS-2 and CARS2-ST scores (administered by examiners with either a master or a doctoral in special education) were retrospectively extracted from charts between January 2019 and July 2020. The ADOS-2 and the CARS2-ST were performed on the same day, by one of the two examiners. In total, scores from 237 children were extracted and analysed. The authors declared no competing interests.
Next to the CARS, the Social Communication Questionnaire (SCQ) was researched in two diagnostic accuracy studies. In the retrospective chart review by Ung (2016), the outcomes of the SCQ were compared with a multidisciplinary assessment, including a physical exam by a paediatrician, a parent interview with the same doctor, and evaluation using the ADOS and CARS. Additional data provided by parents (e.g., social, cognitive, and motor skills, behavioural issues) were reviewed, and a multidisciplinary team discussed each child’s case. Children/youth were referred (self-referrals/healthcare providers) to an outpatient ASD clinic because of concerns about the child’s development. Children lacking verbal skill/competence were not included in this study. In total, data from 76 children were extracted from the medical charts and analysed. The authors declared no competing interests.
In the retrospective chart review by Charman (2016), the outcomes of the SCQ were compared with in depth assessment, including consensus ICD-10 diagnosis by ADI-R and ADOS combined with assessments of IQ, language and adaptive behaviour. In total, 808 children were referred to community child health services between October 2004 and October 2005. Reasons for referral were language difficulties, social communication difficulties, behaviour, general development or other problems. Of these 808, 543 participants received complete screening. Of these 543 participants, 181 children were sampled stratified by service, referral, ASD diagnostic team, SCQ-score and M-CHAT. Diagnostic accuracy outcomes are weighted measures using inverse probability weighting. Due to 61 missings, in depth assessments were performed in 120 children, for whom thus both information for SRS and reference standard were reported. The authors declared no competing interests.
Table 1. Description of included studies
Results
Diagnostic accuracy is assessed below for the following instruments:
1. CARS
2. SCQ
For each measure, sensitivity, specificity, PPV and NPV were reported and summarized below.
1. Childhood Autism Rating Scale (CARS)
The review of Randall (2022) included four studies reporting on the Childhood Autism Rating Scale (Chlebowski, 2010; Ventola, 2006; Wiggins, 2008; Russel, 2010). In addition to this review, four individual studies reported on the CARS (Chu, 2022; Dawkins, 2016; Ji, 2023; Park, 2018).
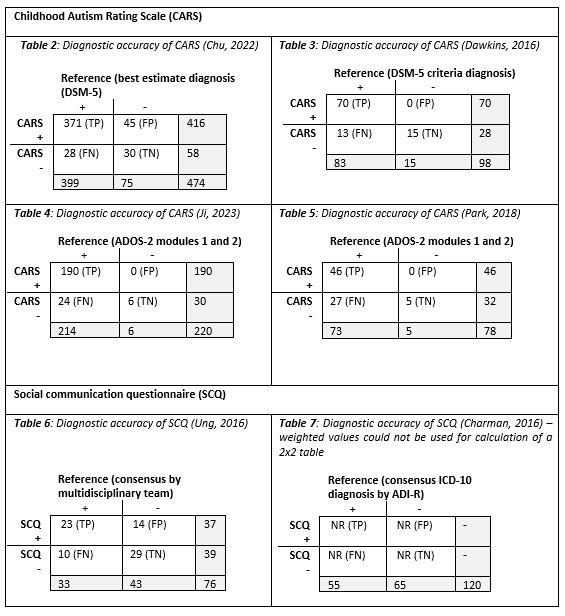
Table 2 shows the results of the CARS as summarized in Chu (2022). Regarding sensitivity, 28 out of 399 participants (7%) with ASD (according to best estimate diagnosis) were falsely identified as not having ASD by using the CARS. Regarding specificity, 45 out of 75 (60%) participants without ASD were falsely identified as having ASD. The PPV was 0.89, meaning that 45 out of 416 (11%) participants testing positive on the CARS did not have ASD. The NPV was 0.52, translating into 28 out of 58 (48%) testing negative with the CARS, did have ASD.
Results of the CARS reported in the studies by Chu, 2022; Dawkins, 2016; Ji, 2023; Park, 2018 have been summarized in tables 3 through 5.
Table 2. Diagnostic accuracy of CARS (Chu, 2022)
2. Social Communication Questionnaire (SCQ)
Two studies reported on the SCQ (Ung, 2016; Charman, 2016). The 2x2 tables are depicted in table 6 and 7.
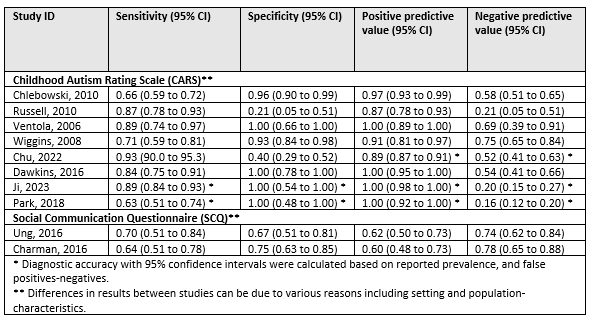
Diagnostic accuracy outcomes of both the CARS and the SCQ are depicted in table 8.
The working group defined values for sensitivity, specificity, positive predictive value (PPV) and negative predictive value (NPV) ≥ 0.70 as high; 0.60–0.70 as moderate and <0.60 as low.
Table 8. Diagnostic accuracy of CARS and SCQ
3. AQ-child, SRS, VISK/CSBQ and ASV
No suitable diagnostic accuracy studies were found for these questionnaires.
Level of evidence of the literature
1. Childhood Autism Rating Scale (CARS)
The level of evidence regarding the outcome measure sensitivity and negative predictive value started as high and was downgraded by two levels to low, because of knowledge of outcome of the index by administering the reference standard in Ji (2023) and unclear reporting on the reference standard (Dawkins, 2016) and high overall risk of bias in studies of Ventola (2006) and Chlebowski (2010) (-1, risk of bias) and 95% confidence intervals overlapping with borders for clinical relevance in 3/8 studies for sensitivity, and in 5/8 studies for negative predictive value (-1, imprecision).
The level of evidence regarding the outcome measure specificity started as high and was downgraded by three levels to very low, because of knowledge of outcome of the index by administering the reference standard in Ji (2023) and unclear reporting on the reference standard (Dawkins, 2016) and high overall risk of bias in studies of Ventola (2006) and Chlebowski (2010) (-1, risk of bias), conflicting results (-1, inconsistency) and broad confidence intervals overlapping with values <0.70 in three studies indicating high specificity (Ventola, 2006; Ji, 2023 and Park, 2018) (-1, imprecision).
The level of evidence regarding the outcome measure positive predictive value started as high and was downgraded by one level to moderate, because of knowledge of outcome of the index by administering the reference standard in Ji (2023) and unclear reporting on the reference standard (Dawkins, 2016) and high overall risk of bias in studies of Ventola (2006) and Chlebowski (2010) (-1, risk of bias).
2. Social Communication Questionnaire (SCQ)
The level of evidence regarding the outcome measures sensitivity, specificity and positive predictive value started as high and was downgraded by three levels to very low, because of high drop-out rates in Charman (2016) after stratified sampling (-1, risk of bias), conflicting results (-1, inconsistency) and a small sample and broad confidence intervals overlap with borders of clinical relevance (-1, imprecision).
The level of evidence regarding the outcome measure negative predictive value started as high and was downgraded by two levels to low, because of high drop-out rates in Charman (2016) after stratified sampling (-1, risk of bias), a small sample and confidence intervals overlap with borders of clinical relevance (-1, imprecision).
3. AQ-child, SRS, VISK/CSBQ and ASV
The level of evidence for these instruments could not be graded due to lack of data.
Zoeken en selecteren
A systematic review of the literature was performed aiming to examine the diagnostic accuracy of questionnaires for case identification (AQ-child, SRS, VISK/CSBQ, CARS, SCQ, ASV)?
| P: |
Children/youth suspected of having ASD |
| I: |
Measures for case identification, i.e. AQ-child, SRS, VISK/CSBQ, CARS, SCQ, ASV |
| C: | Not applicable |
| R: | ADI and/or ADOS, administered by an expert with experience in diagnosing ASD, based on the Diagnostic and Statistic Manual of mental disorders (DSM)/International Classification of Disease (ICD) criteria |
| O: |
Sensitivity, positive predictive value, specificity, negative predictive value |
Timing and setting: Children referred, suspicious for ASD
Relevant outcome measures
The guideline development group considered negative predictive value as critical outcome measures for decision making; and sensitivity, specificity and positive predictive value as important outcome measures for decision making.
The working group defined values for sensitivity, specificity, positive predictive value (PPV) and negative predictive value (NPV) ≥ 0.70 as high; 0.60–0.70 as moderate and <0.60 as low.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until May 17th, 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 797 hits. Studies were selected based on the following criteria:
- Systematic review (searched in at least two databases, and detailed search strategy, risk of bias assessment and results of individual studies available), randomized controlled trial or observational study comparing Questionnaires for case identification, i.e. AQ-child, SRS, VISK/CSBQ, CARS, SCQ, ASV with a reference test ADI and/or ADOS, administered by an expert in diagnosing autism, based on DSM-5(TR) criteria resulting in diagnostic accuracy measures;
- Patients aged ≤ 18 years;
- Full-text English language publication;
- Studies including ≥ 20 patients; and
- Studies according to PICRO and setting.
Initially, 68 studies were selected based on title and abstract screening. After reading the full text, 61 studies were excluded (see Table for exclusion reasons in Methods section) and seven studies were included.
Results
In total, seven studies were included in the analysis of the literature. Study characteristics and results relevant for the topic of the current review are summarized in table 1 and the evidence Table. The assessment of the risk of bias is summarized in the risk of bias Tables.
Referenties
- Charman T, Baird G, Simonoff E, Chandler S, Davison-Jenkins A, Sharma A, O'Sullivan T, Pickles A. Testing two screening instruments for autism spectrum disorder in UK community child health services. Dev Med Child Neurol. 2016 Apr;58(4):369-75. doi: 10.1111/dmcn.12874. Epub 2015 Aug 25. PMID: 26303216.
- Chu JH, Bian F, Yan RY, Li YL, Cui YH, Li Y. Comparison of diagnostic validity of two autism rating scales for suspected autism in a large Chinese sample. World J Clin Cases. 2022 Feb 6;10(4):1206-1217. doi: 10.12998/wjcc.v10.i4.1206. PMID: 35211554; PMCID: PMC8855175.
- Dawkins T, Meyer AT, Van Bourgondien ME. The Relationship Between the Childhood Autism Rating Scale: Second Edition and Clinical Diagnosis Utilizing the DSM-IV-TR and the DSM-5. J Autism Dev Disord. 2016 Oct;46(10):3361-8. doi: 10.1007/s10803-016-2860-z. PMID: 27422400.
- Dietz C, Swinkels S, van Daalen E, van Engeland H, Buitelaar JK. Screening for autistic spectrum disorder in children aged 14–15 months. II: Population screening with the Early Screening of Autistic Traits Questionnaire (ESAT). Design and general findings. J Autism Dev Disord. 2006;36(6):713–22.
- Ji SI, Park H, Yoon SA, Hong SB. A Validation Study of the CARS-2 Compared With the ADOS-2 in the Diagnosis of Autism Spectrum Disorder: A Suggestion for Cutoff Scores. Soa Chongsonyon Chongsin Uihak. 2023 Jan 1;34(1):45-50. doi: 10.5765/jkacap.220027. PMID: 36636493; PMCID: PMC9816003.
- Kaat, A. J., Shui, A. M., Ghods, S. S., Farmer, C. A., Esler, A. N., Thurm, A., ... & Bishop, S. L. (2021). Sex differences in scores on standardized measures of autism symptoms: a multisite integrative data analysis. Journal of Child psychology and Psychiatry, 62(1), 97-106.
- Lord C. Follow-up of two-year-olds referred for possible autism. J Child Psychol Psychiatry. 1995 Nov;36(8):1365-82. doi: 10.1111/j.1469-7610.1995.tb01669.x. PMID: 8988272.
- Lord, C., Charman, T., Havdahl, A., Carbone, P., Anagnostou, E., Boyd, B., ... & McCauley, J. B. (2022). The Lancet Commission on the future of care and clinical research in autism. The Lancet, 399(10321), 271-334.
- Park HS, Yi SY, Yoon SA, Hong SB. Comparison of the Autism Diagnostic Observation Schedule and Childhood Autism Rating Scale in the Diagnosis of Autism Spectrum Disorder: A Preliminary Study. Soa Chongsonyon Chongsin Uihak. 2018 Oct 1;29(4):172-177. doi: 10.5765/jkacap.180015. PMID: 32595311; PMCID: PMC7289466.
- Pham AV, Charles LC. Racial Disparities in Autism Diagnosis, Assessment, and Intervention among Minoritized Youth: Sociocultural Issues, Factors, and Context. Curr Psychiatry Rep. 2023 May;25(5):201-211. doi: 10.1007/s11920-023-01417-9. Epub 2023 Apr 1. PMID: 37004631.
- Randall M, Egberts KJ, Samtani A, Scholten RJ, Hooft L, Livingstone N, Sterling-Levis K, Woolfenden S, Williams K. Diagnostic tests for autism spectrum disorder (ASD) in preschool children. Cochrane Database Syst Rev. 2018 Jul 24;7(7):CD009044. doi: 10.1002/14651858.CD009044.pub2. PMID: 30075057; PMCID: PMC6513463.
- Sinnema, H., & van de Glind, G. (2015). JGZ richtlijn Autismespectrumstoornissen. https://www.jgzrichtlijnen.nl/alle-richtlijnen/richtlijn/autismespectrumstoornissen
- Ung, D., Johnco, C., McBride, N. M., Howie, F., Scalli, L., & Storch, E. A. (2016). Optimizing the screening of autism spectrum disorders in outpatient clinics: An examination of the Social Communication Questionnaire-Lifetime. Research in Autism Spectrum Disorders, 27, 21-28.
Evidence tabellen
Risk of bias table
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Chu, 2022 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? ASD-suspected based on CABS score. No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes, history and parent questions were
If a threshold was used, was it pre-specified? Multiple cut-off’s were used. Diagnostic accuracy in this guideline reported for scores >30
|
Is the reference standard likely to correctly classify the target condition? Yes. DSM-5 confirmed diagnosis by more than two attending physicians, based on parents’ description, child’s development history, observations and DSM-5 criteria
Were the reference standard results interpreted without knowledge of the results of the index test? Unknown
|
Was there an appropriate interval between index test(s) and reference standard? Probably yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNKNOWN
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNKNOWN |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Dawkins, 2016 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Not clear which reference standard was used exactly
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Unknown
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Unknown
Were all patients included in the analysis? Probably yes
|
Are there concerns that the included patients do not match the review question? No, children with suspected ASD
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? Unknown |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: HIGH |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNKNOWN |
|
|
Ji, 2023 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unknown, prevalence of ASD in this sample was very high which could imply an “easy to diagnose” sample
|
Were the index test results interpreted without knowledge of the results of the reference standard? High, both were performed on the same day by the same examiner. In discussion admitted that knowledge of one test could have influenced outcome of the other.
If a threshold was used, was it pre-specified? Yes, diagnostic accuracy from default (>30) were used.
|
Is the reference standard likely to correctly classify the target condition? Unknown
Were the reference standard results interpreted without knowledge of the results of the index test? High, both were performed on the same day by the same examiner. In discussion admitted that knowledge of one test could have influenced outcome of the other.
|
Was there an appropriate interval between index test(s) and reference standard? Yes, both on same day
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes
|
Are there concerns that the included patients do not match the review question? Yes, very high prevalence, probably CARS-2 was already administered when patients were very strongly suspected of ASD (prevalence: 0.97).
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No, DSM-5 diagnosis |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: HIGH |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Park, 2018 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unknown, prevalence of ASD in this sample was very high which could imply an “easy to diagnose” sample
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unknown, not reported
If a threshold was used, was it pre-specified? Yes, 30
|
Is the reference standard likely to correctly classify the target condition? Only ADOS-2 was used, authors specifically write that this does not equal a clinical diagnosis. However, this reference standard matches the predefined PICRO of this chapter.
Were the reference standard results interpreted without knowledge of the results of the index test? Unknown, but were performed on the same day and the authors did not state whether they already knew results.
|
Was there an appropriate interval between index test(s) and reference standard? Yes, assessment on the same day
Did all patients receive a reference standard? Yes, this was an inclusion criterium.
Did patients receive the same reference standard? Yes, this was an inclusion criterium
Were all patients included in the analysis? Yes
|
Are there concerns that the included patients do not match the review question? Yes, very high prevalence, probably CARS-2 was already administered when patients were very strongly suspected of ASD (prevalence: 0.94).
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNKNOWN
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNKNOWN |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
Yes, since only ADOS-2 scores based on DSM-IV have been used. |
|
Ung, 2016 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes, 15
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unknown
|
Was there an appropriate interval between index test(s) and reference standard? Unknown
Did all patients receive a reference standard? Yes, this was an inclusion criterium.
Did patients receive the same reference standard? Yes, this was an inclusion criterium.
Were all patients included in the analysis? Yes
|
Are there concerns that the included patients do not match the review question? No, referral to the clinic due to concern about child’s development matches the predefined setting.
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNKNOWN |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Charman, 2016 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unknown
Did all patients receive a reference standard? No, 21 opt out, 40 not contactable after stratified sampling.
Did patients receive the same reference standard? Yes (in depth assessment)
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Baghdadi 2023 |
study protocol (wrong publication type) |
|
DuBay 2021 |
examination how translation of ASD screening tool impact response patterns/psychometric properties, forward-back translation versus rigorous translation with curtural adaptation (wrong intervention) |
|
Havdahl 2017 |
accuracy of ADI/ADOS compared to clinical judgement (wrong intervention) |
|
Kaat 2021 |
no evaluation of diagnostic accuracy of one of the tools mentioned in the PICO, but a comparison of performance of standard ASD measures in males/females (wrong intervention) |
|
Surén 2019 |
SCQ was provided for all children in the nationwide prospective population-based cohort (n= 114552), not only in children suspected of ASD; this might result in estimates which do not match the setting in which recommendations in this guideline will be made (children suspected of ASD) (wrong setting) |
|
Zirakashvili 2022 |
Diagnostic accuracy of the ASSQ was only evaluated in the highest 10% scores, since children scoring lower did not receive final diagnostics to use as a reference. This design did not test true or false negatives. (wrong intervention, wrong reference) |
|
Diniz 2022 |
Systematic review on identification of ASD in patients with Down syndrome. Focussing on epidemiology (prevalence of ASD in patients with Down-syndrome). |
|
Hampton 2015 |
Systematic review on different screening instruments, search prior to 2014 and not reporting which reference standard was used to confirm diagnosis or in which setting the screening questionnaire was administered (insufficient reporting) |
|
Pondé 2021 |
Sensitivity/specificity was derived from a population known not to have ASD, and is LABIRINTO scale available in the Dutch language? |
|
Ruzich 2015 |
Investigating correlation of seks and occupation with AQ, no reference to ADOS/ADI/clinical expert diagnosis (wrong outcome, wrong reference) |
|
Ruparelia 2022 |
dissertation text, peerreview unknown |
|
Sobieski 2022 |
relevant tools requiring additional training were excluded (SRS) or older children (SCQ), and no information about CARS/AQ/CSBQ/VISK/ASV, also not reporting on measures of dispersion (wrong intervention) |
|
Soto 2015 |
evaluation of cultural adaption rather than diagnostic accuracy compared to a reference standard (wrong intervention) |
|
Chesnut 2017 |
Systematic review but not reporting measures of dispersion or prevalence in individual studies, thus complicating estimating the precision of found results or conducting 2x2 tables. Search period not reported, and a very broad range of settings included. Most recent study from 2013 (Brooks, 2013) |
|
Hirota 2018 |
Systematic review but not reporting measures of dispersion or prevalence in individual studies, thus complicating estimating the precision of found results or conducting 2x2 tables. |
|
Chen 2018 |
ASD was already diagnosed by inclusion (wrong population) |
|
Croft 2015 |
article not available fulltekst |
|
El-Ansary 2018 |
case-control design (wrong study design) |
|
Kaat 2023 |
SRS but no diagnostic accuracy measures, not tested to a reference/gold standard |
|
Karaminis 2022 |
majority of participants was already diagnosed with ASD at study entry (wrong population) |
|
Kidd 2020 |
majority of participants was already diagnosed with ASD at study entry (wrong population) |
|
Leung 2023 |
study on adults (wrong population) |
|
Moody 2017 |
1/3 of the participants already had an diagnosis of ASD (wrong population, wrong study design) |
|
Murray 2017 |
study on adults (wrong population) |
|
Nguyen 2019 |
case-control design (wrong study design) |
|
Park 2016 |
included onlyu participants with previous ASD diagnosis |
|
Staton 2023 |
121 referrals were screened using SCQ. Only positive screens and 10 cases recommended for following assessment received reference standard. |
|
Tsirgiotis 2022 |
Evaluates sex/gender differences in CARS2 en GARS. All included individuals were already diagnosed with ASD (wrong population) |
|
Sun 2019 |
mandarin chinese version of SRS, but non-clinical children from mainstreem group and clinical diagnosed with ASD, no group with suspected ASD (wrong population) |
|
Wong 2021 |
typical developing children (n=2005), children with known ASD (n=202) and children with ADHD, no group with suspected ASD (wrong population) |
|
Wright 2020 |
developing SRS for deaf children, but non-clinical deaf children and deaf children clinical diagnosed with ASD, no group with suspected ASD (wrong population) |
|
Yang 2023 |
children with ASD confirmed by psychiatrist and typical develloping children confirmed by psychiatrist, no children with suspected ASD (wrong population) |
|
Zarokanellou 2017 |
children with confirmed ASD or high-functioning ASD and non-clinical sample recruited from mainstream schools (wrong population) |
|
Zhou 2015 |
children with confirmed ASD and non-clinical sample recruited from general population, no children with suspected ADS |
|
Jones 2020 |
no analysis on sens or spec possible without comparison with reference standard and children in included did already have ASD diagnosis or no suspected ASD diagnosis (no reference standard) |
|
Kose 2017 |
Included cases with diagnosis of PDD, OCD or ADHD and healthy control without complains (wrong population) |
|
Stickley 2017 |
children with confirmed ASD and non-clinical sample recruited from general population, no children with suspected ADS |
|
Stordeur 2019 |
children with confirmed ASD (1), ADHD (2), ADHD+ASD (3) and typicaly developing, no children with suspected ASD (wrong population) |
|
Carruthers 2018 |
children with confirmed ASD and non-clinical sample recruited from general population, no children with suspected ADS (wrong population) |
|
Cen 2017 |
children with confirmed ASD and non-clinical sample recruited from general population, no children with suspected ADS (wrong population) |
|
Cetinoglu 2022 |
children with confirmed ASD and non-clinical sample not meeting any psychiatric disorder's diagnostic criteria, no children with suspected ADS (wrong population) |
|
Chakraborty 2022 |
Indian autism screening questionnaire and CARS as used as reference standard (wrong reference) |
|
Chen 2022 |
accuracy of communication warning behavior measured with Neuropsychological and behavioral scale (CNBS) (wrong intervention) |
|
Gulati 2019 |
development of tool: All India Institute of Medical Sciences (AIIMS)-Modified-INDT-ASD Tool. Diagnostic accuracy compared to clinical assessment in children suspected, but indian tool (wrong intervention) |
|
Guttentag 2022 |
54/176 already had prior diagnosis of ADHD (not ASD), and 48/176 had prior diagnosis of ASD, resembling a case-control study design, majority not suspected of ASD but known or known not to have ASD (wrong population) |
|
Havdahl 2016 |
recruited from two clinics based on previous diagnosis of ASD or another |
|
McDonnell 2023 |
study included 2.853 youth with ASD, no suspected ASD population (wrong population) |
|
Meng 2023 |
Four samples of which only sample 2 consisted youth, but also no sens/spec to derive from reported data (wrong reference) |
|
Miller 2019 |
No sens/spec reported or 2x2 tables enabling calculation of sens/spec/DTA (wrong outcome) |
|
Mukherjee 2015 |
evaluating indian scale for assessment of autism (ISAA), not in Netherlands (wrong intervention) |
|
Rosenberg 2018 |
data derived from earlier case-control study (wrong population) |
|
Sangare 2019 |
DTA of SCQ but population consisted of 60 autistic and 60 age and sex matched controls with neuropsychiatric disorders other than ASD (wrong population) |
|
Lyall 2021 |
retrospective study on multiple cohorts were drawed from different populations not matching the predifined PICO of this chapter (groups with increased familial risks, participants from a preterm birth cohort and participants drawn from the general population (wrong population) |
|
Avcil 2020 |
study on the Turkish version of the SRS, but not focussing on children suspected of ASD (one group with ASD DSM-IVTR, one group with intellectual disability without ASD symptoms). |
|
Barnard Brak 2016 |
retrospective study on SRS in multiple cohorts, population setting unknown (wrong population) |
|
Hashmi 2021 |
Malay version of AQ-child, no reference standard reported (wrong reference) |
|
Lyall 2022 |
Study on general population and population with suspected ASD, however study did not present seperate analysis or results for children suspected of ASD, only comparison of mean scores of the SRS per population were shown (wrong outcome) |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-05-2025
De Nederlandse Vereniging voor Autisme autoriseert de richtlijn maar niet de module ‘Vroege interventies’ omdat zij zich niet kan vinden in de inhoud.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen en jeugd met autismespectrumstoornissen. Alle werkgroepleden hebben deelgenomen aan de werkgroep om het perspectief van de vereniging te vertegenwoordigen.
Werkgroep
- Mevr. dr. Anna van der Miesen, arts-onderzoeker, Amsterdam UMC, Amsterdam, NVvP
- Mevr. dr. Annelies de Bildt, psycholoog, Accare, Groningen, NIP
- Mevr. Claudette Nouris, patiëntvertegenwoordiger, Landelijke Oudervereniging Balans
- Mevr. dr. Els Blijd-Hoogewys, klinisch psycholoog, Psychiatrie Noord, Groningen, NIP
- Mevr. dr. Fleur Velders, kinder- en jeugdpsychiater, Universitair Medisch Centrum Utrecht, Utrecht, NVvP
- Mevr. drs. Gemma Witteman, jeugdarts, Karakter kinder- en jeugdpsychiatrie, Enschede, AJN jeugdartsen
- Mevr. dr. Janneke Zinkstok, kinder- en jeugdpsychiater, Radboud Universitair Medisch Centrum, Nijmegen, NVvP
- Dhr. Jasper Wagteveld, ervaringsdeskundige, NVA
- Mevr. dr. Jopje Ruskamp, kinderarts, Universitair Medisch Centrum Utrecht, Utrecht, NVK
- Dhr. drs. Jos Boer, verpleegkundig specialist, Dimence Groep, Deventer, V&VN
- Dhr. dr. Mathieu Pater, muziektherapeut, Muziek en Therapie, Vaktherapie Nederland
- Dhr. dr. Richard Vuijk, klinisch psycholoog - psychotherapeut, SARR Autisme Rotterdam – onderdeel van Antes Parnassia Groep, Rotterdam, NIP
- Mevr. dr. Wietske Ester, kinder- en jeugdpsychiater, Curium Leids Universitair Medisch Centrum, Leiden en Sarr Autisme Rotterdam-Youz Kinder- en jeugdpsychiatrie, Rotterdam NVvP
- Dhr. prof. dr. Wouter Staal, kinder- en jeugdpsychiater, Radboud Universitair Medisch Centrum, Nijmegen, NVvP
Klankbordgroep
- Mevr. prof. dr. Maretha de Jonge, orthopedagoog-generalist, Universitair Medisch Centrum Utrecht, Utrecht, NVO
- Mevr. prof. dr. Tjitske Kleefstra, klinisch geneticus, Radboud Universitair Medisch Centrum, Nijmegen, VKGN
Met ondersteuning van
- Mevr. drs. Beatrix Vogelaar, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. drs. Laura van Wijngaarden, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dhr. drs. Toon Lamberts, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mevr. dr. Anna van der Miesen |
02-2023--04-2024: CAMH, Toronto, Canada: post-doc onderzoeker 02-2023-heden: Amsterdam UMC, lokatie VUmc, post-doc onderzoeker 04-2024-heden: GGZ inGeest, arts-assistent in opleiding tot psychiater |
* Archives of Sexual Behavior, International Journal of Transgender Health: editorial board member (onbetaald). * Faculty of General Education Initiative (GEI), World Professional Association for Transgender Health (betaald). * Scientific Committee, European Professional Association for Transgender Health (onbetaald). * Lid kerngroep Female Autism Network of the Netherlands (onbetaald).
|
* Robert Wood Johnson Foundation - Investigating Portable Components of the Netherlands Gender Affirming Care Policy to Improve Transgender Youth Health Outcomes in the United States (projectleider). * KNAW Ter Meulen beurs - Gender Diversity in a Prospective Clinical Youth Cohort: Prevalence Rates and Associations with Suicidality, Self-Harm, Mental Health Risks, and Protective Factors (projectleider). * Womenmind 2022 Postdoctoral Fellowship Competition - Sex Assigned at Birth, Gender Identity, and Gender Identity Diversity Differences in a Prospective Clinical Youth Cohort: Prevalence Rates and Associations with Suicidality, Self-Harm, Mental Health Risks, and Protective Factors (projectleider). * Discovery Fund 2022 Postdoctoral Fellowship – Declined. * Agis Innovatiefonds - Buitengewoon jezelf (geen projectleider).
* Arcus Foundation: Transgender Youth Outcomes Initiative: Understanding the Impacts of Trans Youth US State-BasedPolicies to Drive Policy and Public Perception Change (projectleider) * Womenmind 2023 Seed Funding Competition:An Intersectional Lens to Youth Wellness Hubs Ontario: Learning with Girls/Women and Gender Diverse Youth (geen projectleider) * Fonds Wetenschappelijk Onderzoek Seksualiteit:Beyond Gender-Related Medical Care: The influence of Policies, Practices, and Contextual factors on Transgender Adolescent’s Mental Health and Wellbeing (projectleider) * General Research Fund Hong Kong University:Both sides now: Expressed and perceived gender (non)conformity and psychosocial wellbeing in Chinese community children (projectleider) womenmind 2024 Seed Funding Competition: Creating a * Community-Developed Self-Advocacy Tool for Autistic Gender-Diverse Adolescents for the Promotion of Wellbeing (geen projectleider) * Canadian Institutes of Health Research: Strengthening Youth Wellness Hubs Ontario's Learning Health System through Enhancing Measurement Based Care, Data Integration and Equity-focused Practices (geen projectleider)
Alle subsidies zijn charitatief (geen sponsoring door de industrie). |
Geen restricties. |
|
Mevr. dr. Annelies de Bildt |
Psycholoog, Accare, Groningen. |
Stuurgroepvoorzitter ADOS en ADI-R
|
* ZonMw (08450012220002) Verbeteren van diagnostiek bij mensen met een matige of ernstige verstandelijke beperking (projectleider). * Auteur NL bewerking ADI-R en ADOS * ADOS en ADI-R trainer * Redacteur van een boek over autisme bij kinderen, uitgegeven in 2021, bij BSL. |
Geen restricties. |
|
Mevr. Claudette Nouris |
Patiëntvertegenwoordiger, Landelijke Oudervereniging Balans |
Geen. |
Geen. |
Geen restricties. |
|
Mevr. dr. Els Blijd-Hoogewys |
Behandel Inhoudelijk Manager, Klinisch psycholoog en senior onderzoeker bij INTER-PSY (full-time)
Per 1 januari 2025 psycholoog bij Psychiatrie Noord. |
Mede-oprichter en voorzitter FANN (Female Autism Network of the Netherlands), onbetaald Voorzitter CASS18+ (consortium voor BIG geregistreerde behandelaars van volwassenen met autisme), onbetaald Lid Autisme Jonge Kind, landelijk expertise netwerk, onbetaald Lid Alliantie Gender & GGZ, namens NIP, onbetaald Organisator Nationaal Autisme Congres, deelname in winst/verlies Diverse lezingen over autisme, betaald |
Boeken over autisme geschreven of de redactie daarvan gedaan:
Mede-aanvrager van een onderzoek NWO, Breaking the cycle: an inclusive school environment outside the classroom for adolescents with ASD (geen projectleider). |
Geen restricties. |
|
Mevr. dr. Fleur Velders |
Kinder- en jeugdpsychiater, Universitair Medisch Centrum Utrecht, Utrecht |
Nederlands Jeugd Instituut; commissielid erkenningscommissie jeugdinterventies (vacatiegelden) |
* Zorginstituut Nederland, Samen beslissen in de praktijk met kinderen, gericht op kinderen met psychische klachten (geen projectleider). |
Geen restricties. |
|
Mevr. drs. Gemma Witteman |
Jeugdarts, Karakter kinder- en jeugdpsychiatrie, Enschede
Werkzaamheden diagnostiek en behandeling van kinderen met ASS |
Geen. |
Geen. |
Geen restricties. |
|
Mevr. dr. Janneke Zinkstok |
Kinder- en jeugdpsychiater, Radboud Universitair Medisch Centrum, Nijmegen |
* Redactie Tijdschrift voor Psychiatrie (onbetaald, maar vacatiegelden) * Ethics committee internatinal society psycho genetics |
* ZonMW, COFIT-PSY project: Gevolgen van COVID-19-maatregelen voor mensen met psychiatrische aandoeningen (projectleider). * Radboudumc Principal Clinician subsidie voor innovatie project om ouders van kinderen met aangeboren ontwikkelingsstoornissen te ondersteunen (projectleider). * Agis innovatiefonds subsidie voor project om ervaringsdeskundigheid te ontsluiten voor jongeren met autism en licht verstandelijke beperking (projectleider). * ZonMW middellang - Een verloren generatie? Effecten van de COVID-19 pandemie op de mentale gezondheid van jongeren (geen projectleider)
|
Geen restricties. |
|
Dhr. Jasper Wagteveld |
Ervaringsdeskundig adviseur, Dokter Bosman |
Geen. |
Geen. |
Geen restricties. |
|
Mevr. dr. Jopje Ruskamp |
Kinderarts, Universitair Medisch Centrum Utrecht, Utrecht |
Geen. |
Geen. |
Geen restricties. |
|
Dhr. drs. Jos Boer |
Verpleegkundig specialist, Dimence Groep, Deventer
Per januari 2023 bij het Specialistisch Centrum Ontwikkelingsstoornissen (SCOS). |
Promovendus Brain Division UMC Utrecht |
Geen. |
Geen restricties. |
|
Dhr. dr. Mathieu Pater |
Muziektherapeut, ZZP. |
Geen. |
Geen. |
Geen restricties. |
|
Dhr. dr. Richard Vuijk |
Klinisch psycholoog - psychotherapeut, SARR Autisme Rotterdam – onderdeel van Antes Parnassia Groep, Rotterdam, NIP |
Eigen praktijk voor scholing AutismeSpectrumNederland. |
Auteur: Werkwijzer - Psychodiagnostiek autismespectrumstoornis volwassenen (2018) en Nederlands Interview voor Diagnostiek Autismespectrumstoornis bij volwassenen (NIDA) – Handleiding en Interview |
Geen restricties. |
|
Mevr. dr. Wietske Ester |
Kinder- en jeugdpsychiater, Youz Kinder- en jeugdpsychiatrie, SARR Autisme, Rotterdam. Associate Professor, kinder- en jeugdpasychiater, Curium-LUMC, Leiden. |
Geen. |
* Parnassia Groep, IMDAD studie, autisme, jeugd en ouders (projectleider). * Korczak stichting, Tandem studie, autisme, jeugd en ouders (projectleider). * ZonMW, Academische Werkplaats Autisme, Projectgroep 2 hulp, behandeling en medicatie. Inmiddels afgerond, mede-trekker. * Parnassia Academie, 3e PhD Tandem studie, autisme, jeugd, ouders (projectleider). * Curium-LUMC, PhD AWA; Lifelines, autisme, volwassenen (projectleider). |
Geen restricties. |
|
Dhr. prof. dr. Wouter Staal |
Kinder- en jeugdpsychiater, Radboud Universitair Medisch Centrum, Nijmegen |
* Ambasadeur NVA / balans (patiënten-vereniging) * Voorzitter Wetenschappelijke Raad, Kennis Centrum Kinder- en Jeugdpsychiatrie * Vicevoorzitter visitatie commissie TOP-GGz * Bestuurslid Nederlands Autisme Register (NAR) * Lid Autism Europe * Bestuurslid en mede oprichter DREAMS * Lid kerngroep Autisme Jonge kind * Consulent huisartsen praktijken Thermion en Oosterhout * Lid stuurgroep Pro Desing your life (RAAK, NWO) * Lid stuurgroep lectoraat JP Teunisse- ASS levensloop * Lid RINO expertgroep autisme |
* Enactive Mind Autisme: van denkwijze naar werkwijze. (NWO, RAAK) Teunisse JP, Orgassa A, Swinkels E, Leenders J, Staal WG, Tomese E, van Hunsel E, Kok L, Zandvliet S, Strijbos D. NWO (1000k) * CURE4LIFE: Development and societal impact of stem cell based genetic medicines, Staal FJT, ….Staal WG…Bartels (NWO, NWA-ORC) (5574k) * Ontregeling omringd. Een normatief-empirisch onderzoek naar morele en juridische vraagstukken bij intensieve netwerkzorg thuis voor jongeren met ernstige mentale problemen. Van Gurp JLP, van der Meer AF…Staal WG… Lindauer R (ZonMw). (200k) * Design Your Life (NWO), van Dijk J, van der Voort M, Staal WG (350k) * A multi-modal lifestyle intervention program in routine clinical care for children with mental disorders. Staal WG (main applicant), Muskens J, Rommelse N, Klip H, Cahn W, J Deenink,Oomen M, Pillen S, Roosenstiel I, Schene A. (500k) * Personalised interventions to support active leisure time for social (re)integration in psychosis. (NWO, MOVE-2). Cahn W, van Meijel B, Backx F, Schnack H, Deenink J, Swildens W, Staal WG, Koomen L, Jorg F, Scheepers F. (350k) * Pegasus: Equine-assisted Therapy for therapy-resistant adolescents with autism spectrum disorders, a multiple baseline ABA-study’ (ZonMW).Rommelse N, den Boer J, Klip H, Staal WG, Blonk A, Henke K, van Noort E, Tielkens M, van Rosmalen S. (440k) * ProMiSe: Tackling defective Prefrontal development in Mendelian Syndromes (NWO) . Kolk S, Staal WG, Kleefsta T, Egger J, Swaab H, Santen G, Jacobs F. (1600k) * Perspectief wisseling van leerkracht en in het omgaan met leerlinggedrag in de klas (NRO- NWO). Walraven M, Staal WG, Ottenheym A enTruijens P (400k) |
Geen restricties. |
|
Klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Tjitske Kleefstra |
Klinisch geneticus Radboudumc |
Werkgroeplid richtlijn Etiologische diagnostiek bij kinderen met een ontwikkelingsachterstand/ verstandelijke beperking (NVK) |
Ik heb extern gefinancierd onderzoek (ZonMW) maar dat betreft fundamenteel onderzoek |
Geen restricties |
|
Maretha de Jonge |
Hoogleraar Orthopedagogiek, Universiteit Leiden |
- Hoofdopleider OG opleiding regio Leiden/R'dam/Utrecht, Stichting BOPP-WEST en RINOgroep, gedetacheerd door Universiteit Leiden waardoor geen extra inkomsten - initiator/oprichter en adviseur van de Stichting behandeling selectief mutisme, onbezoldigd - Lid wetenschappelijke adviesraad Kenniscentrum Kinder en Jeugdpsychiatrie, onbezoldigd - Initiator en voorzitter Stichting Nour, onbezoldigd - Bestuurslid Stichting Jong, onbezoldigd - Lid landelijke stuurgroep ADI-R en ADOS trainingen en docent in ADI-R en ADOS-2 trainingen, uurvergoeding komt ten goede aan researchbudget persoonlijk in te zetten researchgelden, Universiteit Leiden - Vertaler van ADI-R en ADOS-2, auteursvergoeding (2,5% van de opbrengsten van de uitgeverij Hogrefe) komt ten goede aan mijn oud-werkgever UMC Utrecht |
Grotendeels 1e geldstroom, kleine subsidie van het Leids Universiteits Fonds/ Tiny & Anne van Doorne Fonds 5000,- |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de verenigingen Landelijke Oudervereniging Balans en Nederlandse Vereniging voor Autisme te betrekken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop “Waarden en voorkeuren van patiënten”). De inhoud van de modules ‘Vroege interventies’ en ‘Randvoorwaarden’ zijn tevens in conceptversie besproken binnen een focusgroep met deelnemers vanuit MIND, het Nederlands Autisme Register (NAR), De Nederlandse Vereniging voor Autisme (NVA) en Landelijke Oudervereniging Balans. Eventueel aangeleverde commentaren zijn meegewogen in de eindformuleringen.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Diagnostiek en het gebruik van vragenlijsten ter indicatie voor verder onderzoek naar autisme. |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet of dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft.
Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor kinderen en jongeren met autisme. Tevens zijn er knelpunten aangedragen door de Academische werkplaats autisme (AWA), Beroepsvereniging van professionals in sociaal werk (BPSW), Inspectie Gezondheidszorg en Jeugd (IGJ), Landelijke Beroepsgroep voor Begeleiders Onderwijs (LBBO), Landelijke Beroepsgroep Remedial Teachers (LBRT), MIND,
Nederlands Huisartsen Genootschap (NHG), Nederlandse Associatie Physician Assistants (NAPA), Nederlandse Federatie van Universitair Medische Centra (NFU), Nederlandse Vereniging Artsen Verstandelijk Gehandicapten (NVAVG), Nederlandse Vereniging van Pedagogen en Onderwijskundigen (NVO), Nederlandse Vereniging van Ziekenhuizen (NVZ), Praktijkondersteuners geestelijke gezondheidszorg (POH-ggz), Samenwerkende Topklinische opleidingsZiekenhuizen (STZ), Vereniging Innovatieve Geneesmiddelen (VIG), Vereniging Klinische Genetica Nederland (VKGN), Vereniging Nederlandse Gemeenten (VNG), Zelfstandige Klinieken Nederland (ZKN), Zorginstitituut Nederland (ZiNL) en Zorgverzekeraars Nederland (ZN) via een enquête. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd uit oogpunt van praktische uitvoerbaarheid een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals beschikbaarheid, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Referenties
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.