Monitoring van auditieve ontwikkeling
Uitgangsvraag
Welke auditieve ontwikkelingsaspecten moeten worden gemonitord bij slechthorende kinderen van 0-4 jaar en wanneer en hoe moet dit gebeuren?
Aanbeveling
Aanbeveling-1
- Bespreek met ouders het nut van het monitoren van de auditieve ontwikkeling.
- Zorg dat de auditieve ontwikkeling van alle kinderen in het audiologische zorg traject 0-4 jaar met vragenlijsten wordt gemonitord. Doe dit binnen het Audiologisch Centrum of maak afspraken met de vroegbehandeling hierover.
- Neem deze vragenlijsten bij voorkeur bij iedere periodieke controle af
- Bespreek de uitkomsten met ouders.
- Evalueer de uitkomsten van de vragenlijsten altijd in samenhang met overige diagnostiek (naar het gehoor en naar de spraaktaalontwikkeling en de nonverbale ontwikkeling) en beoordeel op basis van alle uitkomsten samen of er reden is tot wijziging van het beleid zoals het starten van het toepassen van hoortoestellen, het wijzigen van de instellingen daarvan of het inzetten van een adviestraject voor cochleaire implantatie.
Aanbeveling-2
- Gebruik bij kinderen tot de leeftijd van maximaal 2 jaar (ontwikkelingsleeftijd) de LittlEARS vragenlijst.
- Ga over op het gebruik van de PEACH-vragenlijst als de afkapwaarde van 28 punten op de LittlEARS is bereikt.
- Gebruik eventueel items uit de IT-MAIS over onderwerpen waarover meer duidelijkheid nodig is als aanvulling.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor deze module is een systematische search uitgevoerd. Er zijn vier studies gevonden die voldoen aan de PECO. Door de methodologische heterogeniteit en verschillen in de studiepopulaties, is het niet mogelijk om de resultaten van de studies te poolen, of om de bewijskracht te graderen middels GRADE. In de geïncludeerde studies zijn drie meetinstrumenten gebruikt bij kinderen jonger dan vier jaar: LittlEARS, PEACH, en IT-MAIS.
De studies laten zien dat de mate van gehoorverlies correleert met de mate van prestatie op de verschillende testen. Hoe groter het gehoorverlies, hoe hoger het risico op een achterstand in de auditieve ontwikkeling.
Het monitoren van de auditieve ontwikkeling door middel van subjectieve uitkomstmaten op basis van vragenlijsten lijkt een goede aanvulling op audiologische diagnostiek naar de detectie van geluiden en eventueel verstaan, en naast diagnostiek van de spraak- en taalontwikkeling. Subjectieve monitoringsinstrumenten worden al veel ingezet voor het monitoren van de baat van hoorhulpmiddelen maar ook in de besluitvorming of hoorhulpmiddelen nodig zijn. De kracht van dergelijke instrumenten (vooral in de vorm van vragenlijsten) is dat ze niet het auditieve functioneren in de testsituatie in beeld brengen maar juist inzicht geven in het functioneren in het dagelijks leven en het beeld dat ouders daarvan hebben (Bagatto et al., 2011). Er zijn verschillende gevalideerde vragenlijsten in omloop die zich hiervoor lenen. Met deze uitgangsvraag willen we nagaan welke aspecten van de auditieve ontwikkeling gemonitord moeten worden en we gaan na welke vragenlijsten zich hiervoor lenen en voor welke specifieke doelgroep.
Voor ondergenoemde vragenlijsten geldt dat de resultaten meegenomen moeten worden in de audiologische zorg en het maken van keuzes daarin. Het is echter goed mogelijk de vragenlijsten te laten afnemen door de vroegbehandeling, mits de resultaten worden gedeeld.
Bagatto et al. (2011) hebben in een overzichtsartikel de op dat moment meest gebruikte vragenlijsten en interviewinstrumenten bestudeerd. Ze keken naar een aantal aspecten van de vragenlijsten, te weten het concept (meet het instrument inderdaad relevante zaken?), of er normering is voor normaalhorende en slechthorende kinderen, al dan niet met hoorhulpmiddelen (maar ze keken niet naar in hoeverre de groepen door de vragenlijsten onderscheiden konden worden), het meetmodel en risico’s op bias, de administratieve last op basis van het invullen en verwerken, de betrouwbaarheid en validiteit en de mate waarin de instrumenten beschikbaar zijn (b.v. in andere talen). Bagatto et al. (2011) kwamen op basis van hun analyses tot een (consensus) voorstel voor het gebruik van de LittlEARS en de PEACH-rating scale in de Canadese richtlijnen voor audiologische zorg bij jonge kinderen van 0-6 jaar. Vanwege de door Bagatto et al. (2011) gekozen systematiek kunnen we hun bevindingen niet meenemen in de GRADE-waardering die ten grondslag ligt aan de huidige module. We nemen hun bevindingen echter wel mee in de overwegingen die we hier maken.
Omdat het genoemde paper van Bagatto et al.(2011) inmiddels 13 jaar oud is hebben we in onze literatuurstudie gekeken of er nieuwere meetinstrumenten zijn waarvoor meer wetenschappelijk bewijs is en/of die de conclusies uit 2011 doorkruisen. We hebben deze echter niet gevonden.
1. LittlEARS
Persson (2020) gebruikte de Zweedse versie van de LittlEARS vragenlijst om de auditieve ontwikkeling te monitoren van 9 kinderen met matig gehoorverlies, gerevalideerd met hoortoestellen, en 29 normaalhorende kinderen. Zij stelden vast dat er geen verschillen waren tussen de groepen bij de leeftijd van 10, 18 en 24 maanden. De scores van de kinderen met gehoorverlies vielen binnen de normatieve range van het testinstrument, met uitzondering van de scores van één deelnemer. Diens langzamere auditieve ontwikkeling kan volgens de auteurs gerelateerd zijn aan de relatief latere start met het effectief dragen van de hoortoestellen (bij leeftijd van 10 maanden, ondanks eerste fitting bij 6 maanden) en de beperkte draagduur van de hoortoestellen (4.45 uur per dag). Daarnaast is bekend dat de uitkomsten op de LittlEARS vragenlijst gecorreleerd zijn met de vroege taalontwikkeling (Persson et al., 2019). Lagere scores op de LittlEARS vragenlijst kunnen ook verklaard worden door zwakkere taalvaardigheid. Draagduur van de hoortoestellen en hoorbaarheid met hoortoestellen correleerden niet significant met de uitkomsten van de LittlEARS, waarschijnlijk als gevolg van de kleine sample size en de grote range in draagduur en hoorbaarheid met hoortoestellen, bij een kleine range in scores op de LittlEARS. Daarnaast bleek eerder uit het onderzoek van Bagatto et al. (2011) dat de LittlEARS minder sensitief is bij kinderen met een lichter gehoorverlies.
McCreery et al. (2015) vinden dat kinderen met gehoorverlies hoger scoren op de LittlEARS vragenlijst als er sprake is van een hogere hoorbaarheid met hoortoestellen, meer hoortoestelgebruik, betere taalscores en een beter spraakverstaan. Ze vragen zich echter af of de LittlEARS-vragenlijst voldoende gevoelig is omdat veel van de onderzochte kinderen op de leeftijd van 18 of 24 maanden een score behaalden die gelijk of groter was dan de afkapwaarde van 28. Ze merken op dat hierbij een rol kan spelen dat de kinderen uit de onderzoekspopulatie afkomstig waren uit gezinnen met een sociaaleconomische status die hoger was dan gemiddeld in de Verenigde Staten. Ze vonden echter ook dat het opleidingsniveau van de moeder geen voorspeller was voor de LittlEARS-uitkomsten. Wij denken dat ook het feit dat ze voor de statistische analyse keken naar de uitkomsten op de leeftijd van 18 en 24 maanden een rol speelt in hun bevindingen. De afkapwaarde van 28 punten van de LittlEARS is immers precies de waarde die op basis van de normering van de vragenlijst overeenkomt met de ondergrens voor kinderen van 24 maanden oud. Juist de kinderen die deze score niet behaald hebben, zowel op jongere leeftijd als 1:8 maanden als de kinderen die tot 24 maanden de afkapscore niet behalen, zouden geanalyseerd moeten worden om na te gaan of hun score voorspeld kan worden uit factoren als kwaliteit en kwantiteit van de hoorrevalidatie of kindfactoren.
Dat veel kinderen, ook met gehoorverlies, hoog scoren op de LittlEARS-vragenlijst wordt ook door andere auteurs gesignaleerd (bijvoorbeeld Visram et al., 2022 en referenties daarin).
Helaas is longitudinale toepassing van de LittlEARS-vragenlijst maar beperkt onderzocht, terwijl het instrument zich daar juist goed voor leent en ouders en zorgverleners in staat stelt om de eigen ontwikkeling van het kind te monitoren.
De puntenscore van de LittlEARS vragenlijst kan uitgedrukt worden in een “hoorleeftijd” die verwijst naar de leeftijd die normaal ontwikkelende goedhorende kinderen gemiddeld hebben bij dezelfde score. Deze hoorleeftijd kan vergeleken worden met de kalenderleeftijd van het kind, óf met het aantal maanden dat ze redelijkerwijs zijn gestart met horen. Dat laatste wordt soms ook “hoorleeftijd” genoemd. Wij raden dit af en adviseren de term “hoorleeftijd” te reserveren voor de uitkomst van de LittlEARS om verwarring te voorkomen, zie ook module Monitoring van algehele en spraaktaalontwikkeling.
Samenvattend concluderen we dat er weinig bewijs is voor een strikte aanbeveling van het gebruik van de LittlEARS. Subjectieve monitoring van het auditief functioneren, zeker longitudinaal, is echter een nuttige aanvulling op audiologische diagnostiek naar de detectie van geluiden en eventueel verstaan en naast diagnostiek van de spraak- en taalontwikkeling.
We kunnen geen strikte aanbeveling geven voor de frequentie van afname. Bij frequente bezoeken aan het Audiologisch Centrum tijdens de startfase van de audiologische zorg zal afname bij ieder bezoek niet nodig zijn. Signalen van goede of juist van stagnerende ontwikkeling kunnen dan leidend zijn bij het besluit de vragenlijst af te nemen. Als bij een stabiele hoorrevalidatie de bezoekfrequentie afgenomen is tot een keer per 6 maanden is afname bij ieder bezoek raadzaam. De vragenlijst kan ook gebruikt worden om ouders inzicht te geven in het auditief functioneren. De LittlEARS-vragenlijst is voor deze doelen zeker bruikbaar en wordt wereldwijd gebruikt. De uitkomsten moeten echter altijd geïnterpreteerd worden in samenhang met de overige diagnostische uitkomsten.
2. PEACH
Persson (2020) gebruikte de Zweedse versie van de PEACH om het auditieve functioneren te monitoren van 9 kinderen met matig gehoorverlies, gerevalideerd met hoortoestellen, en 29 goedhorende kinderen. Zij vonden significante verschillen tussen de kinderen met en zonder gehoorverlies op de PEACH-subschaal ‘verstaan in ruis’ bij de leeftijd van 30 en 36 maanden. Hoewel er geen significante correlaties werden gevonden tussen hoorbaarheid met hoortoestellen en globale auditieve performance, zoals gemeten met de PEACH-totaalscore, correleerde hoorbaarheid met hoortoestellen wel sterker met de PEACH-subschaal ‘verstaan in ruis’. Dit ondersteunt de conclusie dat spraakverstaan in ruis uitdagend is voor kinderen met gehoorverlies, en dat voldoende hoorbaarheid met hoortoestellen nodig is voor het verstaan in ruis.
McCreery et al. (2015) vonden dat een kleiner gehoorverlies aan het beste oor, hogere hoorbaarheid met hoortoestellen en betere receptieve taalscores geassocieerd zijn met hogere PEACH-scores. Hierbij werden de subschalen voor het functioneren in rumoer en in stilte niet afzonderlijk geanalyseerd. In tegenstelling tot de LittlEARS-vragenlijst is er bij de PEACH rating scale minder sprake van een plafondeffect.
Samenvattend lijkt de PEACH-vragenlijst, hoewel hiervoor geen strikt bewijs werd gevonden, bruikbaar voor het in kaart brengen van het auditief functioneren van jonge kinderen die afkapscore van de LittlEARS-vragenlijst hebben behaald en/of voor kinderen tussen de 2 en 4 jaar oud. Ook voor de PEACH-vragenlijst geldt dat de uitkomsten moeten altijd geïnterpreteerd worden in samenhang met de overige diagnostische uitkomsten. De vragenlijst kan ook gebruikt worden om ouders inzicht te geven in het auditief functioneren.
We kunnen geen strikte aanbeveling geven voor de frequentie van afname. Bij frequente bezoeken aan het Audiologisch Centrum tijdens de startfase van de audiologische zorg zal afname bij ieder bezoek niet nodig zijn. Signalen van goede of juist van stagnerende ontwikkeling kunnen dan leidend zijn bij het besluit de vragenlijst af te nemen. Als bij een stabiele hoorrevalidatie de bezoekfrequentie afgenomen is tot een keer per 6 maanden is afname bij ieder bezoek raadzaam.
3. IT-MAIS
Yang et al. (2020) gebruiken de IT-MAIS om de vroege auditieve ontwikkeling te evalueren van baby's en peuters met een goed gehoor, aangeboren en permanent eenzijdig gehoorverlies, en aangeboren en permanent tweezijdig licht gehoorverlies. Zij vonden geen verschillen tussen de groepen op de totaalscore van de IT-MAIS en op de items met betrekking tot detectie van geluiden in het dagelijks leven. De groepen verschilden wel van elkaar in hun scores op items m.b.t. de discriminatie en identificatie van geluiden. Vergelijking tussen groepen onderling liet zien dat de groep kinderen met eenzijdig gehoorverlies op deze items significant lager scoorde dan de groep goedhorende kinderen. Wat preverbale vocalisaties betreft, scoorden zowel de kinderen met eenzijdig gehoorverlies als licht tweezijdig gehoorverlies significant lager dan de groep goedhorende kinderen. Yang et al. vonden gelijkenissen in het verloop van de vroege auditieve ontwikkeling in de drie groepen. De snelheid van de ontwikkeling varieerde echter tussen de groepen. De vroege auditieve ontwikkeling verliep bij goedhorende kinderen sneller dan bij kinderen met gehoorverlies, en bereikte een plafond rond de leeftijd van 23 maanden. Bij kinderen met een eenzijdig gehoorverlies werd dit plafond bereikt bij 35 maanden, bij kinderen met een tweezijdig licht gehoorverlies bij 40 maanden. Het verloop van de auditieve ontwikkeling van kinderen met een eenzijdig gehoorverlies lag tussen die van de goedhorende en tweezijdig slechthorende kinderen, en dan dichter bij de laatstgenoemde.
We concluderen dat de IT-MAIS op itemniveau verschillen in de auditieve ontwikkeling kan vaststellen tussen groepen kinderen met een goed gehoor, eenzijdig gehoorverlies en tweezijdig licht gehoorverlies, terwijl de totaalscore deze verschillen onvoldoende reflecteert.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het kan voor ouders prettig zijn als er naast gestructureerde testen ruimte is voor vertellen over de eigen ervaringen van het auditieve functioneren in de dagelijkse praktijk.
Kosten (middelenbeslag)
We hebben geen kosteneffectiviteitsstudie gedaan. De kosten voor het afnemen van deze vragenlijsten zijn nihil tot gering.
Aanvaardbaarheid, haalbaarheid en implementatie
Hoewel het afnemen van de vragenlijst enige tijd kost, verwachten we dat dit goed in te passen is in een standaard spreekuur, bijvoorbeeld tijdens de technische controle van de hoorhulpmiddelen.
Rationale van aanbeveling-1: weging van argumenten voor en tegen de interventies
Hoewel er geen strikt bewijs werd gevonden dat vragenlijsten die de auditieve ontwikkeling in kaart brengen kinderen met gehoorverlies van normaalhorende kinderen kunnen onderscheiden denken wij dat ze een nuttig aanvulling op de audiologische diagnostiek zijn.
Naast het meten en vergelijkbaar maken (longitudinaal of ten opzichte van leeftijdsgenoten) van de auditieve ontwikkeling biedt het afnemen van genoemde vragenlijst een goede mogelijkheid om inzicht te krijgen in het zicht van ouders/verzorgers op de auditieve ontwikkeling. Het afnemen van de vragenlijst kan een aanknopingspunt zijn voor het verstrekken van adviezen. Ook kan het afnemen van dergelijke vragenlijsten worden gezien in het verlengde van de anamnese in de vorm van een gestructureerde uitvraag.
Rationale van aanbeveling-2
Op basis van literatuuronderzoek lijken de LittlEARS-vragenlijst en de PEACH rating scale, eventueel aangevuld met items uit de IT-MAIS het meest geschikt om de auditieve ontwikkeling van slechthorende kinderen in het dagelijks leven in kaart te brengen. De verrichte literatuuranalyse leverde voor geen van bovengenoemde vragenlijsten strikt bewijs op dat deze voldoende onderscheidend vermogen hebben om kinderen met (bepaalde maten van) gehoorverlies, al dan niet gerevalideerd, te onderscheiden van normaalhorende kinderen. Wel vonden we voldoende handvatten om te concluderen dat de LittlEARS, de PEACH en de IT-MAIS nuttige aanvullingen kunnen zijn op audiologische diagnostiek en onderzoek naar de spraak- en taalontwikkeling om de ontwikkeling van slechthorende kinderen te monitoren. Wij nemen het advies van Bagatto et al. (2011) om de LittlEARS en de PEACH rating scale op te nemen in de Canadese richtlijnen voor audiologische zorg bij jonge kinderen van 0-6 jaar dan ook over in deze richtlijn. Items uit de IT-MAIS kunnen eventueel in aanvulling op de LittlEARS-vragenlijst en de PEACH rating scale worden uitgevraagd om specifieke aspecten van het auditief functioneren waarover meer duidelijkheid nodig is verder in kaart te brengen.
Onderbouwing
Achtergrond
Gehoorverlies kan een negatief effect hebben op de ontwikkeling van kinderen. Het risico op negatieve effecten en de mate waarin deze optreden, is o.a. afhankelijk van de mate waarin toegang tot auditieve, talige en sociaal-emotionele input wordt beïnvloed door het gehoorverlies. Periodieke monitoring van verschillende aspecten van de ontwikkeling in een multidisciplinair team (of, in overleg, door de vroegbehandeling) kan negatieve effecten van gehoorverlies op de ontwikkeling (mogelijk) voorkomen of beperken, door tijdige interventie. Deze zoekvraag leidt tot aanbevelingen m.b.t. welke auditieve ontwikkelingsaspecten dienen te worden gemonitord en wanneer en hoe deze dienen te worden onderzocht.
Auditieve ontwikkeling is het proces waarbij kinderen geleidelijk het vermogen ontwikkelen om geluiden waar te nemen, te verwerken en leren er op te reageren. De ontwikkeling gebeurt in een aantal fasen: detectie, discriminatie, identificatie en begrip. We richten ons in deze module uitsluitend op instrumenten die de ontwikkeling van deze fasen meten op basis van informatie van ouders via vragenlijsten. We beschrijven dus niet welke audiometrische detectie-, discriminatie-, identificatie- en spraakverstaansmetingen verricht kunnen worden omdat we met betrekking tot die diagnostiek geen knelpunt signaleerden.
Conclusies / Summary of Findings
|
No GRADE |
Due to the absence of multiple comparative studies, no GRADE could be performed on effect of hearing loss on auditory development (measured with LittlEARS, PEACH, or IT-MAIS) when compared with children without hearing loss aged 0-4 years. |
Samenvatting literatuur
Description of studies
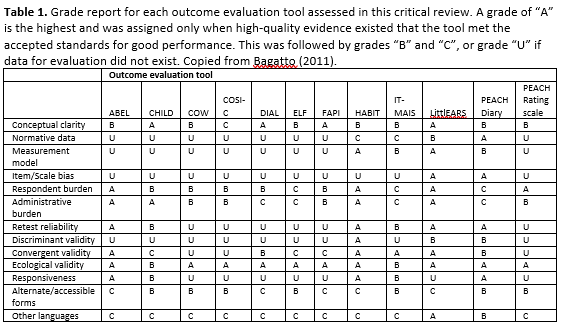
Bagatto (2011) published a critical review of audiological outcome measures for infants and children. Subjective outcome evaluation tools that measure auditory-related behaviors in children from birth to 6 years of age were critically appraised. Subjective outcome evaluation tools that measure auditory related behaviors for the pediatric population were located in several domains including health-related electronic databases (CINAHL, PubMed; 2008 and 2009), visually scanning reference lists from relevant studies, hand-searching key journals and conference proceedings, searching relevant internet resources, contacting experts in the area including the Network of Pediatric Audiologists of Canada, and citation searching. The following selection criteria were used: age range = birth to 6 years, questionnaire- or interview-based, parent/caregiver respondent, audiologist administered and scored, auditory-related outcomes measured, and application to infants and children who wear hearing aids. The following aspects were evaluated: conceptual clarity, normative data, measurement model, item/scale bias, respondent burden, administrative burden, retest reliability, discriminant validity, convergent validity, ecological validity, responsiveness, alternate/accessible forms, and other languages.
McCreery (2015) performed a study to examine effects of variability in children’s auditory experience on parent-reported auditory skills questionnaires and on speech recognition in quiet and in noise, for a large group of children who were followed as part of the Outcomes of Children with Hearing Loss study. All the children and parents involved in the study were recruited as part of the OCHL investigation. They gathered data on amplification, speech recognition, and parental ratings of auditory development from 306 children with congenital hearing loss (CHH). To provide a comparison, information was also collected from 185 children with typical hearing (CNH). The better-ear Pure Tone Average (PTA) at 500, 1000, and 2000 Hz for the CHH group ranged from 20 to 92.5 dB HL during the study, with a mean of 48.5 dB and a standard deviation of 14.4 dB. Of the 306 CHH, 292 were fitted with air conduction hearing aids, while seven used bone conduction devices. Additionally, seven children with mild hearing loss did not utilize any hearing aids. Subsequently, ten children received cochlear implants after enrollment in the study. Only the data collected prior to cochlear implantation were included in the analysis for those children. This study adopted an accelerated longitudinal approach. Unlike traditional single-cohort longitudinal designs, the accelerated longitudinal method involves recruiting children at various ages, facilitating a larger participant pool and allowing for a broader examination of developmental stages. Children and their families underwent an initial baseline assessment, followed by biannual visits for those under 2 years old and annual visits for those aged 2 and above. Participation in the study was maintained for up to 4 years or until the child reached 9 years of age, whichever occurred first. The effectiveness of hearing aid (HA) in transmitting speech was evaluated through probe microphone assessments conducted at each visit. These results were then compared with Desired Sensation Level Targets. Aided SII was measured. The amount of hearing aid (HA) usage on a daily basis was gauged through parental completion of an HA utilization questionnaire (Moeller et al., 2009; Walker et al., 2013; accessible at ochlstudy.org) during every visit. This questionnaire encompassed an assessment of the average hours of HA usage per day along with the extent of HA usage across various listening scenarios. Auditory development was measured by completing either the LittlEARS questionnaire (Tsiakpini et al. 2004) or the PEACH Rating Scale (Ching and Hill, 2007) or the SSQ questionnaire (Gatehouse and Noble 2004). Parents completed the LittlEARS questionnaire (35 questions designed to evaluate a child's auditory development as well as selected expressive and receptive language skills) during the 12-month, 18-month, and 2-year study visits. If a child achieved a score of 28 or higher on the LittlEARS, they were not administered the test at the subsequent study visit. This cutoff score of 28 indicates that the child has attained the maximum level of performance on the assessment. The PEACH rating scale is a questionnaire that assesses children’s listening performance in a wide range of communicative situations, including specific questions about listening in quiet and in background noise. The PEACH rating scale has 13 questions, including one question about HA use, one question about tolerance for loud sounds, six questions about quiet listening situations, and five questions about listening situations with background noise. The Speech, Spatial, and Qualities (SSQ) of Hearing Scale (Gatehouse& Noble 2004) was administered to the parents of CHH at 4-, 6- and 8-year-old study visits. Because of this choice of ages for administering the SSQ, which falls outside of the range of ages of children considered in this guideline, we have not further looked into these results.
Persson (2020) investigated hearing aid use, auditory development, and auditory functional performance in Swedish children with moderate hearing loss during the first 3 years. Participants were recruited through the Hearing and Balance Clinic at Karolinska University Hospital during 2015–2016. Children diagnosed with bilateral congenital sensorineural HL (better ear four-frequency pure-tone average 21–69 dB HL) and amplified with behind-the-ear HAs < 6 months of age were invited to participate. Children were excluded if they presented with additional disabilities and/or syndromes and one of the parents had to be native Swedish speaking. There were 38 children diagnosed with sensorineural bilateral HL through universal newborn hearing screening (UNHS) during the recruitment period of which 15 children fulfilled the criteria, and parents of 14 children gave their consent to participate in the study. During the course of the study, five children were excluded due to progression of HL, which resulted in cochlear implantations (n = 2), relocation (n = 1), no HA use (n = 1), and loss to follow-up (n = 1). The remaining nine children were fitted with HAs at a mean age of 5.1 months (range: 3.2–10 months). The initial fitting was based on auditory brainstem responses (click), and the HAs were fit to DSL Version 5.0 targets and fine-tuned. Real-ear measurements were used, which were simulated in a test box by connecting the HA to a 2-cc coupler in the real-ear measurement (Interacoustics Affinity). In cases where real-ear measurements could not be completed, average measures were used.
A reference group of CNHs (n = 30) were recruited from two well-baby clinics. Participating children entered the study between the ages of 0.5 and 4 months (M = 2). One child in the reference group relocated, resulting in 29 children (15 girls, 14 boys).
The CHL were followed according to Karolinska University Hospital’s clinical protocol with air- and bone conduction thresholds obtained at 500, 1000, 2000, and 4000 Hz (MADSEN Astera2, GN Otometrics A/S) with insert earphones (Otometrics Oto insert ER-3A from Etymotic Research Inc.) and bone oscillator (Radioear B71). In cases where a complete audiogram was not collected, the audiogram nearest at the ages of 10, 18, 24, 30, and 36 months was used. All CNH had passed the UNHS and underwent hearing screening at the ages of 10, 18, 24, and 36 months with the same equipment as the CHL. Insert earphones were used. The number of hours of HA use was collected through datalogging technology of the HAs and parental reports at the ages of 10, 18, 24, 30, and 36 months. The speech intelligibility index (SII) was calculated with the Situational Hearing Aid Response Profile software Version 7 (American National Standards Institute, 1997) for each participant. All parents completed the Swedish version of the LittlEars Auditory Questionnaire (LEAQ) (Persson et al., 2019) from individual study entry and every second month until 24 months of age. Data on functional auditory performance were collected through the Swedish version of the PEACH (Brännström et al., 2014) from all children at the ages of 18, 24, 30, and 36 months.
Yang (2020) performed a study to assess the influence of congenital and permanent unilateral hearing loss (UHL) on early prelingual auditory development (EPLAD) of infants and toddlers, measured with the Infant-Toddler Meaningful Auditory Integration Scale (IT-MAIS) tool. Infants and toddlers under 3 years old, who visited the Hearing Center between September 2018 and June 2019 and met the inclusion criteria, were enrolled in the study. Based on their binaural hearing grades, children were initially categorized into three groups: 1) Bilateral Normal Hearing (BNH), 2) Unilateral Hearing Loss (UHL), and 3) Bilateral Mild Hearing Loss (BMHL). The inclusion criteria for the BNH group were as follows: 1) passing the universal newborn hearing screening bilaterally, 2) absence of any risk indicators for hearing loss, 3) no reports of hearing loss from parents or professionals, and 4) normal functioning in other physiological systems. Most children in the BNH group attended the center for routine health check-ups. Unilateral Hearing Loss (UHL) was characterized by one ear having all tested frequencies (0.5, 1, 2, and 4 kHz) equal to or less than 25 dB HL, while the other ear exhibited an average pure tone threshold (PTA) across these frequencies exceeding 25 dB HL. Bilateral Mild Hearing Loss (BMHL) was defined as a bilateral PTA ranging from 26 to 40 dB HL. In both the UHL and BMHL groups, children were included based on the following criteria: 1) having permanent hearing loss without fluctuations, and 2) completing both the auditory test battery and IT-MAIS assessment. Children with potential fluctuations in hearing loss, identified impairments in other physiological systems, or diagnosed with auditory neuropathy spectrum disorder were excluded to ensure the consistency of effects on IT-MAIS assessment. IT-MAIS is a widely used structured interview to assess EPLAD of children before 3 years old. It comprises 10 items, of which one was excluded in this study. As the participants were not wearing any rehabilitation devices, item 1 in ITMAIS, referring
to the reliance on device, was not suitable and excluded. The second item evaluates the preverbal vocalization behaviors, items 3 to 6 assess the ability to detect sound in daily lives, and the last four items assess the capacity to discriminate and identify sound. Prior to the IT-MAIS assessment, parents received instructions to observe their children's auditory behaviors for approximately one week. Instructions were sent via a social networking app, WeChat. The 9-item IT-MAIS assessment was administered by a qualified and experienced auditory technician. Concurrently, demographic data and relevant medical information of participants were collected. Following the completion of the IT-MAIS assessment, the auditory test battery was conducted for participants in the Unilateral Hearing Loss (UHL) and Bilateral Mild Hearing Loss (BMHL) groups. Since the majority of the participants were under 6 months old, hearing grades were determined based on tone burst auditory brainstem response results. Routine procedures such as otoacoustic emission and acoustic immittance tests were performed, and pediatric audiometry was conducted if children were cooperative.
Bagatto et al. (2011) conducted a review of audiological outcome measures. Twelve outcome evaluation tools with specified criteria were identified prior to assigning grades for thirteen psychometric and feasibility characteristics (Andresen, 2000). Results (Table 1) indicated that four out of the 12 tools received high grades in most of the characteristics and of these four, only two would be considered clinically feasible within an outcome evaluation guideline for infants and young children.
In light of this critical review, the LittlEARS Auditory Questionnaire and the PEACH Rating Scale scored most favorably in the majority of the review categories. To ensure the target age range from birth to 6 years is properly represented for the outcome evaluation guideline, both the LittlEARS and PEACH Rating Scale were chosen to be included. The LittlEARS targets children from birth through the first two years of hearing and the PEACH items appear to target toddlers and older children. Therefore, it is possible that a guideline could provide a two-stage process whereby the LittlEARS is used with caregiver of young infants until they reach a ceiling score and/or age on the tool. This would indicate a certain level of auditory development has occurred within the infant and the child will be developmentally ready to be evaluated by the items in the PEACH Rating Scale.
Results
Outcome of interest was auditory development. In the included studies, auditory development was measured using four instruments that seem suitable for our population of interest: LittlEARS, PEACH and IT-MAIS. The results below are reported separately for each instrument.
1. LittlEARS
McCreery (2015) reported that the overall linear regression model was significant [R2 = 0.48, F(7,89) = 12.5, p<0.001], suggesting that this combination of factors predicted 48% of the variability in LittlEARS scores. Better hearing thresholds (β=−0.32, p=0.005), higher aided audibility (β=0.28, p=0.01), more hours of HA use (β=0.19, p=0.03), higher word recognition (β=0.37, p=0.004), and higher receptive language ability (β=0.29, p=0.02) were associated with higher LittlEARS scores. Age (β=0.10, p=0.34) and maternal education (β=0.17, p=0.22) were not significant predictors of LittlEARS scores after controlling for other variables.
Persson (2020) reported that CHL outcomes were within the normative range according to the instrument scale, except the scores of one participant. There were no significant differences in scores between the CHL and CNH groups at the ages of 10, 18, or 24 months; 10 months t(34) = 0.215 (p=0.83), 18 months t(31) = 1.207 (p=0.26), and 24 months t(36) = 0.783 (p=0.43). The correlations between hours of HA use (datalogging) and auditory development (LittlEARS) at 10 months were positive and weak (r = 0.32), at 18 months negative and weak (r = −0.21), and at 24 months positive and weak (r = 0.19). However, HA use at 10 months demonstrated positive moderate correlations to LittlEARS scores at 18 months (r = 0.48) and at 24 months (r = 0.58). Also, HA use at 18 months demonstrated a positive and moderate correlation to auditory development (LittlEARS) at 24 months, which was significant (r = 0.67, p = 0.05). Correlations between aided audibility (SII) and auditory development (LittlEARS) were positive and weak at 10 months (r = 0.36) and 24 months (r = 0.41), and positive and moderate at 18 months (r = 0.51). When analyzing SII to the LittlEARS at various ages to examine the cumulative effect, correlations were all positive but weak.
2. PEACH
McCreery (2015) reported that the average age at which the PEACH was administered was 21.8 months (SD=4.7 months). The correlation between PEACH and LittlEARS scores for children who had both measures at the 2-year visit was positive and significant (r=0.68, p<0.001), indicating that children with higher LittlEARS scores also had higher PEACH scores. The overall linear regression model was significant [R2=0.43, p<0.001], suggesting that this combination of factors predicted approximately 43% of the variability in Total PEACH score. Lower better-ear PTA (β=−0.48, p=0.02), higher aided audibility (β=0.58, p<0.001), and receptive language ability (β=0.49, p<0.001) were associated with higher Total PEACH scores. The relationship between Total PEACH score and average HA use (p=0.35), O&C word identification (p=0.20), and maternal education (p=0.85) was not significant after controlling for the other predictors.
Persson (2020) reported a significant difference in scores between the CHL and CNH groups on the Noise subscale at 30 and 36 months of age (see table 2).
Table 2. PEACH mean scores, ranges and standard deviations on all scales at all ages over time in children with normal hearing (CNH; n = 29 at 18 months and 24 months, n = 27 at 30 months, n = 28 at 36 months) and children with hearing loss (CHL; n = 9 at 18 months and 36 months, n = 8 at 24 and 30 months). Copied from Persson (2020).
|
PEACH age |
PEACH scale |
CNH – mean score |
Range |
SD |
CHL – mean score |
Range |
SD |
|
18 months |
Total |
79.2 |
(38.6-97.7) |
15.6 |
71.8 |
(38.6–93) |
16.2 |
|
|
Quiet |
82.3 |
(37.5–100) |
13.9 |
77.0 |
(33.3–100) |
20.2 |
|
|
Noise |
77.4 |
(40–100) |
17.1 |
65.4 |
(45–95) |
14.6 |
|
24 months |
Total |
86.6 |
(59–100) |
11.6 |
80.7 |
(43.10–93) |
16.1 |
|
|
Quiet |
89.6 |
(62.5–100) |
9.9 |
85.5 |
(41.6–100) |
19.0 |
|
|
Noise |
83.1 |
(50–100) |
14.9 |
74.3 |
(45–85) |
12.9 |
|
30 months |
Total |
89.3 |
(59–100) |
10.2 |
81.2 |
(63.6–90.9) |
8.9 |
|
|
Quiet |
91.0 |
(58-100) |
10.7 |
88.5 |
(66.6–100) |
10.7 |
|
|
Noise |
87.2 |
(60-100) |
11.9 |
72.5 * |
(60–85) |
8.4 |
|
36 months |
Total |
93.6 |
(61-100) |
9.9 |
84.5 |
(63.6–100) |
10.5 |
|
|
Quiet |
93.6 |
(58-100) |
8.4 |
86.8 |
(57.5–100) |
13.7 |
|
|
Noise |
88.5 |
(60-100) |
12.6 |
77.2 ** |
(50–100) |
16.0 |
Note. The differences between groups were significant on the noise scale at 30 and 36 months. PEACH = Parents Evaluation of Aural/Oral Performance in Children.
*CHL (M = 72.5, SD = 8.4) and CNH (M = 87.2, SD = 11.9); t(33) = −3.23, p = .03.
**CHL (M = 77.2, SD = 16.02) and CNH (M = 88.5, SD = 12.6); t(35) = −2.19, p = .35.
The correlations between HA use and functional auditory performance (PEACH) were negative and weak at 18 months (r = −.36), 24 months (r = −.20), 30 months (r = −.12), and 36 months (r = −.18). Correlations between HA use and PEACH at different ages were all negative and weak. Correlations between aided audibility (SII) and functional auditory performance (PEACH total scale) were positive and weak at 18 months (r = .41) and 24 months (r = .27), and negative and weak at 30 months (r = −.14) and 36 months (r = −.43) Correlations between SII at the various ages of 18, 24, and 30 months to PEACH total scale at 24, 30, and 36 months decreased in strength with age and were negative and weak. When comparing SII and the quiet and noise scale on the PEACH, the correlations were weak across all ages but were higher in the noise scale compared to the quiet and total scales. The highest correlation between SII and the PEACH noise scale was at 18 months (r = .69).
3. IT-MAIS
Yang et al. (2020) reported that there are no significant differences between groups in the age of assessment (Kruskal-Wallis test=2.078, p=0.354), ethnic proportion (Fisher’s exact test =4.221, p=0.293), and sex distribution (X2=0.903, p=0.637). Between the groups, no significant differences are observed in the 9-item total scores (median test=3.352, p=0.187; Kruskal-Wallis test=3.013, p=0.222) and scores of item 3–6 (which assess the ability to detect sound in daily lives) (median test=1.239, p=0.538; Kruskal-Wallis test=1.632, p=0.442). The scores of item 7–10 (which assess the capacity to discriminate and identify sounds), however, are significantly different among the three groups (median test=6.751, p=0.034). Pairwise comparison demonstrates the scores of item 7–10 in the UHL group (18.8% [6.3%, 43.8%]) are significantly lower than those in the BNH group (31.3% [6.3%, 70.3%], median test=6.617, p=0.03). The scores of item 2 (which evaluates the preverbal vocalization behaviors) are significantly different between UHL(0[0,1]) and BNH(1[0,3]) group (Kruskal-Wallis test=4.61, p<0.001), also between BMHL(0[0,1]) and BNH(1[0,3]) group (Kruskal-Wallis test=3.201, p=0.004).
Yang et al. adopted fitting curves, estimated by the 9-item IT-MAIS, to observe early auditory development trajectories in the BNH, UHL, and BMHL groups. Early auditory development develops in the same way in the three groups, which starts early after birth and increases in a logarithmic way. However, the developmental speed varies in three groups. Compared with UHL and BMHL groups, early auditory development with BNH grows more rapidly in the first 12 months after birth, and at the age of 5 months, the score reaches to 50%. After 20 months, early auditory development measured by IT-MAIS approaches to an asymptotic value, and at 23 months, it reaches to the ceiling. Early auditory development in the UHL and BMHL groups grow slower than that in the BNH group. It is estimated that scores reach to 50% at 6.5 and 8 months and reach a ceiling value at 35 and 40 months in the UHL and BMHL groups, respectively. The trajectory of UHL is between that of BNH and BMHL and grows nearer to BMHL.
Level of evidence of the literature
Grading of evidence was not possible due to the limited number of studies included and heterogeneity in study design and population. Furthermore, pooling of results was also not possible.
Zoeken en selecteren
A systematic review of the literature was performed to answer the research question: what auditory development skills are at risk in children aged 0-4 years with established permanent hearing disorders?
PECO:
| P: | Children aged 0 to 4 years who were included through a neonatal hearing screening program |
| E: | (Exposure): Children aged 0-4 years with (congenital) permanent unilateral or bilateral hearing loss |
| C: | Children without hearing loss |
| O: | Auditory development, monitoring tools |
Indirectness
Since it was anticipated that some studies would (also) include children aged slightly older than 4 years that could add further information (more nuance) to the research question, while it was deemed unlikely by the working group that results would not be applicable for 0–4-year-old patients with hearing loss (this relates to indirectness, see Guyatt 2011), it was decided that studies where the population had a median age of around 5 years could also be added to the systematic review. Patients with cochlear implants were not included in the study population (unless otherwise noted).
Relevant outcome measures
The guideline development group considered auditory development as a critical outcome measure for decision making.
The working group did not define a minimal clinically important difference for outcome measures. Therefore, default thresholds were used: 0.5 SD for continuous outcomes and a 25% difference in relative risk (RR< 0.8 or RR>1.25) for dichotomous outcomes.
Since it was anticipated that included studies used different rating instruments to measure the same outcome, the mean differences from all included studies cannot be pooled. However, these mean differences can be divided by their respective standard deviations (SDs) to yield a statistic known as the standardized mean difference (SMD) which can be pooled. The interpretation of the magnitude (needed to define the minimal clinically important difference) of the SMD is given as small, SMD 0.2-0.5; medium, SMD 0.5-0.8; or large, SMD > 0.8. These SMDs are also provided as an indicator to define the minimal clinically important difference for continuous outcome measures.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 31-07-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 216 hits. Studies were selected based on the following criteria:
- Systematic review (detailed search strategy, risk of bias assessment, and results of individual comparative studies available), randomized control trial or observational comparative study;
- Research question includes all elements of the PECO;
- Full text available;
- Full text written in English or Dutch
52 studies were initially selected based on title and abstract screening. After reading the full text, 48 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 4 studies were included.
Results
Four studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bagatto MP, Moodie ST, Seewald RC, Bartlett DJ, Scollie SD. A critical review of audiological outcome measures for infants and children. Trends Amplif. 2011 Mar-Jun;15(1):23-33. doi: 10.1177/1084713811412056. Epub 2011 Aug 25. PMID: 21873343; PMCID: PMC4040835.
- Ching TY, Hill M. The Parents' Evaluation of Aural/Oral Performance of Children (PEACH) scale: normative data. J Am Acad Audiol. 2007 Mar;18(3):220-35. doi: 10.3766/jaaa.18.3.4. PMID: 17479615.
- Gatehouse S, Noble W. The Speech, Spatial and Qualities of Hearing Scale (SSQ). Int J Audiol. 2004 Feb;43(2):85-99. doi: 10.1080/14992020400050014. PMID: 15035561; PMCID: PMC5593096.
- McCreery RW, Walker EA, Spratford M, Oleson J, Bentler R, Holte L, Roush P. Speech Recognition and Parent Ratings From Auditory Development Questionnaires in Children Who Are Hard of Hearing. Ear Hear. 2015 Nov-Dec;36 Suppl 1(0 1):60S-75S. doi: 10.1097/AUD.0000000000000213. PMID: 26731160; PMCID: PMC4703361.
- Persson AE, Al-Khatib D, Flynn T. Hearing Aid Use, Auditory Development, and Auditory Functional Performance in Swedish Children With Moderate Hearing Loss During the First 3 Years. Am J Audiol. 2020 Sep 3;29(3):436-449. doi: 10.1044/2020_AJA-19-00092. Epub 2020 Jul 21. PMID: 32693611.
- Tsiakpini L, Weichbold V, Kuehn-Inacker H, et al. LittlEARS Auditory Questionnaire. Innsbruck, Austria: MED-EL. 2004.
- Visram AS, Purdy SC, Kelly J, Munro KJ. Longitudinal assessment of listening skills in UK infants with hearing aids using the LittlEARS® auditory questionnaire. Int J Audiol. 2023 Apr;62(4):334-342. doi: 10.1080/14992027.2022.2048105. Epub 2022 Apr 25. PMID: 35468301.
- Yang F, Zheng Y, Li G. Early Prelingual Auditory Development of Infants and Toddlers With Unilateral Hearing Loss. Otol Neurotol. 2020 Jun;41(5):654-0. doi: 10.1097/MAO.0000000000002584. PMID: 32604328.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 15-01-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de audiologische zorg voor slechthorende kinderen van 0 tot 4 jaar.
Werkgroep
- Dr. Y.J.W. Simis, voorzitter, klinisch fysicus audioloog, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Ir. M.S. Toll, klinisch fysicus audioloog, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. Ir. W.J.A. Koopmans, klinisch fysicus audioloog, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Ir. J.G. Kleinhuis, klinisch fysicus audioloog, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. D.C.P.B.M. Breukels, klinisch fysicus audioloog, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. Ir. R.A. Boerboom, klinisch fysicus audioloog, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. R.J.H. Ensink, KNO-arts, Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied (NVKNO)
- Dr. E. Huysmans, klinisch-linguïst/master in audiologie, Vereniging voor Klinische Linguïstiek (VKL)
- Dr. E. Dirks, psycholoog, Nederlands Instituut van Psychologen (NIP)
- M.P. van der Heijden, audiologisch maatschappelijk werker, Landelijk Werkverband Maatschappelijk werkers in de Audiologie (LWMA)
Klankbordgroep
- C.P.W.M. van Daelen-Swinkels, logopedist, Nederlandse vereniging voor Logopedie en Foniatrie (NVLF)
- Dr. A.S. Smeijers, kinderarts, Nederlandse Vereniging voor Kindergeneeskunde (NVK)
- R. Glijsteen, huisarts, persoonlijke titel
- Dr. Ir. P. Brienesse, klinisch fysicus audioloog, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- C. ter Huurne, klinisch fysicus audioloog, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- J. Hoogeveen, Federatie van Ouders van Dove Kinderen (FODOK)
- L. Zwemmer, audioloog, Master Audiologen actief in Nederland (MAaN)
- B. van Malcot, audioloog, Master Audiologen actief in Nederland (MAaN)
Met ondersteuning van
- L.W.M. Boerboom, literatuurspecialist, Kennisinstituut van Federatie Medisch Specialisten
- L.H.M. Niesink-Boerboom, literatuurspecialist, Kennisinstituut van Federatie Medisch Specialisten
- Dr. N. van der Zwaluw, senior adviseur, Kennisinstituut van Federatie Medisch Specialisten
- Drs. A.E. Sussenbach, adviseur, Kennisinstituut van Federatie Medisch Specialisten
- Dr. W. Lijfering, senior adviseur, Kennisinstituut van Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. Y.J.W. Simis |
klinisch fysicus -audioloog, Amsterdam UMC |
Extern lid van de klachtencommissie voor medewerkers, MOC 't Kabouterhuis, Amsterdam |
Geen |
Geen restricties |
|
Ir. M.S. Toll |
klinisch fysicus -audioloog, ErasmusMC |
Lid programmacommissie neonatale gehoorscreening |
Geen |
Geen restricties |
|
Dr. Ir. W.J.A. Koopmans |
klinisch fysicus -audioloog, Pento |
Geen |
Geen |
Geen restricties |
|
Ir. J.G. Kleinhuis |
klinisch fysicus -audioloog, Pento |
Geen |
Geen |
Geen restricties |
|
Dr. D.C.P.B.M. Breukels |
klinisch fysicus -audioloog, MUMC+ |
Geen |
Geen |
Geen restricties |
|
Dr. Ir. R.A. Boerboom |
klinisch fysicus -audioloog, UMC Utrecht |
Geen |
Extern gefinancierd onderzoek: Evaluating cochlear insertion trauma and hearing preservation after cochlear implantation (CIPRES) |
Restricties t.a.v. aanbevelingen m.b.t. cochleaire implantaten |
|
Dr. R.J.H. Ensink |
KNO-arts |
lid adviescommissie richtlijnen |
Geen |
Geen restricties |
|
Dr. E. Huysmans |
Klinisch linguïst, Amsterdam UMC |
Geen |
Geen |
Geen restricties |
|
Dr. E. Dirks |
Psycholoog, NSDSK |
Docent ontwikkelingspsychologie universiteit Utrecht (gedetacheerd vanuit NSDSK). Docent postmaster opleiding schoolpsycholoog (betaald 35 uur per jaar). bestuurslid sectie jeugd Nip (vrijwillig) |
Geen |
Geen restricties |
|
M.P. van der Heijden |
Maatschappelijk werker, Libra |
Bestuurslid LWMA |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het perspectief van ouders/verzorgers van patiënten door het uitnodigen van patiëntenfederaties FODOK en FOSS voor de invitational conference. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan FODOK en FOSS en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz (wordt na de commentaarfase ingevuld)
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Monitoring van auditieve ontwikkeling |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor slechthorende kinderen van 0-4 jaar. Tevens zijn er knelpunten aangedragen door verschillende partijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.