Epidemiologie, implicaties en behandeling van subklinisch AF/AHRE
Uitgangsvraag
Bij patiënten met een pacemaker, ICD of loop-recorder bij wie geen atriumfibrilleren bekend is, hoe vaak en in welke mate treedt subklinisch atriumfibrilleren op en wanneer dient dit behandeld te worden?
Aanbeveling
Vervolg bij patiënten bij wie subklinisch AF middels een pacemaker, ICD of ILR geregistreerd wordt:
- progressie naar klinisch atriumfibrilleren;
- toename van de subklinische AF-duur (> 24 uur);
- cardiovasculaire risicoprofiel;
- CHA2DS2-VASc-score;
- en veranderingen in onderliggende aandoeningen.
Het geven van anticoagulantia bij een subklinisch atriumfibrilleren met een duur van korter dan 24 uur kan worden overwogen als het risico op een trombo-embolische complicatie verhoogd is.
Overwegingen
The incidence of AHRE/subclinical AF in patients with a pacemaker/ implanted device is 30-70%, but it may be lower in the general population (Diederichsen, 2019). Very short episodes (<10 - 20 s/day) are considered clinically irrelevant, as they are not significantly associated with longer episodes or an increased risk of stroke or systemic embolism (Swiryn, 2016). However, longer episodes of AHRE/subclinical AF (minimum of 5 – 6 min) are associated with an increased risk of clinical AF (Mahajan, 2018; Boriani, 2018), ischaemic stroke (Healey, 2012; Boriani, 2018), major adverse cardiovascular events (Pastori, 2020), and cardiovascular death (Gonzalez, 2014).
Overall, the absolute risk of stroke associated with AHRE/subclinical AF may be lower than with clinical AF (Hart, 2000; Healey, 2012; Boriani, 2014; Mahajan, 2018). The temporal dissociation from acute stroke suggests that AHRE/subclinical AF may represent a marker rather than a risk factor for stroke (Freedman, 2017; Camm, 2017; Gorenek, 2017).
Whereas current data were obtained mostly from pacemakers/implantable cardioverter defibrillators or post-stroke patients, AHRE/subclinical AF is increasingly reported in a variety of patients undergoing cardiac monitoring. Clinical AF will reportedly develop in 1 in 5 - 6 of patients within 2.5 years after diagnosing AHRE/subclinical AF (Healey, 2012). Notwithstanding that more high-quality evidence is needed to inform optimal management of these patients, more intense follow-up and monitoring to detect clinical AF early is prudent (preferably with the support of remote monitoring). Notably, the AHRE/subclinical AF burden is not static but may change on daily basis (Boriani, 2018), hence should be regularly reassessed—the greater the AHRE/subclinical AF burden at diagnosis, the higher the risk of subsequent progression to longer episodes (Boriani, 2018).
Whereas available evidence is insufficient to justify routine OAC use in patients with AHRE/subclinical AF, modifiable stroke risk factors should be identified and managed in each patient. The use of OAC may be considered in selected patients with longer durations of AHRE/subclinical AF (>24 h) and an estimated high individual risk of stroke (Freedman, 2017; Gorenek, 2017), accounting for the anticipated net clinical benefit and informed patient’s preferences (Figure 1). In the recent trials, OAC was initiated in 76.4% and 56.3% of patients with >2 clinical stroke risk factors and insertable cardiac monitor detected physician-confirmed AF>6 min, but follow-up bleeding rates were not reported (Nasir, 2017; Reiffel, 2017). In a large retrospective cohort study using remote monitoring data about daily AF burden, there was large practice variation in OAC initiation. Across increasing AF burden strata (from >6 min to >24 h) the risk of stroke in untreated patients increased numerically, and the strongest association of OAC with reduction in stroke was observed among patients with device detected AF episodes of >24 h (Perino, 2019).
Figure 1 Proposed management of AHRE/subclinical AF
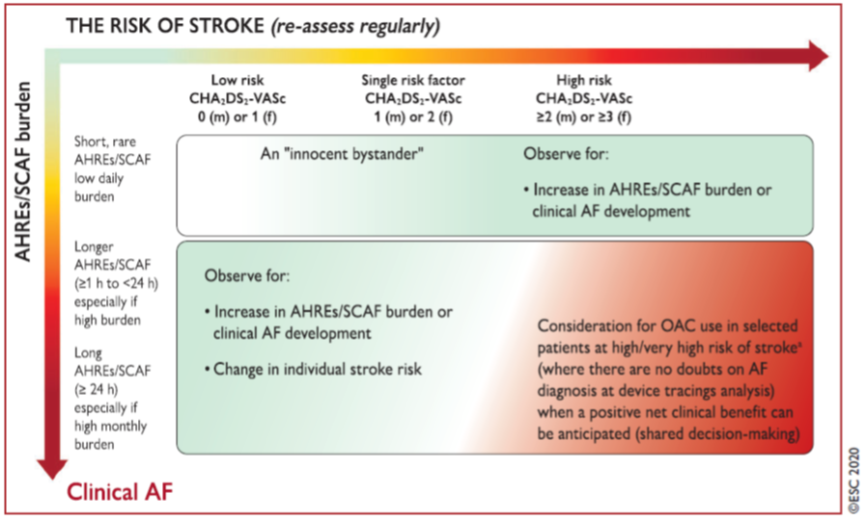
AF = atrial fibrillation; AHRE = atrial high-rate episode; CKD = chronic kidney disease; CHA2DS2-VASc = Congestive heart failure, Hypertension, Age ≥ 75 years, Diabetes mellitus, Stroke, Vascular disease, Age 65 to 74 years, Sex category (female); f = female; LA = left atrium; LoE = level of evidence; m = male; OAC = oral anticoagulant; SCAF = subclinical atrial fibrillation. aHighly selected patients (for example. with previous stroke and/or age ≥75 years, or ≥ 3 CHA2DS2-VASc risk factors, and additional non-CHA2DS2-VASc stroke factors such as CKD, elevated blood biomarkers, spontaneous echo contrast in dilated LA, etc); selected patients (for example with previous stroke and/or age ≥75 years, or ≥3 CHA2DS2-VASc risk factors , et cetera). Adapted from Hindricks (2020).
Onderbouwing
Zoeken en selecteren
To answer the clinical question, the ESC-guideline for the diagnosis and management of atrial fibrillation from 2020 (Hindricks, 2020) was used.
Referenties
- Boriani G, Glotzer TV, Santini M, West TM, De Melis M, Sepsi M, Gasparini M, Lewalter T, Camm JA, Singer DE. Device-detected atrial fibrillation and risk for stroke: an analysis of >10,000 patients from the SOS AF project (Stroke preventiOn Strategies based on Atrial Fibrillation information from implanted devices). Eur Heart J 2014;35:508-516.
- Boriani G, Glotzer TV, Ziegler PD, De Melis M, Mangoni di SSL, Sepsi M, Landolina M, Lunati M, Lewalter T, Camm AJ. Detection of new atrial fibrillation in patients with cardiac implanted electronic devices and factors associated with transition to higher device-detected atrial fibrillation burden. Heart Rhythm 2018;15:376-383.
- Camm AJ, Simantirakis E, Goette A, Lip GY, Vardas P, Calvert M, Chlouverakis G, Diener HC, Kirchhof P. Atrial high-rate episodes and stroke prevention. Europace 2017;19:169-179.
- Diederichsen SZ, Haugan KJ, Brandes A, Lanng MB, Graff C, Krieger D, Kronborg C, Holst AG, Kober L, Hojberg S, Svendsen JH. Natural history of subclinical atrial fibrillation detected by implanted loop recorders. J Am Coll Cardiol 2019;74:2771-2781.
- Freedman B, Boriani G, Glotzer TV, Healey JS, Kirchhof P, Potpara TS. Management of atrial high-rate episodes detected by cardiac implanted electronic devices. Nat Rev Cardiol 2017;14:701-714.
- Gonzalez M, Keating RJ, Markowitz SM, Liu CF, Thomas G, Ip JE, Lerman BB, Cheung JW. Newly detected atrial high rate episodes predict long-term mortality outcomes in patients with permanent pacemakers. Heart Rhythm 2014;11:2214-2221.
- Gorenek BC, Bax J, Boriani G, Chen SA, Dagres N, Glotzer TV, Healey JS, Israel CW, Kudaiberdieva G, Levin LA, Lip GYH, Martin D, Okumura K, Svendsen JH, Tse HF, Botto GLC-C; ESC Scientific Document Group. Devicedetected subclinical atrial tachyarrhythmias: definition, implications and management an European Heart Rhythm Association (EHRA) consensus document, endorsed by Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Europace 2017;19:1556-1578.
- Hart RG, Pearce LA, Rothbart RM, McAnulty JH, Asinger RW, Halperin JL. Stroke with intermittent atrial fibrillation: incidence and predictors during aspirin therapy. Stroke Prevention in Atrial Fibrillation Investigators. J Am Coll Cardiol 2000;35:183-187.
- Healey JS, Connolly SJ, Gold MR, Israel CW, Van Gelder IC, Capucci A, Lau CP, Fain E, Yang S, Bailleul C, Morillo CA, Carlson M, Themeles E, Kaufman ES, Hohnloser SH; ASSERT Investigators. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med 2012;366:120-129.
- Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS) (published online ahead of print, 2020 Aug 29). Eur Heart J. 2020;ehaa612. doi:10.1093/eurheartj/ehaa612.
- Mahajan R, Perera T, Elliott AD, Twomey DJ, Kumar S, Munwar DA, Khokhar KB, Thiyagarajah A, Middeldorp ME, Nalliah CJ, Hendriks JML, Kalman JM, Lau DH, Sanders P. Subclinical device-detected atrial fibrillation and stroke risk: a systematic review and meta-analysis. Eur Heart J 2018;39:1407-1415.
- Nasir JM, Pomeroy W, Marler A, Hann M, Baykaner T, Jones R, Stoll R, Hursey K, Meadows A, Walker J, Kindsvater S. Predicting determinants of atrial fibrillation or flutter for therapy elucidation in Patients at Risk for Thromboembolic Events (PREDATE AF) study. Heart Rhythm 2017;14:955-961.
- Pastori D, Miyazawa K, Li Y, Szekely O, Shahid F, Farcomeni A, Lip GYH. Atrial high-rate episodes and risk of major adverse cardiovascular events in patients with cardiac implantable electronic devices. Clin Res Cardiol 2020;109:96-102.
- Perino AC, Fan J, Askari M, Heidenreich PA, Keung E, Raitt MH, Piccini JP, Ziegler PD, Turakhia MP. Practice variation in anticoagulation prescription and outcomes after device-detected atrial fibrillation. Circulation 2019;139:2502-2512.
- Reiffel JA, Verma A, Kowey PR, Halperin JL, Gersh BJ, Wachter R, Pouliot E, Ziegler PD; REVEAL AF Investigators. Incidence of previously undiagnosed atrial fibrillation using insertable cardiac monitors in a high-risk population: the REVEAL AF study. JAMA Cardiol 2017;2:1120-1127.
- Swiryn S, Orlov MV, Benditt DG, DiMarco JP, Lloyd-Jones DM, Karst E, Qu F, Slawsky MT, Turkel M, Waldo AL; RATE Registry Investigators. Clinical implications of brief device-detected atrial tachyarrhythmias in a cardiac rhythm management device population: results from the Registry of Atrial Tachycardia and Atrial Fibrillation Episodes. Circulation 2016;134:1130-1140.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-10-2022
Beoordeeld op geldigheid : 01-09-2022
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met atriumfibrilleren.
Werkgroep
- Prof. dr. N.M.S. (Natasja) de Groot, cardioloog, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVVC (voorzitter)
- P.H. (Pepijn) van der Voort, cardioloog, werkzaam in het Catharina Ziekenhuis te Eindhoven, NVVC
- Dr. M.E.W. (Martin) Hemels, cardioloog, werkzaam in het Rijnstate Ziekenhuis te Arnhem en RaboudUMC te Nijmegen, NVVC
- Dr. T.J. (Thomas) van Brakel, thoraxchirurg, werkzaam in het Catharina Ziekenhuis te Eindhoven, NVTNET
- Dr. M. (Michiel) Coppens, internist-vasculair geneeskundige, werkzaam in de Amsterdam Universitair Medische Centra te Amsterdam, NIV
- Dr. S. (Sander) van Doorn, huisarts, werkzaam in het Universitair Medisch Centrum Utrecht te Utrecht, NHG
- Prof. dr. M.K. (Kamran) Ikram, neuroloog, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVN
- H. (Hans) van Laarhoven, zelfstandig adviseur, werkzaam bij Laerhof Advies, Harteraad
Met ondersteuning van
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
De Groot (voorzitter) |
Cardioloog-elektrofysioloog, Erasmus Medisch Centrum, Rotterdam |
Mede-oprichter Stichting Atrial Fibrillation Innovation Platform |
Unrestricted grant voor AF bij Hartfalen, Pathofysiologische onderzoek (valt buiten de afbakening) |
Geen (valt buiten de afbakening) |
|
Brakel |
Cardio-thoracaal chirurg |
Verzorgen van trainingen voor chirurgische behandeling van AF (Trainingscontract met Medtronic; inkomsten voor de afdeling) |
Geen |
Geen |
|
Coppens |
Internist-vasculaire geneeskunde |
* Wetenschappelijke adviesraad Trombosestichting Nederland (onbetaald). |
Betaald adviseurschap of betaalde lezingen/nascholingen voor Bayer, Daiichi Investigator initiated studies met externe financiële ondersteuning en door industrie geïnitieerde studies Bayer, UniQure, Roche CSL Behring and Daiichi Sankyo |
Geen (valt buiten de afbakening, niet over AF-patiënten; onderzoek ging bijvoorbeeld over DOAC bij short bowel patiënten) |
|
Van der Voort |
Cardioloog-electrofysioloog Catharinaziekenhuis Eindhoven |
Bestuurslid van NHRA, onbetaald |
Geen |
Geen |
|
Laarhoven |
Zelfstandig adviseur voor de zorg |
Bestuurslid LAREB, vergoeding conform normering NTVZ Voorzitter Raad van Toezicht stichting Leefh, vergoeding conform NVTZ |
* Lid Patientenadviesraad Pfizer, vacatievergoeding * Adviesraad ‘NOAC’ (eenmalig 2019, vacatievergoeding) |
Geen |
|
Van Doorn |
* Assistant professor, Julius Centrum, UMC Utrecht |
Geen |
* Betrokken als co-PI van het ALL-IN onderzoek, naar de substitutie van AF zorg van de 2e lijn naar de huisarts, inclusief behandeling met anticoagulantia: doe 10.1093/eurheartj/ehaa055 (afgerond) * co-PI betrokken bij het FRAIL-AF onderzoek, een gerandomiseerd onderzoek naar de veiligheid en effectiviteit van DOAC’s bij kwetsbare ouderen: trialregister.nl NTR6721, doi 10.1136/bmjopen-2019-032488 (lopend) * Betrokken bij onderzoek met routine zorg data (CPRD) naar de veiligheid en effectiviteit van DOAC’s, en een systematische review naar DOAC doseringen. |
Geen |
|
Hemels |
* Cardioloog-elektrofysioloog Rijnstate ziekenhuis * Programmaleider NVVC Connect atriumfibrilleren |
* Associate editor van Netherlands Heart Journal, géén vergoeding * Onderwijsactiviteiten voor medisch specialisten, huisartsen, (ziekenhuis)apothekers en arts-assistenten/physician assisants, betreft urenvergoeding
|
* Principal investigator (samen met prof. M.V. Huisman) van het Dutch AF onderzoeks en registratieproject namens de NVVC en in opdracht van VWS/ZonMw. Er gaat een vergoeding naar de vakgroep cardiologie in het Rijnstate i.v.m. mijn werkzaamheden voor dit project, ook gefinancierd door FNT * Local principal investigator van diverse patiëntgebonden studies (hartritmestoornissen gerelateerd) in het Rijnstate ziekenhuis, géén persoonlijke vergoeding hiervoor |
Geen |
|
Ikram |
Hoogleraar Klinische Neuro-epidemiologie en neuroloog, Afdelingen Neurologie & Epidemiologie, Erasmus MC, Rotterdam |
Geen |
Geen |
Geen |
|
Stegeman |
Senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen |
|
Meelezer |
||||
|
Jakulj |
* Internist-nefroloog Amsterdam UMC en Dianet * Lid richtlijnencommissie Nederlandse Federatie voor Nefrologie |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module 1 Definitie en diagnose van atriumfibrilleren |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 2 Atriumfibrilleren, subtype, burden en progressie |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 3 Screenen voor atriumfibrilleren |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 4 Integrale behandeling voor patiënten met atriumfibrilleren |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 5.1 Antitrombotisch beleid ter preventie van herseninfarct |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 5.2 Afsluiting of verwijdering van het linker hartoor |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 6.1 Frequentiecontrole |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 6.2 Ritmecontrole |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 6.2.1 Ritmecontrole met antiaritmische medicatie |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 6.3 Katheterablatie |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 6.4 Chirurgie voor atriumfibrilleren en concomitante chirurgie voor atriumfibrilleren |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 6.5 Hybride katheter-/ chirurgische ablatie procedures |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 6.6 Peri-procedureel management ter preventie van herseninfarct |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 7 Cardiovasculaire risicofactoren en bijkomende ziekten |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.1 Atriumfibrilleren bij hemodynamische instabiliteit |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.2 Acute coronaire syndromen, chronisch coronairlijden, en percutane en chirurgische revascularisaties bij patiënten met atriumfibrilleren |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.3 Acuut herseninfarct of hersnebloeding bij patiënten met atriumfibrilleren |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.4 Bloeding ten tijde van antistolling |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.5 Atriumfibrilleren en valvulaire hartziekte |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.6 Atriumfibrilleren en chronische nierschade |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.7 De oudere en kwetsbare patiënt met atriumfibrilleren |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.8 Atriumfibrilleren en aangeboren hartafwijkingen |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.9 Atriumfibrilleren bij erfelijke hartspierziekten |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.10 Atriumfibrilleren tijdens de zwangerschap |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.11 Atriumfibrilleren in professionele sporters |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 8.12 Postoperatief atriumfibrilleren |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 9 Sekse-gerelateerde verschillen in atriumfibrilleren |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
|
Module 10 Epidemiologie, implicaties en behandeling van subklinisch AF/AHRE |
Geen financiële gevolgen |
Het overgrote deel voldoet aan de norm. |
Implementatie
De werkgroep is vooral inhoudelijk bezig geweest met het aanpassen van de ESC-richtlijn ‘Diagnosis and management of atrial fibrillation’ naar de Nederlandse praktijk. De werkgroep heeft een aantal suggesties gegeven voor het onder de aandacht brengen bij medische professionals van de nieuwe richtlijn. De verdere implementatie van de aanbevelingen uit de richtlijn valt buiten de expertise van de werkgroep.
Voorstel voor te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om aandacht te geven aan de richtlijn.
Alle direct betrokken wetenschappelijk verenigingen/beroepsorganisaties
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn maken door over de richtlijn te publiceren in tijdschriften en te vertellen op congressen.
De lokale vakgroepen/individuele medisch professionals
- Het bespreken van de aanbevelingen in de vakgroepsvergadering en lokale werkgroepen.
- Het bespreken van de richtlijnen in de onderwijsuren van de medisch specialist in opleiding
- Het volgen van bijscholing die bij deze richtlijn ontwikkeld gaat worden.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
Het Kennisinstituut van Medisch Specialisten
Toevoegen van de richtlijn aan de Richtlijnendatabase.
Werkwijze
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met atriumfibrilleren. Tevens zijn er knelpunten aangedragen door het Zorginstituut Nederland, Zelfstandige Klinieken Nederland, Nederlandse Vereniging voor Neurologie, Vereniging Innovatieve Geneesmiddelen, Nederlandse Vereniging voor Cardiologie, Federatie voor Nederlandse Trombosediensten, Nederlandse Vereniging voor Hart- en Vaatverpleegkundigen, Nederland Huisartsen Genootschap en Inspectie Gezondheidszorg en Jeugd via Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Overwegingen (van bewijs naar aanbevelingen)
De Engelse tekst uit de ESC-richtlijn Diagnosis and management of atrial fibrillation uit 2020 (Hindricks, 2020) is overgenomen, tenzij er argumenten voor de Nederlandse praktijk van belang zijn. De tekst is vervolgens aangepast en in het Nederlands opgesteld.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/). Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Vertalen van aanbevelingen
De European Society of Cardiology gebruikt een standaardformulering voor de aanbevelingen op basis van de klasse en niveau van het bewijs. Deze standaardformulering met vertaling naar het Nederlands staat in de onderstaande tabel weergegeven.
|
Class of recommendations |
Suggested wording to use |
Nl’se vertaling, gehanteerd door onder andere de CVRM-richtlijn |
|
I |
Is recommended/is indicated |
Sterke aanbeveling met een actieve, directieve formulering, zoals behandel, streef naar, et cetera |
|
II |
|
|
|
IIa |
Should be considered |
Zwakke aanbeveling met een actieve, directieve formulering, zoals overweeg |
|
IIb |
May be considerd |
Zwakke aanbeveling met als formulering: kan worden overwogen |
|
III |
Is not recommended |
Sterke aanbeveling met een actieve, directieve formulering, zoals behandel niet, et cetera |
CVRM, CardioVasculair RisicoManagement
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS) (published online ahead of print, 2020 Aug 29). Eur Heart J. 2020;ehaa612. doi:10.1093/eurheartj/ehaa612
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
