Voorzetkamer of vernevelapparaat bij longaanval astma
Uitgangsvraag
Welke toedieningsvorm van luchtwegverwijdende inhalatiemedicatie heeft de voorkeur bij kinderen met een astma-aanval in de tweedelijn?
Aanbeveling
Aanbeveling 1
Geef aan kinderen met een acute longaanval astma kortwerkende beta2-agonisten (SABA), zo nodig afwisselend of in combinatie met kortwerkende parasympaticolytica, (SAMA) via een dosis-aerosol met voorzetkamer of via verneveling.
Overweeg bronchusverwijders (SABA in combinatie met of afgewisseld met SAMA) in eerste instantie toe te dienen via een dosis-aerosol met voorzetkamer mits hiervoor de personele en materiele randvoorwaarden aanwezig zijn. Gebruik zo mogelijk de dosis-aerosol en voorzetkamer die de patiënt thuis gebruikt. Benut de opname voor goede instructie en begeleiding van inname van de bronchusverwijders.
Voor doseringen wordt verwezen naar het Kinderformularium. Voor juist gebruik van inhalatoren wordt verwezen naar Inhalatorgebruik.nl.
Aanbeveling 2
Overweeg toediening van bronchusverwijders (SABA+SAMA) via verneveling bij ernstige benauwdheid, bij benauwdheid die lang aanhoudt of onvoldoende reageert op toediening via dosis-aerosol met voorzetkamer.
Voor doseringen wordt verwezen naar het Kinderformularium.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor de cruciale uitkomstmaten ziekenhuisopname en bijwerkingen is de bewijskracht van de beschikbare literatuur als zeer laag gewaardeerd vanwege beperkingen in de studie opzet, inconsistentie en imprecisie (onnauwkeurigheid). Dat betekent dat er weinig vertrouwen is in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. Ten aanzien van de cruciale uitkomstmaat astma score is de bewijskracht van de beschikbare literatuur als laag gewaardeerd vanwege beperkingen in de studie opzet en imprecisie. Er werd een statistisch significant maar niet klinisch relevant verschil gevonden voor de astmascore in het voordeel van voorzetkamer.
Er werd geen bewijs gevonden voor de uitkomstmaten herhaling (recurrence), patiënttevredenheid en orale steroïdengebruik. Daarom werden deze uitkomstmaten ook niet beoordeeld met GRADE.
In 2021 publiceerde Stutvoet een Nederlandstalig overzichtsartikel over het dilemma van het gebruik van voorzetkamer of vernevelaar bij acuut astma in de tweedelijn (Stutvoet, 2021). Voor de cruciale uitkomstmaat ziekenhuisopname werd verwezen naar de Cochrane review van Cates uit 2013. Wat betreft de bijwerkingen werd gesteld dat er minder bijwerkingen zijn als salbutamol via de voorzetkamer gegeven werd. Dit wordt waarschijnlijk veroorzaakt door de hogere dosering salbutamol die verneveld wordt, en daarbij relatief hoge orofaryngeale depositie wat lijdt tot meer systemische absorptie (Leelathipkul, 2016).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
In het artikel van Stutvoet is gekeken naar coöperatie van het kind: ouders en zorgverleners gaven een hogere score aan het meewerken van het kind bij gebruik van een voorzetkamer ten opzichte van vernevelen (Stutvoet, 2021). De perceptie van veel ouders is dat vernevelen beter werkt, maar in een Australische studie vond een groot deel van de ondervraagde ouders de voorzetkamer gemakkelijker in gebruik dan een vernevelaar (Breuer, 2015). Daarbij is de tijdsinvestering van gebruik van de voorzetkamer versus vernevelen in het voordeel van het gebruik van de voorzetkamer.
Een ander voordeel van het inhaleren met de voorzetkamer is dat in de acute setting direct feedback gegeven kan worden op de inhalatietechniek waardoor de techniek verbetert. Dit heeft zijn weerslag in beter inhaleren in de thuis setting.
Kosten (middelenbeslag)
De kosten van inhaleren met voorzetkamer lijken niet hoger te zijn vergeleken met vernevelaar. Hoewel de materiaalkosten van een voorzetkamer hoger liggen, zorgen lagere medicijnkosten voor een kleine kostenreductie. Als de kortere tijdsinzet van de verpleegkundige (2 vs 10 minuten) bij inhaleren wordt doorgerekend, wordt het financiële voordeel van de voorzetkamer groter. Daarnaast tonen Spin (2017) en Rodriquez-Martinez (2020) aan dat lagere zorgkosten bij de voorzetkamer kan toegeschreven worden aan een lager opname percentage bij het gebruik van een voorzetkamer (Wildhaber, 1999; Spin, 2017; Rodiguez-Martinez, 2020). Lagere kosten bij toediening met voorzetkamer worden ook gevonden in studies van Doan (2011) en Dhuper (2011).
Aanvaardbaarheid, haalbaarheid en implementatie
In de klinische praktijk heeft het bij kinderen met mild tot mild-ernstige astma aanval de voorkeur om bronchusverwijders te inhaleren met de voorzetkamer. Als het kind door de mate van benauwdheid of uitputting niet meer lukt om te inhaleren met de voorzetkamer, kan overgegaan worden op verneveling. Dit kan in de praktijk zijn in geval van ernstige benauwdheid, bij benauwdheid die lang aanhoudt of onvoldoende reageert op toediening via dosis-aerosol met voorzetkamer worden gedaan. Het heeft uit oogpunt van gezondheidsvoorlichting en opvoeding de voorkeur zo veel mogelijk aan te sluiten bij de manier van behandelen thuis. Dit zal mogelijk (onnodig) SEH-bezoek verminderen.
Rationale van aanbeveling 1: weging van argumenten voor en tegen de interventies
In veel ziekenhuizen wordt traditioneel bij patiënten opgenomen voor een acute astma-longaanval verneveld met kortwerkende bronchusverwijders. Echter, de geraadpleegde literatuur laat geen meerwaarde zien van verneveling boven toediening via dosisaërosol met voorzetkamer. In de systematische review van Payares-Salamanca (2020) worden geen significante verschillen gevonden tussen beide toedienroutes met betrekking tot effectiviteit en bijwerkingen, de bewijskracht voor de gedefinieerde uitkomstmaten laag tot zeer laag. Voordelen van toediening via dosisaerosol met voorzetkamer zijn de lagere kosten, het gaat sneller, is makkelijker en kan beter gecontroleerd worden.
Rationale van aanbeveling 2: weging van de argumenten voor en tegen de interventie voor de subgroep ernstige longaanval
In de meeste gevallen zal een behandeling ingezet met dosis-aerosol en voorzetkamer effectief zijn. Bij extreme benauwdheid en op basis van ervaringen met eerdere longaanvallen kan als eerste interventie gekozen worden voor verneveling in deze subgroep van patiënten.
De aanbeveling steunt niet op empirische resultaten maar op klinische expertise.
Onderbouwing
Achtergrond
Op de SEH worden patiënten met een astma-aanval vaak nog standaard behandeld met kortwerkende bètasympathico-mimetica en parasympathicolytica (SABA+SAMA) toegediend per verneveling teneinde de extreme luchtwegvernauwing te verminderen.
In de afgelopen COVID-pandemie van 2020/2021 was verneveling van medicatie gecontra-indiceerd omdat er verhoogd risico was op besmetting met het SARS-CoV2 virus. Als alternatief werd SABA of SABA+SAMA in een dosis-aerosol via een voorzetkamer geïnhaleerd, waarmee klinisch ook goede resultaten werden verkregen. Ook wordt toediening via dosis-aerosol (met voorzetkamer) en verneveling bij kinderen reeds als equivalent beschouwd.
Uit ervaring en uit de literatuur blijkt dat bijwerkingen van deze medicatie vaker worden gezien bij vernevelingen, gebaseerd op de veel hogere dosering die dan wordt geïnhaleerd in combinatie met een hogere biologische beschikbaarheid. Toediening via een dosis-aerosol in combinatie met voorzetkamer is sneller en praktischer dan via verneveling.
Conclusies / Summary of Findings
Hospital admission
|
Very low GRADE |
The evidence is very uncertain about the effect of inhalation with a nebuliser on hospitalisation compared with inhalation via a holding chamber (spacer) in children with asthma exacerbation.
Source: Payares-Salamanca, 2020 |
Side effects
|
Very low GRADE |
The evidence is very uncertain about the effect of inhalation with nebuliser on side effects (nausea, palpitations and tremor) when compared with holding chamber in children with asthma exacerbation.
Source: Payares-Salamanca, 2020 |
Asthma score
|
Low GRADE |
Inhalation with nebuliser may result in little to no difference in asthma score (pulmonary index score) when compared with holding chamber in children with asthma exacerbation.
Source: Payares-Salamanca, 2020 |
Recurrence
|
No GRADE |
No evidence was found regarding the effect of inhalation with nebuliser on recurrence when compared with holding chamber in children with asthma exacerbation.
Source: - |
Patient satisfaction
|
No GRADE |
No evidence was found regarding the effect of inhalation with nebuliser on patient satisfaction when compared with holding chamber in children with asthma exacerbation.
Source: - |
Oral steroid use
|
No GRADE |
No evidence was found regarding the effect of inhalation with nebuliser on oral steroid use when compared with holding chamber in children with asthma exacerbation.
Source: - |
Samenvatting literatuur
Description of studies
Payares-Salamanca (2020) performed a systematic review and meta-analysis to compare the effect of administration of albuterol delivered through metered-dose inhalers with a spacer (MDI+S) with albuterol delivered through nebulization (NEB) in pediatric patients with asthma exacerbations. The primary outcome was hospital admission. Secondary outcomes were oxygen arterial saturation (SaO2), heart rate (HR), respiratory rate, pulmonary index score (PIS), adverse effects, and need for additional treatment. A systematic search was performed in MEDLINE/PubMed, EMBASE, and Ovid databases from inception through February, 2020. In addition, the ClinicalTrials.gov database was consulted to identify ongoing and completed trials and as a source for grey literature. The following inclusion criteria were used: 1) a cohort of children under 18 years old that had a diagnosis or symptoms suggestive of asthma and that suffered from an acute asthma exacerbation episode managed either in the emergency department (ED) or as an inpatient; 2) a RCT of any duration; 3) comparison of albuterol delivered via NEB versus albuterol delivered via MDI+S; (4) assessment and reporting of the rate of the primary outcome or any of the secondary outcomes. Studies including children with severe asthma exacerbations or those requiring intensive care management and studies including additional interventions, such as management with ipratropium bromide in the randomization, were excluded. A total of 15 studies were included with a total of 2057 patients under 18 years of age with acute wheezing or asthma exacerbations managed either in the ED or as an inpatient. The majority of included studies (73.3%) enrolled children younger than 5 years of age.
The review of Payares-Salamanca (2020) was an update of the Cochrane review of Cates (2013). Because Payares-Salamanca did not report al the outcomes of interest (i.e. lung-function), the review of Cates was used for describing the missing outcomes.
Tabatabaii (2019) performed a RCT comparing the effect of salbutamol delivered through jet nebulizer (NEB) with salbutamol delivered through MDI+S in the pediatric emergency department. A total of 116 children (74 males and 42 females) aged 6 months to 14 years old with wheezing on auscultation and a score >4 on the respiratory distress assessment scale (RDAS) were included, visiting the emergency department for the acute asthmatic attack. Children with severe respiratory distress requiring admission in a pediatric intensive care unit, diagnosed with bronchopulmonary dysplasia, cystic fibrosis or congenital cardiopulmonary disorders were excluded. A total of 62 children were randomized to the MDI+S group and 54 children to the NEB group. The MDI+S group received between 2 and 10 puffs of salbutamol MDI (depending on weight) at 15-min intervals via a valve aerosol-holding chamber device with the aero-chamber masks sealed to their faces and held
there for 30 seconds up to five times. The NeB group received 0.15 mg per kg of salbutamol (maximum dose of 2.5 mg) up to 5 times every 15 minutes. Mean age was 52.3 (SD 33.0) months in the MDI+S group and 39.1 (SD37.9) months in the NEB group (P=0.06). The primary outcome was the score of the Respiratory Distress Assessment Scale.
Results
1. Length of admission and admission (crucial)
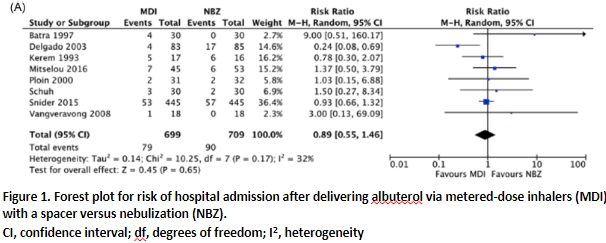
In the systematic review of Payares-Salamanca (2020), eight studies reported on the risk of hospital admission in children. The risk of hospital admission was 11% lower when using a holding chamber compared to nebulizer, with a risk ratio of 0.89 (95% CI 0.55 to 1.46). This effect was not statistically significant. See Figure 1 for the forest plot of the meta-analysis. The length of admission was not reported as outcome measure by Payares-Salamanca.
Tabatabaii (2019) did not report admission or length of admission as outcome measure.
2. Side effects (crucial)
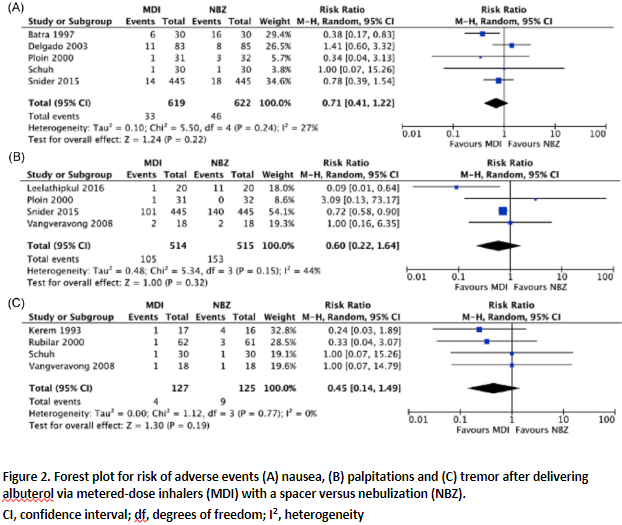
In the systematic review of Payares-Salamanca (2020), nine studies reported on side effects in children, defined as nausea, palpitations and tremor. The risk of nausea was 29% lower when using a holding chamber compared to nebulizer, with a risk ratio of 0.71 (95% CI 0.41 to 1.22). The risk of palpitations was 40% lower when using a holding chamber compared to nebulizer, with a risk ratio of 0.60 (95% CI 0.22 to 1.64). The risk of tremor was 55% lower when using a holding chamber compared to nebulizer, with a risk ratio of 0.45 (95% CI 0.14 to 1.49). None of the effects on adverse events were statistically significant. See Figure 2 for the forest plots of the meta-analyses for adverse events in Payares-Salamanca (2020).
Tabatabaii (2019) did not report side effects as outcome measure.
3. Asthma score (crucial)
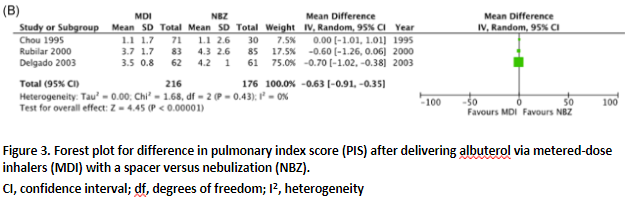
In the systematic review of Payares-Salamanca (2020), three studies reported on the pulmonary index score (PIS) in children, which is a composite of objective clinical observations and compose a score from 0 to 12. The pooled analysis showed a statistically significant reduction in the PIS when using a holding chamber compared to nebulizer, with a mean difference of -0.63 (95% CI -0.91 to -0.35). See Figure 3 for the forest plot of the meta-analysis.
Tabatabaii (2019) reported the clinical asthma score as primary outcome measure. Scores were calculated along with clinical assessment at baseline (0 min) and in the 15th, 30th, 45th and 60th minutes after initiation of treatment, respectively. This scoring system assigns a number from 0-3 for each parameter, and the final score varies from 0 -12. A higher score means an increase in the severity of the asthma attack. There was no significant statistical difference between the two groups in asthma attack severity on any of the time assessments.
4. Recurrence (important)
Payares-Salamanca (2020), Cates (2013) and Tabatabaii (2019) did not report recurrence as outcome measure.
5. Patient satisfaction (important)
Payares-Salamanca (2020), Cates (2013) and Tabatabaii (2019) did not report patient satisfaction as outcome measure.
6. Oral steroid use (important)
Payares-Salamanca (2020), Cates (2013) and Tabatabaii (2019) did not report oral steroid use as outcome measure.
Level of evidence of the literature
Length of admission and admission
The level of evidence regarding the outcome measure hospital admission was downgraded by three levels because of study limitations (risk of bias due to lack of blinding in three studies, 1 level); and very wide confidence interval including clinically relevant differences in both directions (imprecision, 2 levels) to Very low GRADE.
Side effects
The level of evidence regarding the outcome measure nausea was downgraded by three levels because of study limitations (risk of bias due to lack of blinding in two studies, 1 level); conflicting results (inconsistency, 1 level) and wide confidence interval including clinically relevant differences in one direction (imprecision, 2 levels) to Very low GRADE.
The level of evidence regarding the outcome measure palpitations was downgraded by three levels because of study limitations (risk of bias due to lack of or unknown blinding in three studies, 1 level); conflicting results (inconsistency); and wide confidence interval including clinically relevant differences in two directions (imprecision, 2 levels) to Very low GRADE.
The level of evidence regarding the outcome measure tremor was downgraded by three levels because of study limitations (risk of bias due to lack of or unknown blinding in two studies, 1 level); and very wide confidence interval including clinically relevant differences in both directions (imprecision, 2 levels) to Very low GRADE.
Asthma score
The level of evidence regarding the outcome measure asthma score was downgraded by two levels because of study limitations (risk of bias due to lack of blinding in one study, 1 level); and the low number of included patients (imprecision, 1 level)
To Low GRADE.
The level of evidence regarding the outcome measure final rise in FEV1 was downgraded by two levels because of study limitations (risk of bias due to lack of blinding in one study, 1 level); and the low number of included patients (imprecision, 1 level) to Low GRADE.
Recurrence
The level of evidence regarding the outcome measure recurrence was not assessed due to the lack of studies.
Patient satisfaction
The level of evidence regarding the outcome measure recurrence was not assessed due to the lack of studies.
Oral steroid use
The level of evidence regarding the outcome measure oral steroid use was not assessed due to the lack of studies.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness and safety of inhalation with holding chambers compared to inhalation with nebulizer in children with asthma exacerbation?
| P: | children with (mild) asthma exacerbation |
| I: | inhalation with nebuliser |
| C: | inhalation with dosis-aerosol through holding chambers (spacers) |
| O: | (length of) admission, side effects, asthma score, recurrence, patient satisfaction, use of oral steroid courses. |
Relevant outcome measures
The guideline development group considered (length of) admission, side effects and asthma score as critical outcome measures for decision making; and recurrence, patient satisfaction and oral steroid use as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following minimal clinically (patient) important differences:
-
Length of admission: 1 day
-
Hospital admission risk: 5%
-
Asthma-score: 20% or 2 points
-
Side effects: 10%
Search and select (Methods)
The search was already performed for the systematic literature analysis for the module ‘Dosisaerosol bij astma-aanval’ (LINK toevoegen Richtlijnendatabase). The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 23 December 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 370 hits. Studies were selected based on the following criteria: systematic reviews that included studies performed in patients with asthma, relevant for the PICO. In the original study selection for the module ‘Dosisaerosol bij astma-aanval’, 24 studies were excluded with reason ‘wrong population’ based on title and abstract screening in the original study selection. These studies were assessed again for the children population. 11 studies were then included based on title and abstract selection. After reading the full text, nine studies were excluded (see the table with reasons for exclusion under the tab Methods, mostly because these were included in the included systematic review), and two studies were included.
Results
Two studies (one SR and 1 additional RCT) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Breuer O, Shoseyov D, Kerem E, Brooks R. Implementation of a Policy Change: Replacement of Nebulizers by Spacers for the Treatment of Asthma in Children. Isr Med Assoc J. 2015 Jul;17(7):421-4. PMID: 26357717.
- Cates CJ, Welsh EJ, Rowe BH. Holding chambers (spacers) versus nebulisers for beta-agonist treatment of acute asthma. Cochrane Database Syst Rev. 2013 Sep 13;2013(9):CD000052. doi: 10.1002/14651858.CD000052.pub3. PMID: 24037768; PMCID: PMC7032675.
- Dhuper S, Chandra A, Ahmed A, Bista S, Moghekar A, Verma R, Chong C, Shim C, Cohen H, Choksi S. Efficacy and cost comparisons of bronchodilatator administration between metered dose inhalers with disposable spacers and nebulizers for acute asthma treatment. J Emerg Med. 2011 Mar;40(3):247-55. doi: 10.1016/j.jemermed.2008.06.029. Epub 2008 Dec 11. PMID: 19081697.
- Doan Q, Shefrin A, Johnson D. Cost-effectiveness of metered-dose inhalers for asthma exacerbations in the pediatric emergency department. Pediatrics. 2011 May;127(5):e1105-11. doi: 10.1542/peds.2010-2963. Epub 2011 Apr 4. PMID: 21464192.
- Leelathipkul L, Tanticharoenwiwat P, Ithiawatchakul J, Prommin D, Sirisalee P, Junhunee P, Poachanukoon O. MDI with DIY Spacer versus Nebulizer for Bronchodilator Therapy in Children Admitted with Asthmatic Attack. J Med Assoc Thai. 2016 Jul;99 Suppl 4:S265-74. PMID: 29927182.
- Payares-Salamanca L, Contreras-Arrieta S, Florez-García V, Barrios-Sanjuanelo A, Stand-Niño I, Rodriguez-Martinez CE. Metered-dose inhalers versus nebulization for the delivery of albuterol for acute exacerbations of wheezing or asthma in children: A systematic review with meta-analysis. Pediatr Pulmonol. 2020 Dec;55(12):3268-3278. doi: 10.1002/ppul.25077. Epub 2020 Sep 25. PMID: 32940961.
- Rodriguez-Martinez CE, Sossa-Briceño MP, Castro-Rodriguez JA. Metered-dose inhalers vs nebulization for the delivery of albuterol in pediatric asthma exacerbations: A cost-effectiveness analysis in a middle-income country. Pediatr Pulmonol. 2020 Apr;55(4):866-873. doi: 10.1002/ppul.24650. Epub 2020 Jan 17. PMID: 31951679.
- Spin P, Sketris I, Hill-Taylor B, Ward C, Hurley KF. A Cost Analysis of Salbutamol Administration by Metered-Dose Inhalers with Spacers versus Nebulization for Patients with Wheeze in the Pediatric Emergency Department: Evidence from Observational Data in Nova Scotia. CJEM. 2017 Jan;19(1):1-8. doi: 10.1017/cem.2016.344. Epub 2016 Aug 10. PMID: 27506243.
- Stutvoet MD, Balemans WAF. Acuut astma in de kliniek: voorzetkamer of vernevelaar? Praktische pediatrie. 2021 Dec; 4, 46-50.
- Tabatabaii SA, Vahedi M, Khanbabaee G, Sadr S, Farahbakhsh N. Comparison of Salbutamol Delivered via Jet Nebulizer With a Metered Dose Inhaler (MDI) Plus a Spacer for Asthma Exacerbation of Children: A Randomized Clinical Trial. Acta Medica Iranica. 2019, 672-677.
- Wildhaber JH, Dore ND, Wilson JM, Devadason SG, LeSouëf PN. Inhalation therapy in asthma: nebulizer or pressurized metered-dose inhaler with holding chamber? In vivo comparison of lung deposition in children. J Pediatr. 1999 Jul;135(1):28-33. doi: 10.1016/s0022-3476(99)70323-9. PMID: 10393600.
Evidence tabellen
Evidence table
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Payares-Salamanca, 2020
Individual study characteristics deduced from Payares 2020
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to February 2020
A: Batra, 1997
B: Chou, 1995
C: Deerojanawong, 2005
D: Delgado, 2003
E: Kerem, 1993
F: Leelathipkul, 2016
G: Maldonado, 1997
H: Mandelberg, 2000
I: Mitselou, 2016
J: Ploin, 2000
K: Robertson, 1997
L: Rubilar, 2000
M: Schuh, 1999
N: Snider, 2015
O: Vangveravong, 2008 |
Inclusion criteria SR: cohort of children <18 y old that had a diagnosis or symptoms suggestive of asthma and that suffered from an acute asthma exacerbation episode managed either in the emergency department or as an inpatient; a RCT of any duration; comparison of albuterol delivered via NEB versus albuterol delivered via MDI+S; assessment and reporting of the rate of hospital admission (primary outcome), or any of the following secondary outcomes: SaO2, HR, respiratory rate, the PIS, adverse effects (tremor, palpitations, emesis), and need for additional treatment (ipratropium bromide, magnesium sulfate).
Exclusion criteria SR: Studies including children with severe asthma exacerbations or those requiring intensive care management; Studies that included additional interventions, such as management with ipratropium bromide in the randomization; studies in languages other than English or Spanish, as well as those reported only in abstract form.
15 studies included
Important patient characteristics at baseline:
N; mean age A: 60; 1-12 y (mean (SD) not reported) B: 152; >2 y (mean (SD) not reported) C: 47; <5 y (mean (SD) not reported) D: 168; 2-24 m (mean (SD) not reported) E: 33; 6-14 y (mean (SD) not reported) F: 40; 1-15 y (mean (SD) not reported) G: 42; 5-15 y (mean (SD) not reported) H: 42; 10 m - 4 y (mean (SD) not reported) I: 98; 0-6 y (mean (SD) not reported) J: 63; 12-60 m (mean (SD) not reported) K: 155; 4-12 y (mean (SD) not reported) L: 123; 1-24 m (mean (SD) not reported) M: 90; 5-17 y (mean (SD) not reported) N: 890; 2-17 y (mean (SD) not reported) O: 54; 5-18 y (mean (SD) not reported)
Sex, total group: A: 46,7% Male B: 55,9% Male C: 63,8% Male D: 66.7% Male E: 69.7% Male F: 72.5% Male G: 54.8% Male H: 31.0% Male I: 68.4% Male J: 61.9% Male K: 67.1% Male L: 67.5% Male M: not reported N: 64.8% Male O: 64,8% Male
Groups comparable at baseline? Not reported |
A: 2 puffs (200 μg) every 5–10 min up to 60 min, with a commercial spacer (M/s Cipla) with a volume of 750 ml and one‐way valve B: Three puffs (270 μg) with a commercial spacer (Aerochamber). Number of treatments were determined by the treating physician, at 20‐min intervals C: 2 puffs (200 μg) with a commercial spacer (Babyhaler), with a volume of 350 ml and low resistance valves. No repeated doses were administered. D: 3 puffs (270 μg) every 20 min for 1 h, with a commercial spacer (Aerochamber) E: 6–10 puffs (600–1000 μg) depending on weight, with a commercial spacer (Vent A. Haler) with a volume of 750 ml and one‐way valve. No repeated doses were administered. F: Home‐made spacer with a one‐way valve. Albuterol was administered every 2–6 h depending on symptoms. No other details are provided G: 2 puffs (200 μg) every 20 min for two doses. No details of the spacer used were provided H: 4 puffs (400 μg) every 20 min for 1 h, with a commercial metal spacer (Nebuchamber), with a volume of 250 ml and low‐resistance valves (with a pressure drop required to open the valve of 1.02–1.27 cm H2O at a flow rate of 15 L/min) I: 4–6 puffs (400–600 μg) depending on weight. Treatment repeated up to three times during the first hour with 20–30 min intervals J: 1 puff per 2 kg body weight (50 μg/kg), maximum 10 puff, with a commercial spacer (Babyhaler), with a volume of 350 ml and low‐resistance valves. Treatment was repeated three times at 20‐min intervals K: 6–12 puff (600–1200 μg) depending on weight, with a commercial spacer (Volumatic). No repeated doses were administered L: 2 puffs (200 μg) every 10 min for five doses, with a commercial spacer (Aerocell), with a volume of 500 ml and with a one‐way valve. M: 6–10 puffs (600–1000 μg) depending on weight (higher dose MDI group) or two puffs (200 μg) (low‐dose MDI group), with a commercial metal spacer (Aerochamber), with a volume of 140 ml and low resistance valves. No repeated doses were administered N: No details of the doses of albuterol nor the spacer used were provided O: 6 puffs (600 μg) with a commercial spacer (Volumatic). Treatment was repeated three times at 20‐min intervals |
A: 0.15 mg/kg (max 5 mg) diluted in 3ml of normal saline, using jet nebulizer at a flow rate of 6 L per min. Three doses given at 20 min intervals B: 0.15 mg/kg (max 5 mg) diluted in 3ml of normal saline, using jet nebulizer at a flow rate of 6 L per min. Number of treatments were determined by the treating physician, at 20‐min intervals C: 0.03 ml/kg diluted in 2.5 ml of normal saline using jet nebulizer at a flow rate of 6 L per min. No repeated doses were administered. D: 0.15 mg/kg diluted in 3ml of normal saline, using a jet nebulizer at a flow rate of 6 L per min. Three doses given at 20 min intervals E: 0.15 mg/kg (max 5 mg) diluted in 3ml of normal saline, using jet nebulizer at a flow rate of 6–10 L per min. No repeated doses were administered. F: Albuterol was administered every 2–6 h, depending on symptoms. No other details are provided G: 0.15 mg/kg (max 5 mg) every 20 min for two doses, using jet nebulizer at a flow rate of 3 L per min H: 2.5 mg diluted in 1.5 ml of normal saline using jet nebulizer at a flow rate of 5 L per min (with an output of 3ml in 6 min, and an MMAD of 0.5–4 μm range). Three doses given at an interval of 20 min I: 4ml (Ventolin 5 mg/ml) continuous nebulization for 1 to 2 min, every 15 min for two doses, using jet nebulizer J: 150 mg/kg diluted in 4ml of normal saline using an ultrasonic nebulizer at a flow rate of 8 L per min (particle size of 0.5–5 μm). Treatment was repeated three times at 20‐min intervals K: 2.5–5mg of albuterol (depending on weight) diluted in 2.5 ml of normal saline using jet nebulizer at a flow rate of 5 L per minute. No repeated doses were administered L: 0.25 mg/kg (max 5 mg) diluted in 3.5 ml of normal saline using jet nebulizer at a flow rate of 7 L per min. Treatment was repeated three times at 20‐min intervals M: 0.15 mg/kg (max 5 mg) every 20 min for two doses, using jet nebulizer. No repeated doses were administered N: No details of the NEB administration were provided O: 0.03 ml/kg (max 1 ml) diluted in 3ml of normal saline using jet nebulizer at a flow rate of 6–8 L per min. Treatment was repeated three times at 20‐min intervals |
End-point of follow-up: not reported in SR
For how many participants were no complete outcome data available? Not reported in SR
|
Defined as hospital admission A: RR (95% CI): 9.00 (95% CI: 0.51 to 160.17) D: RR (95% CI): 0.24 (95% CI: 0.08 to 0.69) E: RR (95% CI): 0.78 (95% CI: 0.30 to 2.07) I: RR (95% CI): 1.37 (95% CI: 0.50 to 3.79) J: RR (95% CI): 1.03 (95% CI: 0.15 to 6.88) M: RR (95% CI): 1.50 (95% CI: 0.27 to 8.34) N: RR (95% CI): 0.93 (95% CI: 0.66 to 1.32) O: RR (95% CI): 3.00 (95% CI: 0.13 to 69.09)
Pooled effect (random effects model): RR 0.89 [95% CI 0.55 to 1.46] favoring MDI Heterogeneity (I2): 32%
Defined as nausea A: RR (95% CI) 0.38 (0.17 to 0.83) D: RR (95% CI) 1.41 (0.60 to 3.32) J: RR (95% CI) 0.34 (0.04 to 3.13) M: RR (95% CI) 1.00 (0.07 to 15.26) N: (95% CI) 0.78 (0.39 to 1.54)
Pooled effect (random effects model): RR 0.71 [95% CI 0.41 to 1.22] favoring MDI Heterogeneity (I2): 27%
Defined as tremor E: RR (95% CI) 0.24 (0.03 to 1.89) L: RR (95% CI) 0.33 (0.04 to 3.07) M: RR (95% CI) 1.00 (0.07 to 15.26) O: RR (95% CI) 1.00 (0.07 to 14.79)
Pooled effect (random effects model): RR 0.45 [95% CI 0.14 to 1.49] favoring MDI Heterogeneity (I2): 0%
Defined as palpitations F: Adverse events, palpitations: RR (95% CI) 0.09 (95% CI: 0.01 to 0.64) NA J: RR (95% CI) 3.09 (0.13 to 73.17) N: RR (95% CI) 0.72 (0.58 to 0.90) O: Adverse events, palpitations: RR (95% CI) 1.00 (95% CI: 0.16 to 6.35)
Pooled effect (random effects model): RR 0.60 [95% CI 0.22 to 1.64] favoring MDI Heterogeneity (I2): 44%
Defined as pulmonary index score, PIS B: MD 0.00 (95% CI: -1.01 to 1.01) D: MD -0.70 (95% CI: -1.02 to -0.38) L: MD -0.60 (95% CI: -1.26 to 0.06)
Pooled effect (random effects model): MD -0.63 [95% CI -0.91 to -0.35] favoring MDI Heterogeneity (I2): 0%
Not reported
Not reported
Not reported
|
The authors concluded that although delivering albuterol through MDI+S was not significantly superior to its delivery through NEB in terms of hospital admission rates, pooled analyses showed a significant reduction in the PIS score and a significantly smaller increase in HR when albuterol was delivered through MDI+S than when it was delivered through NEB.
The risk of bias of individual studies was assessed differently compared to the systematic review of Cates 2013.
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Tabatabaii, 2019 |
Type of study: RCT
Setting and country: children’s hospital emergency department, Iran
Funding and conflicts of interest: not reported |
Inclusion criteria: Age 6 months -14 years, wheezing present on auscultation, and a score> 4 on the respiratory distress assessment scale (RDAS).
Exclusion criteria: Severe respiratory distress requiring admission in a pediatric intensive care unit, and a patient diagnosed with bronchopulmonary dysplasia, cystic fibrosis or congenital cardiopulmonary disorders.
N total at baseline: Intervention: 64 Control: 54
Important prognostic factors2: age ± SD: I: 52.5 ± 33.0 months C: 39.1 ± 37.9 months
Sex: I: 64.5% M C: 63.0% M
Groups comparable at baseline? Yes |
Metered-dose-inhaler (MDI) + spacer Between 2 and 10 puffs of salbutamol MDI (depending on weight) at 15-min intervals via a valve aerosol-holding chamber device wit the aero-chamber masks sealed to their faces and held there for 30 seconds up to five times. |
Nebulizer 0.15 mg per kg of salbutamol (maximum dose of 2.5 mg), up to 5 times every 15 minutes.
|
Length of follow-up: 60 minutes
Loss-to-follow-up: N=0
Incomplete outcome data: N=0
|
Not reported
Not reported
Defined as clinical asthma score, mean (SD) 30 min I: 6.37 (1.97) C: 6.09 (2.01), P=0.34
45 min I: 5.94 (1.99) C: 0.69 (1.99), P=0.34
60 min I: 5.42 (1.86) C: 5.19 (1.74), P=0.33
Not reported
Not reported
Not reported |
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Roncada C, Andrade J, Bischoff LC, Pitrez PM. COMPARISON OF TWO INHALATIONAL TECHNIQUES FOR BRONCHODILATOR ADMINISTRATION IN CHILDREN AND ADOLESCENTS WITH ACUTE ASTHMA CRISIS: A META-ANALYSIS. Rev Paul Pediatr. 2018 Jul-Sep;36(3):364-371. doi: 10.1590/1984-0462/;2018;36;3;00002. Epub 2018 Jul 10. PMID: 29995144; PMCID: PMC6202895. |
Same articles included as in Cates or Payares-Salamanca, no quality assessment of included studies |
|
Iramain R, Castro-Rodriguez JA, Jara A, Cardozo L, Bogado N, Morinigo R, De Jesús R. Salbutamol and ipratropium by inhaler is superior to nebulizer in children with severe acute asthma exacerbation: Randomized clinical trial. Pediatr Pulmonol. 2019 Apr;54(4):372-377. doi: 10.1002/ppul.24244. Epub 2019 Jan 22. PMID: 30672140. |
Wrong I: ipratropium bromide given in intervention and control group; Wrong P: children with severe acute asthma exacerbations |
|
Snider MA, Wan JY, Jacobs J, Kink R, Gilmore B, Arnold SR. A Randomized Trial Comparing Metered Dose Inhalers and Breath Actuated Nebulizers. J Emerg Med. 2018 Jul;55(1):7-14. doi: 10.1016/j.jemermed.2018.03.002. Epub 2018 Apr 30. PMID: 29716819. |
Included in SR Payares-Salamanca |
|
Leelathipkul L, Tanticharoenwiwat P, Ithiawatchakul J, Prommin D, Sirisalee P, Junhunee P, Poachanukoon O. MDI with DIY Spacer versus Nebulizer for Bronchodilator Therapy in Children Admitted with Asthmatic Attack. J Med Assoc Thai. 2016 Jul;99 Suppl 4:S265-74. PMID: 29927182. |
Included in SR Payares-Salamanca |
|
Mitselou N, Hedlin G, Hederos CA. Spacers versus nebulizers in treatment of acute asthma - a prospective randomized study in preschool children. J Asthma. 2016 Dec;53(10):1059-62. doi: 10.1080/02770903.2016.1185114. Epub 2016 May 17. PMID: 27186989. |
Included in SR Payares-Salamanca |
|
Doan Q, Shefrin A, Johnson D. Cost-effectiveness of metered-dose inhalers for asthma exacerbations in the pediatric emergency department. Pediatrics. 2011 May;127(5):e1105-11. doi: 10.1542/peds.2010-2963. Epub 2011 Apr 4. PMID: 21464192. |
Wrong outcome (costeffectiveness), use for overwegingen |
|
Raissy HH, Kelly HW. MDI versus Nebulizers for Acute Asthma. J Pediatr Pharmacol Ther. 2004 Oct;9(4):226-34. doi: 10.5863/1551-6776-9.4.226. PMID: 23118701; PMCID: PMC3469117. |
Update of Cates 2003, search till 2004 |
|
Buxton LJ, Baldwin JH, Berry JA, Mandleco BL. The efficacy of metered-dose inhalers with a spacer device in the pediatric setting. J Am Acad Nurse Pract. 2002 Sep;14(9):390-7. doi: 10.1111/j.1745-7599.2002.tb00140.x. PMID: 12375358. |
Old SR, no quality assessment of included studies |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-10-2024
Beoordeeld op geldigheid : 04-09-2024
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij tweedelijns astmazorg bij kinderen.
Werkgroep
- Dr. E.P. (Eric) de Groot, kinderlongarts, werkzaam bij Zuyderland Medisch Centrum te Heerlen, NVK (voorzitter)
- Drs. S.C. (Sanne) Hammer, kinderlongarts, werkzaam in het Amphia ziekenhuis te Breda, NVK
- Drs. E.A. (Ellen) Croonen, kinderlongarts, werkzaam in het Canisius Wilhelmina Ziekenhuis te Nijmegen, NVK
- Dr. H.T. (Martijn) den Dekker, kinderarts, werkzaam in het ErasmusMC – Sophia kinderziekenhuis te Rotterdam, NVK
- C.G.W. (Christel) Linssen-Geven, kinderlongverpleegkundige, werkzaam in het Catharina Ziekenhuis te Eindhoven, V&VN
- Dr. J.W.M. (Jean) Muris, huisarts en hoogleraar Huisartsgeneeskunde, NHG
- M.A.P. (Marjo) Poulissen-Erinkveld, senior beleidsadviseur, Longfonds & VND (tot mei 2023)
- Drs. Y. (Yvonne) Kappe, senior projectleider, Longfonds & VND (vanaf september 2023)
- E.M. (Esther) van der Roest, VND
- S.T. (Saskia) van Dorst M, ervaringsdeskundige, Longfonds
- E. (Esther) Oosterling-Vonk, Longfonds (vanaf maart 2023)
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Mark) van Eck, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- L.A.M. (Liza) van Mun, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Y. (Yvonne) van Kempen, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen Actie |
|
Jean Muris |
Universiteit Maastricht 1.0 fte |
Geen |
Geen |
Geen restricties |
|
Eric de Groot* |
Kinderlongarts, Zuyderland Medisch Centrum 80% Kinderlongarts Radboud UMC 0-uren (alleen diensten) |
Lid Medische commissie Villa Pardoes (onbetaald) APLS instructeur, SSHK (onbetaald) |
Geen |
Geen restricties |
|
Saskia van Dorst |
Longfonds ErvaringsDeskundige (vrijwilliger Longfonds) |
Geen |
Geen |
Geen restricties |
|
Marjo Poulissen |
Sr.Projectleider Longfonds 36 uur |
Geen |
Ik heb zelf astma, maar ben dan ook mede patientenvertegenwoordiger vanuit Longfonds en astmaVereniging nederland en Davos. |
Geen restricties |
|
Esther van der Roest |
Unitmanager CDL WKZ |
Lid astmaVereniging Nederland en Davos |
Alleen uit arbeid bij UMCU |
Geen restricties |
|
Martijn den Dekker |
Kinderarts – fellow kinderlongziekten, Sophia Kinderziekenhuis / Erasmus MC, Rotterdam. |
Geen |
Geen |
Geen restricties |
|
Sanne Hammer |
Kinderlongarts Amphia |
Geen |
Geen |
Geen restricties |
|
Christel Linssen-Geven |
Kinderlongverpleegkundige Catharina ziekenhuis Eindhoven (betaald) Lid van Taakgroep kinderlongverpleegkundigen (onbetaald) |
Gastdocent op Fontys Eindhoven en HU Utrecht (betaald) |
Geen |
Geen restricties |
|
Ellen Croonen |
Kinderlongarts, Canisius Wilhelmina Ziekenhuis Nijmegen |
Deelname aan beroepsgerelateerde initiatieven, onbetaald. |
SALSA studie; In vivo efficacy of Salbutamol (Sandoz) versus salbutamol (Ventolin GSK) (Salsa study)- Financier: Longfonds |
Geen restricties |
|
Yvonne Kappe |
Sr. Projectleider Longfonds 12 uur Vanuit Longfonds gedetacheerd naar Sr. Projectleider en Beleidsadviseur astmaVereniging Nederland en Davos 12 uur – vanaf 1 september 2023 |
Geen |
Geen |
Geen restrcities |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van meerdere personen vanuit het Longfonds en astmaVereniging Nederland en Davos in de werkgroep. Op verschillende momenten is input gevraagd tijdens een invitational conference en bij het opstellen van het raamwerk. Het verslag van de invitational conference (zie bijlagen] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module FeNO in diagnostisch traject |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module LTRA vs ICS bij recidiverend piepen |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module SCIT en SLIT bij kinderen met allergische astma |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Titreren behandeling op basis van FeNO |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Voorzetkamer of vernevelapparaat bij longaanval astma |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase heeft de NVK sectie Kinderlongziekten modules van de richtlijn Astma bij kinderen geprioriteerd voor herziening. Tevens zijn er knelpunten uitgevraagd in een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van vijf uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Literature search strategy
Embase
|
No. |
Query |
Results |
|
#11 |
#10 NOT #9 RCT |
238 |
|
#10 |
#5 AND #8 |
277 |
|
#9 |
#4 AND #8 SR |
100 |
|
#8 |
#3 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
748 |
|
#7 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
12751231 |
|
#6 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#5 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1839814 |
|
#4 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#3 |
#1 AND #2 |
850 |
|
#2 |
'inhaler'/exp/mj OR 'metered dose inhaler'/exp OR 'bronchoair':ti,ab,kw OR 'easi-breathe':ti,ab,kw OR 'evohaler':ti,ab,kw OR 'k-haler':ti,ab,kw OR 'medihaler':ti,ab,kw OR 'pulmospheres':ti,ab,kw OR 'redihaler':ti,ab,kw OR 'smartmist':ti,ab,kw OR 'twisthaler':ti,ab,kw OR 'xcelovent':ti,ab,kw OR 'dose inhaler*':ti,ab,kw OR 'turbuhaler*':ti,ab,kw OR 'dose aerosol':ti,ab,kw OR 'holding chamber*':ti,ab,kw |
12790 |
|
#1 |
'asthma attack'/exp OR 'asthma exacerbation'/exp OR 'asthmatic state'/exp OR 'acute severe asthma':ti,ab,kw OR 'severe acute asthma':ti,ab,kw OR 'status asthmaticus':ti,ab,kw OR ((asthma* NEAR/3 (cris?s OR shock OR state OR attack* OR exacerbation*)):ti,ab,kw) OR (('asthma'/exp OR asthma:ti,ab,kw) AND ('respiratory failure'/exp OR 'fatal attack*':ti,ab,kw OR 'near fatal':ti,ab,kw OR 'respiratory failure':ti,ab,kw)) OR 'acute asthma':ti,ab,kw |
30458 |
Ovid/Medline
Search Strategy:
|
# |
Searches |
Results |
|
8 |
7 not 6 RCT |
194 |
|
7 |
3 and 4 |
222 |
|
6 |
3 and 5 SR |
44 |
|
5 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
537332 |
|
4 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1338921 |
|
3 |
1 and 2 |
457 |
|
2 |
Metered Dose Inhalers/ or bronchoair.ti,ab,kf. or easi-breathe.ti,ab,kf. or evohaler.ti,ab,kf. or k-haler.ti,ab,kf. or medihaler.ti,ab,kf. or pulmospheres.ti,ab,kf. or redihaler.ti,ab,kf. or smartmist.ti,ab,kf. or twisthaler.ti,ab,kf. or xcelovent.ti,ab,kf. or dose inhaler*.ti,ab,kf. or turbuhaler*.ti,ab,kf. or dose aerosol.ti,ab,kf. or holding chamber*.ti,ab,kf. |
5022 |
|
1 |
Status Asthmaticus/ or acute severe asthma.ti,ab,kf. or severe acute asthma.ti,ab,kf. or status asthmaticus.ti,ab,kf. or (asthma* adj3 (cris?s or shock or state or attack* or exacerbat*)).ti,ab,kf. or ((exp Asthma/ or asthma.ti,ab,kf.) and (Airway Obstruction/ or fatal attack*.ti,ab,kf. or near fatal.ti,ab,kf. or respiratory failure.ti,ab,kf.)) or acute asthma.ti,ab,kf. |
19799 |