Titreren behandeling op basis van FeNO
Uitgangsvraag
Wat is het klinische nut van FeNO in het behandeltraject van kinderen met niet-ernstig astma?
Aanbeveling
Gebruik geen FeNO bij het titreren van de behandeling van astma bij kinderen verdacht van niet-ernstig astma.
Overweeg het gebruik van FeNO bij kinderen met frequente longaanvallen of ongecontroleerd astma.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek uitgevoerd naar het effect van FeNO bij de behandeling van astma bij kinderen. Het aantal longaanvallen, astmasymptomen en astma controle zijn gedefinieerd als kritische uitkomstmaten; kwaliteit van leven, verandering in longfunctie en luchtwegontsteking als belangrijke uitkomstmaten.
Een systematische review uitgevoerd door Cochrane Nederland in opdracht van het ZorgInstituut in 2021 vormde de basis van de literatuuranalyse. De search uit dat rapport is geüpdatet om nieuwe literatuur te vinden die na het uitkomen van dat rapport is verschenen. Daaruit is nog één additionele studie gekomen die is meegenomen in de analyse.
Monitoring middels FeNO liet een klinisch relevant verschil zien ten opzichte van de standaardbehandeling. Het gevonden effect van op het aantal longaanvallen lijkt met name samen te hangen met ongecontroleerd astma. De bewijskracht voor deze bevinding is laag.
Er werd geen klinisch relevant verschil gevonden in astmacontrole en de bewijskracht voor deze bevinding is laag. Er werd geen klinisch relevant verschil gevonden in kwaliteit van leven en de bewijskracht voor deze bevinding is laag. Er werd geen klinisch relevant verschil gevonden in longfunctie en de bewijskracht voor deze bevinding is laag. Tenslotte is er geen literatuur gevonden op het effect van astma symptomen en luchtwegontsteking. We concluderen dat er in de literatuur geen belangrijke verschillen werden gevonden tussen het gebruik van FeNO en de standaardbehandeling.
De literatuur toont bij subgroepen van kinderen dat het gevonden effect van monitoring middels FeNO op het aantal longaanvallen met name lijkt samen te hangen met ongecontroleerd astma. Voor de overige subgroepen (astma-ernst, allergie/atopie en obesitas) werden in de literatuur geen verschillen gevonden.
In de literatuur is er naast een klein, klinisch niet relevant effect op aantal longaanvallen een gunstig effect beschreven op het aantal longaanvallen leidend tot een behandeling met orale corticosteroïden. Wel zijn er aanwijzingen dat de dagelijkse dosering inhalatiecorticosteroïden hoger is bij een FeNO-gestuurde behandeling ten opzichte van een niet-FeNO-gestuurde behandeling.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
FeNO is snel en non-invasief te meten. Hiermee vormt het een minimale belasting voor de patiënt. Gezien de non-invasieve en minimaal belastende aard zal dit in de praktijk niet of nauwelijks tot bezwaren leiden bij patiënten en/of ouders/verzorgers.
Kosten (middelenbeslag)
Apparatuur om FeNO te meten is relatief duur (minimale prijs >3000 USD). Daarnaast is regelmatig onderhoud en kalibratie vereist. Ook wordt gebruik gemaakt van eenmalig te gebruiken mondstukken, filters, test cassettes en dergelijken.
Aanvaardbaarheid, haalbaarheid en implementatie
Het gebruik van FeNO in de klinische praktijk is relatief eenvoudig te implementeren en vraagt een minimale belasting van zorgmedewerkers en patiënten. Wel dient naast de kosten rekening te worden gehouden met onder andere de effecten van (omgevings)factoren en de leeftijd van de patiënt.
Een aantal (omgevings)factoren heeft enige invloed op FeNO, zoals het tijdstip van de dag, bepaalde dranken en voedingsmiddelen, bovenste luchtweginfecties en recent uitgevoerde spirometrie. In de praktijk zijn alleen bovenste luchtweginfecties en recent uitgevoerde spirometrie van belang, en zijn voeding of dagvariatie van geringe betekenis.
Jonge leeftijd kan een beperkende factor vormen voor het verrichten van een adequate FeNO-meting. Dit komt met name door de vereiste techniek, waarbij gedurende een aantal seconden een expiratoire plateaufase bereikt dient te worden. Bij kinderen jonger dan 12 jaar dient deze expiratoire plateaufase minimaal 4 seconden te duren om een reproduceerbare waarde te krijgen. Bij kinderen vanaf 4 jaar is het mogelijk om een ‘single breath’ meting met een dynamische ‘flow restrictor’ te verrichten, waarmee reproduceerbare metingen verricht kunnen worden. Bij kinderen jonger dan 4 jaar wordt gebruik gemaakt van tidal-breathing technieken. Het probleem bij deze techniek is dat er geen flowcontrole is, terwijl de meting van FeNO sterk flowafhankelijk is. Daarnaast is het nog onduidelijk of bij kinderen jonger dan 4 jaar contaminatie met NO uit de bovenste luchtweg plaatsvindt, doordat de sinussen bij hen voor een groot deel nog niet aangelegd zijn. In de praktijk wordt daarom vanaf de leeftijd van 4 jaar FeNO-metingen verricht.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
FeNO is een snelle, non-invasieve en daarmee weinig belastende meting. Systematisch onderzoek van de literatuur toont dat monitoring middels FeNO een klinisch relevant verschil maakt ten opzichte van de standaardbehandeling. Dit effect lijkt echter gelimiteerd tot patiënten met ongecontroleerd astma. De bewijskracht voor deze bevinding is laag. Daarnaast is er geen klinisch relevant verschil ten aanzien van astma-controle, en is er geen literatuur beschikbaar over het voorkomen van astmasymptomen. De bewijskracht voor deze bevindingen is laag. In een algemene astmapopulatie lijkt de meerwaarde van een FeNO-gestuurde behandeling dan ook beperkt. Mogelijk is de meerwaarde er wel voor de subgroep van patiënten met frequentere longaanvallen of ongecontroleerd astma. Er zijn aanwijzingen dat de dagelijkse dosering inhalatiecorticosteroïden hoger is bij een FeNO-gestuurde behandeling ten opzichte van een niet-FeNO-gestuurde behandeling.
Geconcludeerd kan worden dat het gebruik van FeNO geen aanvullende klinische waarde lijkt te hebben ten opzichte van de huidige standaardbehandeling.
Wij bevelen het gebruik van FeNO voor de behandeling van astma bij kinderen dan ook niet aan.
Onderbouwing
Achtergrond
In (inter)nationale richtlijnen worden verschillende adviezen gegeven met betrekking tot het gebruik van FeNO (fractional exhaled nitric oxide) metingen in de dagelijks praktijk. In de meeste richtlijnen wordt beschreven dat het gebruik van FeNO in de ‘algemene astmapopulatie’ wordt afgeraden, maar dat meer inzicht nodig is m.b.t. het gebruik van FeNO bij specifieke subgroepen. In 2016 zijn twee Cochrane reviews verschenen over kinderen en volwassenen (Petsky, 2016a en 2016b), over de rol van FeNO-levels bij de behandeling van niet-ernstig astma. Hierin werd gesteld dat algemeen gebruik van FeNO om de behandeling af te stemmen niet kan worden aangeraden bij kinderen en volwassenen. Mogelijk dat het voor bepaalde subgroepen wel klinisch nuttig is om FeNO in te zetten bij de diagnosestelling of om de behandeling op af te stemmen. Er zijn sinds de publicatie van eerdergenoemde Cochrane reviews nieuwe wetenschappelijke artikelen gepubliceerd over het onderwerp. De vraagstelling in deze module is wat de rol is van FeNO in het behandeltraject van kinderen verdacht van niet-ernstig astma.
Conclusies / Summary of Findings
Cruciaal
|
Redelijk GRADE |
Het gebruik van FeNO leidde tot een 39% lagere odds op ≥1 longaanval. Het aantal patiënten waarbij de behandeling afgestemd moet worden op basis van de FeNO-meting in plaats van gebruikelijke zorg, om één patiënt minder met ≥1 longaanval te hebben is 12 (95% BI; 8 tot 33).
Bron: Damen, 2021; Turner, 2022 |
|
Laag GRADE |
Er zijn aanwijzingen dat het gebruik van FeNO leidt tot 0,44 minder longaanvallen per jaar
Bron: Damen, 2021; Turner, 2022 |
|
Geen GRADE |
Er is geen evidence gevonden over het effect van FeNO op astmasymptomen vergeleken met de standaardbehandeling bij kinderen met astma.
|
|
Laag GRADE |
Een verschil in effect met betrekking tot de Asthma Control Test kon worden aangetoond noch worden verworpen
Bron: Damen, 2021; Turner, 2022 |
|
Laag GRADE |
Er zijn aanwijzingen dat het gebruik van FeNO leidt tot een hogere dagelijkse dosering van inhalatiecorticosteroïden (budesonide equivalent)
Bron: Damen, 2021; Turner, 2022 |
Belangrijk
|
Laag GRADE |
Een verschil in effect met betrekking tot kwaliteit van leven kon worden aangetoond noch worden verworpen
Bron: Damen, 2021 |
|
Geen GRADE |
Een verschil in effect met betrekking tot de FEV1 percentage van voorspeld kon worden aangetoond noch worden verworpen
Bron: Damen, 2021; Turner, 2022 |
|
Geen GRADE |
Er is geen evidence gevonden over het effect van FeNO op luchtwegontsteking vergeleken met de standaardbehandeling bij kinderen met astma. |
Samenvatting literatuur
Beschrijving van studies
De systematische review van Petsky (2018) includeerde RCT’s waarin het klinisch nut van het instellen van de astmabehandeling met behulp van FeNO vergeleken werd met het niet gebruiken van FeNO, bijvoorbeeld het instellen van de behandeling op basis van symptomen, spirometrie, huidige richtlijnen of een combinatie hiervan. De auteurs identificeerden negen onderzoeken bij kinderen met in totaal 1322 deelnemers. De review beschreef de volgende uitkomsten: aantal deelnemers met ≥1 longaanval tijdens de studieperiode, aantal longaanvallen per jaar, aantal ernstige longaanvallen leidend tot ziekenhuisopname, astma-gerelateerde kwaliteit van leven, ernstige longaanvallen met noodzaak tot het nemen van orale corticosteroïden, dosis inhalatiecorticosteroïden bij het laatste bezoek, FEV1 percentage van voorspeld (‘percentage predicted’ ppFEV1) bij het laatste bezoek, symptomen gemeten met de Asthma Control Test (ACT) en FeNO-waarde bij het laatste bezoek. De kwaliteit van de review was goed. AMSTAR-2 items waar echter minder goed op gescoord werd, zijn rationale voor de geïncludeerde onderzoeksdesigns (item 3), dubbele data-extractie (item 6) en onderzoek naar publicatiebias (item 15) (Tabel 1 in bijlagen).
De studie (Turner, 2022) die werd toegevoegd op basis van de geüpdatet search evalueerde of het gebruik van metingen van FeNO in combinatie met standaardzorg de astmaresultaten bij kinderen van 6 tot 15 jaar kan verbeteren. Deze RCT omvatte 313 kinderen met astma die willekeurig toegewezen om ofwel standaardzorg ofwel FeNO-geleide behandeling in combinatie met standaardzorg te ontvangen. De FeNO-groep kreeg hun behandeling aangepast op basis van hun FeNO-niveaus, terwijl de standaardzorggroep hun behandeling kreeg aangepast op basis van klinische symptomen. De studie evalueerde het aantal longaanvallen (behandeld met corticosteroïden), astma controle en kwaliteit van leven in de periode van twaalf maanden na de start van de behandeling.
Resultaten
1. Longaanvallen (cruciaal)
Aantal longaanvallen
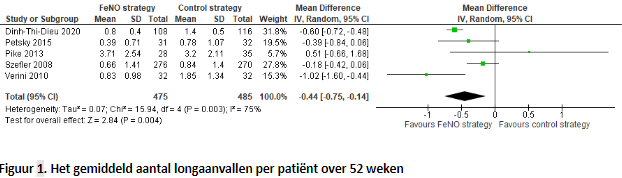
In totaal rapporteerden zes studies het gemiddelde aantal longaanvallen per patiënt dat optrad na één jaar follow-up tijd, waarvan vijf studies bruikbare data hadden om te poolen, omdat Turner (2022) de mediaan rapporteerde en geen gemiddelde (Figuur 1). Na het poolen van de data bestond de FeNO-groep uit 475 patiënten en de controlegroep uit 485 patiënten. Er werd een gepoold gemiddeld verschil gevonden van -0,44 (95% BI; -0,75 tot -0,14). Dit betekent dat wanneer FeNO wordt gebruikt in het behandeltraject er gemiddeld 0,44 minder longaanvallen zijn.
Turner (2022) beschreef het totale aantal longaanvallen over één jaar follow-up. In de FeNO-groep zaten 255 patiënten en werden er 254 longaanvallen gerapporteerd. In de controlegroep zaten 251 patiënten en werden er 255 longaanvallen gerapporteerd. De aangepaste incidentieratio voor het aantal longaanvallen voor de patiënten in de interventiegroep relatief aan de gebruikelijke behandeling is 0,99 (95% BI; 0,82 tot 1,18).
Eén of meer longaanvallen
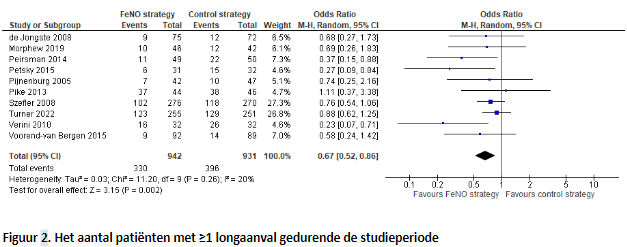
In tien onderzoeken werd het effect van het gebruik van de FeNO-strategie op het aantal patiënten met ≥1 longaanval gedurende de studieperiode onderzocht (Figuur 2). Na het poolen van de data bestond de FeNO-groep uit 942 patiënten en de controle groep uit 931 patiënten. Er werd een odds ratio gevonden van 0,67 (95% BI; 0,52 tot 0,86) ten gunste van de FeNO groep. Het aantal patiënten dat behandeld moet worden om één patiënt minder te hebben die minstens één longaanval heeft is 12 (95% BI; 8 tot 33).
De literatuur toont bij subgroepen van kinderen dat het gevonden effect van monitoring middels FeNO op het aantal longaanvallen met name lijkt samen te hangen met ongecontroleerd astma. Voor de overige subgroepen (astma-ernst, allergie/atopie en obesitas) werden in de literatuur geen verschillen gevonden.
2. Astma symptomen (cruciaal)
Er werden geen studies gevonden die astma symptomen rapporteerden.
3. Astma controle (cruciaal)
Vragenlijst
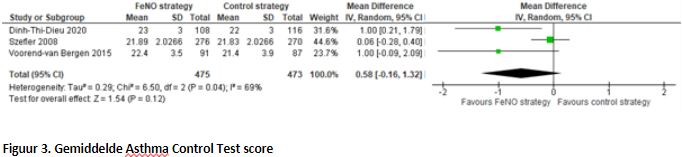
In totaal rapporteerden vier studies de mate de astma controle (Figuur 3). Drie studies hadden bruikbare data om te poolen en deze gebruikten allemaal de ACT-vragenlijst. Na het poolen van de data bestond de FeNO-groep uit 475 patiënten en in de controlegroep uit 473 patiënten. Er werd een gepoold gemiddeld verschil gevonden van 0,58 (95% BI; -0,16 tot 1,32). Dit betekent dat de gemiddelde ACT-score 0,58 hoger is in de FeNO-groep dan in de controlegroep, maar dit verschil is niet statistisch verschillend en niet klinisch relevant.
Turner (2022) beschreef de interkwartielafstand van de ACT en Childhood Asthma Control Test (CACT) scores. De FeNO-groep bestond na één jaar uit 475 patiënten met een mediane score van 22,0 (IQR; 18 tot 24). De gebruikelijke zorg groep bestond na één jaar 473 uit patiënten met een mediane score van 21,0 (IQR; 18 tot 24). Het gestandaardiseerd gemiddeld verschil tussen de groepen van de ACT/CACT over de twaalf maanden follow-up was 0,05 (95% BI; -0,47 tot 0,58).
Medicatie gebruik
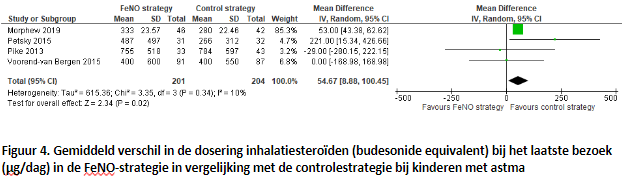
In totaal rapporteerden elf onderzoeken, waarvan tien werden beschreven in het Cochrane rapport, informatie over de dosering inhalatiesteroïden (budesonide equivalent) bij het laatste bezoek. Vier van deze onderzoeken presenteerden de exacte dosering en werden opgenomen in de forest plot (Figuur 4). De FeNO-groep bestond uit 475 patiënten en de controlegroep uit 473 patiënten. Een statistisch significant hogere dosis van een gemiddeld verschil van 54,67 werd gevonden in de FeNO-groep in vergelijking tot de controlegroep (95% BI; 8,88 tot 100,45). Dit verschil werd met name gedreven door één onderzoek. De spreiding in de dosering inhalatiesteroïden was klein in dit onderzoek, mogelijk vanwege de homogene populatie van kinderen met matig-ernstige astma, wat leidt tot een hoog gewicht van meer dan 85% in de meta-analyse. Ditzelfde onderzoek vond echter wel een lagere cumulatieve dosis per jaar in de FeNO-groep ten opzichte van een gemiddeld verschil in de controlegroep van -177,00 (95% BI; -263,62 tot -90,38). De auteurs geven geen verklaring voor dit tegenstrijdige resultaat. Van de overige zes onderzoeken vonden er vier geen verschil in dagelijkse dosis inhalatiecorticosteroïden tussen de twee groepen en vonden er twee een hogere dosis in de FeNO-groep.
Turner (2022) beschreef de mediane en interkwartielafstand van de dagelijkse dosis inhalatiecorticosteroïden aan het begin van de studie en daarna elke drie maanden tot het einde van de studie na twaalf maanden. Het mediane budesonide equivalent van de FeNO-groep aan het einde van de studie was 500 μg (IQR; 400 μg, 1000 μg) en van de controlegroep 400 μg (IQR; 400 μg, 1000 μg). Het aangepaste gemiddeld verschil tussen de groepen in de dosis is -10,88 μg (95% BI; -70,76 μg tot 49,01 μg).
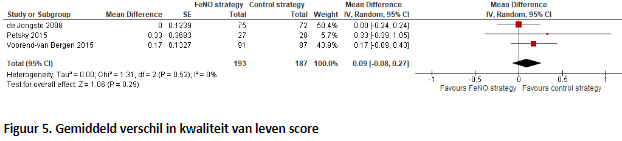
4. Kwaliteit van leven (belangrijk)
In totaal rapporteerden drie studies de kwaliteit van leven (Figuur 5). Na het poolen van de data bestond de FeNO-groep uit 193 patiënten en de controlegroep uit 187 patiënten. Er werd een gepoold gemiddeld verschil van 0,09 (95% BI; -0,08 tot 0,27) gevonden. Dit betekent dat de kwaliteit van leven 0,09 punten hoger is in de controlegroep, maar dit verschil is niet statistisch verschillend en niet klinisch relevant.
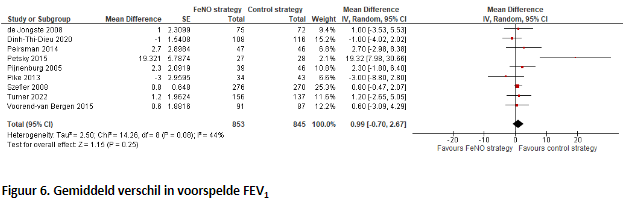
5. Verandering in longfunctie (belangrijk)
In elf onderzoeken werd het FEV1 percentage van voorspeld beschreven en hiervan konden er negen worden opgenomen in de forest plot (Figuur 6). Na het poolen van de data bestond de FeNO-groep uit 193 patiënten en de controlegroep uit 187 patiënten In de meerderheid van deze negen onderzoeken werd geen verschil gevonden tussen de groepen en ook wanneer de resultaten samengenomen werden, kon een verschil worden aangetoond noch worden verworpen (MD=1,02; 95% BI -0,92 tot 2,95). Ook in de twee onderzoeken die niet konden worden opgenomen in de forest plot, werd geen verschil gevonden tussen de groepen. Dit verschil werd echter niet gekwantificeerd.
6. Luchtwegontsteking (belangrijk)
Er werden geen studies gevonden die astmasymptomen rapporteerden.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat minimaal één longaanvallen volgens GRADE was ‘redelijk’, vanwege kans op vertekening (risk of bias).
De bewijskracht voor de uitkomstmaat gemiddeld aantal longaanvallen volgens GRADE was ‘laag‘, vanwege kans op vertekening (risk of bias) en onnauwkeurigheid.
De bewijskracht voor de uitkomstmaat kwaliteit van leven volgens GRADE was ‘laag’, vanwege kans op vertekening (risk of bias) en onnauwkeurigheid.
De bewijskracht voor de uitkomstmaat kwaliteit van leven volgens GRADE was ‘laag’, vanwege kans op vertekening (risk of bias) en onnauwkeurigheid.
De bewijskracht voor de uitkomstmaat longfunctie volgens GRADE was ‘laag’, vanwege een grote kans op vertekening (risk of bias).
De bewijskracht voor de uitkomstmaten astmasymptomen en luchtwegontsteking zijn niet beoordeeld vanwege het ontbreken van studies.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the benefits and risks of FeNO-guided asthma management compared with treatment based on symptoms and lung function alone in children with asthma?
| P: | Children with asthma |
| I: | FeNO-guided asthma management |
| C: | Asthma management based on symptoms and lung function |
| O: |
Critical: (severe) exacerbations, asthma symptoms, and asthma control; Important: (disease-specific) quality of life, change in lung function, and airway inflammation) |
Relevant outcome measures
The guideline development group considered the number of exacerbations, asthma symptoms, and asthma control as critical outcome measures for decision making; and (disease specific) quality of life, change in lung function, and airway inflammation as important outcome measures for decision making.
The working group did not define the above outcome measures a priori, but used the definitions used in the studies.
The working group defined 25% as a minimal clinically (patient) important difference for risk ratios (0.80 ≤ RR ≤ 1.25), 10% of the maximum score for quality of life scales and 0.5 for standardized mean differences.
Search and select (Methods)
A report made by the Dutch Cochrane organization (Damen, 2021), commissioned by the ZorgInstituut, was found. After discussing with its authors, the report’s literature analysis was copied as the basis for this module. The original search for the report was conducted in the Medline and Embase databases with relevant search terms up to 22 September 2020. For this module, the previously used search was re-run on 3 February 2023 to include the most recent literature. The detailed search strategy is also shown under the Methods tab. The meta-analyses from the Cochrane report have been updated with the more recent studies. The literature analysis was published in Dutch and therefore this module reports in Dutch.
Resultaten
In het Cochrane rapport (Damen, 2021) werden negen onderzoeken afkomstig uit een systematische review (Petsky, 2018) geïncludeerd voor de literatuuranalyse over het nut van FeNO bij de behandeling van astma bij kinderen. Op basis van de geüpdatet search van het Cochrane rapport is nog één extra studie is geïncludeerd. Daarmee komt het totaal aantal studies op tien. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Damen J, Heus P, Spijker R, Jenniskens K, Kamm I, Nijman S, Vernooij R, Ghannad M, Korevaar D, Hooft L. Nut van FeNO bij de diagnostiek en behandeling van specifieke groepen astmapatiënten [Internet]; 2021 Jun 9. Available from: https://www.zorginstituutnederland.nl/binaries/zinl/documenten/rapport/2021/06/09/cochrane-rapport-nut-van-feno-bij-astma/Cochrane-rapport+Nut+van+FeNO+bij+de+diagnostiek+en+behandeling+van+specifieke+groepen+astmapatienten.pdf
- Turner S, Cotton S, Wood J, Bell V, Raja EA, Scott NW, Morgan H, Lawrie L, Emele D, Kennedy C, Scotland G, Fielding S, MacLennan G, Norrie J, Forrest M, Gaillard E, de Jongste J, Pijnenburg M, Thomas M, Price D. Treatment guided by fractional exhaled nitric oxide in addition to standard care in 6- to 15-year-olds with asthma: the RAACENO RCT. Effic Mech Evaluation [Internet]. 2022 May [cited 2023 Apr 17];9(4):1-154. Available from: https://doi.org/10.3310/awoi5587
Evidence tabellen
Methodological quality of the systematic review
AMSTAR-2 Tabel van de systematic reviews van Petsky (2016)
|
Domain |
Instructions (Check all that apply) |
Judgement |
Comments (optional) |
|
PICO components |
1. Did the research questions and inclusion criteria for the review include the components of PICO?
For Yes: ☒ Population ☒ Intervention ☒ Comparator group ☒ Outcome
Optional (recommended) ☒ Timeframe for follow up |
☒Yes ☐No |
|
|
Protocol |
2. Did the report of the review contain an explicit statement that the review methods were established prior to the conduct of the review and did the report justify any significant deviations from the protocol?
For Partial Yes: The authors state that they had a written protocol or guide that included ALL the following: ☒ review question(s) ☒ a search strategy ☒ inclusion/exclusion criteria ☒ a risk of bias assessment
For Yes: As for partial yes, plus the protocol should be registered and should also have specified: ☒ a meta-analysis/synthesis plan, if appropriate, and ☒ a plan for investigating causes of heterogeneity ☒ justification for any deviations from the protocol
|
☒Yes ☐Partial Yes ☐No |
This is a Cochrane review and the protocol was not obtained, however all Cochrane reviews have a protocol that meets extensive criteria and the review had a section describing deviations from the protocol. |
|
Study design explanation
|
3. Did the review authors explain their selection of the study designs for inclusion in the review?
For Yes, the review should satisfy ONE of the following: ☐ Explanation for including only RCTs ☐ OR Explanation for including only NRSI ☐ OR Explanation for including both RCTs and NRSI
|
☐Yes ☒No
|
Authors did not provide an explanation for excluding NRSI.
|
|
Comprehensive search strategy
|
4. Did the review authors use a comprehensive literature search strategy?
For Partial Yes (all the following): ☒ searched at least 2 databases (relevant to research question) ☒ provided key words and/or search strategy ☒ justified publication restrictions (e.g. language)
For Yes, should also have (all the following): ☒ searched the reference lists / bibliographies of included studies ☒ searched trial/study registries ☒ included/consulted content experts in the field ☒ where relevant, searched for grey literature ☒ conducted search within 24 months of completion of the review
|
☒Yes ☐Partial Yes ☐No
|
|
|
Duplicate study selection
|
5. Did the review authors perform study selection in duplicate?
For Yes, either ONE of the following: ☒ at least two reviewers independently agreed on selection of eligible studies and achieved consensus on which studies to include ☐ OR two reviewers selected a sample of eligible studies and achieved good agreement (at least 80 percent), with the remainder selected by one reviewer. |
☒Yes ☐No
|
|
|
Duplicate data extraction
|
6. Did the review authors perform data extraction in duplicate?
For Yes, either ONE of the following: ☐at least two reviewers achieved consensus on which data to extract from included studies ☐ OR two reviewers extracted data from a sample of eligible studies and achieved good agreement (at least 80 percent), with the remainder extracted by one reviewer.
|
☐Yes ☒No
|
Study characteristics were extracted by one reviewer and checked by a second reviewer. Outcome data were extracted by two reviewers independently.
|
|
Details of excluded studies
|
7. Did the review authors provide a list of excluded studies and justify the exclusions?
For Partial Yes: ☒ provided a list of all potentially relevant studies that were read in full-text form but excluded from the review
For Yes, must also have: ☒ Justified the exclusion from the review of each potentially relevant study
|
☒Yes ☐Partial Yes ☐No
|
|
|
Description of included studies
|
8. Did the review authors describe the included studies in adequate detail?
For Partial Yes (ALL the following): ☒ described populations ☒ described interventions ☒ described comparators ☒ described outcomes ☒ described research designs
For Yes, should also have ALL the following: ☒ described population in detail ☒ described intervention in detail (including doses where relevant) ☒ described comparator in detail (including doses where relevant) ☒ described study’s setting ☒ timeframe for follow-up
|
☒Yes ☐Partial Yes ☐No
|
|
|
Risk of bias assessment (RCTs)
|
9. Did the review authors use a satisfactory technique for assessing the risk of bias (RoB) in individual studies that were included in the review?
For Partial Yes, must have assessed RoB from ☒ unconcealed allocation, and ☒ lack of blinding of patients and assessors when assessing outcomes (unnecessary for objective outcomes such as all cause mortality)
For Yes, must also have assessed RoB from: ☒ allocation sequence that was not truly random, and ☒ selection of the reported result from among multiple measurements or analyses of a specified outcome
|
☒Yes ☐Partial Yes ☐No ☐Includes only NRSI
|
|
|
Risk of bias assessment (NRSI)
|
10. Did the review authors use a satisfactory technique for assessing the risk of bias (RoB) in individual studies that were included in the review?
For Partial Yes, must have assessed RoB: ☐ from confounding, and ☐ from selection bias
For Yes, must also have assessed RoB: ☐ methods used to ascertain exposures and outcomes, and ☐ selection of the reported result from among multiple measurements or analyses of a specified outcome
|
☐Yes ☐Partial Yes ☐No ☒Includes only RCTs
|
|
|
Funding sources |
11. Did the review authors report on the sources of funding for the studies included in the review?
For Yes ☒ Must have reported on the sources of funding for individual studies included in the review. Note: Reporting that the reviewers looked for this information but it was not reported by study authors also qualifies
|
☒Yes ☐No
|
Reported as part of risk of bias assessment.
|
|
Meta-analyses (RCTs) |
12. If meta-analysis was performed did the review authors use appropriate methods for statistical combination of results?
For Yes: ☒ The authors justified combining the data in a meta-analysis ☒ AND they used an appropriate weighted technique to combine study results and adjusted for heterogeneity if present. ☒ AND investigated the causes of any heterogeneity |
☒Yes ☐No ☐No meta-analysis conducted ☐Includes only NRSI
|
|
|
Meta-analyses (NRSI)
|
13. If meta-analysis was performed did the review authors use appropriate methods for statistical combination of results?
For Yes: ☐ The authors justified combining the data in a meta-analysis ☐ AND they used an appropriate weighted technique to combine study results, adjusting for heterogeneity if present ☐ AND they statistically combined effect estimates from NRSI that were adjusted for confounding, rather than combining raw data, or justified combining raw data when adjusted effect estimates were not available ☐ AND they reported separate summary estimates for RCTs and NRSI separately when both were included in the review
|
☐Yes ☐No ☐No meta-analysis conducted ☒Includes only RCTs
|
|
|
Impact of bias on meta-analysis
|
14. If meta-analysis was performed, did the review authors assess the potential impact of RoB in individual studies on the results of the meta-analysis or other evidence synthesis?
For Yes: ☐ included only low risk of bias RCTs ☒ OR, if the pooled estimate was based on RCTs and/or NRSI at variable RoB, the authors performed analyses to investigate possible impact of RoB on summary estimates of effect.
|
☒Yes ☐No ☐No meta-analysis conducted
|
A sensitivity analysis was conducted excluding studies at high risk of bias.
|
|
Risk of bias and interpretation results |
15. Did the review authors account for RoB in individual studies when interpreting/ discussing the results of the review?
For Yes: ☐ included only low risk of bias RCTs ☒ OR, if RCTs with moderate or high RoB, or NRSI were included the review provided a discussion of the likely impact of RoB on the results
|
☒Yes ☐No
|
|
|
Heterogeneity
|
16. Did the review authors provide a satisfactory explanation for, and discussion of, any heterogeneity observed in the results of the review?
For Yes: ☐ There was no significant heterogeneity in the results ☒ OR if heterogeneity was present the authors performed an investigation of sources of any heterogeneity in the results and discussed the impact of this on the results of the review
|
☒Yes ☐No
|
|
|
Publication bias
|
17. If they performed quantitative synthesis did the review authors carry out an adequate investigation of publication bias (small study bias) and discuss its likely impact on the results of the review?
For Yes: ☐ performed graphical or statistical tests for publication bias and discussed the likelihood and magnitude of impact of publication bias
|
☐Yes ☒No ☐No meta-analysis conducted
|
Formal tests were not possible due to low number of studies, and this was not further discussed in the discussion.
|
|
Conflicts of interest
|
18. Did the review authors report any potential sources of conflict of interest, including any funding they received for conducting the review?
For Yes: ☒ The authors reported no competing interests OR ☐ The authors described their funding sources and how they managed potential conflicts of interest
|
☒Yes ☐No
|
|
Evidence table
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
De Jongste, 2008 |
Type of study: Randomised controlled trial
Setting and country: Secondary asthma care, The Netherlands and Italy
Funding: The study was supported by the company (Aerocrine AB, Sweden) who manufactured the FeNO analyser.
Conflict of interest: |
Inclusion criteria: Participants aged 6 to 18 yrs, stable mild-moderate asthma, diagnosed according
Exclusion criteria: Active smoking, previous admission to an ICU for asthma and concomitant disease
N total at baseline: Intervention: 75 Control: 72
Important prognostic factors: For example age ± SD: I: 11.6 ± 2.6 C: 11.8 ± 4.3
Sex (% male) I: 61.3% male C: 75% male
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
FeNO self-monitoring
|
Describe control (treatment/procedure/test):
Symptom-based |
Length of follow-up: 30 weeks
Loss-to-follow-up: 4 randomised participants (2 in FeNO group, 2 in symptom group) were excluded from final results due
|
Outcome measures and effect size (include 95%CI and p-value if available):
Quality of life: Mean difference: 0 (95% CI; -0.24 to 0.24)
|
|
|
Dinh-Thi-Dieu, 2020 |
Type of study: Randomised controlled trial
Setting and country: Various clinical departments of health centers in Vietnam
Source of funding: Not reported
Competing interests: All the authors declare no conflict of interests. |
Inclusion criteria: All children with uncontrolled asthma, who were between the ages of 6–17 years and under discontinued asthma treatment in the previous months or who had untreated asthma were included.” The children had high level of FeNO. “The diagnosis of asthma was based on the criteria recommended by GINA for children over five years.
Exclusion criteria: Asthmatic children having one of the following features were excluded: other significant chronic or acute non-respiratory diseases, acute respiratory infections, severe asthma exacerbations needing systemic corticosteroid therapy (oral or injection) at inclusion, or who were unable to do a laboratory test. Asthmatic children with non-reproducible FEV1 and FENO measurements were also excluded in the present study.
N total at baseline: Intervention: 108 Control: 116
Important prognostic factors: Age ± SD: I: 11 ± 5 C: 10 ± 4
Sex (% male) I: 63.8% C:62.0%
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
FeNO + GINA |
Describe control (treatment/procedure/test):
GINA |
Length of follow-up:
Loss-to-follow-up: Intervention: (%) Reasons (describe)
Control: (%) Reasons (describe)
Incomplete outcome data: Intervention: (%) Reasons (describe)
Control: (%) Reasons (describe) |
Outcome measures and effect size (include 95%CI and p-value if available):
Number of exacerbations per patient: I: 0.8 ( 95% CI; 0.7 to 0.9) C: 1.4 (95% CI; 1.3 to 1.5)
Asthma Control Test: I: 23.0 (95% CI; 22.4 to 23.6) C: 22.0 (95% CI; 21.4 to 22.6)
|
|
|
Petsky, 2015 |
Type of study: Randomised controlled trial
Setting and country: Secondary asthma care, Australia and Hong Kong
Funding:
Conflict of interest: None mentioned |
Inclusion criteria: Children aged > 4 yrs with persistent asthma, prescribed anti-inflammatory asthma
Exclusion criteria: underlying cardio-respiratory illnesses such as bronchiectasis or tracheomalacia,
N total at baseline: Intervention: 31 Control: 32
Important prognostic factors: Age I: Median age 10.17 yrs (IQR 6.56 to 12.69), C: Median age 10.08 yrs (IQR 6.25 to 12.44),
Sex (% male) I: 58.1% male C:40.6% male
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
FeNO + atopic status |
Describe control (treatment/procedure/test):
Symptom-based |
Length of follow-up: 12 months
Loss-to-follow-up: 8 children did not complete the study (4 in FeNO group and 4 in control group).) |
Outcome measures and effect size (include 95%CI and p-value if available):
Number of exacerbations per patient: I: 0.39 (95% CI; 0.13 to 0.65) C: 0.78 (95% CI; 0.39 to 1.17)
Quality of life: Mean difference: 0.33 (95% CI; -0.39 to 1.05)
|
|
|
Pike, 2013 |
Type of study: Randomised controlled trial
Setting and country: Secondary asthma care, UK
Funding: None reported
Conflict of interest: None reported. |
Inclusion criteria: : aged 6 to 17 yrs, clinical diagnosis of asthma and treatment with beclomethasone
Exclusion criteria: None reported.
N total at baseline: Intervention: 28 Control: 35
Important prognostic factors: Age ± SD: I: 10.51 yrs (SD 2.62), C:11.42 yrs (SD 2.69)
Sex (% male) I: 47.7% C: 65.2%
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
FeNO + symptom-based |
Describe control (treatment/procedure/test):
Symptom-based |
Length of follow-up: 12 months Loss-to-follow-up: 13 children did not complete the study; 10 in FeNO group (8 withdrew, 1 non-adherence to protocol, 1 |
Outcome measures and effect size (include 95%CI and p-value if available):
Number of exacerbations per patient: I: 3.71 (95% CI; 2.73 to 4.69) C: 3.20 (95% CI; 2.48 to 3.92)
|
|
|
Szefler, 2008 |
Type of study: Randomised controlled trial
Setting and country: Secondary asthma care, USA
Funding:
Conflict of interest: |
Inclusion criteria: Aged 12 to 20 yrs, diagnosed with asthma by their physician, symptoms of persistent
Exclusion criteria: None reported
N total at baseline: Intervention: 276 Control: 270
Important prognostic factors: Age ± SD: I: 14.4 years C: 14.4 years
Sex (% male) I: 52.9% C: 52.6%
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
FeNO + symptoms, FEV1 |
Describe control (treatment/procedure/test):
NAEPP |
Length of follow-up: 46 weeks
Loss-to-follow-up: 12 randomised participants were lost to follow-up before the first outcome data were collected. During |
Outcome measures and effect size (include 95%CI and p-value if available):
Number of exacerbations per patient: I: 0.66 (95% CI; 0.49 to 0.83) C: 0.84 (95% CI; 0.67 to 1.00)
Asthma Control Test: I: 21.89 (95% CI; 21.65 to 22.13) C: 21.83 (95% CI; 21.59 to 22.07)
|
|
|
Turner, 2022 |
Type of study: Randomised controlled trial
Setting and country: Secondary asthma care, UK
Funding: The project was funded by the Efficacy and Mechanism Evaluation (EME) programme,
Conflict of interest: Steve Turner reports that Circassia (Oxford, UK) lent to the institution (University of Leicester); an investigator-led research grant from Circassia, Gilead (Foster City, CA, USA) and Chiesi Ltd (Manchester, UK); and research collaboration with Medimmune |
Inclusion criteria: - Asthma diagnosed or confirmed by consultant paediatrician or respiratory/asthma specialist nurse
Exclusion criteria: Unable to provide FeNO measurement at the baseline assessment (expected prevalence of < 5%).
N total at baseline: Intervention: 255 Control: 251
Important prognostic factors2: For example age ± SD: I: 10.7 years C: 10.7 years
Sex: I: 61.2% male C: 58.8% male
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
FeNO-guided treatment escalated either anti-inflammatory medication (algorithm 1, elevated FeNO) or early intervention with bronchodilators (algorithm 2, FeNO not elevated). The response to increasing ICs or the addition of LABA or LTRA is known to be heterogeneous in children, and this algorithm uses FeNO to stratify treatment with early escalation of IC treatment or early addition of LABA and LTRA ‘add-on’ therapies, an approach that has been proven in a FeNO trial in pregnant mothers.
|
Describe control (treatment/procedure/test):
Asthma treatment was guided by symptoms alone.
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: 0 (0%) Reasons (describe) NA
Control: 0 (0%) Reasons (describe) NA
Incomplete outcome data: Intervention: 0 (0%) Reasons (describe) NA
Control: 3 (1.2%) Reasons (describe) Missing primary outcome data
|
Outcome measures and effect size (include 95%CI and p-value if available):
Total number of exacerbations: I: 254 C: 255
Asthma Control Test: Median ACT score
I: 22.0 (IQR; 18 – 24) C: 21.0 (IQR; 18 – 24)
|
Author comments: In children with asthma being cared for in secondary care asthma clinics, the addition of FeNO to |
|
Verini, 2010 |
Type of study: Randomised controlled trial
Setting and country: Secondary asthma care, Italy
Funding: No information provided
Conflict of interest: No information provided |
Inclusion criteria: all children had been admitted for allergic asthma and the diagnosis physician based
Exclusion criteria: None reported
N total at baseline: Intervention: 32 Control: 32
Important prognostic factors: Age ± SD: I: 10.7 (SD 2.4) C: 11.3 (SD 2.1)
Sex (% male) I: 56.3% C: 56.3%
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
FeNO + sympoms, lung function |
Describe control (treatment/procedure/test):
Symptoms, lung function |
Length of follow-up: 12 months
Loss-to-follow-up: All children completed the study |
Outcome measures and effect size (include 95%CI and p-value if available):
Number of exacerbations per patient: I: 0.83 (95% CI; 0.48 to 1.18) C: 1.85 (95% CI; 1.37 to 2.33)
|
|
|
Voorend- Van Bergen, 2015 |
Type of study: Randomised controlled trial
Setting and country: Secondary asthma care, The Netherlands
Funding:
Conflict of interest: |
Inclusion criteria: Aged 4 to 18 yrs, atopic asthma based on clinical symptoms, previous bronchodilator
Exclusion criteria: None reported
N total at baseline: Intervention: 92 Control: 89
Important prognostic factors: Age ± SD: I: 10.3 yrs (SD 2.9) C: 10.1 9SD 3.2)
Sex (% male) I: 67.4% C: 68.5%
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
FeNO + asthma control
|
Describe control (treatment/procedure/test):
Asthma control |
Length of follow-up:
Loss-to-follow-up: All patients completed the intervention |
Outcome measures and effect size (include 95%CI and p-value if available):
Asthma Control Test: I: 22.4 (95% CI; 21.7 to 23.1) C: 21.4 (95% CI; 20.6 to 22.2)
Quality of life: Mean difference: 0.17 (95% CI; -0.09 to 0.43)
|
|
Risk of bias tables
|
Reference
|
Random sequence generation |
Allocation concealment |
Blinding of participants and personnel |
Blinding of outcomes assessment |
Incomplete outcome data |
Selective reporting |
Other |
|
de Jongste 2008 |
Unclear |
Unclear |
High |
High |
Low |
Unclear |
High |
|
Dinh-Thi-Dieu 2020 |
Unclear |
Unclear |
Unclear |
Unclear |
Unclear |
Unclear |
Low |
|
Fritsch 2006 |
Unclear |
Unclear |
Unclear |
Unclear |
High |
High |
High |
|
Morphew 2019 |
Low |
Low |
Low |
Unclear |
Unclear |
High |
Low |
|
Peirsman 2014 |
Unclear |
Low |
Low |
Unclear |
Low |
Low |
Unclear |
|
Petsky 2015 |
Low |
Low |
Low |
Low |
Low |
High |
Low |
|
Pijnenburg 2005 |
Unclear |
Unclear |
Low |
Low |
High |
Unclear |
Unclear |
|
Pike 2013 |
Low |
Low |
Low |
Low |
High |
Unclear |
High |
|
Szefler 2008 |
Low |
Low |
Low |
Low |
Low |
High |
Unclear |
|
Verini 2010 |
Unclear |
Unclear |
High |
High |
Unclear |
High |
Unclear |
|
Voorend-van Bergen 2015 |
Low |
Unclear |
High |
Low |
Low |
Low |
Unclear |
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Turner, 2022 |
Definitely yes
Reason: Random |
Definitely yes:
Reason: The principal investigator (PI), or the individual at a site with delegated authority, accessed the web-based randomisation system. Minimisation characteristics (centre, age, sex and asthma severity) were entered into the web-based system, which returned the allocation. |
Definitely no
Reason: This pragmatic study design used an ‘open-label’ design, given that participants, researchers and the |
Probably yes
Reason: 0 dropouts in one group, 3 in the other group. No reason given why the data was unavailable |
Definitely yes
Reason: study protocol is available and protocol amendments are given in the study appendix |
Probably no
Reason: large list of conflicts of interest |
Some concerns
|
Table of excluded studies
Not applicable.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-10-2024
Beoordeeld op geldigheid : 04-09-2024
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij tweedelijns astmazorg bij kinderen.
Werkgroep
- Dr. E.P. (Eric) de Groot, kinderlongarts, werkzaam bij Zuyderland Medisch Centrum te Heerlen, NVK (voorzitter)
- Drs. S.C. (Sanne) Hammer, kinderlongarts, werkzaam in het Amphia ziekenhuis te Breda, NVK
- Drs. E.A. (Ellen) Croonen, kinderlongarts, werkzaam in het Canisius Wilhelmina Ziekenhuis te Nijmegen, NVK
- Dr. H.T. (Martijn) den Dekker, kinderarts, werkzaam in het ErasmusMC – Sophia kinderziekenhuis te Rotterdam, NVK
- C.G.W. (Christel) Linssen-Geven, kinderlongverpleegkundige, werkzaam in het Catharina Ziekenhuis te Eindhoven, V&VN
- Dr. J.W.M. (Jean) Muris, huisarts en hoogleraar Huisartsgeneeskunde, NHG
- M.A.P. (Marjo) Poulissen-Erinkveld, senior beleidsadviseur, Longfonds & VND (tot mei 2023)
- Drs. Y. (Yvonne) Kappe, senior projectleider, Longfonds & VND (vanaf september 2023)
- E.M. (Esther) van der Roest, VND
- S.T. (Saskia) van Dorst M, ervaringsdeskundige, Longfonds
- E. (Esther) Oosterling-Vonk, Longfonds (vanaf maart 2023)
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Mark) van Eck, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- L.A.M. (Liza) van Mun, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Y. (Yvonne) van Kempen, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen Actie |
|
Jean Muris |
Universiteit Maastricht 1.0 fte |
Geen |
Geen |
Geen restricties |
|
Eric de Groot* |
Kinderlongarts, Zuyderland Medisch Centrum 80% Kinderlongarts Radboud UMC 0-uren (alleen diensten) |
Lid Medische commissie Villa Pardoes (onbetaald) APLS instructeur, SSHK (onbetaald) |
Geen |
Geen restricties |
|
Saskia van Dorst |
Longfonds ErvaringsDeskundige (vrijwilliger Longfonds) |
Geen |
Geen |
Geen restricties |
|
Marjo Poulissen |
Sr.Projectleider Longfonds 36 uur |
Geen |
Ik heb zelf astma, maar ben dan ook mede patientenvertegenwoordiger vanuit Longfonds en astmaVereniging nederland en Davos. |
Geen restricties |
|
Esther van der Roest |
Unitmanager CDL WKZ |
Lid astmaVereniging Nederland en Davos |
Alleen uit arbeid bij UMCU |
Geen restricties |
|
Martijn den Dekker |
Kinderarts – fellow kinderlongziekten, Sophia Kinderziekenhuis / Erasmus MC, Rotterdam. |
Geen |
Geen |
Geen restricties |
|
Sanne Hammer |
Kinderlongarts Amphia |
Geen |
Geen |
Geen restricties |
|
Christel Linssen-Geven |
Kinderlongverpleegkundige Catharina ziekenhuis Eindhoven (betaald) Lid van Taakgroep kinderlongverpleegkundigen (onbetaald) |
Gastdocent op Fontys Eindhoven en HU Utrecht (betaald) |
Geen |
Geen restricties |
|
Ellen Croonen |
Kinderlongarts, Canisius Wilhelmina Ziekenhuis Nijmegen |
Deelname aan beroepsgerelateerde initiatieven, onbetaald. |
SALSA studie; In vivo efficacy of Salbutamol (Sandoz) versus salbutamol (Ventolin GSK) (Salsa study)- Financier: Longfonds |
Geen restricties |
|
Yvonne Kappe |
Sr. Projectleider Longfonds 12 uur Vanuit Longfonds gedetacheerd naar Sr. Projectleider en Beleidsadviseur astmaVereniging Nederland en Davos 12 uur – vanaf 1 september 2023 |
Geen |
Geen |
Geen restrcities |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van meerdere personen vanuit het Longfonds en astmaVereniging Nederland en Davos in de werkgroep. Op verschillende momenten is input gevraagd tijdens een invitational conference en bij het opstellen van het raamwerk. Het verslag van de invitational conference (zie bijlagen] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module FeNO in diagnostisch traject |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module LTRA vs ICS bij recidiverend piepen |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module SCIT en SLIT bij kinderen met allergische astma |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Titreren behandeling op basis van FeNO |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Voorzetkamer of vernevelapparaat bij longaanval astma |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase heeft de NVK sectie Kinderlongziekten modules van de richtlijn Astma bij kinderen geprioriteerd voor herziening. Tevens zijn er knelpunten uitgevraagd in een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van vijf uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Literature search strategy
Embase
|
No. |
Query |
Results |
|
#17 |
#15 AND #16 sleutelartikelen gevonden |
4 |
|
#16 |
#8 OR #9 |
241 |
|
#15 |
#11 OR #12 OR #13 OR #14 sleutelartikelen |
4 |
|
#14 |
fielding AND chest AND 2019 AND fev*:ti NOT less:ti |
1 |
|
#13 |
'exhaled nitric oxide levels to guide treatment for children with asthma' AND 2016 |
1 |
|
#12 |
'reducing asthma attacks in children using exhaled nitric oxide (raaceno) as a biomarker to inform treatment strategy' |
1 |
|
#11 |
'effectiveness of fractional exhaled nitric oxide for asthma management in children: a systematic review and meta-analysis' |
1 |
|
#10 |
#9 NOT #8 RCT |
150 |
|
#9 |
#5 AND #7 |
181 |
|
#8 |
#5 AND #6 SR |
91 |
|
#7 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
2001381 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
890244 |
|
#5 |
#4 AND [1-1-2012]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1255 |
|
#4 |
#3 AND ('adolescent'/exp OR 'boy'/exp OR 'child'/de OR 'minors'/exp/mj OR 'pediatric patient'/exp OR 'pediatrics'/exp OR 'schoolchild'/exp OR minors*:ti,ab OR boy:ti,ab OR boys:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab) |
3181 |
|
#3 |
#1 AND #2 |
8674 |
|
#2 |
'asthma'/exp OR 'bronchus hyperreactivity'/exp OR 'airway obstruction'/exp OR (((airway OR airflow OR repirator*) NEAR/2 (obstruct* OR occlusion* OR closure)):ti,ab,kw) OR ((bronch* NEAR/2 (hyperreactiv* OR 'hyper reactiv*' OR hyperrespons* OR 'hyper respons*')):ti,ab,kw) OR asthma*:ti,ab,kw OR wheez*:ti,ab,kw OR breathles*:ti,ab,kw |
414078 |
|
#1 |
'fractional exhaled nitric oxide'/exp OR 'fractional exhaled nitric oxide test'/exp OR 'feno':ti,ab,kw OR ((exhaled NEAR/3 (no OR 'nitric oxide*')):ti,ab,kw) |
11317 |
Ovid/Medline
|
# |
Searches |
Results |
|
14 |
12 not 11 not 10 |
752 |
|
13 |
11 not 10 RCT |
231 |
|
12 |
4 and (8 or 9) |
960 |
|
11 |
4 and 7 |
258 |
|
10 |
5 and 6 SR |
53 |
|
9 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5320871 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4323436 |
|
7 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1570437 |
|
6 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
635341 |
|
5 |
limit 4 to yr="2012 -Current" |
970 |
|
4 |
3 and (child* or schoolchild* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or childhood or teen or teens or teenager* or puberty).tw. |
1576 |
|
3 |
1 and 2 |
4433 |
|
2 |
Fractional Exhaled Nitric Oxide Testing/ or (Breath Tests/ and Exhalation/) or feno.ti,ab,kf. or (exhaled adj3 ("NO" or nitric oxide*)).ti,ab,kf. |
7267 |
|
1 |
exp Asthma/ or Bronchial Hyperreactivity/ or Airway Obstruction/ or ((airway or airflow or repirator*) adj2 (obstruct* or occlusion* or closure)).ti,ab,kf. or (bronch* adj2 (hyperreactiv* or hyper reactiv* or hyperrespons* or hyper respons*)).ti,ab,kf. or asthma*.ti,ab,kf. or wheez*.ti,ab,kf. or breathles*.ti,ab,kf. |
242639 |