FeNO in diagnostisch traject
Uitgangsvraag
Wat is het klinisch nut van FeNO in het diagnostisch traject van kinderen verdacht van niet-ernstig astma?
Aanbeveling
Gebruik geen FeNO voor het stellen van de diagnose astma bij kinderen tussen de 6 en 18 jaar met verdenking op astma.
Overweeg FeNO bij kinderen tussen de 6 en 18 jaar met verdenking op astma waarbij geen spirometrie uitgevoerd kan worden. Wees ervan bewust dat er dan kinderen met astma gemist worden of onterecht gediagnosticeerd worden.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek gedaan naar de rol van FeNO in het diagnostisch traject van kinderen verdacht van niet-ernstig astma. Sensitiviteit en specificiteit werden gedefinieerd als cruciale uitkomstmaten.
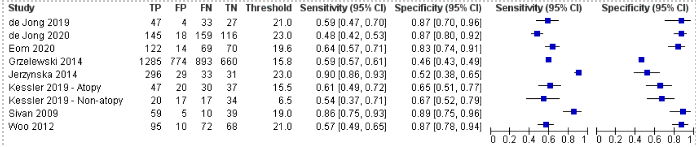
Een Cochrane rapport uit 2021 werd gevonden die negen studies over de diagnostische waarde van FeNO bij kinderen beschreef (Damen, 2021). De gepoolde sensitiviteit van deze studies kwam uit op 66% en was gebaseerd om de optimale afkapwaarde zoals beschreven in de studie (mediane afkapwaarde 19 ppb; bereik van 6,5 tot 23ppb). Dit betekent dat 34% van de kinderen met astma ten onrechte niet gediagnosticeerd worden. De gepoolde specificiteit kwam uit op 75% en dat betekent dat 25% van de kinderen zonder astma ten onrechte worden geclassificeerd als hebbende astma. De bewijskracht zowel de sensitiviteit als de specificiteit kwam uit op zeer laag.
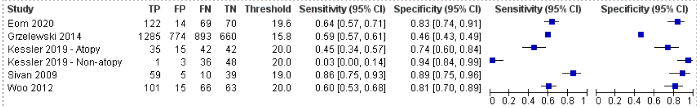
Wanneer werd gekeken naar een afkapwaarde tussen de 10 en 20 ppb, werden er zes studies geïncludeerd. De gepoolde sensitiviteit van deze studies kwam uit op 51%, wat betekent dat 49% van de kinderen met astma ten onrechte niet gediagnosticeerd worden. De gepoolde specificiteit kwam uit op 80% en dat betekent dat 20% van de kinderen zonder astma ten onrechte worden geclassificeerd als hebbende astma. De bewijskracht zowel de sensitiviteit als de specificiteit kwam uit op zeer laag.
Wanneer werd gekeken naar een afkapwaarde tussen de 35 en 45 ppb, werden er vier studies geïncludeerd. De gepoolde sensitiviteit van deze studies kwam uit op 21%, wat betekent dat 79% van de kinderen met astma ten onrechte niet gediagnosticeerd worden. De gepoolde specificiteit kwam uit op 95% en dat betekent dat 5% van de kinderen zonder astma ten onrechte worden geclassificeerd als hebbende astma. De bewijskracht van de sensitiviteit kwam uit op zeer laag en van de specificiteit op matig.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De uitvoering van FeNO test is voor de patiënt korter en gemakkelijker dan het verrichten van spirometrie en reversibiliteits onderzoek. Echter gezien de bevindingen van de search is het de vraag of deze test kan bijdragen in het diagnostisch traject van astma. Daarvoor is te weinig evidence.
Voor de patiënt waarbij longfunctie lastig is te meten, kan FeNO een alternatief zijn.
Kosten (middelenbeslag)
De uitvoerbaarheid van de test is gemakkelijk voor de meeste kinderen, en vlot uitgevoerd. Het zou een goed bruikbaar middel in de eerste en tweede lijn kunnen zijn mits de evidence goed is. Gezien de bevindingen van de Cochrane review is het niet aan te bevelen om FeNO meting te gebruiken in het diagnostische traject van astma.
Aanvaardbaarheid, haalbaarheid en implementatie
Het bepalen van FeNO in diagnostisch traject van astma bij kinderen is aantrekkelijk omdat het snel en gemakkelijk uitvoerbaar is. De begeleider heeft geen lange studietijd nodig om de test succesvol te laten zijn. Kortom, het zou in de eerste en tweede lijn een ideale test zijn. Echter, gezien de uitkomsten van de Cochrane is er onvoldoende evidence om de FeNO meting standaard in te zetten in het diagnostisch traject van astma bij kinderen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Hoewel het gebruiksgemak en gebruiksvriendelijkheid van de FENO test heel goed is, is de evidence voor betrouwbaarheid voor stellen van de juiste diagnose onvoldoende. Het juiste afkappunt is niet beschreven.
Onderbouwing
Achtergrond
In internationale en nationale richtlijnen worden verschillende adviezen gegeven met betrekking tot het gebruik van FeNO (fractional exhaled nitric oxide) meting. In de meeste richtlijnen wordt beschreven dat het gebruik van FeNO in de ‘algemene astmapopulatie’ wordt afgeraden, maar dat meer inzicht nodig is m.b.t. het gebruik van FeNO bij specifieke subgroepen. In 2016 zijn twee Cochrane reviews verschenen over kinderen en volwassenen (Petsky, 2016), over de rol van FeNO-levels bij de behandeling van astma. Hierin werd gesteld dat algemeen gebruik van FeNO om de behandeling af te stemmen niet kan worden aangeraden bij kinderen en volwassenen. Mogelijk dat het voor bepaalde subgroepen wel klinisch nuttig is om FeNO in te zetten bij de diagnosestelling of om de behandeling op af te stemmen. Er zijn sinds de publicatie van eerdergenoemde Cochrane reviews nieuwe wetenschappelijke artikelen gepubliceerd over het onderwerp. De vraagstelling in deze module is wat de rol is van FeNO in het diagnostisch traject van kinderen verdacht van niet-ernstig astma.
Conclusies / Summary of Findings
De conclusies zijn, met toestemming van de auteurs, overgenomen uit het Cochrane rapport (2021).
FeNO afkapwaarde mediaan 19 ppb
Sensitiviteit
|
Very low GRADE |
Bij kinderen met verdenking op astma zijn er aanwijzingen dat bij het gebruik van FeNO (mediane afkapwaarde van 19 ppb (range 6,5 ppb tot 23 ppb) in de ingesloten studies) 34% van de kinderen met astma ten onrechte niet gediagnosticeerd worden.
Bron: de Jong, 2020; de Jong, 2019; Eom, 2020; Grzelewski, 2014; Jerzyńska, 2014; Kessler, 2019; Martins, 2017; Woo, 2012; Sivan, 2009 |
Specificiteit
|
Very low GRADE |
Bij kinderen met verdenking op astma zijn er aanwijzingen dat bij het gebruik van FeNO (mediane afkapwaarde van 19 ppb (range 6,5 ppb tot 23 ppb) in de ingesloten studies) 25% van de kinderen zonder astma ten onrechte worden geclassificeerd als hebbende astma.
Bron: de Jong, 2020; de Jong, 2019; Eom, 2020; Grzelewski, 2014; Jerzyńska, 2014; Kessler, 2019; Martins, 2017; Woo, 2012; Sivan, 2009 |
Afkapwaarden tussen 10 en 20ppb
Sensitiviteit
|
Very low GRADE |
Bij kinderen met verdenking op astma zijn er aanwijzingen dat bij het gebruik van FeNO, wanneer een afkapwaarde tussen de 10 en 20 ppb als definitie voor astma wordt aangehouden, 49% van de kinderen met astma ten onrechte niet gediagnosticeerd worden.
Bron: Eom, 2020; Grzelewski, 2014; Kessler, 2019; Sivan, 2009; Woo, 2012 |
Specificiteit
|
Very low GRADE |
Bij kinderen met verdenking op astma zijn er aanwijzingen dat bij het gebruik van FeNO, wanneer een afkapwaarde tussen de 10 en 20 ppb als definitie voor astma wordt aangehouden, 20% van de kinderen zonder astma ten onrechte worden geclassificeerd als hebbende astma.
Bron: Eom, 2020; Grzelewski, 2014; Kessler, 2019; Sivan, 2009; Woo, 2012 |
Afkapwaarden tussen 35 en 45 ppb
Sensitiviteit
|
Very low GRADE |
Bij kinderen met verdenking op astma zijn er aanwijzingen dat bij het gebruik van FeNO, wanneer een afkapwaarde tussen de 35 en 45 ppb als definitie voor astma wordt aangehouden, 79% van de kinderen met astma ten onrechte niet gediagnosticeerd worden.
Bron: de Jong, 2019; Kessler, 2019; Woo, 2012 |
Specificiteit
|
Moderate GRADE |
Bij kinderen met verdenking op astma zijn er aanwijzingen dat bij het gebruik van FeNO, wanneer een afkapwaarde tussen de 35 en 45 ppb als definitie voor astma wordt aangehouden, 5% van de kinderen zonder astma ten onrechte worden geclassificeerd als hebbende astma.
Bron: de Jong, 2019; Kessler, 2019; Woo, 2012 |
Samenvatting literatuur
Beschrijving studies
Van de twee ingesloten SR’s richtten twee zich op FeNO bij de diagnostiek van astma in het algemeen (Karrasch, 2017; Wang, 2018). In evidencetabellen wordt alle beschikbare informatie over de twee SR’s samengevat.
De publicatie van Karrasch (2017) beschrijft een SR die de diagnostische testaccuratesse van FeNO bij astma heeft onderzocht. Een heranalyse van de data van deze SR werd beschreven in de publicatie van Schneider (2017), waarbij een nieuw statistisch model werd toegepast dat gebruik maakt van alle beschikbare afkapwaarden om de accuratesse van FeNO voor de diagnose astma te bepalen. In november 2015 werd gezocht naar onderzoeken die FeNO vergeleken met een referentiestandaard om astma te diagnosticeren. Zesentwintig onderzoeken (4518 deelnemers; kinderen en volwassenen) werden geïncludeerd. Behalve een meta-analyse van alle ingesloten onderzoeken, werd de subgroep ‘ideale onderzoeksopzet’ geanalyseerd (gedefinieerd als: prospectieve onderzoeken met consecutieve inclusie van ongediagnosticeerde, voornamelijk steroïednaïeve patiënten met symptomen die passen bij astma (niet beperkt tot een specifieke groep) bij wie FeNO metingen gedaan worden volgens de huidige richtlijnen met gebruik van goed gedefinieerde afkapwaarden en adequate referentiestandaarden). Daarnaast werd een overzicht gegeven van de sensitiviteit en specificiteit voor alle beschikbare afkapwaarden. De SR voldeed aan alle AMSTAR 2-criteria, alleen ontbrak informatie over bronnen van financiering van geïncludeerde onderzoeken (item 10) en werd potentiële invloed van vertekening niet meegenomen in de interpretatie van de resultaten (item 13).
Wang en collega’s (publicaties in 2017 en 2018) zochten in april 2017 naar onderzoeken die FeNO vergeleken met een referentiestandaard (klinische diagnose, bronchodilatatie en/of bronchoprovocatie) bij deelnemers vanaf de leeftijd van vijf jaar. Er werden 43 onderzoeken met in totaal 13747 deelnemers ingesloten. Voor verschillende gebieden van FeNO-afkapwaarden (<20 ppb, 20-29 ppb, 30-39 ppb en >40 ppb) werden sensitiviteit en specificiteit, diagnostische odds ratio’s en likelihoodratio’s berekend voor volwassenen, voor kinderen en voor alle leeftijden. Daarnaast werden analyses uitgevoerd voor de volgende subgroepen: atopische patiënten, niet-rokers, rokers en onderzoeken met positieve bronchoprovocatie als referentiestandaard. Met uitzondering van de onderbouwing voor de keuze voor bepaalde onderzoeksdesigns (item 3) en informatie over bronnen van financiering van geïncludeerde onderzoeken (item 10), werd aan alle criteria van AMSTAR 2 voldaan.
De prevalentie van astma varieerde bij de kinderen van 11% tot 85%.
Drie van de 10 onderzoeken bij kinderen werden uitgevoerd in Polen (Grzelewski, 2016; Grzelewski, 2014; Jerzyńska 2014); twee in Zwitserland (Jong, 2020; Jong, 2019); twee in de Republiek Korea (Eom, 2020; Woo, 2012) en telkens één in Duitsland (Kessler, 2019), Portugal (Martins, 2017) en Israël (Sivan, 2009). Onderzoekspopulaties varieerden qua grootte van 111 (Jong, 2019) tot 3612 (Grzelewski, 2016) deelnemers, alle met verdenking op astma. De gemiddelde leeftijden van de onderzoekspopulaties lagen tussen de negen (Jong, 2020; Martins, 2017) en 12 jaar (Woo, 2012; Sivan, 2009). Geen van de onderzoeken includeerde kinderen jonger dan vier jaar. Tot twee van de onderzoeken werden geen gebruikers van inhalatiecorticosteroïden toegelaten (Kessler, 2019; Woo, 2012). Kessler en collega’s en Martins en collega’s onderzochten subgroepen van kinderen met en zonder atopie. De helft van de onderzoeken maakte gebruik van chemiluminescentie voor de FeNO-bepaling (Eom, 2020; Jerzyńska, 2014; Grzelewski, 2014; Woo, 2012; Sivan, 2009) en de andere helft van elektrochemische detectie. Om astma te diagnosticeren vormde in twee onderzoeken een klinische diagnose op basis van alle beschikbare informatie uit het diagnostische traject de referentiestandaard (Jong, 2020; Jong, 2019). In een derde onderzoek werd enkel bronchoprovocatie als referentiestandaard gehanteerd (Kessler, 2019) en in het vierde onderzoek óf bronchodilatatie óf bronchoprovocatie (Martins, 2017). De overige zes onderzoeken volgden richtlijnen van de Global Initiative for Asthma (GINA) als referentiestandaard.
De kans op vertekening in deze onderzoeken en applicability concerns staan in de QUADAS-2 tabel in de bijlagen. Vanwege een niet-consecutieve patiënten selectie en/of het includeren van een selecte populatie, scoorden vier onderzoeken een hoge kans op vertekening voor patiëntenselectie (Eom, 2020; Martins, 2017; Jerzyńska, 2014; Grzelewski, 2014) en twee tevens een verminderde toepasbaarheid (Grzelewski, 2016; Martins, 2017). Op twee onderzoeken (Jerzyńska, 2014; Grzelewski, 2014) na was de kans op vertekening met betrekking tot de indextest hoog, met name vanwege het niet vooraf definiëren van de afkapwaarde van FeNO. In vier onderzoeken werd de kans op vertekening betreffende de referentiestandaard als hoog ingeschat, omdat het FeNO-resultaat onderdeel uitmaakte van de referentiestandaard in drie onderzoeken (Grzelewski, 2016; Jong, 2020; Jong, 2019) en omdat de referentiestandaard uit enkel een bronchoprovocatietest bestond in het vierde onderzoek (Kessler, 2019). Vanwege de referentiestandaard werd van twee onderzoeken de toepasbaarheid als verminderd beoordeeld (Kessler, 2019; Jerzyńska, 2014). De kans op vertekening betreffende het QUADAS-2-domein Flow and timing werd als hoog beoordeeld in drie onderzoeken, omdat niet alle patiënten in de analyses werden meegenomen (Grzelewski, 2016; Jerzyńska, 2014; Grzelewski, 2014).
Resultaten
Omdat de populatie in het onderzoek van Grzelewski en collega’s (Grzelewski, 2016) overlapte met de populatie in het eerdere onderzoek van dezelfde auteurs (Grzelewski, 2014), werd dit onderzoek niet meegenomen in de meta-analyse. Van de negen overige onderzoeken konden er acht worden opgenomen in een meta-analyse, waarvan het onderzoek van Kessler voor twee populaties apart gegevens leverde (atopische en niet-atopische deelnemers) (Kessler, 2019). In totaal werden dus negen onderzoekspopulaties (n=5405 deelnemers) geanalyseerd. De mediane prevalentie van astma in deze onderzoeken was 68% (range 42% tot 85%).
Uitgaande van de optimale FeNO-afkapwaarden in de onderzoeken (mediaan 19 ppb, range 6,5 ppb tot 23 ppb), liep de sensitiviteit uiteen van 0,54 tot 0,90 (mediaan 0,61) en de specificiteit van 0,46 tot 0,89 (mediaan 0,67) (Figuur 1). De gepoolde sensitiviteit bedroeg 0,66 (0,54 tot 0,76) en de gepoolde specificiteit 0,75 (0,63 tot 0,84), met een bijbehorende AUC van 0,760 (Tabel 1). Bij een mediane astmaprevalentie van 68% bedragen de bijbehorende voorspellende waarden voor de aanwezigheid van astma 85% (95% BI 76% tot 91%) voor een positieve testuitslag en 49% (95% BI 38% tot 61%) voor een negatieve testuitslag. In een hypothetische populatie met 1000 kinderen bij wie de FeNO-waarde wordt bepaald, zouden 80 kinderen (95% BI 51 tot 118) ten onrechte geclassificeerd worden als hebbende astma (fout-positieven) en bij 231 kinderen met astma (95% BI 163 tot 313) zou de diagnose gemist zijn (fout-negatieven).
Figuur 1. Gepaarde forestplot van sensitiviteit en specificiteit van FeNO voor het aantonen van astma bij kinderen (9 onderzoeken). Gepoolde sensitiviteit 0,66 (0,54 tot 0,76); gepoolde specificiteit 0,75 (0,63 tot 0,84).
Tabel 1. Gepoolde sensitiviteit en specificiteit van FeNO voor het aantonen van astma bij kinderen (bivariate analyse)
|
Analysis |
Number of studies (participants) |
Prevalence median (range) |
Sensitivity (95% CI) |
Specificity (95% CI) |
AUC |
|
Optimal threshold |
9 (5405) |
0.68 (0.42 to 0.85) |
0.66 (0.54 to 0.76) |
0.75 (0.63 to 0.84) |
0.760 |
|
Non-ICS |
3 (467) |
0.57 (0.42 to 0.68) |
0.58 (0.52 to 0.64) |
0.74 (0.56 to 0.87) |
0.593 |
|
Atopy |
2 (523) |
0.71 (0.57 to 0.85) |
0.79 (0.41 to 0.95) |
0.58 (0.42 to 0.73) |
0.667 |
|
Non-atopy |
1 (88) |
0.42 |
0.54 (0.37 to 0.71) |
0.67 (0.52 to 0.79) |
- |
|
Chemiluminescence |
4 (4359) |
0.65 (0.60 to 0.85) |
0.76 (0.54 to 0.89) |
0.71 (0.44 to 0.89) |
0.798 |
|
Electrochemical |
4 (771) |
0.63 (0.42 to 0.72) |
0.55 (0.48 to 0.62) |
0.76 (0.63 to 0.86) |
0.640 |
|
Cutoff 10-20 |
6 (4467) |
0.61 (0.42 to 0.69) |
0.51 (0.24 to 0.78) |
0.80 (0.64 to 0.90) |
0.753 |
|
Cutoff 35-45 |
4 (578) |
0.63 (0.42 to 0.72) |
0.21 (0.09 to 0.43) |
0.95 (0.88 to 0.98) |
0.816 |
CI: confidence interval; AUC: area under the curve; ICS: inhalation corticosteroids
In de onderzoeken die resultaten rapporteerden voor een FeNO-afkapwaarde tussen de 10 en 20 ppb (n=6; 4467 deelnemers), was de mediane prevalentie 61% (range 42% tot 69%). De sensitiviteit varieerde van 0,03 tot 0,86 (mediaan 0,60) en de specificiteit van 0,46 tot 0,94 (mediaan 0,82) (Figuur 2). Het gepoolde resultaat was 0,51 (95% BI 0,24 tot 0,78) voor sensitiviteit, 0,80 (95% BI 0,64 tot 0,90) voor specificiteit en 0,753 voor de AUC (Tabel 1). Bij een mediane astmaprevalentie van 61% bedragen de bijbehorende voorspellende waarden voor de aanwezigheid van astma 80% (95% BI 51% tot 92%) voor een positieve testuitslag en 49% (95% BI 28% tot 65%) voor een negatieve testuitslag. In een hypothetische populatie met 1000 kinderen bij wie de FeNO-waarde wordt bepaald, zouden 78 kinderen (95% BI 39 tot 140) ten onrechte geclassificeerd worden als hebbende astma (fout-positieven) en bij 299 kinderen met astma (95% BI 134 tot 464) zou de diagnose gemist zijn (fout-negatieven).
Figuur 2. Gepaarde forestplot van sensitiviteit en specificiteit van FeNO voor het aantonen van astma bij kinderen bij een FeNO-afkapwaarde tussen 10 en 20 ppb (6 onderzoeken). 0,51 (95% BI 0,24 to 0,78); gepoolde specificiteit 0,80 (95% BI 0,64 tot 0,90).
In de onderzoeken die resultaten voor een FeNO-afkapwaarde tussen de 35 en 45 ppb rapporteerden (n=4; 578 deelnemers), liep bij een mediane prevalentie van 63% (range 42% tot 72%) de sensitiviteit uiteen van 0,03 tot 0,39 (mediaan 0,25) en de specificiteit van 0,89 tot 0,99 (mediaan 0,96) (Figuur 3). De gepoolde sensitiviteit bedroeg 0,21 (95% BI 0,09 to 0,43) en de gepoolde specificiteit 0,95 (95% BI 0,88 to 0,98), met een bijbehorende AUC van 0,816 (Tabel 1). Bij een mediane astmaprevalentie van 63% bedragen de bijbehorende voorspellende waarden voor de aanwezigheid van astma 88% (95% BI 56% tot 97%) voor een positieve testuitslag en 59% (95% BI 50% tot 64%) voor een negatieve testuitslag. In een hypothetische populatie met 1000 kinderen bij wie de FeNO-waarde wordt bepaald, zouden 18 kinderen (95% BI 7 tot 44) ten onrechte geclassificeerd worden als hebbende astma (fout-positieven) en bij 498 kinderen met astma (95% BI 359 tot 573) zou de diagnose gemist zijn (fout-negatieven).
Figuur 3. Gepaarde forestplot van sensitiviteit en specificiteit van FeNO voor aantonen van astma bij kinderen bij een FeNO-afkapwaarde tussen 35 en 45 ppb (4 onderzoeken). Gepoolde sensitiviteit 0,21 (95% BI 0,09 to 0,43); gepoolde specificiteit 0,95 (95% BI 0,88 tot 0,98)
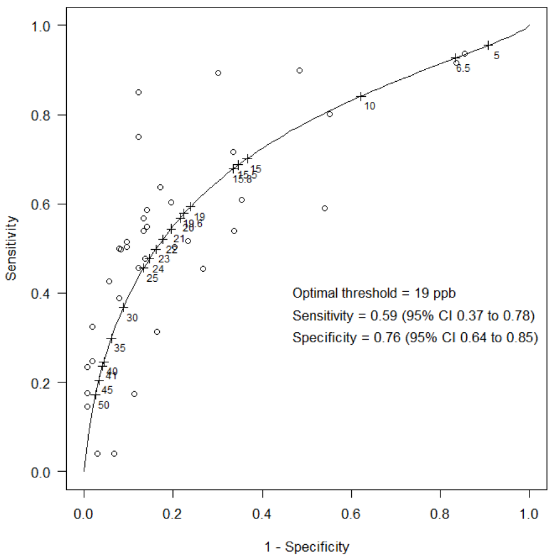
De negen onderzoeken rapporteerden resultaten voor in totaal 39 afkapwaarden, variërend van 1 tot 15 afkapwaarden per onderzoek (mediaan: 4), en er konden 20 unieke afkapwaarden worden onderscheiden. De FeNO-afkapwaarde waarvoor het vaakst resultaten werden gerapporteerd, was 25 ppb (zes keer), gevolgd door 35 ppb (vier keer) en 20 ppb, 21 ppb, 22 ppb en 23 ppb (alle drie keer). Uit een analyse waarin de resultaten voor alle 39 gerapporteerde FeNO-afkapwaarden werden meegenomen, kwam 19 ppb als optimale afkapwaarde voor FeNO (Figuur 4).
Figuur 4. sROC-curve van FeNO voor het aantonen van astma bij kinderen (multiple thresholds analyse). Elke cirkel geeft een combinatie van sensitiviteit en specificiteit weer die in de individuele onderzoeken gevonden werd bij een bepaalde afkapwaarde. De getallen geven de FeNO-afkapwaarden weer (ppb).
In Figuur 5 zijn voor prevalenties van 20%, 40%, 60% en 80%, en voor diverse (afkap- of geobserveerde) waardes van FeNO A) de positief voorspellende waarde (positive predictive value, PPV), B) de kans op op astma, C) de negatief voorspellende waarde (negative predictive value, NPV) en D) de kans op afwezigheid van astma af te lezen. In Tabel 2 staat de informatie uit Figuur 5 uitgewerkt voor een astmaprevalentie van 40%. Opgemerkt moet worden dat voor sommige afkapwaarden in deze tabel de betrouwbaarheidsintervallen rondom de geschatte voorspellende waarden en kans op astma breed zijn. Dit komt doordat het lastig is voor het model om absolute kansen te schatten op basis van (meta-)gegevens over sensitiviteit en specificiteit, wat leidt tot een onzekere schatting.
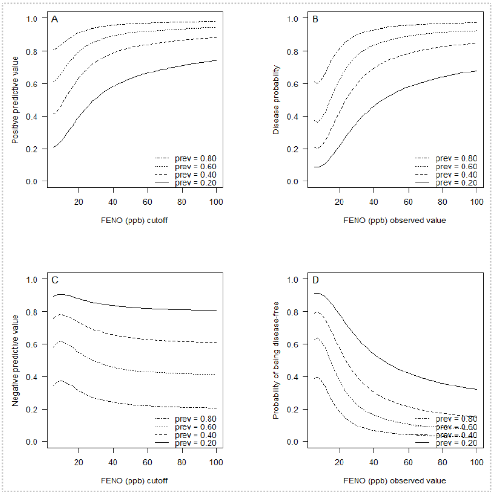
Figuur 5. Positief voorspellende waarde (A), kans op op astma (B), negatief voorspellende waarde (C) en kans op afwezigheid van astma (D) voor diverse (afkap- of geobserveerde) waardes van FeNO (ppb) bij astmaprevalenties van 20%, 40%, 60% en 80% bij kinderen (multiple thresholds analyse)
Tabel 2. Sensitiviteit, specificiteit, voorspellende waarden en kans op het hebben van astma bij een bepaalde FeNO-(afkap)waarde en een prevalentie van 40% bij kinderen (multiple thresholds analyse).
|
FeNO (cutoff) value |
Sensitivity (95% CI) |
Specificity (95% CI) |
PPV |
NPV |
Probability of asthma |
FeNO (cutoff) value |
|
10 |
0.84 (0.70 to 0.92) |
0.38 (0.23 to 0.55) |
0.47 (0.21 to 0.76) |
0.78 (0.27 to 0.97) |
0.23 (0.08 to 0.49) |
10 |
|
15 |
0.70 (0.50 to 0.85) |
0.63 (0.48 to 0.76) |
0.56 (0.14 to 0.91) |
0.76 (0.42 to 0.93) |
0.32 (0.15 to 0.56) |
15 |
|
20 |
0.57 (0.35 to 0.76) |
0.78 (0.67 to 0.87) |
0.64 (0.12 to 0.96) |
0.73 (0.50 to 0.88) |
0.43 (0.11 to 0.83) |
20 |
|
25 |
0.46 (0.25 to 0.68) |
0.87 (0.79 to 0.92) |
0.69 (0.11 to 0.98) |
0.71 (0.53 to 0.83) |
0.53 (0.09 to 0.92) |
25 |
|
30 |
0.37 (0.18 to 0.60) |
0.91 (0.86 to 0.95) |
0.74 (0.12 to 0.98) |
0.68 (0.55 to 0.79) |
0.60 (0.09 to 0.96) |
30 |
|
35 |
0.30 (0.14 to 0.53) |
0.94 (0.90 to 0.96) |
0.77 (0.12 to 0.99) |
0.67 (0.56 to 0.76) |
0.66 (0.10 to 0.97) |
35 |
|
40 |
0.25 (0.11 to 0.47) |
0.96 (0.93 to 0.97) |
0.79 (0.13 to 0.99) |
0.66 (0.57 to 0.73) |
0.70 (0.10 to 0.98) |
40 |
|
45 |
0.20 (0.09 to 0.42) |
0.97 (0.95 to 0.98) |
0.81 (0.13 to 0.99) |
0.65 (0.58 to 0.71) |
0.73 (0.11 to 0.98) |
45 |
Het onderzoek van Martins en collega’s rapporteerde resultaten in onvoldoende detail om in de meta-analyses te worden opgenomen46. In dit onderzoek werd een AUC van 0,620 gevonden voor FeNO als diagnostische test voor astma bij kinderen.
Subgroepen
Een aantal onderzoeken werden uitgevoerd in of rapporteerden resultaten apart voor een specifieke populatie of setting: 1) deelnemers zonder inhalatiecorticosteroïden in drie onderzoekspopulaties (twee onderzoeken (Kessler, 2019; Woo, 2012)), 2) deelnemers met atopie in twee onderzoeken (Kessler, 2019; Jerzyńska, 2014) en 3) deelnemers zonder atopie (Kessler, 2019). Daarnaast werd een subgroepanalyse uitgevoerd naar 4) type apparaat voor de FeNO-bepaling: chemiluminescentie (vier onderzoeken (Jerzyńska, 2014; Grzelewski, 2014; Woo, 2012; Sivan, 2009)) of elektrochemische detectie (vier populaties in drie onderzoeken (Jong, 2020; Jong, 2019; Kessler, 2019).
-
De meta-analyse van onderzoeken met een populatie zonder inhalatiecorticosteroïdengebruik leverde vergelijkbare gepoolde effectschattingen als die van alle onderzoeken (Tabel 2).
-
Hetzelfde geldt voor de meta-analyse van de twee onderzoeken bij atopische deelnemers.
-
Het onderzoek onder niet-atopische deelnemers vond eveneens vergelijkbare waarden voor de sensitiviteit (0,54; 95% BI 0,37 tot 0,78) en specificiteit (0,67; 95% BI 0,52 tot 0,79).
-
Voor onderzoeken met een FeNO-bepaling op basis van chemiluminescentie werd een hogere sensitiviteit gevonden dan die in de onderzoeken die gebruik maakten van elektrochemische detectie (respectievelijk 0,76 [95% BI 0,54 tot 0.89] en 0,55 [0,48 tot 0,62]). De specificiteit verschilde niet tussen de twee subgroepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat sensitiviteit bij een FeNO met mediane afkapwaarde van 19 ppb is met 3 niveaus verlaagd naar GRADE zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias), tegenstrijdige resultaten (inconsistentie); het geringe aantal patiënten (imprecisie.)
De bewijskracht voor de uitkomstmaat specificiteit bij een FeNO met mediane afkapwaarde van 19 ppb is met 3 niveaus verlaagd naar GRADE zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias), tegenstrijdige resultaten (inconsistentie); het geringe aantal patiënten (imprecisie.)
De bewijskracht voor de uitkomstmaat sensitiviteit bij een FeNO met een afkapwaarde tussen de 10 en 20 ppb is met 3 niveaus verlaagd naar GRADE zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias), tegenstrijdige resultaten (inconsistentie); het geringe aantal patiënten (imprecisie.)
De bewijskracht voor de uitkomstmaat specificiteit bij een FeNO met een afkapwaarde tussen de 10 en 20 ppb is met 3 niveaus verlaagd naar GRADE zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias), tegenstrijdige resultaten (inconsistentie); het geringe aantal patiënten (imprecisie.)
De bewijskracht voor de uitkomstmaat sensitiviteit bij een FeNO met een afkapwaarde tussen de 35 en 45 ppb is met 3 niveaus verlaagd naar GRADE zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias), tegenstrijdige resultaten (inconsistentie); het geringe aantal patiënten (imprecisie.)
De bewijskracht voor de uitkomstmaat sensitiviteit bij een FeNO met een afkapwaarde tussen de 35 en 45 ppb is met 3 niveaus verlaagd naar GRADE redelijk gezien beperkingen in de onderzoeksopzet (risk of bias).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the diagnostic accuracy of fractional exhaled nitric oxide (FeNO) compared to provocation test in children suspected of non-severe asthma?
| P: | patient suspected of non-severe asthma |
| I: | fractional exhaled nitric oxide (FeNO) |
| C: | provocation test |
| R: | - |
| O: | diagnostic accuracy for diagnosis asthma (sensitivity, specificity, predictive value) |
| T/S: | FeNO prior to or at diagnosis |
Relevant outcome measures
The guideline development group considered sensitivity and specificity as critical outcome measures for decision making; and predictive value as an important outcome measure for decision making.
Search and select (Methods)
A report made by the Dutch Cochrane organization (Damen, 2021), commissioned by the Zorginstituut, was found. After discussing with its authors, the report’s literature analysis was copied as the basis for this module. The search for the report was performed in the Medline and Embase databases with relevant search terms until September 22nd 2020. For this module, the search was updated on January 3rd 2023 to include the latest literature. The detailed search strategy is also depicted under the tab Methods. The meta-analyses were from the report made by Cochrane were updated with the more recent studies.
No additional studies were included in our literature analysis. The literature analysis of Damen (2021) was published in Dutch and therefore reported in Dutch in this module.
The COSMIN Risk of Bias tool was used to assess the quality of single studies for each measurement property. Thereby, the worst-score-counts method was used to determine the risk of bias, this means that the lowest rating given in a box determines the final rating, i.e., the quality of the study. The result of each study on a measurement property were rated against the updated criteria for good measurement properties (Table 1). Each result was rated as either sufficient (+), insufficient (–), or indeterminate (?).
Table 1. Criteria for good measurement properties (Mokkink, 2018)
|
Measurement property |
Rating1 |
Criteria |
|
Structural validity |
+ |
CTT: CFA: CFI or TLI or comparable measure >0.95 OR RMSEA <0.06 OR SRMR <0.082 IRT/Rasch: No violation of unidimensionality3: CFI or TLI or comparable measure >0.95 OR RMSEA <0.06 OR SRMR <0.08 AND no violation of local independence: residual correlations among the items after controlling for the dominant factor < 0.20 OR Q3's < 0.37 AND no violation of monotonicity: adequate looking graphs OR item scalability >0.30 AND adequate model fit: IRT: χ2 >0.01 Rasch: infit and outfit mean squares ≥ 0.5 and ≤ 1.5 OR Z-standardized values > ‐2 and <2 |
|
? |
CTT: Not all information for ‘+’ reported IRT/Rasch: Model fit not reported |
|
|
- |
Criteria for ‘+’ not met |
|
|
Internal consistency |
+ |
At least low evidence4 for sufficient structural validity5 AND Cronbach's alpha(s) ≥ 0.70 for each unidimensional scale or Subscale.6 |
|
? |
Criteria for “At least low evidence for sufficient structural validity” not met |
|
|
- |
At least low evidence4 for sufficient structural validity5 AND Cronbach’s alpha(s) < 0.70 for each unidimensional scale or Subscale.6 |
|
|
Reliability |
+ |
ICC or weighted Kappa ≥ 0.70 |
|
? |
ICC or weighted Kappa not reported |
|
|
- |
ICC or weighted Kappa < 0.70 |
|
|
Measurement error |
+ |
SDC or LoA < MIC |
|
? |
MIC not defined |
|
|
- |
SDC or LoA > MIC |
|
|
Hypotheses testing for construct validity |
+ |
The result is in accordance with the hypothesis7 |
|
? |
No hypothesis defined (by the review team) |
|
|
- |
The result is not in accordance with the hypothesis |
|
|
Cross‐cultural validity\measurement invariance |
+ |
No important differences found between group factors (such as age, gender, language) in multiple group factor analysis OR no important DIF for group factors (McFadden's R2 < 0.02) |
|
? |
No multiple group factor analysis OR DIF analysis performed |
|
|
- |
Important differences between group factors OR DIF was found |
|
|
Criterion validity |
+ |
Correlation with gold standard ≥ 0.70 OR AUC ≥ 0.70 |
|
? |
Not all information for ‘+’ reported |
|
|
- |
Correlation with gold standard < 0.70 OR AUC < 0.70 |
|
|
Responsiveness |
+ |
The result is in accordance with the hypothesis OR AUC ≥ 0.70 |
|
? |
No hypothesis defined (by the review team) |
|
|
- |
The result is not in accordance with the hypothesis OR AUC < 0.70 |
|
|
Test-retest reliability* |
+ |
The p-value <0.5 and Pearson correlation coefficient (Pearson’s r) > 0.7 |
|
- |
The p-value >0.5 or Pearson correlation coefficient (Pearson’s r) < 0.7 |
|
|
AUC: area under the curve, CFA: confirmatory factor analysis, CFI: comparative fit index, CTT: classical test theory, DIF: differential item functioning, ICC: intraclass correlation coefficient, IRT: item response theory, LoA: limits of agreement, MIC: minimal important change, RMSEA: Root Mean Square Error of Approximation, SEM: Standard Error of Measurement, SDC: smallest detectable change, SRMR: Standardized Root Mean Residuals, TLI = Tucker‐Lewis Index |
||
[1] “+” = sufficient, ” –“ = insufficient, “?” = indeterminate
[2] To rate the quality of the summary score, the factor structures should be equal across studies
[3] unidimensionality refers to a factor analysis per subscale, while structural validity refers to a factor analysis of a (multidimensional) patient‐reported outcome measure
[4] As defined by grading the evidence according to the GRADE approach
[5] This evidence may come from different studies
[6] The criteria ‘Cronbach alpha < 0.95’ was deleted, as this is relevant in the development phase of a PROM and not when evaluating an existing PROM.
[7] The results of all studies should be taken together, and it should then be decided if 75% of the results are in accordance with the hypotheses
* Criteria retrieved from https://www.scalestatistics.com/test-retest-reliability.html
The level of evidence of the literature was evaluated as described in the COSMIN user manual for systematic reviews of patient-reported outcome measures (Mokkink, 2018). The following four factors were taken into account: (1) risk of bias (i.e., the methodological quality of the studies), (2) inconsistency (i.e., unexplained inconsistency of results across studies), (3) imprecision (i.e. total sample size of the available studies), and (4) indirectness (i.e. evidence from different populations than the population of interest in the review). The quality of evidence could be downgraded with one level (e.g., from high to moderate evidence) if there is serious risk of bias, with two levels (e.g., from high to low) if there is very serious risk of bias, or with three levels (i.e., from high to very low) if there is extremely risk of bias. The quality of the evidence could be downgraded with one or two levels for inconsistency, imprecision (-1 if total N=50-100; -2 if total N<50) and indirectness.
Resultaten
In het Cochrane rapport (Damen, 2021) werden 26 onderzoeken afkomstig uit drie verschillende systematische reviews (Karrasch, 2017; Wang, 2017; 2018) geïncludeerd voor de literatuuranalyse over het nut van FeNO bij de diagnostiek van astma bij kinderen. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Eom SY, Lee JK, Lee YJ, et al. Combining spirometry and fractional exhaled nitric oxide improves diagnostic accuracy for childhood asthma. The clinical respiratory journal 2020;14(1):21-28. doi: https://doi.org/10.1111/crj.13095
- Grzelewski T, Stelmach W, Stelmach R, et al. Spirometry-Adjusted Fraction of Exhaled Nitric Oxide Allows Asthma Diagnosis in Children, Adolescents, and Young Adults. Respiratory Care 2016;61(2):162-72. doi: https://doi.org/10.4187/respcare.04092
- Jong CCMd, Pedersen ES, Mozun R, et al. Diagnosis of asthma in children: findings from the Swiss Paediatric Airway Cohort. European Respiratory Journal 2020;04:04. doi: https://doi.org/10.1183/13993003.00132-2020
- Jong CCMd, Pedersen ESL, Mozun R, et al. Diagnosis of asthma in children: the contribution of a detailed history and test results. European Respiratory Journal 2019;54(6):12. doi: https://doi.org/10.1183/13993003.01326-2019
- Kessler A, Kragl U, Glass A, et al. Exhaled nitric oxide can't replace the methacholine challenge in suspected pediatric asthma. Respiratory Medicine 2019;157:21-25. doi: https://doi.org/10.1016/j.rmed.2019.08.008
- Martins C, Silva D, Severo M, et al. Spirometry-adjusted fraction of exhaled nitric oxide increases accuracy for assessment of asthma control in children. Pediatric Allergy & Immunology 2017;28(8):754-62. doi: https://doi.org/10.1111/pai.12803
- Mokkink LB, de Vet HCW, Prinsen CAC, Patrick DL, Alonso J, Bouter LM, Terwee CB. COSMIN Risk of Bias checklist for systematic reviews of Patient-Reported Outcome Measures. Qual Life Res. 2018 May;27(5):1171-1179. doi: 10.1007/s11136-017-1765-4. Epub 2017 Dec 19. PMID: 29260445; PMCID: PMC5891552.
- Jerzy?ska J, Majak P, Janas A, et al. Predictive value of fractional nitric oxide in asthma diagnosis-subgroup analyses. Nitric Oxide 2014;40:87-91. doi: https://doi.org/10.1016/j.niox.2014.06.001 [published Online First: 2014/06/15]
- Grzelewski T, Witkowski K, Makandjou-Ola E, et al. Diagnostic value of lung function parameters and FeNO for asthma in schoolchildren in large, real-life population. Pediatr Pulmonol 2014;49(7):632-40. doi: https://doi.org/10.1002/ppul.22888 [published Online First: 2013/09/11]
- Woo S-I, Lee J-H, Kim H, et al. Utility of fractional exhaled nitric oxide (FENO) measurements in diagnosing asthma. Respiratory Medicine 2012;106(8):1103-09. doi: https://doi.org/10.1016/j.rmed.2012.03.022
- Sivan Y, Gadish T, Fireman E, et al. The Use of Exhaled Nitric Oxide in the Diagnosis of Asthma in School Children. Journal of Pediatrics 2009;155(2):211-16. doi: https://doi.org/10.1016/j.jpeds.2009.02.034
Evidence tabellen
Research question: What is the role of FeNO in diagnosing asthma in children with suspected symptoms?
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Damen, 2021
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR [and meta-analysis]
23rd of September 2020
A: De Jong, 2019 B: De Jong, 2020 C: Eom, 2020 D: Grzelewski, 2016 E: Jerzyńska, 2014 F: Kessler, 2019 G: Martins, 2017 H: Sivan, 2009 I: Woo, 2012
Study design: A: Cross-sectional study B: Cross-sectional study C: Cross-sectional study D: Retrospective cross-sectional study E: Retrospective cross-sectional study F: Cross-sectional study G: Cross-sectional study H: Cross-sectional study I: Cross-sectional study
Setting and Country: A: Switzerland B: Switzerland C: Republic of Korea D: Poland E: Poland F: Germany G: Portugal H: Israel I: Republic of Korea
Source of funding and conflicts of interest: [commercial / non-commercial funding/ industrial co-authorship / potential conflicts of interest ]
|
Inclusion and criteria SR: Relevante SR’s onderzochten het nut van FeNO bij de diagnostiek van patiënten met een verdenking op astma. Er werden SR’s geselecteerd die de sensitiviteit, specificiteit of voorspellende waarden van FeNO bij de diagnose van astma of subgroepen astmapatiënten rapporteerden. We includeerden relevante publicaties in het Engels, Nederlands, Frans, Duits of Spaans.
Nine studies included
Important patient characteristics:
N, mean age A: 111 patients, 6-16 years old B: 514 patients, Median age: 9 (IQR 7-12) C: 275 patients, Mean age 11.5 (10.7 – 12.3) vs 11.6 (11.1 – 12.1) D: 1529 patients, Median age 11.0 (IQR 8-14) E: 1787 patients, Mean age 11.2 (SD 6.3) F: 222 patients, Mean age 9.7 (SD 3.2) G: 662 patients, Mean age 8.7 (SD 0.8) H: 113 patients, Mean age 12.4 (range 5-18) I: 245 patients, Mean age 12.0 (range 8-16)
Sex: A: 62% male B: 57% male C: 65% vs 66% male D: 60.3% male E: 59.3% male F: 55% male G: 48% male H: 55% male I: 66.5%
|
Describe index and comparator tests* and cut-off point(s):
A: Electrochemical; NIOX MINO B: Electrochemical; NIOX MINO C: Electrochemical; NIOX MINO D: Chemiluminescence; Sievers 280i E: Chemiluminescence; Sievers 280i F: Electrochemical; NIOX MINO G: Electrochemical; NObreath H: Chemiluminescence; Eco Physics CLD88 and the Denox 88 NO I: Electrochemical; NIOX MINO
|
Describe reference test and cut-off point(s):
A: Clinical asthma diagnosis B: Clinical asthma diagnosis C: GINA guidelines D: GINA guidelines E: GINA guidelines F: Bronchoprovocation G: 1) Symptoms and evidence of airway reversibility; 2) Bronchodilation response or respiratory symptoms in the previous weeks with exhaled NO levels> 35 ppb H: Conventional clinical criteria: exacerbations in wheezing, dyspnoea or cough; variability in FEV) I: National Asthma Education and Prevention Program (NAEPP) guidelines
Prevalence (%) [based on refence test at specified cut-off point] A: 72% B: 69% C: 69% D: 60% E: 85% F-1: 42% F-2: 57% G: 11% H: 61% I: 68%
Data on incomplete outcome data was not reported in the SR.
|
Endpoint of follow-up: A: Sensitivity and specificity B: Sensitivity and specificity C: Sensitivity and specificity D: Sensitivity and specificity E: Sensitivity and specificity F: Sensitivity and specificity G: Sensitivity and specificity H: Sensitivity and specificity I: Sensitivity and specificity
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1 Optimal cut-off values from the studies Sensitivity A: 0.59 (95% CI; 0.47 – 0.70) B: 0.48 (95% CI; 0.42 – 0.53) C: 0.64 (95% CI; 0.57 – 0.71) D: 0.59 (95% CI; 0.57 – 0.61) E: 0.90 (95% CI; 0.86 – 0.93) F-1: 0.61 (95% CI; 0.49 – 0.72) F-2: 0.54 (95% CI; 0.37 – 0.71) H: 0.86 (95% CI; 0.75 – 0.93) I: 0.57 (95% CI; 0.49 – 0.65)
Outcome measure 1 Optimal cut-off values from the studies (range 6.5 – 23 ppb) Specificity A: 0.87 (95% CI; 0.70 – 0.96) B: 0.87 (95% CI; 0.80 – 0.92) C: 0.83 (95% CI; 0.74 – 0.91) D: 0.46 (95% CI; 0.43 – 0.49) E: 0.52 (95% CI; 0.38 – 0.65) F-1: 0.65 (95% CI; 0.51 – 0.777 F-2: 0.67 (95% CI; 0.52 – 0.79) H: 0.89 (95% CI; 0.75 – 0.96) I: 0.87 (95% CI; 0.78 – 0.94)
Outcome measure-2 Cut-off value between 10 and 20 ppb Sensitivity C: 0.64 (95% CI; 0.57 – 0.71) D: 0.59 (95% CI; 0.57 – 0.61) F-1: 0.45 (95% CI; 0.34 – 0.57) F-2: 0.03 (95% CI; 0.00 – 0.14) H: 0.89 (95% CI; 0.75 – 0.93) I: 0.60 (95% CI; 0.53 – 0.68)
Outcome measure-2 Cut-off value between 10 and 20 ppb Specificity C: 0.83 (95% CI; 0.74 – 0.91) D: 0.46 (95% CI; 0.43 – 0.49) F-1: 0.74 (95% CI; 0.60 – 0.84) F-2: 0.94 (95% CI; 0.84 – 0.99) H: 0.89 (95% CI; 0.75 – 0.96) I: 0.81 (95% CI; 0.70 – 0.89)
Outcome measure-3 Cut-off value between 35 and 45 ppb Sensitivity A: 0.39 (95% CI; 0.28 – 0.50) F-1: 0.17 (95% CI; 0.09 – 0.27) F-2: 0.03 (95% CI; 0.00 – 0.14) I: 0.32 (95% CI; 0.25 – 0.40)
Outcome measure-3 Cut-off value between 35 and 45 ppb Specificity A: 0.94 (95% CI; 0.79 – 0.99) F-1: 0.89 (95% CI; 0.78 – 0.96)( F-2: 0.98 (95% CI; 0.90 – 1.00) I: 0.99 (95% CI; 0.93 – 1.00) |
Place of the index test in the clinical pathway: Triage
Brief description of author’s conclusion: Er is geen rol voor FeNO ter vervanging van de huidige diagnostische zorg. Een rol als triagetest is niet uitgesloten, aangezien een FeNO-waarde hoger dan 35-45 ppb een vrij hoge zekerheid geeft dat een kind astma heeft, in welk geval overwogen kan worden aanvullende diagnostiek achterwege te laten
|
Risk of bias table
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
De Jong, 2019 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Yes/
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Unclear
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: HIGH |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
De Jong, 2020 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: HIGH |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
|
Eom, 2020 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? No
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Unclear |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
||
|
Grzelewski, 2014 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? Yes
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: HIGH |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
||
|
Jerzýnska, 2014 |
Was a consecutive or random sample of patients enrolled? Yes/No/Unclear
Was a case-control design avoided? Yes/No/Unclear
Did the study avoid inappropriate exclusions? Yes/No/Unclear
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes/No/Unclear
If a threshold was used, was it pre-specified? Yes/No/Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes/No/Unclear
Were the reference standard results interpreted without knowledge of the results of the index test? Yes/No/Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Yes/No/Unclear
Did all patients receive a reference standard? Yes/No/Unclear
Did patients receive the same reference standard? Yes/No/Unclear
Were all patients included in the analysis? Yes/No/Unclear |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? Yes
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: HIGH |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
||
|
Kessler, 2019 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unclear |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? No
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? No
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? Yes |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: HIGH |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
||
|
Sivan, 2009 |
Was a consecutive or random sample of patients enrolled? Yes/No/Unclear
Was a case-control design avoided? Yes/No/Unclear
Did the study avoid inappropriate exclusions? Yes/No/Unclear
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes/No/Unclear
If a threshold was used, was it pre-specified? Yes/No/Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes/No/Unclear
Were the reference standard results interpreted without knowledge of the results of the index test? Yes/No/Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Yes/No/Unclear
Did all patients receive a reference standard? Yes/No/Unclear
Did patients receive the same reference standard? Yes/No/Unclear
Were all patients included in the analysis? Yes/No/Unclear
|
Are there concerns that the included patients do not match the review question? Yes/No/Unclear
Are there concerns that the index test, its conduct, or interpretation differ from the review question? Yes/No/Unclear
Are there concerns that the target condition as defined by the reference standard does not match the review question? Yes/No/Unclear
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
||
|
Woo, 2012 |
Was a consecutive or random sample of patients enrolled? Yes/No/Unclear
Was a case-control design avoided? Yes/No/Unclear
Did the study avoid inappropriate exclusions? Yes/No/Unclear
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes/No/Unclear
If a threshold was used, was it pre-specified? Yes/No/Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes/No/Unclear
Were the reference standard results interpreted without knowledge of the results of the index test? Yes/No/Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Yes/No/Unclear
Did all patients receive a reference standard? Yes/No/Unclear
Did patients receive the same reference standard? Yes/No/Unclear
Were all patients included in the analysis? Yes/No/Unclear |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
Table of excluded studies
Not applicable.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-10-2024
Beoordeeld op geldigheid : 04-09-2024
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij tweedelijns astmazorg bij kinderen.
Werkgroep
- Dr. E.P. (Eric) de Groot, kinderlongarts, werkzaam bij Zuyderland Medisch Centrum te Heerlen, NVK (voorzitter)
- Drs. S.C. (Sanne) Hammer, kinderlongarts, werkzaam in het Amphia ziekenhuis te Breda, NVK
- Drs. E.A. (Ellen) Croonen, kinderlongarts, werkzaam in het Canisius Wilhelmina Ziekenhuis te Nijmegen, NVK
- Dr. H.T. (Martijn) den Dekker, kinderarts, werkzaam in het ErasmusMC – Sophia kinderziekenhuis te Rotterdam, NVK
- C.G.W. (Christel) Linssen-Geven, kinderlongverpleegkundige, werkzaam in het Catharina Ziekenhuis te Eindhoven, V&VN
- Dr. J.W.M. (Jean) Muris, huisarts en hoogleraar Huisartsgeneeskunde, NHG
- M.A.P. (Marjo) Poulissen-Erinkveld, senior beleidsadviseur, Longfonds & VND (tot mei 2023)
- Drs. Y. (Yvonne) Kappe, senior projectleider, Longfonds & VND (vanaf september 2023)
- E.M. (Esther) van der Roest, VND
- S.T. (Saskia) van Dorst M, ervaringsdeskundige, Longfonds
- E. (Esther) Oosterling-Vonk, Longfonds (vanaf maart 2023)
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Mark) van Eck, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- L.A.M. (Liza) van Mun, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Y. (Yvonne) van Kempen, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen Actie |
|
Jean Muris |
Universiteit Maastricht 1.0 fte |
Geen |
Geen |
Geen restricties |
|
Eric de Groot* |
Kinderlongarts, Zuyderland Medisch Centrum 80% Kinderlongarts Radboud UMC 0-uren (alleen diensten) |
Lid Medische commissie Villa Pardoes (onbetaald) APLS instructeur, SSHK (onbetaald) |
Geen |
Geen restricties |
|
Saskia van Dorst |
Longfonds ErvaringsDeskundige (vrijwilliger Longfonds) |
Geen |
Geen |
Geen restricties |
|
Marjo Poulissen |
Sr.Projectleider Longfonds 36 uur |
Geen |
Ik heb zelf astma, maar ben dan ook mede patientenvertegenwoordiger vanuit Longfonds en astmaVereniging nederland en Davos. |
Geen restricties |
|
Esther van der Roest |
Unitmanager CDL WKZ |
Lid astmaVereniging Nederland en Davos |
Alleen uit arbeid bij UMCU |
Geen restricties |
|
Martijn den Dekker |
Kinderarts – fellow kinderlongziekten, Sophia Kinderziekenhuis / Erasmus MC, Rotterdam. |
Geen |
Geen |
Geen restricties |
|
Sanne Hammer |
Kinderlongarts Amphia |
Geen |
Geen |
Geen restricties |
|
Christel Linssen-Geven |
Kinderlongverpleegkundige Catharina ziekenhuis Eindhoven (betaald) Lid van Taakgroep kinderlongverpleegkundigen (onbetaald) |
Gastdocent op Fontys Eindhoven en HU Utrecht (betaald) |
Geen |
Geen restricties |
|
Ellen Croonen |
Kinderlongarts, Canisius Wilhelmina Ziekenhuis Nijmegen |
Deelname aan beroepsgerelateerde initiatieven, onbetaald. |
SALSA studie; In vivo efficacy of Salbutamol (Sandoz) versus salbutamol (Ventolin GSK) (Salsa study)- Financier: Longfonds |
Geen restricties |
|
Yvonne Kappe |
Sr. Projectleider Longfonds 12 uur Vanuit Longfonds gedetacheerd naar Sr. Projectleider en Beleidsadviseur astmaVereniging Nederland en Davos 12 uur – vanaf 1 september 2023 |
Geen |
Geen |
Geen restrcities |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van meerdere personen vanuit het Longfonds en astmaVereniging Nederland en Davos in de werkgroep. Op verschillende momenten is input gevraagd tijdens een invitational conference en bij het opstellen van het raamwerk. Het verslag van de invitational conference (zie bijlagen] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module FeNO in diagnostisch traject |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module LTRA vs ICS bij recidiverend piepen |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module SCIT en SLIT bij kinderen met allergische astma |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Titreren behandeling op basis van FeNO |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module Voorzetkamer of vernevelapparaat bij longaanval astma |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase heeft de NVK sectie Kinderlongziekten modules van de richtlijn Astma bij kinderen geprioriteerd voor herziening. Tevens zijn er knelpunten uitgevraagd in een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van vijf uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Literature search strategy
Embase
|
No. |
Query |
Results |
|
#23 |
#15 NOT #14 NOT #13 OBS |
307 |
|
#22 |
#14 NOT #13 Clinical trials, RCT |
145 |
|
#21 |
#11 AND #18 sleutelartikelen gevonden in de basisset |
2 |
|
#20 |
#18 AND #19 sleutelartikel DiCicco niet gevonden |
1 |
|
#19 |
#13 OR #14 OR #15 |
499 |
|
#18 |
#16 OR #17 |
2 |
|
#17 |
'fractional exhaled nitric oxide for the diagnosis of childhood asthma: a systematic review and meta-analysis' |
1 |
|
#16 |
'application of exhaled nitric oxide (feno) in pediatric asthma' |
1 |
|
#15 |
(#7 OR #8) AND #12 |
473 |
|
#14 |
#6 AND #12 |
161 |
|
#13 |
#5 AND #12 |
47 |
|
#12 |
#4 AND #11 |
595 |
|
#11 |
#10 AND [1-1-2012]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) Basisset |
1255 |
|
#10 |
#3 AND #9 |
3181 |
|
#9 |
'adolescent'/exp OR 'boy'/exp OR 'child'/de OR 'minors'/exp/mj OR 'pediatric patient'/exp OR 'pediatrics'/exp OR 'schoolchild'/exp OR minors*:ti,ab OR boy:ti,ab OR boys:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab |
4345434 |
|
#8 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
13738438 |
|
#7 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#6 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3699598 |
|
#5 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
889513 |
|
#4 |
'sensitivity and specificity'/de OR sensitiv*:ab,ti OR specific*:ab,ti OR predict*:ab,ti OR 'roc curve':ab,ti OR 'receiver operator':ab,ti OR 'receiver operators':ab,ti OR likelihood:ab,ti OR 'diagnostic error'/exp OR 'diagnostic accuracy'/exp OR 'diagnostic test accuracy study'/exp OR 'inter observer':ab,ti OR 'intra observer':ab,ti OR interobserver:ab,ti OR intraobserver:ab,ti OR validity:ab,ti OR kappa:ab,ti OR reliability:ab,ti OR reproducibility:ab,ti OR ((test NEAR/2 're-test'):ab,ti) OR ((test NEAR/2 'retest'):ab,ti) OR 'reproducibility'/exp OR accuracy:ab,ti OR 'differential diagnosis'/exp OR 'validation study'/de OR 'measurement precision'/exp OR 'diagnostic value'/exp OR 'reliability'/exp OR 'predictive value'/exp OR ppv:ti,ab,kw OR npv:ti,ab,kw |
9559472 |
|
#3 |
#1 AND #2 |
8669 |
|
#2 |
'asthma'/exp OR 'bronchus hyperreactivity'/exp OR 'airway obstruction'/exp OR (((airway OR airflow OR repirator*) NEAR/2 (obstruct* OR occlusion* OR closure)):ti,ab,kw) OR ((bronch* NEAR/2 (hyperreactiv* OR 'hyper reactiv*' OR hyperrespons* OR 'hyper respons*')):ti,ab,kw) OR asthma*:ti,ab,kw OR wheez*:ti,ab,kw OR breathles*:ti,ab,kw |
413954 |
|
#1 |
'fractional exhaled nitric oxide'/exp OR 'fractional exhaled nitric oxide test'/exp OR 'feno':ti,ab,kw OR ((exhaled NEAR/3 (no OR 'nitric oxide*')):ti,ab,kw) |
11317 |
Ovid/Medline
|
# |
Searches |
Results |
|
16 |
14 not 13 not 12 OBS |
213 |
|
15 |
13 not 12 RCT, clinical trial |
78 |
|
14 |
7 and (10 or 11) |
284 |
|
13 |
7 and 9 |
92 |
|
12 |
7 and 8 SR |
29 |
|
11 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5320871 |
|
10 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4323436 |
|
9 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2536907 |
|
8 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
635341 |
|
7 |
5 and 6 |
438 |
|
6 |
exp "Sensitivity and Specificity"/ or (Sensitiv* or Specific*).ti,ab. or (predict* or ROC-curve or receiver-operator*).ti,ab. or (likelihood or LR*).ti,ab. or exp Diagnostic Errors/ or (inter-observer or intra-observer or interobserver or intraobserver or validity or kappa or reliability).ti,ab. or reproducibility.ti,ab. or (test adj2 (re-test or retest)).ti,ab. or "Reproducibility of Results"/ or accuracy.ti,ab. or Diagnosis, Differential/ or Validation Study/ |
7648880 |
|
5 |
limit 4 to yr="2012 -Current" |
970 |
|
4 |
3 and (child* or schoolchild* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or childhood or teen or teens or teenager* or puberty).tw. |
1576 |
|
3 |
1 and 2 |
4433 |
|
2 |
Fractional Exhaled Nitric Oxide Testing/ or (Breath Tests/ and Exhalation/) or feno.ti,ab,kf. or (exhaled adj3 ("NO" or nitric oxide*)).ti,ab,kf. |
7267 |
|
1 |
exp Asthma/ or Bronchial Hyperreactivity/ or Airway Obstruction/ or ((airway or airflow or repirator*) adj2 (obstruct* or occlusion* or closure)).ti,ab,kf. or (bronch* adj2 (hyperreactiv* or hyper reactiv* or hyperrespons* or hyper respons*)).ti,ab,kf. or asthma*.ti,ab,kf. or wheez*.ti,ab,kf. or breathles*.ti,ab,kf. |
242639 |